一种促进键骨愈合的鹿骨活性多肽及其制备方法
文献发布时间:2024-04-18 20:00:50
技术领域
本发明属于肽制备技术领域,具体涉及一种促进键骨愈合的鹿骨活性多肽及其制备方法。
背景技术
前交叉韧带(Anterior Cruciate Ligaments,ACL)是一条从股骨走向胫骨的致密结缔组织带,可以有效防止膝关节前后过度平移,保持关节稳定。ACL断裂是运动医学中非常常见的损伤,多见于爱好运动的青少年。目前,ACL断裂的经典的手术治疗方法是关节镜下前交叉韧带重建术,而腱-骨界面愈合强度一直被认为是判断重建术是否成功的重要因素。近年来,国内外学者做了大量研究来改善和优化腱-骨愈合过程,包括应用生物活性因子、机械刺激、骨膜覆盖、自体富血小板血浆和骨髓间充质干细胞移植等,取得了较好的效果。
近年来,梅花鹿基因组、转录组、蛋白质组学、代谢组学的研究成果表明,梅花鹿基因组明显优于现已发布的其它鹿类及近源物种(牛、羊),不同时期、不同区段的鹿茸组织蛋白总量可达到4300余种。众所周知,鹿茸在促进伤口愈合、抑制神经炎症、特异的抗炎疗效、促进血管和神经再生、抑制骨质疏松、快速生长等方面均有独特的功效。产业科技研发,揭秘了梅花鹿神奇之处,梅花鹿作为传统的食药材,随着科技进步,梅花鹿新产品开发,将为人类健康做出突出贡献,梅花鹿产业未来发展大有作为。吉林省拥有丰富的鹿骨资源,但其深入研究和产品开发还相对滞后。大部分鹿骨被用做普通食材和制作工艺品,甚至被丢弃,造成资源的极大浪费。
鹿骨为一种传统中药有补虚强骨的功效。鹿骨具有补虚、强筋、壮骨的功效,适用于久病体弱、精髓不足、贫血、风湿、四肢痛疼等症。《本草纲目》中记载鹿骨微热,味甘无毒,鹿骨具有补虚,强劲健骨等功效,鹿骨是名贵的补身珍品,含有丰富的钙、磷等矿物质,具有接骨续筋的作用,尤其对老年骨质疏松效果显著。鹿骨与人体骨骼的成份极其相似,其中钙占30%、胶原占30%、其它矿物质和维生素等占30%左右,所以服用鹿骨五胶原蛋白肽后既补钙又补骨。鹿骨五胶原蛋白肽通过成骨、护骨、养骨三位一体,全面缓解因骨骼缺钙而引起的腰酸、背痛、腿抽筋、手足麻木、驼背、骨质增生、颈椎疼痛、腰间盘突出、肩周炎、关节炎、儿童的发育迟缓、软骨病等症状,构建更加健康的骨骼。鹿骨中富含人体所需的钙、磷、锌、铁及大量的蛋白质、磷脂、软骨素、粘多糖、鹿骨形成蛋白及多种人体无法合成的微量元素和氨基酸等十余种之多,且富含天然活性维生素。
CN107236775A公开了一种鹿骨蛋白多肽,该鹿骨蛋白多肽的制备方法依次包括:脱脂、脱钙步骤、微波辅助碱提、微波辅助碱酶解、微波辅助中性酶解和胰蛋白酶酶解和浓缩步骤。该鹿骨蛋白多肽具有较高的寡肽比例,具有较高的抗氧化性和提神抗疲劳作用。该鹿骨蛋白多肽可用于制备保健品上,其制备的养生酒,具有较高的稳定性。
CN111235201A公开了一种鹿骨肽的提取方法,包括以下内容:1)取鹿骨,取出骨髓备用;将鹿骨粉碎,备用;2)将骨髓分散到纯化的温水中,加入发酵菌剂,发酵处理;待发酵完成后,取上清液备用;3)将粉碎后的鹿骨采用高压蒸汽吹扫处理,去除油脂,清洗后再次使用高压蒸汽处理使鹿骨软化,待软化处理以后置于水中煮制,并保持搅拌,煮制结束后,得鹿骨汤,加入酶制剂,水解结束后升温灭活酶制剂,得鹿骨水解液并静置沉淀,取水解液液体部分备用;循环过滤每次过滤后得到的滤液,经多次过滤后得澄清液;4)将2)中所得上清液和3)中所得澄清液合并搅拌,然后浓缩即得鹿骨肽浓缩液。
因此,开发一种高纯度的鹿骨活性多肽,可以有效促进键骨愈合、促进细胞增殖,是本领域的研究重点。
发明内容
针对现有技术的不足,本发明的目的在于提供一种促进键骨愈合的鹿骨活性多肽及其制备方法,可以有效促进键骨愈合、促进细胞增殖。
为达到此发明目的,本发明采用以下技术方案:
第一方面,本发明提供一种促进键骨愈合的鹿骨活性多肽的制备方法,所述制备方法包括:
(1)将鹿骨粉末脱脂、脱钙后进行水提,所得提取液进行盐析、透析,得到鹿骨蛋白;
(2)将所述鹿骨蛋白进行一次酶解、二次酶解,得到粗鹿骨多肽;
(3)将所述粗鹿骨多肽进行高效液相色谱分离后,得到的鹿骨多肽,将所述鹿骨多肽进行烷基化反应、中和反应,将反应产物进行脱盐,得到所述鹿骨活性多肽。
本发明将鹿骨在水提之后进行盐析,可以有效去除非蛋白杂质,将鹿骨蛋白进行分步酶解,可以获取分子量更小的多肽,高效液相色谱分离,得到的鹿骨多肽纯度较高,将鹿骨多肽进行烷基化可以增强多肽活性,更有益于动物体吸收,再进行中和反应,可以去除烷基化所带来的的杂质,进一步纯化。
优选地,所述鹿骨粉末的粒径为30-50目,例如可以为35目、40目、45目等。
优选地,所述脱脂采用的试剂为石油醚。
优选地,所述脱脂时的料液比为1:(13-17),例如可以为1:14、1:15、1:16等,脱脂的时间为20-30h,例如可以为22h、24h、26h、28h等。
优选地,所述脱钙采用的试剂为盐酸水溶液,所述盐酸水溶液中盐酸的浓度为0.3-0.7mol/L,例如可以为0.4mol/L、0.5mol/L、0.6mol/L等。
优选地,所述脱钙时的料液比为1:(8-12),例如可以为1:9、1:10、1:11等。
优选地,所述脱钙的温度为3-5℃,例如可以为3.5℃、4℃、4.5℃等,时间为2-4h,例如可以为2.5h、3h、3.5h等。
优选地,所述脱钙重复进行7-9次,例如可以为7次、8次或9次。
优选地,所述脱钙之后还包括烘干的步骤。
优选地,所述水提的料液比为1:(8-12),例如可以为1:9、1:10、1:11等。
优选地,所述水提的温度为90-100℃,例如可以为92℃、95℃、98℃等,所述水提重复操作2-3次。
优选地,所述水提之后还包括过滤、浓缩的步骤。
优选地,所述过滤的滤网孔径为30-50目,例如可以为35目、40目、45目等。
优选地,所述盐析采用的试剂为硫酸铵水溶液。
优选地,所述硫酸铵水溶液中硫酸铵的质量百分含量为75-85%,例如可以为76%、78%、80%、82%、84%等。
优选地,所述盐析时提取物与盐析试剂的质量比为1:(3-5),例如可以为1:3.5、1:4、1:4.5等。
优选地,所述盐析时的转速为4000-6000rpm,例如可以为4500rpm、5000rpm、5500rpm等,盐析的时间为8-12min,例如可以为9min、10min、11min等。
优选地,所述透析采用的透析袋孔径为30-40KDa,例如可以为32KDa、35KDa、38KDa等,透析的时间为22-26h,例如可以为23h、24h、25h等。
优选地,所述一次酶解采用胃蛋白酶,所述胃蛋白酶的用量为6000-6500U/g,例如可以为6200U/g、6300U/g、6400U/g等。
优选地,所述一次酶解的pH值为1.8-2.2,例如可以为1.9、2、2.1等,酶解的时间为3-4h,例如可以为3.2h、3.5h、3.8h等。
优选地,所述二次酶解采用胰蛋白酶,所述胰蛋白酶的用量为6000-6500U/g,例如可以为6200U/g、6300U/g、6400U/g等。
优选地,所述二次酶解的pH值为7.8-8.2,例如可以为7.9、8、8.1等,酶解时间为3-5h,例如可以为3.5h、4h、4.5h等。
优选地,所述高效液相色谱的检测条件为:流速为0.7mL/min,进样量为50μL,色谱柱:Sepax BR-C18 4.6×250mm×5μm 120A,检测波长为214nm,分析时间为92min,流动相A为98%水+2%ACN,流动相B为98%ACN+2%水,其中流动相A的pH值为10,流动相A采用25%氨水进行调节pH。
优选地,所述烷基化反应时将鹿骨多肽溶于NH
优选地,所述NH
优选地,所述烷基化反应采用的试剂为DTT(二硫苏糖醇)。
优选地,所述烷基化反应时加入DTT的终浓度为8-12mmol/L,例如可以为9mmol/L、10mmol/L、11mmol/L等。
优选地,所述烷基化反应的温度为50-60℃,例如可以为52℃、54℃、56℃、58℃等,时间为0.8-1.2h,例如可以为0.9h、1h、1.1h等。
优选地,所述中和反应采用的试剂为IAM(碘乙酰胺)。
优选地,所述中和反应时加入IAM的终浓度为45-55mmol/L,例如可以为48mmol/L、50mmol/L、53mmol/L等。
优选地,所述中和反应在避光条件下进行,反应时间为35-45min,例如可以为36min、38min、40min、42min、44min等。
优选地,所述脱盐之前还包括活化、平衡、上样的步骤。
优选地,所述活化采用的试剂为ACN(乙腈)。
优选地,所述平衡采用的试剂为TFA水溶液,所述TFA水溶液中TFA的质量百分含量相同,均为0.08-0.12%,例如可以为0.09%、0.1%、0.11%等。
优选地,所述上样重复两次。
优选地,所述脱盐采用的脱盐液为TFA水溶液(三氟乙酸水溶液)。
优选地,所述脱盐操作1次或2次。
优选地,所述脱盐之后还包括洗脱的步骤。
优选地,所述洗脱采用的试剂为ACN与TFA水溶液按照体积比(3.5-4.5):1混合得到的洗脱液,例如可以为3.8:1、4:1、4.2:1等。
优选地,所述脱盐液、洗脱液中的TFA水溶液中TFA的质量百分含量相同,均为0.08-0.12%,例如可以为0.09%、0.1%、0.11%等。
优选地,所述制备方法包括:
(1)将30-50目的鹿骨粉末采用13-17倍量的石油醚脱脂20-30h、采用8-12倍量的0.3-0.7mol/L盐酸水溶液于3-5℃脱钙2-4h,脱钙重复进行7-9次,烘干后与8-12倍量水混合,90-100℃下水提2-3次,30-50目过滤、浓缩得到提取液,所得提取液采用3-5倍量的75-85%硫酸铵水溶液进行盐析,盐析时的转速为4000-6000rpm,时间为8-12min,所得沉淀复溶后采用30-40KDa透析袋进行透析22-26h,得到鹿骨蛋白;
(2)将所述鹿骨蛋白采用胃蛋白酶于pH值为1.8-2.2下进行一次酶解3-4h,然后,采用胰蛋白酶于pH值为7.8-8.2下进行二次酶解3-5h,得到粗鹿骨多肽;
所述胃蛋白酶的用量为6000-6500U/g,所述胰蛋白酶的用量为6000-6500U/g;
(3)将所述粗鹿骨多肽进行高效液相色谱分离后,得到的鹿骨多肽,将所述鹿骨多肽溶于浓度为45-55mmol/L的NH
本发明所述的数值范围不仅包括上述列举的点值,还包括没有列举出的上述数值范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
第二方面,本发明提供一种促进键骨愈合的鹿骨活性多肽,所述鹿骨活性多肽采用如第一方面所述的制备方法制备得到。
相对于现有技术,本发明具有以下有益效果:
1、本发明将鹿骨在水提之后进行盐析,可以有效去除非蛋白杂质,将鹿骨蛋白进行分步酶解,可以获取分子量更小的多肽,高效液相色谱分离,得到的鹿骨多肽纯度较高,将鹿骨多肽进行烷基化可以增强多肽活性,更有益于动物体吸收;
2、经TDSCs细胞测试可知,本发明制备得到的鹿骨活性多肽可以有效促进键骨愈合、促进细胞迁移与增殖。
附图说明
图1为实施例1中进行高效液相色谱检测得到的谱图;
图2为实施例1中标准品进行高效液相色谱检测得到的谱图;
图3为测试例2中不同浓度鹿骨活性多肽对TDSCs细胞增殖的影响图;
图4为10
图5为10
图6为实施例1制得的鹿骨活性多肽溶液作用于TDSCs细胞的划痕实验结果图;
图7为测试例3中对照组的TDSCs细胞划痕实验结果图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
本文所用术语“包含”、“包括”、“具有”、“含有”或其任何其它变形,意在覆盖非排它性的包括。例如,包含所列要素的组合物、步骤、方法、制品或装置不必仅限于那些要素,还可包括未明确列出的其它要素或此种组合物、步骤、方法、制品或装置所固有的要素。
“任选的”或者“任意一种”是指其后描述的事项或事件可以发生或不发生,而且该描述包括事件发生的情形和事件不发生的情形。
本发明要素或组分前的不定冠词“一种”和“一个”对要素或组分的数量要求(即出现次数)无限制性。因此“一个”或“一种”应被解读为包括一个或至少一个,并且单数形式的要素或组分也包括复数形式,除非所述数量明显只指单数形式。
本发明所描述的术语“一个实施例”、“一些实施例”、“示例性地”、“具体示例”或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本文中,对上述术语的示意性表述不是必须针对相同的实施例或示例。
以下实施例中试剂或仪器来源如下:
实验例1
高效液相色谱分离和分析
柱温:室温;
流速:0.7mL/min;
进样量为50μL;
色谱柱:Sepax BR-C18 4.6×250mm×5μm 120A;
检测波长:214nm;
各组分分析时间为92min;
流动相A为98%水+2% ACN,流动相B为98%ACN+2%水,其中流动相A的pH值为10,流动相A采用25%氨水进行调节pH。
实验例2
脱盐过程
a、活化:用300μL的100%ACN活化脱盐小柱两次;
b、平衡:用200μL的0.1%TFA平衡脱盐小柱2次;
c、上样:上样2次;
d、脱盐:用200μL的0.1%TFA脱盐2次;
e、洗脱:用300μL的CAN(80%)-0.1%TFA(20%)洗脱1次。
实施例1
本实施例提供一种鹿骨活性多肽,所述鹿骨活性多肽的制备方法为:
(1)将鹿骨粉碎至40目,得到的鹿骨粉末采用15倍量的石油醚脱脂25h,再采用10倍量的0.5mol/L盐酸水溶液于4℃脱钙3h,脱钙重复进行8次,烘干后与10倍量纯水混合,95℃下水提2次,过滤,滤液采用旋蒸将其浓缩至原体积的1/3,得到鹿骨提取液;
(2)将鹿骨提取液采用4倍量的80%硫酸铵水溶液进行盐析,盐析时的转速为5000rpm,时间为10min,所得沉淀复溶后采用35KDa透析袋进行透析24h,冷冻干燥,得到鹿骨蛋白;
(3)将鹿骨蛋白复溶于纯水中,使底物浓度为4%,采用6200U/g胃蛋白酶于pH值为2进行一次酶解3.5h,冷冻干燥,得到蛋白粉末,将蛋白粉末复溶于纯水,使底物浓度为4%,采用6300U/g胰蛋白酶于pH值为8进行二次酶解4h,酶解完成后100℃煮15min,终止酶解,冷冻干燥,得到粗鹿骨多肽;
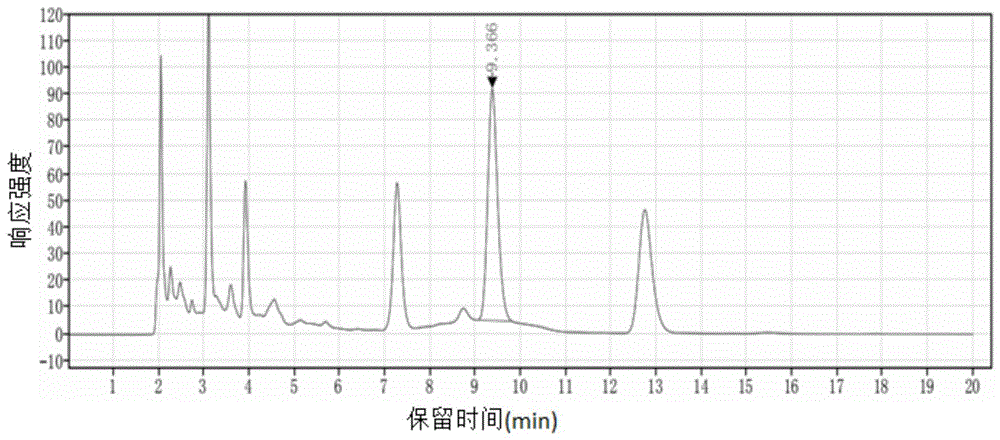
(4)将步骤(3)所得粗鹿骨多肽溶于水配制成10mg/mL的供试品溶液,采用实验例1的过程进行高效液相色谱分析和分离,样品溶液检测得到的谱图如图1所示,收集保留时间为9.366min的组分,得到鹿骨多肽;
标准品溶液检测得到的谱图如图2所示;
(5)将鹿骨多肽溶于浓度为50mmol/L的NH
(6)将反应产物按照实验例2的方法进行脱盐,所得溶液于45℃真空干燥,得到鹿骨活性多肽。
实施例2
本实施例提供一种鹿骨活性多肽,所述鹿骨活性多肽的制备方法为:
(1)将鹿骨粉碎至30目,得到的鹿骨粉末采用17倍量的石油醚脱脂30h,再采用12倍量的0.3mol/L盐酸水溶液于3℃脱钙4h,脱钙重复进行7次,烘干后与8倍量纯水混合,100℃下水提3次,过滤,滤液采用旋蒸将其浓缩至原体积的1/3,得到鹿骨提取液;
(2)将鹿骨提取液采用4倍量的80%硫酸铵水溶液进行盐析,盐析时的转速为5000rpm,时间为10min,所得沉淀复溶后采用30KDa透析袋进行透析26h,冷冻干燥,得到鹿骨蛋白;
(3)将鹿骨蛋白复溶于纯水中,使底物浓度为4%,采用6500U/g胃蛋白酶于pH值为2进行一次酶解3h,冷冻干燥,得到蛋白粉末,将蛋白粉末复溶于纯水,使底物浓度为4%,采用6000U/g胰蛋白酶于pH值为8进行二次酶解5h,酶解完成后100℃煮15min,终止酶解,冷冻干燥,得到粗鹿骨多肽;
(4)将步骤(4)所得粗鹿骨多肽溶于水配制成10mg/mL的供试品溶液,采用实验例1的过程进行高效液相色谱分析和分离,收集保留时间为9.366min的组分,得到鹿骨多肽;
(5)将鹿骨多肽溶于浓度为45mmol/L的NH
(6)将反应产物按照实验例2的方法进行脱盐,所得溶液于45℃真空干燥,得到鹿骨活性多肽。
实施例3
本实施例提供一种鹿骨活性多肽,所述鹿骨活性多肽的制备方法为:
(1)将鹿骨粉碎至50目,得到的鹿骨粉末采用13倍量的石油醚脱脂20h,再采用8倍量的0.7mol/L盐酸水溶液于5℃脱钙2h,脱钙重复进行9次,烘干后与12倍量纯水混合,90℃下水提3次,过滤,滤液采用旋蒸将其浓缩至原体积的1/3,得到鹿骨提取液;
(2)将鹿骨提取液采用4倍量的80%硫酸铵水溶液进行盐析,盐析时的转速为5000rpm,时间为10min,所得沉淀复溶后采用30KDa透析袋进行透析26h,冷冻干燥,得到鹿骨蛋白;
(3)将鹿骨蛋白复溶于纯水中,使底物浓度为4%,采用6000U/g胃蛋白酶于pH值为2进行一次酶解4h,冷冻干燥,得到蛋白粉末,将蛋白粉末复溶于纯水,使底物浓度为4%,采用6500U/g胰蛋白酶于pH值为8进行二次酶解3h,酶解完成后100℃煮15min,终止酶解,冷冻干燥,得到粗鹿骨多肽;
(4)将步骤(3)所得粗鹿骨多肽溶于水配制成10mg/mL的供试品溶液,采用实验例1的过程进行高效液相色谱分析和分离,收集保留时间为9.366min的组分,得到鹿骨多肽;
(5)将鹿骨多肽溶于浓度为55mmol/L的NH
(6)将反应产物按照实验例2的方法进行脱盐,所得溶液于45℃真空干燥,得到鹿骨活性多肽。
实施例4
本实施例提供一种鹿骨活性多肽,其与实施例1的区别仅在于步骤(3)不同,本实施例的步骤(3)为:
将鹿骨蛋白复溶于纯水中,使底物浓度为4%,采用6300U/g胰蛋白酶于pH值为8进行一次酶解4h,冷冻干燥,得到蛋白粉末,将蛋白粉末复溶于纯水,使底物浓度为4%,采用6200U/g胃蛋白酶于pH值为2进行二次酶解3.5h,酶解完成后100℃煮15min,终止酶解,冷冻干燥,得到粗鹿骨多肽;其他原料、用量和制备方法均与实施例1相同。
对比例1
本对比例提供一种鹿骨活性多肽,其与实施例1的区别仅在于步骤(3)不同,本对比例的步骤(3)为:
将鹿骨蛋白复溶于纯水中,使底物浓度为4%,采用6200U/g胃蛋白酶于pH值为2条件下进行酶解3.5h,酶解完成后100℃煮15min,终止酶解,冷冻干燥,得到粗鹿骨多肽;其他原料、用量和制备方法均与实施例1相同。
对比例2
本对比例提供一种鹿骨活性多肽,其与实施例1的区别仅在于步骤(3)不同,本对比例的步骤(3)为:
将鹿骨蛋白复溶于纯水中,使底物浓度为4%,采用6300U/g胰蛋白酶于pH值为8条件下进行酶解4h,酶解完成后100℃煮15min,终止酶解,冷冻干燥,得到粗鹿骨多肽;其他原料、用量和制备方法均与实施例1相同。
对比例3
本对比例提供一种鹿骨多肽,其与实施例1的区别仅在于未进行步骤(2)的盐析过程,将步骤(1)所得鹿骨提取液直接进行步骤(3)酶解;其他原料、用量和制备方法均与实施例1相同。
对比例4
本对比例提供一种鹿骨多肽,其与实施例1的区别仅在于未进行步骤(4)的高效液相色谱分离,将步骤(3)所得产物直接进行步骤(5)的烷基化反应;其他原料、用量和制备方法均与实施例1相同。
对比例5
本对比例提供一种鹿骨多肽,其与实施例1的区别仅在于未进行步骤(5)的烷基化和中和反应,将步骤(4)所得鹿骨多肽直接进行步骤(6)脱盐;其他原料、用量和制备方法均与实施例1相同。
测试例1
1.1主要试剂:Ca
1.2方法:
1.2.1.动物分组
选取60只Wistar雄性大鼠。随机分为6组:对照组,模型组,鹿骨多肽高、中、低剂量(250、125、62.5mg/kg)组,阳性药复方鹿茸健骨胶囊组,每组各8只大鼠。除对照组外,其他5组大鼠im地塞米松2.5mg/kg,每周2次,对照组im等体积的生理盐水。
模型组选择切断一侧前交叉韧带。鹿骨多肽各组分别给予鹿骨多肽250、125、62.5mg/kg,阳性药组ig复方鹿茸健骨胶囊(胶囊内容物以双蒸水溶解)540mg/kg,对照组和模型组ig等量生理盐水,各组均每天给药1次,连续56d(8周)。末次给药后,大鼠麻醉,腹主动脉取血,利用酶联免疫法,检测血清中Ca
1.2.2.血清中Ca
实验各组分别于清晨空腹采集静脉血1mL,将血液样本3000r/min离心5min,分离血清进行测定,采用中生北控生物科技有限公司提供的试剂盒,检测方法为免疫比浊法;
1.2.3.统计方法
采用SPSS13.0统计软件进行统计分析,采用均数标准差表示,应用t检验,p<0.05被判断为差异有统计学意义;
血清中各成分浓度测试结果如表1所示。
表1
根据表格数据,由实施例1-3可知,当将酶解时首先进行胃蛋白酶酶解,再进行胰蛋白酶酶解,效果最好,动物实验结果中大鼠体内Ca
由实施例1-3、实施例4可知,当一次酶解和二次酶解的顺序进行调换时,血清中Ca
测试例2
TDSCs增殖能力试验
采用CCK-8法检测细胞的增殖情况,将实施例1制备的鹿骨活性多肽分别配制为10
示例性地,采用10
测试例3
TDSCs迁移能力试验
用浓度为10
申请人声明,本发明通过上述实施例来说明本发明的工艺方法,但本发明并不局限于上述工艺步骤,即不意味着本发明必须依赖上述工艺步骤才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 一种碳基固体酸的制备方法
- 基于废弃物再生的填埋场VOCs原位高效降解碳基材料的制备方法及应用
- 一种有机-无机固体废弃物复合材料及其制备方法和应用
- 机械增韧碳基固体润滑薄膜及其制备方法和应用
- 一种以Ca基固体废弃物再生高强负碳建材的方法及其应用
- 一种以Ca基固体废弃物再生高强负碳建材的方法及其应用
