一种促进头皮健康的微生物转化人参发酵液及其制备方法与应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及生物发酵领域,具体涉及一种促进头皮健康的微生物转化人参发酵液及其制备方法与应用。
背景技术
人参(P. ginseng C. A.Meyer)为五加科多年生草本植物,也是中国传统中药材,具有许多生物活性成分,如人参皂苷、人参多糖、黄酮等,人参活性成分不仅可以应用于医学和保健品领域,在化妆品领域的应用也日益增多,尤其在防脱生发方面,不仅能促进头发生长、防止头发脱落,还具有抗氧化、抗炎及营养头发等功效,能帮助保持头发的健康和美丽。目前对人参的发酵利用多集中在根须部分,对人参其他部分的研究极为匮乏。但近年来,随着人参出口需求的不断加大,导致人参资源的利用问题进一步凸显。据统计,每年我国人参茎叶总产量可达人参产量的40%~48%,且近年来产量逐年增加,而其市场价格却只有人参根须的约1/50。研究发现,人参茎叶含有与根相似的活性成分,且人参叶中皂苷含量为7.6%~12.6%,是根部人参皂苷含量的3倍,如何更好地开发利用成为亟待解决的难题。
而利用益生菌发酵转化人参中的皂苷类成分,具有转化特异性强、产率高等特点,已经成为提高人参产品生物活性的重要途径之一。乳酸菌是被广泛应用的益生菌,发酵乳杆菌更是CFDA认可的可用于食品生产的乳酸菌,具有较高的安全性,用其转化人参皂苷不需要另外添加可能产生危害的化学试剂,对环境没有污染。除此之外,乳酸菌能够产生β-葡萄糖苷酶,β-葡萄糖苷酶能够水解人参皂苷的β-葡萄糖苷,将原有皂苷转化为活性更高、功能更强稀有皂苷,提高发酵液中稀有皂苷的含量,增强人参提取液的生理功能;用发酵乳杆菌发酵人参还可以提高人参的生物利用度,增强代谢产物的功效等优势。但前期研究中发现适用于人参根须的发酵体系运用于人参茎叶时却无法产生良好的发酵效果。
目前,人参非药用部位的资源还未得到充分利用,同时用乳杆菌发酵人参的生物利用率较低,不利于人参发酵液更广泛、有效的应用。
发明内容
为了充分利用人参资源,本发明利用乳杆菌来发酵人参茎叶提取物,筛选出其中两种菌株进行复配发酵,以抗氧化为指标优化发酵工艺,以此来提高人参发酵液中稀有人参皂苷以及多糖等活性物质含量,从而提高其抗氧化、防脱发等应用功效。
为了解决上述技术问题,本发明采用如下技术方案:
提供一种促进头皮健康的微生物转化人参发酵液的制备方法,制备人参发酵液所用的复配菌是以嗜酸乳杆菌和植物乳杆菌1.140的体积比1:1进行复配。
作为本发明制备方法的一种优选方案,所述制备方法包括如下步骤:
A. 制备人参培养基:取人参茎叶提取粉末,加入蒸馏水混匀得到所述人参培养基;
B. 制备发酵基质:用去离子水配制葡萄糖溶液以及胰蛋白胨溶液,备用;
C. 制备人参发酵液:
C1)取所述复配菌进行活化得到复配菌菌液,离心得到沉淀,清洗并稀释所述沉淀,得到种子液;
C2)步骤A所述人参培养基进行灭菌,得到灭菌后人参培养基,将所述种子液接入所述灭菌后人参培养基中,添加所述发酵基质,得到溶液a,在细菌培养箱静置,进行发酵;
C3)所述发酵后进行离心,收集上清液,即得所述人参发酵液。
作为本发明制备方法的一种优选方案,所述发酵的时间包括35.5小时,所述发酵的温度包括28.2℃,所述种子液接入所述灭菌后人参培养基的接种量包括2.5%。
进一步地,步骤A中所述人参茎叶提取粉末和所述蒸馏水的质量液料比为6:1;步骤B中所述葡萄糖溶液、所述胰蛋白胨溶液的浓度均为0.5g/mL;步骤C1中所述稀释的倍数为10倍,所述清洗并稀释的溶剂包括生理盐水、PBS缓冲液中的一种或多种,所述复配菌菌液和所述清洗的溶剂的体积比为1:1;步骤C2中所述溶液a含有1%葡萄糖、1%胰蛋白胨及16.7%所述人参茎叶提取粉末;步骤C1和步骤C3中所述离心的速度为10000rmp,所述离心的时间为10min。
作为本发明制备方法的一种优选方案,步骤C1中所述活化的步骤如下:分别取于-80 ℃保藏的所述嗜酸乳杆菌、所述植物乳杆菌1.140的甘油种,在37℃下解冻;将解冻后的所述嗜酸乳杆菌、所述植物乳杆菌1.140各按1%的接种量接入MRS肉汤液体培养基中;在30℃细菌培养箱中静置培养36 h;传代两次,得到所述复配菌菌液,备用。
作为本发明制备方法的一种优选方案,所述人参茎叶提取粉末从人参茎叶获得。
进一步地,所述人参茎叶提取粉末的制备步骤如下:
A. 粉碎所述人参茎叶,获得人参茎叶粉碎物;
B. 将所述人参茎叶粉碎物进行两次超声提取,获得总超声提取液;
C. 将所述总超声提取液用旋转蒸发仪浓缩后,进行水浴蒸干,获得粗提物;
D. 用蒸馏水溶解所述粗提物,获得粗提溶液;
E. 取所述粗提溶液用石油醚静置萃取后分液,重复三次,合并三次的下相萃取液作为萃取液a;
F. 取所述萃取液a用乙酸乙酯静置萃取后分液,重复三次,得到乙酸乙酯萃取三次后的下相作为萃取液b;
G. 取所述萃取液b与水饱和正丁醇加入锥形瓶中,摇床过夜,静置萃取后分液,重复三次,得到正丁醇萃取三次后的上相作为萃取液c;
H. 将所述萃取液c用旋转蒸发仪浓缩后,进行水浴蒸干,获得人参茎叶提取物;
I. 用蒸馏水溶解所述人参茎叶提取物,获得人参茎叶提取溶液;
J. 取所述人参茎叶提取溶液进行冻干,即得人参茎叶提取粉末。
进一步地,所述人参茎叶提取粉末的制备步骤如下:
A. 将人参茎叶洗净后于40°C烘箱干燥12 h,将烘干的人参茎叶用多功能粉碎机打成粉后过80目筛,得到人参茎叶粉碎物;
B. 取所述人参茎叶粉碎物进行第一次提取,所述第一次提取的料液比为1:10,超声提取1.5 h,过滤得到超声提取液A,取过滤后固相进行第二次提取,所述第二次提取的液料比1:8,超声提取1.0 h,得到超声提取液B;所述超声提取的提取剂包括80%甲醇水溶液,温度包括60°C,频率包括400 Hz;合并所述超声提取液A和所述超声提取液B得到总超声提取液;
C. 用旋转蒸发仪将所述总超声提取液浓缩后于60°C 水浴锅中蒸干至无流动性,无明显黏性,即得到粗提物;
D. 于室温下用两倍体积的蒸馏水吹打5min,溶解所述粗提物,得到粗提溶液;
E. 取所述粗提溶液,于室温下用等体积的石油醚静置萃取1 h, 分液2min,重复三次萃取和分液,合并三次的下相萃取液作为萃取液a;
F. 取所述萃取液a,于室温下用等体积的乙酸乙酯静置萃取2 h,分液2min,重复三次,得到乙酸乙酯萃取三次后的下相作为萃取液b;
G. 取所述萃取液b,与等体积的水饱和正丁醇加入锥形瓶中,室温下摇床过夜,静置萃取2 h后分液2min,重复三次,得到正丁醇萃取三次后的上相作为萃取液c;
H. 取所述萃取液c,用旋转蒸发仪浓缩后于60°C 水浴锅中蒸干蒸至无流动性,无明显黏性,得到人参茎叶提取物;
I. 于室温下用两倍体积的蒸馏水溶解所述人参茎叶提取物,得到人参茎叶提取溶液;
J. 取所述人参茎叶提取溶液于冷冻干燥机冻干,得到人参茎叶提取粉末。
相应地,本发明还提供一种由上述任一制备方法获得的人参发酵液。
相应地,本发明还提供一种所述人参发酵液在化妆品中的应用,其中,所述化妆品包括驻留型化妆品和洗去型化妆品。
进一步地,所述人参发酵液在所述洗去型化妆品中的体积浓度为0.6%,在所述驻留型化妆品中的体积浓度为0.06%;其中,所述洗去型化妆品可以是防脱洗发露、防脱护发素、防脱发膜、防脱头皮凝胶,所述驻留型化妆品可以是防脱精华、防脱头皮乳、防脱头皮凝胶。
进一步地,所述化妆品包括防脱洗发露、防脱护发素、防脱发膜、防脱精华、防脱头皮乳、防脱头皮凝胶中的一种或多种。
本发明的一个目的在于利用五种乳酸菌株对人参进行发酵,从中挑选出两种菌株复配发酵,并优化发酵工艺,以提高发酵液抗氧化等活性。
本发明的另一个目的是利用所筛选的复配菌将人参茎叶提取粉末进行发酵。
本发明的另一个目的是使人参提取物中增加具有防脱生发、抗氧化等活性的人参皂苷CK、Rg3、F2等成分,并以制得的复配人参发酵液作为防脱发活性成分,制备防脱发化妆品。
与现有技术相比,本发明具有以下有益效果:
1、本发明中以复配乳酸菌作为发酵菌种,将人参进行生物转化而得到人参稀有皂苷及多糖等活性物质的制备方法,实现了绿色、高效地以食药用菌生物转化人参皂苷,克服了以不能用于食品和药品生产的细菌或霉菌作为发酵菌种的缺点,提升了生物转化的安全性。
2、针对人参茎叶做为底物的发酵特性,本发明经过长期实验惊喜地发现,通过选用嗜酸乳杆菌和植物乳杆菌1.140按1:1进行复配,同时优化发酵工艺(发酵时间35.5 h,接种量2.5%,发酵温度28.2℃),得到的复配菌人参发酵液相比人参原液或者单一菌种人参发酵液,其稀有人参皂苷Rg3,CK,F2的含量增加,除此以外,多糖、多酚等活性物质的含量也明显提升,从而综合提高人参的生物利用度,增强人参代谢产物的功效。
3、本发明的人参发酵液具有抗氧化、抑制Ⅱ型5α-还原酶转化等功效,且功效水平优于单一菌种发酵液,在一定的给药浓度下还能提高细胞增殖的能力,因此在抗衰老、防脱发和生发方面有巨大的应用前景,本发明的人参发酵液具有促进头皮健康的功效。
4、由于提升了人参稀有皂苷、多糖等活性物质含量,本发明的复配菌种发酵液应用于制备防脱洗发露时,洗发露的防脱发、生发功效显著优于单一菌种发酵液应用的防脱洗发露。
5、本发明采用人参茎叶替代常用的人参根须作为人参茎叶提取粉末的原料,可以降低发酵成本,在一定程度上提高人参的资源利用率。
附图说明
图1为单一乳杆菌在不同培养基的生长曲线图;
图2为人参原液、单一乳杆菌发酵液的抗氧化活性;
图3为嗜酸乳杆菌和植物乳杆菌1.140复配人参发酵液在不同发酵时间下抗氧化活性;
图4为嗜酸乳杆菌和植物乳杆菌1.140复配人参发酵液在不同发酵温度下抗氧化活性;
图5为嗜酸乳杆菌和植物乳杆菌1.140复配人参发酵液在不同接种量下抗氧化活性;
图6为以O
图7为单一乳杆菌发酵液、复配优化前后发酵液上清液中酶活性图;
图8为人参原液、单一菌种发酵液、复配优化前后发酵液中各活性物质含量;
图9为复配优化后发酵液的液质谱图;
图10为复配优化前发酵液的液质谱图;
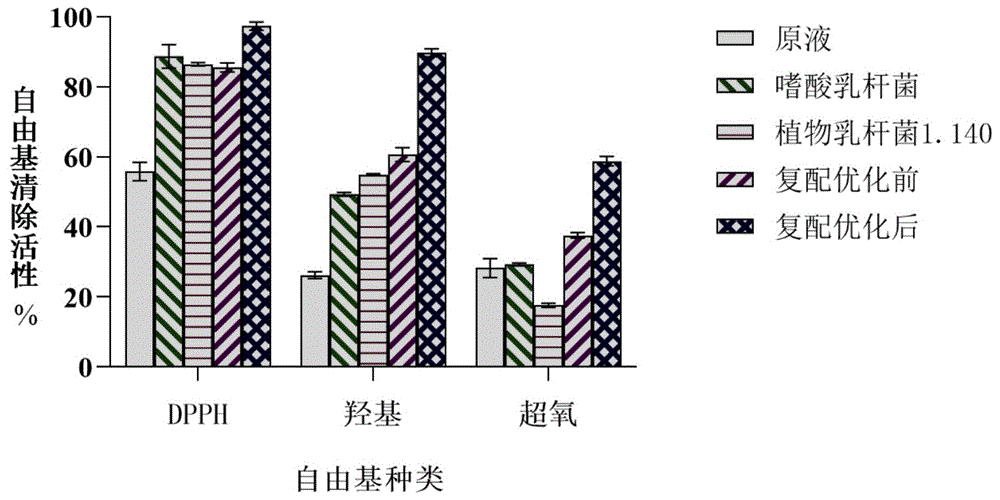
图11为人参原液、单一菌种发酵液、复配优化前后发酵液的自由基清除率;
图12为人参发酵液在不同给药浓度下对BJ细胞活性影响;
图13为人参发酵液在不同给药浓度下对HaCaT细胞活性影响;
图14为人参发酵液在不同给药浓度下对HFSC细胞活性影响;
图15为不同菌种人参发酵液对Ⅱ型5α-还原酶的抑制率
图16为整体毛发密度评估量表;
图17为受试洗发露使用前后脱发数量差值;
图18为受试洗发露使用前后整体毛发密度分级差值(视觉评估);
图19为受试洗发露使用前后整体毛发密度分级差值(图像评估);
图20为受试洗发露使用前后整体毛发密度分级差值(视觉评估和图像评估平均值);
图21为受试洗发露使用前后局部毛发密度差值。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
实施例1 人参茎叶提取
人参茎叶采集于10月上旬,采自吉林省集安市,经广东药科大学专家鉴定为五加科人参属人参,具体为林下参的茎叶部位。人参茎叶提取粉末制备步骤如下:
A、粉碎处理:将人参茎叶洗净后于40°C烘箱干燥12 h,将烘干的人参茎叶用多功能粉碎机打成粉后过80目筛,得到人参茎叶粉碎物;
B、超声提取:取人参茎叶粉碎物进行第一次提取,第一次料液比为1:10,80%甲醇水溶液作为提取剂,于60°C,400 Hz条件下超声提取1.5 h,过滤得到超声提取液A,取过滤后固相进行第二次提取,第二次液料比1:8,在与第一次提取相同的超声条件下提取1.0 h,得到超声提取液B;
C、制粗提物:合并两次超声提取液A和B,用旋转蒸发仪将提取液浓缩后于60°C 水浴锅中蒸干至无流动性,无明显黏性,即得到粗提物;
D、蒸馏水复溶粗提物:于室温下用两倍体积的蒸馏水吹打5min,溶解粗提物;
E、石油醚萃取:于室温下用等体积的石油醚静置萃取1 h, 分液2min,重复三次,合并三次的下相萃取液;
F、乙酸乙酯萃取:取石油醚萃取三次的下相萃取液作为合并液,于室温下用等体积的乙酸乙酯静置萃取2 h,分液2min,重复三次;
G、正丁醇萃取:取乙酸乙酯萃取三次后的下相,加入与下相等体积的水饱和正丁醇于锥形瓶中,室温下摇床过夜(转速100 rpm),静置萃取2 h后分液2min,重复三次;
H、制提取物:取正丁醇萃取三次后的上相,用旋转蒸发仪将其浓缩后于60°C 水浴锅中蒸干蒸至无流动性,无明显黏性,得到提取物;
I、蒸馏水复溶提取物:于室温下用两倍体积的蒸馏水吹打5min,溶解步骤H中的提取物;
J、冻干制粉末:于冷冻干燥机冻干,得到人参茎叶提取粉末。
实施例2 菌种活化
本发明所用五种乳杆菌的信息如下:
嗜酸乳杆菌(GDMCC1.412)、植物乳杆菌1.140(GDMCC1.140)、干酪乳杆菌(GDMCC1.159)、鼠李糖乳杆菌(ATCC7469)、植物乳杆菌1.648(GDMCC1.648),均购自广东省微生物菌种保藏中心。
菌种活化步骤如下:
1)分别取于-80 ℃保藏的上述五种乳杆菌的甘油种,在37℃下快速解冻;
2)按2%的接种量,将乳杆菌分别接入MRS肉汤液体培养基中(对于复配菌,接种量以复配后乳杆菌总量计算);
3)在30℃细菌培养箱中静置培养36 h(培养36h作为活化时间,是通过生长曲线测定的实验获得的);
4)传代两次后,得到相应的菌液,备用。
实施例3 不同培养基生长曲线测定
按照实施例2中的菌种活化方法中的步骤1)和2)活化五种菌株,各取0.6 mL菌液,用生理盐水清洗离心后,往菌体沉淀中加0.6 mL的生理盐水,然后分别与29.4 mL的人参发酵培养基、29.4 mL的MRS肉汤培养基置于专用的离心管中,离心管放入生长曲线分析仪,设置参数为30℃、0rmp、MF10分钟(每10 min测定一次吸光度值)等,观察并记录结果,见图1。图1(A)为 MRS肉汤培养基,图1(B)为人参培养基;其中GA、GB、GC、GD、GE分别代表嗜酸乳杆菌人参发酵液、植物乳杆菌1.140人参发酵液、干酪乳杆菌人参发酵液、鼠李糖乳杆菌人参发酵液、植物乳杆菌1.648人参发酵液。
在MRS肉汤培养基中,植物乳杆菌1.140在4~10 h内处于快速生长期,吸光度值迅速增加;在10~25 h内菌株进入稳定期,生长速率降低;在25.12 h时后开始进入衰亡期,因此该菌株复苏传代的时间最好在25.12 h之前,由于各菌株最佳复苏传代时间各不一致,因此,为了便于比较分析,统一选定36 h作为菌株传代时间。
在人参培养基中,各乳杆菌生长速度都比在(A)的MRS肉汤培养基中缓慢,所需发酵时间都更久。观察发酵生长曲线,除鼠李糖乳杆菌外各菌株经过发酵70 h后生长较为稳定,故设定初始发酵时间为72 h。
实施例4复配菌种筛选
实施例1中的人参茎叶提取粉末利用嗜酸乳杆菌、植物乳杆菌1.140、干酪乳杆菌、鼠李糖乳杆菌、植物乳杆菌1.648发酵,具体发酵步骤如下:
1)制备人参发酵培养基:按照投入液料比6:1,称取按实施例1制备的人参茎叶提取粉末8.33g,加入50mL蒸馏水混匀,即得人参培养基。
2)制备发酵基质:配制0.5g/mL的葡萄糖溶液以及0.5g/mL的胰蛋白胨溶液,备用。
3)发酵:
① 取按照实施例2活化好的菌液1mL,10000rmp离心10 min后留沉淀,用1mL生理盐水清洗、稀释10倍,将稀释后的菌液以2%接种量接入灭菌后的人参培养基中,并添加发酵基质,使葡萄糖与胰蛋白胨终浓度达到10mg/mL;
② 在30°C的发酵温度下的细菌培养箱静置发酵,发酵时间72h,收罐;
③ 收罐后在10000rmp转速下离心10min,收集上清液即为人参发酵液。
检测上述制得的各人参发酵液对DPPH自由基和羟基自由基清除能力,发现相比人参原液均有显著提高。见图2。
五种乳杆菌抗氧化性分析如下:
1)对DPPH·自由基清除能力:嗜酸乳杆菌人参发酵液最强,其清除率达到88.71± 2.75%,对比发酵前增加了58.85%(P<0.05)。植物乳杆菌1.140人参发酵液清除效果也显著,其清除率达到86.48±0.37%,对比发酵前增加了54.84%(P<0.05);
2)对羟基自由基清除能力:植物乳杆菌1.140人参发酵液对羟基自由基清除能力最强,清除率高达55.11±0.09%,比发酵前增加了87.94%(P<0.05);其次是嗜酸乳杆菌人参发酵液,其清除率达到49.33±0.53%,对比发酵前增加了109.39%(P<0.05)。
结合两种自由基清除率结果,因此选定了植物乳杆菌1.140与嗜酸乳杆菌进行1:1复配发酵。
实施例5发酵条件优化
1、单因素试验
试验方法:以发酵时间72 h、发酵温度30°C、接种量2%为初始发酵条件,分别考察发酵时间(15、30、45、60、75 h)、发酵温度(26、28、30、32、34°C) 、菌液接种量(1.5%、2%、2.5%、3%、3.5%)对发酵液抗氧化活性功能的影响。
发酵方法按照实施例4中发酵步骤,只将菌液选定为以嗜酸乳杆菌和植物乳杆菌1.140的体积比1:1复配得到的复配菌菌液,将菌液接种量设为试验接种量,将发酵时间设为试验发酵时间,将发酵温度设为试验发酵温度。将依此方法制备的人参发酵液进行抗氧化活性测定。
抗氧化活性测定结果见图3~图5,反映了不同接种量(1.5~3.5%)、不同温度(26~34°C)、不同时间(15~75 h)对DPPH自由基、羟基自由基、超氧阴离子自由基清除能力的影响。根据对三种自由基清除率的大小,选定了2%~3%,26℃~30℃,15 h~45 h作为后续响应面实验条件。
2、响应面优化
依据单因素试验结果,以发酵时间、温度、接种量为因素,以DPPH自由基清除率、羟基自由基清除率和超氧阴离子自由基清除率为响应,采用三因素三水平的Box Benhnken响应面方法进行优化,获得最佳工艺条件。因素和水平见表1。
表1 优化实验中因素水平
应用Design-Expert 11软件对以DPPH·、·OH、O
对响应值进行分析,最终确定最优工艺为发酵时间35.5 h,接种量2.5%,温度28.2℃。
实施例6 复配乳杆菌发酵人参(发酵条件优化)
采用实施例5确定的最优工艺发酵人参茎叶提取粉末,制备步骤如下:
A、制备人参培养基:按照投入液料比(质量比)6:1,称取按实施例1制备的人参茎叶提取粉末8.33g,加入50mL蒸馏水混匀,即得人参培养基。
B、制备发酵基质:配制0.5g/mL的葡萄糖溶液以及0.5g/mL的胰蛋白胨溶液备用。
C、发酵:
C1、以嗜酸乳杆菌和植物乳杆菌1.140的体积比1:1作为复配菌,按照实施例2步骤进行活化,取活化后的复配菌菌液1.0mL,10000rmp离心10 min后留沉淀,用1mL生理盐水清洗、稀释10倍,得到种子液,备用;
C2、取步骤C1中制备的种子液以2.5%接种量接入灭菌后的人参培养基中,并添加发酵基质,使溶液中葡萄糖与胰蛋白胨液的最终浓度均达到10mg/mL;
C3、将步骤C2中制备的溶液置于28.2℃的细菌培养箱,静置发酵35.5h后收罐;
C4、收罐后在10000rmp转速下离心10min,收集上清液即得人参发酵液。
D、制备冻干粉末:将人参发酵液置于冷冻干燥机,冻干得到人参发酵粉末,保存待用。
对比例1 嗜酸乳杆菌乳杆菌发酵人参
按实施例6的步骤制备人参发酵液、人参发酵粉末,只将复配菌替换为按照实施例2中活化好的嗜酸乳杆菌,用量1mL,其余同实施例6。
对比例2 植物乳杆菌1.140发酵人参
按实施例6的步骤制备人参发酵液、人参发酵粉末,只将复配菌替换为按照实施例2中活化好的植物乳杆菌1.140,用量1mL,其余同实施例6。
对比例3 复配乳杆菌发酵人参(发酵条件优化前)
按实施例6的步骤制备人参发酵液、人参发酵粉末,只将发酵时间设为72h,发酵温度设为30℃,菌液接种量设为2%,其余同实施例6。
对比例4 人参原液制备
按照投入液料比6:1,称取按实施例1制备的人参茎叶提取粉末8.33g,加入50mL蒸馏水混匀;灭菌后,添加1%灭菌过的葡萄糖溶液及1%灭菌过的胰蛋白胨溶液;在28.2℃下的细菌培养箱静置,静置时间为35.5h;10000rmp转速下离心10min,收集上清液,即得人参原液。
对比例5 干酪乳杆菌发酵人参
按实施例6的步骤制备人参发酵液,只将复配菌替换为按照实施例2中活化好的干酪乳杆菌,用量1mL,其余同实施例6。
对比例6 鼠李糖乳杆菌发酵人参
按实施例6的步骤制备人参发酵液,只将复配菌替换为按照实施例2中活化好的鼠李糖乳杆菌,用量1mL,其余同实施例6。
对比例7 植物乳杆菌1.648发酵人参
按实施例6的步骤制备人参发酵液,只将复配菌替换为按照实施例2中活化好的植物乳杆菌1.648,用量1mL,其余同实施例6。
实施例7 酶活性测定
乳酸菌能够产生β-葡萄糖苷酶,β-葡萄糖苷酶能够水解人参皂苷的β-葡萄糖苷,从而改变人参皂苷分子结构中所连接的糖苷配基,将原有皂苷转化为活性更高、功能更强稀有皂苷。本实施例用pNPG法测定发酵液上清液中β-葡萄糖苷酶的酶活性。
测试用发酵液:按照对比例1~2、对比例5~7制备的单一菌种人参发酵液、按照对比例3制备的复配人参发酵液(复配优化前)、按照实施例6制备的复配菌人参发酵液(本发明)。
将上述发酵液的上清液用柠檬酸-磷酸缓冲液(pH=5.0)稀释至OD
pNPG法测出的结果见图7,由图可知,上述单一菌株发酵液的上清液中,干酪乳杆菌酶活力最低,为44.85 U/mL,植物乳杆菌1.140酶活力最高,为87.27 U/mL;而比较复配发酵液,复配菌的酶活力比植物乳杆菌1.140还高,其中复配优化前为100.71 U/mL,复配优化后酶活力比优化前增加了9.96%。
实施例8~实施例11是对单一菌种发酵液、复配菌种发酵液(复配前和复配后)进行分析测定,并与人参原液进行对比,主要考察方面:发酵液中几种活性成分含量、发酵液中皂苷单体含量,以及发酵液的抗氧化活性、发酵液对细胞活性的影响。
实施例8~实施例11的受试发酵液:按照对比例4制备的人参原液、按照对比例1制备的嗜酸乳杆菌人参发酵液、按照对比例2制备的植物乳杆菌1.140人参发酵液、按照对比例3制备的嗜酸乳杆菌和植物乳杆菌1.140复配人参发酵液(复配优化前)、按照实施例6制备的嗜酸乳杆菌和植物乳杆菌1.140复配菌人参发酵液(本发明)。
实施例8~实施例11的试验步骤和结果:见具体实施例。
实施例8 各成分含量测定
使用苯酚-硫酸法测定多糖含量,参照福林酚比色法测定总酚含量,采用亚硝酸钠-硝酸铝-氢氧化钠显色法来测定总黄酮含量。
测试结果见图8,复配优化前发酵液多糖含量比发酵前增加了63.07%,而复配优化后的发酵液其多糖含量无论是相比人参原液、单一菌种发酵液还是复配优化前发酵液,含量都是最高的,比发酵前增加了117.49%;复配优化后发酵液的多酚含量比未发酵前增加了24.41%,比嗜酸乳杆菌发酵液也有所增加;复配发酵后液的黄酮含量相比单一菌种发酵液无显著性差异,但复配优化后发酵液的黄酮含量比人参原液高。
实施例9 皂苷单体含量测定
本实施例采用液质联用测定皂苷单体含量,测定方法如下:
1、发酵液前处理:称取0.5 g按照实施例6制备的冻干粉末,加5 mL 80%甲醇50°C超声提取1.5h,离心后,稀释一定倍数,过0.22μm滤膜。
2、皂苷单体含量液质条件:
色谱条件:Waters ACQUITY UPLC ACQUITY BEH色谱柱(100 mm× 2.1 mm,1.7 μm);流动相为0.1%甲酸水(A)-乙腈(B),洗脱梯度为0~1min,30%B;1~4min,30%~50%B;4~11min,50%~60%B;11~14min,60%~70%B;14~18min,70%~90%B;18~20min,90%~90%B;20~20.2min,90%~30%B;20.2~25min,30%~30%;体积流量为0.3mL/min;柱温为40 °C,进样量为1μL。
质谱条件:ESI离子源;扫描模式为正负离子切换,多反应监测(multiplereaction monitoring,MRM)模式检测;雾化气流量3.0 L/min;干燥气流量10.0 L/min;加热气流量10L/min;接口温度300 °C;去溶剂管温度(desolvation line,DL)250 °C;加热块温度400 °C;碰撞诱导解离电压(collision induced dissociation,CID)270kPa。
3、谱图分析:其中,复配优化后发酵液(本发明实施例6)、优化前发酵液(对比例3)的液质谱图分别见图9、10,由谱图可直观看出复配菌株发酵液中人参皂苷单体出峰情况,除了已知的11种人参皂苷,在这个液相跑样条件下可明显看出还有其他物质峰。
4、皂苷单体含量分析:具体皂苷含量见表2。
表2 复配前后及优化前后发酵液中各皂苷单体含量(单位:mg/g)
可见,通过本方案的复配菌人参发酵液中人参皂苷含量大部分显著高于人参原液中的皂苷含量,尤其是稀有皂苷Rg3、CK、F2;发酵优化后的复配菌人参发酵液比嗜酸乳杆菌人参发酵液的皂苷含量高,Rg3、CK和F2三种稀有皂苷分别高出6.2%、45.9%、5.0%,而相比发酵条件优化前的复配菌人参发酵液,Rg3、CK和F2三种稀有皂苷分别高出9.5%、45.9%、1.0%。
另一方面,通过本方案获得的人参提取液提取率高于普通提取方法(如渗漉法、回流提取法、水提取法和醇沉法等),提取率为16.28%。
实施例10 抗氧化活性测定
将受试样品进行如下抗氧化活性测定:DPPH自由基清除能力的测定、羟基自由基清除能力测定、超氧阴离子自由基清除能力测定。
测定效果见图11。可见,人参提取物经本方案复配发酵后,其DPPH、羟基自由基、超氧阴离子自由基清除能力均增强,且复配优化后三种自由基的清除能力显著提高。
其中,羟基自由基的清除能力增加最为显著,复配优化后与发酵前相比增幅高达241.95%;DPPH次之,复配优化后与发酵前相比增幅为73.16%;而对于超氧阴离子自由基的清除能力,单一菌种发酵液甚至出现低于人参原液,但复配后的人参发酵液比单一菌种发酵液具有更强的清除能力,而经过发酵工艺条件优化后显著提高,与发酵前相比增幅为108.01%。
实施例11 人参发酵液对HaCaT/BJ/HFSC细胞活性影响
取对数生长期的人皮肤成纤维细胞(BJ细胞)、人皮肤角质细胞(HaCaT细胞)、大鼠毛囊干细胞(HFSC细胞)铺板于96孔板中,24 h后加入含有不同浓度发酵液或人参原液的DMEM完全培养基,每个浓度设置3个复孔,24 h后每孔加入10μLCCK8,孵育1h后将96孔细胞培养板放入酶标仪中,以630nm为参比波长,在450nm处测定吸光度,记录测定结果,见图11~13。
由图12看出,复配发酵液和单菌种发酵后对BJ细胞作用相比具有显著性差异,复配优化后的发酵液比复配优化前对BJ细胞活性有显著提升。具体分析如下:复配优化后发酵液在0.06%体积分数以下显示出对BJ细胞的明显增殖作用,细胞存活率在158.13%;在体积分数为0.25%时,其细胞存活率为117.30%,有一定的增殖作用;在体积分数为1%时,其细胞存活率为63.15%,显示出轻微毒性;人参原液对BJ细胞具有一定的细胞毒性作用,BJ细胞存活率为50.00%左右。
由图13可看出,复配前后和优化前后发酵液对HaCaT细胞作用类似于对BJ给药后的效果。具体分析如下:复配优化后发酵液在0.25%和0.06%体积分数下对HaCaT细胞增殖都有促进作用且差异不显著,在体积分数为0.06%的时候,其细胞存活率可高达154.53%;但在1%体积分数时,具有一定的细胞毒性,细胞存活率低于60.00%;人参原液对HaCaT细胞有明显抑制作用,且在三个体积分数下没有显著差异,其细胞存活率都低于50.00%,对HaCaT细胞具有一定毒性作用。
由图14可以看出,在0.25%体积分数以下复配前后及优化前后发酵液对HFSC细胞都有显著的促增殖作用;0.06%体积分数下复配优化后的细胞活性高达171.24%,对HFSC的促增殖作用比0.25%体积分数明显略胜一筹;在1%浓度下的各人参发酵液对HFSC具有显著毒性作用,细胞存活率低于2.00%;人参原液在0.06%的体积分数下,反而对HFSC细胞无明显毒性作用。
综上说明,本发明中复配优化后的人参发酵液在0.06%~0.25%体积分数范围内给药时,有显著的减毒增效作用,优选0.06%体积分数给药,对促进HaCaT/BJ/HFSC细胞增殖作用更明显。
实施例12 对Ⅱ型5α-还原酶抑制活性测定
雄激素脱发(Androgenetic alopecia,AGA)也被称为脂溢性脱发,是现在较普遍的脱发问题。现代医学研究已经证明Ⅱ型5α-还原酶控制雄激素代谢,将雄激素睾酮(T)转化为二氢睾酮(DHT),而二氢睾酮作为一种强效雄激素,对雄激素受体的亲和力高于睾酮,体内高水平二氢睾酮导致雄激素脱发。现代科学研究发现人参皂苷、稀有人参皂苷具有抑制Ⅱ型5α-还原酶的作用。本实施例为人参发酵液抑制Ⅱ型5α-还原酶实验。
受试样品:按照对比例1制备的嗜酸乳杆菌人参发酵液、按照对比例2制备的植物乳杆菌1.140人参发酵液、按照实施例6制备的嗜酸乳杆菌和植物乳杆菌1.140复配菌人参发酵液(本发明)。
实验步骤:
1)根据文献方法制备5α-还原酶:使用二氧化碳窒息法处死大鼠,在冰上提取大鼠附睾,称重剪碎,制备5α-还原酶的提取液,预先放置低温作为预冷酶提取液;
2)加入三倍量预冷酶提取液在玻璃匀浆器中匀浆;
3)匀浆液于4℃,10000 r/min离心10~20min;取上清液在4℃条件下10000 r/min离心1~1.5 h;
4)取上清液即为粗酶,分装保存于-80℃超低温冰箱中,临用前取出,避免反复冻融;
5)将受试样品发酵液分别加入到建立的酶反应体系中,混合物在37℃孵育30分钟后,在紫外可见分光光度计340nm处测定10min内的吸光度变化值(ΔA
6)以提取物的溶剂加入到建立的酶反应体系中,在紫外可见分光光计340nm处测定10min内的吸光度变化值(ΔA
7)计算5α-还原酶抑制率,公式如下:
5α-还原酶抑制率=(ΔA
抑制率结果见图15。可见,相比单一菌种发酵人参发酵液,本发明的复合菌种人参发酵液明显具有更好的抑制5α-还原酶的效果,说明本发明人参发酵液具备减少雄激素脱发的功效。
实施例13 洗发露的制备
以上述实施例6中得到的复配乳杆菌发酵的人参发酵液作为活性物质,制备防脱洗发露。防脱洗发露的制备步骤如下:
1、将适量水加入到反应罐中,在缓慢搅拌下加入瓜尔胶进行分散;
2、缓慢搅拌加热到60℃至80℃,接着加入其他组分,包括pH调节剂(例如柠檬酸)、椰油酰胺丙基甜菜碱、月桂酰两性基乙酸钠、月桂酰肌氨酸钠、癸基葡糖苷、PEG-7甘油椰油酸酯、椰油酰胺MEA、蓖麻醇酸酰胺丙基三甲基氯化铵、聚季铵盐-10、PCA钠、聚季铵盐-7、硬脂酰胺丙基二甲胺,使这些物质完全分散后降温;
3、待温度降至50℃以下加入活性物质,搅拌分散均匀,再加入防腐剂、色素等继续搅拌,确保得到均匀的混合物;
4、根据需要加入其他辅助原料,加水补足,搅拌均匀,即得洗发露。
其中活性物质为对比例1中嗜酸乳杆菌人参发酵液的,制备洗发露为洗发露2;活性物质为对比例2中植物乳杆菌1.140人参发酵液的,制备洗发露为洗发露3;活性物质为实施例6中嗜酸乳杆菌和植物乳杆菌1.140复配菌人参发酵液的,制备洗发露为洗发露4;不加入活性物质的作为空白对照,即洗发露1。具体配方见表3。
表3 防脱洗发露配方表
说明:人参发酵液和洗发露可按照密度相同计算,表3中人参发酵液占洗发露0.6%的质量分数即相当于占0.6%的体积分数。对于洗去型化妆品,通常按照药物给药浓度与实际产品浓度为1:10的比例配制,因此洗发露2~4中人参发酵液在实际使用时的给药浓度为0.06%左右。
实施例14 洗发露临床功效试验
以实施例13中制备的防脱洗发露作为受试洗发露,包括:实施例6洗发露、对比例1洗发露、对比例2洗发露,还包括未添加任何人参发酵液的洗发露作为空白对照组,验证人参发酵液应用在制备防脱洗发露的功效。测试方法如下:
1、受试者的选择:按入选和排除标准选择合格的受试者,并按随机表分为试验组和对照组,确保最终完成有效例数不少于30人/组。
1)入选标准:18~60岁,健康男性或女性;头发长度在5~40cm之间;有脱发多和头发轻度稀疏困扰,且按60次梳发法脱发计数大于10根、2周洗脱期后仍大于10根者;近1个月内没有进行过染发、烫发、定型等特殊美发处理者;能够理解试验过程,自愿参加试验并签署书面知情同意书者。
2)排除标准:受试者筛选和试验期间每次访视前48±4小时内不能洗头,且每次访视前不洗头发的时间基本保持一致,访视当天不能自行梳发;试验期间每次访视评估前2周内不理发;试验期间不能进行任何头发护理和美发处理措施,也不能接受任何防脱发、生发方面的治疗;试验期间需保持原有的生活习惯,避免情绪波动大。
2、检测指标:包括脱发情况评估和毛发密度评估,其中毛发密度评估包括整体毛发密度评估和局部毛发密度评估。
1)脱发计数:受试者每次访视时由经过培训的工作人员采用60次梳发法梳理受试者头发,对脱落头发计数,并记录。
2)整体毛发密度:受试者头顶头发向两侧对称梳开并保持顺畅,每次访视评估必须保持相同的发型(参考首次拍摄的全头头发照片),采用图16的0~7级评估量表评价头顶区域头发密度。整体毛发密度评估包括视觉评估和图像评估,计算两者的均值作为整体毛发密度。
①视觉评估:每次访视时由皮肤科医生现场对毛发密度进行评估,并记录评分等级;
②图像评估:每次访视时,拍摄全头头发照片,访视全部结束后,由皮肤科医生对拍摄的照片进行毛发密度评估,并记录评分等级;拍摄全头头发照片的具体方法如下:受试者穿上黑色无反光围脖,并将头发梳理顺畅(每次发型保持一致,回访拍照参照首次拍摄照片),下巴置于拍摄支架上;固定数码相机拍摄参数,以头顶为中心拍摄全头头发照片;每次拍照时,需要贴上标签,包括试验编号、受试者编号和访视时间,并设置标准色板(至少含有黑色、白色和灰色)。
3)局部毛发密度:受试者头部固定一块至少1.5cmx1.5cm的剪发区域(头顶偏颞侧),做好定位,每次访视时,保证剪除毛发区域一致,毛发剪至残留长度不超过1mm;图像采集过程中,操作人员需要让受试者处于一个舒适的体位,将皮肤镜置于剪除毛发区域正中央进行局部头发图像拍摄,拍摄时皮肤镜镜头与头皮完全贴合且保持垂直,并检查拍摄图像的清晰度。用图像分析软件或者人工计数方法,计数局部毛发数量和密度,并记录。
3、功效判断标准:根据数据分析结果,试验期间任何访视时间点,使用试验产品前后脱发计数无显著增加或前后脱发计数差值(产品使用后某一访视时间点的脱发计数-产品使用前的脱发计数)显著低于对照组(P<0.05);又或者毛发密度(整体毛发密度或局部毛发密度)无显著减少、或前后毛发密度差值(产品使用后某一访视时间点的毛发密度-产品使用前的毛发密度)显著高于对照组(P<0.05),则认定试验产品有防脱发功效,否则认为试验产品无防脱发功效。
4、试验结果:检测结果见图17~图21。可见用实施例6的人参发酵液制备的洗发露在脱发计数、整体毛发密度(视觉评估、图像评估)和局部毛发密度这几个指标上都是优于对比例1或2的发酵液制备的洗发露,更加优于空白对照组洗发露。由此说明,用本申请方案制备的嗜酸乳杆菌和植物乳杆菌1.140复配人参发酵液,制备成防脱洗发露具有临床防脱发效果。
以上所揭露的仅为本发明的较佳实施例而已,不可以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
- 一种自适应光源控制器
- 一种输出自适应恒流的视觉光源控制器
