铱催化不对称氢化α-羰基酸酯制手性α-羟基酸酯的方法
文献发布时间:2024-04-18 20:01:23
技术领域
本发明属于有机合成领域,具体涉及一种铱催化不对称氢化制备手性α-羟基酸酯的方法。
背景技术
在过去的几十年里,过渡金属催化的不对称合成得到了极大发展。其中,不饱和烯烃、酮和亚胺的不对称催化氢化,是最为直接、最为有效的制备手性化合物的方法。通过酮的不对称氢化,可以获得手性药物和天然产物的重要骨架—手性醇[a)R.Noyori andT.Ohkuma,Angew.Chem.Int.Ed.,2001,40,40-73;(b)R.Noyori,Adv.Synth.Catal.,2003,345,15-32.)。和简单酮的氢化相比,由于手性扁桃酸酯类化物是许多药物分子的中间体,不对称氢化合成其相关化合物近些年也出现了许多报道。2006年,Albert S.C.Chan等和Xumu Zhang分别合成一类新的C3-TunePhos在α-羰基酸酯的不对称氢化中取得了突破性的进展。[a)L.Qiu,F.Y.Kwong,J.Wu,W.H.Lam,S.Chan,W.-Y.Yu,Y.-M..Li,R.Guo,Z.Zhou,Albert S.C.Chan.J.Am.Chem.Soc.,2006,128,5955;b)C.-J.Wang,X.Sun,X.Zhang,Synlett,2006,8,1169]。2019年,周其林等发展了铱-P,N,N配体(SpiroOAP)催化剂,该催化剂在α-羰基酰胺的不对称氢化中获得了优秀的对映选择性和高达10000的转化数(F.-H.Zhang,C.Wang,J.-H.Xie,Q.-L.Zhou,Adv.Synth.Catal.2019,361,2832)。近来,我们发展的二茂铁P,N,N配体在铱催化β-酮酸酯不对称氢化中有着优异的表现[a)C.-J.Hou andX.-P.Hu,Org.Lett.,2016,18,5592-5595;b)X.-S.Chen,C.-J.Hou,C.Qin,H.Liu,Y.-J.Liu,D.-Z.Huang and X.-P.Hu,RSC.Adv.,2017,7,12871-12875]。
发明内容
本发明的目的是提供一种铱催化不对称氢化α-羰基酸酯制备手性α-羟基酸酯的方法。
一种铱催化不对称氢化α-羰基酸酯制备手性α-羟基酸酯的方法;该方法以α-羰基酸酯化合物为原料,环辛二烯氯化铱二聚体([Ir(COD)Cl]
所述的反应方程式如下:
所述的酮化合物I,醇化合物II,结构如下式:
其中,R
所述环上碳数为C3-C12环烷基上的取代基、苯基上的取代基、苄基上的取代基分别为C1-C40链烷基烷基、C1-C40的烷氧基、卤素(氟、氯、溴、碘)、硝基、酯基或氰基中的一种或二种以上;取代基个数为1-2个。
R
所述的手性P,N,N配体,其结构如下式:
式中:
R
R
R
该方法的具体步骤为:在氮气环境中,将[Ir(COD)Cl]
所述碱添加剂为t-BuOK、t-BuONa、KOH、NaOH、K
所述的溶剂为甲醇、乙醇、甲苯、苯、二甲苯、二氯甲烷、二氯乙烷、四氢呋喃或乙酸乙酯中的一种或两种以上;所述的溶剂优选为乙醇。
所述氢化反应压力为10-80大气压,氢化反应时间为12-36小时。
所述柱层析洗脱剂参数为体积比石油醚:乙酸乙酯=10:1~50:1。
本发明的有益效果和优势:
本发明所述的铱催化α-羰基酸酯的不对称氢化反应制备手性α-羟基酸酯化合物具有条件温和、易于操作,且产物的对映选择性高等优点。
附图说明
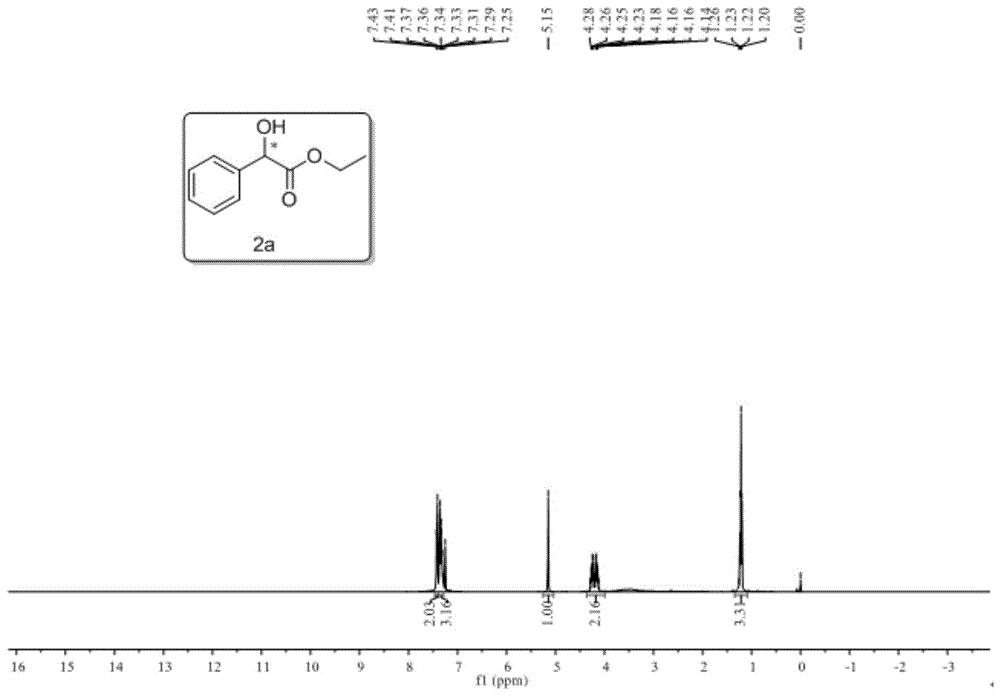
图1是化合物2-羟基-2-苯基乙酸乙酯II-a的核磁氢谱图。
具体实施方式
下面的实施例将对本发明予以进一步的说明,但并不因此而限制本发明。核磁共振是通过Bruker核磁共振仪测定,高效液相色谱(HPLC)是通过Agilent 1100系列高效液相色谱测定。
实施例1
在充满氮气的手套箱中,将[Ir(COD)Cl]
该类化合物是许多药物分子重要的中间体如Cylandelate、Homatropine,参考文献(R.G.Glushkov,N.I.Koretskaya,K.I.Dombrovskaya,G.Y.Shvarts andM.D.Mashkovskii,Pharm.Chem.J.1977,11,905-909)。
化合物L1、I-a和II-a的结构分别如下:
实施例2
与实施例1不同之处在于,将配体L1替换为L2,其余同实施例1,得产物2-羟基-2-苯基乙酸乙酯II-a,98%收率,94%ee。
配体L2的结构如下:
实施例3
与实施例1不同之处在于,将配体L1替换为L3,其余同实施例1,得产物2-羟基-2-苯基乙酸乙酯II-a,96%收率,86%ee。
配体L3的结构如下:
实施例4
与实施例1不同之处在于,将配体L1替换为L4,其余同实施例1,得产物2-羟基-2-苯基乙酸乙酯II-a,96%收率,84%ee。
配体L4的结构如下:
实施例5
与实施例1不同之处在于,将配体L1替换为L5,其余同实施例1,得产物2-羟基-2-苯基乙酸乙酯II-a,96%收率,75%ee。
配体L5的结构如下:
实施例6
与实施例1不同之处在于,将配体L1替换为L6,其余同实施例1,得产物2-羟基-2-苯基乙酸乙酯II-a,96%收率,82%ee。
配体L6的结构如下:
实施例7
与实施例1不同之处在于,将配体L1替换为L7,其余同实施例1,得产物2-羟基-2-苯基乙酸乙酯II-a,98%收率,83%ee。
配体L7的结构如下:
实施例8
与实施例1不同之处在于,将配体L1替换为L8,其余同实施例1,得产物2-羟基-2-苯基乙酸乙酯II-a,98%收率,70%ee。
配体L8的结构如下:
实施例9
与实施例1不同之处在于,将配体L1替换为L9,其余同实施例1,得产物2-羟基-2-苯基乙酸乙酯II-a,96%收率,82%ee。
配体L9的结构如下:
实施例10
与实施例1不同之处在于,将配体L1替换为L10,其余同实施例1,得产物2-羟基-2-苯基乙酸乙酯II-a,98%收率,90%ee。
配体L10的结构如下:
实施例11
与实施例1不同之处在于,将配体L1替换为L11,其余同实施例1,得产物2-羟基-2-苯基乙酸乙酯II-a,95%收率,83%ee。
配体L11的结构如下:
实施例12
与实施例1不同之处在于,将配体L1替换为L12,其余同实施例1,得产物2-羟基-2-苯基乙酸乙酯II-a,95%收率,81%ee。
配体L12的结构如下:
实施例13
与实施例2不同之处在于,将氢气压力改为50大气压,其余同实施例2,得产物2-羟基-2-苯基乙酸乙酯II-a,98%收率,94%ee。
实施例14
与实施例2不同之处在于,将氢气压力改为80大气压,其余同实施例2,得产物2-羟基-2-苯基乙酸乙酯II-a,98%收率,94%ee。
实施例15
与实施例2不同之处在于,将碱t-BuOK替换为t-BuONa,其余同实施例2,得产物2-羟基-2-苯基乙酸乙酯II-a,96%收率,92%ee。
实施例16
与实施例2不同之处在于,将碱t-BuOK替换为KOH,其余同实施例2,得产物2-羟基-2-苯基乙酸乙酯II-a,96%收率,84%ee。
实施例17
与实施例2不同之处在于,将碱t-BuOK替换为NaOH,其余同实施例2,得产物2-羟基-2-苯基乙酸乙酯II-a,96%收率,85%ee。
实施例18
与实施例2不同之处在于,将碱t-BuOK替换为K
实施例19
与实施例2不同之处在于,将反应溶剂EtOH替换为MeOH,其余同实施例2,得产物2-羟基-2-苯基乙酸甲酯II-a,95%收率,82%ee。
实施例20
与实施例2不同之处在于,将反应溶剂EtOH替换为i-PrOH,其余同实施例2,得产物2-羟基-2-苯基乙酸乙酯II-a,95%收率,75%ee。
实施例21
与实施例2不同之处在于,将反应溶剂EtOH替换为Toluene,其余同实施例2,得产物2-羟基-2-苯基乙酸乙酯II-a,35%收率,38%ee。
实施例22
与实施例2不同之处在于,将反应溶剂EtOH替换为CH
实施例23-43
反应底物适用性
在充满氮气的手套箱中,将[Ir(COD)Cl]
本发明具有广泛的底物适用性,按照上述反应条件,许多底物都能参与该反应,高收率和高对映选择性的获得手性中心的醇产物II,其反应式为:
/>
/>
/>
/>
- 轮胎硫化模具、用于铸造轮胎硫化模具的铸模、以及轮胎硫化模具的制造方法
- 充气轮胎的制造方法、轮胎硫化模具以及充气轮胎
- 制造轮胎包络的方法、系统
- 一种轮胎包络生成方法及系统
