隐性抗病基因ATPδ在防控病毒中的应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明属于基因工程领域,涉及植物线粒体基因,特别是指隐性抗病基因ATPδ在防控病毒中的应用。
背景技术
病毒侵染引起的病害导致世界各地的主要作物减产。1935年,英国首次报道黄瓜绿斑驳花叶病毒(Cucumber green mottle mosaic virus, CGMMV)(Dombrovskyet al.,2017)。1935年到1985年,CGMMV在欧洲的分布逐步扩大,侵染各种瓜类作物。随后又传播到亚洲(Liu et al., 2009)。CGMMV属于帚状病毒科(Virgaviridae),烟草花叶病毒属(Tobamovirus),为正单链RNA病毒。是我们重要的检疫性病毒。CGMMV主要侵染葫芦、南瓜、丝瓜、瓠瓜、西瓜、黄瓜、甜瓜等葫芦科植物,同时也可以侵染模式植物本氏烟。CGMMV侵染导致植株叶片表现为黄斑、花叶、褪绿、泡状等症状,有的可能产生绿色的突起,使叶片表面凹凸不平,植株生长缓慢或矮化,严重的可导致不孕。影响果实品质,造成严重经济损失。
活性氧(reactive oxygen species acid, ROS)是使植物响应不同刺激的重要信息分子,在植物的生物和非生物胁迫中发挥着重要作用,同时在病毒侵染植物的过程中扮演着重要的角色。ROS的产生可以上调植物防御相关基因从而抑制病毒的侵染,例如小麦黄花叶病毒(Wheat yellow mosaic virus, WYMV)(Liu et al., 2021)、水稻黑条矮缩病(riceblack‐streaked dwarf virus, TNV)(Xie et al., 2018)、辣椒叶脉斑驳病毒(Chilli veinal mottle virus,ChiVMV)(Yang et al., 2022)和芜菁花叶病毒(turnipmosaic virus, TuMV)(Qiu et al., 2021)等。
在玉米中,FOF1-ATP合成酶活性降低导致ROS爆发,以及细胞程序性死亡(Yang etal., 2022)。在FOF1-ATP合成酶中,ATPδ作为FO和F1亚基之间的连接物(Gibbons et al.,2000)。在拟南芥中,ATPδ是At5g47030转录翻译而来的(Geisler et al., 2012)。在棉花中,GhATPδ1可以诱导不同棉花品种的纤维长度(Gibbons et al.,2000)。同样,在拟南芥中,ATPδ基因在花粉、胚珠和花原基中高度表达,这些都是需要高能量水平维持其发育的组织(Geisler et al., 2012)。目前,ATPδ在病毒侵染中的作用尚不清楚。
发明内容
为解决上述技术问题,本发明提出一种隐性抗病基因ATPδ在防控病毒中的应用。
本发明的技术方案是这样实现的:
隐性抗病基因ATPδ在防控病毒中的应用。
上述隐性抗病基因ATPδ的核苷酸序列如SEQ ID No.1所示。
上述隐性抗病基因ATPδ编码的植物蛋白定位于线粒体中,通过调控ROS途径实现防控病毒。
上述ROS指H
上述隐性抗病基因ATPδ通过调控超氧化物歧化酶的活性实现防控病毒。
上述隐性抗病基因ATPδ通过调控铁超氧化物歧化酶的表达量来调节超氧化物歧化酶(Iron Superoxide dismutase,NbFeSODs)的活性。
上述隐性抗病基因ATPδ编码的植物蛋白的氨基酸序列如SEQ ID No.2所示。
上述病毒指黄瓜绿斑驳花叶病毒。
上述的应用,步骤为:以隐性抗病基因ATPδ基因为目标基因,构建隐性抗病基因ATPδ的基因沉默载体,将基因沉默载体转入待改良植株中,获得抗病植株对病毒进行防控。
上述基因沉默载体通过提高植物体内ROS的水平从而进行抗病毒防控。
本发明具有以下有益效果:
1、本发明提出一种隐性抗病基因ATPδ在防控病毒中的应用,解决了现有技术中黄瓜绿斑驳花叶病毒侵染多种农作物造成果实品质下降,经济损失的技术问题。其中植物蛋白ATPδ的氨基酸序列如SEQ ID No.2所示。ATPδ参与黄瓜绿斑驳花叶病毒侵染过程,并调控植物活性氧(ROS)的清除。本申请首次鉴定了ATPδ通过调控ROS的清除参与CGMMV侵染的机制,确定了ATPδ作为一种隐性抗病毒基因,有利于后续利用基因编辑技术和遗传转化技术进行抗病毒种质的创制。
2、本申请首次通过研究发现在ROS相关基因ATP合成酶δ亚基(ATPδ),证明了ATPδ定位于线粒体。沉默ATPδ可以抑制烟草中CGMMV的积累。过表达ATPδ可以促进CGMMV在叶片中的积累。ATPδ特异性抑制O
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为ATPδ全长的核酸电泳图。
图2为ATPδ沉默后抑制CGMMV侵染结果图,其中A为沉默ATPδ植株接种CGMMV和未接种CGMMV的植株症状;B为沉默ATPδ植株接种CGMMV的系统叶症状;C为ATPδ的沉默效率检测;D为qPCR检测ATPδ沉默后对CGMMV积累的影响;E为western blot检测ATPδ沉默后对CGMMV积累的影响。
图3为ATPδ过表达促进CGMMV侵染的结果图。其中A为鉴定OE ATPδ 1-5为ATPδ过表达转基因植株核酸电泳图;B为ATPδ过表达转基因植株接种CGMMV的系统叶症状;C为激光共聚焦显微镜拍摄ATPδ亚细胞定位图;D为western blot检测ATPδ过表达后对CGMMV积累的影响;E为qRT-PCR检测ATPδ瞬时过表达后对CGMMV积累的影响;F为western blot检测ATPδ瞬时过表达后对CGMMV积累的影响。
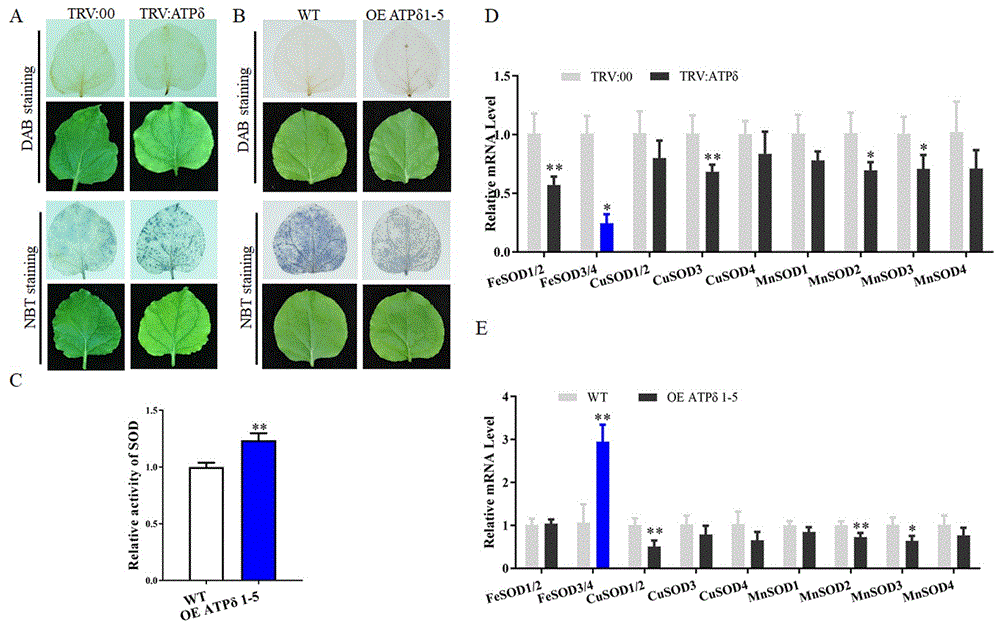
图4为ATPδ沉默和过表达后植株ROS和SOD相关的结果图,其中A为ATPδ沉默植株叶片DAB和NBT染色图;B为ATPδ过表达转基因植株叶片DAB和NBT染色图;C为ATPδ过表达转基因植株对SOD活性的影响;D为qRT-PCR检测ATPδ沉默植株对SOD相关基因的转录水平影响;E为qRT-PCR检测ATPδ过表达植株对SOD相关基因的转录水平影响。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:本氏烟ATPδ基因的克隆
一、本氏烟总RNA提取
1) 用打孔器取本氏烟叶片0.2 g于2 ml Eppendorf (EP)管中,液氮速冻后迅速震荡研磨;
2) 充分研磨后,在组织粉末中加入1.5 ml Trizol震荡混匀,冰上静置5 min,4℃,13,200 rpm离心5 min;
3) 取上清于2 ml EP管中,加1/5体积的三氯甲烷,剧烈震荡30 s,冰上静置5min,4℃,13,200 rpm离心15 min;
4) 取上层水相于2 ml EP管中,加入等体积的异丙醇,轻柔震荡30 s,室温静置10min;4℃,13,200 rpm离心20 min;
5) 弃上清,加入1 ml 75%乙醇,洗涤沉淀,4℃,13,200 rpm离心5 min;
6) 重复步骤 5;
7) 弃上清,小心吸除残留液体,室温干燥 5 min,加入适量 RNase-Free H
8) 紫外分光光度计测定 RNA 浓度后,放置-80℃备用。
二、反转录合成cDNA
将提取后的RNA反转录为cDNA,操作参照Takara Prime ScriptTM RT Regent Kitwith gDNA Eraser说明书:
第一步:
按照上述体系加入到 EP 管中,混合均匀, 42℃ 10 min,冰上 5 min;
第二步:
按照上述体系加入到EP管中,混合均匀。在PCR仪上按下列条件进行反转录反应:
反转录产物可放于-20℃长期保存。
三、RT-PCR扩增ATPδ基因
利用上述cDNA模版,并且根据ATPδ基因核酸序列设计引物,进行PCR扩增,反应体系如下:
引物序列为:
正向引物(5’-3’): ATGTTCCGACACGGTTCT;
反向引物(5’-3’): ACCAGTGAGAGCAGCATTAA。
混匀后,按照如下条件进行PCR:
PCR程序结束后直接进行琼脂糖凝胶电泳。得到目的条带后,参照QIAquick GelExtraction Kit 说明书,进行核酸纯化,如图1获得本氏烟ATPδ基因的全长。
实施例2:TRV介导的ATPδ基因沉默对CGMMV侵染的影响
一、构建TRV-RNA2-ATPδ VIGS载体
ATPδ基因的系统沉默是利用TRV侵染性克隆介导的VIGS技术进行的。以本氏烟的cDNA为扩增模版,利用SGN VIGS Tool(http://vigs.solgenomics.net)在基因上预测一段300bp的片段进行TRV介导的VIGS,并设计引物,通过PCR扩增出目的片段:
引物序列为:
正向引物(5’-3’): AGTGGTCTCTGTCCAGTCCTCGATCTACCGGCGGAGTC
反向引物(5’-3’): GGTCTCAGCAGACCACAAGTTTGCCTTCATGAACTGATAA
将ATPδ-VIGS片段同源重组的方式克隆到VIGS载体,首先需要对载体进行双酶切,体系如下:
根据相应限制性内切酶的反应温度,设置酶切温度,金属浴5-16 h后,取2 μL酶切产物进行琼脂糖凝胶电泳检测,并与原始质粒进行比较。随后进行酶切产物的纯化回收。使用同源重组连接试剂盒(C112)进行融合克隆,体系如下:
混匀后,37℃水域0.5 h,将上述连接产物转化入DH5α;37℃培养过夜,挑取单克隆进行菌落PCR并提取质粒。
二、ATPδ沉默植株沉默效率鉴定
将TRV2-ATPδ和TRV1共注射到本氏烟在ATPδ沉默10天后,接种CGMMV病毒,接种后7天出现病毒侵染症状,如图2A和2B。
利用qRT-PCR检测其沉默效率。
将上述试剂依次加入RNase-free EP管中,混匀后,分装到384孔定量板上,在实时荧光定量PCR仪中进行反应:预变性 95℃ 3 min;94℃ 15 s、60℃ 15 s、72℃ 15 s,进行40个循环。
结果由图2C可知,ATPδ进行VIGS后沉默效率达到98%。
UBC定量引物序列为:
正向引物(5’-3’): GAGGAAGAGACTGGTGAGGGAT;
反向引物(5’-3’): CACAGAGCAAAGACTGGATTGA
ATPδ定量引物序列为:
正向引物(5’-3’): CATCGAAGCTTGGAGGAAAG;
反向引物(5’-3’): ACCCATCTGTCCCGTAGTTG
三、ATPδ沉默对CGMMV侵染的影响
确定ATPδ沉默效率后,对沉默10 dpi的植株接种CGMMV,接种后7天利用qRT-PCR检测病毒积累量。由图2D可知,ATPδ沉默可以有效抑制CGMMV CP转录水平,即抑制CGMMV的侵染。
CGMMV CP定量引物序列为:
正向引物(5’-3’): CCAGACTCAAGCGGGAAGA;
反向引物(5’-3’): TCTACAACCTCAATGACCC
利用western blot检测CGMMV病毒积累量的变化,本氏烟总蛋白提取方法如下:选取适量的面积相同的本氏烟叶片组织,液氮速冻并研磨;由蛋白组织裂解液(100 mM Tris-HCl pH 8.8; 60% SDS; 2% β-巯基乙醇)裂解,冰上静置30 min;13200 rmp 4℃ 离心10min,取上清;加入5 × loading buffer,100℃变性10 min。取相同体积的已变性的蛋白样品,进行SDS-PAGE垂直电泳,电压80 V 30 min,调节电压120 V 1.5 h;半干法转膜,300mA25 min;加入适量封闭液(5%的脱脂牛奶)对NC膜进行封闭,室温 1 h;加入anti-CGMMV CP一抗稀释液,室温孵育1-2 h;二抗为羊抗兔抗体,室温孵育1-2 h;最后用ECL显色液进行显色。结果如图2E可知ATPδ沉默后可以有效减少CGMMV CP蛋白积累量,即ATPδ沉默抑制CGMMV侵染。
实施例3:创制ATPδ过表达转基因植株对CGMMV侵染的影响
一、创制ATPδ过表达转基因植物
将ATPδ全长开放阅读框利用同源重组的方法构建到由CaMV 35S启动子驱动的pFGC5941载体上,经过烟草愈伤组织进行遗传转化,创制ATPδ过表达转基因植物。在烟草遗传转化后的植物中,通过RT-PCR分析鉴定ATPδ稳定过表达的转基因烟草,如图3A所示。最终筛选到OE ATPδ 1-5株系可以稳定过表达ATPδ,且发育正常,表型无明显变化。
ATPδ- pFGC5941引物序列为:
正向引物(5’-3’): ACAATTACATTTACAATTACCATGATGTTCCGACACGGTTCT
反向引物(5’-3’): AAATCATCGATTGGGCGCGACCAGTGAGAGCAGCATTAA
二、ATPδ-GFP瞬时过表达载体的构建及荧光观察
以实施例1中的ATPδ的核酸序列为模板,PCR扩增ATPδ基因,PCR产物通过同源重组的方式克隆到GFP载体,测序验证正确,得到ATPδ-GFP重组质粒。
ATPδ-GFP引物序列为:
正向引物(5’-3’): CGACGACAAGACCGTCACCATGTTCCGACACGGTTCT
反向引物(5’-3’): GAGGAGAAGAGCCGTCGACCAGTGAGAGCAGCATTAA
将上述重组质粒ATPδ-GFP转化农杆菌GV3101,并浸润本氏烟叶片。使用荧光标记物MitoTracker Red对线粒体进行特异性标记。2天后在激光共聚焦显微镜下观察叶片组织。结果如图3C所示,可以得出ATPδ-GFP在线粒体上与MitoTracker Red共定位。
三、ATPδ过表达对CGMMV侵染的影响
对ATPδ过表达转基因植株接种CGMMV,6天都可以观察到CGMMV侵染症状,结果如图3B。如图3D和E所示过表达ATPδ后增加了CGMMV CP的积累。同时,对ATPδ-GFP瞬时过表达的叶片接种CGMMV,接种后48 h利用western blot检测病毒积累量。如图3F所示,过表达ATPδ-GFP后增加了CGMMV CP的积累。
实施例4:ATPδ通过清除ROS从而对CGMMV的侵染产生影响
1、ATPδ沉默和过表达植株H
采用DAB和NBT染色检测了ATPδ沉默和过表达植株H
DAB染色:将待检测的叶片浸润于浓度1 mg/ml的NBT(购于索莱宝生物科技有限公司),25℃,暗反应12h。结束后,将叶片置于沸腾的96%乙醇中去除叶绿素。冷却后,将叶片置于70%乙醇中2-3小时。
NBT染色:将待检测的叶片浸润于浓度2 mg/ml的DAB(购于索莱宝生物科技有限公司)即3,3-diaminobenzidine TrisCI缓冲液中(PH=3.8),25℃,暗反应12 h。结束后,将叶片置于沸腾的96%乙醇中去除叶绿素。冷却后,将叶片置于70%乙醇中2-3小时。
如图4A和4B显示,ATPδ沉默和ATPδ过表达影响了O
2、ATPδ过表达植株中SOD活性检测
SOD活性测定采用超氧化物歧化酶活性测定试剂盒(购于索莱宝生物科技有限公司)。首先,进行粗酶提取。称取0.04 g组织,加入0.6 mL 0.5 mol/L磷酸盐缓冲液(pH7.8),混匀,8000g 4℃离心10min;上清是酶的粗溶液。将反应混合物混合20 min后引发反应,化学反应生成的超氧化物与NBT反应。然后在560 nm处记录NBT还原产物甲醛的吸光度。
使用该方法检测转基因ATPδ过表达植株中SOD活性。如图4C显示,转基因ATPδ过表达植株中SOD活性明显上升。
3、利用qRT-PCR检测本氏烟中SODs相关基因
超氧化物歧化酶(SODs)通过催化O
SOD相关基因定量引物序列为:
NbFeSOD1/2 RT f:ACAGGGCTTATGTCGACAACTT
NbFeSOD1/2 RT r:TTCCTCCTCCACTAGGCTTCA
NbFeSOD3/4 RT f:CGCTCCTCACCATAGACGTT
NbFeSOD3/4 RT r:CTGACTGCTTCCCACGACAC
NbCuZnSOD1/2 RT f:TCCAATGTTGAGGGCGTTGT
NbCuZnSOD1/2 RT r:ACCCGTTTGTAGTGTCACCG
NbCuZnSOD3 RT f:CAACAACCCAACGGCTCTAC
NbCuZnSOD3 RT r:CACAACTACTGCTCTCCCCA
NbCuZnSOD4 RT f:GCAGTGAAGGTGTTAGTGGC
NbCuZnSOD4 RT r:CCTGTTGACATGCAGCCATT
NbMnSOD1 RT f:CTTCTCCCTCCCCGATCTTC
NbMnSOD1 RT r:CAATTTGGCGACGGTAGGAG
NbMnSOD2 RT f:TCAACGGCGGAGGTCATATT
NbMnSOD2 RT r:GAACCCTGTAAAGCTGCACC
NbMnSOD3 RT f:TGGCACTTCGAAGCGTAATG
NbMnSOD3 RT r:ATCTGCATGATCTCACCGCT
NbMnSOD4 RT f:ACGAACCCTAGTGAGCAGAC
NbMnSOD4 RT r:ATGATGCTTCTGGTGGTGGA
CGMMV侵染可诱发ROS爆发。ROS信号传导或ROS触发的防御机制可抑制病毒侵染。为了调节活性氧的毒性,植物在不同的细胞区域产生活性氧,利用活性氧清除剂。在CGMMV侵染的过程中,利用线粒体基因ATPδ通过调节NbFeSODs的表达来诱导SOD活性,从而促进O
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 基于泡沫钛单原子整体电极的二氧化氯气体发生装置
- 单原子阴阳极同时合成高纯二氧化氯气体的方法及其装置
