肝靶向的早期药物性肝炎和自身免疫性肝炎的荧光/光声双模态探针
文献发布时间:2023-06-19 18:37:28
技术领域
本发明涉及小分子荧光/光声双模态探针可视化观察
背景技术
肝脏是人体的主要代谢器官之一,在人体的新陈代谢中起着至关重要的作用。但肝脏更容易接触各种不利因素,比如药物过量、肠道微生物的毒性代谢物和过敏等,可能会导致肝部炎症,造成不同程度的肝脏损伤和肝功能减退。目前肝炎的发病率持续上升,如果没有接受及时且适当的治疗,病情可能会加重,造成更严重的并发症。因此,肝炎及时且准确的检测能够为疾病的治疗提供处理时间和宝贵的机会,能够有效缓解病情,降低相关疾病的死亡率。目前,临床上对肝炎的检测主要依赖对丙氨酸氨基转移酶和天冬氨酸氨基转移酶在血清中含量的检测,是临床诊断的金标准。但是早期肝炎非常容易被漏诊,主要原因在于此阶段未出现明显症状,并且这两个血检指标仍处于正常范围。因此,一种能够实时原位地检测早期肝炎状况,并能够提供准确的病理学信息的检测手段对于准确诊断肝炎和深入了解肝炎相关生理病理过程具有重要意义。
活性氧(Reactiveoxygenspecies,ROS)是氧化应激的主要参与者,高水平的ROS通常与疾病相关。值得注意的是,
近红外荧光可以无创地观察体内生理病理指标和过程。其中,荧光探针因其高灵敏度、高选择性和高时空分辨率而被广泛应用于生物分子成像。近年来,人们更加重视开发对肝炎早期标志物具有高灵敏度和特异性的荧光探针,有望用于实时原位地检测肝炎。但是成像时同时存在较强的组织散射,大大限制了近红外荧光成像对深层组织病理学状况的准确检测能力。值得注意的是,光声成像结合了光学成像和超声成像的特性,能够对深层组织的病理学状况进行有效检测。因为荧光成像和光声成像的相似性,可以实现一个探针两种模态的成像手段。通过这种二合一的策略,荧光/光声双模态成像探针可同时拥有荧光成像的高灵敏度和光声成像的深组织穿透能力,在生物成像领域是一种富有前景的成像方式。
另外,活体成像探针的发展十分迅速,但仍有许多需要解决的问题,比如探针分子快速清除和不可控的体内行为导致的病灶部位信号强度弱、成像对比度低的问题。提高成像探针的剂量可以解决以上为题,但是会面临潜在的代谢压力。主动靶向策略是一种提高成像性能的常用策略。比如基于肝细胞表面丰富的半乳糖受体,半乳糖修饰可以明显提升成像探针在肝脏的积累能力。因此,在靶向基团方面又更多的选择可以促进肝靶向探针的设计,促进肝脏疾病的有效诊断。胆酸是胆汁酸的一种,在肝脏表面有多种受体,是一种探针设计的理想靶向基团。
为了克服活体内检测肝脏炎症准确度差的问题,实现对肝脏炎症病灶的的准确成像,迫切需要开发肝脏炎症早期标志物响应的,同时拥有肝靶向能力的荧光/光声双模态成像探针,实现肝脏原位
发明内容
本发明要解决的技术问题:提供一种针对
为了解决上述技术问题,采取的技术方案如下:
本发明提供一种针对
化合物hCy-Tf-CA
本发明提供一种针对
将hCy-NHBoc与三乙胺在无水二氯甲烷溶液中充分混合,在冰浴和氮气保护条件下滴加三氟甲基磺酸酐。在冰浴条件下反应完成后,加入冰水淬灭反应。收集有机相溶液,并经硅胶柱层析法纯化得到紫色固体,即探针前体hCy-Tf-NHBoc。随后将中间体hCy-Tf-NHBoc溶于无水二氯甲烷中,将体积为二氯甲烷三分之一的三氟乙酸加入进去。反应完成后,减压蒸馏除掉反应溶剂,随后固体产物用乙醚清洗获得粗产物hCy-Tf-NH
其中,
本发明的另一目的在于提供一种NIR荧光探针对细胞中
相较于现有技术,本发明的有益效果在于:
本发明提供的
本发明的探针分子hCy-Tf-CA,具有高选择性和高灵敏度特性,探针hCy-Tf-CA对细胞内含量较高的金属离子、氧化物、还原性分子、酶分子及其它分子显示出良好的抗干扰能力,仅对
本发明的探针分子hCy-Tf-CA,显示出很好的生物相容性,并提供了细胞内在不同药物刺激的条件下
最终,本发明通过荧光/光声双模态成像的手段以非侵入性方式为活体内实时监控肝脏
附图说明
图1为实施例1中制得的
图2为实施例1中制得的探针hCy-Tf-CA(10μM)在乙醇-磷酸盐缓冲溶液(乙醇/PBS=1/1,v/v,pH=7.4)中对
图3为实施例1中制得的探针hCy-Tf-CA(10μM)在乙醇-磷酸盐缓冲溶液(乙醇/PBS=1/1,v/v,pH=7.4)中对
图4为实施例1中制得的探针hCy-Tf-CA(10μM)与不同浓度(0-200μM)的
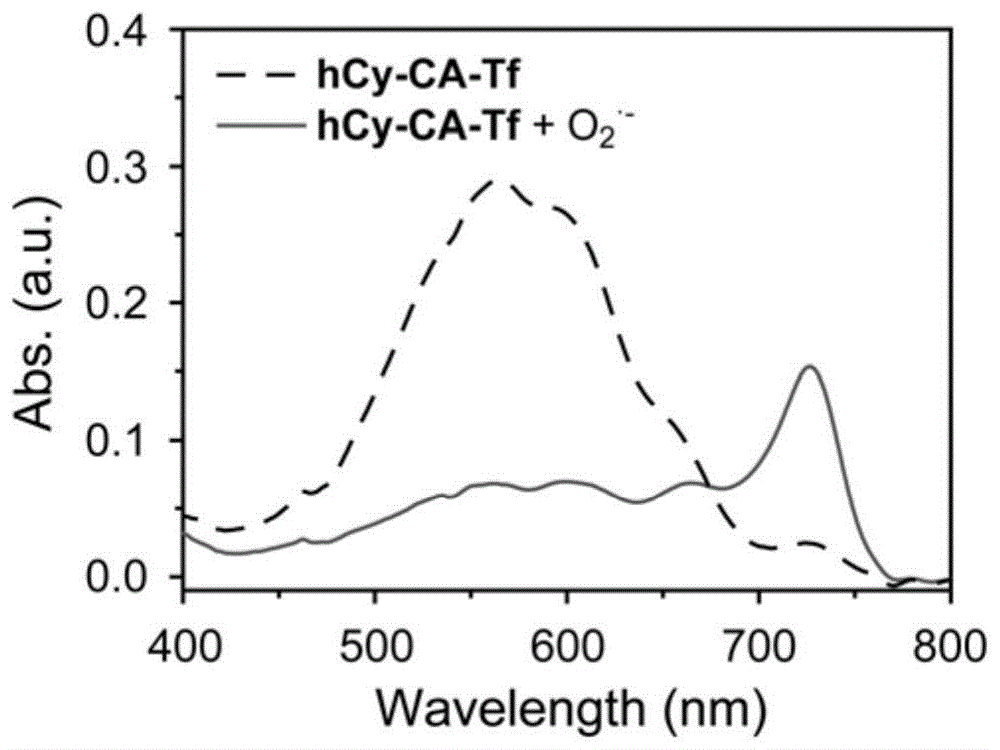
图5为实施例1中制得的探针hCy-Tf-CA(10μM)与浓度为0-100μM的
图6为实施例1中制得的探针hCy-Tf-CA(10μM)与不同浓度(0-100μM)的
图7为实施例1中制得的探针hCy-Tf-CA(10μM)对潜在的干扰性分子抗干扰性检测的荧光响应图。
图8为实施例1中制得的不同浓度的探针hCy-Tf-CA在24小时内对HepG2细胞的毒性分析。
图9为实施例1中制得的探针hCy-Tf-CA在HepG2细胞中的荧光成像图。
图10为实施例1中制得的探针hCy-Tf-CA在药物诱导的肝脏炎症小鼠模型中的荧光成像图。
图11为实施例1中制得的探针hCy-Tf-CA在药物诱导的肝脏炎症小鼠模型中的离体器官成像图。
图12为实施例1中制得的探针hCy-Tf-CA在药物诱导的肝脏炎症小鼠模型中的光声成像图。
图13为实施例1中制得的探针hCy-Tf-CA在自身免疫性肝炎小鼠模型中的荧光成像图。
图14为实施例1中制得的探针hCy-Tf-CA在自身免疫性肝炎小鼠模型中的离体器官成像图。
图15为实施例1中制得的探针hCy-Tf-CA在自身免疫性肝炎小鼠模型中的光声成像图。
图16为实施例1中制得的中间体hCy-Tf-NHBoc的核磁共振
图17为实施例1中制得的中间体hCy-Tf-NHBoc的核磁共振
图18为实施例1中制得的荧光/光声双模态成像探针hCy-Tf-CA的核磁共振
图19为实施例1中制得的荧光/光声双模态成像探针hCy-Tf-CA的核磁共振
具体实施方式
下面结合具体实施例对本发明做进一步的详细说明。
将半花菁染料hCy-NHBoc与三乙胺在无水二氯甲烷溶液中充分混合,在冰浴和氮气保护条件下滴加三氟甲基磺酸酐;在冰浴条件下反应5分钟后,加入冰水淬灭反应;收集有机相溶液,并经硅胶柱层析法纯化得到紫色固体,即探针前体hCy-Tf-NHBoc;随后将中间体hCy-Tf-NHBoc溶于无水二氯甲烷中,将体积为二氯甲烷三分之一的三氟乙酸加入进去;反应5分钟后,减压蒸馏除掉反应溶剂,随后固体产物用乙醚清洗;粗产物hCy-Tf-NH
hCy-NHBoc、三氟甲基磺酸酐和三乙胺的摩尔比为1:1.2:1.2;
第一次硅胶柱层析法纯化中甲醇和二氯甲烷体积比为1:50;
hCy-Tf-NHBoc和三氟乙酸的摩尔比为1:536;
hCy-Tf-NH
第二次硅胶柱层析法纯化中甲醇和二氯甲烷体积比为1:10。
实施例1中制得中间体hCy-Tf-NHBoc和探针hCy-Tf-CA的氢谱(
实施例2
探针hCy-Tf-CA与
在相同实验条件下,向1mL乙醇-磷酸盐缓冲溶液(乙醇/PBS=1/1,v/v,pH=7.4)的中加入10μL探针分子母液(1mM),随后加入
实施例3
探针hCy-Tf-CA与
在相同实验条件下,向1mL乙醇-磷酸盐缓冲溶液(乙醇/PBS=1/1,v/v,pH=7.4)的中加入10μL探针分子母液(1mM),随后加入
实施例4
探针hCy-Tf-CA与
在相同实验条件下,向1mL乙醇-磷酸盐缓冲溶液(乙醇/PBS=1/1,v/v,pH=7.4)的中加入10μL探针分子母液(1mM),随后加入
实施例5
探针hCy-Tf-CA与不同浓度
在相同实验条件下,向1mL乙醇-磷酸盐缓冲溶液(乙醇/PBS=1/1,v/v,pH=7.4)的中加入10μL探针分子母液(1mM),随后进行
实施例6
探针hCy-Tf-CA与不同浓度
在相同实验条件下,向1mL乙醇-磷酸盐缓冲溶液(乙醇/PBS=1/1,v/v,pH=7.4)的中加入10μL探针分子母液(1mM),随后进行
实施例7
探针hCy-Tf-CA对
在相同实验条件下,向1mL乙醇-磷酸盐缓冲溶液(乙醇/PBS=1/1,v/v,pH=7.4)的中加入10μL探针分子母液(1mM),随后滴加各种细胞内潜在干扰物(Na
综上所述,本发明制得的荧光/光声双模态探针hCy-Tf-CA在体外具有高灵敏的
实施例8
探针hCy-Tf-CA的生物相容性测试
实施例8依据实施例1制得的荧光/光声双模态成像探针hCy-Tf-CA对HepG2细胞进行CCK-8毒性测试。将HepG2细胞接种于96孔板上,密度为每孔6×10
细胞存活率计算:细胞存活率(%)=[A(实验组)-A(空白组)]/[A(对照组)-A(空白组)]×100%。
参见图8,图8为细胞存活率结果。不同浓度的hCy-Tf-CA与HepG2细胞共同孵育后,发现即使hCy-Tf-CA浓度高达10μM,hCy-Tf-CA对细胞的毒性仍然较小,测得的细胞存活率可以达到90%以上,这说明合成的hCy-Tf-CA具有良好的生物相容性,可以在细胞水平上验证探针hCy-Tf-CA的成像能力。
实施例9
HepG2细胞中
将HepG2细胞铺板至激光共聚焦皿中并培养过夜以达到80%的密度。细胞成像分为五组。在第一组中,探针hCy-Tf-CA(10μM)与HepG2细胞孵育30分钟。在第二组中,HepG2细胞先用脂多糖(lipopolysaccharide,LPS,1μg/mL)和干扰素-伽马(interferon-gamma,INF-γ,50ng/mL)孵育12小时,PBS清洗两遍后再与探针hCy-Tf-CA(10μM)孵育30分钟。在第三组中,HepG2细胞先用LPS、INF-γ和2,2,6,6-四甲基哌啶氧化物(2,2,6,6-tetramethylpiperidine-N-oxyl,TEMPO,300μM)共同孵育12小时,PBS清洗两遍后再与探针hCy-Tf-CA(10μM)孵育30分钟。第四组和第五组分别用H
参见图10,HepG2细胞与hCy-Tf-CA共孵育后,由于HepG2细胞内源性
实施例11
荧光/光声双模态成像探针hCy-Tf-CA对药物诱导的肝脏炎症的精确检测
为了荧光/光声双模态成像检测肝脏
参见图10,通过在注射探针hCy-Tf-CA不同时间(0、30、60、90、120分钟)点后进行成像观察。在注射探针hCy-Tf-CA之后,小鼠腹部的荧光信号随着时间不断增强。注射1小时后,APAP处理的小鼠腹部的近红外荧光信号明显高于对照组,证明探针分子通过静脉进入肝脏,并被肝脏内病理水平的
实施例12
荧光/光声双模态成像探针hCy-Tf-CA对自身免疫性肝炎的精确检测
为了实现荧光/光声双模态成像手段对自身免疫性肝炎进行可视化检测,将Balb/c雌性小鼠随机分为两组:一组小鼠静脉注射刀豆蛋白A(Concanavalin A,Con A,20mg/Kg)致自身免疫性肝炎,另一组小鼠同时进行PBS处理作为对照组,2小时后分别静脉给药hCy-Tf-CA(50μM,100μL)后进行荧光/光声双模态成像。使用IVIS小动物活体成像系统(PerkinElmer,λ
参见图13,在注射探针后,不同给药组小鼠的代表性近红外荧光图像在预定的时间点被记录下来,健康小鼠腹部近红外荧光信号微弱,而Con A给药组小鼠肝脏区可观察到明显的近红外荧光信号,并随着时间的推移逐渐增强。参见图14,两组小鼠的近红外荧光信号主要位于肝脏,并且Con A给药组小鼠的信号明显强于对照组。参见图15,小鼠光声成像图像的肝区横切面光声信号表现出类似的趋势。Con A处理小鼠肝脏PA信号随着时间迅速增加,在成像2h时的光声信号明显强于对照组小鼠,这说明了探针hCy-Tf-CA能够通过荧光与光声成像信号的差异来检测自身免疫性肝炎。
上述仅为本发明的优选具体实施方式,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但本发明的设计构思并不局限于此,凡利用此构思对本发明进行非实质性的改动,均应属于侵犯本发明保护范围的行为。
