一种电催化乙二醇制备乙醇酸盐的方法
文献发布时间:2024-05-24 17:48:49
技术领域
本发明涉及一种电催化乙二醇制备乙醇酸盐的方法。
背景技术
由于环境和经济优势,通过机械和化学途径回收聚对苯二甲酸乙二醇酯已引起越来越多的关注。回收聚对苯二甲酸乙二醇酯可以生产乙二醇。与广泛采用的热催化途径相比,基于可再生能源的电化学氧化已成为一种有吸引力且可持续的方法,可将乙二醇升级为乙醇酸(GA)、甲酸和草酸等增值化学品。在典型的电催化过程中,乙二醇在碱性介质中进行电化学氧化,生成乙醇酸(碱性介质中实际上成盐)。现有技术中,各类电催化化学反应,基本都是采用恒电位(CP)或恒电流方案,即控制电催化反应时,反应体系所施加的电位为恒定值或者电流为恒定值,普遍认为恒电位或恒电流时,电催化效率最好,电催化最稳定。
在电催化乙二醇制备乙醇酸盐时,反应体系需要采用催化剂。通常采用贵金属催化剂,例如钯、铂和金等,它们具有中等的C-C键断裂能力,在乙二醇至乙醇酸盐转化反应中通常具有高选择性。
然而,现有技术中采用乙二醇电催化制备乙醇酸盐时,贵金属催化剂的活性通常会经历快速衰减,体现为恒电位测量期间电流密度迅速下降(例如,电流密度在一小时内下降到初始值的一半)。这对这些催化剂在乙二醇氧化反应中(EGOR)的应用,特别是在长期测试中提出了重大挑战。
为了缓解当前贵金属催化剂在长期乙二醇氧化反应过程中的衰减,现有技术在催化剂形貌、组成和协同效应方面进行了大量的研发,但是会导致催化剂结构过于复杂,制备工艺繁琐成本高昂,且对于催化剂活性衰减的改进效果有限。
发明内容
针对现有技术的缺点和不足,本发明提供了一种全新的电催化乙二醇制备乙醇酸盐的方法,该方法仅需要采用普通常规的催化剂,就能高效(高转化速率)、高选择性、高稳定性的电催化乙二醇转化为乙醇酸盐,且保证催化剂活性在长期催化反应中基本不失活。
为达到上述目的,本发明采用的技术方案如下:
一种电催化乙二醇制备乙醇酸盐的方法,以含有乙二醇的碱性电解液为原料,在电解体系中催化剂的存在下进行氧化反应,得到乙醇酸盐,所述方法控制对所述电解体系施加变化的电压,所述变化的电压包括多个周期,每个周期包括逐渐增大的电压和逐渐减小的电压。
在一些实施方式中,所述催化剂的活性组分为贵金属,所述逐渐减小的电压减小至所述贵金属的氧化/还原电位之下。
现有技术中,各类电催化化学反应,基本都是采用恒电位(CP)或恒电流方案,即控制电催化反应时,反应体系的电位为恒定值或者电流为恒定值,普遍认为恒电位或恒电流时,电催化效率最好,电催化最稳定。在采用乙二醇电催化制备乙醇酸盐时,现有技术也是如此,均是采用恒电位(CP)或恒电流方案。但是,贵金属催化剂的活性通常会经历快速衰减,贵金属被氧化为金属氧化物,进而降低其活性,甚至导致其失活。现有技术对于该问题的解决存在技术上的惯性思维,即惯性地从改进催化剂本身进行考虑和研发。
而本申请的发明人跳出前述惯性思维,通过研究发现,不从催化剂本身例如结构等方面进行改进,而从电位施加方式上做出大胆地创新,发现采用电位循环的电位施加方式,可以有效地消除乙二醇转化反应过程中催化剂金属表面形成的氧化物,可以使得金属氧化物还原为相应的金属,进而恢复催化剂活性组分,避免了催化剂的失活,使得可以在采用普通催化剂的情况下,仍然能够实现高效(高转化速率)、高选择性、高稳定性地反应。采用本发明的基于电位循环策略,可以使得普通贵金属催化剂对乙二醇的转化速率,相对于传统的恒电位法提升一个数量级,以95%以上的法拉第效率(FE)得到乙醇酸盐,且循环稳定性优异。
在一些实施方式中,每个周期包括从最低电位增加至最高电位,再从最高电位降低至最低电位。
在一些实施方式中,所述最低电位为-0.9~-0.3V;所述最高电位为0~+2.0V。本发明的上述最低电位和最高电位是相对于Ag/AgCl参比电极进行测试的结果。
在一些实施方式中,所述方法采用三角波线性扫描的方式对电解体系施加电压,所述线性扫描的速率为0.1~20.0V/s。本发明中,前述三角波线性扫描的方式指电压随时间的变化曲线为三角波形,且为线性变化。即电压先随着时间线性增大,增大至最高电位后,又随着时间线性减小,减小至最低电位,然后重复循环。
在一些实施方式中,所述线性扫描的速率为0.1~5.0V/s。
在一些实施方式中,所述催化剂为负载型催化剂,且包括载体和活性组分,所述载体选自碳、金属泡沫或金属箔;所述活性组分选自钯、铂和金中的一种或多种的组合。
在一些实施方式中,所述碳为导电碳;所述金属泡沫为镍泡沫;所述金属箔为钛箔。在一些实施方式中,以质量百分比计,所述催化剂包括50%~99.9%的载体和0.1%~50%的活性组分。
在一些实施方式中,以质量百分比计,所述催化剂包括97.0%~99.9%的载体和0.1%~3%的活性组分;每个周期包括从最低电位增加至最高电位,再从最高电位降低至最低电位;所述最低电位为-0.9~-0.3V;所述最高电位为0~+0.4V。
在一些实施方式中,以质量百分比计,所述催化剂包括87.4%~94.1%的载体和5.9%~12.6%的活性组分;每个周期包括从最低电位增加至最高电位,再从最高电位降低至最低电位;所述最低电位为-0.9~-0.3V;所述最高电位为0.2~+0.6V。
在一些实施方式中,以质量百分比计,所述催化剂包括50%~87%的载体和13%~50%的活性组分;每个周期包括从最低电位增加至最高电位,再从最高电位降低至最低电位;所述最低电位为-0.9~-0.3V;所述最高电位为+0.2~+2.0V。
在一些实施方式中,所述碱性电解液中乙二醇的质量百分比为0.1%~30%。本发明对于乙二醇的浓度没有过多的限制,本发明的方法可以实现对各种乙二醇浓度的良好转化。
在一些实施方式中,所述碱性电解液中含有摩尔浓度为1~10M的碱。
在一些实施方式中,所述碱选自氢氧化钠、氢氧化钾。
在一些实施方式中,所述电解体系包括阳极、阴极,所述催化剂位于阴极中。即电解体系可以采用双电极体系。乙二醇的转化反应发生在阴极上。
在一些实施方式中,所述电解体系包括工作电极、对电极和参比电极,所述催化剂位于工作电极中。即电解体系可以采用三电极体系,乙二醇的转化反应发生在工作电极上。
在一些实施方式中,参比电极可为银/氯化银(Ag/AgCl),甘汞电极(Hg/Hg
与现有技术相比,本发明具有如下优势:
本发明提出了一种创新的电位循环控制方法来增强普通贵金属催化剂(例如Pd、Au、Pt等)对乙二醇电化学转化为乙醇酸的催化活性。与传统的恒电位方法相比,我们的电位循环策略表明乙二醇转化速率被显著提高,无需复杂的催化剂设计即可保持较高的乙醇酸盐选择性(95%以上),同时催化稳定性显著提高。电位循环条件下的反应性增强是由于贵金属催化剂表面氧化物的抑制:在正向扫描中(电压增大过程),贵金属催化剂氧化乙二醇,在催化剂表面同时形成一层金属氧化物导致其失活;但在反向扫描(电压减小过程)中,金属氧化物层被还原,从而在下一个周期中为乙二醇氧化反应再生了金属催化剂表面。与恒电位下的乙二醇氧化反应相比,电位循环下的乙二醇氧化反应仅需更低用量的普通的贵金属催化剂即可实现相同的转化率。与恒电位乙二醇氧化反应中观察到的电催化活性快速衰减不同,电位循环对催化剂表面状态的动态控制使催化剂能够长期保持良好的稳定性。
本发明的方法不局限于单一金属催化剂,也能够适用于多种能够催化转化乙二醇的活性金属催化剂,并且可以通过调控电位范围和扫描速率,进一步提高乙二醇的转化速率。
附图说明
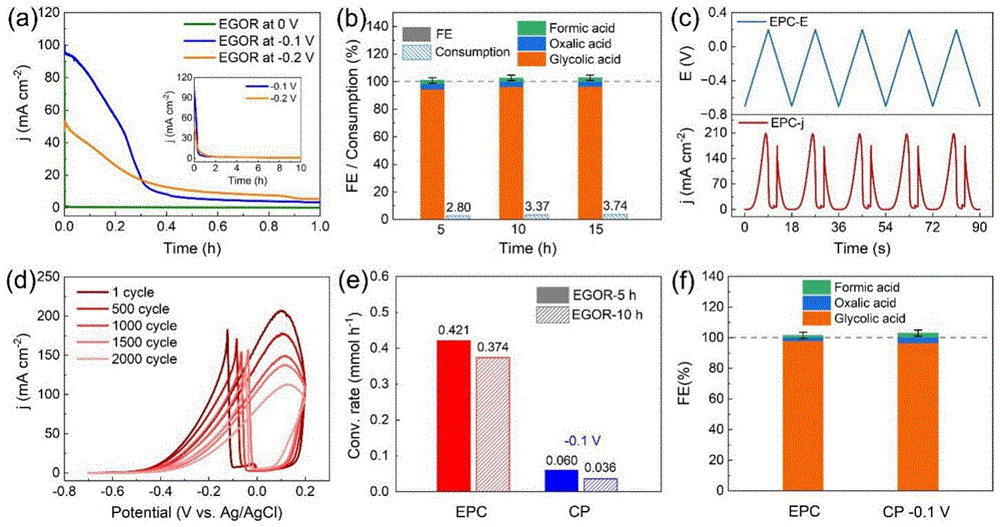
图1为实施例1和对比例1电催化氧化乙二醇生产乙醇酸盐的结果对比图,其中,(a)各个CP-EGOR(恒电位-乙二醇氧化反应)下Pd/NF-1的电流密度,插图中显示的相应长时间运行。(b)将Pd/NF-1保持在-0.1V不同时间段后测量的FE和EG消耗量。(c)EPC-EGOR(电位循环法-乙二醇氧化反应)实验中随时间变化的代表性电位和电流数据。每个周期由-0.7V至+0.2V的正扫描和+0.2V至-0.7V的负扫描组成,扫描速率为0.1V/s。(d)EPC-EGOR不同周期的CV(电势)。(e)EGOR在EPC和最佳CP下的转化率(电位为-0.1V)。(f)从EPC和CP获得的不同产品的相应FE;
图2为实施例2电催化氧化乙二醇生产乙醇酸盐的循环稳定性实验结果图,其中,来自六次EPC-EGOR测试的(a)不同EPC周期后的CV(0.1V/s),(b)转化率,(c)相应的FE和(d)EG消耗量。反应条件:1M KOH中含0.3M EG;
图3为实施例2-6、对比例2-6电催化氧化乙二醇生产乙醇酸盐的实验结果对比图,其中,(a-c)Pd/NF-2、(d-f)Pd/NF-4、(g-i)Pd/NF-7、(j-l)Pd/NF-8.5和(m-o)Pd/NF-10分别使用EPC和CP的EGOR性能(电位范围:-0.7~+0.2V,扫描速率:0.1V/s)。(a)(d)(g)(j)(m)不同CP下Pd/NF的电流密度。(b)(e)(h)(k)(n)EPC和CP的EGOR转化速率。(c)(f)(i)(l)(o)从EPC和CP(最佳电位)获得的各种产品的法拉第效率。反应条件:0.3M EG溶于1M KOH,运行时间为5小时;
图4为实施例7-9电催化氧化乙二醇生产乙醇酸盐中调控电位范围的实验结果,其中,(a-c)Pd/NF-7、(d-f)Pd/NF-8.5和(g-i)Pd/NF-10在EPC不同电位范围内的EGOR性能(扫描速率:0.1V/s)。(a)(d)(g)具有不同正极限电位的Pd/NF的CV(0.1V/s)。(b)(e)(h)EPC和CP得到的EFOR转化速率。(c)(f)(i)从EPC获得的各种产品的法拉第效率。反应条件:0.3MEG溶于1M KOH,运行时间为5小时;
图5为实施例1-10和对比例1-6电催化氧化乙二醇生产乙醇酸盐中催化剂载量和扫描速率调控的实验结果,其中,(a)在不同的Pd负载质量下,最佳EPC和最佳CP电位氧化乙二醇的转化速率。(b)不同扫描速率下Pd/NF-2的CV。(c)不同扫描速率下EPC(电位范围:-0.7~+0.2V)的EGOR转换速率,并与CP(在-0.2V下运行)进行比较。(d)由(c)得到的各种产物相应的法拉第效率。反应条件:0.3M EG在1M KOH中,运行时间为5小时;
图6为实施例11-12、对比例7-8使用EPC和CP电催化氧化乙二醇生产乙醇酸盐的实验结果,其中,(a-c)和(d-f)分别为Pt/NF-1和Au/Ti的EGOR性能。(a)(d)不同EPC周期后的CV。(b)(e)EPC和CP的EGOR转化速率。(c)(f)从EPC和CP获得的各种产品的法拉第效率。反应条件:1M KOH包含0.3M EG,运行时间相同(5小时);
图7为对比例7-8电催化氧化乙二醇生产乙醇酸盐的实验结果,其中,(a-c)Pt/NF-1和(d-f)Au/Ti在CP模式下的EGOR性能。(a)Pt/NF-1和(d)Au/Ti在1M KOH和0.3M EG中的CV。(b)(e)电流密度-时间曲线和(c)(f)固定在不同CP的相应EG消耗。
图8为实施例13、对比例9电催化氧化乙二醇生产乙醇酸盐的实验结果,其中,(a)Pd/C i在CP模式下的EGOR性能。(b)Pd/C在不同EPC周期后的CV。(c)EPC和CP的EGOR转化速率。反应条件:0.3M EG在1M KOH中,运行时间为5小时。
具体实施方式
实施例1
本实施例提供了钯/泡沫镍(Pd/NF)在电位循环方法下对乙二醇的电催化转化,其实施方案如下:
1、Pd/NF-1的制备
在20mL小瓶中,将一块泡沫镍NF(10*20*1.7mm)放入10mL的1mM H
2、基于Pd/NF-1以电位循环法对乙二醇进行催化转化
电化学测试在标准三电极系统中进行。铂网作为对电极,Ag/AgCl(饱和KCl)电极作为参比电极。预先制备的Pd/NF-1(1*2cm
电化学测试在以N
3、基于电位循环策略的EGOR(乙二醇氧化反应)产物分析
在碱性条件下获得的产物都以盐的形式存在,但为了简单和比较,它们在这项工作的所有图中都被标记为酸。首先通过测量不同浓度的标准溶液获得校准曲线。根据校准曲线计算产物的定量。采用以下方程计算了乙二醇的转化率和EGOR的法拉第效率(FE):
其中n是每种产物的电子转移数,n=3表示甲酸,n=4表示乙醇酸,n=8表示草酸,96485C mol
通过计算得到,Pd/NF-1在电位范围为-0.7~+0.2V和0.1V/s扫描速率的电位循环法下,乙二醇以>95%的FE高选择性得到了乙醇酸(图1f),并且EGOR的转化速率在5小时后为0.421mmol/h,即使运行10小时,转化速率依然可达到0.374mmol/h,相比于对比例1在恒电位法下的EOGR,电位循环法将乙二醇的转化速率在10小时的运行时间下提升了10倍(图1-e)。
实施例2-6
实施例2-6提供不同Pd载量的Pd/NF在电位循环法下的EGOR,其制备过程、电位循环法实施过程和产物分析方法基本同实施例1,区别仅在于:通过制备过程中所使用的H
表1不同金属载量的Pd/NF电极
增加催化剂活性位点是提高恒电位EGOR催化速率和稳定性的常用方法。我们比较了电位循环和恒电位模式在不同Pd负载质量上的EGOR性能。不同Pd负载质量的Pd/NF催化剂可以通过改变Pd沉积过程中H
2、电位循环策略下EGOR的长期循环稳定性评价
以实施例2中Pd/NF-2作为工作电极,在含有0.3M EG的1M KOH电解液中,以-0.7V为电位下限,+0.2V为电位上限,以0.1V/s的恒定扫描速率在两个电位之间持续进行循环(图2-a),电位循环的运行时间由循环数乘以每个循环的时间得出。每一次EGOR测试运行10小时,然后将电解液更新为含0.3M EG的1M KOH电解液,重复此过程共获得六次EGOR测试结果(图2)。产物分析结果显示,在六次EGOR平行测试中,电位循环法所展现出的转化速率、乙醇酸的选择性和对底物的消耗量是非常稳定的,表明电位循环策略用于EGOR的出色稳定性。
实施例7-9
实施例7-9提供了实施例4-6的Pd/NF电极在电位循环法中电位范围对EGOR转化速率的影响,其制备过程、电位循环实施过程和产物分析方法基本同实施例1,区别在于:各个Pd/NF在电位循环法转化乙二醇中对比施加了不同的电位范围,详细对比如下表2所示。
表2各Pd/NF在电位循环法中所施加电位范围
在电位循环法中,电位范围需要根据催化剂载量的不同进行调整。例如,当电位范围的上限从+0.2V扩大到+0.8V时,Pd/NF-10的EG转化速率可以加倍(图4h)。这种显著的转化速率提升可以通过相应的CV曲线来理解。如图4g所示,提高EPC(循环电位变化)的电势上限允许Pd/NF-10产生更多的EGOR电流(直到观察到峰值电流密度),从而导致更高的EG转化速率。但当催化剂活性组分负载量较低时,电流衰减(或催化剂失活)在较低的正电位下就会开启,提高电位上限并不能显著提高反应的转化速率。当催化剂活性组分负载量较高时,提高电位上限可以显著提高反应的转化速率。
实施例10
实施例10提供了Pd/NF-2在电位循环法中扫描速率对EGOR转化速率的影响。其制备过程、电位循环实施过程和产物分析方法基本同实施例1,区别在于:Pd/NF-2在电位循环法转化乙二醇中对比施加了不同的扫描速率。
电位循环的速度(即扫描速率)对于优化EGOR性能至关重要。如图5c所示,扫描速率高于0.1V/s的EPC(电位循环变化)表现出较更高的转换速率,并且在扫描速率为1.5V/s时实现了最大转换率。在5小时的测试中,电位循环相对于恒电位的EG转化速率的增强倍数从0.1V/s时的3.4倍增加到1.5V/s时的5.1倍(图5c)。这种影响的原因如下:(1)在低扫描速率下,催化剂在每个循环中氧化EG的时间(t
实施例11
本实施例提供了铂/泡沫镍(Pt/NF)在电位循环方法下对乙二醇的电催化转化,其方案如下:
1、Pt/NF-1的制备
在20mL小瓶中,将一块NF(10*20*1.7mm)放入10mL的1mM H
2、基于Pt/NF-1以电位循环法对乙二醇进行催化转化
电化学测试在标准三电极系统中进行。铂网作为对电极,Ag/AgCl(饱和KCl)电极作为参比电极。预先制备的Pt/NF-1(1*2cm
电化学测试在以N
产物分析方法与实施例1完全相同。通过计算得到,Pt/NF-1在电位范围为-0.7~+0.2V和0.1V/s扫描速率的电位循环法下,乙二醇以>90%的选择性得到乙醇酸盐(图6c),并且EGOR的转化速率在5小时后为0.384mmol/h,相比于对比例7在恒电位法下的EOGR,电位循环法将乙二醇的转化速率显著提高了4.2倍(图6b)。
实施例12
本实施例提供了金/钛(Au/Ti)在电位循环方法下对乙二醇的电催化转化,其方案如下:
1、Au/Ti的制备
Au/Ti的制备采用离子溅射法,在100V和15mA下,通过在Ti箔(10*20*0.1mm)上连续溅射Au获得5min的Au/Ti,其中,Au的质量百分比为0.1%。
2、基于Au/Ti以电位循环法对乙二醇进行催化转化
电化学测试在标准三电极系统中进行。铂网作为对电极,Ag/AgCl(饱和KCl)电极作为参比电极。预先制备的Au/Ti(1*2cm
电化学测试在以N
产物分析方法与实施例1完全相同。通过计算得到,Au/Ti在电位范围为-0.5~+0.4V和0.1V/s扫描速率的电位循环法下,乙二醇以>90%的选择性得到乙醇酸盐(图6f),并且EGOR的转化速率在5小时后为0.103mmol/h,相比于对比例8在恒电位法下的EOGR,电位循环法将乙二醇的转化速率显著提高了5.7倍(图6e)。
实施例11-12说明了电位循环策略用于乙二醇转化时,对所使用的催化剂具有普适性。
实施例13
本实施例提供一种电催化剂,其为普通商业化的Pd/C催化剂(商购于麦克林公司),以质量百分比计,碳载体为95%,活性组分为5%。将其用于电位循环方法下对乙二醇的电催化转化。电位循环实施过程和产物分析方法基本同实施例1。结果如图8所示,可见,实施例13采用普通的催化剂也能成功地转化乙二醇为乙醇酸盐。
对比例1
本实施例提供了钯/泡沫镍(Pd/NF)在恒电位方法(CP)下对乙二醇的电催化转化,其方案如下:
1、Pd/NF-1的制备
在20mL小瓶中,将一块NF(10*20*1.7mm)放入10mL的1mM H
2、基于Pd/NF-1以恒电位法对乙二醇进行催化转化
电化学测试在标准三电极系统中进行。铂网作为对电极,Ag/AgCl(饱和KCl)电极作为参比电极。预先制备的Pd/NF-1(1*2cm
电化学测试在以N
3、基于恒电位法的EGOR产物分析
在碱性条件下获得的产物都以盐的形式存在,但为了简单和比较,它们在这项工作的所有图中都被标记为酸。首先通过测量不同浓度的标准溶液获得校准曲线。根据校准曲线计算产物的定量。采用以下方程计算了乙二醇的转化率和EGOR的法拉第效率(FE):
其中n是每种产物的电子转移数,n=3表示甲酸,n=4表示乙醇酸,n=8表示草酸,96485C mol
通过对比各个恒电位下对EGOR的转化结果得到,Pd/NF-1在-0.1V的恒电位下显示出相对更高的EGOR转化速率,虽然恒电位下对乙二醇能够以>90%的FE高选择性得到乙醇酸盐(图1f),但是前一个5小时的EGOR转化速率仅为0.060mmol/h,再次运行五小时后,转化速率显著减半,结合时间-电流曲线(图1a)表明恒电位下催化剂显著失活,即使在长达15小时的EGOR测试后,恒电位法对EG的消耗量低于4%(图1b),显著低于电位循环法下EGOR的转化速率。
对比例2-6
对比例2-6提供不同Pd载量的Pd/NF在恒电位法下的EGOR,其制备过程、恒电位法实施过程和产物分析方法基本同对比例1,区别仅在于:通过制备过程中所使用的H
电化学测试在以N
对比例7
本对比例提供了铂/泡沫镍(Pt/NF)在恒电位方法下对乙二醇的电催化转化,其方案如下:
1、Pt/NF-1的制备
在20mL小瓶中,将一块NF(10*20*1.7mm)放入10mL的1mM H
2、基于Pt/NF-1以恒电位法对乙二醇进行催化转化
电化学测试在标准三电极系统中进行。铂网作为对电极,Ag/AgCl(饱和KCl)电极作为参比电极。预先制备的Pt/NF-1(1*2cm
电化学测试在以N
3、基于恒电位法的EGOR产物分析
在碱性条件下获得的产物都以盐的形式存在,但为了简单和比较,它们在这项工作的所有图中都被标记为酸。首先通过测量不同浓度的标准溶液获得校准曲线。根据校准曲线计算产物的定量。采用以下方程计算了乙二醇的转化率和EGOR的法拉第效率(FE):
其中n是每种产物的电子转移数,n=3表示甲酸,n=4表示乙醇酸,n=8表示草酸,96485C mol
通过对比各个恒电位下Pt/NF-1对EGOR的转化结果得到,Pt/NF-1在-0.2V的恒电位下显示出相对更高的EGOR转化速率(图7c),但时间-电流曲线(图7b)显示恒电位下催化剂会快速失活,导致5小时后对EG的消耗量仅为4.3%。
对比例8
本对比例提供了金/钛(Au/Ti)在恒电位方法下对乙二醇的电催化转化,其方案如下:
1、Au/Ti的制备
Au/Ti的制备采用离子溅射法,在100V和15mA下,通过在Ti箔(10*20*0.1mm)上连续溅射Au获得5min的Au/Ti,其中,Au的质量百分比为0.1%。
2、基于Au/Ti以恒电位法对乙二醇进行催化转化
电化学测试在标准三电极系统中进行。铂网作为对电极,Ag/AgCl(饱和KCl)电极作为参比电极。预先制备的Au/Ti(1*2cm
电化学测试在以N
3、基于恒电位法的EGOR产物分析
在碱性条件下获得的产物都以盐的形式存在,但为了简单和比较,它们在这项工作的所有图中都被标记为酸。首先通过测量不同浓度的标准溶液获得校准曲线。根据校准曲线计算产物的定量。采用以下方程计算了乙二醇的转化率和EGOR的法拉第效率(FE):
其中n是每种产物的电子转移数,n=3表示甲酸,n=4表示乙醇酸,n=8表示草酸,96485C mol
通过对比各个恒电位下Au/Ti对EGOR的转化结果得到,Au/Ti在+0.1V的恒电位下显示出相对更高的EGOR转化速率(图7f),但时间-电流曲线(图7e)显示恒电位下催化剂会快速失活,导致5小时后对EG的消耗量仅为0.84%。
对比例9
本对比例提供一种电催化剂,其为普通商业化的Pd/C催化剂(商购于麦克林公司),以质量百分比计,碳载体为95%,活性组分为5%。将其用于恒方法(电位:-0.1V)下对乙二醇的电催化转化。恒电位法实施过程和产物分析方法基本同对比例1。结果如图8所示,可见,对比例9采用普通的催化剂不能成功转化乙二醇,乙二醇氧化产物的含量低于检测下限。
可见,采用本发明的循环电位变化的电位控制方法,来电催化乙二醇转化为乙酸酸盐,可以显著提高转化反应的转化速率,转化稳定性,同时保证高转化率,且该方法可以适用于普通催化剂,对催化剂结构要求不高。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
- 一种钛酸盐担载贵金属基析氧电催化剂及其制备方法
- 一种电催化甲醛制乙二醇的方法
- 一种电催化乙二醇制备乙醇酸的阳极催化剂、体系及电催化乙二醇制备乙醇酸方法
- 一种电催化乙二醇或电催化重整废弃塑料PET制备乙醇酸盐的方法
