可降解促愈合医用粘合剂及其制备方法
文献发布时间:2024-01-17 01:20:32
技术领域
本发明属于医药技术领域,涉及一种可降解促愈合医用粘合剂及其制备方法。
背景技术
人在受伤较为严重时,需要对皮肤和其他损坏的组织进行密封以防止失血过多、异物侵入和伤口感染恶化导致伤势加重或死亡。目前,临床上切口闭合的常用方法是针线缝合与缝合钉的机械固定,这类方法需要经历麻醉操作,而多次拆线换药不仅给病人带来身体不适还容易造成伤口二次感染,愈合后留下的伤疤造成不美观,对软组织缝合时更是可能会造成组织损坏甚至干扰组织功能复原。随着外科技术的发展,人们不断寻求能够最大限度减轻患者痛楚,缩短康复时间,同时能够使受损区域完美复原的医疗手段。因此,生物黏附材料的应用得到了发展。
近年来,组织粘合材料发展迅速,主要有纤维蛋白、氰基丙烯酸酯类、聚氨酯类和聚乙二醇类等,但这些粘合材料仍存在各种各样的缺陷,如:纤维蛋白胶中的凝血酶是从生物体内提取得到的,有病毒传播的风险,需要对纤维蛋白胶进行病毒灭活处理,生产成本高,且纤维蛋白胶在潮湿生理环境中粘合强度较差、本体机械强度不足;氰基丙烯酸酯胶类组织粘合剂的粘合强度高,但氰基丙烯酸酯组织粘合剂的降解产物有较高的细胞毒性,且氰基丙烯酸酯组织粘合剂在使用时由于迅速聚合会放出一定的热量,而固化的氰基丙烯酸酯材料还有一定的脆性,这不利于在软组织上的使用;聚乙二醇基粘合剂在水环境中溶胀体积很大,导致其应用于组织密封或止血时会对组织周围的血管、神经形成挤压而对人体有一定的伤害等。此外,上述组合粘合材料还存在不易降解且促进损伤组织愈合性能较差的问题。因此,开发出一种可生物降解,降解产物无毒副作用并且具有促进损伤组织修复的医用粘合剂极为重要。
发明内容
本发明的目的在于提供一种可降解促愈合医用粘合剂,以解决上述技术问题中的至少一个。本发明提供的可降解促愈合医用粘合剂具备抗菌、组织粘合、组织损伤修复、组织填充和可生物降解等性能,可以通过缓慢释放具有促愈合的生长因子从而促进损伤组织的修复,并可以在机体内随着代谢而生物降解为无毒无害的小分子。
本发明的目的在于提供上述可降解促愈合医用粘合剂的制备方法,以解决上述技术问题中的至少一个。
根据本发明的一个方面,提供了一种可降解促愈合医用粘合剂,其包括独立包装的A组分和B组分,其中,
A组分的组分包括质量比为1:1~2:1的氧化海藻酸钠和负载生长因子的改性海藻酸盐微球;
B组分的组分,按质量百分比计,包括:羧甲基壳聚糖2.0~4.0%,改性聚赖氨酸1.0~5.0%,增粘剂0.5~1.0%和水90~96%。
在一些实施方式中,生长因子可以选自VEGF、EGF、bFGF中的一种或两种。
在一些实施方式中,增粘剂可以选自明胶、羧甲基纤维素钠、瓜尔胶中的一种或者多种。
在一些实施方式中,氧化海藻酸钠的制备方法可以包括如下步骤:
将海藻酸钠分散于无水乙醇中配制成海藻酸钠悬浊液,然后加入高碘酸钠溶液在避光的条件下反应18~32h,加入乙二醇终止反应,得到反应混合物,将反应混合物纯化、冷冻干燥,即得。
在一些实施方式中,海藻酸钠的M/G比可以为1:1~1:3;分子量可以为8~12kDa。
在一些实施方式中,海藻酸钠与无水乙醇的质量体积比为1:4~1:6g/mL。
在一些实施方式中,高碘酸钠溶液的浓度可以为6~20wt%。
在一些实施方式中,高碘酸钠与海藻酸钠单体单元的摩尔比可以为20~100%;例如,可以为20%、40%、60%、80%、100%。
在一些实施方式中,加入与高碘酸钠等摩尔的乙二醇,15min后反应终止。
在一些实施方式中,将反应混合物纯化、冷冻干燥可以包括如下步骤:
将反应混合物加入无水乙醇中,析出沉淀,过滤,沉淀干燥后用水透析24~72h,以除掉未反应的高碘酸钠及乙二醇等小分子杂质,最后将透析袋内液体冷冻干燥,即可。
在一些实施方式中,反应混合物与无水乙醇的体积比可以为1:4~1:6。
在一些实施方式中,沉淀干燥可以采用真空干燥的干燥方式,真空干燥的温度可以为35~45℃。
在一些实施方式中,负载生长因子的改性海藻酸盐微球的制备方法,可以包括如下步骤:
将氧化海藻酸钠溶解于水中,按氨基苯硼酸与氧化海藻酸钠的质量比为1:5~1:10加入氨基苯硼酸进行反应,反应结束后加入生长因子,得混合液;将混合液滴加到氯化钙溶液中,最后过滤、冷冻干燥,即得。
在一些实施方式中,将氧化海藻酸钠溶解于水中,制得的氧化海藻酸钠溶液的浓度可以为3~5wt%。
在一些实施方式中,混合液中,生长因子的终浓度可以为0.5~1.0wt%。
在一些实施方式中,氯化钙溶液的浓度可以为2~4wt%。
在一些实施方式中,氨基苯硼酸可以为2-氨基苯硼酸、3-氨基苯硼酸和4-氨基苯硼酸中的一种或两种的混合物。
在一些实施方式中,负载生长因子的改性海藻酸盐微球的粒径可以为10~200μm。
在一些实施方式中,改性聚赖氨酸的制备方法,可以包括如下步骤:
将聚赖氨酸溶于碱性缓冲液中,然后加入甲基丙烯酸酐进行反应,反应结束后加入醛基苯硼酸继续反应,反应结束后将反应混合物纯化、干燥,即得。
在一些实施方式中,碱性缓冲液为pH值为8~10的缓冲液,例如,可以为pH值为8~10的硼酸盐缓冲液、甘氨酸-氢氧化钠缓冲液、磷酸盐缓冲液(PBS)、三羟甲基硝基甲烷缓冲液(Tris)等。
在一些实施方式中,将聚赖氨酸溶于碱性缓冲液中,制得的聚赖氨酸溶液的浓度可以为4~6wt%。
在一些实施方式中,甲基丙烯酸酐与聚赖氨酸的质量比可以为1:1~1:10,反应温度可以为40~60℃,反应时间可以为2~6h。
在一些实施方式中,醛基苯硼酸可以为2-醛基苯硼酸、3-醛基苯硼酸和4-醛基苯硼酸中的一种或两种的组合物;醛基苯硼酸与聚赖氨酸的质量比可以为1:2~1:10。
通过利用甲基丙烯酸酐和醛基苯硼酸对聚赖氨酸进行改性制得的改性聚赖氨酸,一方面,具备光固化性能,将其与氧化海藻酸钠、负载生长因子的改性海藻酸盐微球等一起应用于制备医用粘合剂时,制得的医用粘合剂具有瞬时固化的性能,能够显著缩短组织粘合剂的固化时间;另一方面,改性聚赖氨酸的苯硼酸基团与负载生长因子的改性海藻酸盐微球的苯硼酸基团能够产生相互作用,从而提高医用粘合剂的强度;又一方面,改性聚赖氨酸具有优异的抗菌性能,可以作为高分子抗菌剂代替抗生素使用,避免使用抗生素抗菌导致的耐药性。
根据本发明的另一个方面,提供了一种可降解促愈合医用粘合剂的制备方法,包括如下步骤:
将氧化海藻酸钠和负载生长因子的改性海藻酸盐微球按比例混合,得到A组分;
先将羧甲基壳聚糖和改性聚赖氨酸加入水中,溶解后得到羧甲基壳聚糖和改性聚赖氨酸混合溶液,然后将增粘剂溶解于羧甲基壳聚糖和改性聚赖氨酸混合溶液中,得到B组分;
将A组分和B组分各自独立包装、灭菌,即得。
在一些实施方式中,A组分可以采用辐照灭菌的灭菌方式,B组分可以通过湿法灭菌达到无菌状态。
使用本发明的可降解促愈合医用粘合剂时,首先将生理盐水与冻干粉状态的A组分混合形成悬浮乳液,然后分别将A组分悬浮乳液和B组分注入注射器中,接着将两个注射器分别接在凝胶混合头上,按照体积比为1:1的比例将医用粘合剂挤出到所需要使用的部位即可达到粘合或填充的效果。
与现有技术相比,本发明具有如下有益效果:
(1)通过高碘酸钠氧化得到的多醛基氧化海藻酸钠的醛基能够与组织表面的氨基产生席夫碱反应,产生化学黏合的效果;且相比于未改性的海藻酸钠,本发明使用的氧化海藻酸钠具有可生物降解特性;
(2)本发明的可降解促愈合医用粘合剂中,氧化海藻酸钠的羧基易与羧甲基壳聚糖的氨基发生静电离子交联,氧化海藻酸钠的醛基与羧甲基壳聚糖的氨基形成席夫碱反应,改性聚赖氨酸的苯硼酸基团也能够与负载生长因子的改性海藻酸盐微球发生反应,从而,使用时能够形成力学性能好、贴敷性好的凝胶,医用粘合剂固化后不易因皮肤张力等导致破裂而引起创口开裂;
(3)负载生长因子的改性海藻酸盐微球可以更好的填充组织缺损部位,并且随着改性海藻酸盐被机体组织液降解后,其负载的生长因子缓慢释放出来到达组织缺损部位,促进组织损伤修复;
(4)本发明的可降解促愈合医用粘合剂具有优异的抗菌性能和粘合性能。
附图说明
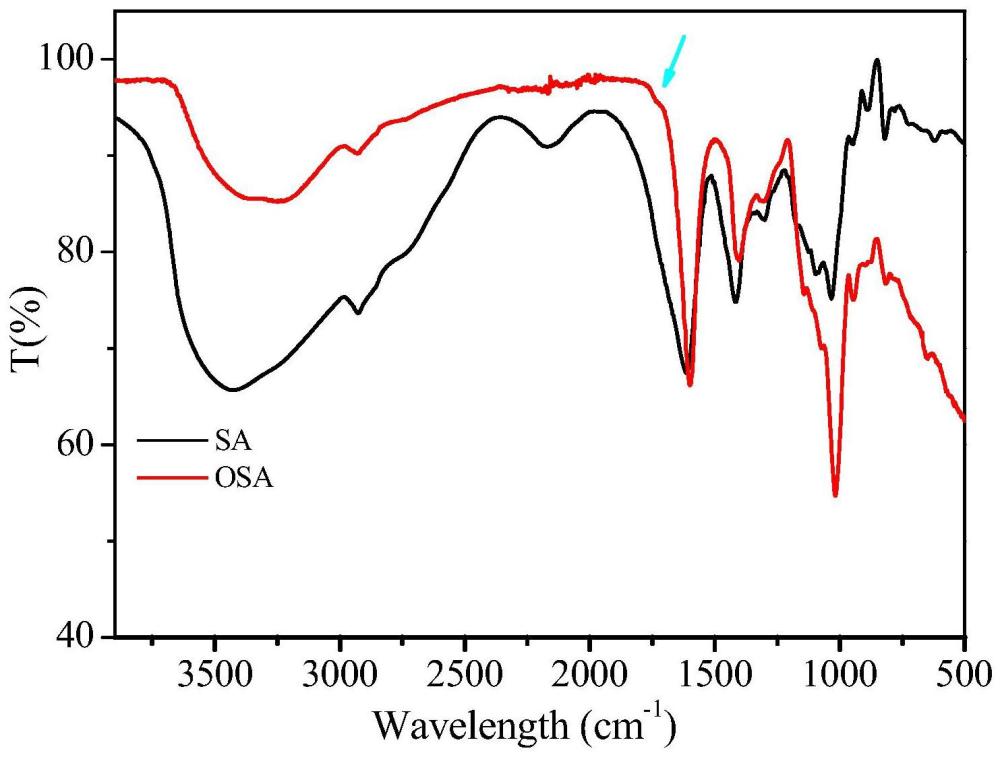
图1为本发明实施例1制备的氧化海藻酸钠的傅里叶变换红外光谱图;其中,SA表示海藻酸钠,OSA表示氧化海藻酸钠。
具体实施方式
下面结合实施方式对本发明作进一步详细的说明。实施例仅用于解释而不以任何方式限制本发明。如无特殊说明,实施例中所用原料和试剂为可以通过市售获得的常规产品;实施例中未注明具体条件的实验方法,通常按照本领域常规条件或按照制造厂商建议的条件。
实施例中所用海藻酸钠粉末源于市购,海藻酸钠的纯度为85%,其中古罗糖醛酸的含量为80~50%。以下实施例中,“剧烈搅拌”是指搅拌转速在1200~1800rpm。
实施例1
本实施例的可降解促愈合医用粘合剂,A组分包括质量比为1:1的氧化海藻酸钠和负载生长因子的改性海藻酸盐微球;B组分按质量百分比计,包括:羧甲基壳聚糖4.0%,改性聚赖氨酸5.0%,羧甲基纤维素钠0.8%,余量为水。
制备方法包括如下步骤:
(1)氧化海藻酸钠的制备:将10g的海藻酸钠粉末分散于50mL无水乙醇中配成海藻酸钠悬浊液;将10g高碘酸钠溶于50mL水中配成高碘酸钠溶液;按高碘酸钠与海藻酸钠单体单元的摩尔比60%,将高碘酸钠溶液加入海藻酸钠悬浊液中避光室温磁力搅拌约24h,然后加入与高碘酸钠等摩尔的乙二醇,约15min后反应终止,得到反应混合物;
将得到的反应混合物倒入剧烈搅拌的无水乙醇中,反应混合物与无水乙醇的体积比为1:5,析出沉淀,然后抽滤、40℃真空干燥,得到固体粉末,将得到的固体粉末采用蒸馏水透析24h以除掉未反应的高碘酸钠及乙二醇等小分子杂质,最后将透析袋内液冷冻干燥,得到氧化海藻酸钠;
采用傅里叶变换红外光谱仪(仪器型号:Nicolet iS50)对制备的氧化海藻酸钠进行了傅里叶变换红外光谱检测,检测结果如图1所示,从图1可以看出,氧化海藻酸钠与纯海藻酸钠相比在1735cm
(2)负载生长因子的改性海藻酸盐微球制备:称取5g的氧化海藻酸钠溶解于纯化水中制得4wt%的氧化海藻酸钠溶液,然后将3-氨基苯硼酸按照与氧化海藻酸钠质量比为1:6的比例加入到氧化海藻酸钠溶液中反应,反应结束后再加入VEGF,得混合溶液,混合溶液中,生长因子的终浓度为1.0wt%;然后使用微量泵将上述混合溶液滴入凝固浴4wt%氯化钙溶液中,最后过滤并冷冻干燥获得负载生长因子的改性海藻酸盐微球;
(3)改性聚赖氨酸的制备:称取5g聚赖氨酸溶于100mL的pH=8的磷酸盐缓冲液中得到5wt%的聚赖氨酸溶液,然后向其中加入1g甲基丙烯酸酐后在40℃反应6h,反应结束后向其中加入1g 2-醛基苯硼酸继续反应,反应结束后将反应混合物纯化、干燥后即可得到改性聚赖氨酸;
(4)A组分的配制:将氧化海藻酸钠冻干粉末与负载生长因子的改性海藻酸盐微球按照质量比为1:1的比例混合均匀,然后灌装入玻璃瓶中并进行封口,最后通过辐照灭菌达到无菌状态;
(5)B组分的配制:按照羧甲基壳聚糖4.0wt%,改性聚赖氨酸5.0wt%,增粘剂0.8wt%取各组分,先将羧甲基壳聚糖和改性聚赖氨酸溶解在纯化水中,再将增粘剂溶解在上述溶液中,然后灌装入玻璃瓶中并进行封口,最后通过湿法灭菌达到无菌状态。
使用时,首先按A组分和生理盐水的质量比为1:50取生理盐水,将生理盐水注入装有A组分的玻璃瓶中直至形成悬浮乳液,再分别用注射器吸出A组分悬浮乳液和B组分,将两个注射器分别接在凝胶混合头上,然后按照体积1:1的比例将医用粘合剂挤出到所需要使用的部位即可达到粘合或填充的效果。
实施例2
本实施例的可降解促愈合医用粘合剂,A组分包括质量比为1:1的氧化海藻酸钠和负载生长因子的改性海藻酸盐微球;B组分按质量百分比计,包括:羧甲基壳聚糖4.0%,改性聚赖氨酸5.0%,羧甲基纤维素钠0.8%,余量为水。
制备方法包括如下步骤:
(1)氧化海藻酸钠的制备:将10g的海藻酸钠粉末分散于50mL无水乙醇中配成海藻酸钠悬浊液;将10g高碘酸钠溶于50mL水中配成高碘酸钠溶液;按高碘酸钠与海藻酸钠单体单元的摩尔比60%,将高碘酸钠溶液加入海藻酸钠悬浊液中避光室温磁力搅拌约24h,然后加入与高碘酸钠等摩尔的乙二醇,约15min后反应终止,得到反应混合物;
将得到的反应混合物倒入剧烈搅拌的无水乙醇中,反应混合物与无水乙醇的体积比为1:5,析出沉淀,然后抽滤、40℃真空干燥,得到固体粉末,将得到的固体粉末采用蒸馏水透析24h以除掉未反应的高碘酸钠及乙二醇等小分子杂质,最后将透析袋内液冷冻干燥,得到氧化海藻酸钠;
(2)负载生长因子的改性海藻酸盐微球制备:称取5g的氧化海藻酸钠溶解于纯化水中制得4wt%的氧化海藻酸钠溶液,然后将3-氨基苯硼酸按照与氧化海藻酸钠质量比为1:8的比例加入到氧化海藻酸钠溶液中反应,反应结束后再加入VEGF,得混合溶液,混合溶液中,生长因子的终浓度为1.0wt%;然后使用微量泵将上述混合溶液滴入凝固浴4wt%氯化钙溶液中,最后过滤并冷冻干燥获得负载生长因子的改性海藻酸盐微球;
(3)改性聚赖氨酸的制备:称取5g聚赖氨酸溶于100mL的pH=8的磷酸盐缓冲液中得到5wt%的聚赖氨酸溶液,然后向其中加入1g甲基丙烯酸酐后在40℃反应2h,反应结束后向其中加入1g 2-醛基苯硼酸继续反应,反应结束后将反应混合物纯化、干燥后即可得到改性聚赖氨酸;
(4)A组分的配制:将氧化海藻酸钠冻干粉末与负载生长因子的改性海藻酸盐微球按照质量比为1:1的比例混合均匀,然后灌装入玻璃瓶中并进行封口,最后通过辐照灭菌达到无菌状态;
(5)B组分的配制:按照羧甲基壳聚糖4.0wt%,改性聚赖氨酸5.0wt%,增粘剂0.8wt%取各组分,先将羧甲基壳聚糖和改性聚赖氨酸溶解在纯化水中,再将增粘剂溶解在上述溶液中,然后灌装入玻璃瓶中并进行封口,最后通过湿法灭菌达到无菌状态。
使用方法参考实施例1。
实施例3
本实施例的可降解促愈合医用粘合剂,A组分包括质量比为1:1的氧化海藻酸钠和负载生长因子的改性海藻酸盐微球;B组分按质量百分比计,包括:羧甲基壳聚糖4.0%,改性聚赖氨酸2.5%,羧甲基纤维素钠0.8%,余量为水。
制备方法包括如下步骤:
(1)氧化海藻酸钠的制备:将10g的海藻酸钠粉末分散于50mL无水乙醇中配成海藻酸钠悬浊液;将10g高碘酸钠溶于50mL水中配成高碘酸钠溶液;按高碘酸钠与海藻酸钠单体单元的摩尔比40%,将高碘酸钠溶液加入海藻酸钠悬浊液中避光室温磁力搅拌约24h,然后加入与高碘酸钠等摩尔的乙二醇,约15min后反应终止,得到反应混合物;
将得到的反应混合物倒入剧烈搅拌的无水乙醇中,反应混合物与无水乙醇的体积比为1:5,析出沉淀,然后抽滤、40℃真空干燥,得到固体粉末,将得到的固体粉末采用蒸馏水透析24h以除掉未反应的高碘酸钠及乙二醇等小分子杂质,最后将透析袋内液冷冻干燥,得到氧化海藻酸钠;
(2)负载生长因子的改性海藻酸盐微球制备:称取5g的氧化海藻酸钠溶解于纯化水中制得4wt%的氧化海藻酸钠溶液,然后将3-氨基苯硼酸按照与氧化海藻酸钠质量比为1:6的比例加入到氧化海藻酸钠溶液中反应,反应结束后再加入VEGF,得混合溶液,混合溶液中,生长因子的终浓度为0.5wt%;然后使用微量泵将上述混合溶液滴入凝固浴4wt%氯化钙溶液中,最后过滤并冷冻干燥获得负载生长因子的改性海藻酸盐微球;
(3)改性聚赖氨酸的制备:称取5g聚赖氨酸溶于100mL的pH=8的磷酸盐缓冲液中得到5wt%的聚赖氨酸溶液,然后向其中加入0.5g甲基丙烯酸酐后在50℃反应4h,反应结束后向其中加入0.5g 2-醛基苯硼酸继续反应,反应结束后将反应混合物纯化、干燥后即可得到改性聚赖氨酸;
(4)A组分的配制:将氧化海藻酸钠冻干粉末与负载生长因子的改性海藻酸盐微球按照质量比为1:1的比例混合均匀,然后灌装入玻璃瓶中并进行封口,最后通过辐照灭菌达到无菌状态;
(5)B组分的配制:按照羧甲基壳聚糖4.0wt%,改性聚赖氨酸5.0wt%,增粘剂0.8wt%取各组分,先将羧甲基壳聚糖和改性聚赖氨酸溶解在纯化水中,再将增粘剂溶解在上述溶液中,然后灌装入玻璃瓶中并进行封口,最后通过湿法灭菌达到无菌状态。
使用方法参考实施例1。
对比例1
本对比例的医用粘合剂,A组分包括质量比为1:1的海藻酸钠和负载生长因子的海藻酸盐微球;B组分按质量百分比计,包括:羧甲基壳聚糖4.0%,羧甲基纤维素钠0.8%,余量为水。
制备方法包括如下步骤:
(1)负载生长因子的海藻酸盐微球制备:称取5g的海藻酸钠溶解于纯化水中制得4wt%的海藻酸钠溶液,加入VEGF,得混合溶液,混合溶液中,生长因子的终浓度为0.5wt%;然后使用微量泵将上述混合溶液滴入凝固浴4wt%氯化钙溶液中,最后过滤并冷冻干燥获得负载生长因子的海藻酸盐微球;
(2)A组分的配制:将海藻酸钠冻干粉末与步骤(1)制得的负载生长因子的海藻酸盐微球按照质量比为1:1的比例混合均匀,然后灌装入玻璃瓶中并进行封口,最后通过辐照灭菌达到无菌状态;
(3)B组分的配制:按照羧甲基壳聚糖4.0wt%,增粘剂0.8wt%取各组分,先将羧甲基壳聚糖溶解在纯化水中,再将增粘剂溶解在上述溶液中,然后灌装入玻璃瓶中并进行封口,最后通过湿法灭菌达到无菌状态。
使用方法参考实施例1。
为验证本发明的可降解促愈合医用粘合剂是否达到预期的效果,对实施例1~3及对比例1制备的医用粘合剂进行抗菌实验、粘合力实验、降解实验和促愈合实验等。
一、抗菌实验
分别将不同实施例制备的医用粘合剂滴加入无菌锥形瓶中,固化后分别加入70mL0.03mol/L的磷酸盐缓冲液和5mL10
抑菌率计算公式:X=(A-B)/A×100%,其中X为抑菌率,A为试样品振荡前平均菌落数,B为试样品振荡后平均菌落数。结果如表1所示。
表1不同实施例的医用粘合剂的金黄色葡萄球菌抑菌率
从表1可以看出,本发明制备的医用粘合剂具有很好的抗菌性能,24h金黄色葡萄球菌抑菌率均为90%以上。
二、组织粘合力测试实验
取猪皮一块,按照尺寸5cm×2.5cm裁剪成小块,将两小块猪皮对接在一起,然后将实施例1的医用粘合剂滴加在两块猪皮的对接处,等固化后,将接好的猪皮置于万能试验机(承德精密仪器有限公司,10ST)夹具上进行拉力实验。
按照同样的方法对实施例2-3及对比例1制备的医用粘合剂进行拉力实验。实验结果如表2所示。
表2实施例1-3及对比例1制备的医用粘合剂的拉力测试结果
从表2可以看出,实施例1-3制备的医用粘合剂的粘合力均为25kPa以上,其中实施例1、实施例3制备的医用粘合剂的粘合力为30kPa以上,而对比例1制备的医用粘合剂的粘合力小于20kPa,由此表明本发明制备的医用粘合剂具有较强的粘合力。
三、降解性能测试实验
将200μL不同实施例制备的医用粘合剂固化后的样品置入5mL含100U/mL脂肪酶的PBS溶液中,并在37℃的恒温振荡器中模拟体内环境,测试医用粘合剂的体外降解速率。各样品在第5天、第10天和第15天质量损失率如表3。
表3医用粘合剂降解后质量损失率
由表3的结果可知,实施例1-3制备的医用粘合剂具有良好的降解性能。
四、交联时间测试实验
将实施例1~3和对比例1制备的医用粘合剂A组分与B组分混合后,马上计时,直至医用粘合剂不再流动为止,停止计时,记录交联时间。各样品的交联时间如表4。
表4实施例1-3及对比例1制备的医用粘合剂的交联时间测试结果
由表4的结果可知,实施例1-3制备的医用粘合剂具有更短的交联时间,满足瞬时固化的要求。
五、促愈合性能测试实验
大鼠注射麻醉,背部剪毛,75%酒精擦拭消毒皮肤,以直径1cm的皮肤活检器在鼠背部正中距离耳后正中线4cm处形成一个1cm×1cm的圆形伤口,切除范围深达筋膜,按以下方法处理伤口。
对照组:创面喷涂对比例1医用粘合剂,覆盖双层纺纱包扎。
实验组一:创面喷涂实施例1医用粘合剂,覆盖双层纺纱包扎。
实验组二:创面喷涂实施例2医用粘合剂,覆盖双层纺纱包扎。
实验组三:创面喷涂实施例3医用粘合剂,覆盖双层纺纱包扎。
每次需清理伤口、记录并重新换药包扎。第7天愈合率如表5所示。
表5医用粘合剂第7天的促伤口愈合率
从表5可以看出,实施例1-2制备的医用粘合剂具有更好的创面愈合性能。
以上所述的仅是本发明的一些实施方式。对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
