一种控制枯草芽孢杆菌基因组同源重组概率的方法
文献发布时间:2023-06-19 18:37:28
技术领域
本发明涉及基因工程技术领域,尤其涉及一种控制枯草芽孢杆菌基因组同源重组概率的方法。
背景技术
同源重组又称一般性重组,发生在DNA的同源序列之间,同源重组是生物界普遍存在的现象,真核生物非姐妹染色单体的交换,姐妹染色单体的交换,细菌及某些低等真核生物的转化,细菌的转导、接合等都属于这一类型。枯草芽孢杆菌(Bacillus subtilis)作为革兰氏阳性菌的模型微生物,用于孢子形成机制和代谢调节的实验室研究,在自然界广泛分布,包括土壤表面,水环境和动物胃。它是一种非致病微生物,不含内毒素,并且通常被美国食品和药物管理局(FDA)认可为安全(GRAS)食品级微生物。此外,枯草芽孢杆菌具有许多优点,包括:细胞生长快,培养时间短,培养要求低,分泌蛋白质能力强,广泛用于工业酶生产,高附加值产品的生物合成。
然而利用枯草芽孢杆菌进行发酵生产伴随着多拷贝基因引起的同源重组,这导致产量的降低或消失。控制枯草芽孢杆菌发酵过程同源重组引起的产量下降或消失对于微生物发酵具有重要影响。
目前,人们为了减少同源重组现象进行了许多研究。但进行同源重组时,需同源序列短于75bp,重组频率才能大大降低。但相比于大肠杆菌遗传转化操作所需的50bp长度的同源臂,枯草芽孢杆菌常用同源臂长度为500-1500bp,因此降低枯草芽孢杆菌重组概率无法有效实现。因此,开发一种同源臂长度在大于75bp的情况下仍能降低枯草芽孢杆菌同源重组概率的方法至关重要。
发明内容
为解决上述技术问题,本发明提供了一种控制枯草芽孢杆菌胞内同源重组的方法,是将控制同源重组的关键基因recA敲除或诱导表达,使其在发酵过程中不表达RecA蛋白,从而降低同源重组概率,以期解决由于同源重组引起的产量降低或消失问题。
本发明的第一个目的是提供一种控制枯草芽孢杆菌基因组同源重组概率的方法,方法中包括敲除所述枯草芽孢杆菌中编码RecA蛋白的基因recA或诱导表达recA的步骤。
进一步地,所述编码RecA蛋白的基因recA的核苷酸序列如SEQ IDNO.1所示。
进一步地,通过诱导型启动子以及非天然氨基酸诱导表达recA。通过这种方法,实现在转录和翻译上共同控制recA的表达,可随时开启或关闭枯草芽孢杆菌胞内的同源重组。
进一步地,诱导表达recA的具体步骤为:将原启动子替换为诱导型启动子,同时将RecA蛋白的第二个密码子替换为编码非天然氨基酸的密码子。优选地,替换密码子为TAG会在该位点引入非天然氨基酸,需要保证非天然氨基酸的引入对该蛋白的性质不产生影响。第二个位点的改变通过申请人的多次尝试得到,前期实验尝试过第一个、第三个等多个位点均构建失败,可见并非任意位点引入非天然氨基酸均可,同时,若将很多位点都改成TAG密码子也不可行,由于RF因子会与引入的tRNA竞争,若将recA中的多个位点都改成TAG,可能会导致蛋白无法正常翻译。
进一步地,将上述得到的recA缺陷菌株进行培养,若要降低同源重组概率,在培养过程中不加入诱导剂和非天然氨基酸即可。
进一步地,所述的培养为,将所述recA缺陷菌株活化后在种子培养基中培养得到种子液,再将种子液接种至发酵培养基中进行发酵培养。
进一步地,所述种子培养基的组成为:5-15g/L胰蛋白胨,1-10g/L酵母粉,5-15g/LNaCl。
优选地,种子培养基的组成为:10g/L胰蛋白胨,5g/L酵母粉,10g/LNaCl。
进一步地,所述发酵培养基的组成为:10-15g/L酵母提取物,5-10g/L胰蛋白胨,1-5g/L KH
优选地,发酵培养基的组成为:12g/L酵母提取物,6g/L胰蛋白胨,2.5g/L KH
进一步地,本发明中测定枯草芽孢杆菌同源重组概率的方法,包括以下步骤:构建抗性基因缺失序列,针对缺失部位设计同源臂,将同源臂与抗性基因缺失序列整合入基因组中,通过抗性表征测试使用该同源臂时枯草芽孢杆菌的同源重组概率。
进一步地,本发明的一个实施例中,抗性基因缺失序列为在卡纳抗性基因正中间删去29个碱基,缺失后的核苷酸序列如SEQ ID NO.6所示(未缺失的卡纳抗性基因序列如SEQ ID NO.5所示),并设计不同长度的同源臂(本发明采用75bp、150bp、250bp、350bp等)在基因组ywpD及mcsL两个基因中间整合,该菌株自发重组后卡纳抗性基因恢复,通过卡纳抗性表征测试不同长度同源臂情况下枯草芽孢杆菌重组概率。
进一步地,通过统计同源重组培养后抗性恢复菌株占总菌落数比例测定同源重组概率。
本发明的第二个目的是提供一种同源重组概率可控的枯草芽孢杆菌,所述枯草芽孢杆菌敲除了编码RecA蛋白的基因recA或经过诱导表达recA改造。
进一步地,所述诱导表达recA改造为利用诱导型启动子以及非天然氨基酸诱导表达recA。
进一步地,所述枯草芽孢杆菌包括但不限于Bacillus subtilis WB600。
本发明的第三个目的是提供上述重组枯草芽孢杆菌在食品或生物领域(尤其是生物发酵)中的应用。
进一步地,上述重组枯草芽孢杆菌能够显著降低同源重组概率(尤其是诱导表达recA得到的菌株),从而实现目标物的稳定产出。
借由上述方案,本发明至少具有以下优点:
本发明通过敲除枯草芽孢杆菌中编码不同的同源重组相关蛋白的基因,筛选出敲除RecA蛋白后能够大大降低菌株的同源重组概率,并进一步对recA的表达方式进行优化,实现在同源臂长度为75-350bp时的同源重组概率仍低于10
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明。
图1为同源臂长度为150bp时,敲除不同重组相关基因对枯草芽孢杆菌同源重组情况的影响;
图2为不同长度同源臂在敲除recA基因后的同源重组情况;
图3为N-乙酰神经氨酸生产菌株敲除recA前后传代发酵产量变化情况。
图4为同源重组概率测试菌株的构建;
图5为通过诱导型启动子和非天然氨基酸共同控制recA基因的表达;
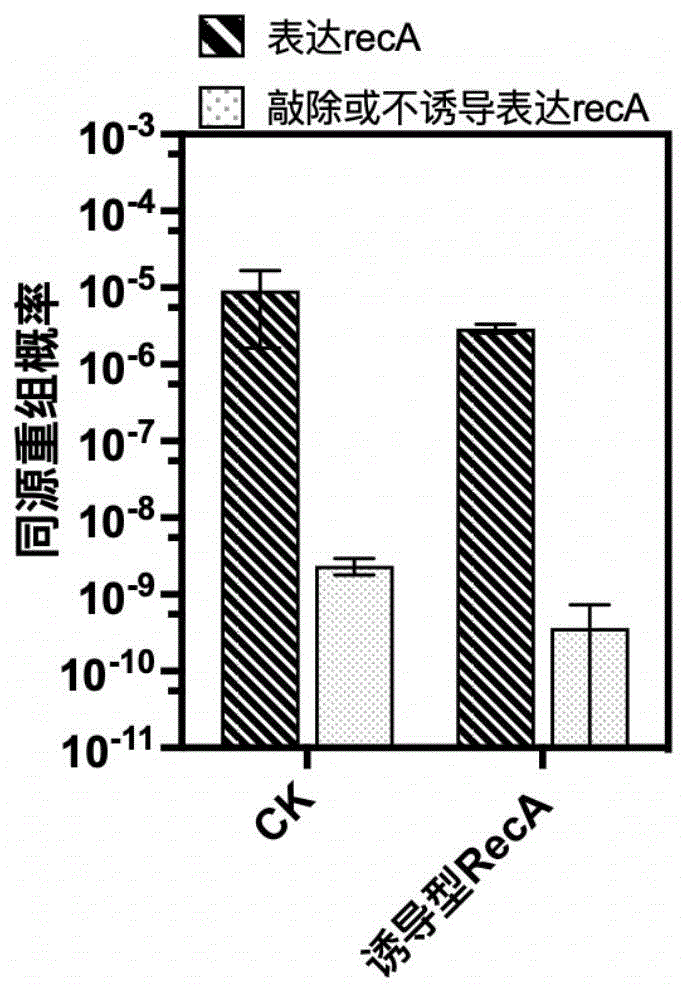
图6为枯草芽孢杆菌正常表达recA时的同源重组概率以及敲除或诱导表达recA时的重组概率。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
下述实施例中所涉及的材料与方法如下:
枯草芽孢杆菌为Bacillus subtilis WB600;
recA基因序列如SEQ ID NO.1所示;
recO基因序列如SEQ ID NO.2所示;
addB基因序列如SEQ ID NO.3所示;
ruvB基因序列如SEQ ID NO.4所示;
卡纳抗性基因序列如SEQ ID NO.5所示;
卡纳抗性基因缺失序列如SEQ ID NO.6所示;
敲除recA基因序列所用的左同源臂如SEQ ID NO.7所示;
敲除recA基因序列所用的右同源臂如SEQ ID NO.8所示;
链霉素抗性基因序列如SEQ ID NO.9所示。
枯草芽孢杆菌种子培养:
LB培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10。
产N-乙酰神经氨酸枯草芽孢杆菌发酵培养基:
BF培养基(g/L):酵母提取物12,胰蛋白胨6,KH
实施例1敲除recA基因菌株构建
敲除基因方法如下:
(1)在所需待敲除recA基因前后设计1000bp的左右同源臂,左臂片段如SEQ IDNO.7所示,右臂片段如SEQ ID NO.8所示,替换相关基因为链霉素抗性基因,分别获得融合片段左右臂以及抗性基因。
(2)连接左右臂以及抗性基因,以其为模板,扩增出整个融合框。将该融合框转化至WB600菌株中完成基因的敲除。按同样的方法完成recO、addB或ruvB的敲除。
实施例2同源重组概率测试
将实施例1构建敲除重组相关基因的菌株在37℃、200rpm、1mL LB培养基、24深孔板中培养12h,获得种子液,再将种子液以1‰的接种量转入1mL LB中相同条件下培养12h后,取一定量的菌液涂布于50ug/mL的卡纳抗性板上。统计抗性板上的单菌落数,按比例计算1mL菌液中带有卡纳抗性基因的菌数,并计算同源重组概率。通过FALCOR网站计算相应的同源重组概率。其中,用于测定枯草芽孢杆菌同源重组概率的测试菌株带有卡纳抗性基因并删去该基因中间29个碱基,同时将缺失的29碱基连接不同长度的同源臂包括75,150,250,350,整合在基因组的另外一个位点。该菌株自发重组后卡纳抗性基因恢复通过将该菌株培养后测定卡纳抗性恢复菌株占总菌落数比例用于测定枯草芽孢杆菌胞内的重组概率(见图4)。
对照组的制备:
将未进行重组基因敲除改造的菌株在37℃、200rpm、1mL LB培养基、24深孔板中培养12h,获得种子液,再将种子液以1‰的接种量转入1mL LB中相同条件下培养12h后,取一定量的菌液涂布于50ug/mL的卡纳抗性板上。统计抗性板上的单菌落数,按比例计算1mL菌液中带有卡纳抗性基因的菌数,并计算同源重组概率。通过FALCOR网站计算相应的同源重组概率。
结果见图1和图2。从图中可以看出,敲除recA后枯草芽孢杆菌的同源重组概率大大降低,且在不同长度下敲除recA同源重组概率都降低了10
实施例3产N-乙酰神经氨酸菌株敲除recA前后传代产量测试
将产N-乙酰神经氨酸的工程菌按照实施例1敲除recA后,挑取单菌落接种在37℃、220rpm、BF培养基50mL,48h后取样处理测试产量,再将种子液以1‰的接种量转入50mL的BF培养基。
对照组:具体实施方式同上,区别是不进行recA的敲除,将产N-乙酰神经氨酸的枯草芽孢杆菌挑取单菌落接种在37℃、220rpm、BF培养基50mL,48h后取样处理测试产量,再将种子液以1‰的接种量转入50mL的BF培养基。
摇瓶发酵结果见图3。由图3可知,不敲除recA的生产菌株传代7次后产量下降64%,而敲除了recA的生产菌传代7次后产量仅下降25%左右,产量更稳定。
实施例4诱导表达recA与敲除recA的效果对比
将WB600菌株中的recA启动子替换为IPTG诱导型启动子,同时将recA的第二个密码子替换为TAG密码子。需要诱导表达recA时添加IPTG诱导剂以及非天然氨基酸(O-methyl-L-tyrosine(OMeY),O-甲基-酪氨酸),不需要表达recA时不添加上述诱导剂即可。
本发明构建了一种诱导表达recA的方法,利用诱导型启动子结合非天然氨基酸分别控制该基因在转录和翻译水平上的表达(图5)。通过这种方式实现的表达或不表达recA的同源重组概率如图6所示,CK组中,表达recA即为WB600正常表达,不表达recA即敲除recA。
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
