一种眼科治疗药物新的制备方法
文献发布时间:2024-04-18 19:59:31
发明领域
本发明属于化学药物领域,具体涉及一种抗寄生虫眼科治疗药物洛替拉纳(Lotilaner)新的制备方法。
背景技术
蠕形螨睑缘炎是一种常见但易被临床忽视的传染性眼表疾病,是蠕形螨感染睑缘所致的慢性炎性反应性疾病,主要累及睑缘皮肤、睫毛囊和腺体以及睑板腺,以眼痒、眼异物感、眼干、睑缘充血、鳞屑及睫毛根部袖套状分泌物等为典型临床表现,严重者可引起结膜及角膜并发症。
洛替拉纳(Lotilaner)滴眼剂是一种抗寄生虫滴眼液,可用于治疗18岁及以上成人的蠕形螨睑缘炎。洛替拉纳能抑制蠕形螨中的γ-氨基丁酸(GABA)门控氯离子通道,导致蠕形螨麻痹和死亡,并缓解眼睑发红和结痂。洛替拉纳在用量低于30μM(18μg/mL)(约1100次推荐的人眼用剂量)时不是哺乳动物GABA门控氯离子通道的抑制剂。洛替拉纳滴眼液不良反应少,耐受性较好,是蠕形螨性睑缘炎的首个治疗药物,市场前景广阔。
洛替拉纳(Lotilaner),化学名称:5-[(5S)-4,5-二氢-5-(3,4,5-三氯苯基)-5-(三氟甲基)-3-异恶唑基]-3-甲基-N-[2-氧代-2-[(2,2,2-三氟乙基)氨基]乙基]-2-噻吩甲酰胺,分子式为C
现有技术文件专利WO2014090918报道了洛替拉纳的合成路线1,具体如下:
该路线以三氟-3,4,5-三氯苯乙酮和2-溴-3-甲基-5-乙酰基噻吩为起始原料,先对接反应得到中间体(Z/E)-1-(5-溴-4-甲基-2-噻吩基)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯-1-酮,再与羟胺在手性相转移催化剂下环合反应得到中间体3-(5-溴-4-甲基-2-噻吩基)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4H-异噁唑。该中间体再与乙基氯化镁、二氧化碳发生格氏反应得到中间体3-甲基-5-[(5S)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4H-异噁唑-3-基]噻吩-2-羧酸(混合构型化合物1);混合构型化合物1经(R)-1-(4-甲基苯基)乙胺手性拆分得到单一S构型的化合物1,化合物1最后与起始原料2-氨基-三氟乙基-乙酰胺反应得到洛替拉纳。该路线采用手性拆分剂拆分制备单一S构型的化合物1,总收率较低,导致洛替拉纳生产成本较高。
现有技术文件专利CN202180061376报道了合成洛替拉纳中间体化合物1的路线2a和路线2b,具体如下:
路线2a:
该路线以5-乙酰基-3-甲基-噻吩-2-羧酸甲酯和2,2,2-三氟-1-(3,4,5-三氯苯基)乙酮为起始原料,首先经缩合反应得到中间体3-甲基-5-[(E/Z)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基]噻吩-2-羧酸甲酯,该中间体在(R)-[(2S)-1-[[3,5-双(三氟甲基)苯基]甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物不对称催化下与羟胺环合反应得到单一构型3-甲基-5-[(5S)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4H-异噁唑-3-基]噻吩-2-羧酸甲酯,再经氢氧化钠水解得到中间体化合物1。该路线为不对称合成路线,采用不对称手性相转移催化剂奎宁衍生物进行单一S构型化合物1,大大提高了合成洛替拉纳的总收率,但该路线中手性相转移催化剂不易购得,限制了该路线的产业化。
路线2b
该路线与路线1类似,但为不对称合成路线;该路线以(Z/E)-1-(5-溴-4-甲基-2-噻吩基)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯-1-酮为起始原料,先在(R)-[(2S)-1-[[3,5-双(三氟甲基)苯基]甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物不对称催化下与羟胺环合反应得到单一构型(5S)-3-(5-溴-4-甲基-2-噻吩基)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4H-异噁唑,再与乙基氯化镁、二氧化碳发生格氏反应得到中间体化合物1,该路线中手性相转移催化剂与路线2a相同,同样存在不易购得的问题。
现有技术文件专利CN202011364241报道了洛替拉纳的合成路线3,具体如下:
该路线以5-溴-3-甲基-噻吩-2-羧酸为起始原料,先制备中间体3-甲基-5-(硝基甲基)噻吩-2-甲酸,该中间体与1,2,3-三氯-5-(3,3,3-三氟丙-1-烯-2-基)苯对接反应得到混合构型化合物1;其与2-氨基-三氟乙基-乙酰胺盐酸盐经酰胺化对接反应得到混合构型洛替拉纳,最后经手性柱拆分后得到单一S构型洛替拉纳。该路线最终通过手性柱进行洛替拉纳S构型拆分,效率和收率均较低,不易产业化。
现有技术文件专利CN201910206232报道了混合构型洛替拉纳的合成路线4,具体路线如下:
该路线较长,且最终得到混合构型洛替拉纳仍需通过手性柱拆分才能得到单一构型洛替拉纳,收率较低,不易产业化。
发明内容
本发明的目的在于克服现有技术的不足,提供一种抗寄生虫眼科治疗药物洛替拉纳新的制备方法,其特征在于,所述方法为:
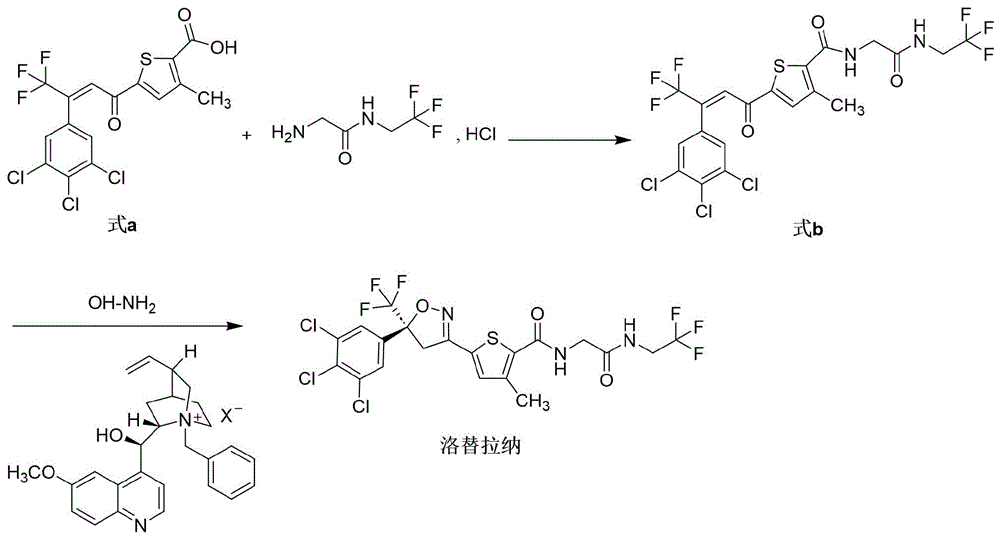
步骤1、式a化合物与2-氨基-三氟乙基-乙酰胺盐酸盐经酰胺化反应得到中间体式b化合物;
步骤2、中间体式b化合物与羟胺在手性相转移催化剂(R)-N-苄基卤化奎宁催化下进行不对称环合反应得到洛替拉纳;
其中(R)-N-苄基卤化奎宁结构中X选自氯或溴。
本发明路线不同于现有技术文件专利WO2014090918、CN202180061376、CN202011364241、和CN201910206232中报道的洛替拉纳合成路线。本发明的目的是提供一种以式a化合物、2-氨基-三氟乙基-乙酰胺盐酸盐、羟胺溶液以及手性相转移催化剂(R)-N-苄基卤化奎宁为物料,经2步反应合成洛替拉纳(Lotilaner)新的方法,该方法不同于现有技术文件,其显著特点是采用相对易购且价格便宜的手性相转移催化剂(R)-N-苄基卤化奎宁进行洛替拉纳的不对称合成,且路线设计更短,产品光学纯度高,收率高,起始原料价廉易购,操作安全简单,环境友好。
本发明步骤1酰胺化反应的缩合剂为氯化亚砜、O-苯并三氮唑-四甲基脲六氟磷酸盐(HBTU)二异丙基碳二亚胺(DIC)或1-(3-二甲胺基丙基)-3-乙基碳二亚胺(EDCI),其中氯化亚砜或O-苯并三氮唑-四甲基脲六氟磷酸盐(HBTU)反应效率较高,且副产物少,作为优选。
本发明步骤1酰胺化反应需加入缚酸剂保证反应顺利进行。缚酸剂选自三乙胺、N,N-二异丙基乙胺或N-甲基吗啉,优选价格便宜,碱性适中且反应效果较好的三乙胺。
本发明步骤1酰胺化反应中,由于式a和式b化合物结构中羰基α位为烯烃,性质较为活泼,在酰胺化反应中容易发生副反应,为降低副产物,酰胺反应过程需严格控制投料比,如当缩合剂为氯化亚砜时,控制式a化合物、2-氨基-三氟乙基-乙酰胺盐酸盐、氯化亚砜及缚酸剂的摩尔投料比为1:1.0~1.5:1.2~2.0:2~3,优选1:1.2:1.5:2.5,另外需严格控制-5~5℃的低温反应条件进行酰胺化反应,并在保证反应进程的前提下尽量缩短反应时间以减少副产物的产生;当缩合剂为O-苯并三氮唑-四甲基脲六氟磷酸盐(HBTU)、二异丙基碳二亚胺(DIC)或1-(3-二甲胺基丙基)-3-乙基碳二亚胺(EDCI)时,控制式a化合物、2-氨基-三氟乙基-乙酰胺盐酸盐、缩合剂及缚酸剂的摩尔投料比为1:1.0~1.2:1.0~1.2:2~3,优选1:1.05:1.05:2.5,室温反应并尽量缩短反应时间以减少副产物的产生。值得庆幸的是,通过以上反应条件的控制,该步反应的副产物得到有效控制,且通过后处理及重结晶操作能够除去,以上是本发明设计路线得以实施的关键。
本发明步骤2环合反应中,由于式b化合物和洛替拉纳结构均存在酰胺键,容易在碱性条件下水解成羧酸,本发明虽然使用无机强碱氢氧化钠或氢氧化钾,但通过严格控制反应温度在-10~0℃,并在保证反应进程的前提下尽量缩短反应时间,试验结果显示步骤2环合反应中酰胺键水解的副产物较少,且通过后处理及重结晶操作能够除去,是本发明设计路线得以实施的又一关键。
本发明步骤2不对称环合反应中手性相转移催化剂为(R)-N-苄基卤化奎宁,该催化剂的使用不同于现有技术文件CN202180061376,其价格相对便宜,更易获得,但保证不对称反应催化效率是本发明实施最关键的环节。值得庆幸的是,反应中控制b化合物、不对称手性相转移催化剂及无机碱的摩尔投料比为1:1.5~2.5:1.5~2.5,优选1:2.0:2.0时,即使控制-10~0℃的低温反应条件,依然能够获得高光学纯度的S构型洛替拉纳,产品ee值大于99%,符合药用要求,无需再进行拆分提供光学纯度。本发明步骤2不对称环合反应中(R)-N-苄基氯化奎宁和(R)-N-苄基溴化奎宁的催化剂效果无显著差异。该手性相转移催化剂的使用是本发明最大的亮点,
本发明提供一条路线短,产品光学纯度高,收率高,环境友好的不对称合成洛替拉纳新的合成方法,该方法相对现有技术文件优势明显,并可从其中获益。
附图说明
图1:本发明的工艺路线图
具体实施方法:
下面将结合本发明实施例中,对本发明的实施例中的技术方案进行详细的说明,但如下实施例仅是用以理解本发明,而不能限制本发明,本发明可以由权利要求限定和覆盖的多种不同方式实施。
以下将结合本发明实施例1和5进一步说明洛替拉纳新的合成方法及该方法的优势。
实施例1:(Z/E)-3-甲基-5-(4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基)噻吩-2-甲酸(式a)的合成
步骤a:将5-乙酰基-3-甲基-2-溴噻吩(164.3g,0.75mol)、2,2,2-三氟-1-(3,4,5-三氯苯基)乙酮(208.1g,0.75mol)、三乙胺(151.8g,1.5mol)以及甲基叔丁基醚1.5L加入至干燥三口瓶中,搅拌加热至50-60℃反应2-3h,再冷却至室温反应10-12h。冷却至-10℃,控温-10℃~0℃滴加二氯亚砜(178.4g,1.5mol),滴毕,自然回温至室温反应10-12h,停止反应,搅拌下滴加饱和碳酸氢钠溶液1.5L,滴毕,加入乙酸乙酯2.0L搅拌分液,有机相先用2L水洗涤,再用饱和食盐水2.0L洗涤,有机相减压浓缩至干,残余物用无水乙醇-正己烷混合溶剂重结晶,烘干得到(Z/E)-1-(5-溴-4-甲基噻吩-2-基)-4,4-4-三氟-3-(3,4,5-三氯苯基)丁-2-烯-1-酮(301.5g,收率84%),Ms m/z 476.8(M+1)。
步骤b:氮气保护下,将步骤a制备的(Z/E)-1-(5-溴-4-甲基噻吩-2-基)-4,4-4-三氟-3-(3,4,5-三氯苯基)丁-2-烯-1-酮(239.3g,0.5mol)和无水四氢呋喃1L加入至干燥三口瓶中,搅拌冷却至-10℃,控温-10℃~0℃滴加乙基氯化镁的四氢呋喃溶液(2mol/L,375ml,0.75mol),滴毕,继续控温反应2-3h,控温-10℃~0℃缓慢通入干燥的二氧化碳气体至液面以下,至反应完全。控温-10℃~0℃滴加10%氯化钠水溶液600ml,随后继续控温-10℃~0℃滴加浓盐酸100ml析出大量固体,搅拌过滤,滤饼用二氯甲烷1L和5%碳酸氢钠溶液1L溶解,搅拌分液,水相加入1L二氯甲烷,用浓盐酸调ph至3-4,分液。有机相再用水1L洗涤,无水硫酸钠干燥,减压浓缩掉大部分溶剂,加入正己烷300ml搅拌分散,过滤,烘干,得到(Z/E)-3-甲基-5-(4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基)噻吩-2-甲酸(式a,190.8g,收率86%),Ms m/z 442.9(M+1)。
实施例2:(Z/E)-3-甲基-N-(2-氧代-2-((2,2,2-三氟乙基)氨基)乙基)-5-(4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基)噻吩-2-甲酰胺(式b)的合成法1
将(Z/E)-3-甲基-5-(4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基)噻吩-2-甲酸(式a,88.7g,0.2mol)和二氯甲烷0.8L加入至干燥三口瓶中搅拌溶解,室温滴加二氯亚砜(35.7g,0.3mol),滴毕,控温30-40℃反应2-3h,蒸干溶剂,加入二氯甲烷400ml继续蒸干;再加入二氯甲烷400ml继续蒸干,最后加入二氯甲烷300ml溶解残余物,得到酰氯溶液备用。
将2-氨基-三氟乙基-乙酰胺盐酸盐(46.2g,0.24mol)和二氯甲烷400ml加入至另一干燥三口瓶中,控温-5~5℃加入三乙胺(50.6g,0.5mol),加毕继续控温搅拌0.5h;控温-5~5℃加入上述备用酰氯溶液,加完后继续控温-5℃~5℃的反应2-3h,停止反应,加入水0.8L搅拌分液,有机相依次用5%碳酸氢钠溶液0.8L、水0.8L、水0.8L洗涤,无水硫酸钠40g干燥,有机相减压浓缩至干,残余物用乙酸乙酯-正己烷混合溶剂重结晶,烘干得到(Z/E)-3-甲基-N-(2-氧代-2-((2,2,2-三氟乙基)氨基)乙基)-5-(4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基)噻吩-2-甲酰胺(式b,98.9g,收率85%),Ms m/z 581.0(M+1),NMR(400MHz,CDCl
实施例3:(Z/E)-3-甲基-N-(2-氧代-2-((2,2,2-三氟乙基)氨基)乙基)-5-(4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基)噻吩-2-甲酰胺(式b)的合成法2
将(Z/E)-3-甲基-5-(4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基)噻吩-2-甲酸(式a,88.7g,0.2mol)、2-氨基-三氟乙基-乙酰胺盐酸盐(40.4g,0.21mol)、O-苯并三氮唑-四甲基脲六氟磷酸盐(HBTU,79.6g,0.21mol)和DMF 400ml加入至干燥三口瓶中搅拌均匀,室温加入三乙胺(50.6g,0.5mol),加完后继续室温反应1h,停止反应,搅拌下加入水0.8L,析出大量固体,过滤,滤饼水洗,烘干,用乙酸乙酯-正己烷混合溶剂重结晶,烘干得到(Z/E)-3-甲基-N-(2-氧代-2-((2,2,2-三氟乙基)氨基)乙基)-5-(4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基)噻吩-2-甲酰胺(式b,91.9g,收率79%),Ms m/z 581.0(M+1)。
实施例4:洛替拉纳的合成法1
在氮气下,将(Z/E)-3-甲基-N-(2-氧代-2-((2,2,2-三氟乙基)氨基)乙基)-5-(4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基)噻吩-2-甲酰胺(式b,87.3g,0.15mol)、(R)-N-苄基氯化奎宁(6.76g,0.015mol)及二氯甲烷1L搅拌溶解,冷却至-10℃,并控温-10~0℃依次滴加羟氨溶液(50%,18ml,0.30mol)、氢氧化钠溶液(40%,30ml,0.30mol),滴毕,继续控温-10~0℃反应20-24h,加入800ml水,搅拌分液,有机相再用800ml水洗涤一次,无水硫酸钠干燥,减压蒸干溶剂,残余物用无水乙醇-正己烷重结晶得到洛替拉纳(69.8g,收率78%),化学纯度99.1%,ee值99.5%。Ms m/z 596.0(M+1),NMR(400MHz,CDCl
实施例5:洛替拉纳的合成法2
在氮气下,将(Z/E)-3-甲基-N-(2-氧代-2-((2,2,2-三氟乙基)氨基)乙基)-5-(4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基)噻吩-2-甲酰胺(式b,87.3g,0.15mol)、(R)-N-苄基溴化奎宁(7.43g,0.015mol)及二氯甲烷1L搅拌溶解,冷却至-10℃,并控温-10~0℃依次滴加羟氨溶液(50%,18ml,0.30mol)、氢氧化钠溶液(40%,30ml,0.30mol),滴毕,继续控温-10~0℃反应20-24h,加入800ml水,搅拌分液,有机相再用800ml水洗涤一次,无水硫酸钠干燥,减压蒸干溶剂,残余物用无水乙醇-正己烷重结晶得到洛替拉纳(72.5g,收率81%),化学纯度99.2%,ee值99.3%。
本发明实施例1-5与现有技术文件洛替拉纳的合成路线相比较,采用不对称合成路线,路线更短,收率更高,且不对称相转移催化剂可容易通过市售获得,整个路线中无重金属催化剂使用,无苛刻反应条件,无异味试剂使用;该路线易于工业放大,对于洛替拉纳原料药的产业化意义重大。
以上仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种基于大数据的航空数据分析方法、设备及存储介质
- 数据分析诊断系统、装置、方法及存储介质
- 基于数据分析的资金处理方法、装置、存储介质和设备
- 基于数据分析的保险配置方法、装置、计算机设备及存储介质
- 基于大数据的数据分析方法、系统、装置及存储介质
- 基于大数据分析的线损治理方法、系统、装置和存储介质
