灌流球囊设计
文献发布时间:2023-06-19 11:39:06
本申请是分案申请,原申请的申请日为2016年9月13日,申请号为201680062155.5,发明名称为“灌流球囊设计”。
技术领域
本发明总体上涉及在瓣膜修复程序(手术,procedure)中用于促进血液通过心脏瓣膜灌流的装置和方法,并且更具体地涉及在将假体植入物递送至天然心脏瓣膜时允许血液流动通过其中的递送球囊。
背景技术
心脏瓣膜疾病是涉及心脏一个或多个瓣膜机能障碍的严重问题。该机能障碍自身可以以多种方式显示。例如,瓣膜狭窄是天然心脏瓣膜钙化或变窄。由此,天然心脏瓣膜不能完全打开,并且通过天然瓣膜的血流被阻挡或被限制。心脏瓣膜疾病的另一实例是瓣膜闭锁不全。瓣膜闭锁不全是天然心脏瓣膜不能适当关闭以防止通过瓣膜血液渗漏或回流。
多种方法已被开发以治疗心脏瓣膜疾病。这些方法中的一些需要在天然心脏瓣膜内扩张的球囊元件。例如,球囊元件可被用于瓣膜成形术程序中,其中球囊元件被定位在天然心脏瓣膜内,并被扩张以增加天然心脏瓣膜的开口尺寸(即,流动区域)并从而提高血液流动。可执行的另一程序是瓣膜置换,其中人造心脏瓣膜置换天然心脏瓣膜。人造心脏瓣膜在心脏中的植入也可涉及球囊元件在瓣环中的扩张。例如,球囊元件可用于在人造瓣膜植入之前增加天然瓣膜的尺寸,和/或其可用于扩张并部署人造瓣膜本身。
目前,一般利用单一球囊在微创心血管程序中部署心脏瓣膜或支架。然而,球囊元件在天然瓣膜或其它血管通道内的扩张可暂时封堵或限制通过该通道的血液流动。此外,在瓣膜置换的情况下,人造心脏瓣膜的定位可因左心室中的压力增长(buildup)而复杂。例如,在程序期间,在心脏仍在搏动(pumping)时,被封堵的血流会对球囊产生强大的力,降低了植入物的稳定性并使心脏瓣膜难以定位。因此,瓣膜成形术和瓣膜置换程序以及利用可扩张球囊元件的其它类似程序总体上必须被快速实施。使得球囊元件仅被膨胀短暂时间。快速心室起搏程序可用来增加稳定性,但该程序仅可被执行有限的时间跨度。
因此,需要在程序进行时能够使患者的血液流动通过通道的改进装置。这种装置将提高装置布置精确度,并降低对患者损伤的风险。
发明内容
本文公开了用于微创心血管程序中的改善的可膨胀结构的设计。这些可膨胀结构在心血管程序中促进血液灌流通过解剖结构,如心脏瓣膜。可膨胀结构由围绕中心位置或轴圆周地排列的多个球囊形成。这种排列的多个球囊因此形成血液流动通过的腔。多个中的每个球囊被塑形或被配置以稳定相邻球囊,限制其彼此相对移动。例如,一些实施方式可以梯形(keystone)形状描述球囊特征,该梯形形状限制了球囊朝向腔的向内移动。一些实施还可包括延伸通过腔的支撑线圈。该支撑线圈保持腔即使在球囊膨胀早期阶段也对灌流开放。本文还公开了使用该可膨胀结构的方法。
一个实施方式包括用于插入体腔并且血液流动通过其中的球囊导管。该球囊导管包括细长元件和多个球囊。细长元件限定膨胀腔,并具有近端和远端。多个球囊偶联至细长元件的远端。球囊还与细长元件的膨胀腔流体连通地连接。有利地,球囊径向(放射状,radially)围绕中心轴排列以形成腔。该腔在球囊膨胀时沿中心轴延伸。该腔被配置以使血液通过,并因此为患者的下游组织提供灌流。每个球囊包括非圆形横截面形状,该非圆形横截面形状具有相对于中心轴径向延伸的至少两个基本上笔直的侧部。每个基本上笔直的侧部至少部分地毗邻众球囊中相邻球囊的基本上笔直的侧部。以这种方式,这种相邻排列防止了球囊的移动和灌流腔的中断。
在另一方面中,球囊导管可包括支撑线圈。支撑线圈偶联至细长元件的远端,并在腔内在球囊之间沿中心轴延伸。支撑线圈至少部分地支撑处于其折绉和膨胀状态的球囊。支撑线圈可包括哑铃形状,该哑铃形状具有在其末端的球鼻型(bulbous)区、以及管状中心区。支撑线圈可包括球鼻型末端区处的大节距以促进血液通过其中。另外,球囊导管可包括植入物,如假体心脏瓣膜——其折绉在球囊和支撑线圈的管状中心区上。
在另一方面中,球囊的笔直侧部可在其朝向中心轴延伸时朝向彼此(在横截面中)会聚(收敛,converge)。这形成楔形状或梯形形状,稳定了径向相邻排列内的球囊。
在其它方面中,非圆形横截面形状可进一步包含内部和外部。内部在至少两个基本上笔直侧部的径向内端之间延伸。并且,外部在至少两个基本上笔直侧部的径向外端之间延伸。内部可被定位相邻于内腔以限定部分内腔。外部可长于内部,并且横截面形状可以是梯形形状。
在另一方面中,球囊的末端可具有在其之间限定的空间。该空间使球囊之间的腔与体腔中的血液流体连通地连接。例如,球囊末端可渐细至具有足够小直径的管以限定在其之间的空间。小直径管可组合成与细长元件的膨胀腔连通地连接的歧管。该歧管将用于球囊膨胀的流体通过其小直径管分离和分配。
在再另一方面中,球囊导管可包括多个联锁机构,该联锁机构定位在相邻对球囊之间。联锁机构可包括例如在球囊的笔直侧面上形成的相应U形的凸出和凹处。
球囊导管还可包括代用瓣膜,该代用瓣膜被配置以封堵在球囊末端之间限定的空间。这防止了血液回流通过球囊之间的腔。代用瓣膜可包括多个小叶,该小叶被配置以在血液回流期间延伸在所述空间上。小叶可进一步被配置以在血液顺流期间偏离所述空间。
使用一种实施方式的球囊导管的方法包括使细长元件延伸通过患者中的开口,直到细长元件的远端到达程序位点。流体通过膨胀腔流动到在程序位点处偶联至细长元件远端的多个球囊中。球囊以沿圆周相邻的排列膨胀,以形成沿球囊排列所围绕的轴延伸的灌流腔。球囊排列的稳定性通过使球囊的径向延伸笔直侧面互相毗邻来保持。血液从球囊圆周相邻排列的一端通过灌流腔被灌流,并被灌流至球囊圆周相邻排列的另一端。在一些实施中,程序位点是经心尖(transapically)、经股动脉、或经主动脉到达的心血管结构。
方法还可包括,在使球囊膨胀时,在排列的一端和另一端处的球囊之间限定空间,和使血液通过该空间灌流到灌流腔中。
方法可进一步包括通过使球囊膨胀,对心脏瓣膜的框架施力,从而扩张假体心脏瓣膜。
另外,方法可进一步包括将球囊支撑在延伸通过灌流腔的螺旋缠绕的线圈上。血液还可被灌流通过腔内的螺旋缠绕线圈。
附图说明
图1A–1C显示了用于递送安装在可膨胀结构上的假体植入物的递送导管组件。
图2A是折绉在可膨胀结构上并定位在心血管程序位点内的假体心脏瓣膜的侧视图。
图2B是膨胀后的图2A的可膨胀结构的侧视图,其已使假体心脏瓣膜扩张并且深色箭头显示可膨胀结构的球囊之间的血流。
图2C是沿图2B中的直线2C–2C截取的、膨胀后的可膨胀结构和扩张后的假体心脏瓣膜的横截面图。
图2D是沿图2B中的直线2D–2D截取的、膨胀后的可膨胀结构和扩张后的假体心脏瓣膜的横截面图,展示了纵向延伸通过可膨胀结构的中心区域的支撑线圈。
图3A是处于部分膨胀状态的可膨胀结构的实施方式示意图。
图3B是处于部分膨胀状态的可膨胀结构的另一实施方式示意图。
图4是被配置以纵向延伸通过可膨胀结构的中心的支撑线圈的侧视图。
图5A是包括定位在可膨胀结构的一端的闭合的代用(surrogate)瓣膜的可膨胀结构的实施方式侧视图。
图5B是其中代用瓣膜打开的图5A的可膨胀结构的侧视图。
图6A–6E是具有球囊的可膨胀结构实施方式的示意图,该球囊具有非圆形横截面并且径向围绕中心轴排列。
图7是可膨胀结构的另一实施方式的示意图,其包括定位在多个球囊的外表面周围的材料层。
图8是可膨胀结构的另一实施方式的示意图,其包括定位在腔和多个球囊之间的材料层。
图9是可膨胀结构的另一实施方式的示意图,其包括定位在球囊对之间的附接机构。
图10A–10D是来自不同可膨胀结构实施方式的个体球囊的示意图。
图11A是具有内部搭边(webbing)的个体球囊的示意图,其中个体球囊可以是较大可膨胀结构的一部分。
图11B是包括图11A的球囊的可膨胀结构的实施方式的示意图。
图12A是未膨胀的球囊的示意图。
图12B是膨胀后的图12A的球囊的示意图。
图13A是具有搭边的未膨胀球囊的示意图。
图13B是膨胀后的图13A的球囊的示意图。
图14A是包括联锁机构的球囊的示意图。
图14B是包括图14A的球囊的可膨胀结构的实施方式的示意图。
图15是用于制作图14A的球囊的模具的示意图。
具体实施方式
以下对医疗设备(例如,球囊导管组件)的某些实例的描述不应用于限制医疗设备的范围。该医疗设备的其它实例、特征、方面、实施方式、和优势将通过以下描述对本领域技术人员显而易见。将理解,该医疗设备能够实现没有偏离该医疗设备的精神的全部其它方面。因此,附图和描述应当被认为实质上是示例性的而非限制性的。
出于这种描述的目的,在此描述了本公开的实施方式的某些方面、优势、和新颖特征。所述方法、系统、和设备不应以任何方式被解释为限制。相反,本公开涉及各种公开实施方式的所有新颖和非显而易见的特征和方面——单独以及彼此各种组合和子组合。本公开的方法、系统、和设备不受限于任何具体方面、特征、或其组合,本公开的方法、系统、和设备也不要求任何一个或多个具体优势存在或问题被解决。
结合本发明的具体的方面、实施方式或实例描述的特征、整数、特性、化合物、化学部分、或基团将被理解为适用于本文描述的任何其它方面、实施方式或实例,除非与之不相容。本说明书(包括任何所附权利要求、摘要、和附图)中公开的所有特征和/或如此公开的任何方法或过程的所有步骤可以以任何组合进行组合——这种特征和/或步骤中至少一些相互排斥的组合除外。本发明不受限于任何前述实施方式的细节。本发明扩展到本说明书(包括任何所附权利要求、摘要、和附图)中公开的特征的任何一个新颖特征、或任何新颖组合,或如此公开的任何方法或过程的步骤的任何一个新颖步骤、或任何新颖组合。
应当理解,谈到通过引用并入本文的任何专利、出版物或其它公开材料(全部或部分)仅在所并入的材料与本公开中展示的现有定义、陈述、或其它公开材料不冲突的程度上被并入本文。因此,在必要的程度上,本文明确展示的公开内容替代通过引用并入本文的任何冲突材料。谈到通过引用并入本文但与本文展示的现有定义、陈述、或其它公开材料冲突的任何材料或其部分将仅在所并入的材料与现有公开材料之间不发生冲突的程度上被并入。
本文公开了用于在微创心血管程序中增加灌流的可膨胀结构,其增加了通过程序位点的血流和/或减少对快速心室起搏的需要。例如,可膨胀结构可用于微创经导管心脏瓣膜置换(TAVR)的程序,如美国专利号7,175,656(其全部内容通过引用并入本文)中描述的程序。
其它球囊已被设计以在心血管程序中通过在程序中并入血液可流动通过的中心腔来增强灌流。目前的灌流球囊设计,如美国专利号7,951,111中描述的灌流球囊设计,包括径向围绕中心腔定位的多个球囊。然而,这些球囊形状上是圆柱形的,并且可在天然瓣环或瓣膜对该结构施力时滑脱至中心腔中。不联系理论,发明人认为该移动是由球囊之间缺乏接触而导致的。膨胀后的圆柱形球囊仅在沿着各直径的顶点的线上相互接触,使其容易滑脱至中心腔中。
总体上,本文公开的可膨胀结构在程序中促进了血液通过解剖结构(如心脏瓣膜)的灌流。可膨胀结构由径向围绕中心开口排列的多个球囊形成。具体地,该多个球囊被排列以形成血液流动通过的腔。所述多个中的个体球囊具有促进该排列的形状。例如,当在横截面观察时,个体球囊可具有梯形或楔样形状。梯形或楔样形状限制了个体球囊可朝向腔向内移动的程度。一些实施方式还可包括延伸通过腔的支撑线圈,从而在球囊膨胀早期阶段保持腔的开放(打开,open)构型。本文还公开了使用该可膨胀结构的方法。
图1A–1C示例了递送导管组件1,其包括用于将假体植入物65(如假体心脏瓣膜)递送至患者的递送鞘63。应当理解,本文描述的递送组件1仅是示例性的,并且当然可以使用其它类似递送系统。递送组件1总体上包括可操纵的(steerable)引导导管67和延伸通过引导导管67的球囊导管7。引导导管67还可被称为弯曲导管、递送导管、或主导管。然而,术语主导管的使用应被理解为包括弯曲导管或引导导管以及不具有弯曲或引导通过患者脉管系统的能力的其它导管。
图1A–1C中示例的引导导管67和球囊导管7适于相对于彼此纵向滑动,以促进假体心脏瓣膜65在患者身体中的植入位点处的递送和定位,如下文详细描述。
引导导管67包括手柄部分68和从手柄部分68延伸的细长引导管或轴69(图1B)。出于示例目的,图1A显示了不具有引导管69的递送设备。图1B显示了在球囊导管7上从手柄部分68延伸的引导管69。球囊导管7包括手柄部分68相邻的近侧部分72(图1A)和从近侧部分72延伸并延伸通过手柄部分68和引导管69的细长轴74。手柄部分68可包括侧臂76,侧臂76具有与手柄部分68限定的腔流体连通的内部通道。
可膨胀球囊4被安装在球囊导管7的远端。如图1C中所示,递送组件1被配置以将折绉状态的假体心脏瓣膜65安装在球囊4的近侧,以将递送组件1和假体心脏瓣膜65插入患者的脉管系统中,这在美国专利号9,061,119(美国申请序号12/247,846,2008年10月8日提交)(其通过引用被并入本文)中被详细描述。由于假体心脏瓣膜65被折绉在与球囊4位置不同的位置处(例如,在本例中,假体心脏瓣膜65期望地被折绉在球囊4的近侧),假体心脏瓣膜65可被折绉至比假体心脏瓣膜65被折绉在球囊4上时可能的轮廓更小(更低度,lower)的轮廓。这个更小的轮廓允许外科医生更容易地导航(navigate)递送组件1(包括折绉的假体心脏瓣膜65)通过患者的脉管系统到达治疗位置。该折绉假体心脏瓣膜65的较小轮廓在导航通过患者脉管系统的特别狭窄的部分(如髂动脉)时是特别有帮助的。该较小轮廓还允许以增强的安全性治疗更广泛的患者群体。
图1C还示例了在引导管69和球囊导管7的细长轴74上延伸的可扩张鞘63。可扩张鞘63具有引导假体心脏瓣膜65通过的腔。在近端处,可扩张鞘63包括防止加压血液渗漏的止血瓣膜。递送组件1还包括用于与可扩张鞘63的近端连接的衬套78(图1B中所示)。
总体上,在使用期间,使可扩张鞘63穿过患者的皮肤(通常在导丝上),使得可扩张鞘63的远端区域插入血管(如股动脉)中,然后推进至更宽的血管(如腹主动脉)。然后将递送组件1插入可扩张鞘63中——通过先将鼻型件(nose piece)71插入通过鞘63的近端处的止血瓣膜进行。利用可操纵引导管69使球囊导管7的轴74和假体心脏瓣膜65推进通过到达鞘63的末端并到鞘63的末端外。在假体心脏瓣膜65通过鞘63的推进期间,假体心脏瓣膜65对鞘63施加径向向外方向的力,导致其扩张。随着假体心脏瓣膜65穿过可扩张鞘63,鞘63恢复至其原始非扩张构型。在递送组件1处于期望的程序位点时,使假体心脏瓣膜65扩张(例如,通过球囊膨胀或通过自扩张),以将装置植入患者的身体中。如果假体心脏瓣膜65被定位在球囊4近侧以缩小递送组件1的轮廓(如图1C中所示),则可将球囊4相对于假体心脏瓣膜65向近侧缩回,滑至假体心脏瓣膜65的腔中,以实现球囊4膨胀。
图2A显示了其中假体植入物65被安装在可膨胀结构2上的包含球囊导管7的血管的截面图。在这个实例中,假体植入物65是假体心脏瓣膜。可膨胀结构2和假体心脏瓣膜65已被引导通过患者的血管73以定位在患者的天然心脏瓣环75内,该天然心脏瓣环75由血管的增厚壁结构示意性表示。在图2A中,可膨胀结构2还未被膨胀,并且假体心脏瓣膜65还未被扩张。大箭头指示可膨胀结构2和假体心脏瓣膜65的外表面周围的血液流动。在其未被膨胀时,球囊导管7基本上不干扰血流。
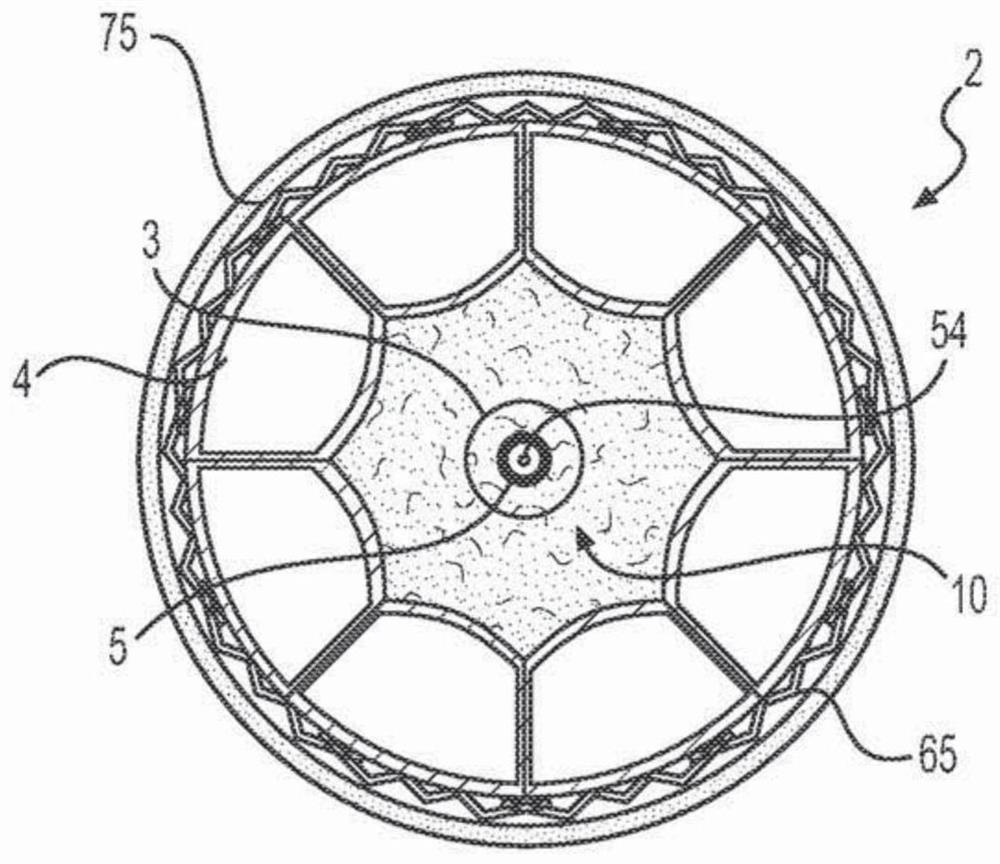
图2B显示了血管73的另一截面图,其中在天然心脏瓣环75内可膨胀结构2已被膨胀并且假体心脏瓣膜65已被扩张。可膨胀结构2包括多个径向排列的球囊4,球囊4形成腔10,腔10甚至在膨胀后也促进血流的通过,如图2C的横截面图(沿图2B的截面线2C–2C截取)显示。具体地,图2C显示了腔10中的阴影区域,其表示通过腔的血流。
在图2B中,黑色箭头表示在可膨胀结构2中相互间隔的球囊4末端之间流动的血液。具体地,球囊4在其末端处具有较小直径的渐细结构,该结构导致其之间的开口16,为血液从可膨胀结构2外至中心腔10提供进路(access)。
再次参照图2C,球囊4可被塑形以促进其围绕中心腔10排列的保持。一方面中,个体球囊4具有梯形或楔样横截面形状,该形状提供了平坦的径向方向的表面。这些表面因此允许球囊4以稳定的圆柱形构型、如同馅饼块(pie pieces)排列。因此,有利地,梯形或楔样形状限制了个体球囊4可以朝向腔10向内移动的程度。
可膨胀结构2可通过将个体球囊4布置为与球囊导管7的远端平行流体连通而形成。例如,个体球囊4(分别都具有延伸通过其中的膨胀腔)的近端30被热融合至球囊导管7的远端,以生成密封接头。密封接头包含捆束的末端,其中每个球囊4的膨胀腔在球囊导管7的膨胀腔处会聚成歧管构型,使得流体可在球囊导管7与球囊4的膨胀腔之间移动。
如图2A中所示,球囊4可被共同折迭(pleated)和折叠和折绉至相对小的轮廓,以递送至程序位点。例如,折绉的组件可呈现可被导航通过多种脉管系统并导航至植入位点的轮廓。导航路径可以例如是经股的、经心尖的、或经主动脉的。在到达程序位点后,流体(液体或气体)被引导通过球囊导管7,通过球囊导管7远端处的密封接头,该密封接头将流体分开并引导至多个球囊4的每一个中。在该方法的一些实施中,球囊4可同时膨胀以得到均匀的形状变化,如膨胀成图2C中显示的径向排列的可膨胀结构2。
在一些方法中,可植入装置,如置换心脏瓣膜或其它植入物,在导航通过患者脉管系统期间被定位在可膨胀结构2的外周周围。可膨胀结构2的膨胀导致心脏瓣膜或其它植入物扩张。可利用可膨胀结构2递送的其它医疗植入物包括,例如,支架或瓣膜成形术装置。然而,可膨胀结构2可以在不递送植入物的情况下使用,例如用于拓宽窄化或封堵了的血管或者狭窄了的天然心脏瓣膜。
如图2D(其是沿图2B中的截面线2D–2D截取的可膨胀结构2和假体心脏瓣膜65的部分横截面)中所示,球囊导管7可包括通过腔10并且在导丝54上延伸的支撑线圈3。支撑线圈3具有沿球囊导管7的长轴62以螺旋方向缠绕的丝(wire)或其它线状细长材料。
图4显示了从可膨胀结构2分离的支撑线圈3。支撑线圈3具有哑铃形状,其中管状中心区56连接球鼻型末端区58。支撑线圈3的中心区56具有致密的密集节距(dense pitch)以提供支撑、和窄于末端区58的直径从而为假体心脏瓣膜65折绉其上提供空隙(clearance)。中心区56的较小直径因而有助于在假体心脏瓣膜65被折绉或压缩其上时使球囊导管7的整体轮廓保持低度(low)。
每个末端区58的直径因而渐增直到达到最大直径,然后渐减大约回到与中心区56的直径匹配的直径。末端区58的节距较不致密,以促进血液流动通过丝(wire)和进入腔10中。另外,末端区58的较大直径部分有助于防止球囊4的末端封堵通过腔10的血液流动。可膨胀结构2的腔10的末端处通过末端区58的逐渐扩张的直径保持扩宽或张开。
在一些实施(如图3B中所示的实施)中,支撑线圈3消除了对导丝管5的需要。支撑线圈3因此提供腔10和导丝通道,而不增大可膨胀结构2的轮廓。例如,具有0.002英寸壁厚的支撑线圈3可替代具有0.007英寸壁厚的内部导丝管5,并且仍具有足够膨胀初始阶段期间导丝54通过和血液灌流的空间。
支撑线圈3可以以多种方式附接或偶联至球囊导管7。支撑线圈3的末端区58可被胶粘、搭接、或热融合至导丝管5、球囊4、和/或鼻型件71。在构建期间,可使支撑线圈3与导丝管5间隔,以保持可膨胀结构2的腔10即使在球囊4膨胀前也处于开放构型。在充分膨胀之前血液通过支撑线圈3灌流可膨胀结构2的能力防止了血液在结构2后方的积累。这在程序的定位阶段中增加了程序位点内的结构稳定性。
图3A和3B显示了膨胀早期阶段中各种实施方式的可膨胀结构2的横截面示意图。即使轻微程度的膨胀也会使腔10打开,为通过周围心血管结构的血流提供一定通道。例如,腔10的开口能够使血液在假体心脏瓣膜65递送和扩张期间流动通过天然心脏瓣膜和瓣环。支撑线圈3有助于保持腔10在早期膨胀阶段期间处于开放状态,通过防止血液积累和伴随的上游压力增加来提高结构的稳定性。
虽然图中示例了线圈,但支撑线圈3可用具有多孔性以允许或促进灌流的其它细长的中空结构代替。支撑线圈3可用编织管或选择性切割管代替。例如,管可被穿孔或被切割而具有孔、洞、或槽、或其组合。
由于灌流始于膨胀的初始阶段,相对于血液灌流被常规球囊堵住的情况,干预者有更多的时间来完成程序。干预者可缓慢并且小心地使球囊4膨胀,以提高植入物至瓣环的锚定。缓慢膨胀是有利的,因为其给予医师准确定位假体心脏瓣膜65的时间。缓慢膨胀还可为钙化的血管提供在附近组织最小限度破裂的情况下适应圆润瓣膜形状的时间。
在一些实例方法中,可通过仅部分地膨胀可膨胀结构2而部分地扩张经导管心脏瓣膜或其它医疗植入物。这为干预者提供了在完成膨胀和锚定植入物至组织之前重新定位植入物的机会。程序位点的灌流在装置重新定位期间存在,这导致对于患者安全性增加。
一些实施方式,如图5A–B中所示的那些实施方式,可包括代用瓣膜9,其附接在球囊4的近端的刚好近侧(近侧紧邻处,just proximal),用于经股动脉假体主动脉心脏瓣膜递送程序。在可膨胀结构2膨胀和灌流腔10打开后,代用瓣膜9介导灌流血液沿远侧方向(相对于导管)的回流。如图5A中所示,代用瓣膜9具有多个小叶77和基体79。基体79定位在可膨胀结构2的近端处,并附接至球囊导管7。小叶77在球囊4的外部上延伸,并且具体地可封堵近侧球囊末端之间的开口16。
在其它实施方式中,代用瓣膜9可定位在由可膨胀结构2的多个球囊4形成的腔10内。在这种构型中,小叶77在开口16内延伸。
代用瓣膜9沿球囊导管7身长的位置也可根据期望的程序而变化。例如,对于经心尖假体主动脉心脏瓣膜递送程序,期望主要灌流流为远侧方向(相对于导管)。因此,代用瓣膜9可被定位在可膨胀结构2的远端处——以萎缩和封堵开口16抵抗近侧方向的逆流。
无论如何,代用瓣膜9的小叶77在心舒期间采取闭合状态以防止血液回流通过程序位点,如图5A中所示。在心舒期间,代用瓣膜9的小叶77被流体压力推动打开以允许血液灌流通过程序位点,如图5B中所示。
代用瓣膜9可用可在正常血压下折叠和弯曲的多种薄的、挠性的并且生物相容性的材料制成。例如,代用瓣膜9可由与意图用于永久植入的组织系(tissue-based)瓣膜或假体瓣膜相同的材料或结构构建。在示例实施方式中,小叶77在其从基体79远离并在可膨胀结构2的渐增直径上延伸时张开成各组三指状伸出体(projections)。多个小叶77被排列在可膨胀结构2的外周周围。
可膨胀结构2的不同的另外的实施方式以图6A–E中的简化横截面示意图显示,以示例另外的稳定构型,促进球囊4保持其共同的、具有中心腔10的可膨胀结构2。在全部图6A–E中,多个球囊4被径向围绕中心轴8排列,形成腔10。球囊4的数目可变化——示例实施方式为6个或8个球囊4。然而,可膨胀结构2可由4个球囊4之少,或32个球囊4之多的球囊4制成。
图6A–E的简化横截面中显示的可膨胀结构2的每个球囊4的横截面均是非圆形的。每个所示横截面具有两个基本上笔直的侧部6。术语“基本上笔直的侧部”意图描述在以横截面观看时球囊4的外周的部分。基本上笔直的侧部6还可具有轴向方向的长度。一些实施方式可具有沿球囊4的整个长度的基本上笔直的侧部6。其它实施方式可具有仅沿球囊4的部分长度的基本上笔直的侧部6。
在膨胀的球囊4被径向排列以形成较大可膨胀结构2时,各基本上笔直的侧部6毗邻相邻球囊4的基本上笔直的侧部6。这种毗邻防止球囊4滑脱至可膨胀结构2的腔10中。尽管图6A–E所示的横截面显示了充分毗邻基本上笔直侧部6的球囊4,但在其它实施方式中,基本上笔直的侧部6可仅部分地毗邻。一些实施方式包括具有多于两个基本上笔直的侧部6的球囊4。
图6A–E中显示的每个球囊4的横截面还具有在至少两个基本上笔直的侧部6之间延伸的内部12和外部14。外部14的长度大于内部12的长度。这种宽度上的差异有助于楔形形状,并进一步防止球囊4滑脱至可膨胀结构2的腔10中。
在一些实施方式中,球囊4的横截面是多边形。例如,球囊4的横截面可以是梯形,如图6E中所示。在一些实施方式(如图6A和6B中显示的那些实施方式)中,球囊4的内部12向内弯曲至可膨胀结构2的腔10中。在一些实施方式(如图6C中显示的那些实施方式)中,内部12远离腔10向外弯曲。在一些实施方式(如图6D和6E中显示的那些实施方式)中,内部12基本上是笔直的。
球囊4的横截面的外部14可远离腔10向外弯曲,使得在其被组装并且膨胀成可膨胀结构2时,其将近似于圆柱体,如图6A-D中所示。球囊4的外部也可以是基本上笔直的,如图6E中。外部14还可朝向可膨胀结构2的腔10向内弯曲。总体上,于是,外部14可被塑形以适应脉管系统的预期几何结构或其意图扩张进入的其它体腔。
可膨胀结构2的尺寸还可依据具体应用而变化。例如,对于假体心脏瓣膜植入,在可膨胀结构2的外表面周围测量的周长可在约16至33毫米范围内,例如20、23、26、或29毫米。
一些实施方式(如图7中显示的实施方式)可包括在多个球囊4周围延伸的外层材料18(如套袋(sock)或套筒(sleeve))。外层材料18防止球囊4远离中心轴8移动和破坏多个球囊4的径向排列。外层18可由具有挠性的和顺应性的(conforming)材料形成,如,例如,塑料膜或编织网。总体上,外层材料18被塑形以顺应球囊4,或不干扰球囊4呈现可膨胀结构2的期望形状。外层材料18的厚度可以为0.010英寸或更少,以对递送导管组件1的轮廓的影响相对较低。
一些实施方式,如图8中显示的实施方式,包括内层材料20,其将球囊4的内表面与可膨胀结构2的腔10隔离。内层材料20防止球囊4朝向中心轴8向内移动和破坏多个球囊4的径向排列。内层材料20可由可具有挠性的和顺应性的材料形成,如,例如,塑料膜或编织网。内层材料20的厚度可以为0.010英寸或更少,以最小化腔10的尺寸减少。
可膨胀结构2,如图9中示意显示,可包括定位在球囊4的基本上笔直的侧部6之间的附接机构22。附接机构22可以是,例如粘合剂、或串(string)、带、缝线、丝、或粗糙表面、或使球囊4的径向排列稳定的任何其它机构。附接机构22可定位在球囊4的侧面之间,或其可跨越球囊4的内表面或外表面。附接机构22通过进一步减少一球囊相对于其它球囊4的移动来稳定球囊4围绕中心轴8的径向排列。
图10A–D显示了从较大可膨胀结构2分离的各种类型的球囊4的透视图。具体地,图10A–D中的球囊4具有不同的形状。例如,图10A显示了在与其它类似球囊4组装成可膨胀结构2时具有弯曲至腔10中的内表面13的球囊4。在与其它被类似构造的球囊4组装成可膨胀结构2时,可膨胀结构2将具有联想到(reminiscent of)图6A的横截面。
球囊4还具有第一端部分和第二端部分,该第一端部分和第二端部分具有基本平坦的表面28。球囊膨胀柱(balloon inflation leg)34从球囊4的第一端部分上的第一开口32和球囊4的第二端部分上的第二开口(未显示)延伸出去。在一些实施方式中,球囊开口沿延伸穿过平坦表面28的中心的共同轴存在。可选地,可根据膨胀和制造考虑使球囊开口与中心或共同纵轴存在空间偏离。开口和膨胀柱34为膨胀流体(inflation fluid)提供从导管的膨胀腔10流动至球囊4内部和反向去膨胀的管道。
图10B显示了从较大可膨胀结构2分离的球囊4的另一实施方式。图10B中的球囊4还具有弯曲到较大可膨胀结构2的腔10中的内表面13。在与其它球囊4组装成可膨胀结构2时,可膨胀结构2将具有联想到图6A的横截面。球囊4还具有第一端部分和第二端部分。第一端部分具有远离球囊4的主体部分40延伸变窄的锥形部38。一个端部分可具有锥形部38,而另一个端部分具有基本上平坦的表面28,如图10B中所示。或者,两个端部分都具有锥形部38。锥形部可介导(调解,mediate)较突兀的直径转变造成的球囊4的材料应力。
图10C–D显示了具有远离较大可膨胀结构2的腔10向外弯曲的内表面13的球囊4的实施方式。在与其它球囊4组装成可膨胀结构2时,可膨胀结构2将具有联想到图6C的横截面。图10C中的球囊4具有端部分,该端部分具有基本上平坦的表面28。图10D中的球囊4具有第一端部分,该第一端部分具有锥形部38;和第二端部分,该第二端部分具有基本上平坦的表面28。
图10A–10D中显示的球囊实施方式的主体部分40具有沿球囊4工作长度一致的横截面面积。然而,在一些实施方式中,主体部分40的横截面面积沿球囊长度变化——如通过具有渐细的主体部分。主体部分40的横截面面积可大于渐细端部分的横截面面积,如图10B和10D中所见。主体部分40的横截面面积也可小于端部分的最大横截面面积,从而形成扩大的末端以协助锚定球囊4或固定植入物。这些变化还可被配置以适配体腔或植入物的不同预期尺寸。
在一些实施方式中,可膨胀结构2可由沿较大可膨胀结构2的中心轴定位的多组球囊4构成。例如,第一组球囊4可径向围绕较大可膨胀结构2的中心轴8排列,并且第二组球囊4可径向围绕中心轴8排列并且纵向相邻于第一组球囊4定位。这允许例如可膨胀结构2构建成期望的直径和长度。
图11A显示了另一实施方式的横截面,其中球囊4具有延伸通过球囊4的内部44的搭边42。具体地,搭边42在笔直侧部6之间延伸,并连接笔直侧部6。图11B显示了另一可膨胀结构2实施方式的横截面,该可膨胀结构2实施方式由球囊4形成,该球囊4具有延伸通过其内部44的搭边42。
有利地,在膨胀后,搭边42促进侧部6保持基本上笔直的构型。例如,图12A显示了未膨胀的球囊4的横截面,以及图12B显示了膨胀后的相同球囊4的横截面。在膨胀后,球囊4的壁扩张,并且横截面变为圆形形状。同时,图13A中显示的未膨胀球囊4具有延伸通过内部44的搭边42。在膨胀后,如图13B中所示,球囊的侧部6保持其基本上笔直的构型。球囊4可具有多于一条搭边42,如图13A和13B中的延伸通过其内部44的两条搭边42。另外的搭边42可根据对于其对球囊形状影响的分配期望而使用。球囊4的壁的不同部分可被塑形——例如,成平坦状或挤挟状的(pinched)——通过使用更多搭边以满足患者的腔和/或可植入装置的不同形状。
图14A–B示意描绘了包括多个球囊4的可膨胀结构2,每个球囊4包括稳定化相邻球囊4以限制移动的联锁机构。联锁机构包括从第一球囊4的基本上笔直的侧部6延伸的凸出48。凸出48被塑形以嵌套在相邻第二球囊4的基本上笔直的侧部6中的凹处50内。例如,图14A中的凸出48具有圆形端指向笔直侧部6外的U形。相应地,凹处50具有圆形端指向球囊4中的U形。U形可以是延长球囊4主体长度的挤出形状,或者其可以是凹处50上以圆顶和相应特征为顶的圆柱形。
虽然图14A–B的实施方式的每个球囊4仅具有一个凸出和凹处,但球囊4可具有与相邻球囊4上多个凹处50对应的多个凸出48。多个凸出48和凹处50可在相邻球囊4表面之间径向地分布。例如,在诸如图14B示意图的横截面中,两个、三个或更多个凸出48可处于沿球囊4的相邻侧部6径向分隔的间隔处。多个凸出48和凹处50也可沿球囊4的长度分布。
凸出48和凹处50的形状和尺寸可基于诸如安全性期望和联锁容易的因素而变化。图14A–B中显示的联锁机构是圆顶形的,其有利地为球囊4的联锁提供了大表面区域。然而,凸出48和凹处50可被不同地塑形,并且仍然起着限制球囊4彼此相对移动的作用。例如,相邻球囊4的相对侧部6可具有被配置以相互啮合的互补Z形区段。
图15显示了用于制造具有联锁机构的球囊4的球囊模具52。球囊模具52由两个半部构成。该半部被接合在一起以形成腔体——例如利用压入配合销(press-fit pins)和/或固定螺钉。球囊模具52的腔体于是具有限定了以下的形状:内部12和外部14的弯曲形状、笔直的侧部6以及相应U形的一侧上凸出48和另一侧上凹处50。壁厚通过将轮廓较小但具有相应形状的心轴(mandrel)插入通过球囊模具52的腔体而设置。心轴的尺寸差异限定了球囊4的壁厚——心轴越小导致壁厚越大。
挤出过程通过以下进行:对具有开口的闭合壳体或管中的液体聚合物加压,该开口内固定了球囊模具52(具有延伸通过其中的心轴)的外周。随着压力积累,液体聚合物推动到心轴上且限定腔体的边缘下,以产生球囊的相应形状的壁结构。这个形状然后可在其末端处通过常规方法被密封。
球囊模具可由适于耐受形成塑性球囊所需高温的材料制成。该材料可包括但不限于铍铜和/或铜合金。球囊模具可利用机械加工、3D打印、或激光切割来制造,以产生具体球囊应用期望的腔体形状。
虽然已关于某个或某些实施方式对本公开进行了显示和描述,但显然在阅读和理解本说明书和附图后本领域其它技术人员将想到等同的改变或改动。具体地关于上文所述要素(构件、组件、装置、组合物等)执行的各种功能,用于描述这种要素的术语(包括“手段”的提及)意图对应于(除非另有说明)执行所述要素的指定功能(即,功能上等同)的任何要素,即使结构上不等同于在本文所示一个或多个示例性实施方式中执行该功能的公开结构。另外,尽管本公开的具体特征可能在上文中仅关于数个示例实施方式中的一个或多个被描述,但这种特征可结合其它实施方式的一个或多个其它特征——在可对任何给定或具体应用是期望的和有利的时。
- 灌流球囊设计
- 灌流球囊设计
