改进QuEChERS-UPLC-MS/MS测定食药两用物质中15种真菌毒素的方法
文献发布时间:2023-06-19 18:37:28
技术领域
本发明属于仪器检测技术领域,具体涉及一种改进QuEChERS-UPLC-MS/MS快速测定食药两用物质中15种真菌毒素的方法。
背景技术
经中国国家卫健委公布的食药两用物质不仅是传统的中药材,也是被人们广泛食用的食品。近年来,随着人民生活水平的提高,具有药用功效的食品越来越受到消费者的欢迎。因此,相较于普通的中药材,食药两用物质具有更高的使用频率。但是,食药两用物质在生长、收获以及储运过程中易受到霉菌的侵染,污染多种真菌毒素,严重影响了食药两用物质的安全性和有效性。因此,关注食药两用物质中霉菌、真菌毒素污染进而控制其品质、降低消费者的中毒风险是很有必要的。
真菌毒素(Mycotoxin)是由多种产毒霉菌在适宜的条件下产生的一类易引起人和动物病理变化和生理变态毒性很高的次级代谢产物,已发现的真菌毒素有400多种。近年来,有关食药两用物质中真菌毒素的报道层出不穷。在这400多种真菌毒素中研究比较深入的主要是污染率较高、毒性强、严重危害人类健康的黄曲霉毒素(AFs)、赫曲霉毒素(OTA)、伏马毒素(FBs)、脱氧雪腐镰刀菌烯醇(DON)、玉米赤霉烯酮(ZEN)、T-2毒素(T-2)、HT-2毒素(HT-2)等。这些真菌毒素不仅具有致癌、致畸和致突变作用,还具有肝细胞毒性、中毒性肾损害、生殖毒性及免疫抑制等作用,严重影响食药两用物质的质量和安全性,对人类健康造成极大威胁。
常见的且使用频率较高的食药两用物质主要有麦芽、薏苡仁、百合、莲子等,由于它们的基质成分复杂,在检测过程中基质效应较大,造成目标化合物回收率低、难检出等问题。因此选择一种合适的前处理方法显得尤为重要。目前真菌毒素检测的样品前处理方法主要有萃取法、QuEChERS方法、免疫亲和柱净化法等。但是,萃取法的溶剂使用量大、操作繁琐,免疫亲和柱净化法的成本高、耗时长。QuEChERS方法相对其他方法具有快速、简单、廉价、有效、可靠、安全等特点,是目前食药两用物质中真菌毒素检测前处理方法的较优选择。目前市场上针对农药残留的QuEChERS产品种类非常多,农药残留的QuEChERS技术已经相当成熟,但是专门针对真菌毒素检测的QuEChERS技术还不够成熟,选择适合真菌毒素净化的吸附剂是发展真菌毒素检测技术的关键。另一方面,由于食药两用物质均经过晒干或烘干,含水量较低。由于原始的QuEChERS方法主要针对一些含水量较大的物质(如果蔬类),且食药两用物质中含有大量色素、有机酸、多糖、蛋白等成分,因此原始的QuEChERS方法提取效率并不理想,需要对其组成及配比进行优化。此外,合适的提取溶剂不仅能减少样品中的杂质如脂肪和蛋白质等,降低基质效应,还可以提高回收率。在真菌毒素检测中,样品提取一般采用有机溶剂加水作为溶剂,提取液含水可以湿润基质,增强有机溶剂的渗透能力。但是,不同真菌毒素的性质有明显的差异,用一种提取溶剂同时提取多种真菌毒素时,每种真菌毒素的回收率也存在差异,所以提取溶剂的选择和优化十分重要。
真菌毒素检测方法主要有薄层色谱法(TLC)、酶联免疫法(ELISA)、液相色谱法(LC)以及液相色谱-质谱联用法(LC-MS/MS)等。TLC属于半定量技术,该方法灵敏度较低,重复性较差。ELISA适合单一真菌毒素的筛查,由于存在抗体之间的交叉反应和假阳性或者假阴性反应,无法用来进行多种真菌毒素的同时检测以及最终的确证。LC方法是目前进行真菌毒素检测的主流方法,多用于一种或者同类真菌毒素检测方面,但分析时间长、操作复杂。超高效液相色谱串联质谱法(UPLC-MS/MS)兼有色谱法分离效率高、分离速度快、定量分析简便的优点,又具有质谱法灵敏度高、定性能力强等特点,可同时达到定性、定量的检测目的。目前该方法在多种真菌毒素同时检测方面发展迅速。
发明内容
发明目的:针对现有技术中存在的一些问题,本发明提供了一种改进QuEChERS-UPLC-MS/MS快速测定食药两用物质中15种真菌毒素的方法,该方法前处理简便,检测过程不需要添加昂贵的同位素内标,成本低,检测时间短,主要解决了食药两用物质前处理复杂及困难的问题,而且弥补了多种真菌毒素在食药两用物质中的检测的不足。
技术方案:为了实现上述目的,本发明所述一种改进QuEChERS-UPLC-MS/MS快速测定食药两用物质中15种真菌毒素的方法,包括如下步骤:
(1)样品提取
以乙腈-乙酸水溶液作提取液,与食药两用物质样品混匀后超声处理,离心取样品上清液;
(2)样品净化
将QuEChERS净化剂加入到离心所得的样品上清液中,混匀再离心取上清液,吹干;
(3)UPLC-MS/MS检测
用甲醇溶液复溶,过滤膜后进UPLC-MS/MS检测,同时配制混合标准工作溶液对15种真菌毒素进行定量分析。
其中,步骤(1)中以60%~90%的乙腈-乙酸水溶液作提取液,按照1:10~1:20的料液比(g/mL)对食药两用物质样品中的15种真菌毒素进行提取,提取溶液和样品涡旋1~5min后,超声波处理10~30min离心后得到样品上清液。
作为优选,步骤(1)中以含1%乙酸的80%乙腈水溶液为提取液,料液比为1:20(g/mL),涡旋1min,超声波处理20min。
其中,步骤(1)中所述食药两用物质样品包括麦芽、薏苡仁、莲子和百合中任意一种或者多种。
其中,步骤(1)中食药两用物质样品中的15种真菌毒素包括黄曲霉毒素B
其中,步骤(2)中所述QuEChERS净化剂组成及比例为:200~300mg的无水MgSO
作为优选,步骤(2)中所述QuEChERS净化剂组成及比例为:240mg的无水MgSO
其中,步骤(2)中QuEChERS净化剂与样品上清液中的比例为35:1~70:1(mg/mL);涡旋1~3min混匀后,再离心取上清液,取2-10mL,在40~50℃下氮气吹干。
作为优选,步骤(2)中QuEChERS净化剂与样品上清液中的比例为505:10(mg/mL);涡旋1min混匀后,再离心取上清液,取5mL,在45℃下氮气吹干。
其中,步骤(3)用体积分数10%~50%甲醇溶液复溶,过0.22μm滤膜后进UPLC-MS/MS检测。
作为优选,步骤(3)中体积分数甲醇溶液的浓度为35%。
其中,步骤(3)中的中UPLC-MS/MS的液相色谱条件为:
(1)流动相:A相甲酸-乙酸铵水溶液,B相甲醇;流速:0.1~0.3mL/min;柱温:25~40℃;进样量:1~5μL;
(2)洗脱梯度程序如下:
作为优选,步骤(3)中UPLC-MS/MS的液相色谱条件为:流动相A相为0.1%甲酸-1mM乙酸铵水溶液;流速0.2mL/min;柱温40℃;进样量1μL。洗脱梯度程序为0~5min,80%~5%A;5~9min,5%A;9~10min,5%~80%A;10~15min,80%A。
其中,步骤(3)中UPLC-MS/MS的质谱条件为:
(1)离子源:电喷雾离子源(ESI);
(2)扫描方式:正负离子同时;
(3)监测方式:多反应监测(MRM);
(4)接口电压:3.0~5.0kV;
(5)离子源温度:280~320℃;
(6)脱溶剂温度:500~550℃;
(7)雾化气流量:2.5~3.5L/min;
(8)加热气流量:8~12L/min。
作为优选,步骤(3)中UPLC-MS/MS的质谱条件为:
(1)离子源:电喷雾离子源(ESI);
(2)扫描方式:正负离子同时;
(3)监测方式:多反应监测(MRM);
(4)接口电压:4.0kV;
(5)离子源温度:300℃;
(6)脱溶剂温度:526℃;
(7)雾化气流量:3.0L/min;
(8)加热气流量:10L/min。
进一步地,步骤(3)中15种真菌毒素的多反应监测离子对及质谱相关参数如表1所示:
表1 15种真菌毒素的质谱条件
*为定量离子。
本发明重点是首先针对个别毒素回收率偏低的问题,选取并优化了提取溶剂,并针对食药两用物质基质复杂的问题,开发了成本低、操作简便且净化效果好的前处理方法,此外,建立了多种真菌毒素同时检测的UPLC-MS/MS方法,在不使用同位素内标的情况下,仍然可以获得良好的灵敏度、准确度和精密度。而且由于采用的是超高效液相系统,大大提高了分离效率,缩短了分析时间,6min之内即可完成对15种真菌毒素的分析。本发明的前处理方法是采用特定比例的净化剂,净化剂的添加量需适当控制,添加过量会导致样品中的真菌毒素被吸附,检测结果不准确,添加过少则会导致杂质吸附不完全,净化效果不明显。而食药两用物质基质复杂,含有大量的植物色素、酸类、糖类、蛋白等,因此需要通过特定的调整净化剂的配比来实现最佳的净化条件,在最大程度去除杂质的基础上,还要保证检测结果的准确性。
本发明作为同时检测多种真菌毒素的方法,尤其是在食药两用物质这种复杂基质的样本,本发明的方法在前处理中没有使用价格昂贵的免疫亲和柱进行净化,而是用价格便宜的净化剂,不仅免去了免疫亲和柱繁琐的活化、洗涤、洗脱等步骤,还大大降低了检测成本,而且更适用于大批量样本的检测。另外,在后续的检测中,本发明也不需要使用价格昂贵的同位素内标进行结果校正,也可以做到良好的回收率和精密度。由于超高效液相色谱的引入,也大大提高了分离效率,缩短了检测时间;同时精密度高重复性好。本发明采用非常简化、便宜的前处理实现了多种真菌毒素的同时检测。
有益效果:与现有技术相比,本发明具有如下优点:
本发明以乙酸-乙腈-水溶液对食药两用物质中15种真菌毒素进行提取,并针对食药两用物质基质复杂的问题,选用了成本低、操作简便且净化效果好的QuEChERS净化包进行净化,本发明通过调整净化剂的配比来实现最佳的净化条件,在最大程度去除杂质的基础上,保证检测结果的准确性,最后建立了多种真菌毒素同时检测的UPLC-MS/MS方法,在不使用同位素内标的情况下,获得良好的灵敏度、准确度和精密度。而且由于采用的是超高效液相系统,大大提高了分离效率,缩短了分析时间。本发明有效提高了样品的净化程度,提高了检测效率,简化了操作过程,灵敏度高、重复性好、准确度高,成本较低。可作为检测食药两用物质中真菌毒素含量的可靠方法。
附图说明
图1为本发明实施例1中15种真菌毒素的总离子流图;
图2为本发明实施例1中15种真菌毒素的多反应监测色谱图;
图3为本发明实施例2中,以1mM乙酸铵水溶液和0.1%乙酸-1mM乙酸铵水溶液作流动相A相时,FB
图4为本发明实施例2中,以0.1%乙酸-1mM乙酸铵水溶液和0.1%甲酸-1mM乙酸铵水溶液作流动相A相时,FB
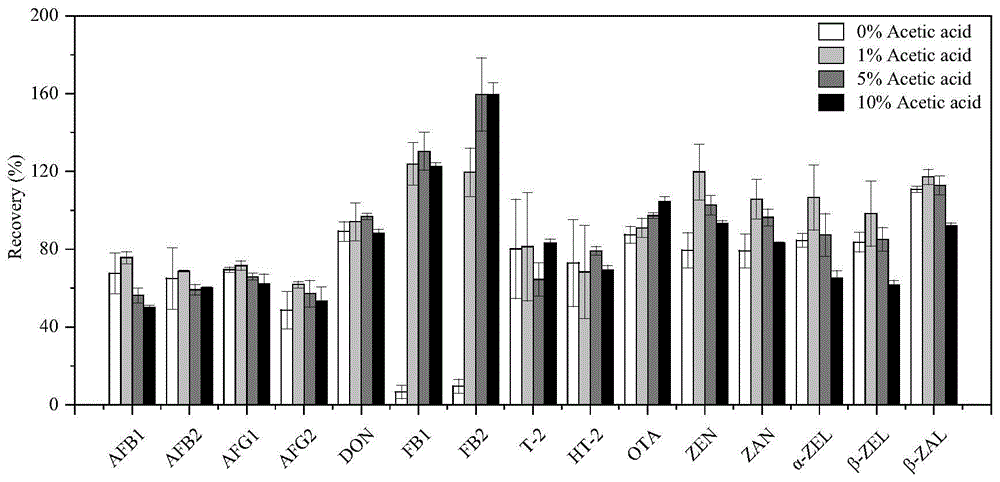
图5为本发明实施例3中,不同提取溶剂对15种真菌毒素回收率的影响;
图6为本发明实施例5中,麦芽、薏苡仁、莲子和百合对真菌毒素的基质效应考察。
具体实施方式
实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可从商业途径获得。
下述实施例中,所用的超高效液相色谱串联质谱仪为岛津LCMS-8050系列(SHIMADZU),色谱柱为Shim-pack GIST C
15种真菌毒素标准品(纯度99.9%),江苏美正生物科技有限公司;甲醇(质谱级)、乙腈(色谱级),上海麦克林公司;甲酸(质谱级),美国Fluka公司;乙酸铵(质谱级),美国Aladdin公司。
薏苡仁、莲子、麦芽、百合常规市售。
实施例1
质谱条件的优化
本实施例提供的15种真菌毒素的检测方法包括下列步骤:
将黄曲霉毒素B
实施例2
色谱条件的优化
本实施例提供的15种真菌毒素的检测方法包括下列步骤:
将黄曲霉毒素B
超高效液相色谱条件为:色谱柱Shim-pack GIST C
表2流动相洗脱程序
以甲醇为流动相B时,考察了A相为1mM乙酸铵水溶液、0.1%乙酸-1mM乙酸铵水溶液和0.1%甲酸-1mM乙酸铵水溶液时,15种真菌毒素的峰形及分离效果。结果发现,流动相加酸前后对FB
实施例3
提取溶剂的优化
合适的提取溶剂不仅能减少样品中的杂质如脂肪和蛋白质等,降低基质效应,还可以提高回收率。在真菌毒素检测中,样品提取一般采用有机溶剂加水作为溶剂,提取液含水可以湿润基质,增强有机溶剂的渗透能力。但是,不同真菌毒素的性质明显差异,用一种提取溶剂同时提取多种真菌毒素时,每种真菌毒素的回收率可能存在较大差异。为了使15种真菌毒素都能获得满意的回收率,需要对提取溶剂进行优化。
本实施例提供的优化的提取溶剂包括下列步骤:
考察了乙腈-水体系或乙腈-水加酸体系对15种真菌毒素提取率的影响,包括含0%、1%、5%和10%乙酸的80%乙腈水溶液,上述比例均为体系中的体积分数。
样品溶液的制备:以不含有真菌毒素的薏苡仁作为空白样品,向其中加入一定浓度的15种真菌毒素的混合标准溶液,获得加标样品,其中真菌毒素的终浓度为:AFB
UPLC-MS/MS检测条件:流动相A相为0.1%甲酸-1mM乙酸铵水溶液,B相为甲醇,流速为0.2mL/min,柱温40℃,进样量1μL,流动相洗脱梯度程序如上述表2。
质谱条件为:接口电压4.0kV、离子源温度300℃、脱溶剂温度526℃、雾化气流量3.0L/min,加热气流量10L/min。离子源为电喷雾离子源(ESI);扫描方式为正负离子同时扫描;监测方式为多反应监测(MRM),15种真菌毒素的多反应监测离子对及质谱相关参数如表1所示。
从回收实验的结果(图5)来看,酸浓度的变化对真菌毒素的提取率有很大影响,尤其是FB
实施例4
QuEChERS净化剂配比优化
本实施例提供的优化的QuEChERS净化剂配比包括下列步骤:
本发明前期检测了不同的食药两用物质样品,并筛选出不含有真菌毒素的薏苡仁作为空白样品,向其中加入一定浓度的15种真菌毒素的混合标准溶液,获得加标样品,其中真菌毒素的终浓度为:AFB
由表3可知,QuEChERS净化剂A的加标回收率不理想。使用QuEChERS净化剂B作前处理后,回收率有显著改善,因此选择QuEChERS净化剂B为最优配比。
表3不同配比的QuEChERS净化剂的加标回收实验
实施例5
基质效应的考察
由于本发明采用LCMS进行检测,使用的是ESI源,样品中的复杂基质对ESI源的干扰很大,所以需要先考察样本的基质效应,否则会影响方法的回收率,即准确性。
本实施例提供的15种真菌毒素的检测方法包括下列步骤:
基质样品溶液的制备:选择不含有15种真菌毒素的薏苡仁、莲子、麦芽、百合作为样品基质,以含1%乙酸的80%乙腈水溶液作提取液,按照1:20(g/mL)的料液比,涡旋1min后,超声波处理20min,8000rpm离心5min后得到样品上清液;将QuEChERS净化剂加入到离心所得的样品上清液中,涡旋1min,再以8000rpm离心5min,取上清液5mL,在45℃下氮气吹干。用1mL的35%甲醇溶液复溶,过0.22μm滤膜后分别得到薏苡仁、莲子、麦芽、百合的基质溶液。
溶剂标准曲线的配制:将黄曲霉毒素B
基质匹配标准曲线的配制:麦芽、薏苡仁、莲子和百合的空白样品按样品制备方法处理后,分别得到麦芽基质空白溶液、薏苡仁基质空白溶液、莲子基质空白溶液、百合基质空白溶液。吸取适量标准储备液,利用基质空白溶液将标准储备液稀释成一系列浓度梯度的混合标准曲线工作液,现配现用。
基质效应考察:以各真菌毒素的浓度为横坐标,相应峰面积为纵坐标,绘制标准曲线并得到线性方程。根据计算公式(1),得到每种真菌毒素分别在麦芽、薏苡仁、莲子和百合基质中的基质效应。
基质效应(%)= 100 ×(Ka/Kb - 1) 公式(1)
式中,Ka表示基质匹配标准曲线的斜率,Kb表示溶剂标准曲线的斜率。基质效应在±20%以内认为可以忽略,否则应进行基质匹配来消除基质效应,以准确定量。如图6所示,麦芽、薏苡仁、莲子和百合对大部分真菌毒素均具有很强的基质效应,因此不可忽略,需用基质匹配标曲来消除基质效应。
各真菌毒素标准曲线工作液的浓度如表4所示。
表4 15种真菌毒素混合标准曲线工作液的浓度
实施例6
方法学考察
本实施例提供的15种真菌毒素的检测方法包括下列步骤,并按上述实施例的各个最优条件进行检测:
样品溶液的制备:以不含有真菌毒素的薏苡仁作为空白样品,向其中加入一定浓度的15种真菌毒素的混合标准溶液。
以含1%乙酸的80%乙腈水溶液作提取液,按照1:20(g/mL)的料液比对食药两用物质样品中的15种真菌毒素进行提取,涡旋1min后,超声波处理20min,8000rpm离心5min后得到样品上清液;将QuEChERS净化剂B加入到离心所得的样品上清液中(净化剂与样品上清液中的比例为505:10(mg/mL)),涡旋1min,再以8000rpm离心5min,取上清液5mL,在45℃下氮气吹干。用1mL的35%甲醇溶液复溶,过0.22μm滤膜后进UPLC-MS/MS检测。
UPLC-MS/MS检测条件:流动相A相为0.1%甲酸-1mM乙酸铵水溶液,B相为甲醇,流速为0.2mL/min,柱温40℃,进样量1μL。流动相洗脱梯度程序如上述表2所示。
质谱条件为:接口电压4.0kV、离子源温度300℃、脱溶剂温度526℃、雾化气流量3.0L/min,加热气流量10L/min。离子源为电喷雾离子源(ESI);扫描方式为正负离子同时扫描;监测方式为多反应监测(MRM),15种真菌毒素的多反应监测离子对及质谱相关参数如表1所示。
将黄曲霉毒素B
选取空白薏苡仁样品,分别添加低、中、高水平(加标水平详见表5,直接采用毒素标准品按质量比加入基质中)混合标准溶液,按照样品制备方法进行前处理,每个添加水平做3次平行实验,结果见表5。结果显示,三个不同添加水平的回收率在61.99%~113.50%之间,相对标准偏差在1.60%~19.55%之间,表明本方法准确度好,精密度高,并且检测限低。
表5薏苡仁中真菌毒素加标回收实验
实施例7
按照实施例6的方法,将薏苡仁样品替换为麦芽,结果见表6。麦芽中15种真菌毒素的回收率范围为65.51%~118.76%,精密度范围为0.78%~15.78%,表明本发明建立的检测方法准确性好,精密度高,检测限低。
表6麦芽中真菌毒素加标回收实验
实施例8
按照实施例6的方法,将薏苡仁样品替换为莲子,结果见表7。莲子中15种真菌毒素的回收率范围为61.51%~116.27%,精密度范围为0.96%~18.47%,表明本发明建立的检测方法准确性好,精密度高,检测限低。
表7莲子中真菌毒素加标回收实验
实施例9
按照实施例6的方法,将薏苡仁样品替换为百合,结果见表8。百合中15种真菌毒素的回收率范围为61.04%~118.75%,精密度范围为0.68%~18.26%,表明本发明建立的检测方法准确性好,精密度高,检测限低。
表8百合中真菌毒素加标回收实验
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 一种药食两用种子类中药材中的真菌毒素的分析方法
- 一种QuEChERS前处理结合LC-MS/MS测定粮谷中的真菌毒素的检测方法
