一种安达曼链霉菌PL25及其在防治小麦赤霉病中的应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及微生物防治技术领域,更具体地说,它涉及一种安达曼链霉菌PL25及其在防治小麦赤霉病中的应用。
背景技术
小麦是全球三大谷物之一,种植面积最为广泛,也是我国重要的经济粮和储藏粮,并在国民经济中起着重要作用。小麦赤霉病是由禾谷镰刀菌等多种镰刀菌属真菌侵染引起的小麦重要病害。近年来,由于气候和耕作制度变化,小麦赤霉病流行成灾,危害程度不断加深。小麦赤霉病除造成小麦减产外,还会产生脱氧雪腐镰刀菌烯醇和玉米赤霉烯酮等多种镰刀菌毒素。人类和牲畜一旦误食了含有这些毒素的小麦,就会产生一系列的中毒反应,严重时甚至导致死亡。目前,使用有益微生物和拮抗菌对小麦赤霉病进行防治是一种高效兼环境友好型的生物防治方法,具有较大的应用潜力。
几丁质,俗称甲壳素,广泛存在于微生物、植物及动物个体中,是真菌、藻类的细胞壁及虾、蟹、昆虫等动物外壳的主要组成成分。几丁质酶是一种能够将几丁质彻底降解为N-乙酰氨基葡萄糖单体或寡聚体的糖苷水解酶,能够直接降解真菌细胞壁的主要组分之一—几丁质,使菌丝生长受阻。植物真菌病害一直是影响我国农业生产和食品安全的重要问题。化学杀菌剂的使用带来了严重的环境问题。因此,越来越多的人将目光投向了生物防治。大多数植物病原真菌的细胞壁中主要成分为几丁质,这就使几丁质酶活性菌成为了潜在的抗真菌生防菌株。
细菌是几丁质酶的重要来源,已被鉴别的几丁质酶产生菌主要包括气单胞菌属、沙雷氏菌属、肠杆菌属、芽胞杆菌属等,已有研究表明几丁质酶活性菌对多种病原真菌都具有一定的抑制活性,能作为较好的生物防治剂,为了满足市场的需求,进一步挖掘更多的生物防治剂,因此亟需一种能对多种植物病害尤其是小麦赤霉病有较强抑制作用的生防菌。
因此,为了解决上述技术问题本申请提出一种安达曼链霉菌PL25及其在防治小麦赤霉病中的应用。
发明内容
针对现有技术存在的不足,本发明的目的在于提供一种安达曼链霉菌PL25及其在防治小麦赤霉病中的应用。
为实现上述目的,本发明提供了如下技术方案:一种安达曼链霉菌PL25的制备,其特征在于:包括如下步骤:
S1:选取实验材料,选取红树林根际土进行实验;
S2:生防菌的分离纯化,挑取不同形态特征的单菌落进行多次纯化,纯化后的单菌落细菌悬浮于80%的甘油中,置-80℃超低温冰箱中保存;
S3:几丁质酶活性测定,包括如下步骤:
a、胶体状几丁质的制备,胶体状几丁质的制备:20g甲壳素溶于350mL浓盐酸,4℃放置24h,玻璃棉过滤,滤液加入2L冰无水乙醇(-20℃过夜),10000r/min离心20min,沉淀用自来水冲洗,直至pH值为中性,冷冻干燥,-20℃密封保存;
b、胶体状几丁质为唯一碳源的培养基,在培养基平板上放入灭过菌的滤纸片,两侧滤纸片点悬浮好的菌液,另外两侧点无菌水作为对照,重复3次,28℃培养5d后观察有无透明圈,测量透明圈的内径和外径;
S4:几丁质酶活性生防菌的筛选,采用平板对峙培养法,以禾谷镰刀菌为靶标菌,对以上步骤筛选得到的具有几丁质酶活性的菌株进行复筛;
S5:产酶和产嗜铁素能力测定,包括如下步骤:
a、蛋白酶活性测定,挑取处于生长旺盛期的菌株点于蛋白培养基(A:脱脂奶粉8g,溶于300mL水中,121℃灭菌10min;B:琼脂8g,定容至300mL,121℃灭菌20min,A与B分别灭菌后趁热混匀),无菌水作为对照,接菌后28℃培养3d观察透明圈有无,分别记录透明圈的内径和外径;
b、β-1,3-葡聚糖酶活性测定,挑取处于生长旺盛期的菌株点于葡聚糖平板上(β-1,3-葡聚糖0.1g,TSB 0.4g,琼脂1.6g,4g/L的刚果红1mL,定容至100mL),无菌水作为对照,接菌后28℃培养3d,观察并测量其透明圈的内径和外径;
c、纤维素酶活性测定,挑取处于生长旺盛期的菌株点于纤维素酶活性测定平板(蛋白胨10g,酵母粉10g,羧甲基纤维素钠10g,氯化钠5g,磷酸二氢钾1g,琼脂18g,定容至1000mL,pH=7.0),无菌水作为对照,28℃培养3d后,用1g/L的刚果红染1h后,倒掉染液后,用1mol/L的NaCl浸泡1h。检测透明圈的有无并且测量其内径和外径;
d、产嗜铁素能力测定,A:1,60.5mg CAS(铬天青S)溶于50mL去离子水;2,10mL三价铁溶液(1mmol/LFeCl3.6H2O,10mmol/L盐酸为溶剂);3,72.9mg HDTMA溶于40mL去离子水。上述三个溶液混合定容至100mL,pH调至中性,121℃灭菌20min。B:30.24g Pipes加入900mLWA培养基,12g 50%(W/V)的NaOH溶液将培养基pH值调至6.8,121℃灭菌20min。A,B液趁热混匀倒平板,牙签挑取处于生长旺盛期的菌株点于平板,无菌水作为对照,接菌28℃培养5d观察并测量透明圈内径和外径;
S6:菌株鉴定包括如下步骤:
a、形态鉴定,将具有拮抗效果的菌株在LB固体培养基上用三线法活化,28℃下培养2d,对菌落形态进行观察,经革兰氏染色后,在光学显微镜下对菌体形态进行观察;
b、生理生化鉴定,对菌株进行生理生化测定。测定的生理生化特性包括:碳源利用试验、M.R.试验、V.P.试验、硫化氢生成实验、硝酸盐还原实验、明胶液化、过氧化氢酶、淀粉酶;
c、分子鉴定,利用16S rDNA通用扩增引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′,SEQ ID NO:2;1492R:5′-TACGGCTACCTTGTTACGACTT-3′,SEQ ID NO:3)进行菌落PCR。PCR反应条件为:95℃预变性3min;95℃变性15s,56℃退火15s,72℃延伸2min,35个循环,最后72℃延伸5min。将获得的PCR产物进行测序,将测得序列在NCBI数据库进行BLAST比对分析,并从GenBank数据库获得同源性高的相关菌株的基因序列,利用MEGA11软件进行序列多重比对,采用邻接法(Neighbor-joining)构建系统发育进化树,最终确定菌株的分类地位。
优选地,一种安达曼链霉菌PL25在防治小麦赤霉病中的应用,包括如下步骤:
S1:菌株PL25对小麦的促生作用的测定;
S2:菌株PL25对小麦赤霉病大田防效测定;
S3:菌株PL25发酵提取物对禾谷镰刀菌的抑制作用;
S4:菌株PL25对病原菌菌丝形态的影响;
S5:菌株PL25对病原菌孢子萌发的影响;
S6:菌株PL25对病原菌细胞膜完整性的影响;
S7:菌株PL25对病原菌菌丝内ROS积累的影响;
S8:实验数据统计与分析。
与现有技术相比,本发明具备以下有益效果:
本研究从红树林土壤中筛选得到的链霉菌PL25对病原菌具有较好的抑制效果,具有较大生防潜力,对菌株PL25的作用机制进一步研究表明,菌株PL25能抑制禾谷镰刀菌孢子的萌发,破坏禾谷镰刀菌菌丝的形态结构,从而抑制病原菌的生长。此外,它还可以破坏质膜完整性,诱导ROS积累。本发明为链霉菌PL25的生防菌剂的开发及其对小麦赤霉病的防治提供了理论依据,也为丰富红树林土壤来源的农业生防菌株资源提供参考。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本申请的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
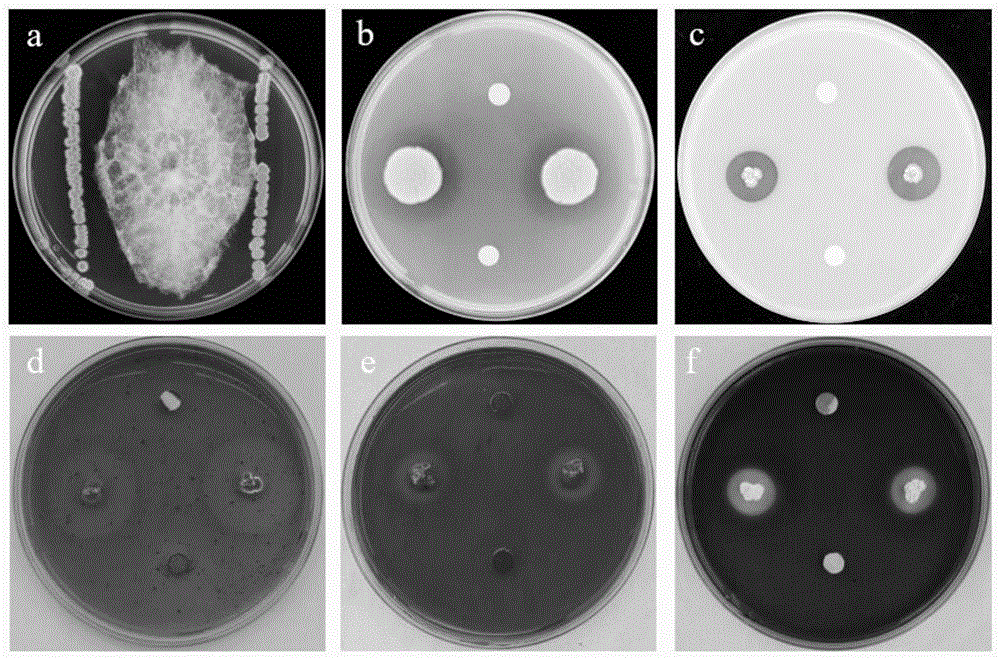
图1菌株PL25对禾谷镰刀菌的拮抗作用及其产酶和产嗜铁素能力测定结果;
图2菌株PL25在培养基上的形态和革兰氏染色结果;
图3显示基于16SrDNA基因序列构建菌株PL25的系统发育树;
图4显示菌株PL25对小麦赤霉病的大田防治效果;
图5菌株PL25发酵提取物对禾谷镰刀菌的抑制作用;
图6显示菌株PL25对菌丝形态的影响的结果;
图7显示菌株PL25对菌丝细胞膜完整性的影响的结果;
图8显示菌株PL25对菌丝内ROS积累的影响的结果;
图9为PL25的16S基因序列。
具体实施方式
如图1-9所示,本发明提供了一种安达曼链霉菌PL25及其在防治小麦赤霉病中的应用。
一种安达曼链霉菌PL25的制备,其特征在于:包括如下步骤:
S1:选取实验材料,选取红树林根际土进行实验;
S2:生防菌的分离纯化,挑取不同形态特征的单菌落进行多次纯化,纯化后的单菌落细菌悬浮于80%的甘油中,置-80℃超低温冰箱中保存;
S3:几丁质酶活性测定,包括如下步骤:
a、胶体状几丁质的制备,胶体状几丁质的制备:20g甲壳素溶于350mL浓盐酸,4℃放置24h,玻璃棉过滤,滤液加入2L冰无水乙醇(-20℃过夜),10000r/min离心20min,沉淀用自来水冲洗,直至pH值为中性,冷冻干燥,-20℃密封保存;
b、胶体状几丁质为唯一碳源的培养基,在培养基平板上放入灭过菌的滤纸片,两侧滤纸片点悬浮好的菌液,另外两侧点无菌水作为对照,重复3次,28℃培养5d后观察有无透明圈,测量透明圈的内径和外径;
S4:几丁质酶活性生防菌的筛选,采用平板对峙培养法,以禾谷镰刀菌为靶标菌,对以上步骤筛选得到的具有几丁质酶活性的菌株进行复筛;
S5:产酶和产嗜铁素能力测定,包括如下步骤:
a、蛋白酶活性测定,挑取处于生长旺盛期的菌株点于蛋白培养基(A:脱脂奶粉8g,溶于300mL水中,121℃灭菌10min;B:琼脂8g,定容至300mL,121℃灭菌20min,A与B分别灭菌后趁热混匀),无菌水作为对照,接菌后28℃培养3d观察透明圈有无,分别记录透明圈的内径和外径;
b、β-1,3-葡聚糖酶活性测定,挑取处于生长旺盛期的菌株点于葡聚糖平板上(β-1,3-葡聚糖0.1g,TSB 0.4g,琼脂1.6g,4g/L的刚果红1mL,定容至100mL),无菌水作为对照,接菌后28℃培养3d,观察并测量其透明圈的内径和外径;
c、纤维素酶活性测定,挑取处于生长旺盛期的菌株点于纤维素酶活性测定平板(蛋白胨10g,酵母粉10g,羧甲基纤维素钠10g,氯化钠5g,磷酸二氢钾1g,琼脂18g,定容至1000mL,pH=7.0),无菌水作为对照,28℃培养3d后,用1g/L的刚果红染1h后,倒掉染液后,用1mol/L的NaCl浸泡1h。检测透明圈的有无并且测量其内径和外径;
d、产嗜铁素能力测定,A:1,60.5mg CAS(铬天青S)溶于50mL去离子水;2,10mL三价铁溶液(1mmol/LFeCl3.6H2O,10mmol/L盐酸为溶剂);3,72.9mg HDTMA溶于40mL去离子水。上述三个溶液混合定容至100mL,pH调至中性,121℃灭菌20min。B:30.24g Pipes加入900mLWA培养基,12g 50%(W/V)的NaOH溶液将培养基pH值调至6.8,121℃灭菌20min。A,B液趁热混匀倒平板,牙签挑取处于生长旺盛期的菌株点于平板,无菌水作为对照,接菌28℃培养5d观察并测量透明圈内径和外径;
S6:菌株鉴定包括如下步骤:
a、形态鉴定,将具有拮抗效果的菌株在LB固体培养基上用三线法活化,28℃下培养2d,对菌落形态进行观察,经革兰氏染色后,在光学显微镜下对菌体形态进行观察;
b、生理生化鉴定,对菌株进行生理生化测定。测定的生理生化特性包括:碳源利用试验、M.R.试验、V.P.试验、硫化氢生成实验、硝酸盐还原实验、明胶液化、过氧化氢酶、淀粉酶;
c、分子鉴定,利用16S rDNA通用扩增引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′,SEQ ID NO:2;1492R:5′-TACGGCTACCTTGTTACGACTT-3′,SEQ ID NO:3)进行菌落PCR。PCR反应条件为:95℃预变性3min;95℃变性15s,56℃退火15s,72℃延伸2min,35个循环,最后72℃延伸5min。将获得的PCR产物进行测序,将测得序列在NCBI数据库进行BLAST比对分析,并从GenBank数据库获得同源性高的相关菌株的基因序列,利用MEGA11软件进行序列多重比对,采用邻接法(Neighbor-joining)构建系统发育进化树,最终确定菌株的分类地位。
优选地,一种安达曼链霉菌PL25在防治小麦赤霉病中的应用,包括如下步骤:
S1:菌株PL25对小麦的促生作用的测定;
S2:菌株PL25对小麦赤霉病大田防效测定;
S3:菌株PL25发酵提取物对禾谷镰刀菌的抑制作用;
S4:菌株PL25对病原菌菌丝形态的影响;
S5:菌株PL25对病原菌孢子萌发的影响;
S6:菌株PL25对病原菌细胞膜完整性的影响;
S7:菌株PL25对病原菌菌丝内ROS积累的影响;
S8:实验数据统计与分析。
以下是本发明涉及的试验材料和试验方法:
1.1试验材料
供试土壤样品采集红树林根际土。
1.2生防菌的分离纯化
对每份样品称取碎土3g,装入50ml无菌离心管中,加入27ml无菌水,手动混匀后置于摇床以200r/min的转速震荡0.5h,取出后静置5min,用无菌水稀释浓度梯度分别为10-1、10-2、10-3、10-4、10-5、10-6。将10-3~10-6三个浓度梯度的溶液取100μl均匀涂布在胶体几丁质为唯一碳源的培养基上,每个浓度梯度平板3个重复,28℃下培养48h后,挑取不同形态特征的单菌落进行多次纯化,纯化后的单菌落细菌悬浮于80%的甘油中,置-80℃超低温冰箱中保存、备用。
1.3几丁质酶活性测定
胶体状几丁质的制备:20g甲壳素溶于350mL浓盐酸,4℃放置24h,玻璃棉过滤,滤液加入2L冰无水乙醇(-20℃过夜),10000r/min离心20min,沉淀用自来水冲洗,直至pH值为中性,冷冻干燥,-20℃密封保存,使用时,胶体状几丁质必须用手动匀浆器至少研磨5次。
胶体状几丁质为唯一碳源的培养基(Chi-Ayers):(NH4H2PO4 1.0g,KCl 0.2g,MgSO4.7H2O 0.2g,胶体状几丁质1%(w/v),定容至1000mL,pH值=7.0,琼脂20g),在培养基平板上放入灭过菌的滤纸片,两侧滤纸片点悬浮好的菌液,另外两侧点无菌水作为对照,重复3次,28℃培养5d后观察有无透明圈,测量透明圈的内径和外径。
1.4几丁质酶活性生防菌的筛选
采用平板对峙培养法:以禾谷镰刀菌(Fusarium graminearum)为靶标菌,对上述筛选得到的具有几丁质酶活性的菌株进行复筛。用5mm打孔器取靶标菌菌饼接种到WA培养基中央,用枪头挑取细菌单菌落在距病原菌菌饼约2cm处划两条平行线,以无菌水为对照,重复3次,于25℃培养箱中倒置培养,几天后观察并记录实验结果。
1.5产酶和产嗜铁素能力测定
蛋白酶活性测定:牙签挑取处于生长旺盛期的菌株点于蛋白培养基(A:脱脂奶粉8g,溶于300mL水中,121℃灭菌10min;B:琼脂8g,定容至300mL,121℃灭菌20min,A与B分别灭菌后趁热混匀),无菌水作为对照,接菌后28℃培养3d观察透明圈有无,分别记录透明圈的内径和外径,试验重复3次。
β-1,3-葡聚糖酶活性测定:牙签挑取处于生长旺盛期的菌株点于葡聚糖平板上(β-1,3-葡聚糖0.1g,TSB 0.4g,琼脂1.6g,4g/L的刚果红1mL,定容至100mL),无菌水作为对照,接菌后28℃培养3d,观察并测量其透明圈的内径和外径,试验重复3次。
纤维素酶活性测定:牙签挑取处于生长旺盛期的菌株点于纤维素酶活性测定平板(蛋白胨10g,酵母粉10g,羧甲基纤维素钠10g,氯化钠5g,磷酸二氢钾1g,琼脂18g,定容至1000mL,pH=7.0),无菌水作为对照,28℃培养3d后,用1g/L的刚果红染1h后,倒掉染液后,用1mol/L的NaCl浸泡1h。检测透明圈的有无并且测量其内径和外径,试验重复3次。
产嗜铁素能力测定:A:1,60.5mg CAS(铬天青S)溶于50mL去离子水;2,10mL三价铁溶液(1mmol/LFeCl3.6H2O,10mmol/L盐酸为溶剂);3,72.9mg HDTMA溶于40mL去离子水。上述三个溶液混合定容至100mL,pH调至中性,121℃灭菌20min。B:30.24g Pipes加入900mLWA培养基,12g 50%(W/V)的NaOH溶液将培养基pH值调至6.8,121℃灭菌20min。A,B液趁热混匀倒平板,牙签挑取处于生长旺盛期的菌株点于平板,无菌水作为对照,接菌28℃培养5d观察并测量透明圈内径和外径。试验重复3次。
1.6菌株鉴定方法
形态鉴定:将具有拮抗效果的菌株在LB固体培养基上用三线法活化,28℃下培养2d,对菌落形态进行观察,经革兰氏染色后,在光学显微镜下对菌体形态进行观察。
生理生化鉴定:根据《伯杰氏细菌鉴定手册》对菌株进行生理生化测定。测定的生理生化特性包括:碳源利用试验、M.R.试验、V.P.试验、硫化氢生成实验、硝酸盐还原实验、明胶液化、过氧化氢酶、淀粉酶,每组试验3个重复。
分子鉴定:利用16S rDNA通用扩增引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′,SEQID NO:2;1492R:5′-TACGGCTACCTTGTTACGACTT-3′,SEQ ID NO:3)进行菌落PCR。PCR反应条件为:95℃预变性3min;95℃变性15s,56℃退火15s,72℃延伸2min,35个循环,最后72℃延伸5min。将获得的PCR产物进行测序,将测得序列在NCBI数据库进行BLAST比对分析,并从GenBank数据库获得同源性高的相关菌株的基因序列,利用MEGA11软件进行序列多重比对,采用邻接法(Neighbor-joining)构建系统发育进化树,最终确定菌株的分类地位。
1.7菌株PL25对小麦的促生作用的测定
选择健康饱满的小麦种子春化后播种于无菌土壤盆砵中,每盆15粒种子,一周后,采用灌根法,将悬浮好的1×106CFU/mL的菌液缓慢灌入根茎周围,每盆接种30mL,其中以清水作为对照,每个处理15盆,试验重复3次。接种菌液后1-2d尽量不浇水,此后常规浇水,7d后重复浇灌处理一次。生防菌处理20d后,统计各处理植株的叶绿素含量、株高、根长,小心剔除根部土壤,清洗干净后晾干,测定植株鲜重,60℃,烘干48h后测植株干重。
1.8菌株PL25对小麦赤霉病大田防效测定
供试小麦品种:镇麦25,播种时间为2022年10月25日,亩播种量为18kg。当小麦进入扬花初期,用1×105CFU/mL的菌液进行叶喷处理,其中以清水作为对照,每个处理面积为20m2,一周后进行第二次叶喷。在小麦灌浆后期,每小区5点取样,每点取40株,分别调查每穗发病情况。
小麦赤霉病病情分级标准:
0级:无病;
1级:发病小穗占全穗的1/4以下;
2级:发病小穗占全穗的1/4~1/2;
3级:发病小穗占全穗的1/2~3/4;
4级:发病小穗占全穗的3/4以上。
病情指数=Σ(病级数×该病级植株数)/(最大病级数×植株总株数)×100,防治效果(%)=(对照组病情指数-处理组病情指数)/对照病情指数×100。
1.9菌株PL25发酵提取物对禾谷镰刀菌的抑制作用
将发酵7天的菌株PL25菌液离心取上清,使用乙酸乙酯对发酵液进行萃取,萃取3次后通过旋转蒸发仪进行浓缩得到代谢产物粗提物,取部分粗提物,溶解于DMSO中并配置成10000μg/mL的母液。在超净工作台中,将母液与PDA培养基充分混合摇匀倒入培养皿平板中,制作成浓度为50μg/mL的含药平板,将禾谷镰刀菌菌饼接于培养基中央,等体积的DMSO作为对照。
1.10菌株PL25对病原菌菌丝形态的影响
采用平板对峙法,将菌株PL25发酵液与禾谷镰刀菌共培养于PDA培养基上,在培养基距中央二分之一处插入灭菌的载玻片,待菌丝长至载玻片上时,显微镜下观察菌丝形态,重复3次。
1.11菌株PL25对病原菌孢子萌发的影响
取40μL过夜培养的菌株PL25发酵液10倍稀释液于灭菌凹玻片中,以加入清水作为对照,随后加入40μL禾谷镰刀菌孢子悬浮液,混匀,25℃恒温培养,当对照处理的孢子萌发率达到90%左右时,调查孢子萌发情况,计算孢子萌发抑制率,抑制率(%)=(对照组孢子萌发数-发酵液处理组孢子萌发数)/对照组孢子萌发数×100,调查孢子总数为200个,重复3次。
1.12菌株PL25对病原菌细胞膜完整性的影响
绿豆培养基中按1:100比例加入菌株PL25发酵液和菌丝悬液,在25℃下孵育12h。收集菌丝于2ml离心管内,弃上清,沉淀用1ml PBS重悬,加入5μL PI染色液。冰浴或4℃孵育20-30min。检测前离心沉淀,用PBS洗涤一次,重悬,制成玻片于荧光显微镜下观察荧光情况,重复3次。
1.13菌株PL25对病原菌菌丝内ROS积累的影响
绿豆培养基中按1:100比例加入菌株PL25发酵液和菌丝悬液,在25℃下孵育12h。收集菌丝于2ml离心管内,弃上清,沉淀用1ml PBS重悬,加入1μL DCFH-DA,37℃细胞培养箱内避光孵育30min。每隔3-5min颠倒混匀一下,使探针和细胞充分接触,检测前离心沉淀,用PBS洗涤两次,重悬,制成玻片于荧光显微镜下观察荧光情况,重复3次。
1.14数据统计与分析
对试验数据进行处理,利用DPS对数据进行单因素分析,采用Duncan新复极差检验法进行多重比较(P<0.05)检验差异显著性。
实施例1
几丁质酶活性生防菌的分离纯化
结合附图1,从红树林根际土土壤中共分离得到40余株高几丁质酶活菌株,通过平板拮抗筛选获得拮抗能力最强的菌株PL25,产酶和代谢产物活性测定结果表明菌株PL25具有蛋白酶活、β-1,3-葡聚糖酶活、纤维素酶活和产嗜铁素能力。
实施例2
几丁质酶活性菌株的鉴定
结合附图2,形态学鉴定:菌株PL25在LB平板上呈乳白色的近圆形菌落,易挑起,表面有褶皱、不透明,革兰氏染色为阳性,气生菌丝丰富多分枝。
生理生化鉴定:菌株PL25能利用葡萄糖、乳糖、D-半乳糖、L-鼠李糖、D-核糖、阿拉伯糖、L-酪氨酸,不能利用甘氨酸、蔗糖,能使硝酸盐还原,明胶液化,不能使淀粉水解,不能生成H2S,VP试验和接触酶试验阳性,MR试验阴性。
表2菌株PL25的生理生化特征
注:+表示该试验结果为阳性;-表示该试验结果为阴性。
结合附图3,分子鉴定:菌株PL25的16S rDNA基因片段测序后得到全长为1355bp的序列,将测得序列在NCBI数据库进行BLAST比对分析,发现与PL25同源性较高的菌株均属于链霉菌属,选取并下载同源性高的模式菌株或代表菌株的16S rDNA序列作为参比对象,利用MEGA11软件的邻接法(Neighbor Joining)构建系统发育树。结果表明,菌株PL25的16SrDNA序列与安达曼链霉菌Streptomyces andamanensis NR149230.1聚在同一个分支,由此,将菌株PL25鉴定为安达曼链霉菌。
实施例3
菌株PL25对小麦的促生作用测定
盆栽防效结果表明(表3),与对照组相比,菌株PL25能促进小麦幼苗的生长,株高、根长、鲜重、干重和叶绿素含量较常规对照组均有不同程度的提高,由表可知,与CK相比,菌株PL25处理的小麦株高、根长、鲜重、干重和叶绿素含量分别增长30.50%、18.46%、58.20%、24.46%、12.22%。
表3菌株PL25对小麦的促生作用效果
实施例4
菌株PL25对小麦赤霉病的大田防效测定
结合附图4,大田防效结果显示,对照组病情指数为67.56%,菌株PL25处理组病情指数为24.79,显著低于对照组,对小麦赤霉病的防治效果为64.10%(表4),结果表明,菌株PL25可以降低小麦赤霉病的发生。
表4菌株PL25对小麦赤霉病的大田防治效果
实施例5
菌株PL25发酵提取物对禾谷镰刀菌的抑制作用
结合附图5,结果显示,与对照相比,加入菌株PL25发酵提取物后,禾谷镰刀菌的菌落生长明显受到抑制,抑菌率为47.39%。
实施例6
菌株PL25对病原菌菌丝形态的影响
结合附图6,菌株PL25和禾谷镰刀菌共培养5天后,在显微镜下观察菌丝形态变化,结果显示,与对照组相比,处理组菌丝明显变粗,膨大,表明菌株PL25能够破坏禾谷镰刀菌菌丝的形态结构,从而抑制其生长。
实施例7
菌株PL25对病原菌孢子萌发的影响
结果显示对照处理10h后,几乎所有的禾谷镰刀菌孢子均正常萌发,形成细长芽管,萌发率为91.83%。菌株PL25处理组的孢子萌发率为40.17%,抑制率为56.22%(表5),表明菌株PL25能够抑制禾谷镰刀菌孢子萌发,从而抑制病原菌的生长。
表5菌株PL25对禾谷镰刀菌孢子萌发的抑制作用
实施例8
菌株PL25对病原菌细胞膜完整性的影响
结合附图7,用碘化丙啶(PI)进行荧光染色,以检查禾谷镰刀菌膜完整性。碘化丙啶(PI)是一种不渗透膜的红色荧光染料,对于具有完整细胞膜的正常细胞不能染色,而膜受损的细胞可以通过碘化丙啶(PI)进行荧光染色,显示红色荧光。结果显示,对照组未检测到明显的荧光,菌株PL25发酵液处理12h的禾谷镰刀菌菌丝能发出明显的红色荧光,表明菌株PL25能破坏禾谷镰刀菌细胞膜的完整性,引起菌丝细胞的凋亡。
实施例9
菌株PL25对病原菌菌丝内ROS积累的影响
结合附图8,利用DCFH-DA检测菌丝中ROS的产生,DCFH-DA本身没有荧光,可以自由穿过细胞膜。进入细胞内后,可以被细胞内的酯酶水解生成DCFH,而DCFH不会通透细胞膜,细胞内的活性氧能够氧化无荧光的DCFH生成有绿色荧光的DCF。结果显示,对照组只能发出微弱的绿色荧光,菌株PL25发酵液处理12h的禾谷镰刀菌菌丝能发出明显的绿色荧光,表明菌株PL25的处理可直接或间接导致禾谷镰刀菌菌丝中ROS的积累。
综上所述,菌株PL25可作为防治植物真菌病害的生防菌株且具有潜在的重要价值,对该菌株的分离鉴定和生防潜力初步研究也为链霉菌后续的深入研究及其生防菌剂的开发及其对小麦赤霉病的防治提供了理论依据,也为丰富红树林土壤来源的农业生防菌资源提供参考。
以上所述,仅为本发明的较佳实施例而已,并非对本发明作任何形式上的限制;凡本行业的普通技术人员均可按说明书附图所示和以上所述而顺畅地实施本发明;但是,凡熟悉本专业的技术人员在不脱离本发明技术方案范围内,利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对以上实施例所作的任何等同变化的更动、修饰与演变等,均仍属于本发明的技术方案的保护范围之内。
- 一种生产普通干混砂浆的流水线设备
- 一种具有防早干功能的干混砂浆储存设备
- 具有防早干功能的干混砂浆储存设备
