以抗TIGIT抗体治疗癌症的方法
文献发布时间:2024-04-18 20:00:50
相关申请的交互参照
本申请要求2021年4月9日提出的美国临时申请No.63/173,216的优先权,该临时申请出于任何目的以全文引用的方式并入本文中。
技术领域
本文提供了以抗TIGIT抗体与抗PD-1抗体和/或抗PD-L1抗体的组合治疗癌症的方法。
背景技术
具有Ig结构域和ITIM结构域的T细胞免疫受体(“T-cell immunoreceptor withIg and ITIM domains”,TIGIT)是在T细胞亚群,例如活化、记忆和调节T细胞以及自然杀伤(NK)细胞上表达的免疫细胞接合子。TIGIT是Ig超家族蛋白质内CD28家族的成员,且充当限制T细胞增殖和活化以及NK细胞功能的共抑制分子。TIGIT通过与CD226(也称为DNAX辅助分子-1,或“DNAM-1”)竞争同一组配体来介导它的免疫抑制作用:CD155(也称为脊髓灰质炎病毒受体或“PVR”)和CD112(也称为脊髓灰质炎病毒受体相关2或“PVRL2”)。Levin等人,Eur:Immunol.,2011,41:902-915。因为CD155对TIGIT的亲和力高于它对CD226的亲和力,所以在TIGIT存在下CD226信号传导受到抑制,由此限制T细胞增殖和活化。
在患有某些癌症(例如黑素瘤)的患者中,TIGIT表达在肿瘤抗原(TA)特异性CD8+T细胞和CD8+肿瘤浸润性淋巴细胞(TIL)上上调。在表达TIGIT配体(CD155)的细胞存在下阻断TIGIT增加TA特异性CD8+T细胞和CD8+TIL两者的增殖、细胞因子产生和脱粒。Chauvin等人,J Clin Invest.,2015,125:2046-2058。因此,TIGIT代表用于刺激患者的抗肿瘤T细胞反应的潜在治疗目标,不过仍需要阻断TIGIT和促进抗肿瘤反应的改良方法,且需要以抗TIGIT抗体(无论呈单一疗法形式还是与其它剂(例如抗体)组合)治疗癌症的改良方法。
提供了以抗TIGIT抗体与抗PD-1抗体和/或抗PD-L1抗体的组合治疗癌症的改良方法。
发明内容
实施方案1.一种治疗癌症的方法,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中所述癌症的样品中的PD-L1水平如通过综合阳性评分(Combined Positive Score,CPS)所测量小于10,或如通过总比例评分(Total Proportion Score,TPS)所测量小于50%,或如通过肿瘤细胞评分(Tumor Cellscore,TC)所测量小于50%,或如通过肿瘤浸润性免疫细胞染色(Tumor-InfiltratingImmune Cell staining,IC)所测量小于10%,且其中所述抗TIGIT抗体包含具有增强的效应功能的Fc区。
实施方案2.如实施方案1的方法,其中如通过CPS所测量,所述癌症的PD-L1表达水平小于5,或小于3,或小于1。
实施方案3.如实施方案1或实施方案2的方法,其中如通过TPS所测量,所述癌症的PD-L1表达水平小于40%,或小于30%,或小于20%,或小于10%,或小于5%,或小于3%,或小于1%。
实施方案4.如实施方案1-3中任一项的方法,其中如通过TC所测量,所述癌症的PD-L1表达水平小于40%,或小于30%,或小于20%,或小于10%,或小于5%,或小于3%,或小于1%。
实施方案5.如实施方案1-4中任一项的方法,其中如通过IC所测量,所述癌症的PD-L1表达水平小于5%,或小于3%,或小于1%。
实施方案6.如实施方案1-5中任一项的方法,其中:
a)所述癌症是非小细胞肺癌且所述TPS<1%;
b)所述癌症是头颈部鳞状细胞癌(HNSCC)且所述CPS<1;
c)所述癌症是尿路上皮癌且所述CPS<10;
d)所述癌症是胃癌且所述CPS<1;
e)所述癌症是食管癌且所述CPS<10;
f)所述癌症是宫颈癌且所述CPS<1;或
g)所述癌症是三阴性乳腺癌且所述CPS<10。
实施方案7.如实施方案6的方法,其中所述方法包括施用抗PD-1抗体,其中所述抗PD-1抗体是派姆单抗(pembrolizumab)或纳武单抗(nivolumab)。
实施方案8.如实施方案1-5中任一项的方法,其中所述癌症是非小细胞肺癌,且所述TPS<50%。
实施方案9.如实施方案8的方法,所述方法包括施用抗PD-1抗体,其中所述抗PD-1抗体是西米普利单抗(cemiplimab)。
实施方案10.如实施方案1-5中任一项的方法,其中:
a)所述癌症是尿路上皮癌且IC<5%;
b)所述癌症是三阴性乳腺癌且IC<1%;或
c)所述癌症是非小细胞肺癌且IC<10%;或
d)所述癌症是非小细胞肺癌且TC<50%。
实施方案11.如实施方案10的方法,所述方法包括施用抗PD-1抗体,其中所述抗PD-1抗体是阿特珠单抗(atezolizumab)。
实施方案12.如实施方案1-11中任一项的方法,其中所述抗PD-1抗体或抗PD-L1抗体以亚治疗剂量施用。
实施方案13.一种治疗癌症的方法,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中所述抗TIGIT抗体包含具有增强的效应功能的Fc区,且其中所述抗PD-1抗体或抗PD-L1抗体以亚治疗剂量施用。
实施方案14.如实施方案12或实施方案13的方法,其中所述抗PD-1抗体或抗PD-L1抗体的亚治疗剂量:a)低于针对所治疗癌症的所述抗体的单一疗法剂量和/或b)包含比针对所治疗癌症的单一疗法给药频率更低的所述抗体给药频率。
实施方案15.如实施方案12-14中任一项的方法,其中所述抗体的所述亚治疗剂量包括低于针对所治疗癌症的所述抗体的所述单一疗法剂量的剂量。
实施方案16.如实施方案15的方法,其中所述亚治疗剂量是在针对所治疗癌症的所述单一疗法剂量的5%与90%之间,或5%与80%之间,或5%与70%之间,或5%与60%之间,或5%与50%之间,或5%与40%之间,或5%与30%之间的所述抗体的剂量。
实施方案17.如实施方案14-16中任一项的方法,其中所述方法包括施用抗PD-1抗体,其中所述抗PD-1抗体是派姆单抗,且其中所述单一疗法剂量是200mg或400mg。
实施方案18.如实施方案14-16中任一项的方法,其中所述方法包括施用抗PD-1抗体,其中所述抗PD-1抗体是纳武单抗,且其中所述单一疗法剂量是240mg、360mg或480mg。
实施方案19.如实施方案14-16中任一项的方法,其中所述方法包括施用抗PD-1抗体,其中所述抗PD-1抗体是西米普利单抗,且其中所述单一疗法剂量是350mg。
实施方案20.如实施方案14-16中任一项的方法,其中所述方法包括施用抗PD-L1抗体,其中所述抗PD-L1抗体是阿维单抗(avelumab),且其中所述单一疗法剂量是800mg。
实施方案21.如实施方案14-16中任一项的方法,其中所述方法包括施用抗PD-L1抗体,其中所述抗PD-L1抗体是德瓦鲁单抗(durvalumab),且其中所述单一疗法剂量是10mg/kg或1500mg。
实施方案22.如实施方案14-16中任一项的方法,其中所述方法包括施用抗PD-L1抗体,其中所述抗PD-L1抗体是阿特珠单抗,且其中所述单一疗法剂量是840mg、1200mg或1680mg。
实施方案23.如实施方案12-22中任一项的方法,其中所述抗体的所述亚治疗剂量包含比针对所治疗癌症的单一疗法给药频率更低的所述抗体给药频率。
实施方案24.如实施方案23的方法,其中所述方法包括施用抗PD-1抗体,其中所述抗PD-1抗体是派姆单抗,且其中所述单一疗法给药频率是每3周或每6周。
实施方案25.如实施方案24的方法,其中所述方法包括施用抗PD-1抗体,其中所述抗PD-1抗体是派姆单抗,且其中所述单一疗法剂量是每3周200mg或每6周400mg。
实施方案26.如实施方案23的方法,其中所述方法包括施用抗PD-1抗体,其中所述抗PD-1抗体是纳武单抗,且其中所述单一疗法给药频率是每2周或每3周或每4周。
实施方案27.如实施方案26的方法,其中所述方法包括施用抗PD-1抗体,其中所述抗PD-1抗体是纳武单抗,且其中所述单一疗法剂量是每2周240mg、每3周360mg或每4周480mg。
实施方案28.如实施方案23的方法,其中所述方法包括施用抗PD-1抗体,其中所述抗PD-1抗体是西米普利单抗,且其中所述单一疗法给药频率是每3周。
实施方案29.如实施方案23的方法,其中所述方法包括施用抗PD-L1抗体,其中所述抗PD-L1抗体是阿维单抗,其中所述单一疗法给药频率是每2周。
实施方案30.如实施方案23的方法,其中所述方法包括施用抗PD-L1抗体,其中所述抗PD-L1抗体是德瓦鲁单抗,其中所述单一疗法给药频率是每2周或每4周。
实施方案31.如实施方案30的方法,其中所述方法包括施用抗PD-L1抗体,其中所述抗PD-L1抗体是德瓦鲁单抗,且其中所述单一疗法剂量是每2周10mg/kg或每4周1500mg。
实施方案32.如实施方案23的方法,其中所述方法包括施用抗PD-L1抗体,其中所述抗PD-L1抗体是阿特珠单抗,其中所述单一疗法给药频率是每2周、每3周或每4周。
实施方案33.如实施方案32的方法,其中所述方法包括施用抗PD-L1抗体,其中所述抗PD-L1抗体是阿特珠单抗,且其中所述单一疗法剂量是每2周840mg、每3周1200mg或每4周1680mg。
实施方案34.如实施方案1-33中任一项的方法,其中所述癌症选自小细胞肺癌、早期小细胞肺癌、肾细胞癌、尿路上皮癌、三阴性乳腺癌、胃癌、肝细胞癌、神经胶母细胞瘤、卵巢癌、头颈部鳞状细胞癌、食管鳞状细胞癌(ESCC)和非高微卫星不稳定性(非高MSI)结直肠癌。
实施方案35.一种治疗癌症的方法,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中所述抗TIGIT抗体包含具有增强的效应功能的Fc区,且其中所述癌症选自小细胞肺癌、早期小细胞肺癌、肾细胞癌、尿路上皮癌、三阴性乳腺癌、胃癌、肝细胞癌、神经胶母细胞瘤、卵巢癌、头颈部鳞状细胞癌、食管鳞状细胞癌(ESCC)和非高微卫星不稳定性(非高MSI)结直肠癌。
实施方案36.如实施方案34或实施方案35的方法,其中所述方法是尿路上皮癌的一线治疗。
实施方案37.如实施方案1-36中任一项的方法,其中所述癌症包含降低所述抗PD-1抗体或抗PD-L1抗体的功效的突变。
实施方案38.一种治疗癌症的方法,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中所述抗TIGIT抗体包含具有增强的效应功能的Fc区,且其中所述癌症包含降低所述抗PD-1抗体或抗PD-L1抗体的功效的突变。
实施方案39.如实施方案37或实施方案38的方法,其中所述癌症包含EGFR基因中的突变和/或ALK基因中的突变和/或ROS1基因中的突变。
实施方案40.如实施方案37-39中任一项的方法,其中所述癌症是非小细胞肺癌,且其中所述癌症包含EGFR基因中的突变和/或ALK基因中的突变。
实施方案41.如实施方案40的方法,其中所述方法包括施用抗PD-1抗体,其中所述抗PD-1抗体是派姆单抗或纳武单抗;或其中所述方法包括施用抗PD-L1抗体,其中所述抗PD-L1抗体是阿特珠单抗。
实施方案42.如前述实施方案中任一项的方法,其中所述抗TIGIT抗体包含与FcγRIIIa、FcγRIIa和FcγRI中的至少一者的结合增强的Fc。
实施方案43.如实施方案42的方法,其中所述抗TIGIT抗体包含与至少FcγRIIIa的结合增强的Fc。
实施方案44.如实施方案42的方法,其中抗TIGIT抗体包含与至少FcγRIIIa和FcγRIIa的结合增强的Fc。
实施方案45.如实施方案42的方法,其中所述抗TIGIT抗体包含与至少FcγRIIIa和FcγRI的结合增强的Fc。
实施方案46.如实施方案42的方法,其中所述抗TIGIT抗体包含与FcγRIIIa、FcγRIIa和FcγRI的结合增强的Fc。
实施方案47.如实施方案42-46中任一项的方法,其中所述抗TIGIT抗体的所述Fc与FcγRIIb的结合减弱。
实施方案48.如前述实施方案中任一项的方法,其中所述抗TIGIT抗体在重链恒定区中包含取代S293D、A330L和1332E。
实施方案49.如前述实施方案中任一项的方法,其中所述抗TIGIT抗体未岩藻糖基化。
实施方案50.如前述实施方案中任一项的方法,其中所述方法包括施用抗TIGIT抗体的组合物,其中所述组合物中至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的所述抗体未岩藻糖基化。
实施方案51.如前述实施方案中任一项的方法,其中所述抗TIGIT抗体的所述Fc包含相对于相同同型的对应野生型Fc具有增强的ADCC和/或ADCP活性的Fc。
实施方案52.如前述实施方案中任一项的方法,其中所述抗TIGIT抗体包含:
a)重链CDR1,所述重链CDR1包含选自SEQ ID NO:7-9的氨基酸序列;
b)重链CDR2,所述重链CDR2包含选自SEQ ID NO:10-13的氨基酸序列;
c)重链CDR3,所述重链CDR3包含选自SEQ ID NO:14-16的氨基酸序列;
d)轻链CDR1,所述轻链CDR1包含SEQ ID NO:17的氨基酸序列;
e)轻链CDR2,所述轻链CDR2包含SEQ ID NO:18的氨基酸序列;以及
f)轻链CDR3,所述轻链CDR3包含SEQ ID NO:19的氨基酸序列。
实施方案53.如前述实施方案中任一项的方法,其中所述抗TIGIT抗体包含重链CDR1、CDR2和CDR3以及轻链CDR1、CDR2和CDR3,所述CDR包含以下序列:
a)分别SEQ ID NO:7、10、14、17、18和19;或
b)分别SEQ ID NO:8、11、14、17、18和19;或
c)分别SEQ ID NO:9、12、15、17、18和19;或
d)分别SEQ ID NO:8、13、16、17、18和19;或
e)分别SEQ ID NO:8、12、16、17、18和19。
实施方案54.如前述实施方案中任一项的方法,其中所述抗TIGIT抗体包含包括选自SEQ ID NO:1-5的氨基酸序列的重链可变区和包括SEQ ID NO:6的氨基酸序列的轻链可变区。
实施方案55.如前述实施方案中任一项的方法,其中所述抗TIGIT抗体包含包括选自SEQ ID NO:20-24的氨基酸序列的重链和包括SEQ ID NO:25的氨基酸序列的轻链。
实施方案56.如前述实施方案中任一项的方法,其中所述抗TIGIT抗体以亚治疗剂量施用。
实施方案57.如实施方案56的方法,其中所述抗TIGIT抗体的所述亚治疗剂量a)低于针对所治疗癌症的所述抗TIGIT抗体的所述单一疗法剂量和/或b)包含比针对所治疗癌症的单一疗法给药频率更低的所述抗TIGIT抗体给药频率。
实施方案58.如实施方案56或实施方案57的方法,其中所述抗TIGIT抗体的所述亚治疗剂量包括低于针对所治疗癌症的所述抗TIGIT抗体的所述单一疗法剂量的剂量。
实施方案59.如实施方案56-58中任一项的方法,其中所述亚治疗剂量是在针对所治疗癌症的所述单一疗法剂量的5%与90%之间,或5%与80%之间,或5%与70%之间,或5%与60%之间,或5%与50%之间,或5%与40%之间,或5%与30%之间的所述抗TIGIT抗体的剂量。
实施方案60.如实施方案56-59中任一项的方法,其中所述抗TIGIT抗体的所述亚治疗剂量包含比针对所治疗癌症的单一疗法给药频率更低的所述抗TIGIT抗体给药频率。
实施方案61.如前述实施方案中任一项的方法,其中所述方法包括施用抗PD-1抗体。
实施方案62.如实施方案61的方法,其中所述抗PD-1抗体选自派姆单抗、纳武单抗、CT-011、BGB-A317、西米普利单抗、信迪利单抗(sintilimab)、替雷利珠单抗(tislelizumab)、TSR-042、PDR001或特瑞普利单抗(toripalimab)。
实施方案63.如实施方案1-60中任一项的方法,其中所述方法包括施用抗PD-L1抗体。
实施方案64.如实施方案63的方法,其中所述抗PD-L1抗体选自德瓦鲁单抗、BMS-936559、阿特珠单抗或阿维单抗。
附图说明
图1A-1C展示了完全免疫活性小鼠中生长的100mm
图2A-B展示了这些肿瘤中PD-1(图2A)和PD-L1(图2B)的mRNA表达水平。
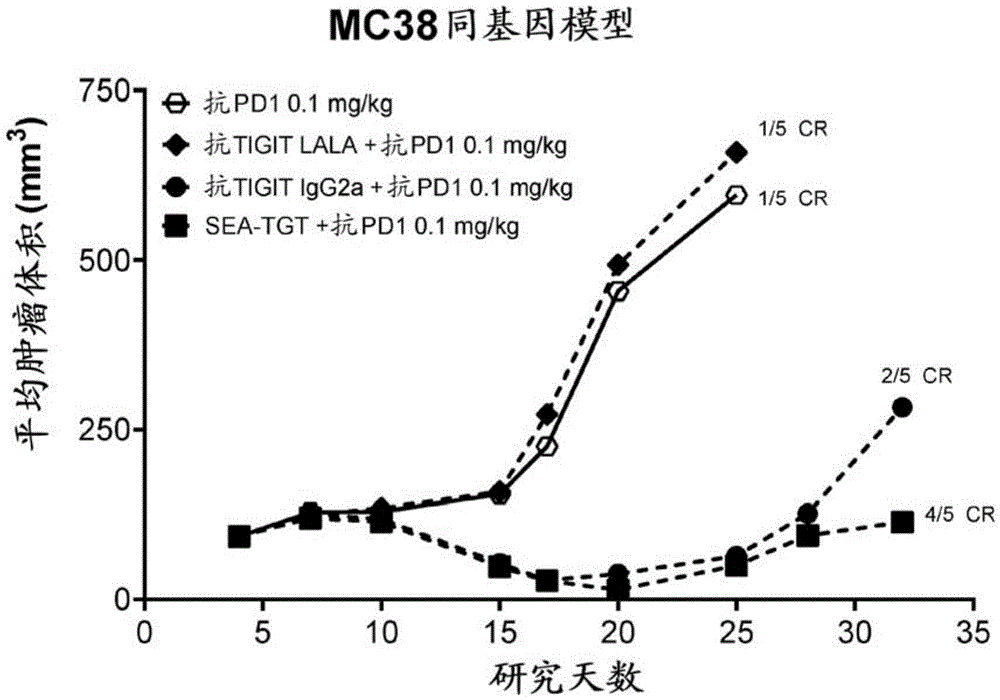
图3展示了以亚治疗剂量的具有具不同效应功能的Fc骨架的抗TIGIT抗体与亚治疗剂量的抗PD-1抗体的组合针对皮下同基因MC38肿瘤进行治疗的体内数据。
图4A和4B展示了以亚治疗剂量的SEA-TGT mIgG2a抗体(即,重新格式化为对应于未岩藻糖基化人IgG1骨架的未岩藻糖基化小鼠IgG2a的SEA-TGT抗体)(它是未岩藻糖基化的效应功能增强的抗TIGIT抗体)、亚治疗剂量的抗PD-1抗体或两者的组合针对皮下同基因CT26肿瘤(图4A)或Renca肿瘤(图4B)进行治疗的体内数据。
图5A-5C展示了以治疗剂量的不同抗TIGIT抗体针对皮下同基因MC38肿瘤(图5A)、CT26肿瘤(图5B)或Renca肿瘤(图5C)进行单剂治疗的体内反应数据。图5D-5F展示了在各种同基因皮下肿瘤MC38(图5D)、CT26(图5E)或Renca(图5F)中以治疗剂量的抗PD-1抗体进行单剂治疗的体内反应数据。
具体实施方式
I.前言
本发明部分基于P以下出人意料的发现,即表达低水平PD-L1的癌症可以抗TIGIT抗体与抗PD-1抗体和/或抗PD-L1抗体的组合治疗。尤其发现具有增强的Fc结合特征和效应功能的抗TIGIT抗体是这样的情况。所需Fc结合特征包括活性,例如与活化性FcγR的结合增强、与抑制性FcγR的结合减弱、ADCC活性增强和/或ADCP活性增强。具有所需活性的某些这类抗体未岩藻糖基化。
根据这些发现,发明人已证明向癌症表达低水平PD-L1的受试者施用抗TIGIT抗体与抗PD-1抗体和/或抗PD-L1抗体的组合引起肿瘤大小减小和/或生长速率降低。在一些实施方案中,抗体可以亚治疗剂量施用。在各种实施方案中,抗TIGIT抗体具有增强的Fc结合特征和/或效应功能。
因此,本文所提供的一些实施方案为治疗癌症的方法,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中癌症的PD-L1表达水平如通过综合阳性评分(CPS)所测量小于10或如通过总比例评分(TPS)所测量小于50%,且其中抗TIGIT抗体包含具有增强的效应功能的Fc区。
在一些实施方案中,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中抗TIGIT抗体包含具有增强的效应功能的Fc区,且其中抗PD-1抗体或抗PD-L1抗体以亚治疗剂量施用。
在一些实施方案中,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中抗TIGIT抗体包含具有增强的效应功能的Fc区,且其中抗TIGIT抗体以亚治疗剂量施用。
在一些实施方案中,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中抗TIGIT抗体包含具有增强的效应功能的Fc区,且其中抗TIGIT抗体和抗PD-1或抗PD-L1抗体两者以亚治疗剂量施用。
在一些实施方案中,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中抗TIGIT抗体包含具有增强的效应功能的Fc区,且其中癌症选自小细胞肺癌、早期小细胞肺癌、肾细胞癌、尿路上皮癌、三阴性乳腺癌、胃癌、肝细胞癌、神经胶母细胞瘤、卵巢癌、头颈部鳞状细胞癌、食管鳞状细胞癌(ESCC)和非高微卫星不稳定性(非高MSI)结直肠癌。
在一些实施方案中,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中抗TIGIT抗体包含具有增强的效应功能的Fc区,且其中癌症包含降低抗PD-1抗体或抗PD-L1抗体的功效的突变。
II.定义
除非另外定义,否则本文所用的技术和科学术语具有与一般本领域的技术人员通常所理解相同的含义。参见例如Lackie,Dictionary of Cell and Molecular Biology,Elsevier(第4版2007);Sambrook等人,Molecular Cloning,A Laboratory Manual,ColdSprings Harbor Press(Cold Springs Harbor,NY 1989)。与本文所描述的方法、装置和材料类似或等效的任何方法、装置和材料可用于实践本发明。
如本文所用,除非上下文另外明确规定,否则单数形式“-(a/an)”和“所述”包括多个参考物。因此,例如,提及“-抗体”任选地包括两个或更多个这类分子的组合等。
如本文所用,术语“约”是指本技术领域的技术人员易于知晓的各别值的常见误差范围。
术语“抗体”包括完整抗体和其抗原结合片段,其中抗原结合片段包含抗原结合区和包含位于CH2中的天冬酰胺(N)297的重链恒定区的至少一部分。通常,“可变区”含有抗体的抗原结合区且与结合的特异性和亲和力相关。参见Fundamental Immunology第7版,Paul编,Wolters Kluwer Health/Lippincott Williams&Wilkins(2013)。轻链通常分类为κ或λ。重链通常分类为γ、μ、α、δ或ε,其又分别定义免疫球蛋白类别IgG、IgM、IgA、IgD和IgE。
术语“抗体”还包括二价或双特异性分子、双功能抗体、三功能抗体和四功能抗体。二价和双特异性分子描述于例如Kostelny等人(1992)J.Immunol.148:1547;Pack和Pluckthun(1992)Biochemistry 31:1579;Hollinger等人(1993),PNAS.USA 90:6444;Gruber等人(1994)J Immunol.152:5368;Zhu等人(1997)Protein Sci.6:781;Hu等人(1996)Cancer Res.56:3055;Adams等人(1993)Cancer Res.53:4026;和McCartney等人(1995)Protein Eng.8:301中。
“单克隆抗体”是指从基本上均质的抗体群获得的抗体,即除可能少量存在的可能的天然存在的突变以外,构成该群体的个别抗体是相同的。修饰语“单克隆”指示抗体的特征为从基本上均质的抗体群体获得,且不应理解为需要通过任何特定的方法产生该抗体。举例来说,欲根据本发明使用的单克隆抗体可通过Kohler等人(1975)Nature 256:495首先描述的融合瘤方法制得,或可通过重组DNA方法(参见例如美国专利第4816567号)制得。“单克隆抗体”还可以使用例如Clackson等人(1991)Nature,352:624-628和Marks等人(1991)J.Mol.Biol.,222:581-597中所描述的技术从噬菌体抗体库分离,或可通过其它方法制得。本文所描述的抗体是单克隆抗体。
单克隆抗体与其目标抗原的特异性结合意指至少10
基本的抗体结构单元是亚基的四聚体。每个四聚体包括两对相同的多肽链,每对具有一个“轻”链(约25kDa)和一个“重”链(约50-70kDa)。每条链的氨基端部分包括主要负责抗原识别的约100至110个或更多个氨基酸的可变区。该可变区最初表达为连接到可裂解信号肽。无信号肽的可变区有时称为成熟可变区。因此,例如轻链成熟可变区意指无轻链信号肽的轻链可变区。每条链的羧基端部分界定主要负责效应功能的恒定区。
轻链分类为κ或λ。重链分类为γ、μ、α、δ或ε,且将抗体同型分别定义为IgG、IgM、IgA、IgD和IgE。在轻链和重链内,可变区和恒定区由具有约12个或更多个氨基酸的“J”区接合,其中重链还包括具有约10个或更多个氨基酸的“D”区。(一般参见FundamentalImmunology(Paul,W.编,第2版,Raven Press,N.Y.,1989,第7章),出于所有目的其以全文引用的方式并入本文中)。
每个轻链/重链对的成熟可变区形成抗体结合位点。因此,完整抗体具有两个结合位点。除了在双官能或双特异性抗体中,两个结合位点是相同的。链均呈现通过三个高变区接合的相对保守框架区(FR)的相同通式结构,也称为互补决定区或CDR。来自每对的两条链的CDR通过框架区对齐,使得能够结合于特异性表位。从N端到C端,轻链和重链均包含结构域FRI、CDRl、FR2、CDR2、FR3、CDR3和FR4。将氨基酸分派到每个结构域是根据以下的定义:Kabat,Sequences of Proteins of Immunological Interest(National Institutes ofHealth,Bethesda,MD,1987和1991)或Chothia和Lesk,J.Mol.Biol.196:901-917(1987);Chothia等人,Nature 342:878-883(1989),或Kabat和Chothia的复合,或IMGT(ImMunoGeneTics信息系统)、AbM或Contact或CDR的其它常规定义。Kabat还提供了一种广泛使用的编号规约(Kabat编号),其中给不同重链之间或不同轻链之间的相应残基分派相同编号。除非从上下文另外显而易见,否则Kabat编号用于指定可变区中氨基酸的位置。除非从上下文另外显而易见,否则EU编号用于指定恒定区中的位置。
“人源化”抗体是保留非人类抗体的反应性同时在人中具较低免疫原性的抗体。这可以例如通过保留非人类CDR区且用其人类对应物置换抗体的其余部分而达成。参见例如Morrison等人,PNAS USA,81:6851-6855(1984);Morrison和Oi,Adv.Immunol.,44:65-92(1988);Verhoeyen等人,Science,239:1534-1536(1988);Padlan,Molec.Immun.,28:489-498(1991);Padlan,Molec.Immun.,31(3):169-217(1994)。
如本文所用,术语“嵌合抗体”是指其中(a)恒定区或其部分被置换使得抗原结合位点(可变区、CDR或其部分)连接到不同物种的恒定区的抗体分子。
术语“表位”是指抗原上由抗体结合的位点。表位可由相邻氨基酸或通过一个或多个蛋白质的三级折叠而并列的非相邻氨基酸形成。由相邻氨基酸形成的表位通常在暴露于变性溶剂后保留,而通过三级折叠形成的表位通常在用变性溶剂处理后消失。表位通常包括呈独特空间构象的至少3个且更通常至少5个或8至10个氨基酸。测定表位的空间构象的方法包括例如x射线晶体学和2维核磁共振。参见例如Epitope Mapping Protocols,于Methods in Molecular Biology,第66卷,Glenn E.Morris编(1996)。
识别相同或重叠表位的抗体可在简单免疫测定中鉴别,该免疫测定展示一种抗体与另一抗体竞争结合于目标抗原的能力。抗体的表位还可以通过与其抗原结合以鉴别接触残基的抗体的X射线晶体学定义。或者,如果抗原中减少或消除一种抗体的结合的所有氨基酸突变减少或消除另一抗体的结合,则两种抗体具有相同的表位。如果减少或消除一种抗体的结合的一些氨基酸突变减少或消除另一抗体的结合,则两种抗体具有重叠的表位。
抗体之间的竞争通过以下测定法来测定,其中测试的抗体抑制参考抗体与共同抗原的特异性结合(参见例如Junghans等人,Cancer Res.50:1495,1990)。如果如在竞争性结合测定中所测量,过量测试抗体(例如至少2×、5×、10×、20×或100×)将参考抗体结合抑制至少50%,但优选地75%、90%或99%,则测试抗体与参考抗体竞争。通过竞争测定鉴别的抗体(竞争抗体)包括与参考抗体结合于相同表位的抗体和结合于足够靠近参考抗体所结合的表位的相邻表位以发生位阻的抗体。
短语“特异性结合”是指对样品中的目标比对结合于非目标化合物以更大的亲和力、亲合力、更容易和/或以更长持续时间结合于该目标的分子(例如抗体或抗体片段)。在一些实施方案中,特异性结合目标的抗体是以比对非目标化合物大至少2倍的亲和力,例如大至少4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、25倍、50倍或100倍的亲和力结合于目标的抗体。举例来说,特异性结合TIGIT的抗体通常以比对非TIGIT目标大至少2倍的亲和力结合于TIGIT。一般本领域的技术人员阅读该定义应理解,例如特异性或优先结合于第一目标的抗体(或部分或表位)可或可不特异性或优先结合于第二目标。因此,“特异性结合”不必需要(尽管其可包括)排他性结合。
术语“结合亲和力”在本文中用作两个分子,例如抗体或其片段与抗原之间的非共价相互作用的强度的量度。术语“结合亲和力”用于描述单价相互作用(固有活性)。
两个分子,例如抗体或其片段与抗原之间经由单价相互作用的结合亲和力可通过测定解离常数(K
如本文所用,术语“交叉反应”是指抗体结合于除抗体所针对的抗原以外的抗原的能力。在一些实施方案中,交叉反应性是指抗体结合于除抗体所针对的抗原以外来自另一物种的抗原的能力。作为一非限制性实例,针对人TIGIT抗原产生的如本文所描述的抗TIGIT抗体可展现与来自不同物种(例如小鼠或猴)的TIGIT的交叉反应性。
“分离”抗体是指已从其天然环境的组分鉴别且分离和/或回收的抗体,和/或以重组方式产生的抗体。“纯化抗体”是相对于干扰蛋白和由其产生或纯化引起的其它杂质通常至少50%w/w纯,但不排除单克隆抗体与过量药学上可接受的载体或意图便于其使用的其它媒介物组合的可能性的抗体。干扰蛋白和其它污染物可包括例如从其中抗体被分离或以重组方式产生的细胞的细胞组分。有时单克隆抗体相对于干扰蛋白和由产生或纯化产生的污染物为至少60%、70%、80%、90%、95%或99%w/w纯。本文所描述的抗体,包括大鼠、嵌合、面饰化和人源化抗体可以呈分离和/或纯化形式提供。
“综合阳性评分(Combined Positive Score)”或“CPS”是测量癌症,例如来自癌症的肿瘤样品中的PD-L1表达的免疫组织化学方法。CPS为PD-L1染色细胞(肿瘤细胞、淋巴细胞、巨噬细胞)数目除以活肿瘤细胞的总数目乘以100。对于一些治疗性治疗,如果CPS≥1,则肿瘤样品视为具有PD-L1表达。举例来说,CPS≥1为受试者符合某些PD-1或PD-L1抑制剂疗法所需,例如患有胃癌、宫颈癌和头颈部鳞状细胞癌的受试者。在一些情况下,CPS≥10为受试者符合某些PD-1或PD-L1抑制剂疗法所需,例如患有尿路上皮癌(膀胱癌)、食管鳞状细胞癌(ESCC)或三阴性乳腺癌正以派姆单抗治疗的受试者。
“肿瘤比例评分”或“TPS”是测量癌症,例如来自癌症的肿瘤样品中的PD-L1表达的免疫组织化学方法。TPS为在任何强度下展示部分或完全膜染色的活肿瘤细胞的百分比。对于一些治疗性治疗,如果TPS≥1%,则肿瘤样品视为具有PD-L1表达,且如果TPS≥50%,则肿瘤样品视为具有高PD-L1表达。举例来说,TPS≥1%为受试者符合某些PD-1或PD-L1抑制剂疗法(例如派姆单抗)所需,例如患有非小细胞肺癌的受试者。在一些情况下,TPS≥50%为受试者符合某些PD-1或PD-L1抑制剂疗法(例如西米普利单抗)所需。
肿瘤浸润性免疫细胞(IC)染色或“IC”是测量例如来自癌症的肿瘤样品的PD-L1表达的免疫组织化学方法。表达测量为任何强度的PD-L1染色IC所占据的肿瘤面积的比例。如果试样在肿瘤浸润性免疫细胞中含有任何强度的PD-L1染色,占据≥5%肿瘤面积,则该试样被指定PD-L1表达水平≥5%IC。如果试样在肿瘤浸润性免疫细胞中含有任何强度的PD-L1染色,覆盖<5%肿瘤面积,则该试样被指定PD-L1表达水平<5%IC。对于一些治疗性治疗,IC用于对来自尿路上皮癌组织的PD-L1表达进行评分。获自切除、经尿道膀胱肿瘤切除术(TURBT)和来自原发和转移部位两者的芯针穿刺活检的尿路上皮癌组织样品可用于IC测定中。可商购的IC测定包括Ventana PD-L1(SP142)Assay
肿瘤细胞或“TC”评分是指任何强度的表达PD-L1的肿瘤细胞的百分比(TC%),且类似于TPS。在一些实施方案中,使用Ventana PD-L1(SP142)测定获得TC评分。举例来说,当以阿特珠单抗(癌自御(TECENTRIQ))治疗NSCLC患者时,使用TC评分。在该适应症中,治疗临限值为TC评分≥50%。关于TC评分的其它信息可在例如以下中获得:1)医师标签:VentanaPD-L1(SP142)Assay(2020)Ventana Medical Systems公司和Roche DiagnosticsInternational公司;和2)Ventana PD-L1(SP142)Assay:Interpretation Guide(2019)Ventana Medical Systems公司和Roche Diagnostics International公司。
“受试者”、“患者”、“个体”和类似术语可互换使用且除指定外是指哺乳动物,例如人和非人类灵长类动物以及家免、大鼠、小鼠、山羊、猪和其它哺乳动物物种。术语不一定指示受试者已被诊断出患有特定疾病,而是通常是指个体在医疗监督下。
术语“疗法”、“治疗”和“改善”是指症状严重程度的任何减轻。在治疗癌症的情况下,治疗可指减小例如肿瘤大小、癌细胞数目、生长速率、转移活性、非癌细胞的细胞死亡等。如本文所用,术语“治疗”和“预防”不意图为绝对术语。治疗和预防可指任何发作延迟、症状改善、患者存活率改良、存活时间或存活率增加等。治疗和预防可以是完全(无剩余可检测症状)或部分的,使得症状比无本文所描述的治疗的患者的症状的频率或严重程度低。治疗效果可与未接受治疗的个体或个体集合进行比较,或与治疗之前或在治疗期间的不同时间的相同患者进行比较。在一些方面,如与例如施用之前的个体或未经历治疗的个体相比,疾病严重程度低至少10%。在一些方面,疾病严重程度降低至少25%、50%、75%、80%或90%,或在一些情况下,使用标准诊断技术不可再检测到。
如本文所用,剂(例如如本文所描述的抗体)的“治疗量”或“治疗有效量”为药剂预防、缓解、减轻、改善或降低受试者的疾病(例如癌症)的症状的严重程度的量。
如本文所用,剂(例如如本文所描述的抗体)的“亚治疗量”或“亚治疗剂量”为剂的一种剂量,其小于当该剂用作单一疗法来治疗相同适应症(例如相同类型或亚型癌症)时所施用的剂量。亚治疗剂量可包括单一疗法剂量的较低频率给药,使得受试者接受整体较低剂量的剂。
术语“施用(administer/administered/administering)”是指将剂、化合物或组合物递送到生物作用的所需部位的方法。这些方法包括但不限于局部递送、不经肠递送、静脉内递送、真皮内递送、肌肉内递送、结肠递送、直肠递送或腹膜内递送。任选地与本文所描述的剂和方法一起采用的施用技术包括例如如Goodman和Gilman,The PharmacologicalBasis of Therapeutics,当前版本;Pergamon;和Remington′s,Pharmaceutical Sciences(当前版本),Mack Publishing Co.,Easton,PA中所论述。
III.PD-L1的表达水平
可在施用任何组合物之前或利用本文所公开的任何方法测量受试者的癌症中的PD-L1表达水平。表达水平可通过本领域中已知的任何方法确定。
在一些实施方案中,为了评估PD-L1的表达水平,可从需要疗法的受试者获得癌症组织样品。在另一实施方案中,可在不获得癌症组织样品的情况下达成PD-L1表达水平的评估。在一些实施方案中,选择适合受试者包括(i)任选地提供获自受试者的癌症组织样品,所述癌症组织样品包含癌细胞和/或癌症浸润性炎症细胞;和(ii)评估癌症组织样品中在细胞表面上表达PD-L1的细胞的比例。
然而,在包含测量癌症组织样品中的PD-L1表达的任何方法中,应理解,包含提供获自受试者的癌症组织样品的步骤是任选地选用的步骤。还应理解,在某些实施方案中,鉴别或确定癌症组织样品中在细胞表面上表达PD-L1的细胞数目或比例的“测量”或“评估”步骤通过测定PD-L1表达的转化方法,例如通过进行反转录酶-聚合酶链反应(RT-PCR)测定或免疫组织化学(IHC)测定来进行。在一些实施方案中,不包括转化步骤且PD-L1表达通过例如审查来自实验室的测试结果报告来评估。在某些实施方案中,直到且包括评估PD-L1表达的方法步骤提供中间结果,该中间结果可提供给医师或其它健康照护提供者以用于选择适合受试者进行治疗。在某些实施方案中,提供中间结果的步骤由开业医师或在开业医师指导下行动的某人执行。在其它实施方案中,这些步骤由独立实验室或由例如实验室技术员的独立个人执行。
在一些实施方案中,表达PD-L1的细胞的比例通过执行确定PD-L1 RNA的存在的测定来评估。在一些实施方案中,通过RT-PCR、原位杂交或RNA酶保护来确定PD-L1 RNA的存在。在其它实施方案中,表达PD-L1的细胞的比例通过执行确定PD-L1多肽的存在的测定来评估。在一些实施方案中,通过IHC测定、酶联免疫吸附测定(ELISA)、体内成像或流式细胞术来确定PD-L1多肽的存在。在一些实施方案中,通过IHC测定来确定PD-L1表达。参见Chen等人,(2013)Clin.Cancer Res.19(13):3462-3473。
成像技术已为癌症研究和治疗提供了重要的工具。分子成像系统的最新发展,包括正电子发射断层摄影术(PET)、单光子发射计算机断层摄影术(SPECT)、荧光反射成像(FRI)、荧光介导的断层摄影术(FMT)、生物发光成像(BLI)、激光扫描共聚焦显微术(LSCM)和多光子显微术(MPM)可能预示这些技术在癌症研究中的应用会更加广泛。这些分子成像系统中的一些使临床医师不仅可见癌症在体内的位置,而且还视觉化影响癌症行为和/或对治疗药物的反应的特定分子的表达和活性、细胞和生物过程(Condeelis和Weissleder,In vivo imaging in cancer,Cold SPring Harb.Perspect.Biol.2(12):a003848(2010))。抗体特异性,连同PET的灵敏度和分辨率使得免疫PET成像对于监测和测定组织样品中抗原的表达特别有吸引力(McCabe和Wu,Positive progress in immunoPET-not justa coincidence,Cancer Biother.Radiopharm.25(3):253-61(2010);Olafsen等人,ImmunoPET imaging of B-cell lymphoma using 124I-anti-CD20 scFv dimers(diabodies),Protein Eng.Des.Sel.23(4):243-9(2010))。在某些实施方案中,通过免疫PET成像测定PD-L1表达。在某些实施方案中,癌症组织样品中表达PD-L1的细胞的比例通过执行确定癌症组织样品中的细胞表面上PD-L1多肽的存在的测定来评估。在某些实施方案中,癌症组织样品为福尔马林固定石蜡包埋(FFPE)组织样品。在其它实施方案中,通过IHC测定来确定PD-L1多肽的存在。在其它实施方案中,使用自动化方法执行IHC测定。在一些实施方案中,使用结合于PD-L1多肽的抗PD-L1单克隆抗体执行IHC测定。
在一些实施方案中,使用自动化IHC方法测定FFPE组织试样中的细胞表面上PD-L1的表达。本公开提供了用于检测癌症组织样品中人PD-L1抗原的存在或定量人PD-L1抗原的水平或样品中表达抗原的细胞比例的方法,所述方法包括在允许在抗体或其部分与人PD-L1之间形成复合物的条件下,使测试样品和阴性对照样品与特异性结合于人PD-L1的单克隆抗体接触。在某些实施方案中,测试和对照组织样品为FFPE样品。随后检测复合物形成,其中测试样品与阴性对照样品之间复合物形成的差异指示样品中存在人PD-L1抗原。使用各种方法定量PD-L1表达。
在一些实施方案中,自动化IHC方法包括:(a)在自动染色仪中对安装的组织切片进行脱蜡和再水化;(b)使用去掩蔽室和pH 6缓中液回收抗原,加热到110℃后维持10分钟;(c)在自动染色仪上设置试剂;(d)运行自动染色仪以包括以下步骤:中和组织试样中的内源性过氧化酶;封闭载玻片上的非特异性蛋白质结合位点;将载玻片与一级抗体一起孵育;与一级后封闭剂一起孵育;与NovoLink聚合物一起孵育;添加色素原底物且显影;和用苏木精复染。
为了评估癌症组织样品中的PD-L1表达,病理学家可在显微镜下检查每个视野中的膜PD-L1+癌细胞的数目,且在内心估计阳性细胞的百分比,然后对其取平均值以得出最终百分比。不同染色强度可定义为0/阴性、1+/弱、2+/中度和3+/强。可首先将百分比值分派给0和3+桶,然后可考虑中间的1+和2+强度。对于高度异质的组织,可将试样划分为多个区域,且可对每个区域单独评分,然后组合成单组百分比值。从每个区域确定不同染色强度的阴性和阳性细胞的百分比,且对于每个区域给出中值。对于每个染色强度类别,可对组织给出最终百分比值:阴性、1+、2+和3+。所有染色强度的总和可以是100%。
还在癌症浸润性炎症细胞,例如巨噬细胞和淋巴细胞中评估染色。在大多数情况下,巨噬细胞充当内部阳性对照,因为在大部分巨噬细胞中观察到染色。虽然不需要以3+强度染色,但可考虑不存在巨噬细胞染色,以排除任何技术故障。可评估巨噬细胞和淋巴细胞的质膜染色,且仅将所有样品记录为对于每个细胞类别呈阳性或阴性。染色还根据外部/内部癌症免疫细胞名称进行表征。“内部”意指免疫细胞在癌症组织内和/或在癌症区域的边界上,而不物理插入癌症细胞之间。“外部”意指与癌症无物理关联,免疫细胞位于与结缔组织或任何相关邻近组织相关的周边。
在这些评分方法的某些实施方案中,样品由独立操作的两名病理学家评分,随后合并评分。在某些其它实施方案中,使用适当软件对阳性和阴性细胞的鉴别进行评分。
组织评分用作IHC数据的更定量的量度。在一些实施方案中,组织评分可如下计算:组织评分=[(癌症%×1(低强度))+(癌症%×2(中等强度))+(癌症%×3(高强度)]。
在一些实施方案中,为了确定组织评分,病理学家可估计试样内每个强度类别中的染色细胞的百分比。由于大多数生物标志物的表达是异质的,所以组织评分可以是整体表达的更真实表示。最终组织评分范围为0(无表达)至300(最大表达)。
在一些实施方案中,定量癌症中PD-L1表达的方式是确定调整后的炎症评分(AIS)评分,其定义为炎症密度乘以癌症浸润性炎症细胞的PD-L 1表达百分比。Taube等人,Colocalization of inflammatory response with B7-hl expression in humanmelanocytic lesions supports an adaptive resistance mechanism of immuneescape,Sci.Transl.Med.4(127):127ra37(2012))。
在一些实施方案中,定量癌症中PD-L1表达的方式是确定综合阳性评分(CPS),如上文所描述,其为PD-L1染色细胞(肿瘤细胞、淋巴细胞、巨噬细胞)数目除以活肿瘤细胞的总数目乘以100。对于一些治疗性治疗,如果CPS≥1,则肿瘤样品视为具有PD-L1表达。举例来说,CPS≥10为受试者符合某些PD-1或PD-L1抑制剂疗法所需,例如患有尿路上皮癌(膀胱癌)、食管鳞状细胞癌(ESCC)或三阴性乳腺癌正以派姆单抗治疗的受试者。
在一些实施方案中,定量癌症中PD-L1表达的方式是确定肿瘤比例评分(TPS),如上文所描述,其为在任何强度下展示部分或完全膜染色的活肿瘤细胞的百分比。对于一些治疗性治疗,如果TPS≥1%,则肿瘤样品视为具有PD-L1表达,且如果TPS≥50%,则肿瘤样品视为具有高PD-L1表达。
在一些实施方案中,用于定量癌症中PD-L1表达的方式是确定肿瘤细胞(TC)评分。对于一些治疗性治疗,如果TC≥50%,则肿瘤样品视为具有PD-L1表达。
在一些实施方案中,用于定量癌症中PD-L1表达的方式为确定肿瘤浸润性免疫细胞(IC)评分。对于一些治疗性治疗,如果试样在肿瘤浸润性免疫细胞中含有任何强度的PD-L1染色,占据≥5%肿瘤面积,则肿瘤样品视为具有PD-L1表达。
在一些实施方案中,定量癌症中PD-L1表达的方式是Agilent(Dako)PD-L1 IHC223 pharmDx Assay
在一些实施方案中,定量癌症中PD-L1表达的方式为Agilent(Dako)PD-L1 IHC28-8 pharmDx Assay
在一些实施方案中,定量癌症中PD-L1表达的方式是Agilent(Dako)PD-L1 IHC73-10 Assay
在一些实施方案中,定量癌症中PD-L1表达的方式是Ventana PD-L1(SP142)Assay
在一些实施方案中,定量癌症中PD-L1表达的方式是Ventana PD-L1(SP263)Assay
下表1提供了以上测定法、可使用其的药物和当前在美国批准的那些治疗的适应症的概述。本文所提供的一些组合疗法在如表1中所列的适应症中利用该等药物以及对应测定法以确定PD-L1表达水平。
表1.PD-L1诊断测定法的概述
另外,O′Malley等人,Immunohistochemical detection of PD-L1 amongdiverse human neoplasms in a reference laboratory:observations based upon 62,896cases,Modern Pathology 32:929-942(2019),提供了使用抗体克隆22C3、28-8、SP142或SP263在各种类型的癌症中评估PD-L1表达的描述。
IV.例示性抗体
例示性PD-1抑制剂和PD-L1抑制剂
在某些实施方案中,本文所提供的方法包括施用PD-1/PD-L1抑制剂。PD-1/PD-L1抑制剂的实例包括(但不限于)描述于美国专利No.7,488,802;7,943,743;8,008,449;8,168,757;8,217,149中,以及PCT专利申请公布No.WO2003042402、WO2008156712、WO2010089411、WO2010036959、WO2011066342、WO2011159877、WO2011082400和WO2011161699中的那些PD-1/PD-L1抑制剂,所有文献以全文引用的方式并入本文中。
在一些实施方案中,本文所提供的方法包括施用PD-1抑制剂。在一些实施方案中,PD-1抑制剂是抗PD-1抗体。在一些实施方案中,抗PD-1抗体是AMP-224、CT-011、西米普利单抗、卡瑞利珠单抗(camrelizumab)、信迪利单抗、替雷利珠单抗、TSR-042、PDR001、特瑞普利单抗、BGB-A317、纳武单抗(也称为ONO-4538、BMS-936558或MDX1106)、派姆单抗(也称为MK-3475、SCH 900475或兰洛利珠单抗(lambrolizumab))。在一个实施方案中,抗PD-1抗体是纳武单抗。纳武单抗为人IgG4抗PD-1单克隆抗体,且以商标名Opdivo
在某些实施方案中,本文所提供的方法包括施用PD-L1抑制剂。在一些实施方案中,PD-L1抑制剂是抗PD-L1抗体。在一些实施方案中,抗PD-L1抗体是MEDI4736(也称为德瓦鲁单抗或
例示性抗TIGIT抗体
用于本文所描述的某些治疗方法中的抗TIGIT抗体具有各种活性。举例来说,在一些实施方案中,抗TIGIT抗体抑制TIGIT与配体CD155和CD112中的一者或两者之间的相互作用。在一些实施方案中,抗TIGIT抗体在功能性生物测定中抑制TIGIT与CD155之间的相互作用,允许发生CD155-CD226信号传导。
发明人出人意料地发现,即使在低PD-L1癌症中,抗TIGIT抗体也展现与PD-1/PD-L1阻断的协同作用。如本文所证明,向包含表达低水平PD-L1的癌症的小鼠模型施用抗TIGIT抗体与抗PD-1和/或抗PD-L1抗体的组合引起肿瘤大小减小和/或生长速率降低。
在某些实施方案中,抗TIGIT抗体是MTIG7192A或其未岩藻糖基化形式。在另一实施方案中,抗TIGIT抗体是BMS-986207或其未岩藻糖基化形式。在又一实施方案中,抗TIGIT抗体是OMP-313M32或其未岩藻糖基化形式。在一个实施方案中,TIGIT抑制剂是MK-7684或其未岩藻糖基化形式。在另一实施方案中,抗TIGIT抗体是AB154或其未岩藻糖基化形式。在又一实施方案中,抗TIGIT抗体是CGEN-15137或其未岩藻糖基化形式。在一个实施方案中,抗TIGIT抗体是SEA-TGT。在另一实施方案中,抗TIGIT抗体是ASP8374或其未岩藻糖基化形式。在又一实施方案中,抗TIGIT抗体是AJUD008或其未岩藻糖基化形式。
在一些实施方案中,抗TIGIT抗体,例如未岩藻糖基化抗TIGIT抗体以高亲和力结合于人TIGIT蛋白或其部分。在一些实施方案中,抗体对于人TIGIT的结合亲和力(K
在一些实施方案中,除了以高亲和力结合于人TIGIT之外,未岩藻糖基化抗TIGIT抗体展现与食蟹猕猴(“cyno”)TIGIT和/或小鼠TIGIT的交叉反应性。在一些实施方案中,抗TIGIT抗体以100nM或更小的结合亲和力(K
在一些实施方案中,抗体交叉反应性通过检测抗TIGIT抗体与在细胞(例如表达人TIGIT、食蟹猕猴TIGIT或小鼠TIGIT的细胞系或内源性表达TIGIT的原代细胞,例如内源性表达人TIGIT、cyno TIGIT或小鼠TIGIT的原代T细胞)上表达的TIGIT的特异性结合来测定。在一些实施方案中,抗体结合和抗体交叉反应性通过检测抗TIGIT抗体与纯化或重组TIGIT(例如纯化或重组人TIGIT、纯化或重组cyno TIGIT或纯化或重组小鼠TIGIT)或包含TIGIT的嵌合蛋白(例如包含人TIGIT、食蟹猕猴TIGIT或小鼠TIGIT的Fc融合蛋白或包含人TIGIT、cyno TIGIT或小鼠TIGIT的His标记的蛋白质)的特异性结合来测定。
在一些实施方案中,本文提供的抗TIGIT抗体抑制TIGIT与配体CD155之间的相互作用。在一些实施方案中,本文提供的抗TIGIT抗体抑制TIGIT与配体CD112之间的相互作用。在一些实施方案中,本文提供的抗TIGIT抗体抑制TIGIT与配体CD155和CD112两者之间的相互作用。
在一些实施方案中,结合于人TIGIT的抗TIGIT抗体包含衍生自本文所描述的以下抗体中的任一者的轻链可变区序列或其部分和/或重链可变区序列或其部分:克隆13、克隆13A、克隆13B、克隆13C或克隆13D。抗TIGIT抗体克隆13、克隆13A、克隆13B、克隆13C和克隆13D的CDR、轻链可变结构域(VL)和重链可变结构域(VH)的氨基酸序列阐述于下文序列表中。
在一些实施方案中,抗TIGIT抗体包含以下中的一者或多者(例如一者、两者、三者、四者、五者或六者):
重链CDR1序列,所述重链CDR1序列包含选自SEQ ID NO:7、SEQ ID NO:8和SEQ IDNO:9的氨基酸序列;
重链CDR2序列,所述重链CDR2序列包含选自SEQ ID NO:10、SEQ ID NO:11、SEQ IDNO:12和SEQ ID NO:13的氨基酸序列;
重链CDR3序列,所述重链CDR3序列包含选自SEQ ID NO:14、SEQ ID NO:15和16的氨基酸序列;
轻链CDR1序列,所述轻链CDR1序列包含SEQ ID NO:17的氨基酸序列;
轻链CDR2序列,所述轻链CDR2序列包含SEQ ID NO:18的氨基酸序列;和/或
轻链CDR3序列,所述轻链CDR3序列包含SEQ ID NO:19的氨基酸序列。
在一些实施方案中,抗TIGIT抗体包含:重链CDR1序列,所述重链CDR1序列包含SEQID NO:7、SEQ ID NO:8或SEQ ID NO:9的氨基酸序列;重链CDR2序列,所述重链CDR2序列包含SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12或SEQ ID NO:13的氨基酸序列;以及重链CDR3序列,所述重链CDR3序列包含SEQ ID NO:14、SEQ ID NO:15或16的氨基酸序列。
在一些实施方案中,抗TIGIT抗体包含:轻链CDR1序列,所述轻链CDR1序列包含SEQID NO:17的氨基酸序列;轻链CDR2序列,所述轻链CDR2序列包含SEQ ID NO:18的氨基酸序列;以及轻链CDR3序列,所述轻链CDR3序列包含SEQ ID NO:19的氨基酸序列。
在一些实施方案中,抗TIGIT抗体包含:重链CDR1序列,所述重链CDR1序列包含SEQID NO:7、SEQ ID NO:8或SEQ ID NO:9的氨基酸序列;重链CDR2序列,所述重链CDR2序列包含SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12或SEQ ID NO:13的氨基酸序列;重链CDR3序列,所述重链CDR3序列包含SEQ ID NO:14、SEQ ID NO:15或SEQ ID NO:16的氨基酸序列;轻链CDR1序列,所述轻链CDR1序列包含SEQ ID NO:17的氨基酸序列;轻链CDR2序列,所述轻链CDR2序列包含SEQ ID NO:18的氨基酸序列;以及轻链CDR3序列,所述轻链CDR3序列包含SEQID NO:19的氨基酸序列。
在一些实施方案中,抗TIGIT抗体包含包括以下的氨基酸序列的重链CDR1、CDR2和CDR3与轻链CDR1、CDR2和CDR3:
(a)分别SEQ ID NO:7、10、14、17、18和19;或
(b)分别SEQ ID NO:8、11、14、17、18和19;或
(c)分别SEQ ID NO:9、12、15、17、18和19;或
(d)分别SEQ ID NO:8、13、16、17、18和19;或
(e)分别SEQ ID NO:8、12、16、17、18和19。
在一些实施方案中,抗TIGIT抗体包含重链可变区(VH),所述VH包含与SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5具有至少90%序列同一性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性)的氨基酸序列。在一些实施方案中,抗TIGIT抗体包含VH,所述VH包含SEQID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5的氨基酸序列。在一些实施方案中,与参考序列(例如SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4或SEQID NO:5)具有至少90%序列同一性的VH序列相对于参考序列含有一个、两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个取代(例如保守性取代)、插入或缺失,但仍能够结合于人TIGIT且任选地仍能够阻断CD155和/或CD112与TIGIT的结合。
在一些实施方案中,抗TIGIT抗体包含轻链可变区(VL),所述VL包含与SEQ ID NO:6具有至少90%序列同一性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性)的氨基酸序列。在一些实施方案中,抗TIGIT抗体包含VL所述VL包含SEQ ID NO:6的氨基酸序列。在一些实施方案中,与参考序列(例如SEQ ID NO:6)具有至少90%序列同一性的VL序列相对于参考序列含有一个、两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个取代(例如保守性取代)、插入或缺失,但仍能够结合于人TIGIT且任选地仍能够阻断CD155和/或CD112与TIGIT的结合。
在一些实施方案中,抗TIGIT抗体包含重链可变区,所述重链可变区包含与SEQ IDNO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5具有至少90%序列同一性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性)的氨基酸序列;且包含轻链可变区,所述轻链可变区包含与SEQ IDNO:6具有至少90%序列同一性(例如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%序列同一性)的氨基酸序列。在一些实施方案中,抗TIGIT抗体包含重链可变区,所述重链可变区包含SEQ ID NO:1、SEQ ID NO:2、SEQ IDNO:3、SEQ ID NO:4或SEQ ID NO:5的氨基酸序列,且包含轻链可变区,所述轻链可变区包含SEQ ID NO:6的氨基酸序列。
在一些实施方案中,抗TIGIT抗体包含:
(a)包含SEQ ID NO:1的氨基酸序列的VH和包含SEQ ID NO:6的氨基酸序列的VL;或
(b)包含SEQ ID NO:2的氨基酸序列的VH和包含SEQ ID NO:6的氨基酸序列的VL;或
(c)包含SEQ ID NO:3的氨基酸序列的VH和包含SEQ ID NO:6的氨基酸序列的VL;或
(d)包含SEQ ID NO:4的氨基酸序列的VH和包含SEQ ID NO:6的氨基酸序列的VL;或
(f)包含SEQ ID NO:5的氨基酸序列的VH和包含SEQ ID NO:6的氨基酸序列的VL。
在一些实施方案中,抗TIGIT抗体包含重链,所述重链包含选自SEQ ID NO:20、21、22、23和24的氨基酸序列;以及轻链,所述轻链包含SEQ ID NO:25的氨基酸序列。
在一些实施方案中,抗TIGIT抗体是SEA-TGT,其为包含分别包含SEQ ID NO:7、10、14、17、18和19的氨基酸序列的重链CDR1、CDR2和CDR3以及轻链CDR1、CDR2和CDR3的未岩藻糖基化IgG1抗体。对应VH和VL分别包含SEQ ID NO:1和6的氨基酸序列。参见例如PCT公布No.WO 2020/041541。
在一些实施方案中,用于本发明方法的抗TIGIT抗体是US 2009/0258013、US2016/0176963、US 2016/0376365或WO 2016/028656中所公开的抗TIGIT抗体的未岩藻糖基化形式。
具有增强效应功能的例示性Fc区
在一些实施方案中,本文所提供的方法中使用的抗体包含具有呈任何组合的以下特征中的一者或多者或全部的Fc:1)与一种或多种活化性FcγR的结合增强,2)与抑制性FcγR的结合减弱,3)未岩藻糖基化,4)具有增强的ADCC活性,5)具有增强的ADCP活性,6)活化抗原呈递细胞(APC),7)增强CD8 T细胞反应,8)上调共刺激受体,9)活化先天性细胞免疫反应,和/或10)接合NK细胞。在一些实施方案中,本文所提供的方法中使用的抗TIGIT抗体包含具有前述特征中的一者或多者的Fc。
因此,在一些实施方案中,抗TIGIT抗体包含与一种或多种活化性FcγR的结合增强和/或与一种或多种抑制性FcγR的结合减弱的Fc,以获得所需增强的FcγR结合概况。活化性FcγR包括FcγRIIIa、FcγRIIa和/或FcγRI中的一者或多者。抑制性FcγR包括例如FcγRIIb。
在某些实施方案中,抗TIGIT抗体包含与至少FcγRIIIa的结合增强的Fc。在其它实施方案中,抗体包含与至少FcγRIIIa和FcγRIIa的结合增强的Fc。在一些实施方案中,抗体包含与至少FcγRIIIa和FcγRI的结合增强的Fc。在某些实施方案中,抗体包含与FcγRIIIa、FcγRIIa和FcγRI的结合增强的Fc。
在一些实施方案中,除与活化性FcγR的结合增强之外或与之分开,抗TIGIT抗体与一种或多种抑制性FcγR的结合减弱。因此,在一些实施方案中,抗体与FcγRIIa和/或FcγRIIb的结合减弱。
在一些实施方案中,抗TIGIT抗体未岩藻糖基化。在一些实施方案中,抗体还具有上文所描述的FcγR结合概况中的一者。
在某些实施方案中,抗TIGIT抗体的Fc包含相对于野生型Fc的氨基酸变化以增强与活化性FcγR的结合,和/或减弱与一种或多种抑制性FcγR的结合,以获得例如上文所描述的FcγR结合概况。举例来说,在一些实施方案中,抗体的Fc在重链恒定区中包含取代S293D、A330L和/或I332E。
因此,本文所提供的方法中使用的抗TIGIT抗体可包含具有以下活性中的一者或多者的Fc:与一种或多种活化性FcγR的结合增强;与抑制性FcγR的结合减弱;ADCC活性增强;和/或ADCP活性增强。具有带这类活性和所需活性概况的Fc的抗体可以多种方式产生,包括产生未岩藻糖基化蛋白和/或通过将Fc工程化成含有产生所需活性的某些突变。本文提供了关于用于产生未岩藻糖基化抗体的方法和例示性工程化途径的额外细节。
抗体可在其恒定区中的保守位置处糖基化(Jefferis和Lund,(1997)Chem.Immunol.65:111-128;Wright和Morrison,(1997)TibTECH 15:26-32)。免疫球蛋白的寡糖侧链影响蛋白质的功能(Boyd等人,(1996)Mol.Immunol.32:1311-1318;Wittwe和Howard,(1990)Biochem.29:4175-4180),和糖蛋白的部分之间的分子内相互作用,这种相互作用会影响糖蛋白的构象和所呈现的三维表面(Jefferis和Lund,见上文;Wyss和Wagner,(1996)Current Opin.Biotech.7:409-416)。寡糖还可以用于基于特定识别结构而将给定糖蛋白靶向到某些分子。举例来说,已报告在无半乳糖化(agalactosylated)IgG中,寡糖部分“翻转”出CH2间空间,且末端N-乙酰葡萄糖胺残基变得可用于结合甘露糖结合蛋白(Malhotra等人,(1995)Nature Med.1:237-243)。通过糖肽酶从中国仓鼠卵巢(CHO)细胞中产生的CAMPATH-1H(识别人淋巴细胞的CDw52抗原的重组人源化鼠类单克隆IgG1抗体)去除寡糖引起补体介导的溶解(CMCL)的完全减小(Boyd等人,(1996)Mol.Immunol.32:1311-1318),而使用神经氨糖酸酶选择性去除唾液酸残基未引起DMCL损失。也已经报告了抗体的糖基化影响抗体依赖性细胞毒性(ADCC)。特定来说,据报告,具有β(1,4)-N-乙酰胺基葡萄糖转移酶III(GnTIII)(催化等分GlcNAc的形成的糖基转移酶)的四环素调节的表达的CHO细胞具有改良的ADCC活性(Umana等人(1999)Nature Biotech.17:176-180)。
抗体的糖基化通常为N连接型或O连接型。N连接型是指碳水化合物部分与天冬酰胺残基的侧链连接。三肽序列天冬酰胺-X-丝氨酸和天冬酰胺-X-苏氨酸,其中X为除脯氨酸以外的任何氨基酸,是用于碳水化合物部分与天冬酰胺侧链的酶促连接的识别序列。因此,多肽中这些三肽序列中的任一者的存在产生潜在糖基化位点。O连接型糖基化是指糖N-乙酰半乳糖胺、半乳糖或木糖中的一者与羟基氨基酸,最通常丝氨酸或苏氨酸连接,不过还可以使用5-羟基脯氨酸或5-羟基赖氨酸。
抗体的糖基化变体是其中抗体的糖基化模式发生改变的变体。改变意指删除抗体中发现的一个或多个碳水化合物部分,将一个或多个碳水化合物部分添加到抗体,改变糖基化的组成(糖基化模式)、糖基化程度等。
将糖基化位点添加到抗体可通过改变氨基酸序列,使得其含有上述三肽序列中的一者或多者来实现(针对N连接型糖基化位点)。还可以通过向原始抗体的序列添加一个或多个丝氨酸或苏氨酸残基或用所述残基取代原始抗体的序列来进行改变(针对O连接型糖基化位点)。类似地,去除糖基化位点可通过抗体的天然糖基化位点内的氨基酸改变来实现。
氨基酸序列通常通过改变基础核酸序列而改变。这些方法包括从天然来源分离(在天然存在的氨基酸序列变体的情况下)或通过对抗体的早期制备的变体或非变体形式进行寡核苷酸介导的(或定点)突变诱发、PCR突变诱发和盒式突变诱发来制备。
抗体的糖基化(包括糖基化模式)还可以在不改变氨基酸序列或基础核苷酸序列的情况下发生改变。参见例如Pereira等人,2018,MAbs,10(5):693-711。糖基化很大程度上取决于用于表达抗体的宿主细胞。由于用于表达重组糖蛋白(例如抗体)作为潜在治疗剂的细胞类型很少为天然细胞,因此可预期抗体的糖基化模式的显著变化。参见例如Hse等人,(1997)J.Biol.Chem.272:9062-9070。除选择宿主细胞之外,在重组产生抗体期间影响糖基化的因素包括生长模式、培养基配制、培养物密度、加氧作用、pH、纯化方案等。已提出各种方法来改变特定宿主生物体中达成的糖基化模式,包括引入或过表达某些参与寡糖产生的酶(美国专利No.5047335;5510261;5278299)。可以酶方式(例如使用内切糖苷酶H(EndoH))从糖蛋白去除糖基化或某些类型的糖基化。另外,重组宿主细胞可进行基因工程化以例如在处理某些类型的多糖方面有缺陷。这些和类似技术是本领域中已知的。
抗体的糖基化结构可通过碳水化合物分析的常规技术,包括凝集素色谱、NMR、质谱分析、HPLC、GPC、单糖组成分析、依序酶促消化和HPAEC-PAD容易地分析,HPAEC-PAD使用高pH阴离子交换色谱以基于电荷分离寡糖。出于分析目的释放寡糖的方法也是已知的,且包括但不限于酶促处理(通常使用肽-N-糖苷酶F/内切-β-半乳糖苷酶执行),使用苛刻碱性环境进行消除以释放主要O连接型结构,和使用无水肼释放N连接型寡糖和O连接型寡糖两者的化学方法。
在一些实施方案中,抗TIGIT抗体的糖基化修饰形式是降低的核心岩藻糖基化。“核心岩藻糖基化”是指在N连接型聚糖的还原端处将岩藻糖(“岩藻糖基化”)添加到N-乙酰葡萄糖胺(“GlcNAc”)。
“复合N-糖苷连接的糖链”通常结合于天冬酰胺297(根据Kabat的编号)。如本文所用,复合N-糖苷连接的糖链具有二触角复合糖链,其主要具有以下结构:
其中±指示糖分子可存在或不存在,且数字指示糖分子之间的键位置。在上文结构中,结合于天冬酰胺的糖链端被称为还原端(在右侧),而相对侧被称为非还原端。岩藻糖通常结合于还原端的N-乙酰葡萄糖胺(“GlcNAc”),通常通过α1,6键(GlcNAc的6位连接到岩藻糖的1位)进行结合。“Gal”是指半乳糖,且“Man”是指甘露糖。
“复合N-糖苷连接的糖链”包括1)复合型,其中核心结构的非还原端侧具有零个、一个或多个半乳糖-N-乙酰葡萄糖胺(也称为“gal-GlcNAc”)分支而gal-GlcNAc的非还原端侧任选地具有唾液酸、等分N-乙酰葡萄糖胺等;以及2)混合型,其中核心结构的非还原端侧具有高甘露糖N-糖苷连接的糖链和复合N-糖苷连接的糖链的两个分支。
在如本文所提供的一些方法中,仅较小量的岩藻糖掺入抗TIGIT抗体的复合N-糖苷连接的糖链中。举例来说,在各种实施方案中,组合物中小于约60%、小于约50%、小于约40%、小于约30%、小于约20%、小于约15%、小于约10%、小于约5%或小于约3%的抗TIGIT抗体具有由岩藻糖引起的核心岩藻糖基化。在一些实施方案中,组合物中约2%的抗TIGIT抗体具有由岩藻糖引起的核心岩藻糖基化。在各种实施方案中,当组合物中小于60%的抗TIGIT抗体具有由岩藻糖引起的核心岩藻糖基化时,组合物的抗体可称为“未岩藻糖基化”或“去岩藻糖基化”的。在一些实施方案中,组合物中至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的抗TIGIT抗体是未岩藻糖基化的。
在某些实施方案中,仅较小量的岩藻糖类似物(或岩藻糖类似物的代谢物或产物)掺入复合N-糖苷连接的糖链中。举例来说,在各种实施方案中,小于约60%、小于约50%、小于约40%、小于约30%、小于约20%、小于约15%、小于约10%、小于约5%或小于约3%的抗TIGIT抗体具有由岩藻糖类似物或岩藻糖类似物的代谢物或产物引起的核心岩藻糖基化。在一些实施方案中,约2%的抗TIGIT抗体具有由岩藻糖类似物或岩藻糖类似物的代谢物或产物引起的核心岩藻糖基化。
在一些实施方案中,组合物中小于约60%、小于约50%、小于约40%、小于约30%、小于约20%、小于约15%、小于约10%、小于约5%或小于约3%的抗TIGIT抗体在G0、G1或G2聚糖结构上具有岩藻糖残基。(参见例如Raju等人,2012,MAbs 4:385-391,图3)。在一些实施方案中,组合物中约2%的抗TIGIT抗体在G0、G1或G2聚糖结构上具有岩藻糖残基。在各种实施方案中,当组合物中小于60%的抗TIGIT抗体在G0、G1或G2聚糖结构上具有岩藻糖残基时,组合物的抗体可称为“未岩藻糖基化”的。在一些实施方案中,组合物中至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的抗TIGIT抗体在G0、G1或G2聚糖结构上缺乏岩藻糖。应注意,G0聚糖包括G0-GN聚糖。G0-GN聚糖是具有一个末端GlcNAc残基的单触角聚糖。G1聚糖包括G1-GN聚糖。G1-GN聚糖是具有一个末端半乳糖残基的单触角聚糖。G0-GN和G1-GN聚糖可以是岩藻糖基化或未岩藻糖基化的。
可采用多种用于产生未岩藻糖基化抗体的方法。例示性策略包括使用缺乏参与岩藻糖基化通路的某些生物合成酶的细胞系,或抑制或敲除参与岩藻糖基化通路的某些基因。这类途径的综述由Pereira等人(2018)mAbs 10:693-711提供,其以全文引用的方式并入本文中。
举例来说,通过将产抗体细胞与岩藻糖类似物一起孵育来制备未岩藻糖基化抗体,例如本文所公开的未岩藻糖基化抗TIGIT抗体的方法描述于例如WO2009/135181和US8,163,551中。简单地说,在岩藻糖类似物或岩藻糖类似物的细胞内代谢物或产物的存在下孵育已经被工程化成表达抗体的细胞。细胞内代谢物可以是例如GDP修饰的类似物或完全或部分去酯化类似物。举例来说,产物可以是完全或部分去酯化类似物。在一些实施方案中,岩藻糖类似物可抑制岩藻糖补救通路中的酶。举例来说,岩藻糖类似物(或岩藻糖类似物的细胞内代谢物或产物)可抑制岩藻糖激酶或GDP-岩藻糖-焦磷酸化酶的活性。在一些实施方案中,岩藻糖类似物(或岩藻糖类似物的细胞内谢物或产物)抑制岩藻糖基转移酶(优选地1,6-岩藻糖基转移酶,例如FUT8蛋白)。在一些实施方案中,岩藻糖类似物(或岩藻糖类似物的细胞内代谢物或产物)可抑制岩藻糖的从头合成通路中的酶的活性。举例来说,岩藻糖类似物(或岩藻糖类似物的细胞内代谢物或产物)可抑制GDP-甘露糖4,6-脱水酶或/或GDP-岩藻糖合成酶的活性。在一些实施方案中,岩藻糖类似物(或岩藻糖类似物的细胞内代谢物或产物)可抑制岩藻糖转运子(例如GDP-岩藻糖转运子)。
在一个实施方案中,岩藻糖类似物是2-氟代岩藻糖。在生长培养基中使用岩藻糖类似物和其它岩藻糖类似物的方法公开于例如WO 2009/135181中,其以引用的方式并入本文中。
用于工程化细胞系以降低核心岩藻糖基化的其它方法包括基因敲除、基因敲入和RNA干扰(RNAi)。参见例如Pereira等人,2018,mAbs,10(5):693-711。在基因敲除中,编码FUT8(α1,6-岩藻糖基转移酶)的基因失活。FUT8催化岩藻糖基残基从GDP-岩藻糖转移到N-聚糖的Asn连接(N连接)的GlcNac的6位。据报告,FUT8是负责在Asn297处将岩藻糖添加到N连接的二触角碳水化合物的唯一酶。基因敲入添加编码例如GNTIII或高尔基体α甘露糖苷酶II的酶的基因。细胞中这类酶水平的增大使单克隆抗体从岩藻糖基化通路转向(引起降低的核心岩藻糖基化),且具有增大的等分N-乙酰葡萄糖胺量。RNAi通常还靶向FUT8基因表达,其引起减小的mRNA转录本水平或完全地敲除基因表达。
可使用的其它策略包括
这些方法中的任一者可用于产生将能够产生未岩藻糖基化抗体的细胞系。
各种工程化途径还可以用以获得具有所需FcγR活性和效应功能的Fc区。在一些实施方案中,Fc被工程化成具有以下突变组合:S239D、A330L和1332E,其提高Fc结构域对FcγRIIIA的亲和力,因此提高ADCC。增强对FcγRIIIa的亲和力的额外取代包括例如T256A、K290A、S298A、E333A和K334A。增强与活化性FcγRIIIa的结合且减弱与抑制性FcγRIIIb的结合的取代包括例如F243L/R292P/Y300L/V305I/P396L和F243L/R292P/Y300L/L235V/P396L。在一些实施方案中,取代处于IgG1 Fc骨架中。
共价连接到保守性Asn297的寡糖与IgG的Fc区结合FcγR的能力有关(Lund等人,1996,J.Immunol.157:4963-69;Wright和Morrison,1997,Trends Biotechnol.15:26-31)。IgG上该糖型的工程化可显著提高IgG介导的ADCC。将等分N-乙酰葡萄糖胺修饰(Umana等人,1999,Nat.Biotechnol.17:176-180;Davies等人,2001,Biotech.Bioeng.74:288-94)添加到该糖型或从该糖型去除岩藻糖(Shields等人,2002,J.Biol.Chem.277:26733-40;Shinkawa等人,2003,J.Biol.Chem.278:6591-604;Niwa等人,2004,CancerRes.64:2127-33)是提高IgG Fc与FcγR之间的结合,由此增强Ig介导的ADCC活性的IgG Fc工程化的两个实例。
人IgG1 Fc区的暴露于溶剂的氨基酸的系统性取代已产生具有改变的FcγR结合亲和力的IgG变体(Shields等人,2001,J.Biol.Chem.276:6591-604)。当与亲本IgG1相比时,涉及在Thr256/Ser298、Ser298/Glu333、Ser298/Lys334或Ser298/Glu333/Lys334处取代为Ala的这些变体的子集表明与FcγR的结合亲和力和ADCC活性两者均增加(Shields等人,2001,J.Biol.Chem.276:6591-604;Okazaki等人,2004,J.Mol.Biol.336:1239-49)。
多种方法可用以测定抗体上的岩藻糖基化的量。方法包括例如经由PLRP-S色谱的LC-MS、电喷雾电离四极TOF MS、毛细管电泳-激光诱导的荧光(CE-LIF)和亲水相互作用色谱-荧光检测(HILIC)。
抗体制备
为了制备抗体,可使用本领域中已知的许多技术。参见例如Kohler和Milstein,Nature 256:495-497(1975);Kozbor等人,Immunology Today 4:72(1983);Cole等人,第77-96页,Monoclonal Antibodies and Cancer Therapy,Alan R.Liss公司(1985);Coligan,Current ProtocolsinImmunology(1991);Harlow和Lane,Antibodies,ALaboratory Manual(1988);和Goding,Monoclonal Antibodies:Principles andPractice(第2版1986))。
编码所关注的抗体的重链和轻链的基因可从细胞中克隆,例如编码单克隆抗体的基因可从表达抗体的融合瘤中克隆且用于产生重组单克隆抗体。编码单克隆抗体的重链和轻链的基因库还可以由融合瘤或浆细胞制得。另外,噬菌体或酵母展示技术可用于鉴别特异性结合于选定抗原的抗体和异质Fab片段(参见例如McCafferty等人,Nature 348:552-554(1990);Marks等人,Biotechnology 10:779-783(1992);Lou等人,(2010)PEDS23:311;以及Chao等人,Nature Protocols,1:755-768(2006))。替代地,抗体和抗体序列可使用基于酵母的抗体呈递系统分离和/或鉴别,所述抗体呈递系统例如为例如以下中公开的抗体呈递系统:Xu等人,Protein Eng Des Sel,2013,26:663-670;WO 2009/036379;WO 2010/105256;以及WO 2012/009568。重链和轻链基因产物的随机组合产生具有不同抗原特异性的大抗体池(参见例如Kuby,Immunology(第3版1997))。用于产生单链抗体或重组抗体的技术(美国专利4,946,778、美国专利No.4,816,567)还可以适于产生抗体。抗体还可以被制成为双特异性,即能够识别两种不同抗原(参见例如WO 93/08829;Traunecker等人,EMBOJ.10:3655-3659(1991);以及Suresh等人,Methods in Enzymology 121:210(1986))。抗体还可以是异缀合物,例如两个共价接合的抗体,或共价结合于免疫毒素的抗体(参见例如美国专利No.4,676,980、WO 9I/00360;以及WO 92/200373)。
可使用多种表达系统,包括原核表达系统和真核表达系统来产生抗体。在一些实施方案中,表达系统是哺乳动物细胞,例如融合瘤,或CHO细胞。许多这类系统可以从商业供应商广泛购得。在抗体包含重链和轻链两者的实施方案中,重链和重链与轻链可使用单一载体表达(例如在双顺反子表达单元中),或在不同启动子的控制下。在其它实施方案中,重链和轻链区可使用单独载体表达。如本文所描述的重链和轻链可任选地在N端处包含甲硫氨酸。
在一些实施方案中,产生抗体片段(例如Fab、Fab′、F(ab′)
在一些实施方案中,抗体或抗体片段可与另一分子,例如聚乙二醇(PEG化)或血清白蛋白结合,以提供延长的体内半衰期。抗体片段的PEG化实例提供于Knigh等人,Platelets 15:409,2004(针对阿昔单抗(abciximab));Pedley等人,Br.J.Cancer 70:1126,1994(针对抗CEA抗体);Chapman等人,Nature Biotech.17:780,1999;以及Humphreys等人,Protein Eng.Des.20:227,2007)。
在一些实施方案中,提供了多特异性抗体,例如双特异性抗体。多特异性抗体是对至少两种不同抗原或对同一抗原的至少两个不同表位具有结合特异性的抗体。用于制备多特异性抗体的方法包括但不限于在宿主细胞中重组共表达两对重链和轻链(参见例如Zuo等人,Protein Eng Des Sel,2000,13:361-367);“杵-臼”工程化(参见例如Ridgway等人,Protein Eng Des Sel,1996,9:617-721);“双功能抗体”技术(参见例如Hollinger等人,PNAS(USA),1993,90:6444-6448);以及分子内三聚(参见例如Alvarez-Cienfuegos等人,Scientific Reports,2016,doi:/10.1038/srep28643);又见Spiess等人,MolecularImmunology,2015,67(2),A部分:95-106。
恒定区的选择
本文所描述的抗体的重链和轻链可变区可连接到人恒定区的至少一部分。恒定区的选择可部分取决于是否需要抗体依赖性细胞介导的细胞毒性、抗体依赖性细胞吞噬作用和/或补体依赖性细胞毒性。举例来说,人同型IgG1和IgG3具有强补体依赖性细胞毒性,人同型IgG2具有弱补体依赖性细胞毒性且人IgG4不具有补体依赖性细胞毒性。人IgG1和IgG3也比人IgG2和IgG4诱导更强的细胞介导的效应功能。轻链恒定区可以是λ或κ。抗体可表达为含有两个轻链和两个重链的四聚体,表达为单独重链、轻链,表达为Fab、Fab′、F(ab′)2和Fv,或表达为单链抗体,其中重链和轻链可变结构域经由间隔子连接。
人恒定区展示在不同个体之间的同种异型变化和同族同种异型变化,即,在不同个体中在一个或多个多态位置处恒定区可不同。同族同种异型与同种异型不同之处在于识别同族同种异型的血清与一个或多个其它同型的非多态区结合。
在一定比例的或全部的分子中,轻链和/或重链的氨基或羧基端处的一个或数个氨基酸,例如重链的C端赖氨酸,可缺失或衍生。取代可在恒定区中进行以降低或提高效应功能,例如补体介导的细胞毒性或ADCC(参见例如Winter等人,美国专利No.5,624,821;Tso等人,美国专利No.5,834,597;和Lazar等人,Proc.Natl.Acad.Sci.USA 103:4005,2006),或以延长在人中的半衰期(参见例如Hinton等人,J.Biol.Chem.279:6213,2004)。
为了构建所需抗体,在一些实施方案中,例示性取代包括天然氨基酸至半胱氨酸残基的氨基酸取代在氨基酸位置234、235、237、239、267、298、299、326、330或332处引入,优选地人IgG1同型中的S239C突变(编号根据EU索引(Kabat,Sequences of Proteins ofImmunological Interest(National Institutes of Health,Bethesda,MD,1987和1991);参见US 20100158909,其引用并入本文中)。额外半胱氨酸残基的存在可允许链间二硫键形成。这类链间二硫键形成可引起位阻,由此减小Fc区-FcγR结合相互作用的亲和力。位置234、235、236和/或237中的任一者处的其它取代减小Fcγ受体、尤其是FcγRI受体的亲和力(参见例如US 6,624,821、US 5,624,821)。
抗体的体内半衰期还可以对其效应功能产生影响。可延长或缩短抗体的半衰期以改变其治疗活性。FcRn是在结构上类似于与β2-微球蛋白非共价缔合的第I类MHC抗原的受体。FcRn调节IgG的分解代谢和其在整个组织中的胞吞转运(Ghetie和Ward,2000,Annu.Rev.Immunol.18:739-766;Ghetie和Ward,2002,Immunol.Res.25:97-113)。IgG-FcRn相互作用发生在pH 6.0(细胞内小泡的pH)而非pH 7.4(血液的pH)下;这一相互作用能够使得IgG再循环回到循环(Ghetie和Ward,2000,Ann.Rev.Immunol.18:739-766;Ghetie和Ward,2002,Immunol.Res.25:97-113)。已定位人IgG1上参与FcRn结合的区(Shields等人,2001,J.Biol.Chem.276:6591-604)。人IgG1的位置Pro238、Thr256、Thr307、Gln311、Asp312、Glu380、Glu382或Asn434处的丙氨酸取代增强FcRn结合(Shields等人,2001,J.Biol.Chem.276:6591-604)。具有这些取代的IgG1分子具有更长的血清半衰期。因此,与未修饰的IgG1相比,这些修饰的IgG1分子可能够在更长时间段内进行其效应功能,因此发挥其治疗功效。用于增加与FcRn的结合的其它例示性取代包括位置250处的Gln和/或位置428处的Leu。EU编号用于恒定区中的所有位置。
抗体的补体结合活性(C1q结合和CDC活性两者)可通过Lys326和Glu333处的取代提高(Idusogie等人,2001,J.Immunol.166:2571-2575)。人IgG2骨架上的相同取代可将与C1q不充分结合且严重缺乏补体活化活性的抗体同型转化成可结合C1q且介导CDC的抗体同型(Idusogie等人,2001,J.Immunol.166:2571-75)。数种其它方法也已经应用于提高抗体的补体结合活性。举例来说,将IgM的18个氨基酸的羧基端尾片接枝到IgG的羧基端极大地增强了其CDC活性。即使在通常不具有可检测CDC活性的IgG4情况下也观察到该增强(Smith等人,1995,J.Immunol.154:2226-36)。此外,用Cys取代位于IgG1重链的羧基端附近的Ser444诱导IgG1的尾-尾二聚,相比于单体IgG1来说,CDC活性增加200倍(Shopes等人,1992,J.Immunol.148:2918-22)。另外,对C1q具有特异性的双特异性双功能抗体构建体也赋予了CDC活性(Kontermann等人,1997,Nat.Biotech.15:629-31)。
补体活性可通过使重链的氨基酸残基318、320和322中的至少一者突变成具有不同侧链的残基(例如Ala)而降低。其它经烷基取代的非离子型残基,例如Gly、IIe、Leu或Val,或例如Phe、Tyr、Trp和Pro的芳族非极性残基代替该三个残基中的任一者也降低或消除C1q结合。Ser、Thr、Cys和Met可用于残基320和322而非318处以降低或消除C1q结合活性。通过极性残基置换318(Glu)残基可改变而非消除C1q结合活性。用Ala置换残基297(Asn)引起溶解活性去除,但仅略微降低(约弱三倍)对C1q的亲和力。这一改变破坏了糖基化位点和补体活化所需的碳水化合物的存在。该位点处的任何其它取代也破坏了糖基化位点。以下突变和其任何组合也降低C1q结合:D270A、K322A、P329A和P311S(参见WO 06/036291)。
提及人恒定区时包括具有任何天然同种异型或天然同种异型中占据多态位置的残基的任何排列的恒定区。另外,相对于天然人恒定区可存在至多1、2、5或10个突变,例如上文所指示的那些突变以减少Fcγ受体结合或增加与FcRN的结合。
核酸、载体和宿主细胞
在一些实施方案中,本文所描述的抗体使用重组方法制备。因此,在一些方面,本发明提供了分离的核酸,所述分离的核酸包含编码本文所描述的任何抗体(例如本文所描述的CDR中的任何一者或多者)的核酸序列;载体,所述载体包含这类核酸;以及宿主细胞,其中引入了用于复制编码抗体的核酸和/或表达抗体的核酸。在一些实施方案中,宿主细胞是真核细胞,例如中国仓鼠卵巢(CHO)细胞;或人类细胞。
在一些实施方案中,多核苷酸(例如分离的多核苷酸)包含编码本文所描述的抗体的核苷酸序列。在一些实施方案中,多核苷酸包含编码本文中所公开的一种或多种氨基酸序列(例如CDR、重链、轻链和/或框架区)的核苷酸序列。在一些实施方案中,多核苷酸包含编码与本文中所公开的序列(例如CDR、重链、轻链或框架区序列)具有至少85%序列同一性(例如至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性)的氨基酸序列的核苷酸序列。
在另一方面,提供了制备本文所描述的抗体的方法。在一些实施方案中,方法包括在适用于表达抗体的条件下培养如本文所描述的宿主细胞(例如表达如本文所描述的多核苷酸或载体的宿主细胞)。在一些实施方案中,随后从宿主细胞(或宿主细胞培养基)回收抗体。
含有编码本公开的抗体或其片段的多核苷酸的适合载体包括克隆载体和表达载体。尽管所选克隆载体可根据意图使用的宿主细胞变化,但适用克隆载体一般能够自我复制,可具有特定限制性核酸内切酶的单一目标和/或可携带可用于选择含有载体的克隆的标志物的基因。实例包括质粒和细菌病毒,例如pUC18、pUC19、Bluescript(例如pBS SK+)和其衍生物、mp18、mpl9、pBR322、pMB9、ColE1、pCR1、RP4、噬菌体DNA和穿梭载体(shuttlevector),例如pSA3和pAT28。克隆载体购自商业供应商,例如BioRad、Stratagene和Invitrogen。
表达载体一般是含有根据本公开的核酸的可复制多核苷酸构建体。表达载体可在宿主生物体中以游离体或染色体DNA的整体部分形式复制。适合的表达载体包括但不限于质粒、病毒载体,包括腺病毒、腺相关病毒、反转录病毒,和任何其它载体。
重组抗体的表达
抗体通常通过重组表达产生。重组多核苷酸构建体通常包括可操作地连接于抗体链的编码序列的表达控制序列,包括天然相关或异源启动子区。优选地,表达控制序列是载体中能够转化或转染真核宿主细胞的真核启动子系统。一旦载体已掺入适当宿主中,宿主就维持在适合高水平表达核苷酸序列且收集和纯化交叉反应抗体的条件下。
哺乳动物细胞是用于表达编码免疫球蛋白或其片段的核苷酸区段的优选宿主。参见Winnacker,From Genes to Clones,(VCH Publishers,NY,1987)。能够分泌完整异源蛋白质的多个适合的宿主细胞系已在本领域中开发,且包括CHO细胞系(例如DG44)、各种COS细胞系、HeLa细胞、HEK293细胞、L细胞和非抗体产生骨髓瘤,包括Sp2/0和NS0。优选地,细胞是非人类的。这些细胞的表达载体可包括表达控制序列,例如复制起点、启动子、增强子(Queen等人,Immunol.Rev.89:49(1986)),和必需的加工信息位点,例如核糖体结合位点、RNA剪接位点、多腺苷酸化位点,以及转录终止子序列。优选的表达控制序列来源于内源基因、巨细胞病毒、SV40、腺病毒、牛乳头瘤病毒等的启动子。参见Co等人,J.Immunol.148:1149(1992)。
一旦表达,抗体就可根据本领域的标准程序纯化,包括HPLC纯化、柱色谱、凝胶电泳等(通常参见Scopes,Protein Purification(Springer-Verlag,NY,1982))。
抗体表征
用于分析结合亲和力、结合动力学和交叉反应性的方法是本领域中已知的。参见例如Ernst等人,Determination of Equilibrium Dissociation Constants,TherapeuticMonoclonal Antibodies(Wiley&Sons 2009版)。这些方法包括但不限固相结合测定(例如ELISA测定)、免疫沉淀、表面等离子体共振(SPR,例如Biacore
V.治疗方法
在一些实施方案中,提供了用于治疗受试者的癌症的方法。在一些实施方案中,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体,其中抗TIGIT抗体包含具有增强的效应功能的Fc区。
在一些实施方案中,方法部分地基于以下出人意料的发现,即表达低水平PD-L1的癌症可以抗TIGIT抗体与抗PD-1抗体和/或抗PD-L1抗体的组合治疗。抗TIGIT抗体与抗PD-1抗体和/或抗PD-L1抗体之间的这一协同作用使得能够治疗当前不存在已经批准的使用抗PD1抗体或PD-L1抗体的单一疗法的癌症。
举例来说,表2展示了以某些抗PD-1抗体治疗某些癌症的治疗剂量水平、PD-L1表达水平和突变状态。表3展示了以某些抗PD-L1抗体治疗某些癌症的治疗剂量水平、PD-L1表达水平和突变状态。从这些表可见,许多这类抗体未被批准用于患有PD-L1表达水平低于某些临限值的癌症的受试者,且未被批准用于患有包含某些突变的癌症的受试者。如下文更详细地描述,本文所提供的方法可用于治疗患有PD-L1表达水平低于批准的截止或临限水平的肿瘤的患者;具有突变,例如表格中所列的突变,使得其对以抗PD1或抗PD-L1抗体治疗的反应较小的患者;和/或以低于表中所列的批准剂量的抗PD1或抗PD-L1抗体剂量治疗患者。
举例来说,虽然在一些实施方案中,抗PD-1抗体和/或抗PD-L1抗体以治疗剂量,例如表2和/或表3中所描述的剂量施用,但在其它实施方案中,抗PD-1抗体和/或抗PD-L1抗体可以亚治疗剂量,例如与表2和/或表3中所描述的剂量相比较低和/或以更低频率施用的剂量施用。在一些实施方案中,所述方法治疗患有癌症的受试者,所述癌症包含导致受试者排除在某些治疗(例如表2和/或表3中所描述的治疗)外的突变。
因此,在一些实施方案中,本文所公开的方法提供了对患有癌症的受试者的治疗,对于该受试者来说,表2和/或表3中所描述的治疗不可用。这些方法更详细地论述于下文中,例如关于PD-L1水平的临限值和给药。
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
在一些实施方案中,提供了治疗受试者的癌症的方法。在一些实施方案中,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中所述癌症的样品中的PD-L1水平如通过综合阳性评分(CPS)所测量小于10,或如通过总比例评分(TPS)所测量小于50%,或如通过总比例评分(TPS)所测量小于50%,或如通过肿瘤细胞评分(TC)所测量小于50%,或如通过肿瘤浸润性免疫细胞染色(IC)所测量小于10%,且其中所述抗TIGIT抗体包含具有增强的效应功能的Fc区。
在一些实施方案中,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中抗TIGIT抗体包含具有增强的效应功能的Fc区,且其中抗PD-1抗体或抗PD-L1抗体以亚治疗剂量施用。
在一些实施方案中,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中抗TIGIT抗体包含具有增强的效应功能的Fc区,且其中癌症选自小细胞肺癌、早期小细胞肺癌、肾细胞癌、尿路上皮癌、三阴性乳腺癌、胃癌、肝细胞癌、神经胶母细胞瘤、卵巢癌、头颈部鳞状细胞癌、食管鳞状细胞癌(ESCC)和非高微卫星不稳定性(非高MSI)结直肠癌。在一些实施方案中,所述方法是尿路上皮癌的一线治疗。
在一些实施方案中,所述方法包括向患有癌症的受试者施用(1)抗TIGIT抗体,和(2)抗PD-1抗体或抗PD-L1抗体;其中抗TIGIT抗体包含具有增强的效应功能的Fc区,且其中癌症包含降低抗PD-1抗体或抗PD-L1抗体的功效的突变。
在一些实施方案中,所述方法包括向患有癌症的受试者施用抗PD-1抗体和抗PD-L1抗体。在一些实施方案中,所述方法包括向患有癌症的受试者施用抗PD-1抗体但不施用抗PD-L1抗体。在一些实施方案中,所述方法包括向患有癌症的受试者施用抗PD-L1抗体但不施用抗PD-1抗体。
PD-L1临限水平
在一些实施方案中,如通过CPS所测量,癌症包含小于10,小于5,或小于3,或小于1的PD-L1水平。在一些实施方案中,如通过CPS所测量,癌症包含在0与10之间,或1与10之间,或3与10之间,或5与10之间,或0与7之间,或1与7之间,或3与7之间,或0与5之间,或1与5之间,或3与5之间,或0与3之间,或1与3之间的PD-L1水平。
在一些实施方案中,如通过TPS所测量,癌症包含小于50%,或小于40%,或小于30%,或小于20%,或小于10%,或小于5%,或小于3%,或小于1%的PD-L1水平。在一些实施方案中,如通过TPS所测量,癌症包含在0%与50%之间,或1%与50%之间,或3%与50%之间,或5%与50%之间,或10%与50%之间,或20%与50%之间,或0%与30%之间,或1%与30%之间,或3%与30%之间,或5%与30%之间,或10%与30%之间,或0%与20%之间,或3%与20%之间,或5%与20%之间的PD-L1水平。
在一些实施方案中,如通过TC所测量,癌症包含小于50%,或小于40%,或小于30%,或小于20%,或小于10%,或小于5,或小于3%,或小于1%的PD-L1水平。在一些实施方案中,如通过TC所测量,癌症包含在0%与50%之间,或1%与50%之间,或3%与50%之间,或5%与50%之间,或10%与50%之间,或20%与50%之间,或0%与30%之间,或1%与30%之间,或3%与30%之间,或5%与30%之间,或10%与30%之间,或0%与20%之间,或3%与20%之间,或5%与20%之间的PD-L1水平。
在一些实施方案中,如通过IC所测量,癌症包含小于10%,小于5%,或小于3%,或小于1%的PD-L1水平。在一些实施方案中,如通过IC所测量,癌症包含在0%与10%之间,或1%与10%之间,或3%与10%之间,或5%与10%之间,或0%与7%之间,或1%与7%之间,或3%与7%之间,或0%与5%之间,或1%与5%之间,或3%与5%之间,或0%与3%之间,或1%与3%之间的PD-L1水平。
抗TIGIT抗体和抗PD-1抗体或抗PD-L1抗体的给药
在一些实施方案中,抗PD-1抗体而非抗PD-L1抗体以亚治疗剂量施用。在一些实施方案中,抗PD-L1抗体而非抗PD-1抗体以亚治疗剂量施用。在一些实施方案中,抗PD-L1抗体和抗PD-1抗体中的每一者以亚治疗剂量施用。在一些实施方案中,抗TIGIT抗体以亚治疗剂量施用。
在一些实施方案中,抗PD-1抗体或抗PD-L1抗体的亚治疗剂量:a)低于针对所治疗的癌症的抗体的单一疗法剂量和/或b)包含比针对所治疗癌症的单一疗法给药频率更低的抗体给药频率。在一些实施方案中,抗TIGIT抗体的亚治疗剂量a)低于针对所治疗的癌症的抗TIGIT抗体的单一疗法剂量和/或b)包含比针对所治疗癌症的单一疗法给药频率更低的抗TIGIT抗体给药频率。在一些实施方案中,抗PD-1抗体或抗PD-L1抗体的亚治疗剂量:a)低于针对所治疗的癌症的抗体的单一疗法剂量和/或b)包含比针对所治疗癌症的单一疗法给药频率更低的抗体给药频率;且抗TIGIT抗体的亚治疗剂量a)低于针对所治疗的癌症的抗TIGIT抗体的单一疗法剂量和/或b)包含比针对所治疗癌症的单一疗法给药频率更低的抗TIGIT抗体给药频率。
在一些实施方案中,抗体的亚治疗剂量包括低于针对所治疗的癌症的抗体的单一疗法剂量的剂量。在一些实施方案中,亚治疗剂量是在针对所治疗的癌症的单一疗法剂量的5%与90%之间,或5%与80%之间,或5%与70%之间,或5%与60%之间,或5%与50%之间,或5%与40%之间,或5%与30%之间,或10%与90%之间,或10%与80%之间,或10%与70%之间,或10%与60%之间,或10%与50%之间,或10%与40%之间,或10%与30%之间,或20%与90%之间,或20%与80%之间,或20%与70%之间,或20%与60%之间,或20%与50%之间,或20%与40%之间,或20%与30%之间,或30%与90%之间,或50%与80%之间,或30%与70%之间,或30%与60%之间,或30%与50%之间,或30%与40%之间,或40%与90%之间,或40%与80%之间,或40%与70%之间,或40%与60%之间,或40%与50%之间,或50%与90%之间,或50%与80%之间,或50%与70%之间,或50%与60%之间的抗体剂量。
在一些实施方案中,亚治疗剂量是与抗体的单一疗法给药相比,较低频率的抗体给药。在一些实施方案中,当单一疗法给药为每周一次时,对于亚治疗给药,每10天,或每2周,或每3周,或每4周,或每月,或甚至以更低的频率施用抗体。在一些实施方案中,当单一疗法给药为每2周时,对于亚治疗给药,每3周,或每4周,或每月,或每5周,或每6周,或甚至以更低的频率施用抗体。在一些实施方案中,当单一疗法给药为每3周时,对于亚治疗给药,每4周,或每月,或每5周,或每6周,或每8周,或每2个月,或每10周,或每12周,或每3个月,或甚至以更低的频率施用抗体。在一些实施方案中,当单一疗法给药为每4周时,对于亚治疗给药,每5周,或每6周,或每8周,或每2个月,或每10周,或每12周,或每3个月,或每14周,或每16周,或每4个月,或甚至以更低的频率施用抗体。
在一些实施方案中,抗PD*1抗体的亚治疗剂量小于每2周240mg,小于每3周200mg,小于每3周350mg,小于每3周360mg,小于每4周480mg,或小于每6周400mg。在一些实施方案中,抗PD*1抗体的亚治疗剂量小于每2周200mg,小于每3周150mg,小于每3周300mg,小于每3周320mg,小于每4周420mg,或小于每6周350mg。在一些实施方案中,抗PD*1抗体的亚治疗剂量小于每2周150mg,小于每3周120mg,小于每3周250mg,小于每3周280mg,小于每4周360mg,或小于每6周300mg。在一些实施方案中,抗PD*1抗体的亚治疗剂量小于每2周100mg,小于每3周80mg,小于每3周200mg,小于每3周240mg,小于每4周320mg,或小于每6周250mg。在一些实施方案中,抗PD*1抗体的亚治疗剂量小于每2周50mg,小于每3周60mg,小于每3周150mg,小于每3周200mg,小于每4周240mg,或小于每6周200mg。在一些实施方案中,抗PD*1抗体的亚治疗剂量小于每2周25mg,小于每3周20mg,小于每3周100mg,小于每3周120mg,小于每4周180mg,或小于每6周160mg。
在一些实施方案中,所述方法包括施用抗PD*1抗体,其中抗PD*1抗体是派姆单抗,其中派姆单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法剂量是200mg或400mg。在一些实施方案中,所述方法包括施用抗PD*1抗体,其中抗PD*1抗体是纳武单抗,其中纳武单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法剂量是240mg、360mg或480mg。在一些实施方案中,所述方法包括施用抗PD*1抗体,其中抗PD*1抗体是西米普利单抗,其中西米普利单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法剂量是350mg。
在一些实施方案中,抗PD*1抗体的亚治疗剂量的频率低于每2周240mg,低于每3周200mg,低于每3周350mg,低于每3周360mg,低于每4周480mg,或低于每6周400mg。在一些实施方案中,抗PD*1抗体的亚治疗剂量的频率低于每4周240mg,低于每6周200mg,低于每6周350mg,低于每6周360mg,低于每8周480mg,或低于每12周400mg。在一些实施方案中,抗PD*1抗体的亚治疗剂量的频率低于每6周240mg,低于每9周200mg,低于每9周350mg,低于每9周360mg,低于每12周480mg,或低于每18周400mg。在一些实施方案中,抗PD*1抗体的亚治疗剂量的频率低于每8周240mg,低于每12周200mg,低于每12周350mg,低于每12周360mg,低于每16周480mg,或低于每24周400mg。在一些实施方案中,抗PD*1抗体的亚治疗剂量的频率低于每10周240mg,低于每15周200mg,低于每15周350mg,低于每15周360mg,低于每20周480mg,或低于每30周400mg。
在一些实施方案中,所述方法包括施用抗PD*1抗体,其中抗PD*1抗体是派姆单抗,其中派姆单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法给药的频率是每3周或每6周。在一些实施方案中,所述方法包括施用抗PD*1抗体,其中抗PD*1抗体是派姆单抗,其中派姆单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法剂量是每3周200mg或每6周400mg。在一些实施方案中,所述方法包括施用抗PD*1抗体,其中抗PD*1抗体是纳武单抗,其中纳武单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法给药的频率是每2周或每3周或每4周。在一些实施方案中,所述方法包括施用抗PD*1抗体,其中抗PD*1抗体是纳武单抗,其中纳武单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法剂量是每2周240mg、每3周360mg或每4周480mg。在一些实施方案中,所述方法包括施用抗PD-1抗体,其中抗PD-1抗体是西米普利单抗,其中西米普利单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法给药的频率是每3周。
在一些实施方案中,抗PD-L1抗体的亚治疗剂量小于每2周800mg,小于每2周840mg,小于每3周1,200mg,小于每3周1,500mg,或小于每4周1,680mg。在一些实施方案中,抗PD-L1抗体的亚治疗剂量小于每2周600mg,小于每2周620mg,小于每3周800mg,小于每3周1,000mg,或小于每4周1,240mg。在一些实施方案中,抗PD-L1抗体的亚治疗剂量小于每2周400mg,小于每2周410mg,小于每3周400mg,小于每3周500mg,或小于每4周820mg。在一些实施方案中,抗PD-L1抗体的亚治疗剂量小于每2周200mg,小于每3周200mg,小于每3周250mg,或小于每4周410mg。
在一些实施方案中,所述方法包括施用抗PD-L1抗体,其中抗PD-L1抗体是阿维单抗,其中阿维单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法剂量是800mg。在一些实施方案中,所述方法包括施用抗PD-L1抗体,其中抗PD-L1抗体是德瓦鲁单抗,其中德瓦鲁单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法剂量是10mg/kg或1,500mg。20.
在一些实施方案中,抗PD-L1抗体的亚治疗剂量的频率低于每2周800mg,低于每2周840mg,低于每3周1,200mg,低于每3周1,500mg,或低于每4周1,680mg。在一些实施方案中,抗PD-L1抗体的亚治疗剂量的频率低于每4周800mg,低于每4周840mg,低于每6周1,200mg,低于每6周1,500mg,或低于每8周1,680mg。在一些实施方案中,抗PD-L1抗体的亚治疗剂量的频率低于每6周800mg,低于每6周840mg,低于每9周1,200mg,低于每9周1,500mg,或低于每12周1,680mg。在一些实施方案中,抗PD-L1抗体的亚治疗剂量的频率低于每8周800mg,低于每8周840mg,低于每12周1,200mg,低于每12周1,500mg,或低于每16周1,680mg。在一些实施方案中,抗PD-L1抗体的亚治疗剂量的频率低于每10周800mg,低于每10周840mg,低于每15周1,200mg,低于每15周1,500mg,或低于每20周1,680mg。
在一些实施方案中,所述方法包括施用抗PD-L1抗体,其中抗PD-L1抗体是阿特珠单抗,其中阿特珠单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法剂量是840mg、1,200mg或1,680mg。在一些实施方案中,所述方法包括施用抗PD-L1抗体,其中抗PD-L1抗体是阿维单抗,其中阿维单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,其中单一疗法给药的频率是每2周。在一些实施方案中,所述方法包括施用抗PD-L1抗体,其中抗PD-L1抗体是德瓦鲁单抗,其中德瓦鲁单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,其中单一疗法给药的频率是每2周或每4周。在一些实施方案中,所述方法包括施用抗PD-L1抗体,其中抗PD-L1抗体是德瓦鲁单抗,其中德瓦鲁单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法剂量是每2周10mg/kg或每4周1,500mg。在一些实施方案中,所述方法包括施用抗PD-L1抗体,其中抗PD-L1抗体是阿特珠单抗,其中阿特珠单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,其中单一疗法给药的频率是每2周、每3周或每4周。在一些实施方案中,所述方法包括施用抗PD-L1抗体,其中抗PD-L1抗体是阿特珠单抗,其中阿特珠单抗以单一疗法剂量或低于单一疗法剂量的亚治疗剂量(例如在本文所提供的百分比内或以本文所提供的降低的剂量或频率)施用,且其中单一疗法剂量是每2周840mg、每3周1,200mg或每4周1,680mg。
在一些实施方案中,抗TIGIT抗体的亚治疗剂量包括低于针对所治疗的癌症的抗TIGIT抗体的单一疗法剂量的剂量。在一些实施方案中,亚治疗剂量是在针对所治疗的癌症的单一疗法剂量的5%与90%之间,或5%与80%之间,或5%与70%之间,或5%与60%之间,或5%与50%之间,或5%与40%之间,或5%与30%之间,或10%与90%之间,或10%与80%之间,或10%与70%之间,或10%与60%之间,或10%与50%之间,或10%与40%之间,或10%与30%之间,或20%与90%之间,或20%与80%之间,或20%与70%之间,或20%与60%之间,或20%与50%之间,或20%与40%之间,或20%与30%之间,或30%与90%之间,或50%与80%之间,或30%与70%之间,或30%与60%之间,或30%与50%之间,或30%与40%之间,或40%与90%之间,或40%与80%之间,或40%与70%之间,或40%与60%之间,或40%与50%之间,或50%与90%之间,或50%与80%之间,或50%与70%之间,或50%与60%之间的抗TIGIT抗体的剂量。
然而,剂量可根据几个因素变化,包括所选施用途径、组合物的配制、患者反应、病状的严重程度、受试者的重量和处方医师的判断。取决于个别患者的需要,剂量可随时间推移而增加或减少。在一些实施方案中,最初给与患者低剂量,接着提高到患者可耐受的较高剂量。在一些实施方案中,最初给与患者较高剂量,接着降低到较低剂量。
例示性适应症
在一些实施方案中,癌症是膀胱癌、乳腺癌、三阴性乳腺癌、子宫癌、宫颈癌、卵巢癌、前列腺癌、睾丸癌、食管癌、食管鳞状细胞癌(ESCC)、胃肠癌、胃癌(gastric cancer)、胰腺癌、结直肠癌、非高微卫星不稳定性(非高MSI)结直肠癌、结肠癌、肾癌、肾细胞癌、透明细胞肾癌、头颈癌、神经胶母细胞瘤、肺癌、小细胞肺癌、早期小细胞肺癌、肺腺癌、胃癌(stomach cancer)、生殖细胞癌、骨癌、肝癌、肝细胞癌、甲状腺癌、皮肤癌、黑素瘤、中枢神经系统肿瘤、间皮瘤、淋巴瘤、白血病、慢性淋巴细胞白血病、弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤、霍奇金淋巴瘤、骨髓瘤或肉瘤。在一些实施方案中,癌症选自胃癌、睾丸癌、胰腺癌、肺腺癌、膀胱癌、尿路上皮癌、头颈癌、头颈部鳞状细胞癌、前列腺癌、间皮瘤和透明细胞肾癌。在一些实施方案中,癌症是淋巴瘤或白血病,包括但不限于急性骨髓、慢性骨髓、急性淋巴细胞或慢性淋巴细胞白血病、弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤、小淋巴细胞性淋巴瘤、原发性纵隔大B细胞淋巴瘤、脾边缘区B细胞淋巴瘤或结外边缘区B细胞淋巴瘤。在一些实施方案中,癌症是结直肠癌、结肠癌、肾癌或透明细胞肾癌。在一些实施方案中,癌症是转移性癌症。
在一些实施方案中,癌症选自小细胞肺癌、早期小细胞肺癌、肾细胞癌、尿路上皮癌、三阴性乳腺癌、胃癌、肝细胞癌、神经胶母细胞瘤、卵巢癌、头颈部鳞状细胞癌、食管鳞状细胞癌(ESCC)和非高微卫星不稳定性(非高MSI)结直肠癌。
在一些实施方案中,癌症是非小细胞肺癌。
在一些实施方案中,癌症是具有高肿瘤突变负荷的癌症,因为这类癌症通常具有较多驱动T细胞反应的抗原。因此,在一些实施方案中,癌症是高突变负荷癌症,例如肺癌、黑素瘤、膀胱癌或胃癌。在一些实施方案中,癌症具有微卫星不稳定性。
在一些实施方案中,
a)癌症是非小肺癌,且TPS<1%;
b)癌症是头颈部鳞状细胞癌(HNSCC),且CPS<1;
c)癌症是尿路上皮癌,且CPS<10;
d)癌症是胃癌,且CPS<1;
e)癌症是食管癌,且CPS<10;
f(癌症是宫颈癌,且CPS<1;或
g)癌症是三阴性乳腺癌,且CPS<10。
在一些实施方案中,
a)癌症是尿路上皮癌,且IC<5%;
b)癌症是三阴性乳腺癌,且IC<1%;或
c)癌症是非小细胞肺癌,且IC<10%。
在一些实施方案中,癌症是非小细胞肺癌,且TPS<50%。
在一些实施方案中,所述方法是尿路上皮癌的一线治疗。
在一些实施方案中,癌症包含降低抗PD-1抗体和/或抗PD-L1抗体的功效的突变。在一些实施方案中,癌症包含降低抗PD-1抗体和抗PD-L1抗体中的每一者的功效的突变。在一些实施方案中,癌症包含降低抗PD-1抗体而非抗PD-L1抗体的功效的突变。在一些实施方案中,癌症包含降低抗PD-L1抗体而非抗PD-L1抗体的功效的突变。在一些实施方案中,癌症包含降低抗TIGIT抗体的功效的突变。
在一些实施方案中,癌症包含EGFR基因中的突变和/或ALK基因中的突变和/或ROS1基因中的突变。在一些实施方案中,癌症包含EGFR基因中的突变和/或ALK基因中的突变。在一些实施方案中,癌症包含EGFR基因中的突变和ALK基因中的突变,但不包含ROS1基因中的突变。在一些实施方案中,癌症包含EGFR基因中的突变和ROS1基因中的突变,但不包含ALK基因中的突变。在一些实施方案中,癌症包含ALK基因中的突变和ROS1基因中的突变,但不包含EGFR基因中的突变。在一些实施方案中,癌症包含EGFR基因中的突变,但不包含ALK基因中的突变或ROS1基因中的突变。在一些实施方案中,癌症包含ALK基因中的突变,但不包含EGFR基因中的突变或ROS1基因中的突变。在一些实施方案中,癌症包含ROS1基因中的突变,但不包含ALK基因中的突变或EGFR基因中的突变。
其它例示性实施方案
在一些实施方案中,抗TIGIT抗体包含与FcγRIIIa、FcγRIIa和FcγRI中的至少一者的结合增强的Fc。在一些实施方案中,抗TIGIT抗体包含与FcγRIIIa、FcγRIIa和FcγRI中的每一者的结合增强的Fc。在一些实施方案中,抗TIGIT抗体包含与至少FcγRIIIa和FcγRIIa的结合增强的Fc。在一些实施方案中,抗TIGIT抗体包含与至少FcγRIIIa和FcγRI的结合增强的Fc。在一些实施方案中,抗TIGIT抗体包含与至少FcγRIIa和FcγRI的结合增强的Fc。在一些实施方案中,抗TIGIT抗体包含与至少FcγRIIIa的结合增强的Fc。在一些实施方案中,抗TIGIT抗体包含与至少FcγRIIa的结合增强的Fc。在一些实施方案中,抗TIGIT抗体包含与至少FcγRI的结合增强的Fc。
在一些实施方案中,抗TIGIT抗体的Fc与一种或多种抑制性FcγR的结合减弱。
在一些实施方案中,抗TIGIT抗体的Fc与FcγRIIb的结合减弱。
在一些实施方案中,抗TIGIT抗体在重链恒定区中包含取代S293D、A330L和I332E。
在一些实施方案中,抗TIGIT抗体未岩藻糖基化。在一些实施方案中,抗TIGIT抗体包含于抗TIGIT抗体的组合物中,其中组合物中至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的抗TIGIT抗体未岩藻糖基化。
在一些实施方案中,抗TIGIT抗体的Fc包含相对于相同同型的对应野生型Fc具有增强的ADCC和/或ADCP活性的Fc。
在一些实施方案中,抗TIGIT抗体包含:
a)重链CDR1,所述重链CDR1包含选自SEQ ID NO:7-9的氨基酸序列;
b)重链CDR2,所述重链CDR2包含选自SEQ ID NO:10-13的氨基酸序列;
c)重链CDR3,所述重链CDR3包含选自SEQ ID NO:14-16的氨基酸序列;
d)轻链CDR1,所述轻链CDR1包含SEQ ID NO:17的氨基酸序列;
e)轻链CDR2,所述轻链CDR2包含SEQ ID NO:18的氨基酸序列;和
f)轻链CDR3,所述轻链CDR3包含SEQ ID NO:19的氨基酸序列。
在一些实施方案中,抗TIGIT抗体包含重链CDR1、CDR2和CDR3以及轻链CDR1、CDR2和CDR3,所述CDR包含以下序列:
a)分别SEQ ID NO:7、10、14、17、18和19;或
b)分别SEQ ID NO:8、11、14、17、18和19;或
c)分别SEQ ID NO:9、12、15、17、18和19;或
d)分别SEQ ID NO:8、13、16、17、18和19;或
e)分别SEQ ID NO:8、12、16、17、18和19。
在一些实施方案中,抗TIGIT抗体包含包括选自SEQ ID NO:1-5的氨基酸序列的重链可变区和包括SEQ ID NO:6的氨基酸序列的轻链可变区。
在一些实施方案中,抗TIGIT抗体包含包括选自SEQ ID NO:20-24的氨基酸序列的重链和包括SEQ ID NO:25的氨基酸序列的轻链。
在一些实施方案中,所述方法包括施用抗PD-1抗体或多种抗PD-1抗体。
在一些实施方案中,抗PD-1抗体选自以下或多种抗PD-1抗体中的每一者独立地选自以下:派姆单抗、纳武单抗、CT-011、BGB-A317、西米普利单抗、信迪利单抗、替雷利珠单抗、TSR-042、PDR001或特瑞普利单抗。
在一些实施方案中,所述方法包括施用抗PD-1抗体,其中抗PD-1抗体是派姆单抗或纳武单抗。在一些实施方案中,所述方法包括施用抗PD-1抗体,其中抗PD-1抗体是西米普利单抗。在一些实施方案中,所述方法包括施用抗PD-L1抗体,其中抗PD-L1抗体是阿特珠单抗。
在一些实施方案中,所述方法包括施用抗PD-L1抗体或多种抗PD-L1抗体。
在一些实施方案中,抗PD-L1抗体选自以下或多种抗PD-L1抗体中的每一者独立地选自以下:德瓦鲁单抗、BMS-936559、阿特珠单抗或阿维单抗。
在一些实施方案中,所述方法包括施用抗PD-1抗体,其中抗PD-1抗体是派姆单抗或纳武单抗;或其中所述方法包括施用抗PD-L1抗体,其中抗PD-L1抗体是阿特珠单抗。
在各种实施方案中,抗TIGIT抗体耗竭T调节(Treg)细胞、活化抗原呈递细胞(APC)、增强CD8 T细胞反应、上调共刺激受体和/或促进免疫活化细胞因子(例如CXCL10和/或IFNγ)的释放。在一些实施方案中,抗TIGIT抗体促进免疫活化细胞因子释放的程度大于免疫抑制细胞因子(例如IL10和/或MDC)。
抗TIGIT抗体、抗PD-1抗体和/或抗PD-L1抗体可同时或依序施用。对于依序施用,抗TIGIT抗体、抗PD-1抗体和抗PD-L1抗体中的一者的至少第一剂量可在抗TIGIT抗体、抗PD-1抗体和抗PD-L1抗体中的另一者的至少第一剂量之前施用。对于同时施用,在一些实施方案中,抗TIGIT抗体、抗PD-1抗体和抗PD-L1抗体中的一者的至少第一剂量和抗TIGIT抗体、抗PD-1抗体和抗PD-L1抗体中的另一者的至少第一剂量可以独立药物组合物形式或在同一药物组合物中施用。
药物组合物的施用途径可以是经口、腹膜内、经皮、皮下、静脉内、肌肉内、吸入、局部、病灶内、经直肠、支气管内、经鼻、经粘膜、经肠道、经眼或经耳递送,或本领域中已知的任何其它方法。在一些实施方案中,一种或多种治疗剂经口、静脉内或腹膜内施用。
共施用的治疗剂,例如抗TIGIT抗体、抗PD-1抗体和/或抗PD-L1抗体中的任一者可一起或分开、同时或在不同时间施用。当施用时,治疗剂可视需要独立地每天施用一次、两次、三次、四次或更多次或更少次。在一些实施方案中,所施用的治疗剂每天施用一次。在一些实施方案中,所施用的治疗剂在一个或多个相同时间施用,例如作为掺合物。在一些实施方案中,治疗剂中的一者或多者以持续释放制剂形式施用。
在一些实施方案中,本文所提供的组合疗法中的任一者向受试者长时间段施用,例如持续至少30天、40天、50天、60天、70天、80天、90天、100天、150天、200天、250天、300天、350天或更长时间。
例示性功效结果
在一些实施方案中,在本文所描述的组合疗法中的至少一些的情况下观察到的增强的活性与对应单一疗法治疗相比具有某些益处。举例来说,在一些实施方案中,组合疗法的毒性概况与以单一疗法形式施用时组分抗体中的任一者的毒性概况相当。在一些实施方案中,与以单一疗法形式施用时组分抗体中的任一者提供的反应持续时间相比,施用组合疗法提供了更长反应持续时间。在一些实施方案中,与以单一疗法形式施用时组分抗体中的任一者引起的无进展存活期相比,施用组合疗法引起更长无进展存活期。在一些实施方案中,施用组合疗法可用于治疗在以组合疗法的组分抗体中的任一者进行单一疗法治疗后复发的复发性癌症。
VI.组合物和试剂盒
在另一方面,提供了用于治疗或预防受试者的癌症的组合物和试剂盒。
药物组合物
在一些实施方案中,提供了用于本发明方法的药物组合物。在一些实施方案中,(1)抗TIGIT抗体和(2)抗PD-1抗体和/或抗PD-L1抗体中的至少一者以第一药物组合物形式施用,且(1)抗TIGIT抗体和(2)抗PD-1抗体和/或抗PD-L1抗体中的至少另一者以第二药物组合物形式施用。在一些实施方案中,(1)抗TIGIT抗体和(2)抗PD-1抗体和/或抗PD-L1抗体以单一药物组合物形式施用。
用于制备用于本发明的制剂的指导见于例如Remington.The Science andPractice of Pharmacy,第21版,2006,见上文;Martindale.The Complete DrugReference,Sweetman,2005,London:Pharmaceutical Press;Niazi,Handbook ofPharmaceutical Manufacturing Formulations,2004,CRC Press;以及Gibson,Pharmaceutical Preformulation and Formulation:A Practical Guide fromCandidate Drug Selection to Commercial Dosage Form,2001,Interpharm Press,这些参考特此以引用的方式并入本文中。本文所描述的药物组合物可以本领域的技术人员已知的方式,例如借助于常规混合、溶解、粒化、糖衣药丸制造、乳化、囊封、包覆或冻干工艺制造。以下方法和赋形剂仅仅是例示性的且决不是限制性的。
在一些实施方案中,制备一种或多种治疗剂以用于在持续释放、控制释放、延长释放、定时释放或延迟释放制剂中,例如在含有治疗剂的固体疏水性聚合物的半渗透基质中递送。已确立各种类型的持续释放物质且是本领域的技术人员众所知周的。当前延长释放制剂包括膜衣片剂、多微粒或丸粒系统、使用亲水性或亲脂性物质的基质技术和具有成孔赋形剂的基于蜡的片剂(参见例如Huang等人,Drug Dev.Ind.Pharm.29:79(2003);Peamchob等人,Drug Dev.Ind.Pharm.29:925(2003);Maggi等人,Eur.J.Pharm.Biopharm.55:99(2003);Khanvilkar等人,Drug Dev.Ind.Pharm.228:601(2002);以及Schmidt等人,Iht.J.Pharm.216:9(2001))。持续释放递送系统取决于其设计可在数小时或数天过程中释放化合物,例如经4小时、6小时、8小时、10小时、12小时、16小时、20小时、24小时或更长。通常,持续释放制剂可使用天然存在的或合成聚合物来制备,所述天然产生的或合成聚合物例如聚合乙烯基吡咯烷酮,例如聚乙烯吡咯烷酮(PVP);羧基乙烯基亲水性聚合物;疏水性和/或亲水性水解胶体,例如甲基纤维素、乙基纤维素、羟丙基纤维素和羟丙基甲基纤维素;以及羧基聚亚甲基。
对于经口施用,治疗剂可通过与本领域中众所知周的药学上可接受的载体组合而容易地配制。这类载体使得化合物能够配制成用于由待治疗的患者经口摄取的片剂、丸剂、糖衣药丸、胶囊、乳液、亲脂性和亲水性悬浮液、液体、凝胶、糖浆、浆液、悬浮液等。经口使用的药物制剂可通过将化合物与固体赋形剂混合,任选地研磨所得混合物,且必要时在添加适合助剂之后加工颗粒的混合物以得到片剂或糖衣药丸芯来获得。适合的赋形剂包括例如填充剂,例如糖,包括乳糖、蔗糖、甘露醇或山梨醇;纤维素制剂,例如玉米淀粉、小麦淀粉、大米淀粉、马铃薯淀粉、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮(PVP)。必要时,可添加崩解剂,例如交联聚乙烯吡咯烷酮、琼脂或褐藻酸或其盐,例如褐藻酸钠。
治疗剂可被配制用于通过注射,例如通过弹丸注射或连续输注来进行不经肠施用。对于注射,可通过将一种或多种化合物溶解、悬浮或乳化于水性或非水溶剂,例如植物油或其它类似油、合成脂族酸甘油酯、高级脂族酸的酯或丙二醇中,且视需要,伴以常规添加剂,例如增溶剂、等张剂、悬浮剂、乳化剂、稳定剂和防腐剂来将该一种或多种化合物配制成制剂。在一些实施方案中,化合物可配制于水溶液中,优选地配制于生理相容缓冲液,例如汉克氏溶液(Hanks′s solution)、林格氏溶液(Ringer′s solution)或生理盐水缓冲液中。注射用制剂可呈单位剂型,例如以安瓿或多剂量容器形式,其中添加有防腐剂。组合物可采用例如于油性或水性媒介物中的悬浮液、溶液或乳液的形式,且可含有例如悬浮剂、稳定剂和/或分散剂的配制剂。
治疗剂可通过经粘膜或经皮方式全身性施用。对于经粘膜或经皮施用,在制剂中使用适于待渗透的障壁的渗透剂。对于局部施用,药剂被配制成软膏、乳膏、油膏、散剂和凝胶。在一个实施方案中,经皮递送剂可以是DMSO。经皮递送系统可包括例如贴剂。对于经粘膜施用,在制剂中使用适于待渗透的障壁的渗透剂。这类渗透剂一般是本领域中已知的。例示性经皮递送制剂包括美国专利No.6,589,549;6,544,548;6,517,864;6,512,010;6,465,006;6,379,696;6,312,717和6,310,177中所描述的制剂,所述专利中的每一者特此以引用的方式并入本文中。
在一些实施方案中,药物组合物包含可接受的载体和/或赋形剂。药学上可接受的载体包括生理相容且优选地不会干扰或另外抑制治疗剂的活性的任何溶剂、分散介质或包衣。在一些实施方案中,载体适用于静脉内、肌肉内、经口、腹膜内、经皮、局部或皮下施用。药学上可接受的载体可含有一种或多种生理学上可接受的化合物,其用于例如使组合物稳定或增加或减少活性剂吸收。生理学上可接受的化合物可包括例如碳水化合物,例如葡萄糖、蔗糖或聚葡萄糖;抗氧化剂,例如抗坏血酸或谷胱甘肽;螯合剂;低分子量蛋白质;减少活性剂的清除或水解的组合物或赋形剂或其它稳定剂和/或缓冲剂。其它药学上可接受的载体和其制剂是众所知周的且一般描述于例如Remington:The Science and Practice ofPharmacy,第21版,Philadelphia,PA.Lippincott Williams&Wilkins,2005中。各种药学上可接受的赋形剂是本领域中众所知周的且可见于例如Handbook of PharmaceuticalExcipients(第5版,Rowe等人编,Pharmaceutical Press,Washington,D.C.)中。
本公开的药物组合物的剂量和所需浓度可视所设想的特定用途而变化。适当剂量或施用途径的确定完全在本领域的技术人员的技能内。本文中还描述了适合的剂量。
试剂盒
在一些实施方案中,提供了用于治疗患有癌症的受试者的试剂盒。在一些实施方案中,试剂盒包含:
如本文所提供的抗TIGIT抗体;和
如本文所提供的抗PD-1抗体和/或抗PD-L1抗体。
在一些实施方案中,试剂盒还可包含含有用于实践本发明方法的说明(即,方案)的说明材料(例如使用试剂盒治疗癌症的说明书)。虽然说明材料通常包含书面或印刷材料,但其不限于此。本发明考虑了能够存储这类说明书且将其传达到最终使用者的任何媒体。这类媒体包括但不限于电子储存媒体(例如磁盘、磁带、盒式磁带、芯片)、光学媒体(例如CD ROM)等。这类媒体可包括提供这类说明材料的互联网网站的网址。
VII.实施例
下文所论述的实施例仅意图例示本发明,且不应视为以任何方式限制本发明。所述实施例不意图表示以下实验是所进行的所有实验或唯一实验。已努力确保关于所用数量(例如量、温度等)的准确性,但应当考虑一些实验误差和偏差。除非另有指示,否则份数为重量份,分子量为平均分子量,温度以摄氏度计,且压力为大气压或接近大气压。
实施例1:不同的同基因模型中的肿瘤微环境
1.1材料和方法
将Renca、CT26和MC38肿瘤细胞皮下植入Balb/c或C57BL/6小鼠且使其生长到100mm
1.2结果
测定且绘制肿瘤中每个细胞类型的百分比(图1A-图1C)。每个肿瘤在治疗开始之前100mm
实施例2:肿瘤PD-1和PD-L1表达水平
1.1材料和方法
对各种大小(100mm
1.2结果
该分析揭露了不同肿瘤模型之间的不同PD-1和PD-L1表达水平(图2A-图2B),其中MC38肿瘤显示两种分子的最低平均水平,之后为Renca肿瘤。CT26肿瘤展现两种分子的最高水平。
实施例3:MC38肿瘤对抗TIGIT和抗PD-1抗体的反应性
1.1材料和方法
通过用MC38同基因肿瘤细胞系植入C57BL/6小鼠,测试MC38肿瘤对具有不同Fc骨架的各种抗TIGIT抗体与抗PD-1抗体的组合的反应性。皮下植入肿瘤,且当其达到100mm
1.2结果
单独以次最佳剂量(0.1mg/kg)或更低剂量的任一剂治疗的动物仅展现最小反应性和肿瘤生长延迟(图3)(单独的TIGIT未示)。将Fc无效抗TIGIT LALA抗体添加到PD-1治疗中未增强抗肿瘤活性。将基于mIgG2a骨架(FcγR接合与IgG1人骨架的FcγR接合等效)的标准抗TIGIT添加到PD-1治疗中显著提高肿瘤生长延迟的程度且使治愈率提高两倍(图3)。
然而,当该Fc相互作用利用未岩藻糖基化抗TIGIT抗体(SEA-TGT mIgG2a)的SEA骨架进一步增强时,抗肿瘤活性甚至得到进一步增强且伴随完全反应再提高两倍(图3)。这些数据证明,抗TIGIT抗体的Fc接合有助于驱动抗TIGIT治疗与抗PD-1阻断之间的协同作用。此外,值得注意的是,在MC38模型中看到这种与SEA-TGTmIgG2a的协同活性,该模型具有最低的PD-1表达水平和PD-L1表达水平两者(图2)。
实施例4:CT26和Renca肿瘤对抗TIGIT和抗PD-1抗体的反应性
1.1材料和方法
在CT26和Renca模型中进一步测试对SEA-TGT mIgG2a(额外细节参见实施例3)与抗PD-1抗体的组合的反应性。Balb/c小鼠植入了CT26或Renca同基因肿瘤细胞系。皮下植入肿瘤且当其达到100mm
1.2结果
单独以0.1mg/kg次最佳剂量SEA-TGT治疗的动物在CT26模型(图4A)和Renca模型(图4B)两者中均展现最小反应性和肿瘤生长延迟;类似地,在低剂量抗PD-1治疗的情况下发现最小抗肿瘤活性。然而,添加两种次最佳剂量的SEA-TGT mIgG2a和抗PD-1抗体极大地增强抗肿瘤活性。在CT26模型(图4A)和Renca模型(图4B)两者中看到肿瘤生长延迟和对组合治疗的完全反应两者的增加。与Renca模型(图4B)相比,CT26模型(图4A)中组合活性的程度更高,MC38模型(图3)仍展现对组合的最大敏感性。
1.3实施例2-4的概述
鉴于这些模型中的PD-L1表达水平不同(图2A-2B),来自实施例2-4的数据证明SEA-TGT mIgG2a和抗小鼠PD-1抗体的协同效应出人意料地与潜在PD-L1表达水平不相关。MC38模型具有最低PD-L1表达水平,在以SEA-TGT mIgG2a与抗PD-1抗体的组合治疗时展示最大效果(图3)。
包含具有增强的效应功能的Fc区的抗TIGIT抗体(例如未岩藻糖基化抗体,例如SEA-TGT)即使在表达较低水平PD-L1的肿瘤模型中也能够展现与抗PD-1抗体的协同效应的发现出人意料。事实就是如此,因为具有其它Fc骨架(例如野生型或IgG1效应无效)的抗TIGIT抗体的研究已发现该组合依赖于相对高的PD-L1表达水平。因此,常规地,用这类抗TIGIT抗体进行的临床试验通常被设计成仅在表达高于某些临限限值的PD-L1的患者中测试该组合。
实施例5:用单一剂治疗MC38、CT26和Renca肿瘤
1.1材料和方法
MC38、CT26和Renca肿瘤对具有不同Fc骨架的抗TIGIT抗体的反应性通过用指定同基因肿瘤细胞系植入C57BL/6或Balb/c小鼠来测试(图5A-5F)。皮下植入肿瘤且当其达到100mm
1.2结果
在MC38模型中,即使在5mg/kg剂量的单独抗TIGIT治疗下,完全反应治愈率也仅为1/6(图5A),与之相对,在仅0.1mg/kg SEA-TGT mIgG2a与0.1mg/kg剂量的抗PD-1抗体组合时完全反应治愈率为4/5(图3)。因此,在MC38模型中,组合疗法的完全反应率比即使在呈单一疗法形式的SEA-TGT mIgG2a的剂量水平增加50倍的情况下达成的完全反应率更佳。
在CT26模型中,与MC38模型中达成的治愈反应水平相比,5mg/kg剂量的SEA-TGTmIgG2a驱动提高的治愈反应水平(图5B),但即使如此,在与抗PD-1抗体一起给与时在0.1mg/kg剂量情况下发现类似水平的治愈反应(图4A)(即,驱动相同反应率的SEA-TGT抗体水平减少50倍)。
相比之下,在Renca模型中,1mg/kg剂量的SEA-TGT mIgG2a驱动治愈反应(图5C),而在与抗PD-1抗体一起给与时在0.1mg/kg剂量情况下发现类似反应(图4B)。
在单独的抗PD-1抗体治疗的情况下,5mg/kg的剂量减少MC38模型中的肿瘤生长(图5D),10mg/kg的剂量更适度地减少CT26模型中的肿瘤生长(图5E),且1mg/kg的剂量未减少Renca模型中的肿瘤生长(图5F)。尽管单一药剂活性极小,但在所有这些模型中以显著较低剂量将SEA-TGT添加到抗PD-1治疗中能够极大地提高抗肿瘤活性。
总体来说,前述实施例中呈现的结果支持出人意料的发现,即表达低水平PD-L1的癌症可通过抗TIGIT抗体和抗TIGIT抗体与PD-1/PD-L1抑制剂的组合治疗。如前述实施例所证明,尤其发现在使用具有增强的Fc结合特征和效应功能的抗体(例如SEA-TGT)时是这样的情况。所需Fc结合特征包括活性,例如与活化性FcγR的结合增强、与抑制性FcγR的结合减弱、ADCC活性增强和/或ADCP活性增强。具有所需活性的某些这类抗体未岩藻糖基化,例如SEA-TGT。举例来说,本文所提供的数据支持具有增强的Fc骨架的抗TIGIT抗体(例如SEA-TGT)与抗PD1或抗PD-L1抗体的组合治疗患有肿瘤的患者的用途,所述肿瘤表达的PD-L1低于当前批准的使用抗PD1或抗PD-L1抗体的疗法中的截止水平。数据进一步支持在由于例如本文所描述的肿瘤中的突变而对利用抗PD1或抗PDL1抗体治疗的标准治疗也相对无反应的患者中进行这类组合疗法。
本文所提供的数据还证明,以抗TIGIT抗体(例如具有增强效应功能的抗TIGIT抗体,例如SEA-TGT)和亚治疗剂量的PD-L1抑制剂治疗展现功效的协同改良。数据还表明,亚治疗剂量的这类抗TIGIT抗体可与PD-1/PD-L1抑制剂组合使用以治疗表达低水平PD-L1的癌症。以较低水平的抗PD1(或抗PD-L1)抗体和/或抗TIGIT抗体给药的能力可潜在地减轻毒性。
不意图受理论束缚,在TIGIT的情况下,咸信未岩藻糖基化抗TIGIT抗体提高抗原(+)T细胞与抗原呈递细胞之间的免疫突触强度。先天性细胞上的FcγRIIIa接合提高其活化和可增强抗原特异性T细胞反应的因子的产生。未岩藻糖基化骨架可独立于目标抗原,结合于先天性免疫细胞或其它表达FcgγIIIa的细胞,例如γδT细胞,以诱导可帮助引发二级抗原特异性T细胞反应的活化状态。未岩藻糖基化抗体借以起作用的所有这些机制可引起驱动抗肿瘤活性和长期免疫保护的T细胞反应。与FcγRIIb的结合降低或缺乏意指不存在降低由未岩藻糖基化抗体驱动的免疫活化的反信号或抑制信号。
本文中所引用的所有公布、专利、专利申请或其它文献皆特此以全文引用的方式并入以用于达成所有目的,引用的程度就如同个别地指示将每个个别的公布、专利、专利申请或其它文献以引用的方式并入以用于所有目的一样。
VIII.序列表
/>
/>
/>
/>
序列表
<110>思进公司(Seagen Inc.)
<120>以抗TIGIT抗体治疗癌症的方法
<130>01218-0028-00PCT
<150>US 63/173,216
<151>2021-04-09
<160>25
<170>PatentIn version 3.5
<210>1
<211>125
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>抗TIGIT抗体克隆13 VH蛋白
<400>1
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 1015
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
202530
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
354045
Gly Ser Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
505560
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65707580
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
859095
Ala Arg Gly Pro Ser Glu Val Gly Ala Ile Leu Gly Tyr Val Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210>2
<211>125
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>抗TIGIT抗体克隆13A VH
<400>2
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 1015
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Leu Ser Ser
202530
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
354045
Gly Ser Leu Ile Pro Tyr Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
505560
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65707580
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
859095
Ala Arg Gly Pro Ser Glu Val Gly Ala Ile Leu Gly Tyr Val Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210>3
<211>125
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>抗TIGIT抗体克隆13B VH
<400>3
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 1015
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ala Trp
202530
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
354045
Gly Ser Ile Ile Pro Tyr Phe Gly Lys Ala Asn Tyr Ala Gln Lys Phe
505560
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65707580
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
859095
Ala Arg Gly Pro Ser Glu Val Ser Gly Ile Leu Gly Tyr Val Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210>4
<211>125
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>抗TIGIT抗体克隆13C VH
<400>4
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 1015
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Leu Ser Ser
202530
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
354045
Gly Ser Ile Ile Pro Leu Phe Gly Lys Ala Asn Tyr Ala Gln Lys Phe
505560
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65707580
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
859095
Ala Arg Gly Pro Ser Glu Val Lys Gly Ile Leu Gly Tyr Val Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210>5
<211>125
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>抗TIGIT抗体克隆13D VH
<400>5
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 1015
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Leu Ser Ser
202530
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
354045
Gly Ser Ile Ile Pro Tyr Phe Gly Lys Ala Asn Tyr Ala Gln Lys Phe
505560
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65707580
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
859095
Ala Arg Gly Pro Ser Glu Val Lys Gly Ile Leu Gly Tyr Val Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210>6
<211>112
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13、13A、13B、13C和13D VL蛋白
<400>6
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
202530
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
859095
Arg Arg Ile Pro Ile Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210>7
<211>9
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13 VH CDR1
<400>7
Gly Thr Phe Ser Ser Tyr Ala Ile Ser
1 5
<210>8
<211>9
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13A、13C和13D VH CDR1
<400>8
Gly Thr Phe Leu Ser Ser Ala Ile Ser
1 5
<210>9
<211>9
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13B VH CDR1
<400>9
Gly Thr Phe Ser Ala Trp Ala Ile Ser
1 5
<210>10
<211>17
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13 VH CDR2
<400>10
Ser Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 1015
Gly
<210>11
<211>17
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13A VH CDR2
<400>11
Ser Leu Ile Pro Tyr Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 1015
Gly
<210>12
<211>17
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13B和13D VH CDR2
<400>12
Ser Ile Ile Pro Tyr Phe Gly Lys Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 1015
Gly
<210>13
<211>17
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13C VH CDR2
<400>13
Ser Ile Ile Pro Leu Phe Gly Lys Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 1015
Gly
<210>14
<211>18
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13和13A VH CDR3
<400>14
Ala Arg Gly Pro Ser Glu Val Gly Ala Ile Leu Gly Tyr Val Trp Phe
1 5 1015
Asp Pro
<210>15
<211>18
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13B VH CDR3
<400>15
Ala Arg Gly Pro Ser Glu Val Ser Gly Ile Leu Gly Tyr Val Trp Phe
1 5 1015
Asp Pro
<210>16
<211>18
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13C和13D VH CDR3
<400>16
Ala Arg Gly Pro Ser Glu Val Lys Gly Ile Leu Gly Tyr Val Trp Phe
1 5 1015
Asp Pro
<210>17
<211>16
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13、13A、13B、13C和13D VL CDR1
<400>17
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
1 5 1015
<210>18
<211>7
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13、13A、13B、13C和13D VL CDR2
<400>18
Leu Gly Ser Asn Arg Ala Ser
1 5
<210>19
<211>9
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13、13A、13B、13C和13D VL CDR3
<400>19
Met Gln Ala Arg Arg Ile Pro Ile Thr
1 5
<210>20
<211>455
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13重链hIgG1 (和hIgG1未岩藻糖基化)氨基酸序列;SEA-TGT
<400>20
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 1015
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
202530
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
354045
Gly Ser Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
505560
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65707580
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
859095
Ala Arg Gly Pro Ser Glu Val Gly Ala Ile Leu Gly Tyr Val Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys
450 455
<210>21
<211>455
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13A重链hIgG1 (和hIgG1未岩藻糖基化)氨基酸序列
<400>21
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 1015
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Leu Ser Ser
202530
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
354045
Gly Ser Leu Ile Pro Tyr Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
505560
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65707580
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
859095
Ala Arg Gly Pro Ser Glu Val Gly Ala Ile Leu Gly Tyr Val Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys
450 455
<210>22
<211>455
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13B重链hIgG1 和hIgG1未岩藻糖基化)氨基酸序列
<400>22
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 1015
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ala Trp
202530
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
354045
Gly Ser Ile Ile Pro Tyr Phe Gly Lys Ala Asn Tyr Ala Gln Lys Phe
505560
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65707580
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
859095
Ala Arg Gly Pro Ser Glu Val Ser Gly Ile Leu Gly Tyr Val Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys
450 455
<210>23
<211>455
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13C重链hIgG1 (和hIgG1未岩藻糖基化)氨基酸序列
<400>23
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 1015
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Leu Ser Ser
202530
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
354045
Gly Ser Ile Ile Pro Leu Phe Gly Lys Ala Asn Tyr Ala Gln Lys Phe
505560
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65707580
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
859095
Ala Arg Gly Pro Ser Glu Val Lys Gly Ile Leu Gly Tyr Val Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys
450 455
<210>24
<211>455
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13D重链hIgG1 (和hIgG1未岩藻糖基化)氨基酸序列
<400>24
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 1015
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Leu Ser Ser
202530
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
354045
Gly Ser Ile Ile Pro Tyr Phe Gly Lys Ala Asn Tyr Ala Gln Lys Phe
505560
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65707580
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
859095
Ala Arg Gly Pro Ser Glu Val Lys Gly Ile Leu Gly Tyr Val Trp Phe
100 105 110
Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys
450 455
<210>25
<211>219
<212>PRT
<213>人工序列(Artificial Sequence)
<220>
<223>克隆13、13A、13B、13C和13D轻链hκ (和未岩藻糖基化)氨基酸序列;SEA-TGT
<400>25
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 1015
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
202530
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
354045
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
505560
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65707580
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
859095
Arg Arg Ile Pro Ile Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
- 一种用于校正显示设备的灰阶显示曲线的方法、电子设备及计算机可读存储介质
- 一种分布式显示方法、系统、设备及计算机可读存储介质
- 一种显示处理方法、设备及计算机可读存储介质
- 一种图像显示方法、设备及计算机可读存储介质
- 一种基于多屏设备的字幕滚动显示方法、系统及存储介质
- 一种坯布瑕疵显示方法、系统、计算机设备、及存储介质
- 一种坯布幅宽测量方法、系统、计算机设备、及存储介质
