一种EBV感染组织的检测用EBER探针及检测试剂盒
文献发布时间:2023-06-19 11:59:12
技术领域
本发明属于病毒检测技术领域,具体涉及一种EBV感染组织的检测用EBER探针及检测试剂盒。
背景技术
EB病毒(Epstein-Barr Virus,EBV)是一种常见的4型人类疱疹病毒。在人群中感染普遍,但多数无明显症状,长期潜伏,进行着缓慢的生物学活动。但是在少数特定情况下,如,机体免疫功能低下或某些因素触发下,EB病毒可从潜伏状态转变为增殖状态,形成复发感染,引起临床疾病。
与EB病毒相关的疾病包括:鼻咽癌、部分胃腺癌、传染性单核细胞增多症、慢性活动性EBV感染、EBV相关的嗜血组织细胞综合症、X染色体相关淋巴增生综合征、淋巴瘤样肉芽肿、淋巴瘤样丘疹病、Burkitt’s淋巴瘤、艾滋病相关淋巴瘤、霍奇金淋巴瘤、鼻T/NK细胞淋巴瘤、肠病型T淋巴瘤、皮肤T淋巴瘤、淋巴上皮癌等。
EBV的检测包括多种方法,例如,血清抗原抗体反应、Southern印迹杂交、聚合酶链式反应PCR、免疫组化IHC和原位杂交等。EBV感染血清反应复杂多样,常见的抗EBV-CA-IgM在病例中可能表现延迟、缺失或长时间存在,确诊有难度。PCR直接检测EBV病毒核酸,具有较强的敏感性和特异性,能够鉴别EBV健康携带者低水平复制与EBV相关疾病的高水平感染的差异,用于评估患者EBV负荷。EBV末端重复探针的Southern blot检测组织或外周血细胞中的EBV-DNA,可用于确定EBV携带细胞的克隆性。上述三种方法常用于普查和筛选分型。IHC和ISH结合细胞/组织形态进行分析,可以确定病毒与组织细胞的关系。免疫组化检测特定的EBV潜伏蛋白(如EBV-LMP1等)有助于确定感染细胞的潜伏期模式,特异性较好,但灵敏度和准确性劣于ISH。EBER原位杂交目前被认为是检测EBV感染细胞的金标准,能够直接验证肿瘤细胞核中EBV基因组的存在。
临床应用中,基于ISH的方法常使用免疫信号放大的方法进行检测,例如,使用地高辛等标记探针杂交靶区域,然后通过HRP标记的抗地高辛抗体结合并显色,进行观察。但检测过程中涉及多步洗涤、孵育,过程较为繁琐。在病原微生物FISH的检测中,常见PNA探针的应用,具有较理想的检测结果,但合成成本较高,合成周期较长,且PNA在纯化水中的溶解性较差,需要借助热或有机试剂助溶,可能会影响短片段探针的稳定性和杂交均一性,大大影响检测结果的准确性。
发明内容
有鉴于此,本发明的目的在于提供一种EBV感染组织的检测用EBER探针,所述EBER探针是利用荧光原位杂交方法直接检测,既可以在相应滤块下低倍镜直接观察组织整体信号状况,也能够转移至高倍镜下,结合DAPI核染料,确认EBER探针结合区域,保证了检测的准确性。
本发明的目的还在于提供一种EBV感染组织的检测用试剂盒,利用荧光原位杂交方法直接检测EBV,既避免了免疫显色多步骤过程,又保持了核酸杂交稳定性和特异性,结合DAPI核染料,确认探针结合区域,检测信号更直观,保证了检测的准确性。
本发明提供了一种EBV感染组织的检测用EBER探针,所述EBER探针为荧光素标记的EBER探针;
所述EBER探针的核苷酸序列如SEQ ID NO:1所示。
优选的,所述荧光素包括FITC或CY3。
本发明提供了一种EBV感染组织的检测用探针杂交液,所述EBER探针杂交液为含10~20pmol/μl探针、体积百分含量48%~52%甲酰胺、质量百分含量9%~11%硫酸葡聚糖、体积百分含量0.9%~1.1%Triton X-100、48~52mmol/LTris-HCl的水溶液;
所述探针为所述EBV感染组织的检测用EBER探针。
优选的,所述探针杂交液为含15pmol/μl探针、体积百分含量50%甲酰胺、质量百分含量10%硫酸葡聚糖、体积百分含量1.0%Triton X-100、50mmol/LTris-HCl的水溶液。
本发明提供了一种EBV感染组织检测试剂盒,包括所述EBER探针杂交液、DAPI复染剂和质控片组。
优选的,所述质控片组为在一片载玻片上设置EBV感染的阳性样本区和阴性样本区;
优选的,所述EBV感染的阳性样本区中阳性样本是用人鼻咽癌细胞C666制备的细胞蜡块或明确EBER阳性的淋巴瘤或鼻咽癌的FFPE样本的切片。
优选的,所述阴性样本区中阴性样本是使用正常人外周血淋巴细胞制备的细胞蜡块或用肺癌或乳腺癌FFPE样本切片制备得到。
优选的,所述检测试剂盒还包括2×SSC缓冲液和含体积百分含量0.1%~0.2%NP-40的2×SSC缓冲液。
本发明提供的EBV感染组织的检测用EBER探针是荧光素标记的EBER探针;所述EBER探针的核苷酸序列如SEQ ID NO:1所示。与采用地高辛标记的探针进行免疫放大显色只能使用低倍镜整体阅片观察相比,本发明提供的所述EBER探针具有较好的杂交特异性,利用荧光原位杂交方法,能够实现直接检测,既可以在相应滤块下低倍镜直接观察组织整体信号状况,也能够转移至高倍镜下,结合DAPI核染料,确认探针结合区域,因此,本发明提供的EBER探针具有检测结果更准确的优势。
同时本发明提供的EBER探针能够稳定与EBV感染组织中EBV的核酸进行稳定杂交,克服了现有技术中免疫显色时抗体特异性不足造成的假阳性或抗体结合差造成的假阴性情况。
进一步的,本发明具体限定了荧光素包括FITC或CY3。实验证明,所述FITC和CY3标记EBER探针均能实现荧光原位杂交检测的目的。由于在绿色荧光滤块下,样本的自发荧光对判读存在干扰,特别对于固定不良的样本表现强自发荧光,产生较高的背景,对读取结果不利,因此,发红色荧光的CY3较发绿色荧光的FITC更适合EBV的检测。
本发明提供的EBV感染组织的检测用探针杂交液,所述EBER探针杂交液为含10~20pmol/μl所述EBER探针、体积百分含量48%~52%甲酰胺、质量百分含量9%~11%硫酸葡聚糖、体积百分含量0.9%~1.1%Triton X-100、48~52mmol/L Tris-HCl的水溶液。本发明在EBER探针与EBV的核酸杂交稳定性好和特异性高的基础上,配制用于溶解所述EBER探针的杂交液体系。实验证明,与其他杂交液配方法相比,本发明提供的探针杂交液在检测EBV感染组织切片时,具有背景低,信号更清晰的特点,进一步提高了检测结果的准确性。
本发明提供了一种EBV感染组织检测试剂盒,包括所述EBER探针杂交液、DAPI复染剂和质控片组。所述试剂盒在检测时,先用EBER探针杂交液与检测样本杂交1h后可直接在镜下观察信号,避免了免疫显色多步骤过程,简化了检测步骤,同时结合DAPI复染剂,可确认探针结合区域。由此可见,采用所述检测试剂盒检测可以实现组织或细胞样本中EBER状态的检测,辅助临床判断是否存在EBV感染。经过验证,在样本中的检测灵敏度高(肿瘤细胞系+正常淋巴细胞梯度比例混合进行检测,可以检测到10%的异常核)、特异性好(对收集的淋巴瘤和鼻咽癌样本进行检测,与ISH结果比较,一致性高,且操作更为简便)。质控品组可用于临床随未知样本的同步测试,能够避免操作误差导致的假阴性结果。
附图说明
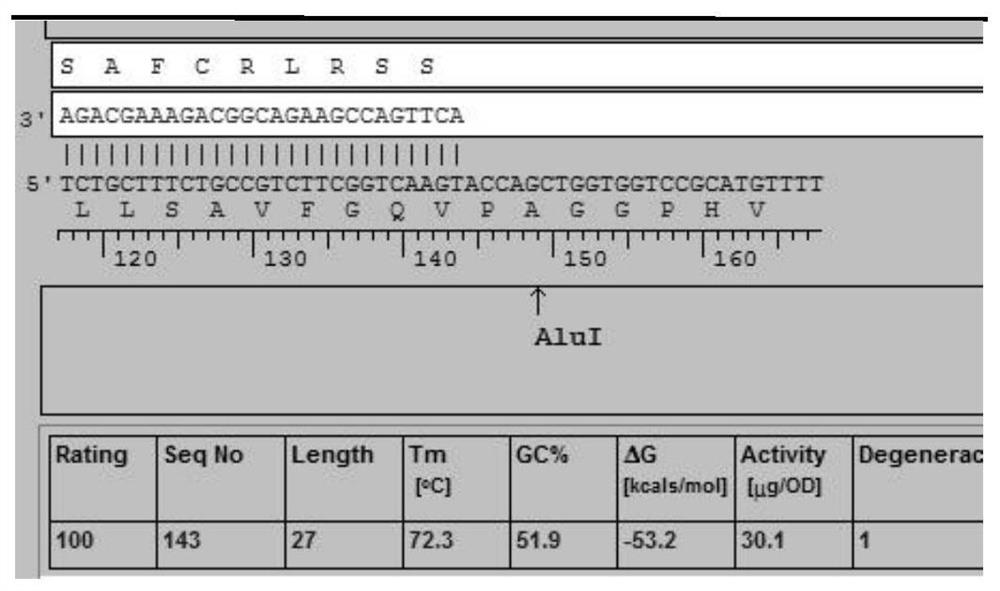
图1为本发明提供的EBER探针与EBER-1基因结合位点示意图;
图2为EBER-1探针和EBER-2和体系1形成的杂交液荧光检测结果;其中图2-1为EBER-1/体系1检测EBV阳性样本的检测结果;图2-2为EBER-2/体系1检测EBV阳性样本的检测结果;图2-3为EBER-1/体系1检测EBV阴性样本的检测结果;图2-4为EBER-2/体系1检测EBV阴性样本的检测结果;显微镜观察倍数为40;
图3为EBER-1探针和EBER-2在体系2中荧光检测结果;其中图3-1为EBER-1/体系2检测EBV阳性样本的检测结果;图3-2为EBER-2/体系2检测EBV阳性样本的检测结果;图3-3为EBER-1/体系2检测EBV阴性样本的检测结果;图3-4为EBER-2/体系2检测EBV阴性样本的检测结果;显微镜观察倍数为40;
图4为EBER-2探针和体系2形成的杂交液(EBER-LNA探针)与ISH(地高辛标记探针)检测不同样本的对比检测结果;其中图4-1为地高辛探针检测样本编号98172的荧光检测结果;图4-2为EBER-LNA探针检测样本编号98172的荧光检测结果;图4-3为地高辛探针检测样本编号K57084的荧光检测结果;图4-4为EBER-LNA探针检测样本编号K57084的荧光检测结果;图4-5为地高辛探针检测样本编号K56035的荧光检测结果;图4-6为EBER-LNA探针检测样本编号K56035的荧光检测结果;图4-7为地高辛探针检测样本编号K56302的荧光检测结果;图4-8为EBER-LNA探针检测样本编号K56302的荧光检测结果;图4-9为地高辛探针检测样本编号K56926的荧光检测结果;图4-10为EBER-LNA探针检测样本编号K56926的荧光检测结果;图4-11为地高辛探针检测样本编号K57085的荧光检测结果;图4-12为EBER-LNA探针检测样本编号K57085的荧光检测结果;图4-13为地高辛探针检测样本编号K55290的荧光检测结果;图4-14为EBER-LNA探针检测样本编号K55290的荧光检测结果;显微镜观察倍数为40;
图5为含CY3标记EBER-2探针的体系2中液检测不同类型样本得到的荧光结果;其中图5-1为含CY3标记EBER-2探针的体系2检测EBV阳性样本1得到的结果图;图5-2为含CY3标记EBER-2探针的体系2检测EBV阳性样本2得到的结果图;图5-3为含CY3标记EBER-2探针的体系2检测EBV阳性样本3得到的结果图;图5-4为含CY3标记EBER-2探针的体系2检测EBV阴性样本得到的结果图;显微镜观察倍数为40;
图6为采用不同浓度的CY3标记EBER-2探针检测EBV阳性样本的荧光结果;其中图6-1为5pmol/μl的CY3标记EBER-2探针检测EBV阳性样本的荧光结果;图6-2为10pmol/μl的CY3标记EBER-2探针检测EBV阳性样本的荧光结果;图6-3为20pmol/μl的CY3标记EBER-2探针检测EBV阳性样本的荧光结果;图6-4为40pmol/μl的CY3标记EBER-2探针检测EBV阳性样本的荧光结果(低倍镜下);图6-5为40pmol/μl的CY3标记EBER-2探针检测EBV阳性样本的荧光结果(高倍镜下);图6-1为100倍下观察结果,图6-2~图6-4均为20倍下观察结果,图6-5为100倍下观察结果;
图7为CY3标记EBER-2探针检测阴性样本和阳性样本的荧光结果,其中图7-1为CY3标记EBER-2探针检测阴性样本的荧光结果;图7-2为CY3标记EBER-2探针检测阳性样本的荧光结果;显微镜观察的倍数为20倍;
图8为质控品建立及检测限评估结果;图8-1为0%阳性比率(阴性)细胞蜡块检测结果;图8-2为10%阳性比率细胞蜡块检测结果;图8-3为50%阳性比率细胞蜡块检测结果;图8-4为100%阳性细胞蜡块检测结果;显微镜观察的倍数为20倍;
图9为荧光原位杂交法检测试剂盒和ISH金标准法检测试剂盒对同种样本的检测结果;其中图9-1为荧光原位杂交法检测试剂盒检测阳性样本1的荧光结果;图9-2为ISH金标准法检测试剂盒检测阳性样本1的荧光结果;图9-3为荧光原位杂交法检测试剂盒检测阳性样本2的荧光结果;图9-4为ISH金标准法检测试剂盒检测阳性样本2的荧光结果;图9-5为荧光原位杂交法检测试剂盒检测阳性样本3的荧光结果;图9-6为ISH金标准法检测试剂盒检测阳性样本3的荧光结果;图9-7为荧光原位杂交法检测试剂盒检测阳性样本4的荧光结果;图9-8为ISH金标准法检测试剂盒检测阳性样本4的荧光结果;图9-9为荧光原位杂交法检测试剂盒检测阳性样本5的荧光结果;图9-10为ISH金标准法检测试剂盒检测阳性样本5的荧光结果;图9-11为荧光原位杂交法检测试剂盒检测阳性样本6的荧光结果;图9-12为ISH金标准法检测试剂盒检测阳性样本6的荧光结果;图9-13为荧光原位杂交法检测试剂盒检测阳性样本7的荧光结果;图9-14为ISH金标准法检测试剂盒检测阳性样本7的荧光结果;显微镜观察倍数为40。
具体实施方式
本发明提供了一种EBV感染组织的检测用EBER探针,所述EBER探针为荧光素标记的EBER探针;所述EBER探针的核苷酸序列如SEQ ID NO:1所示(ACTTGACCGAAGACGGCAGAAAGCAGA)。所述荧光素优选包括FITC或CY3,更优选为CY3。本发明对所述EBER探针的制备方法不做特殊限制,采用本领域所熟知的EBER探针即可,例如委托基因合成公司人工合成。
本发明提供了一种EBV感染组织的检测用探针杂交液,所述EBER探针杂交液为含10~20pmol/μl探针、体积百分含量48%~52%甲酰胺、质量百分含量9%~11%硫酸葡聚糖、体积百分含量0.9%~1.1%Triton X-100、48~52mmol/L Tris-HCl的水溶液;所述探针为所述EBV感染组织的检测用EBER探针。所述探针杂交液优选为含15pmol/μl探针、体积百分含量50%甲酰胺、质量百分含量10%硫酸葡聚糖、体积百分含量1.0%Triton X-100、50mmol/L Tris-HCl的水溶液。与本领域常规选择形成的体系(包含10%硫酸葡聚糖、10mMNaCl、30%甲酰胺、0.1%焦磷酸钠、0.2%聚乙烯吡咯烷酮、0.2%Ficoll、50mM Tris-HCl(pH值7.5)和水形成的溶剂)相比,本发明提供的探针杂交液在检测EBV感染组织切片时发现,荧光图片背景低,且信号更清晰,检测结果效果更佳。
本发明提供了一种EBV感染组织检测试剂盒,包括所述EBER探针杂交液、DAPI复染剂和质控片组。
在本发明中,所述DAPI复染剂来自广州安必平医药科技有限公司,货号为F.01238。
在本发明中,所述质控片组优选为在一片载玻片上设置EBV感染的阳性样本区和阴性样本区。所述阳性样本区和阴性样本区分布于载玻片同一面,具体为左右区。所述EBV感染的阳性样本区中阳性样本优选是用人鼻咽癌细胞C666制备的细胞蜡块或明确EBER阳性的淋巴瘤或鼻咽癌的FFPE样本的切片。所述阴性样本区中阴性样本优选是使用正常人外周血淋巴细胞制备的细胞蜡块或用肺癌或乳腺癌FFPE样本切片制备得到。
在本发明中,所述检测试剂盒优选还包括2×SSC缓冲液和含体积百分含量0.1%NP-40的2×SSC缓冲液。所述2×SSC缓冲液和含体积百分含量0.1%NP-40的2×SSC缓冲液均是作为核酸杂交漂洗液使用。
在本发明中,所述检测试剂盒的使用方法,优选包括以下步骤:
(1)将带检测样本前处理后,用探针杂交液孵育杂交,得到杂交后的样本;
(2)将杂交后的样本洗涤后用DAPI复染剂进行复染,得到复染样本;
(3)将所述复染样本洗涤后再荧光显微镜下观察并拍照;
(4)将得到的荧光照片与质控片组进行比较,样本的荧光图片与指控片组中阳性样本显示情况一致表示待检测样本为EBV感染的组织。
本发明对所述带检测样本前处理的方法不做具体限定,采用本领域所熟知的带检测样本前处理方法即可。
在本发明中,所述孵育杂交的温度优选为95℃加热3min,再37℃保温1h。所述杂交后的样本洗涤优选依次用2×SSC缓冲液和含0.1%NP-40的2×SSC缓冲液浸泡;所述2×SSC缓冲液的浸泡时间优选为8~12min,更优选为10min;所述含0.1%NP-40的2×SSC缓冲液的浸泡时间更优选为4~6min,更优选为5min。所述复染的时间优选为1min。
在本发明中,采用本发明提供的试剂盒进行FISH方法检测,与用地高辛标记探针按照ISH金标准方法检测相比,具有检测步骤更简便的特点,两种方法检测步骤对照表见表1。由表1可知,本发明提供的FISH方法检测步骤简单,对于容易曝露在空气中降解的核酸样本而言,缩短检测时间有利于提高检测结果的准确性和可靠性。
表1 FISH方法和ISH金标准方法检测步骤对照表
下面结合实施例对本发明提供的一种EBV感染组织的检测用EBER探针及检测试剂盒进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
EBER探针设计与合成
EBER-1和EBER-2基因是与宿主蛋白结合的EB病毒编码小RNA,不编码蛋白,但在所有EBV阳性细胞中大量表达,每个细胞中可达10
实施例2
两种探针和两种杂交缓冲液的评估
两种探针分别与两种杂交缓冲液配制成杂交体系,使用经确认的EBV阳性和阴性的鼻咽癌组织样本FFPE切片进行测试。
一、体系的配制
体系1包含10%硫酸葡聚糖、10mM NaCl、30%甲酰胺、0.1%焦磷酸钠、0.2%聚乙烯吡咯烷酮、0.2%Ficoll、50mM Tris-HCl(pH值7.5)和终浓度5μM荧光标记探针(EBER-1探针或EBER-2探针)。
体系2包含10%硫酸葡聚糖、50%甲酰胺、1%Triton X-100、50mM Tris-HCl(pH值7.5)和终浓度5μM荧光标记探针(EBER-1探针或EBER-2探针)。
二、检测方法:
1.前处理流程:
烤片:65℃烤片30min。
脱蜡:环保脱蜡剂2次各10min,无水乙醇1次10min。
复水:以无水乙醇、90%乙醇、70%乙醇、纯化水的顺序浸泡,各1次,每次3min。风干。
消化:在37℃恒温条件下,用胃酶工作液消化30min;1×PBS浸泡3min终止消化。
脱水:依次用70%乙醇、90%乙醇、无水乙醇进行浸泡,每次浸泡2min。
风干。
2.EBER探针杂交
①在37℃下用2×SSC缓冲液浸泡10min。
②在37℃下用含0.1%NP-40的2×SSC缓冲液浸泡5min。
③脱水:依次用70%乙醇、90%乙醇、无水乙醇进行浸泡,各浸泡2min。
④滴加DAPI复染液进行复染。
3.检测
荧光显微镜下观察并拍照。
结果见图2和图3。图2为EBER-1探针和EBER-2制备的体系1形成的杂交液荧光检测结果;图3为EBER-1探针和EBER-2制备的体系2形成的杂交液荧光检测结果。结果表明,体系2检测的荧光图片较体系1的荧光图片,具有更低的背景,检测信号更清晰。这说明体系2优于体系1更适合制备探针杂交液。同时针对相同检测样本和相同的体系,EBER-2探针较EBER-1探针,表现出更清晰的信号,说明EBER-2探针较EBER-1探针具有更优异的特异性和检测效果。
实施例3
FITC标记的EBER-2探针检测样本的方法
1.探针杂交液的体系配制
体系包含10%硫酸葡聚糖、50%甲酰胺、1%Triton X-100、50mM Tris-HCl(pH值7.5)和终浓度5μMFITC标记的EBER-2探针。
2.检测方法
同实施例2方法,其中样本编号分别为98172、K57084、K56035、K56302、K56926、K57085和K55290。
3.检测结果
结果见图4。
对比例1
采用地高辛标记探针检测样本的方法
合成地高辛标记DNA探针,利用免疫放大使用抗地高辛抗体检测地高辛标记探针,最终通过辣根过氧化物酶系统DAB显色。
地高辛标记探针:5'-DIG-acttgaccgaagacggcagaaagcaga-3'(SEQ ID NO:3)。
1.前处理流程
操作步骤同实施例2记载,其中样本编号分别为98172、K57084、K56035、K56302、K56926、K57085和K55290。
2.杂交
①变性:95℃加热3min。
②杂交:37℃恒温过夜。
3.杂交后处理
①1×杂交洗涤液洗涤2次,每次10min,甩去多余液体。
②鼠抗地高辛抗体常温孵育1h,甩去多余液体,使用1×洗液清洗3次,各5min。
③甩去多余液体,酶标羊抗鼠IgG常温孵育1h,甩去多余液体,使用1x洗液清洗3次,各5min。
④DAB显色液显色5~15min,蒸馏水冲洗1min。
⑤苏木素复染,1min,蒸馏水冲洗,1×PBS溶液浸泡,返蓝。
⑥脱水:依次用70%乙醇、90%乙醇、无水乙醇进行浸泡,各浸泡3min。
⑦二甲苯浸泡10min,中性树脂封片。
3.检测
光学显微镜下观察并拍照。
结果见图4。
实施例3和对比例1采用不同方法对相同样本进行检测,由图4结果比较发现,两种方法对相同样本的检测结果基本一致。但是FITC标记的EBER-2探针检测结果中,在绿色荧光滤块下,样本的自发荧光对判读存在干扰,特别对于固定不良的样本,表现较强的自发荧光,产生高背景,容易产生假阳性或假阴性的错误判读。
实施例4
针对FITC标记EBER-2探针检测样本时容易产生高背景情况,本发明合成新的探针,即红色荧光素CY3标记探针EBER-2作为测试探针,比较检测结果。
按照实施例2的方法检测不同的EBV阳性样本和阴性样本。结果见图5。针对EBV阳性样本1~3的检测结果可知,荧光图片背景低,信号清晰,结果可准确判读。针对阴性样本的检测结果可知,荧光图片背景低,无干扰背景,结果可准确判读。由此可见,采用荧光素CY3标记EBER-2探针对提高EBV感染组织的检测灵敏度有较理想效果。
实施例5
探针用量的筛选实验
使用实施例1中的反应体系2,调整CY3标记EBER-2探针的浓度,分别使用1pmol/μl、5pmol/μl、10pmol/μl、15pmol/μl、20pmol/μl和40pmol/μl配制杂交体系,用于样本测试。按照实施例2的方法进行检测同一阳性样本。
结果见图6。由图6可知,CY3标记EBER-2探针浓度为1pmol/μl未见杂交信号,5pmol/μl时部分细胞杂交信号差,可能出现假阴性可能,10pmol~20pmol/μl时,背景低,信号清晰,结果能够准确判读。40pmol/μl时,背景低,信号清晰,但部分区域出现杂质点,可能干扰判读。需转到高倍镜下观察。由上述结果可知,本发明选择10~20pmol/μl作为探针的工作浓度。
实施例6
一种EBV感染检测试剂盒的使用方法
1.检测样本:通过原位杂交(ISH)法检测福尔马林固定石蜡包埋的组织切片中表达的EB病毒编码的RNA。
2.试剂盒的组成包括探针杂交液、DAPI复染剂和质控片组。
其中探针杂交液为20pmol/μl CY3标记EBER-2探针、50%甲酰胺、10%硫酸葡聚糖、50%甲酰胺、1%Triton X-100、50mM Tris-HCl(pH值7.5)的水溶液。
3.检测步骤:
1.前处理
脱蜡:环保脱蜡剂浸泡2次各10分钟。无水乙醇浸泡10分钟。
复水:按无水乙醇、90%乙醇、70%乙醇、纯化水的顺序将样本浸泡其中,各浸泡2分钟。
消化:在37℃、200μl胃酶工作液下孵育10~20分钟。
脱水:按70%乙醇、90%乙醇、无水乙醇的顺序浸泡,各浸泡2分钟。
自然风干。
2.杂交
用10μl探针杂交液滴在处理后的样本切片上。
在37℃孵育1小时。
3.洗涤与复染
在37℃条件下用2×SSC缓冲液浸泡5min;再在37℃下用0.1%NP-40的2×SSC缓冲液浸泡5min。然后用70%乙醇处理2分钟。自然风干后,用DAPI复染。
4.荧光显微镜下观察。
结果见图7。对阴性样本检测发现,在20×物镜下观察,细胞核内无红色荧光,提示细胞内无EBER表达。对阳性样本检测发现,在20×物镜下观察,细胞核内有红色荧光,提示细胞内有EBER表达。
实施例7
质控品建立及检测限评估
使用人鼻咽癌肿瘤细胞系C666与非EBV感染细胞按梯度比例混合制备成细胞蜡块,使用实施例6中的检测试剂盒进行检测。C666:非阳细胞的比例为100%、50%、10%、0%。
结果见图8,本发明提供的试剂盒可以检测到10%的异常核,具有较高的检测灵敏度。
质控品组可用于临床随未知样本的同步测试,能够避免操作误差导致的假阴性结果。
实施例8
两种试剂盒的应用对比评价
使用实施例6中的试剂盒(FISH方法)和临床金标准方法(EBER地高辛探针)对FFPE样本进行检测。
EBER地高辛探针的操作方法同对比例1方法。同时按照实施例6的方法进行同样的组织样本进行荧光检测。
结果见图9。由图9可知,FISH方法与金标准方法一致性较好,且步骤更简单,信号更直观(直接观察蓝色染色区域中红色荧光的分布即可判断是否有无EBV感染)。可见,本发明提供的即用型试剂盒,可以保证临床结果的准确性和可靠性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110> 广州安必平医药科技股份有限公司
<120> 一种EBV感染组织的检测用EBER探针及检测试剂盒
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 27
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
acttgaccga agacggcaga aagcaga 27
<210> 2
<211> 30
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
ctcctcccta gcaaaaccct caggacggcg 30
<210> 3
<211> 27
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
acttgaccga agacggcaga aagcaga 27
- 一种EBV感染组织的检测用EBER探针及检测试剂盒
- 基于AllGlo探针荧光定量PCR的组织microRNA检测试剂盒及其检测方法
