枯草芽胞杆菌JZXJ-7在制备缓解副溶血弧菌感染制剂中的应用
文献发布时间:2023-06-19 19:37:02
技术领域
本发明属于生物医药技术领域,具体涉及枯草芽胞杆菌JZXJ-7在制备缓解副溶血弧菌感染制剂中的应用。
背景技术
副溶血弧菌(Vibrio parahaemolyticus,Vp)是一种革兰氏阴性嗜盐短杆菌,广泛分布于海洋环境,也常见于盐渍类食品,据调查我国水产品中Vp检测率高达38.8%,远超沙门氏菌和大肠杆菌,成为威胁公共健康的首要病原菌。日常生活中,人们因误食被Vp污染的海鲜导致食物中毒,表现为腹痛、腹泻和呕吐等急性胃肠炎症状,体弱人群中还会出现脱水休克、全身感染,甚至死亡。传统观点认为,Vp的致病性与菌体和毒力代谢物有关,该菌经食物链传播进入机体,依靠菌体侵袭力和黏附作用破坏宿主肠壁屏障,其产生的耐热直接溶血素、脲酶和金属蛋白酶等毒力因子具有细胞毒性加剧肠道感染程度。此外,团队前期研究还发现,Vp诱导肠道菌群紊乱触发固有层炎症反应,参与肠道炎性损伤的发生发展。因此,基于调整肠道微生物群落结构,重塑微生态稳定的方法可能成为干预Vp食物中毒的新策略。
目前,针对Vp食物中毒的治疗剂主要有喹诺酮和头孢曲松,抗生素虽然能够杀灭病原菌和清除毒力因子,但频繁使用会引发耐药菌、肾功能异常和肠道菌群失衡等副作用。益生菌被世界卫生组织定义为“当摄取适当数量后,对食用者的身体健康能发挥有益作用的活的微生物”,广泛应用于食品添加和膳食补充剂。研究表明,益生菌具有改善肠组织形态、抑制肠道炎症和优化菌群结构等作用,是缓解食源性致病菌感染的潜在功能因子。植物乳杆菌、乳酸乳球菌、戊糖乳杆菌等益生菌制剂已经非常普遍。然而,枯草芽胞杆菌的益生功效研究集中在营养物质吸收和改善脂质代谢方面,鲜有研究评估该菌预防病原菌感染的作用。鉴于枯草芽胞杆菌对食源性致病菌感染的保护作用及机制不明,极大地限制了其在干预Vp感染中的应用。
发明内容
为弥补现有技术不足,本发明提供枯草芽胞杆菌JZXJ-7在制备缓解副溶血弧菌感染制剂中的应用。
枯草芽胞杆菌JZXJ-7(Bacillus subtilis JZXJ-7,JZXJ-7)是团队从锦州虾酱中分离得到的一株益生菌,保藏编号为GDMCC No:62458,于2022.05.09保藏于广东省微生物菌种保藏中心。经生理特征和体外抑菌实验证实,JZXJ-7能够分泌细菌素且高度抑制Vp生长,且高度耐胃酸和肠液侵蚀(比市面常见益生菌活力更高),但该菌株在体内对Vp感染损伤的缓解作用尚不清楚。
本发明的的目的通过以下技术方案实现:
枯草芽胞杆菌JZXJ-7在制备治疗/缓解/改善副溶血弧菌感染制剂中的应用。
优选的,所述副溶血弧菌感染至少具备如下一种表现:
(1)便血;
(2)结肠病理损伤;
(3)肠道过度炎症反应;
(4)抗氧化能力减弱;
(5)肠壁通透性增加;
(6)肠道菌群失调。
更优选的,所述结道病理损伤具体表现为:结肠黏膜结构缺失,黏膜细胞减少,隐窝深度变浅,伴有增生结缔组织,固有层可见大量炎性细胞浸润;结肠杯状细胞数目减少;结肠胶原沉积增加。
更优选的,所述肠道过度炎症反应是指结肠组织中白介素1β、白介素6和肿瘤坏死因子α水平上调。
更优选的,所述抗氧化能力减弱是指结肠组织中过氧化氢酶、超氧化物歧化酶和总抗氧化酶表达下调。
更优选的,所述肠壁通透性增加是指血清脂多糖、二胺氧化酶和D-乳酸含量增加。
更优选的,所述枯草芽胞杆菌JZXJ-7的用量为10
与现有技术相比,本发明的有益效果是:
本发明研究发现枯草芽胞杆菌JZXJ-7可以缓解副溶血弧菌感染,摄入枯草芽胞杆菌JZXJ-7能有效抵御副溶血弧菌感染引起的小鼠体质量减轻、疾病活动指数升高和病原菌定植,同时能改善小鼠结肠病理损伤,有效抑制副溶血弧菌感染造成的肠道生理功能障碍;枯草芽孢杆菌JZXJ-7通过增加小鼠肠道微生物多样性,富集阿克曼菌属、双歧杆菌属和梭菌属等有益菌群,缓解副溶血弧菌感染引起的肠道菌群紊乱,重塑肠道微生态稳定。该制剂有望成为预防副溶血弧菌食物中毒和减少抗生素滥用的新策略,具有较好的应用前景。
附图说明
图1为枯草芽胞杆菌JZXJ-7对副溶血弧菌感染小鼠生长性能、疾病指数和肠道细菌载量的影响效果分析图。
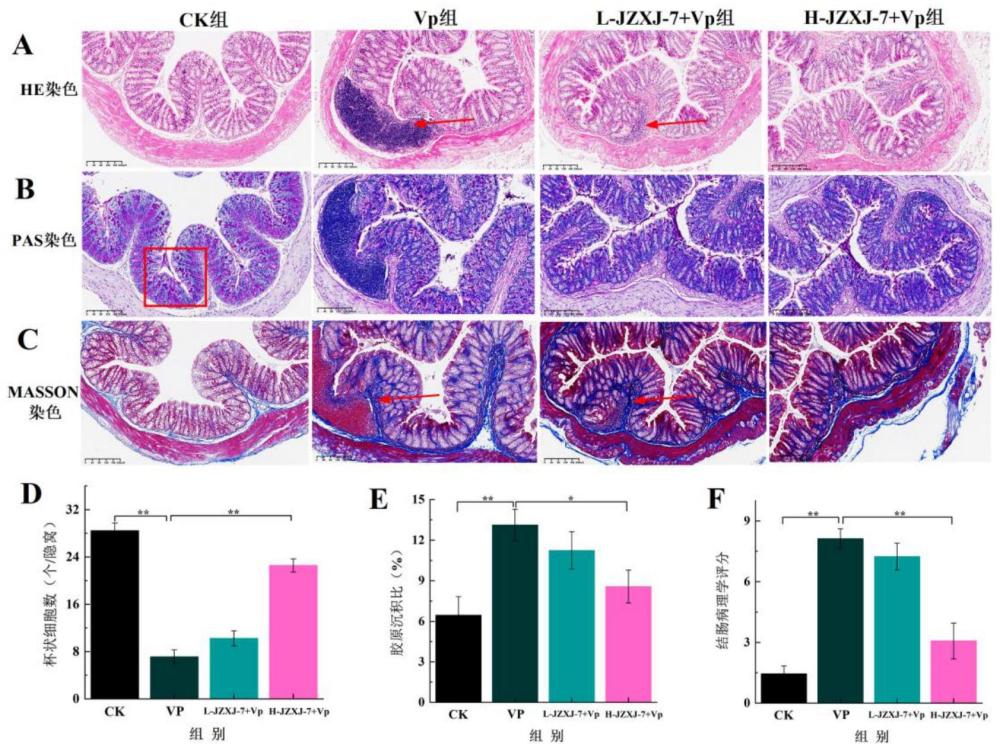
图2为枯草芽胞杆菌JZXJ-7对副溶血弧菌感染小鼠结肠病理损伤的影响结果分析图。
图3为枯草芽胞杆菌JZXJ-7对副溶血弧菌感染小鼠结肠炎症、抗氧化和通透性的影响结果分析图。
图4为枯草芽胞杆菌JZXJ-7对副溶血弧菌感染小鼠结肠微生物α和β多样性的影响结果分析图。
图5为枯草芽胞杆菌JZXJ-7对副溶血弧菌感染小鼠门水平和属水平菌群结构的影响结果分析图。
图6为枯草芽胞杆菌JZXJ-7干预小鼠肠道菌群的LEfSe分析图。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实验过程
1、材料与试剂
1.1、材料
实验菌株:副溶血弧菌ATCC33847(tdh
实验动物:6周龄雄性无特定病原菌C57BL/6J小鼠28只,体质量(17±2)g,购自北京斯贝福生物技术有限公司(SCXK(京)2019-0010),动物房温度(20±2)℃,相对湿度(44±5)%,12h明暗循环,暂养一周,不限饮食和饮水。
1.2、试剂
磷酸盐缓冲溶液(phosphate buffered solution,PBS,pH=7.2),索莱宝(北京)生物科技公司;4%多聚甲醛组织固定液、氯化钠(NaCl)、乙醚溶液、溶菌营养肉汤(LB)培养基、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂(TCBS)培养基,北京路桥生物技术公司;白介素-1β、白介素-6和肿瘤坏死因子-α酶联免疫试剂盒,武汉酶免生物科技有限公司;苏木素伊红染色剂、过碘酸雪夫染色剂、马松染色剂、超氧化物歧化酶、过氧化氢酶和总抗氧活力试剂盒、脂多糖、二胺氧化酶和D-乳酸试剂盒,南京建成生物工程研究所。
1.3、仪器
DL-CJ-2N超净工作台,苏州净化公司;SPX-25生物恒温培养箱,上海丙林科技有限公司;5804R高速台式低温离心机,湘仪(湖南)实验室仪器发开公司;ABI-stePone-Plus聚合酶联反应仪,德国艾本德公司;GI54DS立式高温高压蒸汽灭菌锅,山东卓隆生物科技公司;I-mark酶标仪,美国伯乐公司;HS-B7-B生物组织自动包埋机、HS-S7220-C石蜡包埋机、KD-P组织摊片机,湖北贝诺医疗科技公司;EcliPse-E100光学显微镜,日本尼康公司。
1.4、实验菌种活化
取ATCC33847冻干粉,在LB琼脂培养基上连续划线后,放入37℃培养箱中活化24h;挑取单菌落接种到LB液体培养基,37℃,150r/min摇床孵育12h;将复苏菌液以1:100转接至新鲜的含质量浓度3% NaCl的LB液体培养基中扩大培养,待生长至对数期(OD
将-80℃冻存的JZXJ-7用接种环挑取,于LB固体平板上划线活化,30℃培养48h;挑取生长形态一致的单菌落接种于LB液体培养基,35℃,180r/min摇床孵育36h;收集菌液于8,000r/min离心20min去除上清液,获得菌体沉淀;用无菌PBS溶液洗涤菌体沉淀2次后,重悬于新鲜的无菌生理盐水,采用10倍稀释涂布平板法测定此时菌液浓度,根据动物实验的需要将菌液分成两部分,分别调整至10
1.5、动物实验
将28只雄性C57BL/6J小鼠随机分为4组(n=7/组):对照组(control,CK)、模型组(Vibrio parahaemolyticus,Vp)、低剂量干预组(low dose Bacillus subtilis JZXJ-7+Vp,L-JZXJ-7+Vp)和高剂量干预组(high dose Bacillus subtilis JZXJ-7+Vp,H-JZXJ-7+Vp)。干预组小鼠每日分别灌胃0.1mL含10
1.5.1、小鼠感染症状评价
针对Vp诱导的小鼠感染症状,从体重变化、疾病活动指数和肠组织中Vp载量进行评估。小鼠暴露Vp期间,观察并记录各组小鼠的活动行为、饮食摄水、精神状况、粪便性状和体质量等指标。根据疾病活动指数评价标准,结合体质量变化、稀便程度和脏器病变等指标评分。此外,取0.5g回肠、盲肠或结肠内容物与4.5mL无菌PBS溶液混匀,10倍梯度稀释后,将3个连续适宜稀释度涂布于TCBS平板,37℃培养24h,统计菌落数,表示为lg(CFU/g),平板计数经平行3次实验。
1.5.2、结肠病理损伤分析
针对Vp诱导的小鼠结肠组织病变,从肠上皮杯状细胞数量、纤维化程度和结构破损情况进行评估。对固定的结肠样品经酒精梯度脱水、透明、浸蜡、包埋、切片(厚度5μm)、展片、贴片、烤片、常规脱蜡复水、苏木素-伊红(htoxylin eosin,HE)、过碘酸雪夫(periodicacid-Schiff,PAS)和马松(MASSON)染色、梯度脱水、中性树胶封片,使用普通光学显微镜(100×)全盲阅片,观察结肠上皮结构和固有层炎性细胞浸润,Image J软件统计杯状细胞数量和胶原沉积比,按照病理学评分标准从CK组、Vp组、L-JZXJ-7+Vp组和H-JZXJ-7+Vp组中随机挑选6张片打分。
1.5.3、结肠生理功能检测
针对Vp诱导的小鼠结肠功能异常,从肠道炎症反应、抗氧化活力和肠壁通透性进行评估。使用白介素(interleukin,IL)-1β(IL-1β)、IL-6、肿瘤坏死因子-α(tumournecrosis factor--α,TNF-α)试剂盒检测结肠中促炎因子水平,过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和总抗氧化酶(Total antioxidantenzyme,T-AOC)试剂盒检测结肠中抗氧化酶活力,脂多糖(lipopolysaccharide,LPS)、二胺氧化酶(diamine oxidase,DAO)和D-乳酸(D-lactic acid,D-LA)试剂盒检测血清中肠壁通透性标志物浓度,所有样品的制备和具体流程按照说明书操作,利用多功能酶标仪读取吸光度,测定结肠组织和血清中共9个指标,单位为pg/g、pg/mg或U/mg。
1.5.4、肠道微生物群落结构检测
针对Vp诱导小鼠肠道菌紊乱,使用16S rRNA测序进行分析,由杭州谷禾生物科技公司完成。使用十六烷基三甲基溴化铵提取CK组、Vp组和H-JZXJ-7+Vp组(n=6/组),共18个样品基因组DNA,采用1%琼脂糖凝胶电泳检测DNA纯度和完整性;以纯化的基因组DNA为模板,选择高效高保真酶进行PCR,扩增16S rDNA V4区;将PCR产物等浓度混样后使用2%琼脂糖凝胶电泳检测;构建好的文库在Illumina HiSeq4000平台测序。运用QIIME(V.1.7.0)计算Alpha(α)多样性指数,包括Chao1、Shannon和Simpson。基于bray curtis,使用R语言包(V.2.15.3)进行主坐标分析(Principal Coordinate Analysis,PCoA);将序列相似性≥97%归为一个操作分类单元(operational taxonomic unit,OTU),并绘制门和属水平的物种组成图和聚类热图,确定3组之间的物种结构差异;测序结果上传至在线网站,进行线性判别分析(linear discriminate analysis[LDA]size effect,LEfSe)识别组间生物标志物种。
结果分析
1、枯草芽胞杆菌JZXJ-7缓解副溶血弧菌感染症状
各组小鼠体质量变化如图1A所示,对照(CK)组小鼠体质量呈稳定上升趋势,模型(Vp)组小鼠暴露副溶血弧菌感染2d后体质量持续下降,尽管低剂量JZXJ-7干预(L-JZXJ-7+Vp)未能显著抑制体质量减轻,但在一定程度上减缓,高剂量JZXJ-7(H-JZXJ-7+Vp)干预逆转了体质量下降,实验结束时与CK组体质量变化一致,增加(6.88±0.41)%,且与Vp组存在统计学意义(P<0.05);实验期间,副溶血弧感染小鼠出现摄食减少、精神萎靡、行动迟缓和轻微腹泻血便,反映在疾病活动指数(disease activity index,DAI)评分(图1B),CK组健康小鼠DAI评分未见变化,Vp组的DAI评分显著上升,在暴露感染7d达到8.23±0.21,L-JZXJ-7+Vp组的DAI评分(7.46±0.33)与Vp组无明显差异,而H-JZXJ-7+Vp组DAI评分(3.92±0.18)显著低于Vp组(P<0.05);肠道病原菌载量是评价感染损伤的重要指标(图1C),CK组小鼠肠道内溶物未检出副溶血弧菌,Vp组、L-JZXJ-7+Vp组和H-JZXJ-7+Vp组小鼠回肠及盲肠中副溶血弧菌检出量较低,结肠中菌量最高,分别为(3.52±0.13)、(3.13±0.11)和(1.52±0.07)lg CFU/g,经组间差异分析,H-JZXJ-7+Vp组小鼠回肠、盲肠和结肠病中的副溶血弧菌定植量均显著低于Vp组(P<0.05)。综上结果,摄入10
2、枯草芽胞杆菌JZXJ-7改善小鼠结肠病理损伤
肠道致病菌的感染始于上皮组织。小鼠结肠HE染色显示(图2A),CK组健康小鼠结肠隐窝清晰,层次分明,黏膜上皮完整,无炎性细胞润湿,Vp组副溶血弧菌感染造成结肠黏膜结构明显缺失,黏膜细胞减少,隐窝深度变浅,伴有增生结缔组织,固有层可见大量炎性细胞浸润,L-JZXJ-7+Vp组和H-JZXJ-7+Vp组小鼠结肠黏膜下层的炎性细胞浸润显著减少,局灶性肠腺结构消失,JZXJ-7改善了副溶血弧菌对结肠的侵袭损害;PAS染色显示(图2B,2D),与CK组结肠上皮杯状细胞数28.93±1.41相比,Vp组杯状细胞数极显著减少到6.72±0.79(P<0.01),H-JZXJ-7+Vp组的高剂量JZXJ-7干预显著缓解了副溶血性弧菌诱导的杯状细胞消失(23.95±1.12,P<0.05),而L-JZXJ-7+Vp组未见明显改善作用;MASSON染色显示(图2C,2E),与CK组小鼠肠组织胶原沉积(6.03±1.64)%相比,Vp组副溶血弧菌感染导致结肠胶原沉积显著上升,达到(13.12±1.45)%,经JZXJ-7预处理,L-JZXJ-7+Vp组和H-JZXJ-7+Vp组小鼠结肠胶原沉积现象均有所减少,其中高剂量JZXJ-7干预显著减少了细胞外基质在肠壁聚集([7.83±1.21]%),与Vp组存在显著差异(P<0.05);结肠病理学综合评分表明(图2F),各组小鼠结肠病理评分均有差异,其中Vp组和L-JZXJ-7+Vp组评分较高,分别为(8.26±0.98)和(7.33±1.02),二者数据差异无统计学意义,其次为H-JZXJ-7+Vp组(2.89±1.21),CK组最低(1.55±1.03),与Vp组相比,高剂量JZXJ-7干预组有效降低了病理评分(P<0.05)。
3、枯草芽胞杆菌JZXJ-7强化小鼠结肠生理功能
肠道病理损伤导致肠道生理功能障碍。如图3A-3C所示,与CK组相比,Vp组小鼠结肠中白介素-1β(IL-1β)、白介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)的含量分别升高3.55、2.44和2.12倍,说明副溶血弧菌感染造成小鼠结肠过度炎症,膳食补充JZXJ-7能够降低小鼠结肠3种促炎因子水平,其中高剂量抑制炎症的效果优于低剂量,在H-JZXJ-7+Vp组中IL-1β、IL-6和TNF-α水平仅为Vp组的0.32、0.41和0.28倍,差异存在统计学意义(P<0.05);各组小鼠结肠中过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和总抗氧化酶(T-AOC)活力结果显示(图3D-3F),Vp组结肠CAT、SOD和T-AOC活力均显著低于CK组(P<0.01),说明副溶血弧菌感染造成肠道抗氧化能力下降,JZXJ-7干预不同程度提高了结肠中3种抗氧化酶活力,特别是高剂量干预(H-JZXJ-7+Vp)组小鼠T-AOC活性接近CK组(P>0.05)。血清中肠壁通透性标志物检测结果显示(图3F-3H),Vp组中小鼠血清脂多糖(LPS)、二胺氧化酶(DAO)和D-乳酸(D-LA)浓度显著高于CK组(P<0.01),分别为CK组1.78倍、1.52倍、1.54倍,补充高剂量JZXJ-7显著降低小鼠血清中LPS、DAO和D-LA浓度,而低剂量干预(L-JZXJ-7+Vp)组与Vp组无统计学意义(P>0.05)。综上说明,JZXJ-7干预与结肠过度炎症、抗氧化性和肠壁通透性之间存在明显的剂量依赖关系,小鼠预补充高剂量(10
4、枯草芽胞杆菌JZXJ-7重塑小鼠肠道菌群稳态
4.1、肠道菌群的α和β多样性分析
肠道菌群的α多样性指数中Chao1反映菌群丰富度,Shannon和Simpson反映菌群多样性,其中Chao1指数和Shannon指数越大,而Simpson指数越小,表明样品中的物种越丰富。研究结果显示,与CK组相比,Vp组的Chao1指数和Shannon指数极显著降低,Simpson指数极显著升高(P<0.01),而高剂量JZXJ-7(H-J+V)干预后显著增加Chao1指数和Shannon指数,降低Simpson指数(P<0.05),即提高了肠道菌群α多样性(图4A~4C)。β多样性用于评估组间微生物结构的差异性,采用主坐标分析法(PCoA)将差异可视化,根据样本间的集散程度,判断菌群结构的相似性,样本点距离越近提示群落构成差异越小,样品群落组成越相似。如图4D所示,与CK组相比,Vp组在PC1和PC2水平向右下方偏移,表明副溶血弧菌感染显著改变小鼠肠道菌群结构与组成;与Vp组相比,H-J+V组在PC1水平和PC2水平向左上方偏移,提示JZXJ-7干预后小鼠肠道菌群的结构发生实质性改善,趋向CK组变化。通过聚类,将OTUs按照相似性分组,由图4E可知,CK组独有444个OTUs,Vp组独有57个OTUs,H-J+V组独有85个OTUs;CK组与Vp组共有169个OTUs,H-J+V组与Vp组共有104个OTUs,CK组与H-J+V组共有175个OTUs,说明感染副溶血弧菌减少了与正常小鼠菌群的相似度,降低了物种丰度,而预补充JZXJ-7使得H-J+V组与CK组共有OTUs数量增加71个,说明JZXJ-7部分恢复副溶血弧菌感染小鼠肠道物种丰富度。
4.2、肠道菌群结构分析
对菌群分类学的分析表明,3组之间的微生物结构存在明显差异,如图5A所示,在门水平上将物种相对丰度>1%定义为优势菌门,拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)在各组的占比最高,为优势物种;与CK组相比,Vp组小鼠肠道菌群中拟杆菌门丰度显著降低,厚壁菌门和变形菌门(Proteobacteria)丰度显著升高(P<0.05);与Vp组相比,高剂量JZXJ-7干预(H-J+V)组显著上调了拟杆菌门丰度,下调厚壁门和变形菌门丰度(P<0.05)。在非优势物种中,与CK组相比,Vp组菌群中脱铁杆菌门(Deferribacteres)和放线菌门(Actinobacteriota)相对丰度升高;与Vp组比较,高剂量JZXJ-7干预后显著下调脱铁杆菌门和放线菌门丰度,提高疣微菌门(Verrucomicrobia)丰度。在属水平(图5B),与CK组相比,Vp组拟杆菌属(Bacteroides)、乳杆菌属(Lactobacillus)和瘤胃球菌属(Ruminiclostridium)丰度显著降低,幽门螺杆菌属(Helicobacter)、Odoribacter杆菌属、肠杆菌属(Enterobacter)、弧菌属(Vibrios)和Tyzzerella菌属丰度显著升高;与Vp组相比,H-J+V组小鼠肠道拟杆菌属、乳杆菌属、双歧杆菌属(Bifidobacterium)和阿克曼菌属(Akkermansia)显著上调,幽门螺杆菌属、肠杆菌属和弧菌属相对丰度明显下调。基于小鼠代表性群落进行聚类分析(图5C),结果显示,H-J+V组与CK组聚类在同组,与CK组存在显著差异,进一步验证了高剂量JZXJ-7缓解副溶血弧菌感染引起的肠道菌群紊乱,显示出与CK组接近的微生物群落结构。
4.3、肠道菌群标志物种分析
肠道菌群多样性和菌群结构分析表明,高剂量JZXJ-7干预缓解了副溶血弧菌诱导的小鼠菌群失调,重塑了微生态平衡。因此,为了识别高剂量JZXJ-7干预组中抵御副溶血弧菌感染的标志性微生物类群,对小鼠结肠菌群LefSe分析和LDA效应大小判别(图6A-6B),结果显示,23个分类群明显影响副溶血弧菌感染期间微生物群的生物学特征,涉及:4个门、5个纲、4个科和10个属。具体来说,与Vp组相比,JZXJ-7干预降低了变形菌门(Proteobacteria)、肠杆菌科(Enterobacteriaceae)、链球菌属(Streptococcus)、普氏菌属(Prevotella)、萨特氏菌属(Sutterella)和弧菌属(Vibrios)相对丰度,增加了疣微菌门(Verrucomicrobiota)、毛螺菌科NK4A136(Lachnospiraceae NK4A136)、梭状芽胞杆菌科UCG-014(Clostridia UCG-014)、双歧杆菌属(Bifidobacterium)和阿克曼菌属(Akkermansia)和梭菌属(Clostridium)相对丰度。
在副溶血弧菌感染小鼠模型中,小鼠结肠杯状细胞数和抗氧化酶活明显降低,而结肠胶原沉积、炎症反应和通透性显著增加,通过补充JZXJ-7可有效缓解上述损伤,且这一过程与微生物群落结构调整密切相关。因此,为了明确关键微生物群发挥的作用,采用Spearman’s相关性分析研究特定细菌群落与感染指标之间的相关性(图6C),结果显示,结肠中CAT、SOD、T-AOC活力和杯状细胞数与梭状芽胞杆菌UCG-014(Clostridia UCG-014)(0.426≤r≤0.541)、阿克曼菌属(Akkermansia)(0.612≤r≤0.794)、毛螺菌科NK4A136(Lachnospiraceae NK4A136)(0.449≤r≤0.613)、双歧杆菌属(Bifidobacterium)(0.534≤r≤0.835)、疣微菌门(Verrucomicrobia)(0.421≤r≤0.633)、梭菌属(Clostridium)(0.592≤r≤0.818)显著正相关(P<0.05),其中阿克曼菌属、双歧杆菌属和梭菌属具有较强的正相关性(r≥0.75),与变形菌门(Proteobacteria)(-0.294≤r≤-0.387)、普氏菌属(Prevotella)(-0.275≤r≤-0.397)、埃希氏杆菌属(Escherichia)(-0.296≤r≤-0.401)和弧菌属(Vibrios)(-0.328≤r≤-0.423)显著负相关(P<0.05),但相关系数较低;此外,结肠组织胶原沉积、促炎因子(IL-1β、IL-6和TNF-α)水平、血清LPS、DAO和D-LA浓度与变形菌门(0.585≤r≤0.763)、普氏菌属(0.579≤r≤0.793)、埃希氏杆菌属(0.592≤r≤0.831)和弧菌属(0.614≤r≤0.823)显著正相关(P<0.05),且相关性较强(r≥0.75)。
显然,以上所述的具体实施方案,只是对本发明的目的、技术方案和有益效果进行了进一步的详细说明,所应理解的是,以上所述仅为本发明的具体实例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、同等替换、改进等,均应包含在本发明的保护范围之内。
- 鱼油在缓解副溶血弧菌感染中的应用
- 脆弱拟杆菌在制备防治副溶血弧菌感染的组合物中的应用
