用于确定间隙体积的方法和设备
文献发布时间:2023-06-19 11:57:35
技术领域
本公开至少部分地涉及测量哺乳动物受试者中的生物计量指标的方法,并且更特别地涉及用于测量间隙空间的体积作为用于治疗疾病的诊断工具的系统和技术。
背景技术
生物计量指标是医学从业人员用以辅助患者诊断的有价值的工具,并且它们确定适当的医疗过程的能力经常受限于快速和准确的定量生物计量信息的获取。医学从业人员使用的一些常见的生物计量指标包含核心体温、血压、心脏和呼吸速率、血液氧合和红细胞比容、肾小球滤过率(“GFR”)等。尽管医学从业人员可能更愿意在决定特定治疗之前评估多个生物计量指标,但患者的病状恶化可能快于指标的评估速度。在这些情形下,要求医生以有限的信息做出决定,从而可能降低患者的生存机会。可以为医学从业人员提供强大诊断工具的一种生物计量指标是患者的间隙体积。
人体,甚至是其各种体液,在概念上都可以被分为各种液室,所述液室尽管从字面上看并不是解剖学上的室,但确实表示了在人体水分、溶质和悬浮元素的部分在分离方式方面的真正划分。两个主要的液室是细胞内室和细胞外室。细胞内室是生物体细胞内的空间,它通过细胞膜与细胞外室分开。
人类身体总水分的约三分之二保留在细胞中,大部分保留在细胞溶质中,其余的则存在于细胞外室中。细胞外液可以被分为三种类型:“间隙室”(围绕组织细胞并将其浸入营养物质和其它化学物质的溶液中)中的间隙液、“血管内室”(血管和淋巴管内)中的血浆和淋巴),以及“跨细胞室”中的少量跨细胞液,例如眼和脑脊髓液。间隙和血管内室很容易地交换水分和溶质,但是第三种细胞外室(跨细胞室)被认为与其它两种分开,并且与它们之间没有动态平衡。间隙室(也被称为“间隙空间”)围绕组织细胞并充满间隙液。间隙液提供直接的微环境,其使离子、蛋白质和营养物质跨细胞屏障移动。这种液不是静态的,而是被毛细血管不断刷新并被毛细淋巴管重新收集。在平均男性(70kg)的人体中,间隙空间有大约10.5升液体。
确定患有疾病(例如,充血性心力衰竭、高血压和慢性肾病)的患者的干重一直很困难,因为没有商业和实用的方式来确定患者的间隙体积。对于此些疾病,临床医生使用利尿剂来控制总人体体积(其中间隙体积是重要组分)。对于所有这些疾病,间隙体积的量化将有助于最大化利尿剂的期望作用并最小化副作用。另外,了解间隙体积的体积增加(指示液体从血管内室泄漏)的速率可以用作例如败血症、烧伤、放射毒性、水肿形成状态和一些药物毒性中的内皮疾病/损伤的量度。
因此,需要一种用于准确地测量间隙体积的系统和技术。
因此,需要一种用于准确地测量间隙体积的变化的系统和技术。
发明内容
本公开总体上涉及用于测量哺乳动物受试者中的生物计量指标的组合物和方法。哺乳动物受试者可以是人类。目标生物计量指标包含但不限于红细胞比容、血液体积、血浆体积、分布体积、肾小球滤过率(GFR)和间隙体积。更具体地,一种用于基于受试者的间隙空间体积的值为所述受试者选择治疗的方法和系统利用表示随时间变化的多个血液样本中的小和大标志物的浓度的多个样本数据值。在测试期间,在所述标志物消散之前,利用所述样本浓度来预测所述小标志物的假设峰值浓度。通过双指数或三指数衰减曲线拟合算法,利用本假设峰值浓度和其它样本值来定义衰减曲线,然后利用其曲线特性来计算肾小球滤过率、所述小标志物进入间隙空间的泄漏率的值并最后计算所述间隙体积的值。然后,如果需要,可以将所述间隙体积的所述确定值与与各种形态相关联的多个预定阈值或范围进行比较,并且可以就所述受试者的进一步治疗做出确定和/或推荐。
还公开了用于收集和分析来自哺乳动物受试者的生物计量信息(更特别地是间隙体积、分布体积和肾小球滤过率的生物计量指标)的组合物、系统和方法。
根据本公开的一个方面,一种基于患有疾病或处于疾病风险中的受试者的间隙空间体积的值为所述受试者选择治疗的方法,所述方法包括:A)获取多个样本数据值,所述样本数据值表示一段时间内受试者的血液样本中的小标志物和大标志物的浓度,所述小标志物可被所述受试者的肾小球滤过,而所述大标志物不可被所述患者的肾小球滤过;B)通过将提供给所述受试者的所述大标志物的给药浓度除以来自所述多个样本数据值的所述大标志物的测量平均浓度来计算所述受试者的血浆体积V
根据本公开的一个方面,一种为患有充血性心力衰竭、高血压、慢性肾病或败血症或处于发展充血性心力衰竭、高血压、慢性肾病或败血症的风险中的受试者选择治疗的方法包括:A)向所述受试者施用第一VFI,其中所述第一VFI被所述受试者的肾小球滤过;B)向所述受试者施用第二VFI,其中所述第二VFI不被所述受试者的肾小球滤过;C)测量时间点Tm处的所述受试者中的所述第一VFI和所述第二VFI的浓度;D)确定Tm处的所述第一VFI和所述第二VFI的血管分布体积;E)通过以下中的一种来计算所述第一VFI的T
根据本公开的另一方面,一种为患有疾病或处于疾病风险中的受试者选择治疗的方法包括:A)确定时间点Tm处的第一VFI和第二VFI的血管分布体积,所述第一VFI可被所述受试者的肾小球滤过,而所述第二VFI不可被所述受试者的肾小球滤过;B)通过将Tm处的所述第二VFI浓度的浓度乘以Tm处的所述第一VFI浓度与Tm处的所述第二VFI浓度之比来计算所述第一VFI的T
根据本公开的另一方面,一种为患有疾病或处于疾病风险中的受试者选择治疗的方法包括:A)获得表示时间点Tm处的受试者中的第一VFI和第二VFI的测量浓度的数据,所述第一VFI可被所述受试者的肾小球滤过,而所述第二VFI不可被所述受试者的肾小球滤过;B)确定Tm处的所述第一VFI和所述第二VFI的血管分布体积;C)通过以下中的一种来计算所述第一VFI的T
根据本公开的又一方面,一种用于计算患者的间隙体积的系统包括:A)外围装置,其可操作以测量时间点Tm处的受试者中的第一VFI和第二VFI的浓度,所述第一VFI可被所述受试者的肾小球滤过,而所述第二VFI不可被所述受试者的肾小球滤过;B)存储器,其可操作以存储所述第一VFI和第二VFI的多个测量浓度值、间隙体积的多个阈值以及与所述阈值间隙体积值相关联的多个治疗推荐;C)处理器,其耦合到所述外围装置和存储器,并且可操作以:i)确定Tm处的所述第一VFI和所述第二VFI的血管分布体积;ii)通过将Tm处的所述第二VFI浓度的浓度乘以(Tm处的第一VFI浓度)/(Tm处的第二VFI浓度)之比来计算所述第一VFI的T0浓度(C
根据本公开的再一方面,一种用于与可操作地耦合到外围器件的计算机系统一起使用的计算机程序产品,所述计算机程序产品包括其上嵌入有计算机可读指令的非暂时性媒体,所述非暂时性媒体包括:A)用于确定时间点Tm处的受试者中的第一VFI和第二VFI的浓度的程序代码,所述第一VFI可被所述受试者的肾小球滤过,而所述第二VFI不可被所述受试者的肾小球滤过;B)用于确定Tm处的所述第一VFI和所述第二VFI的血管分布体积的程序代码;C)用于通过将Tm处的所述第二VFI浓度的浓度乘以(Tm处的第一VFI浓度)/(Tm处的第二VFI浓度)之比,或乘以Tm处的所述第一VFI浓度与Tm处的所述第二VFI浓度的这种比较的代理来计算所述第一VFI的T
附图说明
在本文中参考附图描述了本公开的各个方面,其中:
图1是根据本公开的逐步剂量血液测试集的结果的一个实例;
图2是根据本公开的使用每个剂量步骤的平均信号水平和每种组分的量的每种VFI组分(截距强制为零)的图;
图3是根据本公开的荧光强度水平相对于HCT的图;
图4是根据本公开的图3的HCT数据的图,其采用组分1与组分2的信号水平之比并绘制所述比率相对于在每个阶段计算的HCT的关系;
图5是根据本公开的通过施用注射剂(injectate)并荧光监测其血管分布获得的光谱数据集的一个实例;
图6是根据本公开的荧光强度信号水平相对于材料量的校准曲线的一个实例;
图7是根据本公开的荧光强度信号水平相对于HCT的校准曲线的一个实例;
图8是根据本公开的荧光标志物相对于HCT的原始比率(T
图9是根据本公开的使用具有两种荧光标签的单种静态标志物的荧光强度信号水平相对于HCT的校准曲线的一个实例;
图10示出了根据本公开的将被表征为正常mGFR的通过在测试期内多次施用注射剂并荧光监测其血管分布获得的光谱数据集;
图11示出了根据本公开的将被表征为受损mGFR的通过在测试期内多次施用注射剂并荧光监测其血管分布获得的光谱数据集;
图12是示出了根据本公开的患者23的计算T0浓度和双指数曲线拟合的衰减率的图示;
图13概念性地示出了现有技术两室模型;
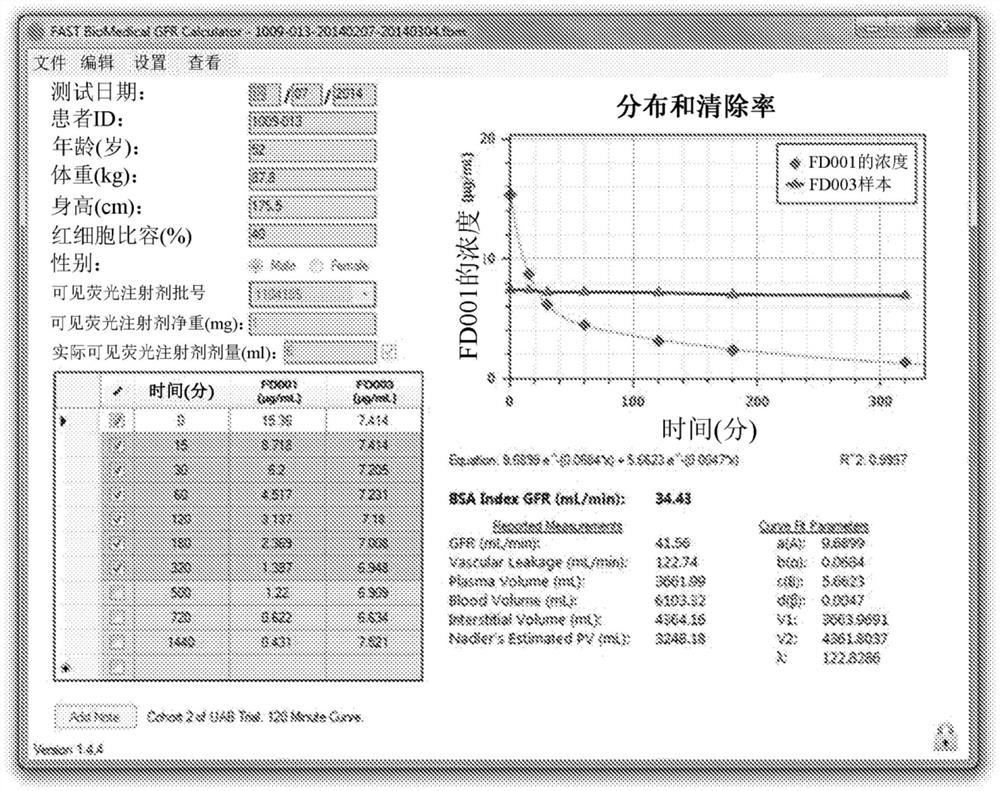
图14示出了根据本公开的GFR计算器软件的应用的示范性屏幕截图;
图15是能够执行根据本公开描述的方法的包含GFR计算器应用的系统;
图16是示出了根据本公开的计算T0浓度和双指数曲线拟合的衰减率的图示;
图17是示出了根据本公开的计算T0浓度和三指数曲线拟合的衰减率的图示;和
图18是根据本公开的用于基于多个标志物浓度样本计算受试者的间隙体积的过程的流程图。
具体实施方式
为了促进对本公开的原理的理解,将参考附图中示出的实施例,并且将使用特定语言来描述它们。然而,将理解,本公开的范围不受限制,并且对所示出的系统和方法的这种改变和进一步修改以及其中所示出的技术原理的这种进一步应用是技术相关领域的技术人员通常会想到的。
如本申请中所定义,术语“血浆体积”是指受试者的脉管系统中含有的血浆的总量,而术语“循环血浆体积”是指受试者的脉管系统中含有的流动血浆的量。尽管“血浆体积”和“循环血浆体积”的测量相似且相关,但它们并不相同。
诸如红细胞比容、肾小球滤过率和血浆体积的生物计量指标可以通过将具有动态荧光标志物(即,用第一荧光标签标记的动态分子)和静态荧光标志物(即,用第二荧光标签标记的静态分子,其中第一和第二标签具有不同的(不重叠的)荧光特性,使得它们能够被分开检测)的注射剂施用到哺乳动物受试者的脉管系统中来测量。诸如红细胞比容和血浆体积(而不是GFR)的生物测定指示剂也可以通过将含有用两种荧光标签标记的单种静态标志物的注射剂施用到受试者的脉管系统中来确定。本文还可以从荧光标签与静态或动态标志物“缀合”或“缔合”的角度来描述本公开的标志物。本术语并不旨在暗示用标签“标记”动态或静态分子的任何特定化学手段。所述方法需要通过一或多次测量在一段时间内测量荧光标签的发射强度,这取决于所确定的指标。例如,PV可以经由单次测量(如本文中所使用的术语)来测量,而GFR可以基于在施用注射剂之后以预定时间进行三次测量来确定。
本公开的方法可以用注射剂(在本文中也被称为“可见荧光注射剂(VFI)”)、能够测量荧光强度的一个装置或一组装置以及能够基于从VFI和一或多个装置收集的数据确定不同生物计量指标的一组数学算法来实践。如本文所公开,在一些实施例中,VFI可以包含两个右旋糖酐分子,其具有不同的分子量,缀合到2种荧光不同的标签(例如,染料)。因此,在一些实施例中,第一高分子量右旋糖酐分子可以缀合到荧光“红色染料”,而另一低分子量右旋糖酐可以缀合到荧光“绿色染料”。“装置”可以是基于探针的仪器,例如比率荧光装置(RFD),其被设计成与探针(例如,侵入性探针,例如被设计成插入哺乳动物受试者的静脉中的探针;以及非侵入性探针,例如能够通过口腔的皮肤测量荧光强度的口腔探针)协同工作。可以在本公开的实践中使用的其它装置包含血液样本读取装置,例如使用快速离心(spun down)的血液样本来产生血浆的基于临床实验室的仪器,并且根据本发明,能够通过全血读取荧光的床边仪器需要“校正”,以便准确地确定HCT。可以根据本公开进行测量的每个生物计量指标需要由装置收集的数据集的不同部分,并且使用不同的数学方程来获得必要的测量。这些方程和测量的图示在工作实例中示出。
血浆体积(PV)可以使用具有缀合于其上的两种荧光不同标签的单种静态标志物来确定。PV可以通过以下方式导出:任选地采集空白(给药前)样本以测量残留或背景或现有荧光,随后在标志物“分布”之后(例如,通常在施用注射剂后约10-15分钟)测量标签的荧光强度。如本文使用,术语分布是指一(或多)种标志物已经充分混合到血浆中的时间。然后,通过测量血浆中的大标志物的浓度来使用数据集计算PV(VFI(剂量浓度)除以测得的浓度)。本值直接测量PV。任选地,可以随时间采集另外的样本以监测PV的变化。这种监测允许临床医生进行干预,并且因此监测PV如何变化。继而可以通过将受试者中含有的HCT的量加回到总体积来导出血液体积。HCT总体积加上血浆体积等于血液体积。
肾小球滤过率(GFR)也可以使用本公开方法以几种方式确定。在一些实施例中,在不同时间点采集血液样本。本领域技术人员可以任选地进行空白(给药前值)测量,所述测量用于确定荧光的任何残留/背景/现有水平。在进行VFI的重复或后续给药的那些实施例中,这种测量是尤其有利的。然后,在约3个时间点(例如,10-15分钟、约60分钟和约120分钟)从样本收集数据。T
红细胞比容(HCT)可以用于校正具有RFD装置的基于探针的系统。这些装置能够连续读取体内流动的全血中的荧光信号。本公开利用在某些时间处采集的数据集来产生HCT。因此,在探针的情况下,可以使用前10-15分钟内采集的数据集来外推回T
红细胞比容可以通过分析光谱数据集(如图5中所示,其通过在包含T
本申请中使用的光谱数据集是指通过在包含荧光标志物的峰值血管分布的一段时间内施用含有具有不同荧光特性的两种或两种以上荧光标志物的注射剂并荧光监测其血管分布而得到的数据集,其中荧光标志物中的一种是动态标志物,而荧光标志物中的另一种是动态标志物,或者其中两种荧光标志物都与静态分子缔合。
可用于所公开的技术的校准光谱分析仪包含光谱数据集的输入、校准标识的输入、用于计算红细胞比容的计算引擎和用于报告计算红细胞比容的输出。可以在制造期间用工厂预测的平均注射剂参数设置校准标识,并将其存储在计算上可访问的位置,它可以经由软件或硬件的变化来间接更新,或者可以通过上传注射剂特定参数来直接更新。注射剂特定参数可以通过使用手动装置(例如,小键盘或触摸屏),通过使用半自动装置(例如,条形码扫描仪)或通过使用间接自动过程(例如,通过使用无线软件更新)来输入。
算法和应用
使用一种算法来根据两种标志物的血浆浓度确定mGFR和PV。衰减曲线的关键起点T
其中V
用于mGFR测量的VFI含有已知浓度的滤过和未滤过标志物,可以使用其来通过将大未滤过标志物的浓度乘以所述浓度之比导出T0浓度。例如,假设VFI含有35mg/ml滤过标志物和15mg/ml未滤过标志物;浓度比为2.33。通过将10和15分钟之间确定的未滤过标志物的浓度乘以2.33,可以确定T0处的滤过标志物的浓度。正确计算本起始浓度的能力是本公开的mGFR测试的双标志物所独有的。然后,可以将T0处的滤过小标志物的浓度用作衰减曲线拟合计算的起始点。
来自1期人体试验的结果已经表明,在前15分钟期间,小滤过标志物的浓度衰减非常快。在健康的患者中,超过一半的起始浓度在所述时间内已经衰减,如图12中所示。图12展示了示出患者23的计算T0浓度和双指数曲线拟合的衰减率。
这种快速衰减使得几乎无法仅使用后面采样时间的曲线拟合来正确预测T0点。当前的单标志物GFR测试依靠更长的测试时间来弥补本早期数据的错过,但是在许多情况下,除非遵循慢曲线8小时或更长时间,否则仍然可能出现高达30%的大误差。
萨皮尔斯坦,L.A.(Sapirstein,L.A.)、维特,D.G.(Vidt,D.G.)、曼德尔,M.J.(Mandel,M.J.)和哈努西克,G.(Hanusek,G.)(1955),狗体内静脉注射肌酸酐的分布体积和清除率(Volumes of Distribution and Clearances of Intravenously InjectedCreatinine in the Dog),美国生理学杂志——遗留内容(American Journal ofPhysiology-Legacy Content),181(2),330–336,描述了对两室系统建模的推导,并且示出了针对C
使用以下边界条件:
C
at t=0,
at t=0,C
因此:
其中C
C
C
当使用本文描述的双标志物算法时,上述边界条件是有效的,因为在完成曲线拟合之后测试了根据上述边界条件导出的方程。然而,本领域中的大多数单标志物系统将示出V
如本文所述,利用本文公开的系统和算法,使用mGFR计算机程序模块209将测量浓度拟合为具有改良四参数指数衰减的双指数衰减曲线。本程序模块使用非线性最小二乘的列文伯格-马夸尔特法。假设所有数据在测试的两小时间隔内具有同方差性。
本曲线拟合产生以下参数信息:
α=陡直线的斜率
β=缓直线的斜率
A=陡曲线的截距
B=缓曲线的截距
基于以下方程:
C
一旦获得了上述曲线拟合参数,使用以下方程计算以下结果:
G=GFR(以mL/分为单位)
λ=脉管系统泄漏
V
V
肾小球滤过率
分布体积
脉管系统泄漏
在一个实施例中,本公开的注射剂包含第一荧光标志物、第二荧光标志物和注射剂载体。每种荧光标志物具有其自己独特的荧光特性,即独特的激发波长和发射波长。第一荧光标志物具有第一激发波长和第一发射波长。第二荧光标志物具有第二激发波长和第二发射波长。荧光标志物是含有使分子发荧光的荧光团(在本文中也被定义为标签,例如染料)的任何分子。多种已知的荧光染料可以用作所公开技术的荧光标志物,例如但不限于罗丹明染料或其衍生物(例如,2-巯基罗丹明(2SHR)和德克萨斯红(Texas Red)
第一荧光标志物是用第一荧光标签标记的动态分子,而第二荧光标志物是用第二荧光标签标记的静态分子。
“动态分子”是具有足够低的分子质量以渗透受试者的血管壁或脉管系统的分子。动态分子在本领域中已知具有小于50kDa的分子质量,并且更典型地具有小于20kDa的分子质量。
“静态分子”是具有足够高的分子质量以显著限制其血管壁渗透性的分子。静态标志物可能会在一段时间内达到准稳定血管浓度,但是此类标志物最终可能会从脉管系统清除。静态标志物在本领域中已知具有大于50kDa的分子质量,并且更典型地具有大于200kDa的分子质量。取决于标志物的分子质量以及其它因素,此类标志物可以在脉管系统中保留约1或2小时至12小时或更长的时间。
因此,举例来说,第一荧光标志物可以包含缀合到荧光素染料的动态分子(例如,5-7kDa右旋糖酐),而第二荧光标志物可以包含缀合到2SHR的静态分子(例如,150kDa右旋糖酐)。
在另一个实施例中,注射剂可以包含具有附着于其上的两种荧光标签的静态标志物和注射剂载体。每种荧光标签具有其自己独特的荧光特性,即独特的激发波长和发射波长。这种静态标志物的一个实例是大分子,例如分子质量大于50kDa的右旋糖酐,其用两种不同的荧光染料(例如,德克萨斯红
在测量生物计量指标的时间段期间,荧光标志物在受试者内不被代谢。如果标志物在受试者的血管系统中具有大约4小时或更长时间的半衰期(T
在本公开中,两种注射剂可以基本上可互换地使用。也就是说,除了测量GFR外,注射剂是否具有提供两种不同荧光特性的两种单独的荧光标志物,或者注射剂是否具有具有提供两种不同荧光特性的两种荧光标签的仅一种标志物并不重要。重要的是,注射剂提供两种不同的荧光发射信号,以便允许如本申请中所述的生物计量指标的测量。因此,当在本申请中提及使用具有两种荧光标志物的注射剂时,这也旨在包含并且是指在分子上仅具有一种标志物但具有两种荧光标签的注射剂。否则,导致红细胞比容和其它生物计量指标的测量的后续步骤是相同的。然而,由于仅包含一个分子的注射剂使用静态标志物,而不是使用动态标志物,因此可以使用所述注射剂来测量红细胞比容和其它生物计量指标,而不能测量GFR(其需要至少两种标志物)。
本申请中使用的术语“注射剂载体”是指能够溶解和递送荧光标志物以帮助荧光标志物的递送和生物相容性的生物学上可接受的液体。合适载体的实例包含但不限于缓冲液、盐水(例如,生理缓冲盐水)等。
可以经由大剂量注射或通过输注将注射剂引入血管系统中。
本公开的注射剂被校准以提供含有注射剂的参数的校准标识。
如本公开中使用,术语“校准标识”是指荧光注射剂参数的集合,其用于通过光谱数据集计算生物计量参数(例如,HCT)。所述参数可以包含可见荧光注射剂(VFI)批号以及每种荧光标志物或同一标志物上的每种荧光标签的校准荧光强度。
校准标识可以被呈现为由一系列数字或信号表示的校准标识符。在一个实施例中,一系列数字或信号可以是数据的光学机器可读表示,例如但不限于条形码。将校准标识符转换为条形码校准标识符的算法是本领域技术人员熟知的。
可以在制造期间用工厂预测的平均注射剂参数设置校准标识,并将其存储在计算上可访问的位置。它可以经由软件或硬件的变化来间接更新,或者可以通过上传注射剂特定参数来直接更新。
校准标识中含有的注射剂特定参数可以通过使用手动装置(例如,小键盘或触摸屏),通过使用半自动装置(例如,条形码扫描仪)或通过使用间接自动过程(例如,无线软件更新)来输入到另一个装置(例如,荧光检测器或光谱分析仪)中。
用于生成校准曲线的参考标准荧光强度(其继而用于计算生物计量参数)可以在校准标识符中被表示为设置值1000,并且紧随其后的字母标号表示紧随其后的具有不同荧光波长的每种荧光标志物(即,1000a;1000b)。每种荧光标志物的相较于参考标准的荧光强度差异可以在校准标识符中被表示为相对于设置值1000的代表性等效增加或减少。
样本校准标识符如下所示:
LOTIOIAI034B0975
其含有以下信息:
VFI批号:101
相较于校准的荧光标志物1(A)强度:1034
相较于校准的荧光标志物2(B)强度:0975
本公开的校准注射剂(“校准注射剂”)可以包含具有第一红细胞比容依赖性荧光衰减系数的第一荧光标志物或荧光标签、具有第二红细胞比容依赖性荧光衰减系数的第二荧光标志物或荧光标签、注射剂载体和校准标识。校准标识可以与校准注射剂分开提供,可以与校准注射剂一起提供,或者可以作为校准标识提供。通过校正由多个制造步骤引起的光学批次差异,可以使用校准注射剂进一步改善校准光谱分析仪的准确性和精密度。
用于产生校准注射剂的本公开的校准方法可以包含针对每种荧光标志物或荧光标签的一组荧光强度标准、用于创建工作标准溶液和用于校准荧光检测器的校准溶液的设置制备程序以及用于读取校准溶液和注射剂中的每种荧光标志物的荧光强度的荧光检测器。从荧光标志物标准溶液开始,遵循设置程序以创建工作标准溶液和校准溶液。在与注射剂相同的每种标志物的荧光强度范围内使用校准溶液。使用校准溶液来设置荧光检测器的参数。然后使用相同的设置程序,使用待校准的注射剂制成测试溶液。使用校准荧光检测器,生成校准注射剂的校准标识的注射剂测试溶液。
红细胞比容可以通过分析光谱数据集(其通过在包含标志物的峰值血管分布的一段时间内施用含有具有不同荧光波长的两种或两种以上荧光标志物的注射剂并荧光监测其血管分布而得到,其中荧光标志物中的至少一种是动态标志物)来确定。可替代地,注射剂可以仅含有一种静态标志物,所述静态标志物在标志物上具有两种荧光标签。可以使用校准光谱分析仪来根据光谱数据集确定HCT。所公开的方法和系统的一个优点是其利用动态静态标志物或静态标志物(与两种不同的荧光标签缔合)的组合确定动物受试者中的HCT的能力。
如本文使用,术语“时间零”或“T
已经发现,在动态标志物和静态标志物的初始大剂量输注之后仅约15分钟之后,多达一半的小标志物从血流滤过,在实施例中可以总计约3ml。因此,如本文所述,在本公开的程序之后,可以使用例如光谱分析仪以10到15分钟的间隔测量静态标志物的浓度,从而准确地预测T
继而可以使用原始比率来计算在光学探针的光学界面处观察的红细胞比容(在本文中被称为表观HCT)。从侵入性(例如,静脉)探针获得的表观红细胞比容可能与受试者的真实HCT不同。这可以归因于在插入流动系统中的光学界面附近发生的液体动力学异常。可以通过应用校正因子根据表观HCT计算真实HCT。校正因子可以在表观HCT的1到10%的范围内,更具体地说,在HCT的4到5%的范围内。在本文的实例中示出了校正因子的典型计算。因此,当用非侵入性探针(例如,口腔探针)执行所公开的方法时,校正功能不是必需的。
一种用于确定物种特异性HCT曲线的方法可以利用以下组分:校准荧光检测器、校准注射剂和物种特异性血液的测试体积。可以进行一个程序,以在改变测试体积中的HCT的同时,保持测试体积中的恒定总测试体积和校准注射剂的恒定浓度。校准荧光检测器被设置且配置成在整个程序中读取测试体积的荧光强度。用已知的HCT(H
适合用于本公开的侵入性(例如,静脉)探针是本领域已知的。参见例如共同拥有的美国专利公开2012/197136,其内容由此通过引用并入。
实例
表1汇总了以下实例中使用的变量的定义。
表1
实例1:用于生成校准曲线的方法
1.在含有两种荧光标志物的全血样本上运行逐步剂量血液测试集,所述两种荧光标志物各自具有其不同的发射波长。结果的一个实例在图1中示出,其中上部曲线将来自通道1中记录的第一荧光标志物或标签的第一发射信号表示为通道1信号,并且将来自通道2中记录的第二荧光标志物或标签的第二发射信号表示为通道2信号。如先前所讨论,也可以使用具有两种荧光标签的一种静态标志物来生成本逐步剂量血液测试集,所述两种荧光标签各自具有其不同的发射波长。在下文中,每种荧光标志物或每种荧光标签可以被称为“荧光组分”。
2.计算每种荧光组分的每个剂量步骤的“平坦”或稳定部分的平均信号水平。
3.基于所使用的已知血液体积(V
x
4.使用平均信号水平和先前计算的每个剂量步骤的每种组分的量,生成每种荧光组分(截距强制为零)的图表的拟合线。所述图表在图2中示出。
S
S
其中S是信号水平,m是拟合线的斜率,x是材料的量(mg)。
实例2:用于生成物种特异性红细胞比容(HCT)校准曲线的方法
1.用单剂量方法运行血液测试。利用已知血液体积(V
V
2.将血液和盐水从同一VFI小瓶等量地给药。
3.从测试集去除预定体积的血液并丢弃。将与先前去除的血液相同体积的给药盐水注射回测试集中。这种交换将保持每种组分的浓度以及测试集的总体积,但会改变分布体积与HCT之比。重复本步骤多次,以生成多个数据点,这些数据点处的分布体积和HCT比不同。
4.在生成新的点之前,允许每个新的点稳定。在每个稳定点处计算新的HCT。
其中V
5.在测试期间生成的每个HCT水平下,获取数据的“平坦”稳定部分的平均信号水平。
6.如图3中所示,使用先前计算的值生成信号水平对HCT的图。
7.针对每个单独的组件图生成拟合线。所述生成的方程为以下形式:
S
S
其中S是信号水平,H是HCT,m是斜率,而r是速率。
8.如图4中所示,生成了根据相同的HCT数据的拟合线,其采用组分1与组分2的信号水平之比(8),并绘制所述比率相对于方程5中的每个阶段计算的HCT的关系。
R=S
所生成的方程应采用以下形式:
R=KH
其中R是比率,K是斜率,H是HCT,而q是速率。
实例3:用于确定各种生物计量指标的方法
当对受试者运行测试时,必须知道VFI的“批次”,因为用于解释的信号校准和HCT校准曲线必须基于给予受试者的相同“批次”的VFI。
1.从图5的测试数据样本提取T
2.使用T
R
H=H
3.使用计算表观HCT和信号水平相对于材料量校准曲线;计算校正量C,并将其应用于平均信号水平组分。
根据方程7:
S
S
若H
若H
S
4.根据测试数据,将在(14)中计算的校正因子C应用于组分2的平均信号水平S
C*S
5.在方程(16)中使用校正信号Sc以基于信号水平相对于材料量校准曲线确定组分2的材料的当量。
S
x=x
6.根据在受试者中给药的VFI组分2的已知量(mg)x
V
x
V
7.根据表观HCT和HCT偏移计算受试者的HCT。
H
8.根据受试者的分布体积和计算受试者HCT计算血液体积。
BV=V
实例4:示范性计算
在本实例中使用的校准曲线在图6到图8中示出。图9是使用具有两种荧光标签的单种静态标志物的校准曲线。
对于本实例,使用以下一组已知参数:
VFI剂量浓度:组分1为35mg/mL,组分2为15mg/mL
剂量体积:3.0mL
T
平均稳定组分2信号水平:12000
校准曲线的测试体积:100mL
校准曲线的测试HCT:38%。
1.根据T
1.2=9.618H
H
2.使用计算表观HCT和信号水平相对于HCT校准曲线;使用以下(25、26、27)计算需要应用于组分2的平均信号水平(S
S
S
S
S
H
10476/10930=0.958=C (27)
3.根据测试数据,将校正因子C应用于组分2的平均信号水平S
(0.958)(12000)=S
S
4.使用方程(16)中的校正信号S
11496=5478.2x (29)
x=2.09mg=x
5.根据在受试者中给药的VFI组分2的已知量(mg)x
V
V
2.07/62=(3*15)/V
V
6.根据表观HCT和HCT偏移计算受试者的HCT。
H
7.根据受试者的分布体积和计算受试者HCT计算血液体积。
BV=1334.9/0.38 (35)
BV=3513mL
实例5:在多剂量情况下确定GFR
所公开的用于多剂量计算的公式解决了给药前采用的任何标志物的血浆体积(空白)。使用此方法,始终计算和使用血浆中的标志物的总浓度,因为早期和晚期衰减率的处理方式不同。使用此技术,第一次测试的情况被视为与后续测试相同,但是将给药前空白值设置为零。
多剂量公式和假设如下:
空白=给药前采用的任何标志物的血浆浓度
C1=相对于时间的血浆中的标志物的初始浓度
C2=在给予新的后续剂量之前测量的浓度
C3=在给予后续剂量之后的相对于时间的浓度
A
B
α=快衰减率
β=慢衰减率
t
t
t
mGFR=计算肾小球滤过率
剂量1=初始剂量
剂量2=后续剂量
PV=第二剂量下的测量血浆体积
假设空白=0,其是给药前测量的浓度
在时间=t
因此:
其中A
利用上述方程和技术,可以实践一种用于在多剂量情况下确定生物计量指标(例如,血浆浓度)的方法。
图10-11中示出的图是根据计算机模拟模型生成的,并且示出了快和慢衰减曲线在正常和受损患者的后续剂量期间如何反应。图10示出了正常的mGFR,其示出了FD001的后续剂量。在图10中,信号10A(红色)表示FD001的血浆清除率,单位为ug/ml,而信号12A(绿色)表示FD001的间隙浓度,单位为ug/ml,并且信号14A(蓝色)表示在测试时间期间的膀胱中含有的累积标志物。
图11示出了受损mGFR,其示出了FD001的后续剂量。在图11中,信号10B(红色)表示FD001的血浆清除率,以ug/ml为单位,而信号12B(绿色)表示FD001的间隙浓度,以ug/ml为单位,并且信号14B(蓝色)表示在测试时间期间的膀胱中含有的累积标志物。注意,总肾脏清除率与FD001的总浓度成比例,而间隙泄漏始终与新的剂量有关。
实例6:间隙体积的计算
所公开的用于计算间隙体积的公式为:
其中方程(10)表示根据单个可自由滤过的报告分子类型的强度的GFR,而方程(11)表示与单个可自由滤过的报告分子类型相关联的体积分布。
常数A
间隙体积为:Vd-PV,其中PV是通过评价给药标志物(例如,给药FD003标志物)的浓度变化来计算的。
如上文所述,由于在曲线拟合计算中使用了T0时间点浓度,因此上述方程起作用。如果试图在没有T0的情况下进行曲线拟合,则上述方程实际上将不起作用。因此,A+B的边界条件=时间零处的报告标志物的浓度必须为真。
实例7:在二指数拟合算法的情况下测量间隙体积
用于使用导出T0时间点浓度进行曲线拟合到二指数拟合来计算间隙体积的方程采用以下变量:
α=陡直线的斜率
β=中直线的斜率
γ=最缓直线的斜率
V
V
D=给予的清除率或血浆标志物的剂量,以μg为单位
t=时间
A=陡曲线的幅度
B=中曲线的幅度
C=最慢曲线的幅度
C
C
G=原始肾小球滤过率(GFR),以mL/min为单位
λ=进入V
为了使用二指数拟合算法来测量间隙体积,采用了以下过程,需进一步注意,将约650道尔顿的小分子用于实验目的:
1.将数据拟合到包含有被称为时间零的时间点的双指数曲线拟合算法。通过将大右旋糖酐标志物(150kD)的给药浓度除以在以下讨论的测试过程中从血液样本获得的测量平均浓度来计算已知血浆体积。剂量为12000μg FD003。
2.使用计算PV(V
3.下表2中列出了表示待使用双指数曲线拟合算法拟合的随时间变化的小或清除率标志物的浓度的样本数据:
表2
时间,以分钟问单位 浓度ug/ml
使用双指数曲线拟合算法根据上述表2数据拟合的所得曲线在图16中示出,并得到以下拟合曲线参数:
A=106.47
α=.1924
B=14.49
β=.005847
4.给出清除标志物的初始剂量为D
5.使用mGFR的计算值,然后计算进入间隙空间的标志物的测量泄漏率λ,即:
6.使用mGFR的计算值和λ,然后通过以下导出间隙体积:
实例8:在三指数拟合算法的情况下测量间隙体积
1.将数据拟合到包含有被称为时间零的时间点的三指数曲线拟合算法。通过将小或清除率标志物的给药浓度除以已知血浆体积来计算本点。通过将大或血浆标志物(150kD)的给药浓度除以在以下讨论的测试过程中从血液样本获得的大标志物的测量平均浓度来计算已知血浆体积。剂量为12000μg FD003。需进一步注意,在本拟合实例中也使用了FD001(其大小为大约7000道尔顿)。
2.使用计算PV(V
3.下表3中列出了表示待使用三指数曲线拟合算法拟合的随时间变化的小或清除率标志物的浓度的样本数据:
表3
时间,以分钟为单位 浓度ug/ml
使用针对来自上述表3的数据的三指数曲线拟合算法的所得曲线拟合数据在图17中示出,从而得到:
A=7.6491
α=.1342
B=4.3982
β=.0253
C=1.0105
γ=0.0025
4.给出清除或小标志物的初始剂量为D
5.使用mGFR的计算值,然后计算进入间隙空间的标志物的测量泄漏率λ,即:
6.使用mGFR的计算值和λ,然后通过以下导出间隙体积:
用于计算如本文(特别是参考本文上述的实例6-8)所述的间隙体积的过程参考图15的系统图和图18的流程图进行描述。如过程框1802所示,在开始时,获取多个VFI样本数据222,其表示在测试期间的持续时间内的血液中的大和小标志物的浓度。这种获取可以使用外围装置112和计算机110实时完成,或可以通过先前存储在存储器210中的数据进行。接下来,如过程框1804所示,通过将大标志物的给药浓度除以来自血液样本的测量平均浓度来计算血浆体积V
α=陡直线的斜率
β=中直线的斜率
γ=最缓直线的斜率
A=陡曲线的幅度
B=中曲线的幅度
C=最慢曲线的幅度
接下来,如过程框1812所示,使用清除或小标志物的剂量D
系统架构
可以使用本文所述的系统和设备来实践本文公开的技术和方法。图15是示出了包括计算机110、外围装置112、呈现装置115和网络基础设施116的系统架构100的框图。计算机110包括中央处理单元(CPU)200和存储器210以及通信接口114。在一个实施例中,CPU200可以与通用处理器一起执行多个专有模块(其中每一个被编程为进行特定的算法功能),包含但不限于T0计算器模块202、曲线拟合模块204、决定引擎205、推荐引擎模块206、用户界面模块208、mGFR计算器模块209和间隙体积计算器模块211。存储器210存储VFI样本数据222的值、校准和其它杂项数据值224、预定间隙体积阈值227,并且在存在疾病的情况下,如果后面接有间隙体积阈值,则还存储疗法推荐228,如在其中的图15中所示。参照图18的流程图详细描述了用于经由各种算法模块可执行计算机110的交互来计算间隙体积的过程。计算机110进一步包括通信接口114,所述通信接口使计算机110能够与外围装置112、呈现装置115和网络基础设施116交互。
可以在数字电子电路系统、计算机硬件、固件、软件和/或其组合中实施上述系统和方法的实施例。所述实施方案可以作为计算机程序产品。所述实施方案可以例如在机器可读存储装置中,以由数据处理设备执行或控制数据处理设备的操作。所述实施方案可以例如是可编程处理器、计算机和/或多个计算机。
计算机程序以任何形式的编程语言(包含编译和/或解释语言)提供,并且计算机程序可以以任何形式(包含作为独立程序或适用于计算环境中的子例程、元素和/或其它单元)部署。计算机程序可以被部署成在一个计算机上或一个站点处的多个计算机上执行。
本文描述的方法的各种数学计算和步骤可以由执行计算机程序以通过对输入数据进行操作并生成输出来进行所公开的方法的功能的一或多个可编程处理器来进行。方法步骤也可以由被实施为专用逻辑电路系统的设备来进行。所述电路系统可以例如是FPGA(现场可编程门阵列)和/或ASIC(专用集成电路)。子例程和软件代理可以是指计算机程序、处理器、专用电路系统、软件和/或硬件实施所述功能的部分。
本公开的系统的组件可以被体现为电路系统、被配置成执行应用(例如,软件、通信设备应用)的可编程电路系统,或被体现为被配置成在可编程电路系统上执行的电路系统和软件的组合系统。实施例可以包含存储一组指令的机器可读媒体,所述指令组使得至少一个处理器进行所描述的方法步骤。机器可读媒体通常被定义为可以由机器访问以检索内容或数据的任何存储媒体。机器可读媒体的实例包含但不限于磁光盘、只读存储器(ROM)、随机存取存储器(RAM)、可擦可编程只读存储器(EPROM)、电可擦可编程只读存储器(EEPROM)、固态通信设备(SSD)或适合于存储待由机器(例如,计算机)执行的指令的任何其它机器可读装置。
举例来说,适合于执行计算机程序的处理器包含通用和专用微处理器以及任何种类的数字计算机的任何一或多个处理器。通常,处理器从只读存储器或随机存取存储器或两者接收指令和数据。计算机的基本元件是用于执行指令的处理器和用于存储指令和数据的一或多个存储装置。通常,计算机可以可操作地耦合以从用于存储数据的一或多个大容量存储装置(例如,磁盘、磁光盘或光盘)接收数据和/或向其转移数据。
在实施例中,外围装置112可以用光探针来实施,所述光探针通过适当的光耦合耦合到计算机110以对数据进行采样并将其存储到存储器210中。在实施例中,探针包括“光导管”或透明光波导,例如光线电缆或光反射管,其能够将光信号从一个位置传输到另一个位置。光导管可以包含一个光波导(例如,单个光纤电缆)或围绕公共光源和光学界面布置的多个光波导(例如,一束光纤电缆)。在实施例中,光导管具有近端和远端,其中远端在光导管和血管系统之间形成非侵入性界面,使得血管系统中的荧光分子的荧光强度从血管系统向光导管传输,通过光导管的远端处的光学界面到达光导管的近端。光导管的近端可以连接到荧光检测器,以监测血管系统中的荧光标志物的荧光强度。光导管可以超出口腔稳定引导件,或者可以被设置成与稳定引导件的表面机械连通,使得口腔稳定引导件限制光导管的移动。口腔稳定引导件可以包含牙齿嵌入件。口腔稳定引导件还可以含有用于保持光导管在舌头下方的位置的光导突出件。
口腔探针可以进一步包含无菌鞘,其可以包含均匀的透明材料或者可以包含透明区域和可移动区域。口腔探针可以进一步包含用于在光学界面和组织部分之间保持透明无菌屏障的装配区域,或用于在光学定位引导件和生物环境之间保持无菌屏障的可移动区域。用于激发荧光标签的光源在本领域中是已知的。在探针的情况下,光源可以与探针成一体或与探针分开。
为了提供与用户的交互,可以在具有显示装置115的计算机上实施上述技术。在实施例中,显示装置115可以包括专用显示器监视器,例如液晶显示器(LCD)监视器,或者可以用任何数量的显示装置来实施,所述显示装置包含但不限于具有浏览器装置的计算机、电话、IP电话、移动装置(例如,蜂窝电话、个人数字助理(PDA)装置、膝上型计算机、电子邮件装置)和/或其它通信装置。浏览器装置包含例如具有万维网浏览器(例如,可从微软公司获得的
用户界面,例如图14中示出的用户界面118,是由计算机110的用户界面模块208呈现的。此用户界面可以包含一或多个触敏元件,其允许用户基于与在用户界面上呈现的可视图标的交互来选择访问和操纵信息。另外,与用户的交互可以例如是经由键盘和定点装置(例如,鼠标或轨迹球)的,用户可以通过所述键盘和定点装置向计算机提供输入(例如,与用户界面元件交互)。可以使用其它种类的装置来提供与用户的交互。其它装置可以例如是以任何形式的感觉反馈(例如,视觉反馈、听觉反馈或触觉反馈)提供给用户的反馈。例如,可以以任何形式接收来自用户的输入,包含声音、语音和/或触觉输入。
可以在包含后端组件的分布式计算系统中实施上述技术。后端组件可以例如是数据服务器、中间件组件和/或应用服务器。可以在包含前端组件的分布式计算系统中实施上述技术。前端组件可以例如是客户端计算机,其具有图形用户界面、用户可以通过其与示范性实施方案进行交互的Web浏览器和/或传输装置的其它图形用户界面。系统的组件可以通过数字数据通信的任何形式或媒体(例如,通信网络)互连。通信网络的实例包含局域网(LAN)、广域网(WAN)、互联网、有线网络和/或无线网络,其可以作为云网络116将计算机110到图15中示出的计算机网络基础设施中的任何其它资源或处理元件。
数据传输和指令也可以通过通信网络进行。适合于体现计算机程序指令和数据的信息载体包含所有形式的非易失性存储器,包含例如半导体存储器装置。信息载体可以是例如EPROM、EEPROM、闪速存储器装置、磁盘、内部硬盘、可移动盘、磁光盘、CD-ROM和/或DVD-ROM盘。处理器和存储器可以由专用逻辑电路系统补充和/或并入专用逻辑电路系统中。
可以将实现所公开的方法的目标所需的各种处理步骤描述为客户端/服务器模型,其中一或多个过程作为客户端执行,而其它过程作为服务器执行。在实施例中,客户端和服务器的关系是通过在相应计算机上运行并且彼此具有客户端-服务器关系的计算机程序产生的。在这种系统中,客户端过程和服务器过程通常彼此相距遥远,并且通常通过通信网络基础设施进行交互。is the right will see you tomorrow此类网络可以包含任何已知网络基础设施组件或替代物,包含分组交换和电路交换网络或其任何组合。基于分组的网络可以包含例如因特网、运营商互联网协议(IP)网络(例如,局域网(LAN)、广域网(WAN)、校园网(CAN)、城域网(MAN)、家庭区域网(HAN))、专用IP网络、IP专用分支交换(IPBX)、无线网络(例如,无线点访问网络(RAN)、802.11网络、802.16网络、通用分组无线电服务(GPRS)网络、HiperLAN)和/或其它基于分组的网络。基于电路的网络可以包含例如公共电话交换网(PSTN)、专用分支交换(PBX)、无线网络(例如,RAN、蓝牙、码分多址(CDMA)网络、时分多址(TDMA)网络、全球移动通信系统(GSM)网络)和/或其它基于电路的网络。
术语包括、包含和/或每一个的复数形式是开放式的,并且包含所列出的部分,并且可以包含未列出的另外的部分。所述术语和/或是开放式的,并且包含一或多个所列出的部分以及所列出的部分的组合。
读者将理解,本文所公开的系统和技术使从业人员能够获得某些生物计量指标的相当准确的表示,包含间隙空间体积,其可以用于诊断某些疾病状态,包含但不限于充血性心力衰竭、高血压、慢性肾病或败血症中的任何一种。
尽管已经在附图中示出了本公开的几个实施例,但是不旨在将本公开限制于此,因为旨在使本公开的范围与本领域将允许的一样宽,并且说明书也需以同样方式阅读。还可以设想到上述实施例的任何组合,并且其在所附权利要求的范围内。因此,以上描述不应被解释为是限制性的,而仅仅是特定实施例的例示。
- 用于确定间隙体积的方法和设备
- 车辆传感器、具有用于车辆状态确定的控制设备和至少两个车辆传感器的系统以及用于运行具有用于车辆状态确定的控制设备和至少两个车辆传感器的系统的方法
