氢化奎尼丁作为单一活性成分在制备抗肿瘤药物中的应用
文献发布时间:2023-06-19 19:16:40
技术领域
本发明属于药物应用领域,特别是指一种氢化奎尼丁作为单一活性成分在制备抗肿瘤药物中的应用。
背景技术
肝癌俗称“癌中之王”,是一种侵袭性恶性疾病,是全球第六大常见高发癌症,也是癌症相关死亡的第三大原因,仅次于肺癌和结直肠癌。据统计,2020年全球肝癌新发患者为905677例,死亡患者为830180例。由于发病机制极其复杂,个体差异较大,且侵袭性强,进展迅速,多数患者确诊时已为中晚期。目前临床采用的较为有效的治疗方案包括手术、放化疗、靶向治疗以及免疫治疗联合中药等。然而,上述治疗方法随着药物浓度和时间增加,耐药性增强,预后差,副作用大,肝癌的治疗手段尚需进一步完善。因此,加强抗肝癌药物研发力度尤为重要。
氢化奎尼丁也称为二氢奎尼丁,英文名称为Dihydroquinidine,分子式为C
发明内容
本发明的目的在于提供一种氢化奎尼丁作为单一活性成分在制备抗肿瘤药物中的应用,可明显抑制肝癌细胞的增殖,诱导细胞凋亡,但不影响正常肝细胞的增殖,有望开发并作为治疗肝癌的临床药物选择。
本发明的整体技术构思是:
氢化奎尼丁作为单一活性成分在制备抗肿瘤药物中的应用,所述的肿瘤为肝癌。
优选的技术实现手段是,所述的抗肿瘤药物含有药学上可接受的载体或稀释剂,制备成药用剂型。
所述的抗肿瘤药物是在体外抑制人肝癌细胞生长的药物,优选的技术实现手段是,所述的抗肿瘤药物为治疗人肝癌细胞Bel-7404、HepG-2的药物。
所述的抗肿瘤药物是在体内抑制肝癌动物模型肿瘤生长的药物。
本发明的药物在制备成粉剂、片剂、可分散粉剂、胶囊、扁囊剂形式的固体药物制剂时,可使用固体载体。可使用的固体载体优选为选自稀释剂、调味剂、增溶剂、润滑剂、悬浮剂、粘合剂、膨胀剂等中的一种或多种物质,或可为包封物质。适宜的固体载体包括碳酸镁、硬脂酸镁、滑石粉、蔗糖、乳糖、果胶、糊精、淀粉、明胶、甲基纤维素、羧甲基纤维素钠、可可脂等。由于它们易于给药,片剂,粉剂、扁囊剂和胶囊等代表最有利的口服固体制剂。
为了易于给药及剂量均一,将上述药物制剂配制成剂量单位形式是特别有利的。
制剂的剂量单位形式指适于作为单一剂量的物理分离单位,每个单位含有产生所期望的治疗效果的计算好的预定量的活性成分。这种剂量单位形式可为包装形式,如片剂、胶囊或装在小管或小瓶中的粉剂。
本领域技术人员可按常规方法确定适于某种情况的优选剂量。一般开始治疗的量低于活性成分的最佳剂量,然后逐渐增加给药剂量,直到达到最佳治疗效果。为方便起见,总的日剂量可分为几部分,分数次给药。
本发明所具备的实质性特点和取得的显著技术进步在于:
申请人经实验证实,氢化奎尼丁可明显抑制人肝癌细胞的增殖,诱导细胞凋亡,但不影响人体正常肝细胞的增殖;表明氢化奎尼丁能够安全、有效地抑制肝癌细胞的生长,具有抗肝癌作用。本发明为制备治疗肝癌的药物以及氢化奎尼丁的临床应用提供了新的思路。
附图说明
本发明的附图有:
图1为氢化奎尼丁对人肝癌细胞HepG2、人肝癌细胞Bel-7404和人正常肝细胞HL7702细胞形态及增殖的影响结果示意图,与对照组比,*p<0.05,**p<0.01,***p<0.001。
其中图1a是MTT法检测氢化奎尼丁处理人肝癌细胞Bel-7404、人肝癌细胞HepG2和人正常肝细胞HL-7702细胞24小时细胞活性的影响结果图。
图1b是氢化奎尼丁处理人肝癌细胞Bel-7404、人肝癌细胞HepG2细胞24小时后形态观察图。
图1c是氢化奎尼丁处理人肝癌细胞Bel-7404、人肝癌细胞HepG2细胞24小时、48小时、72小时后细胞活性的影响结果图。
图2为氢化奎尼丁诱导人肝癌细胞Bel-7404细胞凋亡结果示意图。
其中图2a是Hoechst染色形态图。
图2b是细胞凋亡流式结果图。
图2c是凋亡细胞统计图。
图3为氢化奎尼丁诱导人肝癌细胞Bel-7404细胞线粒体膜电位(Δψm)降低和凋亡信号通路激活的结果示意图。
其中图3a是氢化奎尼丁处理人肝癌细胞Bel-7404后检测线粒体膜电位的流式图。
图3b是氢化奎尼丁处理人肝癌细胞Bel-7404后检测线粒体膜电位的荧光图。
图3c是氢化奎尼丁处理人肝癌细胞Bel-7404后提取的蛋白凋亡相关WB结果图及灰度扫描结果图。
图4为氢化奎尼丁诱导活性氧(ROS)产生的结果示意图。
图4中左图是活性氧(ROS)产生的结果。
图4中右图是活性氧(ROS)产生统计图。
图5为氢化奎尼丁抑制细胞迁移的结果示意图。
其中图5a是细胞划痕观察细迁移图。
图5b是细胞划痕统计迁移率示意图。
图5c是Transwell小室细胞迁移效果图。
图5d是Transwell小室细胞迁移率统计图图。
图6为氢化奎尼丁体外诱导自噬的结果示意图。
其中图6a是AO和MDC染色图。
图6b是氢化奎尼丁处理人肝癌细胞Bel-7404后提取的蛋白自噬相关WB结果图及灰度扫描结果图。
图7为氢化奎尼丁对体内肿瘤生长的抑制作用示意图。
其中图7a是肿瘤大小统计图。
图7b是小鼠体重统计图。
图7c是肿瘤大小示意图图。
图8为氢化奎尼丁对体内脏器的影响示意图。
其中图8a体内脏器指数统计表。
图8b是肝肾肿瘤组织的HE染色形态观察图。
图8c是血液肝肾功能指标统计图。
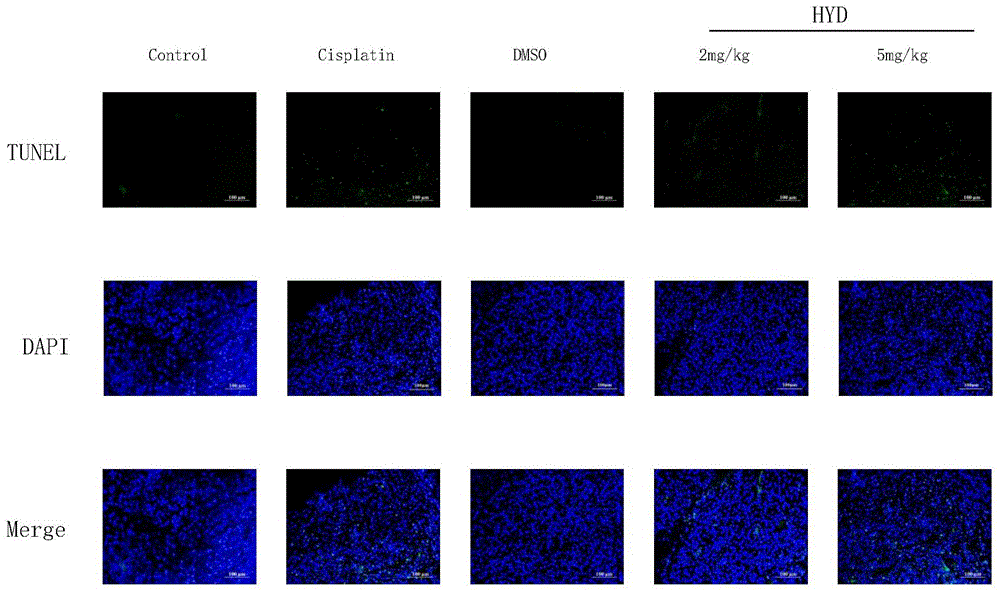
图9为氢化奎尼丁体内诱导凋亡的结果示意图。
图10为氢化奎尼丁体内诱导自噬的结果示意图。
其中图10a是免疫组化检测肿瘤组织切片中自噬蛋白LC3B蛋白表达示意图。
图10b是LC3B蛋白表达统计图。
具体实施方式
为了使本技术领域的技术人员更好地理解本发明的技术方案,下面结合附图和最佳实施例对本发明作进一步的详细说明。
实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
实施例1
细胞增殖检测实验
1.1材料和仪器
试剂:胰酶消化液、胎牛血清、培养基RPMI-1640及MEM培养液(Gibco公司产品),氢化奎尼丁(上海源叶);噻唑蓝(Sigma公司);培养皿、移液管和96孔板(LABSELECT公司);Epoch 2微孔板酶标仪(BioTek公司)。
1.2实验用药:
样品:氢化奎尼丁用二甲基亚砜配制成浓度为20毫克/毫升的溶液。
阳性对照品:顺铂(上海源叶)。
1.3试验方法
收集对数生长期的人肝癌细胞Bel-7404、人肝癌细胞HepG-2及人正常肝细胞HL-7702细胞,用胰酶消化液消化,并将其悬浮于含有10%新鲜胎牛血清的DEME培养基、MEM培养基及RPMI-1640培养基的培养液中,将细胞密度为5000个/毫升的细胞按每孔100微升接种于96孔细胞培养板中,放置于二氧化碳浓度为5%、温度为37℃的培养箱培养24小时后,加入不同浓度的氢化奎尼丁,设5个复孔,继续在培养箱培养24小时,之后向每个细胞培养孔中加入100微升噻唑蓝溶液,并在培养箱培养4小时后加入150微升的二甲基亚砜然后在酶标仪490nm处测吸光值(OD值)。
生长抑制率(%)=100-(用药组值/对照组平均值)×100%。
1.4结果
为了检测氢化奎尼丁对肝癌细胞活性的影响,用不同浓度氢化奎尼丁处理人肝癌细胞Bel-7404,24小时后采用倒置显微镜观察细胞形态。与对照组相比,氢化奎尼丁处理的细胞形态发生了明显的变化,细胞发生皱缩且形态变圆,细胞的数量减少,具体见图1a。同时MTT法检测氢化奎尼丁对人肝癌细胞HepG2、人肝癌细胞Bel-7404及人正常肝细胞HL7702细胞活性的影响。结果发现,氢化奎尼丁对人肝癌细胞HepG2和人肝癌细胞Bel-7404细胞的IC
实施例2
细胞凋亡检测实验
2.1材料和仪器
试剂:不含EDTA的胰酶消化液、胎牛血清、培养基RPMI-1640(Gibco公司产品),氢化奎尼丁(上海源叶);细胞凋亡检测试剂盒(上海翌圣);培养皿、移液管和6孔板(LABSELECT公司);流式细胞仪(BD公司);Hoechst33258试剂盒(上海碧云天)。
2.2试验方法
收集对数生长期的人肝癌细胞Bel-7404后,将细胞密度为1×10
以1×10
2.3结果
通过样品分析发现氢化奎尼丁处理人肝癌细胞Bel-7404时,凋亡细胞比例从17.52%增至43.6%,表明氢化奎尼丁显著(p<0.001)诱导肝癌细胞凋亡,具体见图2a,hoechst实验结果也说明氢化奎尼丁破坏了细胞核中的染色质完整性从而引起了细胞凋亡,具体见图2b。
实施例3
线粒体膜电位、活性氧检测及Western blot实验
3.1材料和仪器
试剂:胰酶消化液、胎牛血清、培养基RPMI-1640(Gibco公司产品),氢化奎尼丁(上海源叶);线粒体膜电位检测试剂盒及活性氧检测试剂盒(索莱宝);培养皿、移液管和6孔板(LABSELECT公司);流式细胞仪(BD公司)。
蛋白提取试剂盒;蛋白浓度测定试剂盒;SDS凝胶电泳试剂盒;PVDF膜;Caspase3(Cell Signaling Technology,MA,USA);Bcl-2(Cell Signaling Technology,MA,USA);Bax(Cell Signaling Technology,MA,USA);PARP(Cell Signaling Technology,MA,USA);二抗(Abcam,Cambridge,UK)。
3.2试验方法
收集对数生长期的人肝癌细胞Bel-7404后将细胞密度为1×10
蛋白提取后进行定量,之后跑凝胶电泳转模,封闭1小时敷一抗2小时,敷相应的二抗之后进行显色。
3.3结果
线粒体依赖性途径是诱导细胞凋亡的内源性途径,线粒体膜电位(Δψm)的降低能够诱导细胞凋亡。当Δψm降低,JC-1多聚体(红色荧光)会分解成单体(绿色荧光)。因此,用JC-1染色检测了氢化奎尼丁处理24小时后的Δψm。结果显示,氢化奎尼丁红色荧光呈剂量依赖性下降,绿色荧光升高,具体见图3a,表明氢化奎尼丁处理降低了Δψm,该结果与Ba×水平升高和Bcl-2水平下降相一致。进一步发现,氢化奎尼丁处理增加了caspase3和PARP的剪切,具体见图3b。结果表明,氢化奎尼丁通过线粒体途径诱导人肝癌细胞Bel-7404细胞凋亡。
活性氧(ROS)产生在诱导细胞凋亡中起着重要的作用。进一步通过荧光探针DCFH-DA检测ROS的产生。发现氢化奎尼丁处理能够增加ROS的产生,具体见图4。
实施例4
迁移实验
4.1试验方法
以1×10
在Tranwell上室每孔接种150微升的1×10
4.2结果
肿瘤细胞迁移是恶性肿瘤转移能力的重要表现之一,因此申请人研究氢化奎尼丁是否可以抑制人肝癌细胞BEL-7404细胞的横向迁移,申请人进行了细胞划痕实验。在24小时及48小时时氢化奎尼丁处理组细胞的划痕愈合程度低于对照组细胞划痕愈合程度,具体见图5a及图5b。Transwell小室实验结果也显示,相对于对照组而言,氢化奎尼丁处理组人肝癌细胞Bel-7404穿过Transwell小室底膜的细胞数明显低于对照组,具体见图5c及图5d。说明氢化奎尼丁能够显著(p<0.001)抑制人肝癌细胞Bel-7404细胞迁移。
实施例5
Western blot检测细胞自噬实验
5.1材料和仪器
同3.1。
5.2试验方法
同3.2。
4.3结果
AO和MDC是细胞内自噬泡的特异性标记物,AO可进入细胞核与DNA结合呈现绿色荧光,与酸性细胞器结合(如自噬溶酶体)可呈现出红色荧光。自噬泡数量与AO红色荧光和MDC荧光强度呈正相关。本试验结果如图6a所示,氢化奎尼丁处理后细胞内AO红色荧光以及MDC绿色荧光增强,且随着处理浓度增加,荧光强度也逐渐增加,说明氢化奎尼丁可以诱导人肝癌细胞Bel-7404细胞自噬泡形成。Western blot分析氢化奎尼丁对人肝癌细胞Bel-7404细胞自噬的影响。数据显示,氢化奎尼丁处理后LC3B和Beclin-1的表达显著升高,而p62的表达降低,说明氢化奎尼丁通过其自噬诱导潜能介导抗肝癌作用,具体见图6b。
实施例6
体内实验
6.1试验方法
将小鼠肝癌细胞H22细胞悬液100微升(1×10
6.2结果
为了验证氢化奎尼丁是否能在体内抑制肝癌细胞生长,申请人建立了小鼠肝癌细胞H22肿瘤小鼠模型。与对照组相比,氢化奎尼丁组和顺铂组明显抑制肿瘤细胞的生长,具体见图7a。值得注意的是,氢化奎尼丁组体重没有变化,但顺铂组体重明显下降,具体见图7b。
第23天处死小鼠,分离肿瘤组织器官,称重,并拍摄肿瘤照片,如图7所示。顺铂组和高剂量氢化奎尼丁组大鼠肿瘤重量明显降低。器官指数方面,除脾脏指数外,其他各组均无明显变化,但顺铂组脾脏指数明显低于对照组,说明顺铂对小鼠有严重的副作用,具体见图8a。肿瘤、肝、肾组织HE染色,与对照组相比,氢化奎尼丁治疗组肿瘤组织有坏死区域,各组肝脏、肾脏均未见病理改变,具体如图8b所示。采用血液生化法检测肝肾功能,包括丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、尿素氮(BUN)和肌酐(Cr)。申请人观察到氢化奎尼丁处理组对丙氨酸转氨酶、天冬氨酸转氨酶等指标有一定的下降趋势,但与Cisplatin相比无显著变化,具有一定的保护作用,如图8c所示。这些结果表明,氢化奎尼丁在体内对肺癌细胞的生长有明显抑制作用,且无毒副作用。
为了证明氢化奎尼丁是否能在体内诱导肝癌细胞凋亡,TUNNEL染色结果显示氢化奎尼丁处理组经TUNNEL染色的细胞数量明显高于对照组,表明凋亡细胞数量增加,具体见图9。
为了证明氢化奎尼丁是否能在体内诱导肝癌细胞自噬,申请人通过免疫组化染色分析了肝癌模型小鼠肿瘤组织中LC3B的表达。免疫组化染色显示,与对照组相比,氢化奎尼丁处理组LC3B表达增加,具体见图10。结果与体外实验结果一致,提示氢化奎尼丁可通过诱导自噬来抑制肝癌。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- SB203580在制备抗肿瘤药物中的应用及抗肿瘤药物
- 化合物lithocarolsA-F及其制备方法和在制备抗肿瘤药物中的应用
- 四环素的有效成分在制备抗肿瘤药物中的应用
- 盐酸小檗碱的有效成分在制备抗肿瘤药物中的应用
