通过施用抗HER3抗体-药物缀合物治疗HER3-突变的癌症
文献发布时间:2023-06-19 11:14:36
技术领域
本发明涉及包含抗HER3抗体-药物缀合物的HER3-突变的癌症的治疗剂和/或癌症的治疗方法,所述方法包括将抗HER3抗体-药物缀合物施用于确定具有HER3-突变的癌症的受试者。
背景技术
人表皮生长因子受体3 (HER3;也称为ErbB3)是跨膜受体,其属于受体蛋白酪氨酸激酶的表皮生长因子受体亚家族。已知HER3在各种癌症、诸如乳腺癌、肺癌和结肠直肠癌中表达,并且其与酪氨酸激酶受体、诸如HER2和EGFR一起形成异二聚体,其后,HER3被磷酸化,由此诱导癌细胞生长或凋亡抑制信号(非专利参考文献1至3)。
存在HER3的突变体,其被称为癌症驱动突变之一(非专利参考文献4至6)。据报道,这种HER3-突变的癌症存在于例如4%的乳腺癌病例(非专利参考文献7)、10%的胃癌病例(非专利参考文献8)、1%的卵巢癌病例(非专利参考文献9)、1%的结肠直肠癌病例(非专利文献5)和1%的头颈癌病例(非专利文献10)中。
已经报道,在HER2过表达的情况下,抗HER2药物、诸如曲妥珠单抗、帕妥珠单抗和拉帕替尼在体外和体内表现出针对HER3-突变的癌症的有效性(非专利参考文献11)。
同时,也已经报道在使用作为抗HER2药物的诺拉替尼的临床研究中未显示针对HER3-突变的癌症的有效性(非专利参考文献12)。
已经表明,抗HER2药物针对HER3-突变的癌症无效的原因之一是HER3-突变的癌症可以不依赖于HER2的过表达而发挥功能。也就是说,已经报道,甚至在HER2没有过表达的情况下,HER3-突变的癌症也可以诱导癌细胞生长(非专利文献13和14),且因此据信在HER2未过表达的情况下,抗HER2药物不能发挥对HER3-突变的癌症的抗肿瘤效果。
此外,还已知已经实施研究以验证抗HER3抗体针对HER3-突变的癌症的效力(非专利参考文献11)。然而,没有报道:无论是否存在HER2过表达,抗HER3抗体已经表明针对HER3-突变的癌症的明显的效力。另外,通常假设抗HER3抗体与HER3的结合随着HER3的突变而降低,且因此将难以获得持续表现出优异的针对各种HER3突变体的抗肿瘤活性的抗HER3抗体。因此,尚未建立治疗HER3-突变的癌症的有效方法。
因此,预期具有与抗体缀合的具有细胞毒性的药物的抗体-药物缀合物(ADC)(其抗原在癌细胞的表面上表达,并且还结合能够细胞内化的抗原,且因此可以将药物选择性递送至癌细胞)引起药物在癌细胞内的累积并杀死癌细胞(非专利参考文献15至19)。
作为一种这样的抗体-药物缀合物,包含抗HER3抗体和作为拓扑异构酶I抑制剂的依沙替康的衍生物作为其组分的抗HER3抗体-药物缀合物是已知的(专利参考文献1)。没有关于抗HER3抗体-药物缀合物针对HER3-突变的癌症的效力的报道。
引文列表
专利文献
专利参考文献1:国际公开号WO 2015/155998
非专利文献
非专利参考文献1:Alimandi等人, Oncogene (1995) 10, 1813-1821.
非专利参考文献2:deFazio等人, Int. J. Cancer (2000) 87, 487-498.
非专利参考文献3:Naidu等人, Br. J. Cancer (1998) 78, 1385-1390.
非专利参考文献4:Sergina等人, Nature (2007) 445, 437-41.
非专利参考文献5:Jeong等人, Int. J. Cancer (2006) 119, 2986-7.
非专利参考文献6:Ding等人, Nature (2008) 455, 1069-75.
非专利参考文献7:Kan等人, Nature (2010) 466, 869-73.
非专利参考文献8:Wang等人, Nat. Genet. (2011) 43, 1219-23.
非专利参考文献9:Greenman等人, Nature (2007) 446, 153-8.
非专利参考文献10:Stransky等人, Science (2011) 333, 1157-60.
非专利参考文献11:Jaiswal等人, Cancer Cell (2013) 23, 603-17.
非专利参考文献12:Hyman等人, Cancer Res. (2017) Abstract CT001.
非专利参考文献13:Mishra等人, Oncotarget (2017) 69, 114371-114392.
非专利参考文献14:Mishra等人, Oncotarget (2018) 45, 27773-27788.
非专利参考文献15:Ducry等人, Bioconjugate Chem. (2010) 21, 5-13.
非专利参考文献16:Alley等人, Current Opinion in Chemical Biology(2010) 14, 529-537.
非专利参考文献17:Damle, Expert Opin. Biol. Ther. (2004) 4, 1445-1452.
非专利参考文献18:Senter等人, Nature Biotechnology (2012) 30, 631-637.
非专利参考文献19:Howard等人, J Clin Oncol (2011) 29, 398-405。
发明概述
技术问题
本发明的一个目的是提供包含抗HER3抗体-药物缀合物的HER3-突变的癌症的治疗剂和/或癌症的治疗方法,所述方法包括将抗HER3抗体-药物缀合物施用于确定具有HER3-突变的癌症的受试者。
问题的解决方案
作为为了解决上述问题而进行的认真研究的结果,发明人已经发现抗HER3抗体-药物缀合物表现出优异的针对HER3-突变的癌症的抗肿瘤活性,由此完成了本发明。
因此,本发明提供了以下[1]至[85]。
[1] HER3-突变的癌症的治疗剂,其包含抗HER3抗体-药物缀合物作为活性成分。
[2]根据[1]所述的治疗剂,其中所述HER3-突变的癌症中的HER3突变是选自以下的至少一种:V104L、V104M、A232V、P262H、G284R、D297Y、G325R、T355I、Q809R、S846I和E928G。
[3]根据[1]所述的治疗剂,其中所述HER3-突变的癌症中的HER3突变是Q809R。
[4]根据[1]至[3]中任一项所述的治疗剂,其中HER2在所述HER3-突变的癌症中过表达。
[5]根据[1]至[3]中任一项所述的治疗剂,其中HER2在所述HER3-突变的癌症中未过表达。
[6]根据[1]至[5]中任一项所述的治疗剂,其中在野生型HER3-表达细胞中和在突变型HER3-表达细胞中之间,所述抗HER3抗体-药物缀合物的溶酶体迁移没有实质性差异。
[7]根据[1]至[6]中任一项所述的治疗剂,其中在过表达HER2的HER3-表达细胞中和在不过表达HER2的HER3-表达细胞中之间,所述抗HER3抗体-药物缀合物的溶酶体迁移没有实质性差异。
[8]根据[1]至[7]中任一项所述的治疗剂,其中所述抗HER3抗体-药物缀合物是这样的抗HER3抗体-药物缀合物,其中由下式代表的药物-接头经由硫醚键与抗HER3抗体缀合:
[式1]
其中A代表与抗HER3抗体的连接位置。
[9]根据[1]至[7]中任一项所述的治疗剂,其中所述抗HER3抗体-药物缀合物是由下式代表的抗HER3抗体-药物缀合物:
[式2]
其中所述药物-接头经由硫醚键与抗HER3抗体缀合,且n是每个抗体分子缀合的药物-接头的单元的平均数。
[10]根据[1]至[9]中任一项所述的治疗剂,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:1代表的氨基酸序列组成的CDRH1、由SEQ ID NO:2代表的氨基酸序列组成的CDRH2和由SEQ ID NO:3代表的氨基酸序列组成的CDRH3;且所述轻链包含由SEQ ID NO:4代表的氨基酸序列组成的CDRL1、由SEQ ID NO:5代表的氨基酸序列组成的CDRL2和由SEQ ID NO:6代表的氨基酸序列组成的CDRL3。
[11]根据[1]至[9]中任一项所述的治疗剂,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:7代表的氨基酸序列组成的重链可变区,且所述轻链包含由SEQ ID NO:8代表的氨基酸序列组成的轻链可变区。
[12]根据[1]至[9]中任一项所述的治疗剂,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链由SEQ ID NO:9代表的氨基酸序列组成,且所述轻链由SEQ ID NO:10代表的氨基酸序列组成。
[13]根据[12]所述的治疗剂,其中所述抗HER3抗体在重链的羧基末端缺乏赖氨酸残基。
[14]根据[1]至[13]中任一项所述的治疗剂,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7至8的范围内。
[15]根据[1]至[13]中任一项所述的治疗剂,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7.5至8的范围内。
[16]根据[1]至[15]中任一项所述的治疗剂,其中所述癌症是选自以下的至少一种:乳腺癌、肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤、黑色素瘤、肾癌、尿路上皮癌、前列腺癌、胰腺癌、膀胱癌、胃肠道间质瘤、宫颈癌、食道癌、鳞状细胞癌、腹膜癌、多形胶质母细胞瘤、肝癌、肝细胞癌、子宫内膜癌、子宫癌、唾液腺癌、外阴癌、甲状腺癌、肝癌、肛门癌和阴茎癌。
[17]根据[1]至[15]中任一项所述的治疗剂,其中所述癌症是选自以下的至少一种:乳腺癌、非小细胞肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤和黑色素瘤。
[18]癌症的治疗方法,其包括向确定具有HER3-突变的癌症的受试者施用抗HER3抗体-药物缀合物。
[19]根据[18]所述的治疗方法,其中所述HER3-突变的癌症中的HER3突变是选自以下的至少一种:V104L、V104M、A232V、P262H、G284R、D297Y、G325R、T355I、Q809R、S846I和E928G。
[20]根据[18]所述的治疗方法,其中所述HER3-突变的癌症中的HER3突变是Q809R。
[21]根据[18]至[20]中任一项所述的治疗方法,其中HER2在所述HER3-突变的癌症中过表达。
[22]根据[18]至[20]中任一项所述的治疗方法,其中HER2在所述HER3-突变的癌症中未过表达。
[23]根据[18]至[22]中任一项所述的治疗方法,其中在野生型HER3-表达细胞中和在突变型HER3-表达细胞中之间,所述抗HER3抗体-药物缀合物的溶酶体迁移没有实质性差异。
[24]根据[18]至[23]中任一项所述的治疗方法,其中在过表达HER2的HER3-表达细胞中和在不过表达HER2的HER3-表达细胞中之间,所述抗HER3抗体-药物缀合物的溶酶体迁移没有实质性差异。
[25]根据[18]至[24]中任一项所述的治疗方法,其中所述抗HER3抗体-药物缀合物是这样的抗HER3抗体-药物缀合物,其中由下式代表的药物-接头经由硫醚键与抗HER3抗体缀合:
[式3]
其中A代表与抗HER3抗体的连接位置。
[26]根据[18]至[24]中任一项所述的治疗方法,其中所述抗HER3抗体-药物缀合物是由下式代表的抗HER3抗体-药物缀合物:
[式4]
其中所述药物-接头经由硫醚键与抗HER3抗体缀合,且n是每个抗体分子缀合的药物-接头的单元的平均数。
[27]根据[18]至[26]中任一项所述的治疗方法,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:1代表的氨基酸序列组成的CDRH1、由SEQ IDNO:2代表的氨基酸序列组成的CDRH2和由SEQ ID NO:3代表的氨基酸序列组成的CDRH3;且所述轻链包含由SEQ ID NO:4代表的氨基酸序列组成的CDRL1、由SEQ ID NO:5代表的氨基酸序列组成的CDRL2和由SEQ ID NO:6代表的氨基酸序列组成的CDRL3。
[28]根据[18]至[26]中任一项所述的治疗方法,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:7代表的氨基酸序列组成的重链可变区,且所述轻链包含由SEQ ID NO:8代表的氨基酸序列组成的轻链可变区。
[29]根据[18]至[26]中任一项所述的治疗方法,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链由SEQ ID NO:9代表的氨基酸序列组成,且所述轻链由SEQ ID NO:10代表的氨基酸序列组成。
[30]根据[29]所述的治疗方法,其中所述抗HER3抗体在重链的羧基末端缺乏赖氨酸残基。
[31]根据[18]至[30]中任一项所述的治疗方法,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7至8的范围内。
[32]根据[18]至[30]中任一项所述的治疗方法,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7.5至8的范围内。
[33]根据[18]至[32]中任一项所述的治疗方法,其中所述癌症是选自以下的至少一种:乳腺癌、肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤、黑色素瘤、肾癌、尿路上皮癌、前列腺癌、胰腺癌、膀胱癌、胃肠道间质瘤、宫颈癌、食道癌、鳞状细胞癌、腹膜癌、多形胶质母细胞瘤、肝癌、肝细胞癌、子宫内膜癌、子宫癌、唾液腺癌、外阴癌、甲状腺癌、肝癌、肛门癌和阴茎癌。
[34]根据[18]至[32]中任一项所述的治疗方法,其中所述癌症是选自以下的至少一种:乳腺癌、非小细胞肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤和黑色素瘤。
[35]抗HER3抗体-药物缀合物,其用于治疗HER3-突变的癌症。
[36]根据[35]所述的抗HER3抗体-药物缀合物,其中所述HER3-突变的癌症中的HER3突变是选自以下的至少一种:V104L、V104M、A232V、P262H、G284R、D297Y、G325R、T355I、Q809R、S846I和E928G。
[37]根据[35]所述的抗HER3抗体-药物缀合物,其中所述HER3-突变的癌症中的HER3突变是Q809R。
[38]根据[35]至[37]中任一项所述的抗HER3抗体-药物缀合物,其中HER2在所述HER3-突变的癌症中过表达。
[39]根据[35]至[37]中任一项所述的抗HER3抗体-药物缀合物,其中HER2在所述HER3-突变的癌症中未过表达。
[40]根据[35]至[39]中任一项所述的抗HER3抗体-药物缀合物,其中在野生型HER3-表达细胞中和在突变型HER3-表达细胞中之间,所述抗HER3抗体-药物缀合物的溶酶体迁移没有实质性差异。
[41]根据[35]至[40]中任一项所述的抗HER3抗体-药物缀合物,其中在过表达HER2的HER3-表达细胞中和在不过表达HER2的HER3-表达细胞中之间,所述抗HER3抗体-药物缀合物的溶酶体迁移没有实质性差异。
[42]根据[35]至[41]中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体-药物缀合物是这样的抗HER3抗体-药物缀合物,其中由下式代表的药物-接头经由硫醚键与抗HER3抗体缀合:
[式5]
其中A代表与抗HER3抗体的连接位置。
[43]根据[35]至[41]中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体-药物缀合物是由下式代表的抗HER3抗体-药物缀合物:
[式6]
其中所述药物-接头经由硫醚键与抗HER3抗体缀合,且n是每个抗体分子缀合的药物-接头的单元的平均数。
[44]根据[35]至[43]中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:1代表的氨基酸序列组成的CDRH1、由SEQ ID NO:2代表的氨基酸序列组成的CDRH2和由SEQ ID NO:3代表的氨基酸序列组成的CDRH3;且所述轻链包含由SEQ ID NO:4代表的氨基酸序列组成的CDRL1、由SEQ IDNO:5代表的氨基酸序列组成的CDRL2和由SEQ ID NO:6代表的氨基酸序列组成的CDRL3。
[45]根据[35]至[43]中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:7代表的氨基酸序列组成的重链可变区,且所述轻链包含由SEQ ID NO:8代表的氨基酸序列组成的轻链可变区。
[46]根据[35]至[43]中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链由SEQ ID NO:9代表的氨基酸序列组成,且所述轻链由SEQ ID NO:10代表的氨基酸序列组成。
[47]根据[46]所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体在重链的羧基末端缺乏赖氨酸残基。
[48]根据[35]至[47]中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7至8的范围内。
[49]根据[35]至[47]中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7.5至8的范围内。
[50]根据[35]至[49]中任一项所述的抗HER3抗体-药物缀合物,其中所述癌症是选自以下的至少一种:乳腺癌、肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤、黑色素瘤、肾癌、尿路上皮癌、前列腺癌、胰腺癌、膀胱癌、胃肠道间质瘤、宫颈癌、食道癌、鳞状细胞癌、腹膜癌、多形胶质母细胞瘤、肝癌、肝细胞癌、子宫内膜癌、子宫癌、唾液腺癌、外阴癌、甲状腺癌、肝癌、肛门癌和阴茎癌。
[51]根据[35]至[49]中任一项所述的抗HER3抗体-药物缀合物,其中所述癌症是选自以下的至少一种:乳腺癌、非小细胞肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤和黑色素瘤。
[52]抗HER3抗体-药物缀合物用于制备用于治疗HER3-突变的癌症的药物的用途。
[53]根据[52]所述的用途,其中所述HER3-突变的癌症中的HER3突变是选自以下的至少一种:V104L、V104M、A232V、P262H、G284R、D297Y、G325R、T355I、Q809R、S846I和E928G。
[54]根据[52]所述的用途,其中所述HER3-突变的癌症中的HER3突变是Q809R。
[55]根据[52]至[54]中任一项所述的用途,其中HER2在所述HER3-突变的癌症中过表达。
[56]根据[52]至[54]中任一项所述的用途,其中HER2在所述HER3-突变的癌症中未过表达。
[57]根据[52]至[56]中任一项所述的用途,其中在野生型HER3-表达细胞中和在突变型HER3-表达细胞中之间,所述抗HER3抗体-药物缀合物的溶酶体迁移没有实质性差异。
[58]根据[52]至[57]中任一项所述的用途,其中在过表达HER2的HER3-表达细胞中和在不过表达HER2的HER3-表达细胞中之间,所述抗HER3抗体-药物缀合物的溶酶体迁移没有实质性差异。
[59]根据[52]至[58]中任一项所述的用途,其中所述抗HER3抗体-药物缀合物是这样的抗HER3抗体-药物缀合物,其中由下式代表的药物-接头经由硫醚键与抗HER3抗体缀合:
[式7]
其中A代表与抗HER3抗体的连接位置。
[60]根据[52]至[58]中任一项所述的用途,其中所述抗HER3抗体-药物缀合物是由下式代表的抗HER3抗体-药物缀合物:
[式8]
其中所述药物-接头经由硫醚键与抗HER3抗体缀合,且n是每个抗体分子缀合的药物-接头的单元的平均数。
[61]根据[52]至[60]中任一项所述的用途,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:1代表的氨基酸序列组成的CDRH1、由SEQ ID NO:2代表的氨基酸序列组成的CDRH2和由SEQ ID NO:3代表的氨基酸序列组成的CDRH3;且所述轻链包含由SEQ ID NO:4代表的氨基酸序列组成的CDRL1、由SEQ ID NO:5代表的氨基酸序列组成的CDRL2和由SEQ ID NO:6代表的氨基酸序列组成的CDRL3。
[62]根据[52]至[60]中任一项所述的用途,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:7代表的氨基酸序列组成的重链可变区,且所述轻链包含由SEQ ID NO:8代表的氨基酸序列组成的轻链可变区。
[63]根据[52]至[60]中任一项所述的用途,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链由SEQ ID NO:9代表的氨基酸序列组成,且所述轻链由SEQ ID NO:10代表的氨基酸序列组成。
[64]根据[63]所述的用途,其中所述抗HER3抗体在重链的羧基末端缺乏赖氨酸残基。
[65]根据[52]至[64]中任一项所述的用途,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7至8的范围内。
[66]根据[52]至[64]中任一项所述的用途,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7.5至8的范围内。
[67]根据[52]至[66]中任一项所述的用途,其中所述癌症是选自以下的至少一种:乳腺癌、肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤、黑色素瘤、肾癌、尿路上皮癌、前列腺癌、胰腺癌、膀胱癌、胃肠道间质瘤、宫颈癌、食道癌、鳞状细胞癌、腹膜癌、多形胶质母细胞瘤、肝癌、肝细胞癌、子宫内膜癌、子宫癌、唾液腺癌、外阴癌、甲状腺癌、肝癌、肛门癌和阴茎癌。
[68]根据[52]至[66]中任一项所述的用途,其中所述癌症是选自以下的至少一种:乳腺癌、非小细胞肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤和黑色素瘤。
[69] HER3-突变的癌症的治疗方法,其包括向需要针对HER3-突变的癌症的治疗的受试者施用抗HER3抗体-药物缀合物。
[70]根据[69]所述的治疗方法,其中所述HER3-突变的癌症中的HER3突变是选自以下的至少一种:V104L、V104M、A232V、P262H、G284R、D297Y、G325R、T355I、Q809R、S846I和E928G。
[71]根据[69]所述的治疗方法,其中所述HER3-突变的癌症中的HER3突变是Q809R。
[72]根据[69]至[71]中任一项所述的治疗方法,其中HER2在所述HER3-突变的癌症中过表达。
[73]根据[69]至[71]中任一项所述的治疗方法,其中HER2在所述HER3-突变的癌症中未过表达。
[74]根据[69]至[73]中任一项所述的治疗方法,其中在野生型HER3-表达细胞中和在突变型HER3-表达细胞中之间,所述抗HER3抗体-药物缀合物的溶酶体迁移没有实质性差异。
[75]根据[69]至[74]中任一项所述的治疗方法,其中在过表达HER2的HER3-表达细胞中和在不过表达HER2的HER3-表达细胞中之间,所述抗HER3抗体-药物缀合物的溶酶体迁移没有实质性差异。
[76]根据[69]至[75]中任一项所述的治疗方法,其中所述抗HER3抗体-药物缀合物是这样的抗HER3抗体-药物缀合物,其中由下式代表的药物-接头经由硫醚键与抗HER3抗体缀合:
[式9]
其中A代表与抗HER3抗体的连接位置。
[77]根据[69]至[75]中任一项所述的治疗方法,其中所述抗HER3抗体-药物缀合物是由下式代表的抗HER3抗体-药物缀合物:
[式10]
其中所述药物-接头经由硫醚键与抗HER3抗体缀合,且n是每个抗体分子缀合的药物-接头的单元的平均数。
[78]根据[69]至[77]中任一项所述的治疗方法,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:1代表的氨基酸序列组成的CDRH1、由SEQ IDNO:2代表的氨基酸序列组成的CDRH2和由SEQ ID NO:3代表的氨基酸序列组成的CDRH3;且所述轻链包含由SEQ ID NO:4代表的氨基酸序列组成的CDRL1、由SEQ ID NO:5代表的氨基酸序列组成的CDRL2和由SEQ ID NO:6代表的氨基酸序列组成的CDRL3。
[79]根据[69]至[77]中任一项所述的治疗方法,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:7代表的氨基酸序列组成的重链可变区,且所述轻链包含由SEQ ID NO:8代表的氨基酸序列组成的轻链可变区。
[80]根据[69]至[77]中任一项所述的治疗方法,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链由SEQ ID NO:9代表的氨基酸序列组成,且所述轻链由SEQ ID NO:10代表的氨基酸序列组成。
[81]根据[80]所述的治疗方法,其中所述抗HER3抗体在重链的羧基末端缺乏赖氨酸残基。
[82]根据[69]至[81]中任一项所述的治疗方法,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7至8的范围内。
[83]根据[69]至[81]中任一项所述的治疗方法,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7.5至8的范围内。
[84]根据[69]至[83]中任一项所述的治疗方法,其中所述癌症是选自以下的至少一种:乳腺癌、肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤、黑色素瘤、肾癌、尿路上皮癌、前列腺癌、胰腺癌、膀胱癌、胃肠道间质瘤、宫颈癌、食道癌、鳞状细胞癌、腹膜癌、多形胶质母细胞瘤、肝癌、肝细胞癌、子宫内膜癌、子宫癌、唾液腺癌、外阴癌、甲状腺癌、肝癌、肛门癌和阴茎癌。
[85]根据[69]至[83]中任一项所述的治疗方法,其中所述癌症是选自以下的至少一种:乳腺癌、非小细胞肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤和黑色素瘤。
此外,本发明还可以表示为以下(1)至(48)。
(1) HER3基因突变的癌症的治疗剂,其包含抗HER3抗体-药物缀合物作为活性成分。
(2)根据(1)所述的治疗剂,其中HER2在所述HER3基因突变的癌症中过表达。
(3)根据(1)所述的治疗剂,其中HER2在所述HER3基因突变的癌症中未过表达。
(4)根据(1)至(3)中任一项所述的治疗剂,其中所述抗HER3抗体-药物缀合物是这样的抗HER3抗体-药物缀合物,其中由下式代表的药物-接头经由硫醚键与抗HER3抗体缀合:
[式11]
其中A代表与抗HER3抗体的连接位置。
(5)根据(1)至(4)中任一项所述的治疗剂,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:1代表的氨基酸序列组成的CDRH1、由SEQ ID NO:2代表的氨基酸序列组成的CDRH2和由SEQ ID NO:3代表的氨基酸序列组成的CDRH3;且所述轻链包含由SEQ ID NO:4代表的氨基酸序列组成的CDRL1、由SEQ ID NO:5代表的氨基酸序列组成的CDRL2和由SEQ ID NO:6代表的氨基酸序列组成的CDRL3。
(6)根据(1)至(5)中任一项所述的治疗剂,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:7代表的氨基酸序列组成的重链可变区,且所述轻链包含由SEQ ID NO:8代表的氨基酸序列组成的轻链可变区。
(7)根据(1)至(6)中任一项所述的治疗剂,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链由SEQ ID NO:9代表的氨基酸序列组成,且所述轻链由SEQ ID NO:10代表的氨基酸序列组成。
(8)根据(7)所述的治疗剂,其中所述抗HER3抗体在重链的羧基末端缺乏赖氨酸残基。
(9)根据(1)至(8)中任一项所述的治疗剂,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7至8的范围内。
(10)根据(1)至(8)中任一项所述的治疗剂,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7.5至8的范围内。
(11)根据(1)至(10)中任一项所述的治疗剂,其中所述癌症是选自以下的至少一种:乳腺癌、肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤、黑色素瘤、肾癌、尿路上皮癌、前列腺癌、胰腺癌、膀胱癌、胃肠道间质瘤、宫颈癌、食道癌、鳞状细胞癌、腹膜癌、多形胶质母细胞瘤、肝癌、肝细胞癌、子宫内膜癌、子宫癌、唾液腺癌、外阴癌、甲状腺癌、肝癌、肛门癌和阴茎癌。
(12)根据(1)至(10)中任一项所述的治疗剂,其中所述癌症是选自以下的至少一种:乳腺癌、非小细胞肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤和黑色素瘤。
(13)癌症的治疗方法,其包括向确定具有HER3基因突变的癌症的受试者施用抗HER3抗体-药物缀合物。
(14)根据(13)所述的治疗方法,其中HER2在所述HER3基因突变的癌症中过表达。
(15)根据(13)所述的治疗方法,其中HER2在所述HER3基因突变的癌症中未过表达。
(16)根据(13)至(15)中任一项所述的治疗方法,其中所述抗HER3抗体-药物缀合物是这样的抗HER3抗体-药物缀合物,其中由下式代表的药物-接头经由硫醚键与抗HER3抗体缀合:
[式12]
其中A代表与抗HER3抗体的连接位置。
(17)根据(13)至(16)中任一项所述的治疗方法,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:1代表的氨基酸序列组成的CDRH1、由SEQ IDNO:2代表的氨基酸序列组成的CDRH2和由SEQ ID NO:3代表的氨基酸序列组成的CDRH3;且所述轻链包含由SEQ ID NO:4代表的氨基酸序列组成的CDRL1、由SEQ ID NO:5代表的氨基酸序列组成的CDRL2和由SEQ ID NO:6代表的氨基酸序列组成的CDRL3。
(18)根据(13)至(17)中任一项所述的治疗方法,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:7代表的氨基酸序列组成的重链可变区,且所述轻链包含由SEQ ID NO:8代表的氨基酸序列组成的轻链可变区。
(19)根据(13)至(18)中任一项所述的治疗方法,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链由SEQ ID NO:9代表的氨基酸序列组成,且所述轻链由SEQ ID NO:10代表的氨基酸序列组成。
(20)根据(19)所述的治疗方法,其中所述抗HER3抗体在重链的羧基末端缺乏赖氨酸残基。
(21)根据(13)至(20)中任一项所述的治疗方法,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7至8的范围内。
(22)根据(13)至(20)中任一项所述的治疗方法,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7.5至8的范围内。
(23)根据(13)至(22)中任一项所述的治疗方法,其中所述癌症是选自以下的至少一种:乳腺癌、肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤、黑色素瘤、肾癌、尿路上皮癌、前列腺癌、胰腺癌、膀胱癌、胃肠道间质瘤、宫颈癌、食道癌、鳞状细胞癌、腹膜癌、多形胶质母细胞瘤、肝癌、肝细胞癌、子宫内膜癌、子宫癌、唾液腺癌、外阴癌、甲状腺癌、肝癌、肛门癌和阴茎癌。
(24)根据(13)至(22)中任一项所述的治疗方法,其中所述癌症是选自以下的至少一种:乳腺癌、非小细胞肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤和黑色素瘤。
(25)抗HER3抗体-药物缀合物,其用于治疗HER3基因突变的癌症。
(26)根据(25)所述的抗HER3抗体-药物缀合物,其中HER2在所述HER3基因突变的癌症中过表达。
(27)根据(25)所述的抗HER3抗体-药物缀合物,其中HER2在所述HER3基因突变的癌症中未过表达。
(28)根据(25)至(27)中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体-药物缀合物是这样的抗HER3抗体-药物缀合物,其中由下式代表的药物-接头经由硫醚键与抗HER3抗体缀合:
[式13]
其中A代表与抗HER3抗体的连接位置。
(29)根据(25)至(28)中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:1代表的氨基酸序列组成的CDRH1、由SEQ ID NO:2代表的氨基酸序列组成的CDRH2和由SEQ ID NO:3代表的氨基酸序列组成的CDRH3;且所述轻链包含由SEQ ID NO:4代表的氨基酸序列组成的CDRL1、由SEQ IDNO:5代表的氨基酸序列组成的CDRL2和由SEQ ID NO:6代表的氨基酸序列组成的CDRL3。
(30)根据(25)至(29)中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:7代表的氨基酸序列组成的重链可变区,且所述轻链包含由SEQ ID NO:8代表的氨基酸序列组成的轻链可变区。
(31)根据(25)至(30)中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链由SEQ ID NO:9代表的氨基酸序列组成,且所述轻链由SEQ ID NO:10代表的氨基酸序列组成。
(32)根据(31)所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体在重链的羧基末端缺乏赖氨酸残基。
(33)根据(25)至(32)中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7至8的范围内。
(34)根据(25)至(33)中任一项所述的抗HER3抗体-药物缀合物,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7.5至8的范围内。
(35)根据(25)至(34)中任一项所述的抗HER3抗体-药物缀合物,其中所述癌症是选自以下的至少一种:乳腺癌、肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤、黑色素瘤、肾癌、尿路上皮癌、前列腺癌、胰腺癌、膀胱癌、胃肠道间质瘤、宫颈癌、食道癌、鳞状细胞癌、腹膜癌、多形胶质母细胞瘤、肝癌、肝细胞癌、子宫内膜癌、子宫癌、唾液腺癌、外阴癌、甲状腺癌、肝癌、肛门癌和阴茎癌。
(36)根据(25)至(34)中任一项所述的抗HER3抗体-药物缀合物,其中所述癌症是选自以下的至少一种:乳腺癌、非小细胞肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤和黑色素瘤。
(37)抗HER3抗体-药物缀合物用于制备用于治疗HER3基因突变的癌症的药物的用途。
(38)根据(37)所述的用途,其中HER2在所述HER3基因突变的癌症中过表达。
(39)根据(37)所述的用途,其中HER2在所述HER3基因突变的癌症中未过表达。
(40)根据(37)至(39)中任一项所述的用途,其中所述抗HER3抗体-药物缀合物是这样的抗HER3抗体-药物缀合物,其中由下式代表的药物-接头经由硫醚键与抗HER3抗体缀合:
[式14]
其中A代表与抗HER3抗体的连接位置。
(41)根据(37)至(40)中任一项所述的用途,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:1代表的氨基酸序列组成的CDRH1、由SEQ ID NO:2代表的氨基酸序列组成的CDRH2和由SEQ ID NO:3代表的氨基酸序列组成的CDRH3;且所述轻链包含由SEQ ID NO:4代表的氨基酸序列组成的CDRL1、由SEQ ID NO:5代表的氨基酸序列组成的CDRL2和由SEQ ID NO:6代表的氨基酸序列组成的CDRL3。
(42)根据(37)至(41)中任一项所述的用途,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链包含由SEQ ID NO:7代表的氨基酸序列组成的重链可变区,且所述轻链包含由SEQ ID NO:8代表的氨基酸序列组成的轻链可变区。
(43)根据(37)至(42)中任一项所述的用途,其中所述抗HER3抗体是包含重链和轻链的抗体,所述重链由SEQ ID NO:9代表的氨基酸序列组成,且所述轻链由SEQ ID NO:10代表的氨基酸序列组成。
(44)根据(43)所述的用途,其中所述抗HER3抗体在重链的羧基末端缺乏赖氨酸残基。
(45)根据(37)至(44)中任一项所述的用途,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7至8的范围内。
(46)根据(37)至(44)中任一项所述的用途,其中所述抗HER3抗体-药物缀合物中每个抗体分子缀合的药物-接头的单元的平均数在7.5至8的范围内。
(47)根据(37)至(46)中任一项所述的用途,其中所述癌症是选自以下的至少一种:乳腺癌、肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤、黑色素瘤、肾癌、尿路上皮癌、前列腺癌、胰腺癌、膀胱癌、胃肠道间质瘤、宫颈癌、食道癌、鳞状细胞癌、腹膜癌、多形胶质母细胞瘤、肝癌、肝细胞癌、子宫内膜癌、子宫癌、唾液腺癌、外阴癌、甲状腺癌、肝癌、肛门癌和阴茎癌。
(48)根据(37)至(46)中任一项所述的用途,其中所述癌症是选自以下的至少一种:乳腺癌、非小细胞肺癌、结肠直肠癌、胃癌、卵巢癌、头颈癌、多形胶质母细胞瘤和黑色素瘤。
本发明的有利效果
本发明可以提供包含抗HER3抗体-药物缀合物的HER3-突变的癌症的治疗剂和/或癌症的治疗方法,所述方法包括将抗HER3抗体-药物缀合物施用于确定具有HER3-突变的癌症的受试者。
附图简述
[图1]图1显示抗HER3抗体的重链的氨基酸序列(SEQ ID NO:9)。
[图2]图2显示抗HER3抗体的轻链的氨基酸序列(SEQ ID NO:10)。
[图3]图3显示各种HER3-稳定表达细胞的RT-PCR产物的1%琼脂糖凝胶电泳的结果(HER3表达)。
[图4]图4显示各种HER2-过表达和HER3-稳定表达细胞的RT-PCR产物的1%琼脂糖凝胶电泳的结果(HER3表达)。
[图5]图5显示各种HER2-过表达和HER3-稳定表达细胞的RT-PCR产物的1%琼脂糖凝胶电泳的结果(HER2表达)。
[图6]图6显示HER3-ADC (1)在HER3-稳定表达细胞中的结合活性。
[图7]图7显示HER3-ADC (1)在HER2-过表达和HER3-稳定表达细胞中的结合活性。
[图8]图8显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对空载体-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图9]图9显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对野生型HER3-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图10]图10显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(V104L)-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图11]图11显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(V104M)-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图12]图12显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(A232V)-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图13]图13显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(P262H)-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图14]图14显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(G284R)-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图15]图15显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(D297Y)-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图16]图16显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(G325R)-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图17]图17显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(T355I)-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图18]图18显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(S846I)-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图19]图19显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(E928G)-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图20]图20显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对空载体-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图21]图21显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对野生型HER3-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图22]图22显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(V104L)-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图23]图23显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(V104M)-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图24]图24显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(A232V)-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图25]图25显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(P262H)-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图26]图26显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(G284R)-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图27]图27显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(D297Y)-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图28]图28显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(G325R)-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图29]图29显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(T355I)-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图30]图30显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(S846I)-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图31]图31显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(E928G)-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图32]图32显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对空载体-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图33]图33显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对野生型HER3-引入的细胞(没有HER2过表达)的细胞生长抑制活性。
[图34]图34显示突变型HER3 (Q809R)-引入的细胞(具有HER2过表达)的RT-PCR产物的1%琼脂糖凝胶电泳的结果(HER3表达)。
[图35]图35显示突变型HER3 (Q809R)-引入的细胞(具有HER2过表达)的RT-PCR产物的1%琼脂糖凝胶电泳的结果(HER2表达)。
[图36]图36显示HER3-ADC (1)在突变型HER3 (Q809R)-引入的细胞(具有HER2过表达)中的结合活性。
[图37]图37显示HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对突变型HER3(Q809R)-引入的细胞(具有HER2过表达)的细胞生长抑制活性。
[图38]图38显示HER3-ADC (1)针对空载体-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图39]图39显示HER3-ADC (1)针对野生型HER3-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图40]图40显示HER3-ADC (1)针对突变型HER3 (V104L)-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图41]图41显示HER3-ADC (1)针对突变型HER3 (V104M)-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图42]图42显示HER3-ADC (1)针对突变型HER3 (A232V)-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图43]图43显示HER3-ADC (1)针对突变型HER3 (P262H)-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图44]图44显示HER3-ADC (1)针对突变型HER3 (G284R)-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图45]图45显示HER3-ADC (1)针对突变型HER3 (D297Y)-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图46]图46显示HER3-ADC (1)针对突变型HER3 (G325R)-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图47]图47显示HER3-ADC (1)针对突变型HER3 (T355I)-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图48]图48显示HER3-ADC (1)针对突变型HER3 (S846I)-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图49]图49显示HER3-ADC (1)针对突变型HER3 (E928G)-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图50]图50显示HER3-ADC (1)针对空载体-引入的细胞(具有HER2过表达)的溶酶体迁移。
[图51]图51显示HER3-ADC (1)针对野生型HER3-引入的细胞(具有HER2过表达)的溶酶体迁移。
[图52]图52显示HER3-ADC (1)针对突变型HER3 (V104L)-引入的细胞(具有HER2过表达)的溶酶体迁移。
[图53]图53显示HER3-ADC (1)针对突变型HER3 (V104M)-引入的细胞(具有HER2过表达)的溶酶体迁移。
[图54]图54显示HER3-ADC (1)针对突变型HER3 (A232V)-引入的细胞(具有HER2过表达)的溶酶体迁移。
[图55]图55显示HER3-ADC (1)针对突变型HER3 (P262H)-引入的细胞(具有HER2过表达)的溶酶体迁移。
[图56]图56显示HER3-ADC (1)针对突变型HER3 (G284R)-引入的细胞(具有HER2过表达)的溶酶体迁移。
[图57]图57显示HER3-ADC (1)针对其中引入的突变型HER3 (D297Y)(具有HER2过表达)的溶酶体迁移。
[图58]图58显示HER3-ADC (1)针对突变型HER3 (G325R)-引入的细胞(具有HER2过表达)的溶酶体迁移。
[图59]图59显示HER3-ADC (1)针对突变型HER3 (T355I)-引入的细胞(具有HER2过表达)的溶酶体迁移。
[图60]图60显示HER3-ADC (1)针对突变型HER3 (Q809R)-引入的细胞(具有HER2过表达)的溶酶体迁移。
[图61]图61显示HER3-ADC (1)针对突变型HER3 (S846I)-引入的细胞(具有HER2过表达)的溶酶体迁移。
[图62]图62显示HER3-ADC (1)针对突变型HER3 (E928G)-引入的细胞(具有HER2过表达)的溶酶体迁移。
[图63]图63显示HER3-ADC (1)针对空载体-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图64]图64显示HER3-ADC (1)针对野生型HER3-引入的细胞(没有HER2过表达)的溶酶体迁移。
[图65]图65显示HER3蛋白的氨基酸序列(SEQ ID NO:69)。
实施方案的描述
在下文中,描述了用于实施本发明的优选模式。给出以下描述的实施方案仅用于举例说明本发明的典型实施方案的一个实例,并且不意欲限制本发明的范围。
[定义]
在本发明中,“HER3”与人表皮生长因子受体3 (HER3;也称为ErbB3)同义,并且是与HER1 (EGFR或ErbB-1)、HER2 (ErbB2)和HER4 (ErbB4)一起属于受体蛋白酪氨酸激酶的表皮生长因子受体亚家族的跨膜受体。已知HER3在各种癌症、诸如乳腺癌、肺癌和结肠直肠癌中表达,并且其与酪氨酸激酶受体、诸如HER2和EGFR一起形成异二聚体,其后,HER3被磷酸化,由此诱导癌细胞生长或凋亡抑制信号(Alimandi等人, Oncogene (1995) 10, 1813-1821, deFazio等人, Int. J. Cancer (2000) 87, 487-498, Naidu等人, Br. J.Cancer (1998) 78, 1385-1390)。
在本发明中,术语“HER3蛋白”以与HER3相同的含义使用。可以使用本领域技术人员众所周知的方法、诸如免疫组织化学(IHC)来检测HER3蛋白的表达。此外,还可以通过将Flag肽引入HER3蛋白并使用抗Flag肽抗体来检测HER3蛋白的表达。
HER3蛋白的氨基酸序列显示于SEQ ID NO:69 (图65)中。
在本发明中,“HER3基因”意指编码HER3蛋白的基因。HER3蛋白是HER3基因的基因产物。
在本发明中,“HER3突变”意指在HER3蛋白的氨基酸序列中具有一个或多个突变。
在本发明中,“HER3-突变的癌症”意指在HER3蛋白的氨基酸序列中具有一个或多个突变的癌症。此外,在HER3-突变的癌症中包括含有具有HER3突变的癌细胞的癌症,其甚至在整个肿瘤组织中都不具有HER3突变。
在本发明中,“HER3基因突变”意指在HER3基因中具有一个或多个突变。
在本发明中,“HER3基因突变的癌症”意指在HER3基因中具有一个或多个突变的癌症。此外,在HER3基因突变的癌症中包括含有具有HER3基因突变的癌细胞的癌症,其甚至在整个肿瘤组织中都不具有HER3基因突变。HER3基因突变引起作为基因产物的HER3蛋白的氨基酸序列中的突变,由此引起HER3突变。
HER3突变的具体实例可以包括,其中作为HER3蛋白的氨基酸残基104的V(缬氨酸)被L(亮氨酸)替代的突变(其也可以称为“V104L”)(参见例如Cancer Cell. 2013 May 13;23 (5): 603-17, Nat Genet. 2014 Aug; 46 (8): 872-6, Cancer Res. 2014 Nov 1;74 (21): 6071-81, Cancer. 2016 Sep 1; 122 (17): 2654-62, Nat Med. 2017 Jun;23 (6): 703-713, 和Nature. 2018 Feb 8; 554 (7691): 189-194),其中作为HER3蛋白的氨基酸残基104的V(缬氨酸)被M(甲硫氨酸)替代的突变(其也可以称为“V104M”)(参见例如Hum Mutat. 2008 Mar; 29 (3): 441-50, Cancer Cell. 2013 May 13; 23 (5): 603-17, Genome Biol. 2014 Apr 1; 15 (4): R55, Cancer Res. 2014 Jun 15; 74 (12):3238-47, Nat Genet. 2014 Aug; 46 (8): 872-6, 和Ann Oncol. 2016 Jan; 27(1):127-33),其中作为HER3蛋白的氨基酸残基232的A(丙氨酸)被V(缬氨酸)替代的突变(其也可以称为“A232V”)(参见例如Nat Genet. 2013 May; 45 (5): 478-86, Cancer Cell.2013 May 13; 23 (5): 603-17, Cancer Cell. 2016 Feb 8; 29 (2): 229-40, CellRep. 2016 Apr 26; 15 (4): 857-865),其中作为HER3蛋白的氨基酸残基262的P(脯氨酸)被H(组氨酸)替代的突变(其也可以称为“P262H”)(参见例如Cancer Cell. 2013 May 13;23 (5): 603-17, Gastroenterology. 2014 Feb; 146 (2): 530-38. e5, 和Nat Med.2017 Jun; 23 (6): 703-713),其中作为HER3蛋白的氨基酸残基284的G(甘氨酸)被R(精氨酸)替代的突变(其也可以称为“G284R”)(参见例如Nature. 2008 Oct 23; 455 (7216):1069-75, Cancer Cell. 2013 May 13; 23 (5): 603-17, Nat Genet. 2014 Jun; 46(6): 573-82, 和Ann Oncol. 2015 Aug; 26 (8): 1704-9),其中作为HER3蛋白的氨基酸残基297的D(天冬氨酸)被Y(酪氨酸)替代的突变(其也可以称为“D297Y”)(参见例如PLoSOne. 2014 Mar 5; 9 (3): e90459, Nat Genet. 2014 Jun; 46 (6): 573-82, NatGenet. 2014 Oct; 46 (10): 1097-102, Ann Oncol. 2016 Jan; 27(1): 127-33, 和Cancer. 2016 Sep 1; 122 (17): 2654-62),其中作为HER3蛋白的氨基酸残基325的G(甘氨酸)被R(精氨酸)替代的突变(其也可以称为“G325R”)(参见例如Nat Med. 2017 Jun; 23(6): 703-713),其中作为HER3蛋白的氨基酸残基355的T(苏氨酸)被I(异亮氨酸)替代的突变(其也可以称为“T355I”))(参见例如Nat Med. 2017 Jun; 23 (6): 703-713, 和Nature. 2018 Feb 8; 554 (7691): 189-194),其中作为HER3蛋白的氨基酸残基809的Q(谷氨酰胺)被R(精氨酸)替代的突变(其也可以称为“Q809R”)(参见例如Cancer Cell.2013 May 13; 23 (5): 603-17, Cell Rep. 2016 Apr 26; 15 (4): 857-865, 和NatMed. 2017 Jun; 23 (6): 703-713),其中作为HER3蛋白的氨基酸残基846的S(丝氨酸)被I(异亮氨酸)替代的突变(其也可以称为“S846I”)(参见例如Int J Cancer. 2006 Dec 15;119 (12): 2986-7, Nat Genet. 2014 Dec; 46 (12): 1264-6, 和Cell Rep. 2016 Apr26; 15 (4): 857-865),以及其中作为HER3蛋白的氨基酸残基928的E(谷氨酸)被G(甘氨酸)替代的突变(其也可以称为“E928G”)(参见例如Nat Genet. 2011 Oct 30; 43 (12):1219-23, Clin Cancer Res. 2016 Apr 1; 22 (7): 1583-91, Cancer. 2016 Sep 1;122 (17): 2654-62, Clin Cancer Res. 2016 Dec 15; 22 (24): 6061-6068, CancerRes. 2016 Oct 15; 76 (20): 5954-5961, 和PLoS Med. 2016 Dec 27; 13 (12):e1002201)。
在上述HER3突变中,已经表明尤其具有Q809R的癌症显示对现有抗HER2药物和抗HER3抗体的强烈抗性(Jaiswal等人, Cancer Cell (2013) 23, 603-17)。
本发明中的HER3突变没有特别限制,只要其在HER3蛋白的氨基酸序列中具有一个或多个突变,但其实例可以包括选自以下的至少一者:优选为V104L、V104M、A232V、P262H、G284R、D297Y、G325R、T355I、Q809R、S846I和E928G,更优选Q809R。
HER3突变的存在或不存在可以例如通过从癌症患者收集肿瘤组织并使福尔马林固定石蜡包埋的样本(FFPE)经受方法、诸如实时定量PCR (qRT-PCR)或微阵列分析来证实。
此外,可以通过从癌症患者收集无细胞血液循环肿瘤DNA (ctDNA)并对其进行方法、诸如下一代测序(NGS)来证实HER3突变的存在或不存在(例如Sergina等人, Nature(2007) 445, 437-41, Jeong等人, Int. J. Cancer (2006) 119, 2986-7, Ding等人,Nature (2008) 455, 1069-75, Kan等人, Nature (2010) 466, 869-73, Wang等人,Nat. Genet. (2011) 43, 1219-23, Greenman等人, Nature (2007) 446, 153-8,Stransky等人, Science (2011) 333, 1157-60, Jaiswal等人, Cancer Cell (2013)23, 603-17, Hyman等人, Cancer Res. (2017) Abstract CT001, Mishra等人,Oncotarget (2017) 69, 114371-114392, Mishra等人, Oncotarget (2018) 45, 27773-27788)。
在本发明中,术语“HER3突变”以与HER3基因突变相同的含义使用。
在本发明中,“野生型HER3”意指没有HER3突变的HER3蛋白。在本发明中,这种野生型可以被称为“WT”。
在本发明中,“突变型HER3”意指具有HER3突变的HER3蛋白。
可以通过化学转染方法(通过使用阳离子脂质、阳离子聚合物、磷酸钙等的转染),物理转染方法(通过电穿孔、显微注射、声波穿孔、激光照射等),生物转染方法(使用病毒载体等),来产生HER3-稳定表达细胞。例如,在生物转染方法中使用慢病毒的情况下,所述细胞可以通过如下产生:将慢病毒蛋白和包膜蛋白的表达质粒以及HER3表达质粒引入包装细胞(诸如Lenti-X 293 T细胞,其后从培养上清液制备慢病毒溶液,并使用该溶液培养肿瘤细胞。在此,可以根据所使用的HER3表达质粒的类型来选择性产生野生型或突变型HER3-表达细胞。突变型HER3表达质粒可以使用HER3诱变引物产生。
在本发明中,“抗HER3抗体”意指特异性结合HER3、优选具有通过结合HER3而在HER3-表达细胞中被内化的活性的抗体,换言之,具有结合HER3后迁移至HER3-表达细胞中的活性的抗体。
在本发明中,“HER2”与人表皮生长因子受体2(其也可以称为neu或ErbB-2)同义,并且是与HER1、HER3和HER4一起属于受体蛋白酪氨酸激酶的表皮生长因子受体亚家族的跨膜受体。已知HER2通过由于与HER1、HER3或HER4形成异二聚体而被细胞间酪氨酸残基的自磷酸化激活而在正常细胞和肿瘤细胞的细胞生长、分化和存活中发挥重要作用。
在本发明中,术语“HER2蛋白”以与HER2相同的含义使用。
在本发明中,HER2的“过表达”意指HER2表达被确定为阳性。例如,其表明通过免疫组织化学(IHC)确定HER2表达为3+,或通过免疫组织化学确定HER2表达为2+,并且通过原位杂交(ISH)确定HER2表达为阳性。免疫组织化学和原位杂交可以使用本领域技术人员众所周知的方法进行。例如,可以参考HER2 Test Guide, Breast Cancer Edition,第4版(由Breast Cancer HER2 Laboratory Pathology Subcommittee创建)。
可以通过化学转染方法(通过使用阳离子脂质、阳离子聚合物、磷酸钙等的转染),物理转染方法(通过电穿孔、显微注射、声波穿孔、激光照射等),生物转染方法(使用病毒载体等),来产生HER2-过表达细胞。例如,在生物转染方法中使用慢病毒的情况下,所述细胞可以通过如下产生:将慢病毒蛋白和包膜蛋白的表达质粒以及HER2表达质粒引入包装细胞(诸如Lenti-X 293 T细胞,其后从培养上清液制备慢病毒溶液,并使用该溶液培养肿瘤细胞。此外,可以通过使用上述通过引入HER3表达质粒而获得的慢病毒溶液培养HER2-过表达细胞来产生HER2-过表达和HER3-稳定表达细胞。
[抗HER3抗体-药物缀合物]
在本发明中,“抗体-药物缀合物”意指其中细胞毒性药物经由接头与抗体结合的复合物。作为此类抗体-药物缀合物,例如,可以例举美国专利号6214345、国际公开号WO2002/083067、国际公开号WO 2003/026577、国际公开号WO 2004/054622、国际公开号WO2005/112919、国际公开号WO 2006/135371、国际公开号WO 2007112193、国际公开号WO2008/033891、国际公开号WO 2009/100194、国际公开号WO 2009/134976、国际公开号WO2009/134977、国际公开号WO 2010/093395、国际公开号WO 2011/130613、国际公开号WO2011/130616、国际公开号WO 2013/055993、国际公开号WO 2014/057687、国际公开号WO2014/061277、国际公开号WO 2014/107024、国际公开号WO 2014/134457和国际公开号WO2014/145090中描述的那些,可以优选地例举国际公开号WO 2014/057687和国际公开号WO2014/061277中描述的那些,并且可以更优选地例举国际公开WO 2014/057687中描述的那些。这些抗体-药物缀合物可以通过前面提及的参考文献中描述的方法产生。
细胞毒性药物没有特别限制,只要其具有抗肿瘤效果和可以与接头结合的取代基或部分结构即可。作为此类细胞毒性药物,例如,可以例举喜树碱、加利车霉素、多柔比星、道诺霉素、丝裂霉素C、博来霉素、环胞苷、长春新碱、长春碱、甲氨蝶呤、顺铂、澳瑞他汀E、美登素、紫杉醇、吡咯并苯并二氮杂䓬及其衍生物,可以优选地例举喜树碱衍生物,并且可以更优选地例举依喜替康衍生物。
依喜替康(IUPAC名称:(1S,9S)-1-氨基-9-乙基-5-氟-1,2,3,9,12,15-六氢-9-羟基-4-甲基-10H,13H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-10,13-二酮,(其也可以由以下化学名表示:(1S,9S)-1-氨基-9-乙基-5-氟-2,3-二氢-9-羟基-4-甲基-1H,12H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-10,13(9H,15H)-二酮))(其为拓扑异构酶I抑制剂)是由下式代表的化合物。
[式15]
在本发明中,“药物-接头”意指抗体-药物缀合物中的药物和接头部分,换言之,抗体-药物缀合物中除了抗体以外的部分结构。
在本发明中,“抗HER3抗体-药物缀合物”意指其中抗体是抗HER3抗体的抗体-药物缀合物。作为此类抗HER3抗体-药物缀合物,例如,可以例举国际公开号WO 2012/019024、国际公开号WO 2012/064733和国际公开号WO 2015/155998中描述的那些,并且可以优选地例举国际公开号WO 2015/155998中描述的那些。这些抗HER3抗体-药物缀合物可以通过前面提及的参考文献中描述的方法产生。
本发明中优选使用的抗HER3抗体-药物缀合物是这样的抗HER3抗体-药物缀合物,其中由下式代表的药物-接头经由硫醚键与所述抗体缀合:
[式16]
其中A代表与抗体的连接位置。所述药物-接头与在抗体的链间二硫键位点(重链之间的两个位点,以及重链和轻链之间的两个位点)处形成的硫醇基团(换言之,半胱氨酸残基的硫原子)连接。
本发明中优选使用的抗HER3抗体-药物缀合物也可以由下式代表。
[式17]
其中所述药物-接头经由硫醚键与抗HER3抗体缀合。n的含义与所谓缀合的药物分子的平均数(DAR;药物:抗体比)的含义相同,并且指示每个抗体分子缀合的药物-接头的单元的平均数。
本发明中优选使用的抗HER3抗体-药物缀合物的每个抗体分子缀合的药物-接头的单元的平均数目优选为2至8,更优选为3至8,甚至更优选为7至8,甚至更优选为7.5至8,且甚至更优选为约8。
本发明中使用的抗HER3抗体-药物缀合物的抗HER3抗体部分优选为包含重链和轻链的抗体,所述重链包含由SEQ ID NO:1代表的氨基酸序列组成的CDRH1、由SEQ ID NO:2代表的氨基酸序列组成的CDRH2和由SEQ ID NO:3代表的氨基酸序列组成的CDRH3;且所述轻链包含由SEQ ID NO:4代表的氨基酸序列组成的CDRL1、由SEQ ID NO:5代表的氨基酸序列组成的CDRL2和由SEQ ID NO:6代表的氨基酸序列组成的CDRL3,
更优选地,包含重链和轻链的抗体,所述重链包含由SEQ ID NO:7代表的氨基酸序列组成的重链可变区,且所述轻链包含由SEQ ID NO:8代表的氨基酸序列组成的轻链可变区,和,
甚至更优选地,包含重链和轻链的抗体,所述重链由SEQ ID NO:9代表的氨基酸序列组成,且所述轻链由SEQ ID NO:10代表的氨基酸序列组成,或其中重链的羧基末端的赖氨酸残基缺失的抗体的变体。
在迁移至癌细胞中之后,本发明中优选使用的抗HER3抗体-药物缀合物通过释放由下式代表的化合物发挥抗肿瘤效果:
[式18]
推断上面提及的化合物是本发明中优选使用的抗HER3抗体-药物缀合物的抗肿瘤活性的原始来源,并且已经证实其具有拓扑异构酶I抑制作用(Ogitani Y. 等人,Clinical Cancer Research, 2016, Oct15; 22 (20): 5097-5108, Epub 2016 Mar 29)。
推断上面提及的化合物通过由下式代表的化合物的氨基结构的分解而形成:
[式19]
推断其通过抗HER3抗体-药物缀合物的接头部分的切割而形成。
[抗HER3抗体的产生]
本发明中使用的HER3蛋白可以直接从人HER3-表达细胞纯化,使用此类细胞的细胞膜级分制备为HER3蛋白(在用作抗原的情况下),或者通过在体外合成HER3或通过基因工程改造在宿主细胞中产生HER3来获得。在基因工程改造中,HER3可以通过如下具体合成:将HER3 cDNA整合至可表达的载体中,且其后在含有转录和翻译所需的酶、底物和能量物质的溶液中孵育该载体。或者,可以通过用表达HER3的载体转化另一原核或真核宿主细胞来获得蛋白。此外,还可能使用通过基因工程改造的HER3-表达细胞或表达HER3的细胞系作为HER3蛋白抗原。
HER3的RNA序列、cDNA序列和氨基酸序列公开于公共数据库中,并且可以通过登录号、诸如AAA35979(在氨基末端含有由19个氨基酸残基组成的信号序列的前体)和M34309(NCBI)进行指代。
此外,在HER3中还包括由在HER3的氨基酸序列中1至10个氨基酸被取代、缺失、添加和/或插入的氨基酸序列组成且具有与所述蛋白等效的生物活性的蛋白。
本发明中使用的抗HER3抗体可以通过已知方法获得。例如,所述抗体可以通过如下获得:使用本领域中通常实施的方法,用选自充当抗原的HER3或HER3的氨基酸序列的任何多肽免疫动物,收集体内产生的抗体并纯化所述抗体。抗原的来源不限于人,并且还可能用源自除了人以外的动物、诸如小鼠和大鼠的抗原免疫动物。在这种情况下,可以通过测试结合获得的异源抗原的抗体和人抗原之间的交叉反应性来选择适用于人疾病的抗HER3抗体。
此外,根据已知方法(例如,Kohler和Milstein, Nature (1975) 256, p. 495-497; Kennet, R. 编, Monoclonal Antibodies, p.365-367, Plenum Press, N.Y.(1980)),也可能通过经由将产生针对抗原的抗体的产生抗体的细胞与骨髓瘤细胞融合来建立杂交瘤而获得单克隆抗体。
可以通过经由基因工程改造在宿主细胞中产生编码抗原蛋白的基因来获得抗原。具体地,可以产生能够表达抗原基因的载体,使得将所述载体引入宿主细胞以表达该基因,随后纯化表达的抗原。还可以通过使用通过基因工程改造获得的抗原表达细胞或表达所述抗原的细胞系对动物进行免疫的方法来获得抗体。
本发明中使用的抗HER3抗体优选为人工修饰(例如,为了降低对人的异源抗原性的目的)的重组抗体,诸如嵌合抗体和人源化抗体,或优选为仅具有源自人的抗体基因序列的抗体,即,人抗体。可以使用已知方法产生此类抗体。
作为嵌合抗体,可以例举其中抗体的可变区和恒定区彼此异质的抗体,诸如其中小鼠或大鼠来源的抗体的可变区与人来源的恒定区缀合的嵌合抗体(Proc. Natl. Acad.Sci. U.S.A., 81, 6851-6855, (1984))。
作为人源化抗体,可以例举其中仅将异源抗体的互补决定区(CDR;互补决定区)并入人来源的抗体中的抗体(Nature (1986) 321, p. 522-525),其中除了异源抗体的CDR序列以外还通过CDR移植(WO 90/07861)将异源抗体的一部分框架中的氨基酸残基移植至人抗体中的抗体,以及使用基因转化诱变策略人源化的抗体(美国专利号5821337)。
作为人抗体,可以例举使用具有含有人抗体的重链和轻链基因的人染色体片段的人抗体产生小鼠制备的抗体(参见例如Tomizuka, K. 等人, Nature Genetics (1997)16, p. 133-143; Kuroiwa, Y. 等人, Nucl. Acids Res. (1998) 26, p. 3447-3448;Yoshida, H. 等人, Animal Cell Technology: Basic and Applied Aspects vol.10,p. 69-73 (Kitagawa, Y., Matsuda, T. 和Iijima, S. 编), Kluwer AcademicPublishers, 1999; 和Tomizuka, K. 等人, Proc. Natl. Acad. Sci. USA (2000) 97,p. 722-727)。作为一个替代方案,可以例举通过选自人抗体文库的噬菌体展示获得的抗体(参见例如Wormstone, I. M.等人, Investigative Ophthalmology & Visual Science.(2002) 43 (7), p. 2301-2308; Carmen, S.等人, Briefings in Functional Genomicsand Proteomics (2002), 1 (2), p. 189-203; 和Siriwardena, D. 等人,Ophthalmology (2002) 109 (3), p. 427-431)。
本发明中使用的抗HER3抗体也包括抗体的修饰变体。根据本发明的修饰的变体意指通过化学或生物修饰根据本发明的抗体获得的那些。化学修饰的变体包括具有附接至氨基酸骨架或N-连接或O-连接的碳水化合物链的化学部分的化学修饰的变体。生物修饰的变体包括翻译后修饰(诸如添加N-连接或O-连接的糖链,N-末端或C-末端加工,脱酰胺基,天冬氨酸的异构化和甲硫氨酸的氧化)的那些,以及具有通过使用原核宿主细胞表达在N-末端添加的甲硫氨酸残基的那些。此外,修饰的变体的含义还包括标记为使得能够检测或分离本发明中使用的抗HER3抗体或抗原的那些,诸如酶标记体、荧光标记体和亲和力标记体。本发明中使用的抗HER3抗体的此类修饰变体可用于提高抗体的稳定性和血液保留,降低抗原性以及检测或分离抗体或抗原。
此外,可以通过调节与本发明中使用的抗HER3抗体结合的糖链的修饰(诸如糖基化和去岩藻糖基化)来增强抗体依赖性细胞毒性活性。作为用于调节抗体的糖链的修饰的技术,国际公开号WO 99/54342、国际公开号WO 00/61739、国际公开号WO 02/31140、国际公开号WO 2007/133855和国际公开号WO 2013/120066等是已知的,但对这些实例没有限制。本发明中使用的抗HER3抗体还包括此类抗体,其具有调节的糖链修饰。
已知在培养的哺乳动物细胞中产生的抗体的重链的羧基末端的赖氨酸残基被缺失(Journal of Chromatography A, 705: 129-134 (1995))。此外,还已知重链的羧基末端的两个氨基酸残基甘氨酸和赖氨酸也被缺失,并且新位于羧基末端的脯氨酸残基被酰胺化(Analytical Biochemistry, 360: 75-83 (2007))。然而,重链序列的此类缺失和修饰对抗体的抗原结合能力和效应子功能(诸如补体激活和抗体-依赖性细胞毒性)没有影响。因此,本发明中使用的抗HER3抗体包括如上修饰的抗体和抗体的功能片段,并且包括在重链羧基末端缺失一个或两个氨基酸的缺失变体和酰胺化的缺失变体(诸如羧基末端的脯氨酸残基被酰胺化的重链)。然而,本发明中使用的抗HER3抗体的重链的羧基末端的缺失变体不限于上面提及的类型,只要维持抗原结合能力和效应子功能即可。构成本发明中使用的抗HER3抗体的两条重链可以由任何一条重链构成,或者可以是选自全长和上述缺失变体的任何两条重链的组合。缺失变体的定量比可以受到培养的哺乳动物细胞的类型和用于产生本发明中使用的抗HER3抗体的培养条件的影响,但本发明中使用的抗HER3抗体的实例可以优选包括在两条重链各自的羧基末端缺失一个氨基酸残基的那些。
作为本发明中使用的抗HER3抗体的同种型,可以例举IgG (IgG1、IgG2、IgG3和IgG4),并且可以优选地例举IgG1或IgG2。此外,它们的变体也可以用作根据本发明的抗HER3抗体。
本发明中可以使用的抗HER3抗体的实例包括patritumab (U3-1287),U1-59(国际公开号WO 2007/077028),AV-203 (国际公开号WO 2011/136911),LJM-716 (国际公开号WO2012/022814),duligotumab (MEHD-7945A)(国际公开号WO 2010/108127),istiratumab(MM-141) (国际公开号WO 2011/047180),lumretuzumab (RG-7116) (国际公开号WO2014/108484),setibantumab (MM-121) (国际公开号WO 2008/100624),REGN-1400 (国际公开号WO 2013/048883),ZW-9 (国际公开号WO 2013/063702)及其变体、活性片段和修饰的变体。优选地,可以例举patritumab和U1-59。这些抗HER3抗体可以通过上面提及的参考文献中描述的方法产生。
[抗HER3抗体-药物缀合物的产生]
用于产生根据本发明的抗HER3抗体-药物缀合物的药物-接头中间体由下式代表。
[式20]
所述药物-接头中间体可以表示为化学名N- [6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酰基]甘氨酰基甘氨酰基-L-苯丙氨酰基-N-[(2-{[(1S,9S)-9-乙基-5-氟-9-羟基-4-甲基-10,13-二氧代-2,3,9,10,13,15-六氢-1H,12H-苯并[de]吡喃并[3',4':6,7]吲哚嗪并[1,2-b]喹啉-1-基]氨基}-2-氧代乙氧基)甲基]甘氨酰胺,并且可以参考国际公开号WO 2014/057687、国际公开号WO 2015/155998、国际公开号WO 2019/044947等的描述来产生。
本发明中使用的抗HER3抗体-药物缀合物可以通过使上述药物-接头中间体与具有硫醇基团(或者称为巯基基团)的抗HER3抗体反应来产生。
具有巯基基团的抗HER3抗体可通过本领域技术人员众所周知的方法获得(Hermanson, G.T, Bioconjugate Techniques, pp. 56-136, pp. 456-493, AcademicPress (1996))。例如,通过在抗体内每个链间二硫化物使用0.3至3摩尔当量的还原剂诸如三(2-羧乙基)膦盐酸盐(TCEP)并在含有螯合剂诸如乙二胺四乙酸(EDTA)的缓冲液中与抗HER3抗体反应,可以获得在抗体内具有部分或完全还原的链间二硫化物的具有巯基基团的抗HER3抗体。
此外,通过每个具有巯基基团的抗HER3抗体使用2至20摩尔当量的药物-接头中间体,可以产生其中每个抗体分子缀合2至8个药物分子的抗HER3抗体-药物缀合物。
产生的抗HER3抗体-药物缀合物的每个抗体分子缀合的药物分子的平均数目可以例如通过如下进行确定:基于在两个波长280 nm和370 nm处测量抗HER3抗体-药物缀合物及其缀合前体的UV吸光度的计算方法(UV方法),或基于通过HPLC测量定量通过用还原剂处理抗体-药物缀合物获得的片段的计算方法(HPLC方法)。
抗HER3抗体和药物-接头中间体之间的缀合,以及抗HER3抗体-药物缀合物的每个抗体分子缀合的药物分子的平均数的计算,可以参考国际公开号WO 2015/155998等等中的描述来进行。
[治疗剂和/或治疗方法]
本发明的治疗剂和/或治疗方法包括施用抗HER3抗体-药物缀合物,并且可以用于治疗HER3-突变的癌症。
可以使用本发明的治疗剂和/或治疗方法的HER3-突变的癌症优选为选自以下的至少一种:乳腺癌,肺癌(包括小细胞肺癌和非小细胞肺癌),结肠直肠癌(其也可以称为结肠直肠癌,并且包括结肠癌和直肠癌),胃癌(其也可以称为胃腺癌),卵巢癌,头颈癌,多形胶质母细胞瘤,黑色素瘤,肾癌,尿路上皮癌,前列腺癌,胰腺癌,膀胱癌,胃肠道间质瘤,宫颈癌,食道癌,鳞状细胞癌,腹膜癌,多形胶质母细胞瘤,肝癌,肝细胞癌,子宫内膜癌,子宫癌,唾液腺癌,外阴癌,甲状腺癌,肝癌,肛门癌和阴茎癌,并且更优选为选自以下的至少一种:乳腺癌,非小细胞肺癌,结肠直肠癌,胃癌,卵巢癌,头颈癌,多形性胶质母细胞瘤和黑色素瘤。
本发明的治疗剂和治疗方法可以优选用于哺乳动物,并且可以更优选用于人。
本发明的治疗剂和治疗方法的抗肿瘤效果可以例如通过如下来证实:使肿瘤细胞表达突变型HER3并且在没有HER2过表达和/或具有HER2过表达的情况下测量抗HER3抗体-药物缀合物的细胞生长抑制活性。此外,也可能通过如下来证实该效果:通过将表达突变型HER3的肿瘤移植至测试动物中来产生模型,并向动物应用本发明的治疗剂或治疗方法。
此外,还可以在临床研究中证实本发明的治疗剂和治疗方法的抗肿瘤效果。也就是说,该效果可以通过如下来证实:将本发明的治疗剂或治疗方法应用于确定为具有HER3突变的癌症患者并使用实体瘤的应答评估标准(RECIST)评估方法、WHO评估方法、Macdonald评估方法、重量测量和其他技术。该效果可以通过指数、诸如完全应答(CR)、部分应答(PR)、进行性疾病(PD)、客观应答率(ORR)、应答的持续时间(DoR)、无进展存活(PFS)和总体存活(OS)来确定。
对于针对HER3-突变的癌症的抗肿瘤效果,可以通过上面提及的方法证实本发明的治疗剂和治疗方法相对于现有抗癌剂的优势。
本发明的治疗剂和治疗方法减慢癌细胞的生长,抑制生长,和甚至破坏癌细胞。这些作用可以使癌症患者摆脱癌症症状并改善QOL,由此达到治疗效果,同时维持癌症患者的生命。即使不破坏癌细胞,也可以通过抑制或控制癌细胞的增殖,癌症患者可以存活更久,同时实现更高的QOL。
可以预期本发明的治疗剂通过局部应用于癌组织而不是作为全身疗法应用于患者而具有治疗作用。
本发明的治疗剂可以作为含有至少一种药学上合适的成分的药物组合物施用。考虑到本发明中使用的抗HER3抗体-药物缀合物的剂量、施用浓度等,药学上合适的成分可以从本领域中通常使用的制剂添加剂等中适当地选择和应用。例如,本发明的治疗剂可以作为含有缓冲剂、诸如组氨酸缓冲剂、赋形剂、诸如蔗糖或海藻糖和表面活性剂、诸如聚山梨酯80或20的药物组合物(下文中称为“本发明的药物组合物”)施用。本发明的药物组合物可以优选地用作注射剂,可以更优选地用作水性注射剂或冻干注射剂,并且甚至可以更优选地用作冻干注射剂。
在本发明的药物组合物是水性注射剂的情况下,其可以优选地用合适的稀释剂稀释,且然后作为静脉内输注给予。对于稀释剂,可以例举葡萄糖溶液、生理盐水等,并且可以优选地例举葡萄糖溶液,并且可以更优选地例举5%葡萄糖溶液。
在本发明的药物组合物是冻干注射剂的情况下,可以优选地将其溶解于注射用水中,随后可以将所需量用合适的稀释剂稀释,且然后作为静脉内输注给予。对于稀释剂,可以例举葡萄糖溶液、生理盐水等,并且可以优选地例举葡萄糖溶液,并且可以更优选地例举5%葡萄糖溶液。
可用于施用本发明的药物组合物的施用途径的实例包括静脉内、皮内、皮下、肌内和腹膜内途径,并且优选地包括静脉内途径。
本发明中使用的抗HER3抗体-药物缀合物可以优选地每周一次、每2周一次、每3周一次或每4周一次施用于人,并且甚至可以更优选地每3周一次施用。
另外,本发明中使用的抗HER3抗体-药物缀合物可以优选地以1.6 mg/kg至12.8mg/kg的剂量施用于人,并且可以更优选地以1.6 mg/kg、3.2 mg/kg、4.8 mg/kg、5.6 mg/kg、6.4 mg/kg、8.0 mg/kg、9.6 mg/kg或12.8 mg/kg的剂量施用,并且可以甚至更优选以4.8 mg/kg、5.6 mg/kg或6.4 mg/kg的剂量施用。
本发明的治疗剂还可以与除了本发明中使用的抗HER3抗体-药物缀合物以外的癌症治疗剂组合施用,由此增强抗肿瘤效果。用于这种目的的其他癌症治疗剂可以与本发明的治疗剂同时、分开或随后施用于受试者,并且可以在改变各自的施用间隔的同时进行施用。此类癌症治疗剂不受限制,只要其为具有抗肿瘤活性的试剂即可,并且可以通过选自以下的至少一种进行例举:伊立替康(CPT-11)、顺铂、卡铂、奥沙利铂、氟尿嘧啶(5-FU)、吉西他滨、卡培他滨、紫杉醇、多西他赛、多柔比星、表柔比星、环磷酰胺、丝裂霉素C、替加氟-吉美拉西汀-奥替拉西制剂、西妥昔单抗、帕尼单抗、贝伐单抗、雷莫西单抗、瑞戈非尼、曲氟胸苷-地匹福林制剂、吉非替尼、厄洛替尼、阿法替尼、奥希替尼、甲氨蝶呤、培美曲塞、他莫昔芬、托瑞米芬、氟维司群、亮丙瑞林、戈舍瑞林、来曲唑、阿那曲唑、孕酮制剂、曲妥珠单抗emtansin、曲妥珠单抗、帕妥珠单抗、拉帕替尼、尼沃单抗、派姆单抗、阿特珠单抗、杜瓦鲁单抗、阿维单抗、伊匹单抗和曲美单抗。
本发明的治疗剂也可以与放射疗法组合使用。例如,癌症患者在用本发明的治疗剂治疗之前和/或之后或与其同时进行放射疗法。
本发明的治疗剂还可以与外科手术组合用作辅助化学疗法。外科手术通过例如除去脑肿瘤的全部或部分来实施。本发明的治疗剂可以为了在外科手术之前减小脑肿瘤的大小的目的进行施用(称为手术前辅助化学疗法或新辅助疗法),或者可以在外科手术后为了预防脑肿瘤的复发的目的进行施用(称为手术后辅助化学疗法或辅助治疗)。
实施例
鉴于以下所示的实施例具体描述了本发明。然而,本发明不限于这些。此外,其决不应以限制的方式进行解释。
[实施例1]抗HER3抗体-药物缀合物的产生
根据国际公开号WO 2015/155998中描述的产生方法,使用包含由SEQ ID NO:9代表的氨基酸序列组成的重链和由SEQ ID NO:10代表的氨基酸序列组成的轻链的抗HER3抗体(在本发明中称为"HER3-Ab (1)"),且使其与由下式代表的药物-接头中间体(下文中,称为“药物-接头中间体(1)”)反应:
[式21]
产生抗HER3抗体-药物缀合物(在本发明中称为"HER3-ADC (1)"),其中由下式代表的药物-接头经由硫醚键与抗HER3抗体缀合:
[式22]
其中A代表与抗体的连接位置。每个HER3-ADC (1)的抗体分子的缀合的药物分子的平均数在7至8的范围内。
[实施例2] HER3-稳定表达细胞的产生
实施例2-1:用于表达HER3突变的慢病毒的载体的产生
1. pLVSIN EF1α HER3 (WT) Pur的产生
使用HER3 cDNA作为模板,将DNA用由SEQ ID NO:11代表的HER3 IF引物(Fw)和由SEQ ID NO:12代表的HER3 IF引物(Rev)扩增,并使用InFusion System (可得自ClontechLaboratories, Inc.)插入pLVSIN EF1α Pur (#6186, 可得自Takara Bio Inc.)的XbaI位点(pLVSIN EF1α HER3 (WT) Pur)。通过DNA测序证实插入序列。
2. pLVSIN EF1α flag-HER3 (WT) Pur的产生
使用pLVSIN EF1α HER3 (WT) Pur作为模板,将质粒的全长用由SEQ ID NO:13代表的Flag IF引物(Fw)和由SEQ ID NO:14代表的Flag IF引物(Rev)扩增,以通过使用InFusion System (可得自Clontech Laboratories, Inc)自连接获得pLVSIN EF1α flag-HER3 (WT) Pur。通过DNA测序证实序列。编码Flag-HER3 (WT)的cDNA的核苷酸序列显示于SEQ ID NO:15中,且Flag-HER3 (WT)的氨基酸序列显示于SEQ ID NO:16中。
3. 用于表达各种突变型HER3的每种质粒的产生
i) pLVSIN EF1α flag-HER3 (V104L) Pur
使用pLVSIN EF1α flag-HER3 (WT)作为模板,将质粒的全长用由SEQ ID NO:17代表的HER3诱变引物(Fw)和由SEQ ID NO:18代表的HER3诱变引物(Rev)扩增,以通过使用InFusion System (可得自Clontech Laboratories, Inc)自连接获得用于表达突变型HER3的质粒(pLVSIN EF1α flag-HER3 (V104L) Pur)。通过DNA测序证实序列。编码Flag-HER3 (V104L)的cDNA的核苷酸序列显示于SEQ ID NO:19中,且Flag-HER3 (V104L)的氨基酸序列显示于SEQ ID NO:20中。
ii) pLVSIN EF1α flag-HER3 (V104M) Pur
使用pLVSIN EF1α flag-HER3 (WT)作为模板,将质粒的全长用由SEQ ID NO:21代表的HER3诱变引物(Fw)和由SEQ ID NO:22代表的HER3诱变引物(Rev)扩增,以通过使用InFusion System (可得自Clontech Laboratories, Inc)自连接获得用于表达突变型HER3的质粒(pLVSIN EF1α flag-HER3 (V104M) Pur)。通过DNA测序证实序列。编码Flag-HER3 (V104M)的cDNA的核苷酸序列显示于SEQ ID NO:23中,且Flag-HER3 (V104M)的氨基酸序列显示于SEQ ID NO:24中。
iii) pLVSIN EF1α flag-HER3 (A232V) Pur
使用pLVSIN EF1α flag-HER3 (WT)作为模板,将质粒的全长用由SEQ ID NO:25代表的HER3诱变引物(Fw)和由SEQ ID NO:26代表的HER3诱变引物(Rev)扩增,以通过使用InFusion System (可得自Clontech Laboratories, Inc)自连接获得用于表达突变型HER3的质粒(pLVSIN EF1α flag-HER3 (A232V) Pur)。通过DNA测序证实序列。编码Flag-HER3 (A232V)的cDNA的核苷酸序列显示于SEQ ID NO:27中,且Flag-HER3 (A232V)的氨基酸序列显示于SEQ ID NO:28中。
iv) pLVSIN EF1α flag-HER3 (P262H) Pur
使用pLVSIN EF1α flag-HER3 (WT)作为模板,将质粒的全长用由SEQ ID NO:29代表的HER3诱变引物(Fw)和由SEQ ID NO:30代表的HER3诱变引物(Rev)扩增,以通过使用InFusion System (可得自Clontech Laboratories, Inc)自连接获得用于表达突变型HER3的质粒(pLVSIN EF1α flag-HER3 (P262H) Pur)。通过DNA测序证实序列。编码Flag-HER3 (P262H)的cDNA的核苷酸序列显示于SEQ ID NO:31中,且Flag-HER3 (P262H)的氨基酸序列显示于SEQ ID NO:32中。
v) pLVSIN EF1α flag-HER3 (G284R) Pur
使用pLVSIN EF1α flag-HER3 (WT)作为模板,将质粒的全长用由SEQ ID NO:33代表的HER3诱变引物(Fw)和由SEQ ID NO:34代表的HER3诱变引物(Rev)扩增,以通过使用InFusion System (可得自Clontech Laboratories, Inc)自连接获得用于表达突变型HER3的质粒(pLVSIN EF1α flag-HER3 (G284R) Pur)。通过DNA测序证实序列。编码Flag-HER3 (G284R)的cDNA的核苷酸序列显示于SEQ ID NO:35中,且Flag-HER3 (G284R)的氨基酸序列显示于SEQ ID NO:36中。
vi) pLVSIN EF1α flag-HER3 (D297Y) Pur
使用pLVSIN EF1α flag-HER3 (WT)作为模板,将质粒的全长用由SEQ ID NO:37代表的HER3诱变引物(Fw)和由SEQ ID NO:38代表的HER3诱变引物(Rev)扩增,以通过使用InFusion System (可得自Clontech Laboratories, Inc)自连接获得用于表达突变型HER3的质粒(pLVSIN EF1α flag-HER3 (D297Y) Pur)。通过DNA测序证实序列。编码Flag-HER3 (D297Y)的cDNA的核苷酸序列显示于SEQ ID NO:39中,且Flag-HER3 (D297Y)的氨基酸序列显示于SEQ ID NO:40中。
vii) pLVSIN EF1α flag-HER3 (G325R) Pur
使用pLVSIN EF1α flag-HER3 (WT)作为模板,将质粒的全长用由SEQ ID NO:41代表的HER3诱变引物(Fw)和由SEQ ID NO:42代表的HER3诱变引物(Rev)扩增,以通过使用InFusion System (可得自Clontech Laboratories, Inc)自连接获得用于表达突变型HER3的质粒(pLVSIN EF1α flag-HER3 (G325R) Pur)。通过DNA测序证实序列。编码Flag-HER3 (G325R)的cDNA的核苷酸序列显示于SEQ ID NO:43中,且Flag-HER3 (G325R)的氨基酸序列显示于SEQ ID NO:44中。
viii) pLVSIN EF1α flag-HER3 (T355I) Pur
使用pLVSIN EF1α flag-HER3 (WT)作为模板,将质粒的全长用由SEQ ID NO:45代表的HER3诱变引物(Fw)和由SEQ ID NO:46代表的HER3诱变引物(Rev)扩增,以通过使用InFusion System (可得自Clontech Laboratories, Inc)自连接获得用于表达突变型HER3的质粒(pLVSIN EF1α flag-HER3 (T355I) Pur)。通过DNA测序证实序列。编码Flag-HER3 (T355I)的cDNA的核苷酸序列显示于SEQ ID NO:47中,且Flag-HER3 (T355I)的氨基酸序列显示于SEQ ID NO:48中。
ix) pLVSIN EF1α flag-HER3 (S846I) Pur
使用pLVSIN EF1α flag-HER3 (WT)作为模板,将质粒的全长用由SEQ ID NO:49代表的HER3诱变引物(Fw)和由SEQ ID NO:50代表的HER3诱变引物(Rev)扩增,以通过使用InFusion System (可得自Clontech Laboratories, Inc)自连接获得用于表达突变型HER3的质粒(pLVSIN EF1α flag-HER3 (S846I) Pur)。通过DNA测序证实序列。编码Flag-HER3 (S846I)的cDNA的核苷酸序列显示于SEQ ID NO:51中,且Flag-HER3 (S846I)的氨基酸序列显示于SEQ ID NO:52中。
x) pLVSIN EF1α flag-HER3 (E928G) Pur
使用pLVSIN EF1α flag-HER3 (WT)作为模板,将质粒的全长用由SEQ ID NO:53代表的HER3诱变引物(Fw)和由SEQ ID NO:54代表的HER3诱变引物(Rev)扩增,以通过使用InFusion System (可得自Clontech Laboratories, Inc)自连接获得用于表达突变型HER3的质粒(pLVSIN EF1α flag-HER3 (E928G) Pur)。通过DNA测序证实序列。编码Flag-HER3 (E928G)的cDNA的核苷酸序列显示于SEQ ID NO:55中,且Flag-HER3 (E928G)的氨基酸序列显示于SEQ ID NO:56中。
实施例2-2:用于表达HER2的慢病毒的载体的产生
1. pLVSIN EF1α HER2 Neo的产生
使用HER2 cDNA作为模板,将DNA用由SEQ ID NO:57代表的HER2 IF引物(Fw)和由SEQ ID NO:58代表的HER2 IF引物(Rev)扩增,并使用InFusion System (可得自ClontechLaboratories, Inc.)插入pLVSIN EF1α Neo (Takara Bio Inc., #6184)的NotI位点(pLVSIN EF1α HER2 Neo)。通过DNA测序证实插入序列。编码HER2的cDNA的核苷酸序列显示于SEQ ID NO:59中,且HER2的氨基酸序列显示于SEQ ID NO:60中。
实施例2-3:HER3-稳定表达细胞的产生
将Lenti-X 293 T细胞(可得自Clontech Laboratories, Inc.)以1 x 10
实施例2-4:HER2-过表达和HER3-稳定表达细胞系的产生
1. HER2-过表达细胞的产生
将Lenti-X 293 T细胞(可得自Clontech Laboratories, Inc.)以1 x 10
2. HER2-过表达和HER3-稳定表达细胞的产生
将Lenti-X 293 T细胞(可得自Clontech Laboratories, Inc.)以1 x 10
图3至图5显示结果。图3显示各种HER3-稳定表达细胞的RT-PCR产物的1%琼脂糖凝胶电泳的结果,且图4和图5显示各种HER2-过表达和HER3-稳定表达细胞的RT-PCR产物的1%琼脂糖凝胶电泳的结果。
在HER3-稳定表达细胞中,在野生型和突变型HER3两者中均观察到HER3基因表达。在HER2-过表达和HER2-稳定表达细胞中,观察到HER2过表达,并且在HER3野生型和突变型HER3两者中均观察到HER3基因表达。
实施例2-5:细胞表面上的HER3表达阳性率的证实
将HER3-稳定表达MDA-MB-231细胞用含有10% FBS(可得自HycloneLaboratories, Inc)的RPMI1640培养基(可得自Thermo Fisher SCIENTIFIC K.K.)培养。用TrypLE (R) Express Enzyme (可得自Thermo Fisher SCIENTIFIC K.K.)将细胞与培养板分离,以通过台盼蓝处理测量活细胞的数目。将相同数目的活细胞添加至96-孔U-型底板,通过离心沉淀细胞,并用Stain Buffer(可得自Becton, Dickinson and Company)替换培养基。再次,通过离心沉淀细胞,并通过添加100 μL稀释至1 μg/mL的PE抗DYKDDDDK标签抗体(BioLegend, #637310)进行悬浮。将用未添加PE抗DYKDDDDK标签抗体的Stain Buffer处理的细胞用作对照组。使细胞在黑暗中在冰上反应60分钟,且然后用Stain Buffer洗涤。再次,将细胞悬浮于100 μL Stain Buffer中,然后向其中添加等量的4%多聚甲醛磷酸盐缓冲液(Wako Pure Chemical Industries, Ltd.),并使混合物在黑暗中在冰上反应20分钟。用Stain Buffer洗涤后,使用Attune NxT流式细胞仪(可得自Thermo Fisher SCIENTIFICK.K.)测量荧光信号,并使用FlowJo软件(版本10.5.0,可得自Becton, Dickinson andCompany)分析测量结果。表1显示用PE抗DYKDDDDK标签抗体处理的各种突变型HER3-引入的细胞的HER3表达阳性率。
细胞表面上的HER3表达比例为65.0%至83.9%,并且确定比较细胞之间的抗HER3抗体-药物缀合物的特性没有问题。
[实施例3]HER3-ADC (1)与野生型和各种突变型HER3-引入的细胞系各自的结合活性的证实。
将野生型和各种突变型HER3-引入的MDA-MB-231细胞用含有10% FBS(可得自Hyclone Laboratories, Inc)的RPMI1640培养基(可得自Thermo Fisher SCIENTIFICK.K.)培养。用TrypLE (R) Express Enzyme (可得自Thermo Fisher SCIENTIFIC K.K.)将细胞与培养板分离,以通过台盼蓝处理测量活细胞的数目。将相同数目的活细胞添加至96-孔U-型底板,然后通过离心沉淀细胞,并用Stain Buffer(可得自Becton, Dickinson andCompany)替换培养基。再次,通过离心沉淀细胞,并将其悬浮于用冰冷却的100 μL HER3-ADC (1)稀释液(通过使用Stain Buffer进行1/10系列稀释,制备为100 nM至0.1 nM)中。将用未添加HER3-ADC (1)的Stain Buffer处理的细胞用作对照组。使细胞在冰上反应60分钟,且然后用Stain Buffer洗涤。此外,向其中添加100 µL稀释至10 µg/mL的Stain Buffer或二抗(山羊抗人IgG (H+L)交叉吸附的二抗, Alexa Fluor647, Thermo FisherSCIENTIFIC K.K., #A-21445),并将细胞悬浮于其中。使细胞在黑暗中在冰上反应60分钟之后,且然后用Stain Buffer洗涤。将细胞悬浮于100 μL Stain Buffer中之后,向其中添加等量的4%多聚甲醛磷酸盐缓冲液(Wako Pure Chemical Industries, Ltd.),并使混合物在黑暗中在冰上反应20分钟。用Stain Buffer洗涤后,使用Attune NxT流式细胞仪(可得自Thermo Fisher SCIENTIFIC K.K.)测量荧光信号,并使用FlowJo软件(版本10.5.0,可得自Becton, Dickinson and Company)分析测量结果。为了定量源自细胞中的HER3-ADC (1)的荧光信号,使用通过减去用Stain Buffer处理的对照组的信号而获得的值。
图6和图7显示结果。纵轴显示在每种浓度下HER3-ADC (1)与野生型和各种突变型HER3-引入的细胞系各自的结合活性(HER3-阳性细胞的平均荧光强度)。
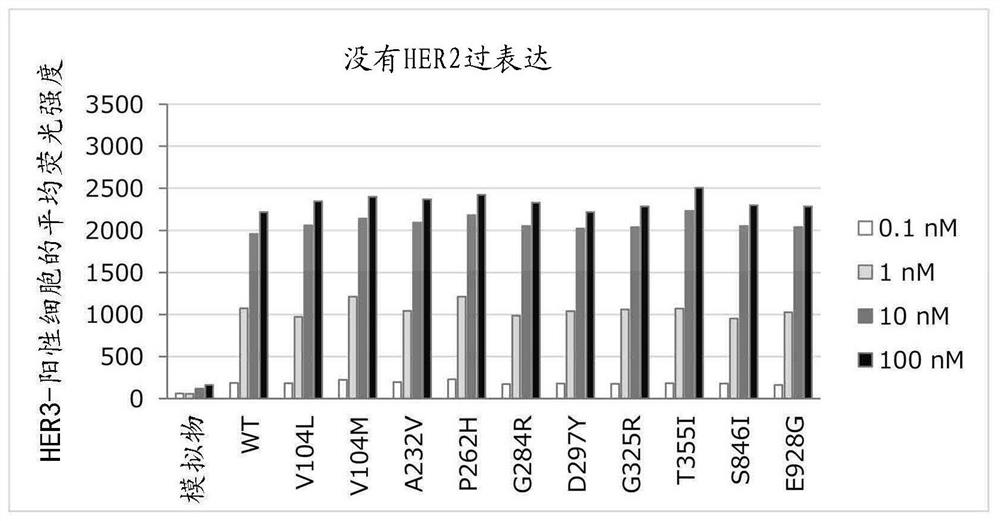
HER3-ADC (1)与各种突变型HER3-稳定表达细胞的结合以浓度依赖性方式增加,表现出与野生型HER3中相同的结合活性(图6)。HER3-ADC (1)在HER2-过表达和HER3-稳定表达细胞中的结合也以浓度依赖性方式增加,表现出与野生型HER3中相同的结合活性(图7)。在该实验中,使用没有HER2过表达的细胞用于比较,再次测量结合活性,以证实HER3-ADC (1)的结合活性没有差异,这取决于HER2表达水平(图7)。
[实施例4]通过HER3-ADC (1)抑制野生型和各种突变型HER3-引入的细胞系各自中的体外细胞生长。
在含有10% FBS(可得自Hyclone Laboratories, Inc)的RPM1640培养基(可得自Thermo Fisher SCIENTIFIC K.K.)存在的情况下,测量HER3-ADC (1)针对野生型和各种突变型HER3-引入的MDA-MB-231细胞各自的生长抑制活性。通过测量未处理组、HER3-ADC(1)-处理组和HER3-Ab (1)-处理组中的三磷酸腺苷(ATP)活性来评估细胞生长。作为阴性对照,使用通过IgG抗体和药物-接头中间体(1)之间的缀合反应产生的IgG抗体-药物缀合物(在本发明中称为“IgG-ADC (1)”)。
实施例4-1:细胞的处理
将野生型和各种突变型HER3-引入的MDA-MB-231细胞系各自作为500个细胞/100μL/孔的细胞悬浮液接种至96-微孔板(Corning,#3904,黑色壁和透明底部)中。第二天,用含有10% FBS的RPMI1640培养基制备HER3-ADC (1)、HER3-Ab (1)和阴性对照IgG-ADC (1)的10-倍浓缩液,各自添加10 μL,并将混合物在37℃、5% CO
实施例4-2:确定细胞生长抑制作用
基于ATP活性,对于具有代谢活性的活细胞,评估在培养6天期间各种试剂的细胞生长抑制活性。将100 μL CellTiter-Glo (R)试剂(Promega, #G7573)或100 μL ATPlite1-步Luminescence Assay System (PerkinElmer, #6016739)添加至96-微孔板的每个孔中,以使用EnVision Workstation (超灵敏发光测量方案,h = 0.9)测量活性。为了测量ATP活性的降低,测定每种条件下3孔或5孔的平均发光值。通过与未处理组中的细胞比较来确定发光残余比例(%),并将该值解释为细胞活力(%)。
图8至图33显示结果。图8至图19是显示各种试剂针对野生型和各种没有HER2过表达的突变型HER3-引入的细胞各自的细胞生长抑制活性的图。图20至图31是显示各种试剂针对野生型和各种具有HER2过表达的突变型HER3-引入的细胞各自的细胞生长抑制活性的图。发现HER3-ADC (1)表现出针对各种突变型HER3-引入的细胞各自以及针对野生型HER3-引入的细胞的细胞生长抑制活性(图8至图19)。另外,在HER2-过表达和HER3-稳定表达细胞中,发现HER3-ADC (1)表现出针对各种突变型HER3-引入的细胞各自以及针对野生型HER3-引入的细胞的细胞生长抑制活性(图20至图31)。在该实验中,使用没有HER2过表达的细胞,再次测量各种试剂的细胞生长抑制活性用于比较(图32和33),以证实HER3-ADC (1)的细胞生长抑制活性没有差异,这取决于HER2表达水平。
[实施例5]突变型HER3 (Q809R)-引入的细胞的产生及其药理评估
实施例5-1:用于表达突变型HER3的质粒的产生
使用pLVSIN EF1α flag-HER3 (WT)作为模板,将质粒的全长用由SEQ ID NO:65代表的HER3诱变引物(Fw)和由SEQ ID NO:66代表的HER3诱变引物(Rev)扩增,以通过使用InFusion System (可得自Clontech Laboratories, Inc)自连接获得用于表达突变型HER3的质粒(pLVSIN EF1α flag-HER3 (Q809R) Pur)。通过DNA测序证实序列。编码Flag-HER3 (Q809R)的cDNA的核苷酸序列显示于SEQ ID NO:67中,且Flag-HER3 (Q809R)的氨基酸序列显示于SEQ ID NO:68中。
实施例5-2:突变型HER3 (Q809R)-引入的细胞(具有HER2过表达)的产生
使用实施例5-1中产生的用于表达突变型HER3的质粒(pLVSIN EF1α flag-HER3(Q809R) Pur),通过与实施例2-4中相同的方法获得突变型HER3 (Q809R)-引入的细胞,作为HER2-过表达和HER3-稳定表达细胞(多克隆)。以与实施例2-4中相同的方式,从获得的细胞提取总RNA,并对RT-PCR产物进行1%琼脂糖凝胶电泳,以证实HER3基因表达(图34)和HER2基因表达(图35)。
实施例5-3:细胞表面上的HER3表达阳性率的证实
对于实施例5-2中产生的突变型HER3 (Q809R)-引入的细胞(具有HER2过表达),通过与实施例2-5中相同的方法证实细胞表面上的HER3表达阳性率。细胞表面上的HER3表达比例为58.8%,并且确定比较抗HER3抗体-药物缀合物的特性没有问题。
实施例5-4:证实与突变型HER3 (Q809R)-引入的细胞(具有HER2过表达)的结合活性
对于实施例5-2中产生的突变型HER3 (Q809R)-引入的细胞(具有HER2过表达),通过与实施例3中相同的方法评估HER3-ADC (1)与野生型和突变型HER3 (Q809R)-引入的细胞系各自在每种浓度的结合活性。HER3-ADC (1)与突变型HER3 (Q809R)引入的细胞系的结合以浓度依赖的方式增加,表现出与野生型HER3中相同的结合活性(图36)。
实施例5-5:抑制突变型HER3 (Q809R)-引入的细胞(具有HER2过表达)中的体外细胞生长
对于实施例5-2中产生的突变型HER3 (Q809R)-引入的细胞(具有HER2过表达),通过与实施例4中相同的方法,评估HER3-ADC (1)、HER3-Ab (1)和IgG-ADC (1)针对野生型和突变型HER3 (Q809R)-引入的细胞系各自的体外细胞生长的抑制。发现HER3-ADC (1)表现出针对突变型HER3 (Q809R)-引入的细胞以及针对野生型HER3-引入的细胞的细胞生长抑制活性(图37)。
[实施例6]证实HER3-ADC (1)在野生型和各种突变型HER3-引入的细胞各自中的溶酶体迁移
在含有10% FBS(可得自Hyclone Laboratories, Inc)的RPMI1640培养基(可得自Thermo Fisher SCIENTIFIC K.K.)存在的情况下,测量HER3-ADC (1)在野生型和各种突变型HER3-引入的细胞各自中的溶酶体迁移。HER3-ADC (1)用具有pH敏感性的荧光染料pHrodo标记,并通过测量通过溶酶体迁移发射的荧光信号进行评估。
实施例6-1:pHrodo-标记的HER3-ADC (1)的制备
对于pHrodo标记,使用pHrodo (R) iFL Microscale Protein Labeling Kit。使用10 mM乙酸盐/5%山梨糖醇(pH5.5, NACALAI TESQUE, INC),将HER3-ADC (1)制备为1mg/mL。将其100 μL(等于100μg)添加至反应管中。将pHrodo (R) iFL Red STP酯溶解于DMSO中,并将对应于HER3-ADC (1)的蛋白的摩尔数10倍的量添加至反应管中并混合,且然后使混合物在室温下反应60分钟。将反应溶液使用Zeba-spin (R)脱盐柱(可得自ThermoFisher SCIENTIFIC K.K.)和Amicon Ultra-0.5 (Merck Millipore Corporation)进行离心,以纯化pHrodo-标记的HER3-ADC (1)。使用NanoDrop (R) 8000分光光度计测量280 nm和566 nm处的吸光度,以测定标记效率。
实施例6-2:在培养细胞中的溶酶体迁移
将野生型和各种突变型HER3-引入的细胞各自作为5x10
图38至64显示结果。图38至49显示HER3-稳定表达细胞(没有HER2过表达)的结果,且图50至62显示HER3-稳定表达细胞(具有HER2过表达)的结果。
pHrodo-标记的HER3-ADC (1)在各种突变型HER3-引入的细胞各自以及野生型HER3-引入的细胞中以浓度依赖的方式表现出溶酶体迁移(图38至图49)。由此发现,在野生型HER3-表达细胞中和在突变型HER3-表达细胞中之间,HER3-ADC (1)的溶酶体迁移没有实质性差异。
还发现pHrodo-标记的HER3-ADC (1)在HER2-过表达和HER3-稳定表达细胞中也以浓度依赖的方式表现出溶酶体迁移(图50至图62)。在该实验中,再次证实HER3-ADC (1)在没有HER2过表达的细胞中的溶酶体迁移用于比较(图63和64)。由此发现,在具有HER2的过表达的HER3-表达细胞中和没有HER2的过表达的HER3-表达细胞中之间,HER3-ADC (1)的溶酶体迁移没有实质性差异。
前面提及的结果证实,无论是否存在HER2过表达,HER3-ADC (1)表现出针对各种突变型HER3-引入的细胞各自的细胞生长抑制活性。
当前,已经临床研究HER3-ADC (1),并且已经表明,对于突变型HER3情况以及对于野生型HER3情况,可以预期临床效力。
序列表的自由文本
SEQ ID NO:1 - 抗HER3抗体的CDRH1的氨基酸序列
SEQ ID NO:2 - 抗HER3抗体的CDRH2的氨基酸序列
SEQ ID NO:3 - 抗HER3抗体的CDRH3的氨基酸序列
SEQ ID NO:4 - 抗HER3抗体的CDRL1的氨基酸序列
SEQ ID NO:5 - 抗HER3抗体的CDRL2的氨基酸序列
SEQ ID NO:6 - 抗HER3抗体的CDRL3的氨基酸序列
SEQ ID NO:7 - 抗HER3抗体的重链可变区的氨基酸序列
SEQ ID NO:8 - 抗HER3抗体的轻链可变区的氨基酸序列
SEQ ID NO:9 - 抗HER3抗体的重链的氨基酸序列
SEQ ID NO:10 - 抗HER3抗体的轻链的氨基酸序列
SEQ ID NO:11 - HER3 IF引物(Fw)的核苷酸序列
SEQ ID NO:12 - HER3 IF引物(Rev)的核苷酸序列
SEQ ID NO:13 - Flag IF引物(Fw)的核苷酸序列
SEQ ID NO:14 - Flag IF引物(Rev)的核苷酸序列
SEQ ID NO:15 - 编码Flag-HER3 (WT)的cDNA的核苷酸序列
SEQ ID NO:16 - Flag-HER3 (WT)的氨基酸序列
SEQ ID NO:17 - HER3诱变引物(Fw)的核苷酸序列
SEQ ID NO:18 - HER3诱变引物(Rev)的核苷酸序列
SEQ ID NO:19 - 编码Flag-HER3 (V104L)的cDNA的核苷酸序列
SEQ ID NO:20 - Flag-HER3 (V104L)的氨基酸序列
SEQ ID NO:21 - HER3诱变引物(Fw)的核苷酸序列
SEQ ID NO:22 - HER3诱变引物(Rev)的核苷酸序列
SEQ ID NO:23 - 编码Flag-HER3 (V104M)的cDNA的核苷酸序列
SEQ ID NO:24 - Flag-HER3 (V104M)的氨基酸序列
SEQ ID NO:25 - HER3诱变引物(Fw)的核苷酸序列
SEQ ID NO:26 - HER3诱变引物(Rev)的核苷酸序列
SEQ ID NO:27 - 编码Flag-HER3 (A232V)的cDNA的核苷酸序列
SEQ ID NO:28 - Flag-HER3 (A232V)的氨基酸序列
SEQ ID NO:29 - HER3诱变引物(Fw)的核苷酸序列
SEQ ID NO:30 - HER3诱变引物(Rev)的核苷酸序列
SEQ ID NO:31 - 编码Flag-HER3 (P262H)的cDNA的核苷酸序列
SEQ ID NO:32 - Flag-HER3 (P262H)的氨基酸序列
SEQ ID NO:33 - HER3诱变引物(Fw)的核苷酸序列
SEQ ID NO:34 - HER3诱变引物(Rev)的核苷酸序列
SEQ ID NO:35 - 编码Flag-HER3 (G284R)的cDNA的核苷酸序列
SEQ ID NO:36 - Flag-HER3 (G284R)的氨基酸序列
SEQ ID NO:37 - HER3诱变引物(Fw)的核苷酸序列
SEQ ID NO:38 - HER3诱变引物(Rev)的核苷酸序列
SEQ ID NO:39 - 编码Flag-HER3 (D297Y)的cDNA的核苷酸序列
SEQ ID NO:40 - Flag-HER3 (D297Y)的氨基酸序列
SEQ ID NO:41 - HER3诱变引物(Fw)的核苷酸序列
SEQ ID NO:42 - HER3诱变引物(Rev)的核苷酸序列
SEQ ID NO:43 - 编码Flag-HER3 (G325R)的cDNA的核苷酸序列
SEQ ID NO:44 - Flag-HER3 (G325R)的氨基酸序列
SEQ ID NO:45 - HER3诱变引物(Fw)的核苷酸序列
SEQ ID NO:46 - HER3诱变引物(Rev)的核苷酸序列
SEQ ID NO:47 - 编码Flag-HER3 (T355I)的cDNA的核苷酸序列
SEQ ID NO:48 - Flag-HER3 (T355I)的氨基酸序列
SEQ ID NO:49 - HER3诱变引物(Fw)的核苷酸序列
SEQ ID NO:50 - HER3诱变引物(Rev)的核苷酸序列
SEQ ID NO:51 - 编码Flag-HER3 (S846I)的cDNA的核苷酸序列
SEQ ID NO:52 - Flag-HER3 (S846I)的氨基酸序列
SEQ ID NO:53 - HER3诱变引物(Fw)的核苷酸序列
SEQ ID NO:54 - HER3诱变引物(Rev)的核苷酸序列
SEQ ID NO:55 - 编码Flag-HER3 (E928G)的cDNA的核苷酸序列
SEQ ID NO:56 - Flag-HER3 (E928G)的氨基酸序列
SEQ ID NO:57 – HER2 IF引物(Fw)的核苷酸序列
SEQ ID NO:58 – HER2 IF引物(Rev)的核苷酸序列
SEQ ID NO:59 - 编码HER2的cDNA的核苷酸序列
SEQ ID NO:60 - HER2的氨基酸序列
SEQ ID NO:61 - HER3引物(Fw)的核苷酸序列
SEQ ID NO:62 - HER3引物(Rev)的核苷酸序列
SEQ ID NO:63 – HER2引物(Fw)的核苷酸序列
SEQ ID NO:64 – HER2引物(Rev)的核苷酸序列
SEQ ID NO:65 - HER3诱变引物(Fw)的核苷酸序列
SEQ ID NO:66 - HER3诱变引物(Rev)的核苷酸序列
SEQ ID NO:67 - 编码Flag-HER3 (Q809R)的cDNA的核苷酸序列
SEQ ID NO:68 - Flag-HER3 (Q809R)的氨基酸序列
SEQ ID NO:69 – HER3蛋白的氨基酸序列
- 通过施用抗HER3抗体-药物缀合物治疗HER3-突变的癌症
- 通过施用抗HER2抗体-药物缀合物治疗HER2突变的癌
