降糖食品成分的酶促富集
文献发布时间:2024-04-18 19:58:26
相关申请的交叉引用
本申请要求2021年2月2日提交的美国临时申请号63/144,815的优先权,其公开内容通过引用并入本文。
技术领域
本发明涉及通过酶促转化制备富含低升糖的(low-glycemic)糖替代品的食品成分。更具体地,本发明涉及制备富含D-塔格糖、D-阿洛酮糖(D-allulose)、D-阿洛糖(D-allose)、D-甘露糖、D-塔罗糖和/或肌醇的食品成分的方法,该方法通过将在面粉、粗粉(meal)、磨碎的块茎、磨碎的豆类、磨碎的茎皮(ground bark)、淀粉、麦芽谷物或麦芽提取物、麦芽糊精、纤维素、纤维糊精、它们的任何衍生物(例如,直链淀粉、支链淀粉、糊精、纤维二糖等)中发现的糖类和/或蔗糖酶促转化为D-塔格糖、D-阿洛酮糖、D-阿洛糖、D-甘露糖、D-塔洛糖和/或肌醇,其中富集的物料用作食品成分,而不是经纯化后用作食品成分的低升糖的糖。
背景技术
为了对抗糖尿病和肥胖症,降低传统糖(包括蔗糖、葡萄糖和其他糖)是各大食品公司的共同目标。随着低升糖的糖替代品(例如阿洛酮糖或赤藓糖醇)的大规模生产的出现,这一目标正在越来越多的产品中得到实现。然而,低升糖的糖替代品的高成本经常导致这些低成本食品中的更健康产品的经济可行性失败。降低成本的一种方法是在其现有的低成本成分(例如面粉、淀粉或蔗糖)中生产低升糖的糖替代品,而不是将其作为单独的成分进行纯化和添加。例如,目前阿洛酮糖主要通过果糖的酶促异构化来生产(WO2014049373)。总之,该方法的缺点是原料成本较高,从果糖中分离阿洛酮糖的成本高,并且产品收率相对较低。
需要开发一种在食品成分生产中富集低升糖的糖的成本有效的合成途径,其中该方法的至少一个步骤涉及节约能量的化学反应。此外,需要富集方法,其中生产低升糖的糖替代品的方法步骤可以在一个罐或生物反应器中进行。还需要一种可以在相对低的磷酸盐浓度下进行的低升糖的糖替代品的富集方法,其中磷酸盐可以再循环,和/或该方法不需要使用三磷酸腺苷(ATP)作为磷酸盐源。还需要在任何反应步骤中不需要使用昂贵的烟酰胺腺嘌呤二核苷酸(NAD(H))辅酶的低升糖的糖替代品的富集途径。当由于食品成分的未转化部分的物理性质而需要较低的向低升糖的糖的转化率(相对于纯淀粉)并且商业上可接受以满足食物制备中的降低糖目标时,还需要用低升糖的糖来富集食品成分,而不需要首先纯化非淀粉组分的食品成分。
发明内容
本文描述的发明包括利用酶促级联反应制备富含低升糖的糖替代品的食品成分的方法。适用于该方法的食品成分是那些不需要ATP就能产生葡萄糖1-磷酸的那些成分(例如,面粉、粗粉、磨碎的块茎、磨碎的豆类、磨碎的茎皮、淀粉、麦芽谷物或麦芽提取物、麦芽糊精、纤维素、纤维糊精、它们的衍生物和蔗糖)。在各个方面,所述方法包括在果糖6-磷酸4-差向异构酶(F6PE)的催化下,将果糖6-磷酸(F6P)转化为塔格糖6-磷酸(T6P);以及在塔格糖6-磷酸磷酸酶(T6PP)的催化下,将T6P转化为塔格糖。本发明还涉及通过本文描述的任何方法制备的塔格糖。
在各个方面,所述方法包括在阿洛酮糖(psicose)6-磷酸3-差向异构酶(P6PE)的催化下,将果糖6-磷酸(F6P)转化为阿洛酮糖6-磷酸(P6P);并在阿洛酮糖6-磷酸磷酸酶(P6PP)的催化下,将P6P转化为阿洛酮糖(allulose)(也称为阿洛酮糖(psicose))。本发明还涉及通过本文描述的任何方法制备的阿洛酮糖。
在各个方面,所述方法包括在阿洛酮糖6-磷酸3-差向异构酶(P6PE)的催化下,将果糖6-磷酸(F6P)转化为阿洛酮糖6-磷酸(P6P);在阿洛糖6-磷酸异构酶(A6PI)的催化下,将P6P转化为阿洛糖6-磷酸(A6P);以及在阿洛糖6-磷酸磷酸酶(A6PP)的催化下,将A6P转化为阿洛糖。本发明还涉及通过本文描述的任何方法制备的阿洛糖。
在各个方面,所述方法包括在磷酸甘露糖异构酶(PMI)的催化下,将果糖6-磷酸(F6P)转化为甘露糖6-磷酸(M6P);以及在甘露糖6-磷酸磷酸酶(M6PP)的催化下,将M6P转化为甘露糖。本发明还涉及通过本文描述的任何方法制备的甘露糖。
在各个方面,所述方法包括在果糖6-磷酸4-差向异构酶(F6PE)的催化下,将果糖6-磷酸(F6P)转化为塔格糖6-磷酸(T6P);在塔罗糖6-磷酸异构酶(Tal6PI)的催化下,将T6P转化为塔罗糖6-磷酸(Tal6P);以及在塔罗糖6-磷酸磷酸酶(Tal6PP)的催化下,将Tal6P转化为塔罗糖。本发明还涉及通过本文描述的任何方法制备的塔格糖。
在各个方面,所述方法包括在肌醇合酶(IPS)的催化下,将葡萄糖6-磷酸(G6P)转化为肌醇3-磷酸(I3P);在肌醇单磷酸酶(IMP)的催化下,将I3P转化为肌醇。本发明还涉及通过本文描述的任何方法制备的肌醇。
在本发明的一些方面,制备低升糖的糖替代品的方法还包括将葡萄糖6-磷酸(G6P)转化为F6P的步骤,其中该步骤由磷酸葡萄糖异构酶(PGI)催化。在其他方面,低升糖的糖替代品合成的方法还包括将葡萄糖1-磷酸(G1P)转化为G6P的步骤,并且该转化步骤由磷酸葡萄糖变位酶(PGM)催化。
在各个方面,制备塔格糖富集物的方法可以包括:在至少一种酶的催化下,将糖类转化为G1P;在磷酸葡萄糖变位酶(PGM)的催化下,将G1P转化为G6P;在磷酸葡萄糖异构酶(PGI)的催化下,将G6P转化为F6P;在F6PE的催化下,将F6P转化为塔格糖6-磷酸(T6P);以及在T6PP的催化下,将产生的T6P转化为塔格糖。
在各个方面,制备阿洛酮糖富集物的方法可以包括:在至少一种酶的催化下,将糖类转化为G1P;在磷酸葡萄糖变位酶(PGM)的催化下,将G1P转化为G6P;在磷酸葡萄糖异构酶(PGI)的催化下,将G6P转化为F6P;在P6PE的催化下,将F6P转化为阿洛酮糖6-磷酸(P6P);以及在P6PP的催化下,将产生的P6P转化为阿洛酮糖。
在各个方面,制备阿洛糖富集物的方法可以包括:在至少一种酶的催化下,将糖类转化为G1P;在磷酸葡萄糖变位酶(PGM)的催化下,将G1P转化为G6P;在磷酸葡萄糖异构酶(PGI)的催化下,将G6P转化为F6P;在P6PE的催化下,将F6P转化为阿洛酮糖6-磷酸(P6P);在A6PI的催化下,将P6P转化为阿洛糖6-磷酸(A6P),以及在A6PP的催化下,将产生的A6P转化为阿洛糖。
在各个方面,制备甘露糖富集物的方法可以包括:在至少一种酶的催化下,将糖类转化为G1P;在磷酸葡萄糖变位酶(PGM)的催化下,将G1P转化为G6P;在磷酸葡萄糖异构酶(PGI)的催化下,将G6P转化为F6P;在PMI的催化下,将F6P转化为甘露糖6-磷酸(M6P);以及在M6PP的催化下,将产生的M6P转化为甘露糖。
在各个方面,制备肌醇富集物的方法可以包括:在至少一种酶的催化下,将糖类转化为G1P;在磷酸葡萄糖变位酶(PGM)的催化下,将G1P转化为G6P;在IPS的催化下,将G6P转化为肌醇3-磷酸(I3P);以及在IMP的催化下,将产生的I3P转化为肌醇。
本发明的方法通常但非必须用于在用作食品成分的糖类组合物中富集低升糖的糖。例如,本发明的方法可用于富集面粉、粗粉、磨碎的块茎、磨碎的豆类、磨碎的茎皮、淀粉、麦芽谷物或麦芽提取物或任何前述物质的衍生物中的低升糖的糖。
面粉,通常被定义为通过研磨原料谷物、根、豆类、坚果或种子制成的粉末。面粉或面粉衍生物可以含有一种或多种糖类,包括但不限于直链淀粉、支链淀粉、淀粉、可溶性淀粉、淀粉糊精和麦芽糊精。在本发明的一些方法中,富含低升糖的糖的面粉通过酶水解或淀粉的酸水解将面粉转化为面粉衍生物。例如,本发明的方法可以通过由异淀粉酶、支链淀粉酶、α-淀粉酶或两种或多种这些酶的组合催化的淀粉的酶水解来制备面粉衍生物。通过本发明的方法制备的面粉衍生物的实例包括但不限于直链淀粉、支链淀粉、可溶性淀粉、淀粉糊精或麦芽糊精。在本发明的另一种方法中,淀粉通过酶水解或淀粉的酸水解转化为淀粉衍生物。例如,本发明的方法可以通过由异淀粉酶、支链淀粉酶、α-淀粉酶或两种或多种这些酶的组合催化的淀粉的酶促水解来制备淀粉衍生物。一种从糖类组合物(包括例如面粉、淀粉或它们的衍生物)中制备低升糖的糖富集物的方法,还可以加入4-葡聚糖转移酶(4GT)。
附图说明
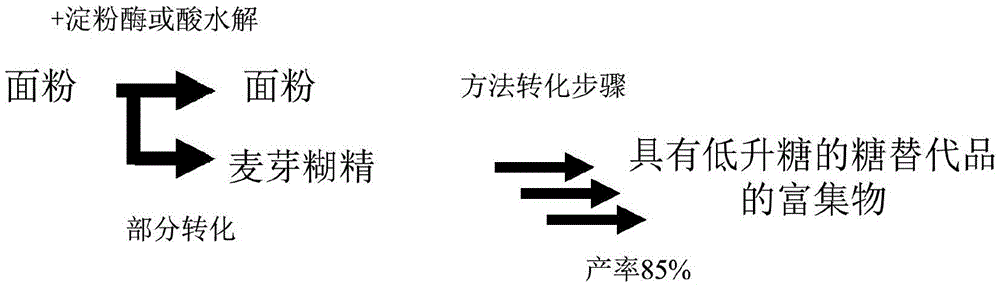
图1A是说明通过部分转化为麦芽糊精和将麦芽糊精酶促转化为低升糖的糖来富集具有低升糖的糖的面粉的示意图。
图1B是说明通过部分转化为麦芽糊精和将麦芽糊精酶促转化为低升糖的糖来富集具有低升糖的糖的淀粉组合物的示意图。
图1C是说明通过将麦芽糊精酶促转化为低升糖的糖来富集具有低升糖的糖的麦芽糊精组合物的示意图。
图1D是说明通过部分转化成纤维糊精和将纤维糊精酶促转化为低升糖的糖来富集具有低升糖的糖的纤维素组合物的示意图。
图1E是说明通过将纤维糊精酶促转化为低升糖的糖来富集具有低升糖的糖的纤维糊精组合物的示意图。
图1F是说明通过部分转化为果糖和将果糖酶促转化为低升糖的糖来富集具有低升糖的糖的蔗糖组合物的示意图。
图2是说明通过将淀粉部分转化为麦芽糊精,然后在不从淀粉组合物中提取麦芽糊精的情况下进行以下步骤:将麦芽糊精转化为葡萄糖1-磷酸(G1P);将G1P转化为葡萄糖6-磷酸(G6P);将G6P转化为果糖6-磷酸(F6P);将F6P转化为塔格糖6-磷酸(T6P);并将T6P转化为塔格糖,从而富集具有塔格糖的淀粉组合物的示意图。
图3是说明通过将淀粉部分转化为麦芽糊精,然后在不从淀粉组合物中提取麦芽糊精的情况下进行以下步骤:将淀粉糊精转化为葡萄糖1-磷酸(G1P);将G1P转化为葡萄糖6-磷酸(G6P);将G6P转化为果糖6-磷酸(F6P);将F6P转化为阿洛酮糖6-磷酸(P6P);并将P6P转化为阿洛酮糖(也称为阿洛酮糖),从而富集具有阿洛酮糖的淀粉组合物的示意图。
具体实施方式
以下描述根据涉及从含有至少一种糖类的糖类组合物生产富含低升糖的糖的糖类组合物的方法的实施方案公开了本发明。通常,本发明的类糖组合物是一种食品成分,其可用于在没有ATP的情况下生产葡萄糖1-磷酸,例如,面粉、粗粉、磨碎的块茎、磨碎的豆类、磨碎的茎皮、淀粉、麦芽谷物或麦芽提取物、麦芽糊精、纤维素、纤维糊精、它们的衍生物和蔗糖。在本发明的一些方法中,糖类组合物是面粉,其可以包含一种或多种以下物质:淀粉、麦芽糊精、蔗糖或纤维素。在本发明的一些方法中,糖类组合物是用作食品成分的面粉,包括例如燕麦粉、马铃薯粉、木薯粉、小麦粉、玉米粉。
本发明的方法可以包括但不一定需要以下步骤:(i)使用至少一种酶将至少一种糖类和任选的至少一种糖类衍生物的一部分转化为葡萄糖1-磷酸(G1P);(ii)使用磷酸葡萄糖变位酶(PGM)将G1P转化为葡萄糖6-磷酸(G6P);和(iii)使用磷酸葡萄糖异构酶(PGI)将G6P转化为果糖6-磷酸(F6P)。
本发明方法的其他步骤还包括特定低升糖的糖的富集,包括:
(a)其中所述富含低升糖的糖的糖类组合物富含低升糖的糖,塔格糖,
(1)使用果糖6-磷酸差向异构酶(F6PE)将果糖6-磷酸(F6P)转化为塔格糖6-磷酸(T6P),和
(2)在塔格糖6-磷酸磷酸酶(T6PP)的催化下,将产生的T6P转化为塔格糖;
(b)其中所述富含低升糖的糖的糖类组合物富含低升糖的糖,阿洛酮糖,
(1)使用阿洛酮糖6-磷酸差向异构酶(P6PE)将果糖6-磷酸(F6P)转化为阿洛酮糖6-磷酸(P6P),和
(2)使用阿洛酮糖6-磷酸磷酸酶(P6PP)将产生的P6P转化为阿洛酮糖;
(c)其中所述富含低升糖的糖的糖类组合物富含低升糖的糖,阿洛糖,
(1)使用阿洛酮糖6-磷酸3-差向异构酶(P6PE)将果糖6-磷酸(F6P)转化为阿洛酮糖6-磷酸(P6P),
(2)使用阿洛糖6-磷酸异构酶(A6PI)将P6P转化为阿洛糖6-磷酸(A6P),和
(3)在阿洛糖6-磷酸磷酸酶(A6PP)的催化下,将A6P转化为阿洛糖;
(d)其中所述富含低升糖的糖的糖类组合物富含低升糖的糖,甘露糖,
(1)使用磷酸甘露糖异构酶(PMI)或磷酸葡萄糖/磷酸甘露糖异构酶(PGPMI)将果糖6-磷酸(F6P)转化为甘露糖6-磷酸(M6P),和
(2)使用甘露糖6-磷酸磷酸酶(M6PP)将M6P转化为甘露糖6-磷酸(M6P);
(e)其中所述富含低升糖的糖的糖类组合物富含低升糖的糖,半乳糖,
(1)使用果糖6-磷酸差向异构酶(F6PE)将果糖6-磷酸(F6P)转化为塔格糖6-磷酸(T6P),
(2)使用半乳糖6-磷酸异构酶(Gal6PI)将T6P转化为半乳糖6-磷酸(Gal6P),和
(3)使用半乳糖6-磷酸磷酸酶(Gal6PP)将Gal6P转化为半乳糖;
(f)其中所述富含低升糖的糖的糖类组合物富含低升糖的糖,果糖,
(1)使用果糖6-磷酸磷酸酶(F6PP)将果糖6-磷酸(F6P)转化为果糖;
(g)其中所述富含低升糖的糖的糖类组合物富含低升糖的糖,阿卓糖(altrose),
(1)使用阿洛酮糖6-磷酸3-差向异构酶(P6PE)将果糖6-磷酸(F6P)转化为阿洛酮糖6-磷酸(P6P),
(2)使用阿卓糖6-磷酸异构酶(Alt6PI)将P6P转化为阿卓糖6-磷酸(Alt6P),和
(3)使用阿卓糖6-磷酸磷酸酶(Alt6PP)将产生的Alt6P转化为阿卓糖;
(h)其中所述富含低升糖的糖的糖类组合物富含低升糖的糖,塔罗糖,
(1)使用果糖6-磷酸4-差向异构酶(F6PE)将果糖6-磷酸(F6P)转化为塔格糖6-磷酸(T6P),
(2)使用塔罗糖6-磷酸异构酶(Tal6PI)将T6P转化为塔罗糖6-磷酸(Tal6P),和
(3)使用塔罗糖6-磷酸磷酸酶(Tal6PP)将Tal6P转化为塔罗糖;
(i)其中所述富含低升糖的糖的糖类组合物富含低升糖的糖,山梨糖,
(1)使用果糖6-磷酸4-差向异构酶(F6PE)将果糖6-磷酸(F6P)转化为塔格糖6-磷酸(T6P),
(2)使用山梨糖6-磷酸差向异构酶(S6PE)将T6P转化为山梨糖6-磷酸(S6P),和
(3)使用山梨糖6-磷酸磷酸酶(S6PP)将S6P转化为山梨糖;
(j)其中所述富含低升糖的糖的糖类组合物富含低升糖的糖,古洛糖,
(1)使用果糖6-磷酸4-差向异构酶(F6PE)将果糖6-磷酸(F6P)转化为塔格糖6-磷酸(T6P),
(2)使用山梨糖6-磷酸差向异构酶(S6PE)将T6P转化为山梨糖6-磷酸(S6P),
(3)使用古洛糖6-磷酸异构酶(Gul6PI)将S6P转化为古洛糖6-磷酸(Gul6P),和
(4)使用古洛糖6-磷酸磷酸酶(Gul6PP)将Gul6P转化为古洛糖;
(k)其中所述富含低升糖的糖的糖类组合物富含低升糖的糖,艾杜糖,
(1)使用果糖6-磷酸4-差向异构酶(F6PE)将果糖6-磷酸(F6P)转化为塔格糖6-磷酸(T6P),
(2)使用山梨糖6-磷酸差向异构酶(S6PE)将T6P转化为山梨糖6-磷酸(S6P),
(3)使用艾杜糖6-磷酸异构酶(I6PI)将S6P转化为艾杜糖6-磷酸(I6P),和
(4)使用艾杜糖6-磷酸磷酸酶(I6PP)将I6P转化为艾杜糖。
在本发明的另一种方法中,在肌醇合酶(IPS)的催化下,将葡萄糖6-磷酸(G6P)转化为肌醇3-磷酸(I3P);以及在肌醇单磷酸酶(IMP)的催化下,将I3P转化为肌醇。本发明还涉及通过本文描述的任何方法制备的肌醇。
前述方法步骤的细节在一个或多个以下PCT公开文本中描述:WO 2017/059278(塔格糖)、WO 2018/112139(阿洛酮糖)、WO 2018/169957(己糖),其全部内容并入本文。
在本发明的某些方法中,至少一种糖类是淀粉,并且使用酸水解或酶水解将一部分淀粉转化成淀粉衍生物。酶水解可以使用但不限于异淀粉酶、支链淀粉酶、α-淀粉酶中的至少一种来进行。
在本发明的一些方法中,糖类衍生物是麦芽糊精、直链淀粉、支链淀粉、糊精、纤维糊精或纤维二糖。在本发明的其他方法中,在实施该方法之前,糖类组合物可以包含至少一种糖类以及至少一种糖类衍生物。换言之,原料可能已经含有一种或多种糖类和一种或多种糖类衍生物。
本发明的方法包括至少一个节约能量的化学反应。在本发明的一些方法中,该方法的步骤作为节约能量的化学反应的级联进行,从而允许该方法在单个反应容器,例如单个生物反应器中进行。本发明的这些方法也可以在不含NAD(H)的条件下进行。
本发明的方法步骤通常在约37℃至约160℃的温度范围内进行。因此,在本发明的一些方法中,该方法例如在约40℃、约45℃、约50℃、约55℃、约60℃、约65℃、约70℃、约75℃、约80℃、约85℃、约90℃、约95℃或约100℃的温度下进行。在本发明的一些方法中,反应温度在整个过程中是恒定的。
本发明的方法可以在一定范围的pH条件下进行,pH通常为2.5-9.0。例如,本发明的方法可以在2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6、6.2、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.0或9的pH条件下进行。
本发明方法的反应时间可以根据需要进行调整,以获得期望的产率和/或适应其他工艺目标。通常,本发明的方法进行约1小时至约48小时。因此,在本发明的一些方法中,该方法进行约16小时、约18小时、约20小时、约22小时、约24小时、约26小时、约28小时、约30小时、约32小时、约34小时、约36小时、约38小时、约40小时、约42小时、约44小时、约46小时或约48小时。
当多个或所有方法步骤在单个生物反应器或反应容器中进行时,通过方法中间体的去磷酸化产生的磷酸根离子(P
在本发明的方法中,其中加入磷酸根离子,磷酸根离子的浓度通常为约0.1mM至约150mM。例如,磷酸根离子的浓度为约0.1mM、约0.5mM、约1mM、约1.5mM、约2mM、约2.5mM、约5mM、约6mM、约7mM、约8mM、约9mM、约10mM、约15mM、约20mM、约25mM、约30mM、约35mM、约40mM、约45mM、约50mM、约55mM、约60mM、约65mM、约70mM、约75mM、约80mM、约85mM、约90mM、约95mM、约100mM、约110mM、约120mM、约130mM、约140mM或约150mM。
本发明用于在糖类组合物中富集低升糖的糖的方法可以转化糖类组合物中约0.1%至约100%的糖类。例如,本发明的方法可以将面粉(例如,燕麦粉、马铃薯粉、木薯粉、小麦粉、玉米粉、大豆粉、米粉、豌豆粉、香蕉粉或车前草粉)、粗粉、磨碎的块茎、磨碎的豆类、磨碎的茎皮、淀粉、麦芽谷物或麦芽提取物、纤维素和/或蔗糖中的0.1%、0.5%、1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%的糖类转化为糖类衍生物,例如麦芽糊精、纤维二糖、纤维糊精和/或它们的衍生物。随后,在本发明的相同或不同的方法中,该方法进一步将约0.1%至约95%的糖类衍生物转化为低升糖的糖。例如,在本发明的方法中,由糖类组合物中的糖类转化而产生的约0.1%、0.5%、1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的麦芽糊精被转化为塔格糖、阿洛酮糖、甘露糖、塔罗糖、肌醇和/或阿洛糖。
实施例
以下实施例举例说明了要求保护的发明的方法。
实施例中使用的材料和方法
化学品
重组酶的生产和纯化
使用三种方法纯化各种重组蛋白。His标记蛋白通过Profinity IMAC镍交换树脂(Bio-Rad,Hercules,CA,USA)纯化。包含纤维素结合模块(CBM)和自切割内含肽的融合蛋白通过在大表面积再生无定形纤维素上的高亲和力吸附进行纯化。在70-95℃下加热沉淀5-30分钟用于纯化热稳定酶。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)检测重组蛋白的纯度。
使用的酶及其活性测定
使用来自Caldibacillus debilis(Uniprot A0A150LLZ1)的磷酸葡萄糖变位酶(PGM)。在50℃下,在含有5mM MgCl
使用来自嗜热栖热菌(Thermus thermophilus)(Uniprot ID Q5SLL6)的磷酸葡萄糖异构酶(PGI)。在50℃下,在含有5mM MgCl
Cheng et al.,Doubling power output of starch biobattery treated bythe most thermostable isoamylase from an archaeon Sulfolobustokodaii.Scientific Reports 2015;5:13184描述了来自头寇岱硫化叶菌(Sulfolobustokodaii)的重组异淀粉酶。其活性如所述进行分析。
Jeon et al.4-α-Glucanotransferase from the Hyperthermophilic ArchaeonThermococcus Litoralis.Eur.J.Biochem.1997;248:171-178描述了来自极端耐热细菌(Thermococcus litoralis)的重组4-α-葡聚糖转移酶(4GT)。其活性如所述进行测量。使用来自嗜热厌氧菌株DSM 14523(Uniprot E8MXP8)的4GT,并如Jeon等人所述进行分析。
使用来自解木聚糖热厌氧杆菌(Thermoanaerobacterium xylanolyticum)(菌株ATCC 49914/DSM 7097/LX-11)的蔗糖磷酸化酶。在含有10mM蔗糖和12mM有机磷酸盐的50mMHEPES缓冲液(pH 7.5)中测量其活性。使用补充有25U/mL磷酸葡萄糖变位酶和α-葡聚糖磷酸化酶的葡萄糖己糖激酶/G6PDH测定试剂盒测量葡萄糖1-磷酸(G1P)。
使用来自Thermanaerothrix daxensis(Uniprot A0A0P6XN50)的果糖6-磷酸差向异构酶(F6PE)。在50℃下,在含有5mM MgCl
使用来自嗜热球形杆菌(Sphaerobacter thermophilus)菌株DSM 20745(UniprotID D1C7G9)的塔格糖6-磷酸磷酸酶(T6PP)。在50℃下,在含有5mM MgCl
使用来自热解糖高温厌氧杆菌(Thermoanaerobacteriumthermosaccharolyticum)(Uniprot A0A223HZI7)的阿洛酮糖6-磷酸差向异构酶(P6PE)。在50℃下,在含有5mM MgCl
使用来自嗜热甲烷八叠球菌(Methanosarcina thermophila)CHTI-55(UniprotID A0A0E3NCH4)的阿洛酮糖6-磷酸磷酸酶(P6PP)。在50℃下,在含有5mM MgCl
使用来自嗜中温螺旋杆菌(Heliobacterium modesticaldum)(Uniprot B0TI 66)的阿洛糖6-磷酸异构酶(A6PI)。在50℃下,在含有5mM MgCl
使用来自海栖热袍菌(Thermotoga maritima)(Uniprot ID Q9X0Y1)的阿洛糖6-磷酸磷酸酶(A6PP)。在50℃下,在含有5mM MgCl
使用来自深海耐热丝杆菌(Caldithrix abyssi)DSM 13497(Uniprot H1XQS6)的磷酸甘露糖异构酶(PMI)。在50℃下,在含有5mM MgCl
使用来自Thermobifida cellulosilytica TB100(Uniprot ID A0A147KII8)的甘露糖6-磷酸磷酸酶(M6PP)。在50℃下,在含有5mM MgCl
使用塔罗糖6-磷酸异构酶(Tal6PI)。在50℃下,在含有5mM MgCl
使用塔罗糖6-磷酸磷酸酶(T6PP)。在50℃下,在含有5mM MgCl
使用来自闪烁古生球菌(Archaeoglobus fulgidus)(Uniprot O28480)的肌醇-3-磷酸合酶(Chen et al.Inositol-3-phosphate synthase from Archaeoglobus fulgidusis a Class II Aldolase.Biochemistry 2000;39:12415-12423)。如文献中所述测量其活性。
使用来自海栖热袍菌(Thermotoga maritima)(Uniprot O33832)的肌醇单磷酸酶(Stec etal.MJ0109 is an enzyme that is both an inositol monophosphatase andthe'missing'archaeal fructose-1,6-bisphosphatase.Nat.Struct.Biol.7:1046-1050(2000))。如文献中所述测量其活性。
可以根据需要增加或减少以下每个实施例中使用的酶单位来调节反应时间。例如,如果想要在2小时而不是8小时内进行富集,酶的单位理论上可以增加约4倍。相反,如果富集过程在24小时而不是8小时内进行,酶单位理论上可以减少约3倍。
类似地,在下面的每个实施例中,酶单位或反应时间可以根据所需的富集程度进行调整。例如,如果在用5U总酶的24小时反应中观察到85%的富集,可以将反应时间减少到8.5小时或将酶含量减少到1.75U以实现30%的富集。
实施例1:为了验证麦芽糊精中塔格糖的富集,将含有20g/L麦芽糊精、50mM磷酸盐缓冲盐水(pH 7.2)、5mM MgCl
实施例2:为了验证麦芽糊精中塔格糖的增强的富集,将含有200g/L麦芽糊精、10mM乙酸缓冲液(pH 5.5)、5mM MgCl
实施例3:为了进一步升高麦芽糊精中塔格糖的富集,将0.05U 4-葡聚糖转移酶(4GT)加入实施例2所述的反应中。将含有20g/L异淀粉酶处理的麦芽糊精(参见实施例2)、50mM磷酸盐缓冲盐水(pH 7.2)、5mM MgCl
实施例4:为了富集蔗糖中的塔格糖,将含有10g/L蔗糖、50mM磷酸盐缓冲盐水(pH7.2)、5mM MgCl
实施例5:为了验证马铃薯粉中塔格糖的富集,将含有200g/L马铃薯粉、0.02g/LCaCl
实施例6:为了验证木薯粉中塔格糖的富集,将含有200g/L木薯粉、0.02g/L CaCl
实施例7:为了验证马铃薯淀粉中塔格糖的富集,将含有200g/L马铃薯淀粉、0.02g/LCaCl
实施例8:为了验证木薯淀粉中塔格糖的富集,将含有200g/L木薯淀粉、0.02g/LCaCl
实施例9:为了验证豌豆淀粉中塔格糖的富集,将含有200g/L豌豆淀粉、0.02g/LCaCl
实施例10:为了验证玉米淀粉中塔格糖的富集,将含有200g/L豌豆淀粉、0.02g/LCaCl
实施例11:为了验证麦芽糊精中阿洛酮糖的富集,将含有20g/L异淀粉酶处理的麦芽糊精(参见实施例2)、50mM磷酸盐缓冲盐水(pH 7.2)、5mM MgCl
实施例12:为了富集蔗糖中的阿洛酮糖,将含有10g/L蔗糖、50mM磷酸盐缓冲盐水(pH7.2)、5mM MgCl
实施例13:为了验证马铃薯粉中阿洛酮糖的富集,将含有200g/L马铃薯粉、0.02g/L CaCl
实施例14:为了验证木薯粉中阿洛酮糖的富集,将含有200g/L木薯粉、0.02g/LCaCl
实施例15:为了验证马铃薯淀粉中阿洛酮糖的富集,将含有200g/L马铃薯淀粉、0.02g/LCaCl
实施例16:为了验证木薯淀粉中阿洛酮糖的富集,将含有200g/L木薯淀粉、0.02g/L CaCl
实施例17:为了验证豌豆淀粉中阿洛酮糖的富集,将含有200g/L豌豆淀粉、0.02g/L CaCl
实施例18:为了验证玉米淀粉中阿洛酮糖的富集,将含有200g/L豌豆淀粉、0.02g/L CaCl
实施例19:为了验证麦芽糊精中阿洛糖的富集,将含有20g/L异淀粉酶处理的麦芽糊精(参见实施例2)、50mM磷酸盐缓冲盐水(pH 7.2)、5mM MgCl
实施例20:为了富集蔗糖中的阿洛糖,将含有10g/L蔗糖、50mM磷酸盐缓冲盐水(pH7.2)、5mM MgCl
实施例21:为了验证马铃薯粉中阿洛糖的富集,将含有200g/L马铃薯粉、0.02g/LCaCl
实施例22:为了验证木薯粉中阿洛糖的富集,将含有200g/L木薯粉、0.02g/LCaCl
实施例23:为了验证马铃薯淀粉中阿洛糖的富集,将含有200g/L马铃薯淀粉、0.02g/LCaCl
实施例24:为了验证木薯淀粉中阿洛糖的富集,将含有200g/L木薯淀粉、0.02g/LCaCl
实施例25:为了验证豌豆淀粉中阿洛糖的富集,将含有200g/L豌豆淀粉、0.02g/LCaCl
实施例26:为了验证玉米淀粉中阿洛糖的富集,将含有200g/L豌豆淀粉、0.02g/LCaCl
实施例27:为了验证麦芽糊精中甘露糖的富集,将含有20g/L异淀粉酶处理的麦芽糊精(参见实施例2)、50mM磷酸盐缓冲盐水(pH 7.2)、5mM MgCl
实施例28:为了富集蔗糖中的甘露糖,将含有10g/L蔗糖、50mM磷酸盐缓冲盐水(pH7.2)、5mM MgCl
实施例29:为了验证马铃薯粉中甘露糖的富集,将含有200g/L马铃薯粉、0.02g/LCaCl
实施例30:为了验证木薯粉中甘露糖的富集,将含有200g/L木薯粉、0.02g/LCaCl
实施例31:为了验证马铃薯淀粉中甘露糖的富集,将含有200g/L马铃薯淀粉、0.02g/LCaCl
实施例32:为了验证木薯淀粉中甘露糖的富集,将含有200g/L木薯淀粉、0.02g/LCaCl
实施例33:为了验证豌豆淀粉中甘露糖的富集,将含有200g/L豌豆淀粉、0.02g/LCaCl
实施例34:为了验证玉米淀粉中甘露糖的富集,将含有200g/L豌豆淀粉、0.02g/LCaCl
实施例35:为了验证麦芽糊精中塔罗糖的富集,将含有20g/L异淀粉酶处理的麦芽糊精(参见实施例2)、50mM磷酸盐缓冲盐水(pH 7.2)、5mM MgCl
实施例36:为了富集蔗糖中的塔罗糖,将含有10g/L蔗糖、50mM磷酸盐缓冲盐水(pH7.2)、5mM MgCl
实施例37:为了验证马铃薯粉中塔罗糖的富集,将含有200g/L马铃薯粉、0.02g/LCaCl
实施例38:为了验证木薯粉中塔罗糖的富集,将含有200g/L木薯粉、0.02g/LCaCl
实施例39:为了验证马铃薯淀粉中塔罗糖的富集,将含有200g/L马铃薯淀粉、0.02g/LCaCl
实施例40:为了验证木薯淀粉中塔罗糖的富集,将含有200g/L木薯淀粉、0.02g/LCaCl
实施例41:为了验证豌豆淀粉中塔罗糖的富集,将含有200g/L豌豆淀粉、0.02g/LCaCl
实施例42:为了验证玉米淀粉中塔罗糖的富集,将含有200g/L豌豆淀粉、0.02g/LCaCl
实施例43:用于从麦芽糊精富集肌醇的酶是来自海栖热袍菌(T.maritima)(KEGGCDS,TM0769)的α-葡聚糖磷酸化酶、来自Thermococcus kodakaraensis(KEGG CDS,TK1108)的磷酸葡萄糖变位酶、来自闪烁古生球菌(KEGG CDS,AF1794)的肌醇3-磷酸酶和来自海栖热袍菌(KEGG CDS,TM1415)的肌醇单磷酸酶。在含有100mM HEPES缓冲液(pH 7.2)、10g/L麦芽糊精、10mM磷酸盐、5mM MgCl
实施例44:麦芽糊精含有许多阻碍αGP作用的分支。如实施例2中使用异淀粉酶,产生线性淀粉糊精。与使用未经异淀粉酶预处理的麦芽糊精的3.6g/L肌醇相比,经异淀粉酶预处理的淀粉在最终产品中获得6.0g/L的更高的肌醇富集。
实施例45:为了进一步提高脱支链麦芽糊精的肌醇富集,使用了4-α-葡聚糖转移酶,其可以将两个短的麦芽糊精(例如,麦芽糖和麦芽三糖)重排为更长的麦芽糊精和葡萄糖。向实施例44中添加0.05U/mL 4-α-葡聚糖转移酶进一步将肌醇富集升高至7.0g/L。
实施例46:为了测试增强麦芽糊精的肌醇富集的另一种方法,首先使用支链淀粉酶在37℃下使麦芽糊精脱支链10小时;然后加入1U/mLαGP、1U/mL PGM、2U/mL IPS和2U/mLIMP。在60℃下反应40小时后,肌醇的最终浓度为7.3g/L。
实施例47:为了富集蔗糖中的肌醇,将含有10g/L蔗糖、50mM磷酸盐缓冲盐水(pH7.2)、5mM MgCl
实施例45:为了验证马铃薯粉中肌醇的富集,将含有200g/L马铃薯粉、0.02g/LCaCl
实施例46:为了验证木薯粉中肌醇的富集,将含有200g/L木薯粉、0.02g/L CaCl
实施例47:为了验证马铃薯淀粉中肌醇的富集,将含有200g/L马铃薯淀粉、0.02g/L CaCl
实施例48:为了验证木薯淀粉中肌醇的富集,将含有200g/L木薯淀粉、0.02g/LCaCl
实施例49:为了验证豌豆淀粉中肌醇的富集,将含有200g/L豌豆淀粉、0.02g/LCaCl
实施例50:为了验证玉米淀粉中肌醇的富集,将含有200g/L豌豆淀粉、0.02g/LCaCl
实施例51:F6P及其前体G6P是富含纤维素的低升糖的糖原料。为了测试由Avicel(市售纤维素)生产F6P,使用Sigma纤维素酶在50℃水解纤维素。为了从市售纤维素酶中去除β-葡萄糖苷酶,将10滤纸单位/mL纤维素酶与10g/L的
实施例52:为了增加Avicel的F6P产量,用浓磷酸预处理Avicel以产生无定形纤维素(RAC),如在Zhang et al.Atransition from cellulose swelling to cellulosedissolution by o-phosphoric acid:evidence from enzymatic hydrolysis andsupramolecular structure.Biomacromolecules 2006;7:644-648中所描述。为了从市售纤维素酶中去除β-葡萄糖苷酶,将10滤纸单位/mL的纤维素酶与10g/L的RAC在冰水浴中混合5分钟。在4℃离心后,将含有β-葡萄糖苷酶的上清液倾析。将与含有内切葡聚糖酶和纤维二糖水解酶的纤维素酶结合的RAC重新悬浮在柠檬酸盐缓冲液(pH 4.8)中,在50℃水解12小时。在含有10mM磷酸盐、5mM MgCl
实施例53:为了进一步增加RAC的F6P产量,添加了多聚磷酸葡萄糖激酶和多聚磷酸。为了从市售纤维素酶中去除β-葡萄糖苷酶,将10滤纸单位/mL的纤维素酶与10g/L的RAC在冰水浴中混合5分钟。在4℃离心后,将含有β-葡萄糖苷酶的上清液倾析。将与含有内切葡聚糖酶和纤维二糖水解酶的纤维素酶结合的RAC重新悬浮在柠檬酸盐缓冲液(pH 4.8)中以在50℃下水解,在柠檬酸盐缓冲液(pH 4.8)中孵育以在50℃下水解12小时。在含有50mM多磷酸盐、10mM磷酸盐、5mM MgCl
实施例54:为了验证由F6P生产塔格糖(并因此验证从纤维素富集的可行性),在含有5mM MgCl
实施例55:为了验证由F6P生产阿洛酮糖(并因此验证从纤维素富集的可行性),在含有5mM MgCl
实施例56:为了验证由F6P生产阿洛糖(并因此验证从纤维素富集的可行性),在含有5mM MgCl
实施例57:为了验证由F6P生产甘露糖(并因此验证从纤维素富集的可行性),在含有5mM MgCl
实施例58:为了验证由F6P生产塔罗糖(并因此验证从纤维素富集的可行性),在含有5mM MgCl
实施例59:为了验证由G6P生产肌醇(F6P前体;并因此验证从纤维素富集的可行性),在含有5mM MgCl
实施例60:将含有10g/L麦芽糊精、50mM磷酸盐缓冲盐水(pH 7.2)、5mM MgCl
实施例61:为了验证燕麦粉中塔格糖的富集,将含有200g/L燕麦粉、0.02g/LCaCl
实施例62:为了验证大麦芽提取物中塔格糖的增强富集,将含有205.1g/L脱支链的麦芽提取物(参见实施例2)、25mM磷酸盐缓冲盐水(pH 7.2)、5mM MgCl
实施例63:为了验证燕麦粉中阿洛酮糖的富集,将含有200g/L燕麦粉、0.02g/LCaCl
实施例64:为了验证大麦芽提取物中阿洛酮糖的增强富集,将含有205.1g/L脱支链的麦芽提取物(参见实施例2)、25mM磷酸盐缓冲盐水(pH 7.2)、5mM MgCl
实施例65:为了进一步提高大麦芽提取物中阿洛酮糖的富集,将0.125U 4-葡聚糖转移酶(4GT)加入实施例64所述的反应物中。如实施例11中所述,检测和定量阿洛酮糖富集,由这种原料生产得到51.4g/L阿洛酮糖。
- DNA-孔隙-聚合酶复合物的酶促富集
- 甘油酯形式的n-3脂肪酸的酶促富集
