一株高效生产赤藓糖醇的重组解脂耶氏酵母菌的构建
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及一种重组解脂耶氏酵母菌及其在生产赤藓糖醇中的应用,属于生物工程技术领域。
背景技术
赤藓糖醇(1,2,3,4-丁四醇)是一种具有甜味和低热量的功能性糖醇,一般由微生物发酵生产。以前的研究主要集中在利用耐渗酵母菌株生产赤藓糖醇。例如,利用NTG处理和紫外突变来提高菌株Aureobasidium sp.SN-124A的赤藓糖醇生产率,获得了最大赤藓糖醇滴度为170g/L(具体可见参考文献:Ishizuka,H.,Wako,K.,Kasumi,T.,Sasaki,T.,1989.Breeding of a mutant of Aureobasidium sp.with high erythritolproduction.J.Ferment.Bioeng.68(5),310-314.)。对于菌株Moniliella sp.,各种策略已被成功地应用于促进赤藓糖醇的生产,最高可达152g/L(具体可见参考文献:Lin,S.J.,Wen,C.Y.,Wang,P.M.,Huang,J.C.,Wei,C.L.,Chang,J.W.,Chu,W.S.,2010.High-levelproduction of erythritol by mutants of osmophilic Moniliellasp.Process.Biochem.45(6),973-979.)。然而,尽管这些工艺中的一些已经发展到工业规模,但上述菌株在工业化应用中仍存在发酵培养基的高成本,以及副产物多使下游加工变得复杂的困扰。
Yarrowia lipolytica是一种非常规的酵母,其对高盐、极端pH和各种有机化合物有很强的耐受性,这简化了生物过程的优化。此外,Y.lipolytica有清晰的遗传背景和成熟的遗传操作工具,可以进行合理的工程设计。出于这些原因,已经进行了一系列的工作来提高Y.lipolytica的赤藓糖醇生产力,这些研究大多基于URA blast和Cre/lox位点特异性重组系统对Y.lipolytica进行靶向、重复和无标记的基因整合。然而,上述方法有一些缺点,如效率低、耗时长等,这严重阻碍了对提升Y.lipolytica生产赤藓糖醇的进一步研究。
发明内容
针对现有技术中的不足,目的在于提高现有技术当中的赤藓糖醇的生产菌株的滴度及产量,本发明提供了一种高产赤藓糖醇的重组解脂耶氏酵母菌的构建方法及其应用。
本发明提供的第一个技术方案为一种重组解脂耶氏酵母菌,以解脂耶氏酵母菌为出发菌,敲除Ku70基因和EYD基因,并过表达了磷酸戊糖途径关键靶基因,所述磷酸戊糖途径关键靶基因包括来源于解脂耶氏酵母菌的基因转酮酶基因TKL、转醛酶基因TAL、6-磷酸葡萄糖脱氢酶基因ZWF、6-磷酸葡萄糖酸酯脱氢酶基因GND、核酮糖-5-磷酸-3-差向异构酶基因RPE、核糖5-磷酸异构酶基因RPI、赤藓糖还原酶基因ER10、赤藓糖还原酶基因ER27、果糖1,6-二磷酸酶基因FBP、磷酸丙糖异构酶基因TPI和来源于木兰念珠菌的赤藓糖还原酶基因ALR中的一个或多个。
在某些实施方式中,所述磷酸戊糖途径关键靶基因包括来源于解脂耶氏酵母菌的TKL基因和TAL基因。
进一步,所述TKL基因和TAL基因的拷贝数为1~3。
在某些实施方式中,所述磷酸戊糖途径关键靶基因包括来源于解脂耶氏酵母菌的TKL基因、TAL基因、RPE基因和RPI基因。
进一步,所述RPE基因和RPI基因的拷贝数为1~2。
在某些实施方式中,所述磷酸戊糖途径关键靶基因包括来源于解脂耶氏酵母菌的TKL基因、TAL基因、RPE基因和RPI基因、FBP基因和TPI基因。
进一步,所述FBP基因的拷贝数为1~2,所述TPI基因的拷贝数为1~3。
在某些实施方式中,所述磷酸戊糖途径关键靶基因包括来源于解脂耶氏酵母菌的TKL基因、TAL基因、RPE基因和RPI基因、FBP基因和TPI基因、ZWF基因和GND基因。
进一步,所述ZWF基因和GND基因的拷贝数为1~4。
在某些实施方式中,所述磷酸戊糖途径关键靶基因包括来源于解脂耶氏酵母菌的TKL基因、TAL基因、RPE基因和RPI基因、FBP基因和TPI基因、ZWF基因和GND基因,同时所述磷酸戊糖途径关键靶基因还包括解脂耶氏酵母菌的ER10基因和ER27基因以及来源于木兰念珠菌的ALR基因。
在某些实施方式中,所述磷酸戊糖途径关键靶基因由启动子8UAS1B
在某些实施方式中,所述重组解脂耶氏酵母同时还敲除了蛋白激酶基因CLA4和转录因子MHY1。
在某些实施方式中,所述重组解脂耶氏酵母以pCRISPRyl质粒和pHR质粒为表达载体。
所述pCRISPRyl质粒表达载体购自Addgene。
所述pHR质粒在pUC19质粒基础上构建获得,具体的构建方法参照“Schwartz,C.,Shabbir-Hussain,M.,Frogue,K.,Blenner,M.,Wheeldon,I.,2017b.Standardizedmarkerless gene integration for pathway engineering in Yarrowialipolytica.ACS.Synth.Biol.6(3),402-409.”也可购自Addgene。
在某些实施方式中,所述重组解脂耶氏酵母菌是以Yarrowia lipolytica PO1f为出发菌株。
本发明第一个技术方案中重组解脂耶氏酵母菌,首先,通过敲除菌株Yarrowialipolytica PO1f的Ku70和EYD基因来提高同源重组的效率和调控赤藓糖醇降解途径,得到基础菌株E002。其次,11个关键靶基因和一个强启动子8UAS1B
本发明提供的第二技术方案为构建第一技术方案中所述的重组解脂耶氏酵母的方法,所述方法包括以下步骤:
(1)以pCRISPRyl质粒和pHR质粒敲除出发菌株解脂耶氏酵母菌基因组上的Ku70基因;
(2)以pCRISPRyl质粒和pHR质粒敲除步骤(1)改造后的解脂耶氏酵母菌基因组上的EDY基因;
(3)以pCRISPRyl质粒和pHR质粒在步骤(2)改造后的解脂耶氏酵母菌中过表达磷酸戊糖途径关键靶基因,所述磷酸戊糖途径关键靶基因包括来源于解脂耶氏酵母菌的TKL基因、TAL基因、ZWF基因、GND基因、RPE基因、RPI基因、ER10基因、ER27基因、FBP基因、TPI基因和ALR基因中的一个或多个;
(4)以pCRISPRyl质粒和pHR质粒敲除步骤(3)改造后的解脂耶氏酵母菌基因组上的CLA4和MHY1基因。
对于基因的敲除,将质粒pHR(携带靶标基因的上下游各1kb同源臂和URA3筛选标记)和CRISPR-Cas9表达质粒pCRISPRyl(携带相应的sgRNA和LEU2筛选标记)共转化到Y.lipolytica菌株中,定位并敲除靶标基因;
对于基因过表达,和基因敲除原理相似,将质粒pHR(携带靶标基因上下游两个各1kb同源臂和相应的过表达的基因)和CRISPR-Cas9表达质粒pCRISPRyl(携带相应的sgRNA和LEU2筛选标记)共转化到Y.lipolytica菌株中,定位并过表达相应的基因。
本发明还提供的第三个技术方案为一种生产赤藓糖醇的方法,所述方法为,采用第一个技术方案中所述的重组解脂耶氏酵母菌为发酵菌株,生产赤藓糖醇。
在某些实施方式中,将所述重组解脂耶氏酵母菌种子液添加至含有以葡萄糖为唯一碳源的反应体系中进行发酵,制备得到发酵液,从发酵液中分离得到赤藓糖醇。
进一步,将所述重组解脂耶氏酵母菌接种至种子培养基中进行培养,得到一级种子液;将一级种子液按照10%的接种量转接至种子培养基中,进行培养,得到二级种子液;将制备得到的二级种子液按照20%的接种量接种至以葡萄糖为唯一碳源的发酵培养基中进行发酵,制备得到赤藓糖醇。
所述发酵培养基为:葡萄糖200g/L,酵母提取物8.0g/L,柠檬酸铵5.0g/L,KH
所述种子培养基为:葡萄糖100g/L,酵母提取物10g/L,蛋白胨20g/L,pH自然。
在某些实施方式中,将重组解脂耶氏酵母接种至种子培养基中,培养条件为:30℃、220rpm,pH自然,培养时间14h。
在某些实施方式中,所述方法为采用5L发酵罐发酵制备赤藓糖醇,所述方法为:将重组解脂耶氏酵母接种至种子培养基中进行培养,得到一级种子液;将一级种子液按照10%(v/v)的接种量转接至种子培养基中,进行培养,得到二级种子液,将制备得到的二级种子液按照20%(v/v)的接种量接种至以葡萄糖为唯一碳源的发酵培养基中进行发酵,制备得到赤藓糖醇。
在某些实施方式中,将种子液接种至发酵培养基中,所述发酵条件为:30℃、800rpm,溶氧20~30%,pH 3.0,培养时间144h。
在某些实施方式中,发酵培养基为:葡萄糖200g/L,酵母提取物8.0g/L,柠檬酸铵5.0g/L,KH
在某些实施方式中,种子培养基为:葡萄糖100g/L,酵母提取物10g/L,蛋白胨20g/L,pH自然。
在某些实施方式中,5L发酵罐发酵过程中搅拌速度设置为800rpm,温度设置为30℃,溶氧控制在20~30%,利用3M NaOH将pH控制在3.0,发酵时长为144h。
本发明还提供的第四个技术方案为第一个技术方案所述的重组解脂耶氏酵母或者第三个技术方案所述的方法在制备含有赤藓糖醇的产品中的应用。
有益效果
(1)本发明以葡萄糖作为赤藓糖醇生产的底物,提供了一株可高效生产赤藓糖醇的重组解脂耶氏酵母,将此重组解脂耶氏酵母接种至5L发酵罐中发酵144h,赤藓糖醇的滴度高达249.4g/L,转化率高达57%,这是到目前为止报道的通过系统代谢改造Y.lipolytica菌株从葡萄糖中获得的最高赤藓糖醇滴度。本发明为高水平赤藓糖醇的工业化生产提供了一株优秀的菌株,并为其他功能性糖的进一步开发提供了一个可行的策略。
(2)本发明敲除了Ku70基因将同源重组的效率提高至86%,敲除了EYD基因,调控赤藓糖醇降解途径,避免赤藓糖醇的降解,最终赤藓糖醇滴度、产量和产率分别提高27.5%、32.5%和29.1%。
(3)本发明中挖掘并验证了11个(ZWF,GND,RPE,RPI,TKL,TAL,ER10,ER27,FBP,TPI,和ALR)有助于赤藓糖醇生物合成的靶标基因,通过利用8UAS1B
(4)本发明通过敲除CLA4基因和MHY1基因,有效抑制菌丝的形成,从而提高赤藓糖醇的产量。
(5)本发明以Yarrowia lipolytica PO1f为出发菌株,具有遗传背景清晰,易于基因工程操作,安全性好,来源广泛的优势。
(6)本发明使用CRISPR/Cas系统对解脂耶氏酵母进行改造,解决了传统技术的效率低、耗时长等问题,取得了在提高赤藓糖醇产量的同时节省了筛选标记的回收时间,实现高赤藓糖醇菌株的快速构建效果。
附图说明
图1是菌株Y.lipolytica PO1f和E001的同源重组效率;
图2是Y.lipolytica PO1f、E001和E002菌株在赤藓糖醇发酵培养基中的生长曲线、残留葡萄糖、赤藓糖醇滴度、产量和产率。
图3是菌株E002、E101-E103在摇瓶发酵中的OD
图4是菌株E102、E104-E105在摇瓶发酵中的OD
图5是菌株E104、E106-E110在摇瓶发酵中的OD
图6是菌株E109、E111-E115在摇瓶发酵中的OD
图7是菌株E112、E116-E118、E123在摇瓶发酵中的OD
图8是菌株E112、E119-E122在摇瓶发酵中的OD
图9是工程菌株的显微镜图像;
图10是菌株E123和E124在摇瓶发酵中的OD
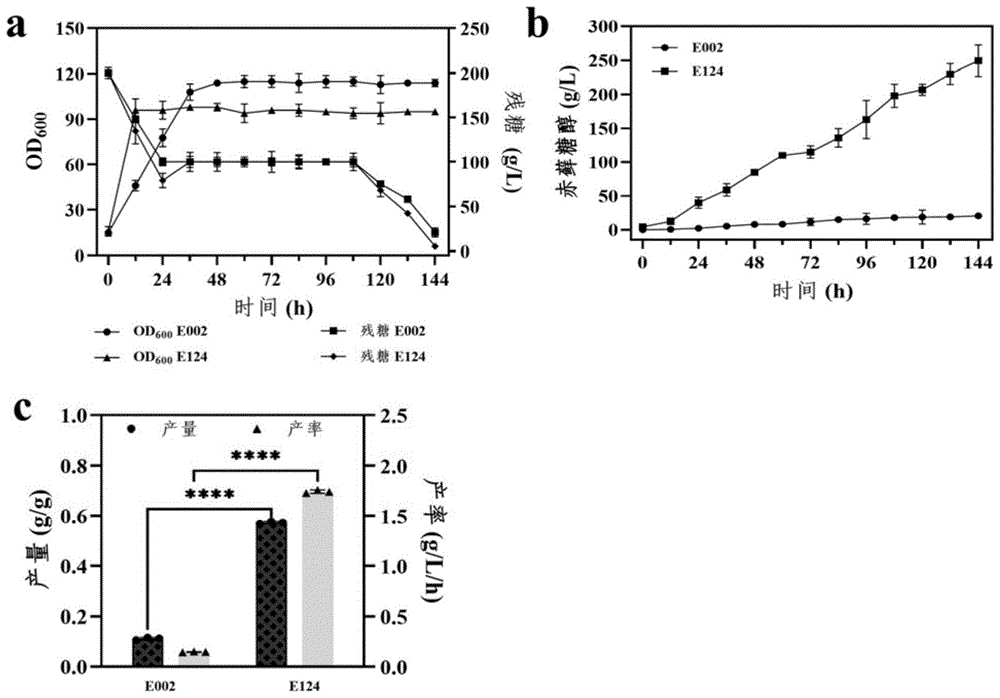
图11是E002和E124菌株在5L生物反应器中的分批补料发酵结果。
具体实施方式
本发明以较佳实施例公开了一种重组解脂耶氏酵母及其在赤藓糖醇生产中的应用。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明已经通过较佳实施例进行了描述,相关人员明显能够在不脱离本发明内容、精神和范围内对本文所述的方法进行改动或适当变更与组合,来实现和应用本发明技术。
为了进一步理解本发明,下面结合具体实施例对本发明进行详细阐述,如无特殊说明,本发明实施例中所涉及的试剂均为市售产品,均可以通过商业渠道购买获得。
下述实施例中所涉及的“Yarrowia lipolytica PO1f”由法国教授CatherineMadzak赠送,同时也可从BioVector NTCC质粒载体菌株细胞蛋白抗体基因保藏中心,NTCC典型培养物保藏中心购买。
下述实施例中所涉及的培养基如下:
1、YPD液体培养基(g/L):酵母提取物10,葡萄糖20,蛋白胨20;
2、YPD固体培养基(g/L):酵母提取物10,葡萄糖20,蛋白胨20,琼脂粉20。
下述实施例中所涉及的检测方法如下:
1、采用紫外分光光度计测定细胞密度OD
2、赤藓糖醇的含量的检测:
采用高效液相色谱法(安捷伦1200系列;安捷伦科技)检测。
样品体积为10μl,氨基柱为Platisil NH
3、转化率的计算公式如下:
式中:η:转化率;C
下述实施例中所涉及的基因、质粒、菌株和引物信息如下:
1、基因信息如表1所示
表1基因
2、质粒信息如表2所示
表2质粒
3、菌株信息如表3所示
表3菌株
4、引物信息如表4所示
表4引物
/>
/>
实施例1:基础菌株E002的构建
(1)构建敲除质粒pCRISPRyl_Ku70/pCRISPRyl_EYD和同源质粒pHR_Ku70/pHR_EYD
从NCBI网站公布的Y.lipolytica CLIB122基因组上的Ku70基因序列(NCBIGenebank登录号2910012)和EYD基因序列(NCBI Genebank登录号2908154),确定Ku70基因和EYD基因的序列位置并确定缺失片段分别为1758bp和942bp。分别选取Ku70基因和EYD基因前后各约1000bp大小的基因片段作为上下游同源臂,以引物Ku70-UP-F/R、Ku70-DOWN-F/R、EYD-UP-F/R和EYD-DOWN-F/R从Y.lipolytica PO1f基因组中扩增出Ku70基因和EYD基因的上下游同源臂片段,来构建同源质粒pHR_Ku70和pHR_EYD。PCR程序为:95℃,10min;95℃,30s;58℃,30s;72℃,1min;72℃,10min,循环30次。对于敲除质粒,分别设计了两个引物对(Ku70-sg和EYD-sg)来构建质粒pCRISPRyl_Ku70和pCRISPRyl_EYD,所涉及的引物序列见表4。
将上述所得的pCRISPRyl_Ku70、pCRISPRyl_EYD、pHR_Ku70和pHR_EYD质粒分别转化到E.coli JM109感受态细胞,得到转化子。
挑取转化子菌落PCR验证条带大小正确后,提质粒,送金唯智公司测序正确,则敲除质粒pCRISPRyl_Ku70和pCRISPRyl_EYD与同源质粒pHR_Ku70和pHR_EYD构建成功。
(2)解脂耶氏酵母感受态细胞的制备
从-80℃甘油管中用接种环挑取Y.lipolytica PO1f,在YPD固体培养基上三区划线,置于30℃培养箱培养48h;挑取平板活化的单菌落,接种到装有10mL YPD液体培养基的50mL小瓶中,30℃,220rpm培养20h;将菌体在超净台中收集到50mL离心管中,4℃,6000rpm离心5min,弃上清液;用20mL无菌水重悬菌体并洗涤,4℃,6000rpm离心5min,弃上清,重复洗涤两次;用1mL 0.1mol/L醋酸锂(pH6.0)重悬菌体,室温培养10min。将感受态细胞等分100μL到无菌的2mL离心管里用于转化,制备得到Y.lipolytica PO1f感受态细胞。
(3)Y.lipolytica PO1fΔKu70的制备
将10μL pCRISPRyl_Ku70质粒、pHR_Ku70质粒、10μL鲑鱼精DNA(10mg/mL)加入到Y.lipolytica PO1f感受态细胞中,吹吸混匀后30℃培养15min;将600μL 50% PEG4000加入上述混合物,混匀后于30℃、220rpm培养1h;
将装有上述混合液的离心管放入39℃水浴锅中水浴1h;添加1ml YPD培养基,30℃、220rpm活化培养2h;9000rpm离心1min,去上清并用1ml无菌水悬浮菌体;9000rpm离心1min,收集菌体,将菌体涂布于SC筛选固体培养基上,于30℃恒温培养箱中培养3-4d;从平板上挑取单菌落,以Ku70-UP-F/Ku70-DOWN-R为引物通过Taq DNA聚合酶对单菌落进行菌落PCR验证;将含有目的条带的阳性单菌落接种于YPD液体培养基中,30℃,220rpm培养24h后,提取基因组利用Ku70-UP-F/Ku70-DOWN-R为引物送金唯智公司测序再次进行验证,即得到Y.lipolytica PO1f中Ku70基因成功敲除的菌株Y.lipolytica PO1f-ΔKu70,命名为E001。筛选标记URA3通过培养在补充有1mg/ml 5-FOA的YPD培养基中被去除。筛选标记LEU2是通过在无筛选压力的YPD培养基中连续传代被去除。
(4)Y.lipolytica PO1fΔKu70ΔEYD的制备
在菌株E001的基础上,继续敲除EYD基因,得到基础菌株E002。类似于Ku70基因的敲除,将10μL pCRISPRyl_EYD质粒、pHR_EYD质粒、10μL鲑鱼精DNA(10mg/mL)加入到Y.lipolytica PO1fΔKu70感受态细胞中,吹吸混匀后30℃培养15min;将600μL 50%PEG4000加入上述混合物,混匀后于30℃、220rpm培养1h;
将装有上述混合液的离心管放入39℃水浴锅中水浴1h;添加1ml YPD培养基,30℃、220rpm活化培养2h;9000rpm离心1min,去上清并用1ml无菌水悬浮菌体;9000rpm离心1min,收集菌体,将菌体涂布于SC筛选固体培养基上,于30℃恒温培养箱中培养3-4d;从平板上挑取单菌落,以EYD-UP-F/EYD-DOWN-R为引物通过Taq DNA聚合酶对单菌落进行菌落PCR验证;将含有目的条带的阳性单菌落接种于YPD液体培养基中,30℃,220rpm培养24h后,提取基因组利用EYD-UP-F/EYD-DOWN-R为引物送金唯智公司测序再次进行验证,即得到成功敲除EYD基因的菌株Y.lipolytica PO1f-ΔKu70ΔEYD,并命名为E002,被用作后续遗传操作的出发菌株。
如图1-2所示,相比于出发菌株Y.lipolytica PO1f,E001的同源重组效率由初始的8%提高到86%,这说明,Ku70基因的敲除是提高解脂耶氏酵母同源重组效率的有效策略;E002不但有效阻断了赤藓糖醇的降解,最终赤藓糖醇滴度、产量和产率分别提高27.5%、32.5%和29.1%。
实施例2:高产赤藓糖醇的重组解脂耶氏酵母的构建
具体步骤如下:
(1)过表达质粒的构建
以过表达质粒pCRISPRyl_A08和pHR_A08_P
根据NCBI中Genbank(YALI0A08382g)上公布的A08序列,分别选取A08基因前后各约1000bp大小的基因片段作为上下游同源臂,以引物A08-UP-F/R和A08-DOWN-F/R从Y.lipolytica PO1f基因组中扩增出A08基因的上下游同源臂片段。利用引物A08-UP-F/A08-DOWN-R将A08 UP、A08 DOWN和双基因过表达片段P
对于质粒pCRISPRyl_A08的构建,将A08-sg与线性化的pCRISPRyl质粒通过同源重组酶ClonExpress IIOne Step Cloning Kit(诺唯赞)连接,获得质粒pCRISPRyl_A08,所涉及的引物序列见表4。
按照上述方法同样可得到其他相关过表达质粒,所涉及的具体质粒与引物序列分别见表2和表4。
(2)过表达质粒的转化
制备相应的工程菌株的感受态细胞,分别将10μL pCRISPRyl_A08和pHR_A08_P
需要特别说明的是,工程菌株E101-E118、E123中启动子为P
如图3-8所示,采用系统代谢工程方法,包括增加前体E4P的合成,改善辅因子NADPH的供应以及增强关键途径酶的表达,构建了具有高赤藓糖醇滴度的解脂耶氏酵母工程菌。与菌株E002相比,工程菌株E123的赤藓糖醇滴度、产量和产率分别提高了12.5倍、4.8倍和12.5倍。
实施例3:工程菌株的形态改变
(1)构建敲除质粒pCRISPRyl_CLA4/pCRISPRyl_MHY1和同源质粒pHR_CLA4/pHR_MHY1
从NCBI网站公布的Y.lipolytica CLIB122基因组上的CLA4基因序列(NCBIGenebank登录号2909555)和MHY1基因序列(NCBI Genebank登录号2907618),确定CLA4基因和MHY1基因的序列位置并确定缺失片段分别为2766bp和858bp。分别选取CLA4基因和MHY1基因前后各约1000bp大小的基因片段作为上下游同源臂,以引物CLA4-UP-F/R、CLA4-DOWN-F/R、MHY1-UP-F/R和MHY1-DOWN-F/R从Y.lipolytica PO1f基因组中扩增出CLA4基因和MHY1基因的上下游同源臂片段,来构建同源质粒pHR_CLA4和pHR_MHY1。PCR程序为:95℃,10min;95℃,30s;58℃,30s;72℃,1min;72℃,10min,循环30次。对于敲除质粒,分别设计了两个引物对(CLA4-sg和MHY1-sg)来构建质粒pCRISPRyl_CLA4和pCRISPRyl_MHY1,所涉及的引物序列见表4。
将上述所得的pCRISPRyl_CLA4、pCRISPRyl_MHY1、pHR_CLA4和pHR_MHY1质粒分别转化到E.coli JM109感受态细胞,得到转化子。
挑取转化子菌落PCR验证条带大小正确后,提质粒,送金唯智公司测序正确,则敲除质粒pCRISPRyl_CLA4和pCRISPRyl_MHY1与同源质粒pHR_CLA4和pHR_MHY1构建成功。
(2)菌株E123ΔCLA4的制备
将10μL pCRISPRyl_CLA4质粒、pHR_CLA4质粒、10μL鲑鱼精DNA(10mg/mL)加入到菌株E123感受态细胞中,吹吸混匀后30℃培养15min;将600μL 50% PEG4000加入上述混合物,混匀后于30℃、220rpm培养1h;
将装有上述混合液的离心管放入39℃水浴锅中水浴1h;添加1ml YPD培养基,30℃、220rpm活化培养2h;9000rpm离心1min,去上清并用1ml无菌水悬浮菌体;9000rpm离心1min,收集菌体,将菌体涂布于SC筛选固体培养基上,于30℃恒温培养箱中培养3-4d;从平板上挑取单菌落,以CLA4-UP-F/CLA4-DOWN-R为引物通过Taq DNA聚合酶对单菌落进行菌落PCR验证;将含有目的条带的阳性单菌落接种于YPD液体培养基中,30℃,220rpm培养24h后,提取基因组利用CLA4-UP-F/CLA4-DOWN-R为引物送金唯智公司测序再次进行验证,即得到菌株E123中CLA4基因成功敲除的菌株E123-ΔCLA4。筛选标记URA3通过培养在补充有1mg/ml 5-FOA的YPD培养基中被去除。筛选标记LEU2是通过在无筛选压力的YPD培养基中连续传代被去除。
(3)菌株E123ΔCLA4ΔMHY1的制备
在菌株E123ΔCLA4的基础上,我们继续敲除MHY1基因,得到菌株E123ΔCLA4ΔMHY1,命名为E124。类似于CLA4基因的敲除,将10μL pCRISPRyl_MHY1质粒、pHR_MHY1质粒、10μL鲑鱼精DNA(10mg/mL)加入到菌株E123ΔCLA4感受态细胞中,吹吸混匀后30℃培养15min;将600μL 50% PEG4000加入上述混合物,混匀后于30℃、220rpm培养1h;
将装有上述混合液的离心管放入39℃水浴锅中水浴1h;添加1ml YPD培养基,30℃、220rpm活化培养2h;9000rpm离心1min,去上清并用1ml无菌水悬浮菌体;9000rpm离心1min,收集菌体,将菌体涂布于SC筛选固体培养基上,于30℃恒温培养箱中培养3-4d;从平板上挑取单菌落,以MHY1-UP-F/MHY1-DOWN-R为引物通过Taq DNA聚合酶对单菌落进行菌落PCR验证;将含有目的条带的阳性单菌落接种于YPD液体培养基中,30℃,220rpm培养24h后,提取基因组利用以MHY1-UP-F/MHY1-DOWN-R为引物送金唯智公司测序再次进行验证,即得到成功敲除MHY1基因的菌株E123ΔCLA4ΔMHY1,并命名为E124。
如图9、10所示,菌株E124的菌丝被成功去除,只观察到酵母形态。令人惊喜的是,菌株E124的赤藓糖醇滴度进一步提高到96.1g/L,相比菌株E123提高了9.7%。上述结果表明,删除CLA4和MHY1基因可以有效抑制菌丝的形成,从而提高赤藓糖醇的滴度。
实施例4:赤藓糖醇基因工程菌发酵生产赤藓糖醇
1、摇瓶发酵制备赤藓糖醇
发酵过程:
(1)从-80℃甘油管中用接种环挑取实施例1、实施例2和实施例3制备得到的重组解脂耶氏酵母E002、E101-E123和E124,分别在YPD固体培养基上三区划线,置于30℃培养箱培养48h进行活化;
(2)配制培养基
1)种子培养基的配制:葡萄糖100g/L,酵母提取物10g/L,蛋白胨20g/L,pH自然。
2)发酵培养基的配制:葡萄糖200g/L,酵母提取物8.0g/L,柠檬酸铵5.0g/L,KH
(3)挑取活化后的单菌落,分别接种到种子培养基中,在30℃,220rpm培养20h后,制备得到种子液;
(4)分别将种子液按20%(v/v)的接种量转接到含有50mL发酵培养基的500mL挡板摇瓶中开始发酵,温度为30℃,转速为220rpm,发酵时间为144h。
按照上述方法,分别将重组解脂耶氏酵母E002和E101-E124进行摇瓶发酵制备赤藓糖醇,结果如表5所示。
表5不同工程菌株的赤藓糖醇滴度及产量
结果显示,重组菌株E124相比于基础菌株E002具有合成赤藓糖醇能力更强的优势,最终在摇瓶发酵中赤藓糖醇的滴度达到了96.1g/L,相比菌株E002,赤藓糖醇的滴度增加了9.15倍。
2、5L发酵罐发酵制备赤藓糖醇
(1)从-80℃甘油管中用接种环挑取重组解脂耶氏酵母,分别在YPD平板培养基上三区划线,置于30℃培养箱培养48h;
(2)配制培养基
1)种子培养基的配制:葡萄糖100g/L,酵母提取物10g/L,蛋白胨20g/L,pH自然。
2)发酵培养基的配制:葡萄糖200g/L,酵母提取物8.0g/L,柠檬酸铵5.0g/L,KH
(3)挑取平板活化的单菌落,分别接种到种子培养基中,30℃,220rpm培养20h后,制备得到一级种子液;
将一级种子液按10%(v/v)的接种量转接到含有200mL上述种子培养基的1L挡板摇瓶中,30℃,220rpm培养14h,得到二级种子液;
(4)分别将二级种子液按体积比20%(v/v)的接种量全部转移至5L发酵罐中,发酵罐中含1.6L发酵培养基,进行发酵培养;发酵参数控制:搅拌速度为800rpm,温度为30℃,溶氧为20%~30%,pH为3.0,发酵时间为144h;
分别将重组解脂耶氏酵母E002和E124进行5L发酵罐发酵制备得到含有赤藓糖醇的发酵液,检测发酵液中的赤藓糖醇的含量,结果如图11及表6所示。
表6不同工程菌株的赤藓糖醇滴度及产量
结果显示,最终得到的重组菌株E124以葡萄糖为碳源发酵获得了249.4g/L的赤藓糖醇,相对于基础菌株E002提高了12.2倍,产量提高至0.57g/g,这是目前报道的重组解脂耶氏酵母最高生产水平,因此本发明的重组菌株能够利用葡萄糖来高效生产赤藓糖醇,可应用于工业化生产。
上述仅本发明较佳可行实施例,并非是对本发明的限制,本发明也并不限于上述举例,本技术领域的技术人员,在本发明的实质范围内,所做出的变化、改型、添加或替换,也应属于本发明的保护范围。
- 合成赤藓糖醇的重组解脂耶氏酵母菌的构建方法及其菌株
- 合成赤藓糖醇的重组解脂耶氏酵母菌的构建方法及其菌株
