一种二聚体融合蛋白及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于生物医药技术领域,具体涉及一种二聚体融合蛋白及其应用。
背景技术
单克隆抗体(mAb)已经广泛用于治疗多种人类疾病,包括癌症、自身免疫疾病、感染性疾病以及心血管疾病等。目前,存在超过30种单克隆抗体,包括鼠类、全人源化和嵌合抗体,它们已经被FDA批准用于治疗用途。这些抗体大多数是单特异性抗体,其识别单一表位并且可被选择以便通过此单一表位激活或抑制靶分子的活性。
CEACAM属于免疫球蛋白超家族黏附分子,其结构域高度糖基化,通常包括1-2个免疫球蛋白可变区样结构域(Ndomain)和0-6个免疫球蛋白恒定区样结构域。CEACAM涉及多种细胞功能,以细胞间的黏附功能为基础,通过信号转导调节细胞生长和分化,并在胰岛素稳态、血管生成及免疫调节中发挥重要作用。在人中,CEACAM亚群由7个成员组成:CEACAM1、CEACAM3、CEACAM4、CEACAM5、CEACAM6、CEACAM7、CEACAM8。CEACAM基因家族成员参与各种各样的病理生理作用,包括作为微生物病原体的受体,它们在致癌、癌症检测、进展和转移中起重要作用。
CEACAM5(简称为CEA,又称为CD66e)是具有约180kDa分子量的糖蛋白,编码CEA蛋白。CEACAM5含有经由糖基磷脂酰肌醇(GPI)锚与细胞膜连接的7个结构域,7个结构域包括单一N端Ig可变域和与Ig恒定域同源的6个结构域(A1-B1-A2-B2-A3-B3)。CEACAM5在1965首次被描述为胃肠癌胚抗原,但截至目前,研究表明CEACAM5在结肠直肠、胃、肺、乳腺、前列腺、卵巢、子宫颈和膀胱肿瘤细胞的表面上具有高表达,并在少数正常上皮组织(结肠中的柱状上皮和杯状细胞、胃中的黏液颈细胞和食道和子宫颈中的鳞状上皮细胞)中具有弱表达。例如,在前列腺癌和结直肠癌中,CEACAM5的过度表达被证明可以作为肿瘤生物标志物。
CEACAM6(也称为CD66c或NCA-90)是与糖基磷酸肌醇(GPI)相连的细胞表面蛋白,具有一个N-结构域和2个C2样结构域,通过其具有各种膜受体(已鉴定其中的一些)的胞外结构域介导许多顺式或反式引导的CEACAM相互作用。CEACAM6在来自各种器官的粒细胞和上皮细胞上表达,并且与正常粘膜、癌症相比,CEACAM6在增生性结肠息肉和腺瘤的增殖细胞中具有更广泛的表达区,在患有肺癌、胰腺癌、乳腺癌、结肠直肠癌和肝细胞癌的患者中发现CEACAM6的相对高血清水平。CEACAM6的过表达导致形态改变,类似于上皮-间充质转化,使得侵袭性增强,化学抗药性增强。先前的研究表明,使用CEACAM6特异性siRNA通过CEACAM6沉默可实现肿瘤生长抑制,使用抗体片段抑制CEACAM6功能可在体外影响细胞迁移,细胞侵袭和细胞粘附。这些研究结果表明,CEACAM6是各种肿瘤的良好生物标志物。
此外,在多种恶性肿瘤,如乳房、胰腺、卵巢、结肠、肺和胃腺肿瘤中CEACAM5/CEACAM6亦被发现呈过度表达,并且与肿瘤的侵袭性和转移有关。
CEACAM家族成员的胞外结构域由重复免疫球蛋白样(Ig样)结构域构成,根据序列同源性,所述重复免疫球蛋白样(Ig样)结构域已分为3种类型:A、B和N。CEACAM5包含7个这样的结构域,即N、A1、B1、A2、B2、A3和B3。CEACAM5A1、A2和A3结构域与B1、B2和B3结构域展示高序列同源性,人CEACAM5的A结构域呈现84%至87%成对序列相似性,且B结构域呈现69%至80%成对序列相似性。此外,其结构中呈现A和/或B结构域的其他人CEACAM成员(即CEACAM1、CEACAM6、CEACAM7和CEACAM8)展示与人CEACAM5的同源性。具体而言,人CEACAM6蛋白的A和B结构域分别展示与人CEACAM5的A1和A3结构域和B1至B3结构域中任一种的序列同源性,该序列同源性甚至高于在人CEACAM5的A结构域和B结构域中所观察到的序列同源性。
IL-10主要由激活的T细胞和抗原提呈细胞分泌,抗原识别的过程中,CD8+T细胞中的IL-10受体(IL-10R)表达上调。IL-10由特异的细胞表面受体复合物介导多种活性,IL-10受体包含两个不同的链,IL-10R1和IL-10R2,两条链均属于II类细胞因子受体家族(CRF2)。在细菌感染和组织损伤中,IL10可以减少炎症反应,抑制T细胞(Th17)和巨噬细胞引起的炎症反应(IL-12/23),降低肿瘤相关炎症反应。在肿瘤微环境中,IL-10可以高效激活抗原特异性CD8+T细胞的增殖和毒性。
IL-10抗肿瘤的作用机制为:a.可以激活肿瘤内部CD8+T细胞的活性和扩增;b.IL10可以增加肿瘤内部抗原特异性T淋巴细胞的活性和扩增;c.IL-10对肿瘤的排斥作用具有记忆功能,动物体内试验数据表明,给予IL-10药物肿瘤消失后,再次给予小鼠接种肿瘤细胞,该肿瘤细胞不在小鼠体内生长,主要的原因为:IL-10能够增强抗原特异性CD8+T细胞的存活率,起到肿瘤疫苗的作用;d.IL10通过恢复终端耗竭T细胞的氧化磷酸化代谢来重新激活T细胞达到杀伤肿瘤细胞的目的。临床试验也证明,与PDL1抗体联合使用时,会增加肿瘤内部细胞PDL1特异性CD8+阳性细胞,产生持久的抗肿瘤效果。但目前暂未有以IL-10为靶点的上市药物。
IL-10可以促进针对特异性抗原的CD8+T细胞的扩增和存活期,而特异性抗原CD8+T细胞与免疫细胞对肿瘤的杀伤呈正相关性。虽然已有多项研究表明,免疫调节剂可用于在动物模型和癌症患者中施加抗肿瘤作用,然而,与免疫调节剂的应用相关的短半衰期和系统性毒性极大地限制了它们的使用。IL-10与受体结合以后,启动STAT3、STAT1通路,这两条通路是IL-10起生物功能的信号转导途径。
专利CN201380041222.1中提供了包含IL-10的融合蛋白,公开了特定靶点和序列的优势结构。然而,这种融合蛋白的表达量低,纯度不高,IL-10端的结合活性与信号激活能力弱,与癌细胞结合活性差,无法用于规模化工业生产。此外,该专利也没有公开其他靶点和序列的优势结构。
因此,有必要寻找既与IL-10具有良好结合活性,又与肿瘤组织与正常组织差异化结合(即,与肿瘤细胞高度结合,与正常细胞微弱结合或不结合),并且与周围健康组织交叉反应较小的抗CEACAM5和CEACAM6二聚体融合蛋白。
发明内容
本发明目的在于提供一种二聚体融合蛋白及其应用,该二聚体融合蛋白对CEACAM5和CEACAM6、IL10均有较高的亲和力,且具有良好的抗肿瘤活性。
本发明提供了一种二聚体融合蛋白,所述二聚体融合蛋白包含:轻链和重链,所述轻链和重链复合以形成表现出对肿瘤抗原或免疫检查点的结合特异性的靶向部分;一个或多个免疫调节剂,所述免疫调节剂融合至所述重链的C端以形成多肽链;所述轻链、重链与免疫调节剂形成所述二聚体融合蛋白。
在一个实施方案中,所述肿瘤抗原为CEACAM5和/或CEACAM6。
在一个实施方案中,所述重链含一个或多个相同或者不同类型的免疫调节剂。在一个实施方案中,所述免疫调节剂增强免疫应答。在一个实施方案中,所述免疫调节剂降低免疫应答。在一个实施方案中,所述免疫调节剂可以是天然的免疫调节剂,也可以经过突变形成。在一个实施方案中,所述免疫调节剂为细胞因子、细胞因子受体、生长因子、激素或细胞外基质分子。在一个实施方案中,所述免疫调节剂选自IL-1、IL-2、IL-2Rα、IL-2Rβ、IL-3、IL-3Rα、IL-4、IL-4Rα、IL-5、IL-5Rα、IL-6、IL-6Rα、IL-7、IL-7Rα、IL-8、IL-9、IL-9Rα、IL-10、IL-10R1、IL-10R2、IL-11、IL-11Rα、IL-12、IL-12Rα、IL-12Rβ2、IL-12Rβ1、IL-13、IL-13Rα、IL-13Rα2、IL-14、IL-15、IL-15Rαsushi、IL-16、IL-17、IL-18、IL-19、IL-20、IL-20R1、IL-20R2、IL-21、IL-21Rα、IL-22、IL-23、IL-23R、IL-27R、IL-31R中的一种或多种。在一个实施方案中,所述免疫调节剂为IL-10。在一个实施方案中,所述免疫调节剂是IL-10或其二元复合物(IL-10)
在一个实施方案中,天然的IL-10单体序列如SEQ ID NO:1所示。或为与SEQ IDNO:1有至少80%同一性的氨基酸序列。
在一个实施方案中,所述重链含有如SEQ ID NO:2所示的HCDR1、如SEQ ID NO:3所示的HCDR2、如SEQ ID NO:4所示的HCDR3的氨基酸序列或具有至少80%同一性的氨基酸序列;所述轻链含有如SEQ ID NO:5所示的LCDR1、如SEQ ID NO:6所示的LCDR2、如SEQ ID NO:7所示的LCDR3的氨基酸序列或具有至少80%同一性的氨基酸序列。
在一个实施方案中,所述重链的可变区的氨基酸序列如SEQ ID NO:8所示,或为与SEQ ID NO:8有至少80%同一性的氨基酸序列。在一个实施方案中,所述轻链的可变区的氨基酸序列如SEQ ID NO:9所示,或为与SEQ ID NO:9具有至少80%同一性的氨基酸序列。
在一个实施方案中,所述重链的氨基酸序列如SEQ ID NO:10,或为与SEQ ID NO:10有至少80%同一性的氨基酸序列。在一个实施方案中,所述轻链的氨基酸序列如SEQ IDNO:11所示,或为与SEQ ID NO:11具有至少80%同一性的氨基酸序列。
在一个实施方案中,所述免疫调节剂与所述特异性结合肿瘤抗原或免疫检查点的抗体的Fc区域连接。在一个实施方案中,所述免疫调节剂通过多肽接头连接至Fc区域。在一个实施方案中,所述多肽接头为5-30个氨基酸。在一个实施方案中,所述多肽接头为(GGGGS)n,其中n=1-6。在一个实施方案中,所述重链包含选自IgG1、IgG2、IgG3和IgG4的免疫球蛋白的恒定区。
本发明还提供了上述二聚体融合蛋白的制备方法,所述制备方法是将分别含上述轻链、重链、IL-10质粒转入同一宿主细胞中进行重组表达。
在一个实施方案中,所述轻链、重链、IL-10重组质粒的浓度比为1:0.5-2:0.5-2。在一个实施方案中,所述轻链、重链、IL-10的重组质粒的浓度比为1:1:1。
在一个实施方案中,所述宿主细胞为哺乳动物细胞、细菌、真菌或昆虫细胞。在一个实施方案中,所述哺乳动物细胞为CHO细胞、SP20细胞、NSO细胞、COS细胞、BHK细胞、HEK293细胞或PerC6细胞。在一个实施方案中,所述哺乳动物细胞为CHO细胞。
本发明提供了一种编码上述二聚体融合蛋白的核酸。本发明提供了一种含上述核酸的载体或质粒。本发明提供了一种表达上述载体或质粒的细胞。本发明还提供了一种药物组合物,所述药物组合物包含上述的二聚体融合蛋白以及至少一种药学上可接受的赋形剂、稀释剂或载体。在一个实施方案中,所述药物组合物可以单独使用或与其他治疗剂联用,来提高疗效或减少潜在的副作用。
本发明还提供了上述二聚体融合蛋白在制备防治肿瘤疾病的药物方面的应用。在一个实施方案中,所述肿瘤疾病包括大肠癌、膜腺癌、肺癌、食管癌、前列腺癌、促结缔组织增生性小圆细胞肿瘤、卵巢癌、胃癌、胰腺癌、肝癌、肾癌、乳腺癌、非小细胞肺癌、黑色素瘤、肺泡横纹肌肉瘤、胚胎性横纹肌肉瘤、尤因肉瘤、肾母细胞瘤、神经母细胞瘤、神经节细胞瘤、髓母细胞瘤、高级别胶质瘤、弥漫性内在脑桥胶质瘤、多层菊形团胚胎性肿瘤中的一种或多种。
本发明还提供了上述二聚体融合蛋白在制备检测肿瘤相关抗原CEACAM5、CEACAM6和IL-10受体分子的试剂或试剂盒方面的应用。
附图说明
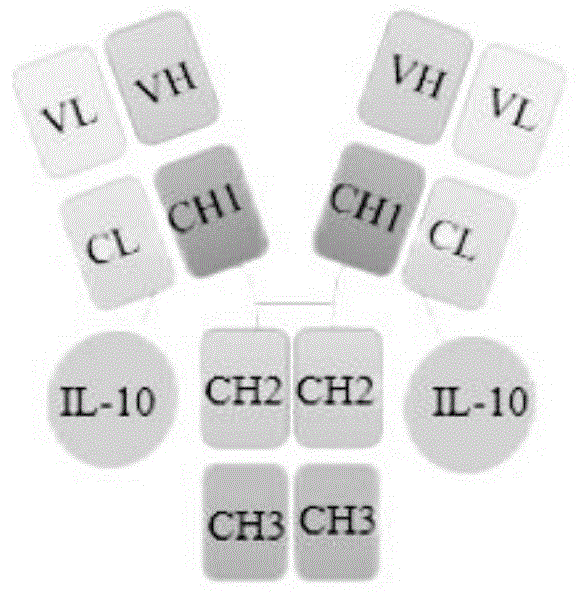
图1:二聚体融合蛋白(以下简称融合蛋白)1的结构示意图。
图2:融合蛋白2的结构示意图。
图3:ELISA检测融合蛋白对CEACAM5的结合活性。
图4:ELISA检测融合蛋白对IL-10受体蛋白的结合活性。
图5:融合蛋白与OVCAR3细胞结合活性的FACS检测结果。
图6:ELISA检测融合蛋白对IL-10受体的亲和力。
图7:融合蛋白1和2与LS174T细胞结合活性的FACS检测结果。
图8:融合蛋白对IL-10报告基因细胞的激活活性实验。
图9:阳性对照与融合蛋白1的激活IL-10报告基因细胞的活性。
图10:阳性对照与融合蛋白2的激活IL-10报告基因细胞的活性。
具体实施方式
下面结合实施例对本发明作进一步说明,实施例用于描述本发明的一些具体实施方案,而非用于限制本发明的保护范围。
除非另有定义,否则本文使用的所有技术和科学术语具有与本申请所属领域的普通技术人员通常理解的相同的含义。虽然与本文所述的方法和材料相似或等同的方法和材料可用于本申请的实践或测试,但下文描述了合适的方法和材料。在矛盾的情况下,以专利说明书为准。
术语“二聚体”通常是指由两个成员组成的分子(例如蛋白质分子)。二聚体的两个成员可在结构、功能、活性和/或组成方面不同。例如,两种不同的成员可以包含在形成这些多肽的氨基酸残基的顺序、数目或种类上不同的多肽。二聚体的两个不同成员中的每一个可以独立地包含一个、两个或更多个单元、多肽链或部分。
术语“靶向部分”通常是指与靶分子、细胞、颗粒、组织或聚集体特异性、选择性或优先结合的分子、复合物或聚集体。例如,靶向部分可以是抗体、抗原结合性抗体片段、双特异性抗体或其他基于抗体的分子或化合物。靶向部分的其他实例可以包括但不限于适体、高亲和性多聚体、受体结合性配体、核酸、生物素-亲和素结合对、结合肽或蛋白质等。
本领域中有多种方法/系统来定义和描述CDR,这些系统和/或定义已经开发和精制多年,包括Kabat、Chothia、IMGT、AbM和Contact。Kabat是最常用的,基于序列变异性定义CDR;Chothia基于结构循环区域的位置基于序列变异性定义CDR;IMGT系统基于可变域结构内的序列变异性和位置定义CDR;AbM是基于牛津分子公司的AbM抗体建模软件进行定义,是Kabat和Chothia之间的折衷;Contact基于对复杂晶体结构的分析定义CDR,在多个方面与Chothia类似。本发明中氨基酸位置的编号(例如Fc区的氨基酸残基)和目标区域(例如CDR),使用Kabat系统。
术语“肿瘤抗原”通常是指在肿瘤细胞中或由肿瘤细胞产生的抗原物质,其可具有在宿主中触发免疫应答的能力。例如,肿瘤抗原可以是构成肿瘤细胞的一部分并且能够诱导肿瘤特异性细胞毒性T淋巴细胞的蛋白质、多肽、肽或其片段。在一些实施方案中,术语“肿瘤抗原”还可指在癌细胞上唯一地或优先地或差异地表达和/或经发现与癌细胞相关从而提供对癌症是优先的或特异性的靶标的生物分子(例如蛋白质、碳水化合物、糖蛋白等)。例如,优先表达可以是相较于生物体中的任何其他细胞的优先表达,或者在生物体的特定区域内(例如在特定器官或组织内)的优先表达。
术语“免疫检查点”通常指免疫系统中存在的一些抑制型分子和激活型分子,可通过调控T细胞活性,调控机体的抗肿瘤免疫体系。例如,抑制型分子包括PDL1、B7H3、CTLA4等,激活型分子包括OX40、4-1BB、CD40等。
术语“免疫调节剂”通常指影响免疫系统功能的物质。免疫调节剂可以增强或减小免疫应答。例如,免疫调节剂可以是免疫疗法的活性剂,包括但不限于例如细胞因子、粒细胞集落刺激因子(G-CSF)、干扰素、咪喹莫特、来自细菌的细胞膜片段、趋化因子、白细胞介素、胞嘧啶磷酸-鸟苷(CpG)寡脱氧核苷酸和葡聚糖的重组、合成和/天然制剂。在一些实施方案中,所述免疫调节剂是细胞因子。
术语“多肽接头”通常是指连接或联接两个多肽序列(例如联接两个多肽结构域)的合成氨基酸序列。多肽接头可以通过肽键连接两个氨基酸序列。
术语“抗体”通常是指包含一个或多个基本上由免疫球蛋白基因或免疫球蛋白基因片段编码的多肽的蛋白质。免疫球蛋白基因可以包括κ、λ、α、γ、δ、ε和μ恒定区基因,以及无数的免疫球蛋白可变区基因。如本文所用,轻链可被分类为κ或λ。重链可被分类为γ、μ、α、δ或ε,其依次分别定义免疫球蛋白类别:IgG、IgM、IgA、IgD和IgE。本申请中使用的抗体可具有包含四聚体的结构单元。每个四聚体可由两对相同的多肽链组成,每对具有一条“轻”链(约25kD)和一条“重链”(约50-70kD)。每个成员的N末端可以界定约100至110个或更多个氨基酸的可变区,其主要负责抗原识别。如本文中所用,术语轻链可变区(VL)和重链可变区(VH)通常分别指轻链和重链的这些区域。抗体可作为完整免疫球蛋白存在或作为通过用各种肽酶消化或从头表达产生的许多充分表征的片段存在。术语“抗体”还可包括通过修饰整个抗体或使用重组DNA方法从头合成产生的抗体片段,包括但不限于Fab'2、IgG、IgM、IgA、IgE、scFv、dAb、纳米抗体、单抗体和双链抗体。在一些实施方案中,抗体包括但不限于Fab'2、IgG、IgM、IgA、IgE和单链抗体,例如单链Fv(scFv)抗体,其中可变重链和可变轻链(直接地或通过肽接头)连接在一起以形成连续的多肽。在一些实施方案中,本申请中的抗体和片段是双特异性的。在一些实施方案中,双特异性抗体或其片段对至少两个不同表位(例如,至少两个不同表位中的至少一个是肿瘤相关抗原)具有结合特异性。在一些实施方案中,抗体和片段也可以是异种抗体,例如它们可以是或可以包含两个或更多个连接在一起的抗体或抗体结合片段(例如Fab),其中每个抗体或片段具有不同的特异性。
术语“同一性”定义为比对序列并在必要时引入缺口以获取最大百分比序列同一性后,候选序列中与对照多肽序列中的氨基酸残基相同的氨基酸残基的百分率。为测定百分比氨基酸序列同一性目的的对比可以以本领域技术范围内的多种方式进行,例如使用公众可得到的计算机软件,诸如BLAST软件或FASTA程序包。
术语“至少80%同一性”是指候选序列中与对照多肽序列中的氨基酸残基相同的氨基酸残基的百分率为80%以上,包括80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%。
术语“宿主细胞”通常包括可以是或已经是受试者质粒或载体的接受者的单个细胞、细胞系或细胞培养物,其包含本申请公开的多核苷酸,或表达本申请的异源二聚体蛋白质。宿主细胞可以包括单个宿主细胞的后代。由于天然、偶然或有意的突变,后代可以不一定与原始亲本细胞完全相同(在形态上或在基因组总DNA互补体上)。宿主细胞可包括用本申请公开的载体在体外转染的细胞。宿主细胞可以是细菌细胞(例如大肠杆菌(E.coli))、酵母细胞或其它真核细胞,例如COS细胞、中国仓鼠卵巢(CHO)细胞、HeLa细胞或骨髓瘤细胞。
术语“载体”通常是指能够在合适的宿主中自我复制的核酸分子,其将插入的核酸分子转移至宿主细胞中和/或在宿主细胞之间转移。该术语可包括主要用于将DNA或RNA插入细胞的载体,主要用于DNA或RNA的复制的载体,以及用于DNA或RNA的转录和/或翻译的表达载体。还包括提供不止一种上述功能的载体。“表达载体”是当被引入合适的宿主细胞时可被转录并翻译成多肽的多核苷酸。
术语“治疗”或“医治”或“防治”或“缓解”或“改善”在本文中可互换使用,并且是指获得有益或所需的结果(包括但不限于治疗益处和/或预防益处)的方法。如本文中所用,治疗益处通常是指根除或减轻所治疗的潜在病症的严重性。此外,通过根除、减轻严重性或减少与潜在病症相关的一种或多种生理症状的发生率,以使得在受试者中观察到改善(尽管受试者仍然可能受到潜在病症折磨)来实现治疗益处。对于预防益处,可向处于发展特定疾病的风险中的受试者,或报告疾病的一种或多种生理症状的受试者施用组合物,即使可能尚未进行该疾病的诊断。
术语“试剂”通常是指生物部分、药物部分或化合物或其它部分。非限制性实例包括简单或复杂的有机或无机分子、肽、蛋白质、寡核苷酸、抗体、抗体衍生物、抗体片段、维生素衍生物、碳水化合物、毒素或化疗化合物。可以合成各种化合物,例如小分子和寡聚物(例如,寡肽和寡核苷酸)和基于各种核心结构的合成有机化合物。另外,各种天然来源可提供用于筛选的化合物,诸如植物或动物提取物等。
术语“抗癌剂”、“抗肿瘤剂”或“化学治疗剂”通常是指可用于治疗肿瘤病况的任何试剂。一类抗癌剂包括化疗剂。
术语“化疗”通常是指通过各种方法向癌症患者施用一种或多种化疗药物和/或其它试剂,所述方法包括静脉内、口服、肌内、腹膜内、膀胱内、皮下、经皮、口腔或吸入或以栓剂的形式。
术语“体内”通常是指在受试者体内发生的事件。
术语“体外”通常是指发生在受试者体外的事件。例如,体外测定包括在受试者外进行的任何测定。体外测定包括其中使用死细胞或活细胞的基于细胞的测定。体外测定还包括其中不使用完整细胞的无细胞测定。
术语“受试者”通常是指人或非人动物,包括但不限于猫、狗、马、猪、牛、绵羊、山羊、兔、小鼠、大鼠或猴。
本文中的人源化单克隆抗体、融合蛋白1和2、IL-10、CEACAM6(AB)蛋白以及实施例8中的阳性对照的氨基酸序列如表1所示。其中,融合蛋白1的结构如图1所示,融合蛋白2的结构如图2所示。融合蛋白1和融合蛋白2的重链和轻链氨基酸序列相同。区别在于,融合蛋白1中IL-10通过多肽接头连接在轻链的C端,融合蛋白2中IL-10通过多肽接头连接在重链的C端。
表1序列表
实施例1基因合成与表达载体的构建
构建抗体为可同时结合CEACAM5、CEACAM6的人源化单克隆抗体,该抗体与IL-10构建成融合蛋白,结构设计见图1-2,IL-10序列通过GGGGS连接子分别融合至构建抗体的轻链C端或重链C端。
采用PcDNA3.1载体作为表达抗体的轻链和重链的专用载体。PcDNA3.1载体含有重链所使用的启动子CMV Promoter、真核筛选标记G418标签和原核筛选标签Ampicilline。基因合成分别得到融合蛋白表达的重链、轻链编码基因的核苷酸序列(即目的基因),用HindIII和XhoI对载体和目的片段进行双酶切,回收后通过DNA连接酶进行酶连,并转化大肠杆菌感受态细胞DH5α,挑选出阳性克隆并进行质粒提取和酶切验证,获得含融合蛋白重链、轻链编码基因的重组质粒。
实施例2质粒抽提
根据《分子克隆实验指南》(2002年,科学出版社)所述方法,将含有上述各目的基因的重组质粒转化至大肠杆菌感受态细胞DH5α中,将转化细菌涂布在含100μg/mL氨苄青霉素的LB平板上培养,挑选质粒克隆至液体LB培养基中培养,260rpm摇菌14h,由无内毒素质粒大抽试剂盒抽提质粒,用无菌水溶解并用核酸蛋白定量仪进行浓度测定。
实施例3质粒转染、瞬转表达与融合蛋白纯化
在37℃、8%CO
ProteinA、离子柱纯化的具体操作步骤为:细胞培养液经过高速离心后取上清,利用GE的ProteinA层析柱进行亲和层析。层析使用平衡缓冲液为1×PBS(pH 7.4),细胞上清上样结合后利用PBS洗涤至紫外线回到基线,然后利用洗脱缓冲液0.1M甘氨酸(pH 3.0)洗脱目的蛋白,利用Tris调节pH至中性保存。将亲和层析所得产物调节pH至低于或者高于等电点pI 1-2个pH单位,适当稀释以控制样本电导在5ms/cm以下。利用合适的对应pH缓冲液如磷酸缓冲液、醋酸缓冲液等条件,利用本领域内常规的离子交换层析方法如阴离子交换或者阳离子交换进行对应pH条件下NaCl梯度洗脱,根据SDS-PAGE选择目的蛋白所在的收集管合并保存。然后,将纯化后所得的洗脱液超滤换液至缓冲液中。
实施例4ELISA检测融合蛋白对CEACAM5的亲和力
采用pH 7.4的PBS缓冲液将人CEACAM5-His(ACRO CE5-H5220,蛋白号为UniProtKB-P06731)稀释至0.5μg/mL,每孔100μL加入到96孔ELISA板中,4℃包被过夜。用1%BSA封闭液封闭1小时后。PBST洗板3次后,将纯化得到的融合蛋白1和2用0.5%BSA样品稀释液稀释至100nM,以此为起始浓度,进行3倍梯度稀释,共11个梯度,并设阴性对照(曲妥珠单抗),每孔100μL,37℃孵育1h。再用PBST洗板3次,将HRP标记的山羊抗人IgG Fc(Jackson Cat:109-035-098)用样品稀释液按1:10000稀释,每孔加入100μL,室温孵育1h。PBST洗板4次后,每孔加入100μL TMB底物,室温避光孵育10min,每孔加入100μL 1M HCl液终止显色反应。在多功能酶标仪上选择波长450nm,参比波长570nm测定96孔板中各孔的吸光值,每孔吸光值(OD)=OD450nm-OD570nm。将融合蛋白的浓度取对数后作为横坐标,测得的每孔吸光值为纵坐标,选用Sigmoidal dose-response(Variable Slope)方式(GraphPad Prism软件,Graph Pad Software,SanDiego,California)进行非线性回归,得到目标融合蛋白与人CEACAM5蛋白的结合曲线。
ELISA结果如图3所示,融合蛋白1和2在多浓度范围下均可与CEACAM5蛋白结合,阴性对照不能与该蛋白结合,表明IL-10融合至构建抗体轻链或重链C端的融合蛋白具有与人CEACAM5蛋白的特异性结合活性。
实施例5ELISA检测融合蛋白对CEACAM6的亲和力
采用pH 7.4的PBS缓冲液将人-CEACAM6-His(ACRO CE6-H5223,蛋白号为UniProtKB-P40199)稀释至0.5μg/mL,每孔100μL加入到96孔ELISA板中,4℃包被过夜。用1%BSA封闭液封闭1小时后。PBST洗板3次后,将纯化得到的融合蛋白用0.5%BSA样品稀释液稀释至100nM,以此为起始浓度,进行3倍梯度稀释,共11个梯度,并设阴性对照(曲妥珠单抗),每孔100μL,37℃孵育1h。再用PBST洗板3次,将HRP标记的山羊抗人IgG Fc(JacksonCat:109-035-098)用样品稀释液按1:10000稀释,每孔加入100μL,室温孵育1h。PBST洗板4次后,每孔加入100μL TMB底物,室温避光孵育10min,每孔加入100μL 1M HCl液终止显色反应。在多功能酶标仪上选择波长450nm,参比波长570nm测定96孔板中各孔的吸光值,每孔吸光值(OD)=OD450nm-OD570nm。将融合蛋白的浓度取对数后作为横坐标,测得的每孔吸光值为纵坐标,选用Sigmoidal dose-response(Variable Slope)方式(Graph Pad Prism软件,Graph Pad Software,SanDiego,California)进行非线性回归,得到目标融合蛋白与人CEACAM6蛋白的结合曲线。
ELISA结果如图4所示,融合蛋白1和2在多浓度范围下均可与人CEACAM6蛋白结合,阴性对照不能结合,表明IL-10序列融合至构建抗体轻链或重链C端的融合蛋白具有与人CEACAM6蛋白的特异性结合活性。
实施例6ELISA检测融合蛋白对CEACAM6(AB)的亲和力
采用pH 7.4的PBS缓冲液将人-CEACAM6(AB)-His(氨基酸序列为SEQ ID NO:14),在C端添加6个His标签,通过镍柱纯化得到)稀释至0.5μg/mL,每孔100μL加入到96孔ELISA板中,4℃包被过夜。用1%BSA封闭液封闭1小时后。PBST洗板3次后,将纯化得到的融合蛋白用0.5%BSA样品稀释液稀释至100nM,以此为起始浓度,进行3倍梯度稀释,共11个梯度,并设阴性对照(曲妥珠单抗),每孔100μL,37℃孵育1h。再用PBST洗板3次,将HRP标记的山羊抗人IgG Fc(Jackson Cat:109-035-098)用样品稀释液按1:10000稀释,每孔加入100μL,室温孵育1h。PBST洗板4次后,每孔加入100μL TMB底物,室温避光孵育10min,每孔加入100μL 1MHCl液终止显色反应。在多功能酶标仪上选择波长450nm,参比波长570nm测定96孔板中各孔的吸光值,每孔吸光值(OD)=OD450nm-OD570nm。将融合蛋白的浓度取对数后作为横坐标,测得的每孔吸光值为纵坐标,选用Sigmoidal dose-response(Variable Slope)方式(Graph Pad Prism软件,Graph Pad Software,SanDiego,California)进行非线性回归,得到目标融合蛋白与人CEACAM6(AB)蛋白的结合曲线。
ELISA结果如图5所示,融合蛋白1和2在多浓度范围下均可与人CEACAM6(AB)蛋白结合,阴性对照不能结合该蛋白,表明IL-10序列融合至构建抗体轻链或重链C端的融合蛋白具有与人CEACAM6(AB)蛋白的特异性结合活性。
实施例7ELISA检测融合蛋白对IL-10受体的亲和力
采用pH 7.4的PBS缓冲液将IL-10受体人IL10RA-his(购于北京义翘神州,CAT:10419-H08H)稀释至0.5μg/mL,每孔100μL加入到96孔ELISA板中,4℃包被过夜。用1%BSA封闭液封闭1小时。PBST洗板3次后,将纯化得到的融合蛋白用0.5%BSA样品稀释液稀释至100nM,以此为起始浓度,进行3倍梯度稀释,共11个梯度,并设阴性对照(曲妥珠单抗)与阳性对照(专利202110141918.8实施例4中得到的融合蛋白),每孔100μL,37℃孵育1h。再用PBST洗板3次,将HRP标记的山羊抗人IgG Fc(Jackson Cat:109-035-098)用样品稀释液按1:10000稀释,每孔加入100μL,室温孵育1h。PBST洗板4次后,每孔加入100μLTMB底物,室温避光孵育10min,每孔加入100μL 1M HCl液终止显色反应。
在多功能酶标仪上选择波长450nm,参比波长570nm测定96孔板中各孔的吸光值,每孔吸光值(OD)=OD450nm-OD570nm。将融合蛋白的浓度取对数后作为横坐标,测得的每孔吸光值为纵坐标,选用Sigmoidal dose-response(Variable Slope)方式(Graph PadPrism软件,Graph Pad Software,SanDiego,California)进行非线性回归,得到目标融合蛋白与IL-10受体IL-10RA蛋白的结合曲线。
ELISA结果如图6所示,阳性对照与融合蛋白1至3在多浓度范围下均可与IL-10受体结合,其中融合蛋白2的结合能力和融合蛋白3相当,优于融合蛋白1。
实施例8融合蛋白与LS174T细胞的结合活性
取对数期生长、形态正常的LS174T细胞(来自上海中科院),转至离心管1000rpm离心5min,按照1×10
FACS检测结果如图7所示,融合蛋白1和2在多浓度范围下均可与LS174T细胞特异结合。
实施例9IL-10端荧光素酶表达激活验证
IL-10与IL-10R结合,介导控制炎症的程度和炎症的持续时间,这对于维持机体炎症反应稳态至关重要。这一过程依赖于信号转导和转录激活因子3(STAT3)的调控。该实验使用HEK293工具细胞,稳定表达IL-10R及STAT3信号通路报告基因系统,使用IL-10蛋白刺激,能够激活细胞荧光素酶表达上升。因此使用此细胞系用于IL-10-STAT3的活性研究。
取对数生长期的IL-10-Reporter-HEK-293细胞株(购于吉满生物),每孔2.5×10
以融合蛋白浓度为横坐标,相对发光值(RLU)为纵坐标,采用GraphPad Prism软件Graphpad Prism 5Demo,San Diego,California)中非线性回归分析方法,选择Log(agonist)v.s.Response--Variable Slope方式做拟合曲线图,得到融合蛋白荧光量效曲线。
如图8所示,IL-10与阳性对照(专利202110141918.8实施例4中得到的异源融合蛋白)呈剂量依赖性地激活HEK293细胞荧光素酶表达,而阴性对照西妥昔单抗与人IgG1无此效果,表示此报告基因方法可反应IL-10的信号激活活性。阳性对照为双价的IL-10异源二聚体,融合蛋白1和2为单价IL-10的对称结构。如图9-10所示,阳性对照与融合蛋白1、2均具有激活IL-10报告基因细胞的活性。示例中,在低浓度时,融合蛋白1和2的IL-10激活活性弱于阳性对照。融合蛋白1的EC
应当说明的是,以上所述仅为本发明的较佳实施例而已,并不用于限制本发明的范围,凡在本发明的精神和原则之内所作出的任何修改、等同的替换和改进等,均应包含在本发明的保护范围之内。
- 一种大肠杆菌肠毒素STa-LTB-STb融合蛋白及其编码基因和应用
- 一种含有ApcE2突变体的融合蛋白及其应用
- 一种融合标签促进Kuma030蛋白酶可溶性表达及非亲和层析快速纯化的应用
- 一种长效抗凝血融合蛋白及其应用
- 一种重组马绒毛膜促性腺激素融合蛋白及其制备方法和其应用
- 一种二聚体化融合蛋白及其制备方法和应用
- 单克隆抗体-细胞因子融合蛋白二聚体及其应用
