生物分子的尺寸排阻色谱法
文献发布时间:2023-06-19 09:36:59
相关申请的交叉引用
本申请要求2018年6月12日提交的名称为“生物分子的尺寸排阻色谱法(SizeExclusion Chromatography of Biological Molecules)”的美国临时专利申请号62/683,942的权益和优先权,该文献的全部内容据此以引用方式并入本文。
技术领域
本发明涉及用于执行尺寸排阻色谱法的方法。本发明的实施方案的特征在于例如通过使用包括具有小颗粒(直径<2微米)的固定相的大孔柱来提高尺寸排阻色谱法的速度并改进尺寸排阻色谱法的分离的装置和方法。
背景技术
除非术语出现的文本的上下文需要不同的含义,否则本申请将使用如下定义的以下术语。
色谱法是用于浓缩或分离存在于混合物中的一种或多种化合物(例如,生物分子)的分离方法。化合物(例如,生物分子)通常存在于样品中。术语“样品”广义上表示个体希望分析的任何混合物。术语“混合物”用来表示含有一种或多种溶解的化合物(例如,生物分子)的流体。感兴趣的化合物被称为分析物。
色谱法是差速迁移过程。混合物中的化合物以不同的速率穿过柱,从而导致它们分离。迁移通过流体相(称为流动相)相对于颗粒填充床或多孔整体结构(称为固定相)的对流而发生。在色谱法的一些模式中,通过分析物与固定相和流动相的亲和力差异而发生差速迁移。
尺寸排阻色谱法(SEC)是一类基于流体动力学半径来分离或隔离混合物中的分析物的色谱法。在SEC中,由于分析物探测多孔固定相介质的体积的能力的差异而发生分离。参见例如A.M.Striegel等人的Modern Size-Exclusion Chromatography:Practice ofGel Permeation and Gel Filtration Chromatography(《现代尺寸排阻色谱法:凝胶渗透和凝胶过滤色谱法的实践》,第2版,威立出版社,新泽西州,2009年)。SEC通常用于大分子或分子络合物的分离。例如但非限制地,通过SEC分析许多生物来源的大分子,诸如脱氧核糖核酸(DNA)、核糖核酸(RNA)、蛋白质、多糖及其片段和络合物。还通过SEC分析合成聚合物、塑料等。
通常使用具有颗粒填充床的柱来执行SEC。颗粒填充床是流动相将流动通过的分离介质或固定相。柱被放置成与泵和进样器流体连通。在压力下通过进样器将样品混合物装载到柱上,并且通过泵将混合物和流动相推动通过柱。混合物中的化合物离开柱或从柱洗脱,其中分子量最大的化合物首先离开,并且最小的分子最后离开。
柱被放置成与检测器流体连通,检测器可随着溶液离开柱而检测溶液性质的变化。检测器将登记这些变化并将其记录为曲线图,该曲线图被称为色谱图,用于确定分析物是否存在。分析物离开柱的时间指示分子的大小。分子的分子量可使用标准校准曲线来估计。用于尺寸排阻色谱法的检测器的示例为但不限于折射率检测器、UV检测器、光散射检测器和质谱仪。
希望具有与可在大于1,000psi的压力和快速流速下工作以加快分析时间的SEC技术配套使用的柱。还希望具有附加的或提高的效率和分辨率;减少的溶剂用量;以及与高级检测器的改善的兼容性。希望具有带固定相的柱,该固定相具有清晰的孔结构和明确的粒度以得到高度可再现的结果。希望具有带固定相的柱,该固定相具有与生物聚合物相容的表面改性特征。因此,越来越需要采用高通量分析方法,该高通量分析方法可越来越接近重组表达,使得对于连续制造或工艺开发目的,可以实现实时分析反馈。希望例如具有能够以高通量方式分离和分析单体和聚集体形式的生物分子的柱。
发明内容
本发明的实施方案涉及用于执行SEC的装置和方法。本发明的实施方案在以下条件下工作:从约500psi扩展至约10,000psi、从约500psi扩展至约4,000psi;从约1,000psi扩展至约10,000psi和更大的压力,以及从0.3mL/min至3mL/min或更大的快速流速,以加快分析时间。本发明的实施方案的特征在于固定相,该固定相具有清晰的孔结构和明确的粒度,以高度可再现的方式得到生物分子的解析(例如,单体和聚集体形式的生物分子的解析)。并且,本发明的实施方案的特征在于具有与生物聚合物相容的表面改性特征的固定相。
在一些实施方案中,固定相材料包括颗粒。在一些实施方案中,固定相材料包括具有平均粒度分布小于2微米的直径的颗粒。在一些实施方案中,颗粒具有平均粒度分布介于约1微米至约2微米之间的直径。在一些实施方案中,颗粒具有平均粒度分布为约1.7微米的直径。在一些实施方案中,颗粒具有平均粒度分布为约1.5微米的直径。在一些实施方案中,固体固定相包括多孔颗粒。在一些实施方案中,固体固定相包括无孔颗粒。
在一个方面,本发明提供了执行尺寸排阻色谱法的方法,该方法包括以下步骤:a)提供具有至少一个壁的外壳,该至少一个壁限定具有入口和出口的腔室;以及固定相材料,该固定相材料包括保持在所述腔室中的芯和表面组合物;其中所述固定相材料包括具有平均粒度分布小于2.0微米的直径的颗粒;b)在大于500psi的柱入口压力下将样品装载在所述腔室中的所述固定相材料上,并且使样品流动通过所述固定相;以及c)按尺寸将样品分离成一种或多种生物分子分析物。
在一些实施方案中,固定相材料包括具有平均粒度分布介于约1微米至2微米之间的直径的颗粒。在一些实施方案中,固定相材料包括具有平均粒度分布为约1.7微米的直径的颗粒。在一些实施方案中,固定相材料包括具有平均粒度分布为约1.5微米的直径的颗粒。
在一些实施方案中,腔室的长度为约50mm。在一些实施方案中,腔室的长度为约30mm。在一些实施方案中,腔室的长度为约20mm。在一些实施方案中,腔室的长度为约10mm。在一些实施方案中,腔室的长度小于约50mm、30mm、20mm或10mm。
在一些实施方案中,外壳包括大孔柱。在一些实施方案中,柱具有4.6mm内径或更大的孔尺寸。在一些实施方案中,柱具有7.8mm内径或更大的孔尺寸。在一些实施方案中,柱具有大于约4mm内径的孔尺寸。在一些实施方案中,柱具有大于约5mm内径的孔尺寸。在一些实施方案中,柱具有大于约6mm内径的孔尺寸。在一些实施方案中,柱具有大于约7mm内径的孔尺寸。
对于本领域的技术人员而言,在查看下文所述的附图并阅读下面的具体实施方式之后,本发明的这些和其他特征和优点将显而易见。
附图说明
图1示出了根据本发明的装置。
图2A示出了根据本发明的示例性实施方案,使用本文所述的方法在1mL/min的流速下配制的英夫利昔单抗的示例性色谱分离。
图2B示出了根据本发明的示例性实施方案,使用本文所述的方法在2mL/min的流速下配制的英夫利昔单抗的示例性色谱分离。
图2C示出了根据本发明的示例性实施方案,使用本文所述的方法在3mL/min的流速下配制的英夫利昔单抗的示例性色谱分离。
具体实施方式
本文描述了用于执行SEC例如用来以高通量方式分离、解析和/或分析生物分子的装置和方法。在一个方面,本文描述了用于执行SEC的装置和方法,该装置包括:具有至少一个壁的外壳,该至少一个壁限定具有入口和出口的腔室(例如,大孔柱、大于约4mm、5mm、6mm或7mm内径(i.d.)的大孔柱);和固定相材料,该固定相材料与SEC技术一起使用,包括具有平均粒度分布小于2.0微米的直径的颗粒。在一些实施方案中,在使用本文所述的方法期间,较短长度(例如,小于约50mm、约30mm、约20mm、约10mm或更小)的腔室抑制了压力的波动或变化。在一些实施方案中,本文所述的固定相材料包括包封在大于约4mm、5mm、6mm或7mm内径的腔室中的小颗粒(例如,具有平均粒度分布小于2.0微米的直径的颗粒),该固定相材料最大程度降低了样品的剪切劣化或样品剪切。本文所述的用于执行SEC的方法可在大于500psi、1,000psi、2,000psi或3,000psi的压力和快速流速(例如,0.3mL/min至3mL/min或更大)下工作以加快分析时间。在一些实施方案中,本文所述的用于执行SEC的方法提供了高通量分析方法,该高通量分析方法可例如为如本文所述的生物分子的连续制造或工艺开发提供实时分析反馈。在一些实施方案中,该方法的持续时间小于10分钟、5分钟、4分钟、3分钟、2分钟或1分钟。
现在将本发明的实施方案详细描述为用于执行SEC的装置和方法,并且应当理解,此类装置和方法是示例性装置和方法。此类装置和方法构成本发明人现在认为是实践本发明的最佳模式的装置和方法。本领域的技术人员将认识到,此类装置和方法能够进行修改和更改。
在一个方面,本发明提供了执行尺寸排阻色谱法的方法,该方法包括以下步骤:a)提供具有至少一个壁的外壳,该至少一个壁限定具有入口和出口的腔室;以及固定相材料,该固定相材料包括保持在所述腔室中的芯和表面组合物;其中所述固定相材料包括具有平均粒度分布小于2.0微米的直径的颗粒;b)在大于500psi的柱入口压力下将样品装载在所述腔室中的所述固定相材料上,并且使样品流动通过所述固定相;以及c)按尺寸将样品分离成一种或多种生物分子分析物。
在一些实施方案中,该方法的持续时间小于60分钟、50分钟、40分钟、30分钟、20分钟、10分钟或5分钟。在一些实施方案中,该方法的持续时间小于10分钟、5分钟、4分钟、3分钟、2分钟或1分钟。在一些实施方案中,该方法的持续时间为约8分钟至约30分钟。
在一些实施方案中,使样品流动经过固定相是在约500psi至约4,000psi的入口压力下进行的。在一些实施方案中,使样品流动经过固定相是在大于1,000psi的入口压力下进行的。
在一些实施方案中,使样品流动经过固定相是在约1mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约2mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约3mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约0.3mL/min至约3mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在大于3mL/min的流速下进行的。
在一些实施方案中,固定相材料包括具有平均粒度分布介于约1微米至2微米之间的直径的颗粒。在一些实施方案中,固定相材料包括具有平均粒度分布为约1.7微米的直径的颗粒。在一些实施方案中,固定相材料包括具有平均粒度分布为约1.5微米的直径的颗粒。
在一些实施方案中,固定相材料包括多孔颗粒。
在一些实施方案中,固定相材料包括无孔颗粒。
在一些实施方案中,样品包括一种或多种生物分子分析物。在一些实施方案中,生物分子分析物为核酸(例如,RNA、DNA、寡核苷酸)、蛋白质(例如,融合蛋白)、肽、抗体(例如,单克隆抗体(mAb))、抗体-药物缀合物(ADC)、多糖、病毒、病毒样颗粒、病毒载体(例如,基因疗法病毒载体、腺相关病毒载体)、生物类似物或它们的任何组合。在一些实施方案中,生物分子分析物为抗体。在一些实施方案中,生物分子分析物为单克隆抗体(mAb)。在一些实施方案中,生物分子分析物为抗体的高分子量物质或聚集体形式。
在一些实施方案中,腔室的长度为约50mm。在一些实施方案中,腔室的长度为约30mm。在一些实施方案中,腔室的长度为约20mm。在一些实施方案中,腔室的长度为约10mm。在一些实施方案中,腔室的长度小于约50mm、30mm、20mm或10mm。
在一些实施方案中,外壳包括大孔柱。在一些实施方案中,柱具有4.6mm内径或更大的孔尺寸。在一些实施方案中,柱具有7.8mm内径或更大的孔尺寸。在一些实施方案中,柱具有大于约4mm内径的孔尺寸。在一些实施方案中,柱具有大于约5mm内径的孔尺寸。在一些实施方案中,柱具有大于约6mm内径的孔尺寸。在一些实施方案中,柱具有大于约7mm内径的孔尺寸。
在一些实施方案中,本发明的方法包括另外的分离或解析步骤(例如,色谱法步骤)。在一些实施方案中,本文所述的方法在多维色谱法方法(例如,二维(2D)液相色谱法在第一维、第二维中,或作为中间脱盐方法)中使用。例如,本文所述的方法与反相色谱法、亲和色谱法或离子交换色谱法结合(例如,一起使用)。在一些实施方案中,本文所述的方法与用固定化酶柱进行分离的方法一起使用。
在一些实施方案中,该方法还包括另外的分离或解析步骤。在一些实施方案中,该方法还包括反相色谱法、亲和色谱法或离子交换色谱法步骤。在一些实施方案中,另外的分离步骤包括使用固定化酶柱。
在本发明的方法的一些实施方案中,柱入口压力大于500psi、大于1,000psi、大于2,000psi、大于3,000psi、大于4,000psi、大于5,000psi、大于6,000psi、大于7,000psi、大于8,000psi、大于9,000psi、大于10,000psi、大于15,000psi、或大于20,000psi。在其他实施方案中,柱入口压力为约500psi至约10,000psi、1,000psi至约20,000psi、约5,000psi至约20,000psi、约7,000psi至约20,000psi、约10,000psi至约20,000psi、约1,000psi至约15,000psi、或约5,000psi至约15,000psi。
在本发明的方法的一些实施方案中,使样品流动经过固定相是在约0.3mL/min的流速下进行的。在本发明的方法的某些实施方案中,使样品流动经过固定相是在约1mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约2mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约3mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在大于约0.3mL/min、大于约1mL/min、大于2mL/min或大于3mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约0.3mL/min至约3mL/min的流速下进行的。
在一些实施方案中,本发明的方法的持续时间小于60分钟、50分钟、40分钟、30分钟、20分钟、10分钟或5分钟。在一些实施方案中,该方法的持续时间小于10分钟、5分钟、4分钟、3分钟、2分钟或1分钟。在本发明的方法的某些实施方案中,该方法的持续时间为约8分钟至约30分钟。
在另一方面,本发明提供了执行尺寸排阻色谱法的方法,该方法包括以下步骤:a)提供具有至少一个壁的外壳,该至少一个壁限定具有入口和出口的腔室;其中外壳包括孔尺寸为7.8mm内径或更大的大孔柱;以及固定相材料,该固定相材料包括保持在所述腔室中的芯和表面组合物;其中所述固定相材料包括具有平均粒度分布小于2.0微米的直径的颗粒;b)在大于500psi的柱入口压力下将样品装载到所述腔室中的所述固定相材料上,并且使样品流动通过所述固定相材料;以及c)按尺寸将样品分离成一种或多种生物分子分析物。
在一些实施方案中,该方法的持续时间小于60分钟、50分钟、40分钟、30分钟、20分钟、10分钟或5分钟。在一些实施方案中,该方法的持续时间小于10分钟、5分钟、4分钟、3分钟、2分钟或1分钟。在一些实施方案中,该方法的持续时间为约8分钟至约30分钟。
在一些实施方案中,使样品流动经过固定相是在约500psi至约4,000psi的入口压力下进行的。在一些实施方案中,使样品流动经过固定相是在大于1,000psi的入口压力下进行的。
在一些实施方案中,使样品流动经过固定相是在约1mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约2mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约3mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约0.3mL/min至约3mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在大于3mL/min的流速下进行的。
在一些实施方案中,固定相材料包括具有平均粒度分布介于约1微米至2微米之间的直径的颗粒。在一些实施方案中,固定相材料包括具有平均粒度分布为约1.7微米的直径的颗粒。在一些实施方案中,固定相材料包括具有平均粒度分布为约1.5微米的直径的颗粒。
在一些实施方案中,固定相材料包括多孔颗粒。
在一些实施方案中,固定相材料包括无孔颗粒。
在一些实施方案中,样品包括一种或多种生物分子分析物。在一些实施方案中,生物分子分析物为核酸(例如,RNA、DNA、寡核苷酸)、蛋白质(例如,融合蛋白)、肽、抗体(例如,单克隆抗体(mAb))、抗体-药物缀合物(ADC)、多糖、病毒、病毒样颗粒、病毒载体(例如,基因疗法病毒载体、腺相关病毒载体)、生物类似物或它们的任何组合。在一些实施方案中,生物分子分析物为抗体。在一些实施方案中,生物分子分析物为单克隆抗体(mAb)。在一些实施方案中,生物分子分析物为抗体的高分子量物质或聚集体形式。
在一些实施方案中,腔室的长度为约50mm。在一些实施方案中,腔室的长度为约30mm。在一些实施方案中,腔室的长度为约20mm。在一些实施方案中,腔室的长度为约10mm。在一些实施方案中,腔室的长度小于约50mm、30mm、20mm或10mm。
在一些实施方案中,本发明的方法包括另外的分离或解析步骤(例如,色谱法步骤)。在一些实施方案中,本文所述的方法在多维色谱法方法(例如,二维(2D)液相色谱法在第一维、第二维中,或作为中间脱盐方法)中使用。例如,本文所述的方法与反相色谱法、亲和色谱法或离子交换色谱法结合(例如,一起使用)。在一些实施方案中,本文所述的方法与用固定化酶柱进行分离的方法一起使用。
在一些实施方案中,该方法还包括另外的分离或解析步骤。在一些实施方案中,该方法还包括反相色谱法、亲和色谱法或离子交换色谱法步骤。在一些实施方案中,另外的分离步骤包括使用固定化酶柱。
在本发明的方法的一些实施方案中,柱入口压力大于500psi、大于1,000psi、大于2,000psi、大于3,000psi、大于4,000psi、大于5,000psi、大于6,000psi、大于7,000psi、大于8,000psi、大于9,000psi、大于10,000psi、大于15,000psi、或大于20,000psi。在其他实施方案中,柱入口压力为约500psi至约10,000psi、1,000psi至约20,000psi、约5,000psi至约20,000psi、约7,000psi至约20,000psi、约10,000psi至约20,000psi、约1,000psi至约15,000psi、或约5,000psi至约15,000psi。
在本发明的方法的一些实施方案中,使样品流动经过固定相是在约0.3mL/min的流速下进行的。在本发明的方法的某些实施方案中,使样品流动经过固定相是在约1mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约2mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约3mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在大于约0.3mL/min、大于约1mL/min、大于2mL/min或大于3mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约0.3mL/min至约3mL/min的流速下进行的。
在一些实施方案中,本发明的方法的持续时间小于60分钟、50分钟、40分钟、30分钟、20分钟、10分钟或5分钟。在一些实施方案中,该方法的持续时间小于10分钟、5分钟、4分钟、3分钟、2分钟或1分钟。在本发明的方法的某些实施方案中,该方法的持续时间为约8分钟至约30分钟。
在另一方面,本发明提供了执行尺寸排阻色谱法的方法,该方法包括以下步骤:a)提供具有至少一个壁的外壳,该至少一个壁限定具有入口和出口的腔室;其中所述腔室的长度为约50mm;并且其中所述外壳包括孔尺寸为7.8mm内径或更大的大孔柱;以及固定相材料,该固定相材料包括保持在所述腔室中的芯和表面组合物;其中所述固定相材料包括具有平均粒度分布小于2.0微米的直径的颗粒;b)在大于500psi的柱入口压力下将样品装载到所述腔室中的所述固定相材料上,并且使样品流动通过所述固定相材料;以及c)按尺寸将样品分离成一种或多种生物分子分析物。
在一些实施方案中,该方法的持续时间小于60分钟、50分钟、40分钟、30分钟、20分钟、10分钟或5分钟。在一些实施方案中,该方法的持续时间小于10分钟、5分钟、4分钟、3分钟、2分钟或1分钟。在一些实施方案中,该方法的持续时间为约8分钟至约30分钟。
在一些实施方案中,使样品流动经过固定相是在约500psi至约4,000psi的入口压力下进行的。在一些实施方案中,使样品流动经过固定相是在大于1,000psi的入口压力下进行的。
在一些实施方案中,使样品流动经过固定相是在约1mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约2mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约3mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约0.3mL/min至约3mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在大于3mL/min的流速下进行的。
在一些实施方案中,固定相材料包括具有平均粒度分布介于约1微米至2微米之间的直径的颗粒。在一些实施方案中,固定相材料包括具有平均粒度分布为约1.7微米的直径的颗粒。在一些实施方案中,固定相材料包括具有平均粒度分布为约1.5微米的直径的颗粒。
在一些实施方案中,固定相材料包括多孔颗粒。
在一些实施方案中,固定相材料包括无孔颗粒。
在一些实施方案中,样品包括一种或多种生物分子分析物。在一些实施方案中,生物分子分析物为核酸(例如,RNA、DNA、寡核苷酸)、蛋白质(例如,融合蛋白)、肽、抗体(例如,单克隆抗体(mAb))、抗体-药物缀合物(ADC)、多糖、病毒、病毒样颗粒、病毒载体(例如,基因疗法病毒载体、腺相关病毒载体)、生物类似物或它们的任何组合。在一些实施方案中,生物分子分析物为抗体。在一些实施方案中,生物分子分析物为单克隆抗体(mAb)。在一些实施方案中,生物分子分析物为抗体的高分子量物质或聚集体形式。
在一些实施方案中,本发明的方法包括另外的分离或解析步骤(例如,色谱法步骤)。在一些实施方案中,本文所述的方法在多维色谱法方法(例如,二维(2D)液相色谱法在第一维、第二维中,或作为中间脱盐方法)中使用。例如,本文所述的方法与反相色谱法、亲和色谱法或离子交换色谱法结合(例如,一起使用)。在一些实施方案中,本文所述的方法与用固定化酶柱进行分离的方法一起使用。
在一些实施方案中,该方法还包括另外的分离或解析步骤。在一些实施方案中,该方法还包括反相色谱法、亲和色谱法或离子交换色谱法步骤。在一些实施方案中,另外的分离步骤包括使用固定化酶柱。
在本发明的方法的一些实施方案中,柱入口压力大于500psi、大于1,000psi、大于2,000psi、大于3,000psi、大于4,000psi、大于5,000psi、大于6,000psi、大于7,000psi、大于8,000psi、大于9,000psi、大于10,000psi、大于15,000psi、或大于20,000psi。在其他实施方案中,柱入口压力为约500psi至约10,000psi、1,000psi至约20,000psi、约5,000psi至约20,000psi、约7,000psi至约20,000psi、约10,000psi至约20,000psi、约1,000psi至约15,000psi、或约5,000psi至约15,000psi。
在本发明的方法的一些实施方案中,使样品流动经过固定相是在约0.3mL/min的流速下进行的。在本发明的方法的某些实施方案中,使样品流动经过固定相是在约1mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约2mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约3mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在大于约0.3mL/min、大于约1mL/min、大于2mL/min或大于3mL/min的流速下进行的。在一些实施方案中,使样品流动经过固定相是在约0.3mL/min至约3mL/min的流速下进行的。
在一些实施方案中,本发明的方法的持续时间小于60分钟、50分钟、40分钟、30分钟、20分钟、10分钟或5分钟。在一些实施方案中,该方法的持续时间小于10分钟、5分钟、4分钟、3分钟、2分钟或1分钟。在本发明的方法的某些实施方案中,该方法的持续时间为约8分钟至约30分钟。
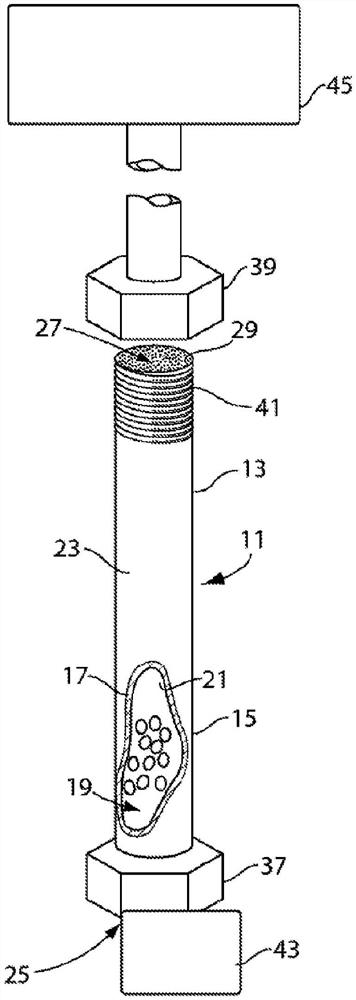
现在转向图1,该图示出了体现本发明的特征的装置,该装置通常用数字11表示。用于执行SEC的装置11包括以下主要元件或部件:外壳13和粒状固定相介质15。
外壳13具有限定腔室19的至少一个壁17。如图所示,壁17为具有内表面21和外表面23的圆柱体形式。虽然在本文中被描述为柱,但外壳13和限定腔室19的壁17可呈现任何形状。例如但非限制地,外壳13可为其中形成腔室19的平面片状结构。
在一些实施方案中,柱(或外壳和限定腔室的壁)的长度小于约150mm、小于约100mm或小于约50mm。在一些实施方案中,腔室的长度小于约150mm、小于约100mm或小于约50mm。在一些实施方案中,腔室的长度为约50mm、约30mm、约20mm、约10mm或更小。
在一些实施方案中,外壳包括大孔柱。在一些实施方案中,柱具有约4.6mm内径的孔尺寸。在一些实施方案中,柱具有约7.8mm内径的孔尺寸。在一些实施方案中,柱具有大于4.6mm内径的孔尺寸。在一些实施方案中,柱具有大于7.8mm内径的孔尺寸。在一些实施方案中,柱具有大于约4mm内径、大于约5mm内径、大于约6mm内径、或大于约7mm内径的孔尺寸。
如图所示,至少一个壁17限定具有入口开口25和出口开口27的腔室。虽然入口开口25在图1中被遮挡,但入口开口25和出口开口27共享若干特征。入口开口25和出口开口27具有玻璃料,其中仅示出了相对于出口开口27的玻璃料29。如图所示,玻璃料29是在柱内容纳固定相但允许流动相通过的元件。在某些实施方案中,玻璃料可由烧结金属或类似材料构成。在其他实施方案中,玻璃料也可由将颗粒在床上保持在一起的粘合剂或胶构成,但为足够多孔的以允许流体流动通过床。在其他实施方案中,固定相材料可包括颗粒。在此类实施方案中,可能不需要玻璃料元件。
至少一个壁17具有位于入口开口25处或其附近的第一连接部件和位于出口开口27处或其附近的第二连接部件。第一连接部件包括通过配合螺纹[未示出]保持到至少一个壁17的紧固螺母37。类似地,第二连接部件包括通过配合螺纹41保持到至少一个壁17的第二紧固螺母39。第一连接部件和第二连接部件可包括配合配件、夹具、互锁凹槽等[未示出]。第一连接部件和第二连接部件还可包括套管、密封件、O形环等[未示出],为简单起见,已从附图中省略套管、密封件、O形环等。
腔室17的入口开口25与以方框示意图形式由数字43示出的流体源和样品流体连通。优选的流体源和样品在正常HPLC或UPLC范围内具有约5,000psi的工作压力。然而,颗粒和装置11能够在大于500psi、大于1,000psi、大于2,000psi、大于3,000psi、大于4,000psi、大于5,000psi、大于6,000psi、大于7,000psi、大于8,000psi、大于9,000psi、或大于10,000psi的压力下工作。在本发明的装置的其他实施方案中,颗粒和装置能够在约500psi至约10,000psi、1,000psi至约15,000psi、约5,000psi至约15,000psi、约7,000psi至约15,000psi、约10,000psi至约15,000psi、约1,000psi至约10,000psi、或约5,000psi至约10,000psi的压力下工作。
在某些具体实施方案中,流体源和样品是
腔室17的出口开口27与检测器45流体连通。许多检测器是可用的;然而,具体的检测器是Waters
粒状固定相介质15保持在腔室17中。粒状固定相介质15包括在图1中未按比例绘制的颗粒。颗粒通常为球体,但也可为可用于色谱法的任何形状。颗粒通常具有平均直径小于2微米(例如,2微米或1微米)的粒度分布。在一些实施方案中,颗粒具有平均直径为约1.7微米的粒度分布。在一些实施方案中,颗粒具有平均直径为约1.5微米的粒度分布。在一些实施方案中,颗粒具有平均直径介于约1微米至约2微米之间的粒度分布。
本发明的装置和方法利用固定相材料。此类材料可由一个或多个颗粒、一个或多个球形颗粒、或一个或多个薄膜颗粒构成。颗粒通常具有平均直径小于2微米(例如,2微米或1微米)的粒度分布。在一些实施方案中,颗粒具有平均直径为约1.7微米的粒度分布。在一些实施方案中,颗粒具有平均直径为约1.5微米的粒度分布。在一些实施方案中,颗粒具有平均直径介于约1微米至约2微米之间的粒度分布。
在某些实施方案中,所述固定相材料包括由式1表示的具有芯和表面组合物的颗粒:
W-[X]-Q 式1
其中:
X为芯组合物,该芯组合物具有包括二氧化硅芯材料、金属氧化物芯材料、有机-无机杂化芯材料或其嵌段聚合物的组的表面;
W为氢或羟基;以及
Q不存在或者为最大程度减小静电相互作用、范德瓦尔斯相互作用、氢键相互作用或与分析物的其他相互作用的官能团。
此外,在某些实施方案中,W和Q占据芯组合物X或芯组合物表面的自由价。在本发明的装置的其他实施方案中,W和Q被选择为形成表面组合物。在其他实施方案中,X可被选择为形成嵌段聚合物或嵌段聚合物的组。
在本发明的各方面,粒状固定相材料的颗粒可具有平均粒度分布小于2微米的直径。在一些实施方案中,颗粒具有平均粒度分布介于约1微米至约2微米之间的直径。在一些实施方案中,颗粒具有平均粒度分布为约1.7微米的直径。在一些实施方案中,颗粒具有平均粒度分布为约1.5微米的直径。
在本发明的装置的其他实施方案中,固定相材料的孔体积为0.1cm
在固定相材料的某些实施方案中,X为二氧化硅、氧化钛、氧化铝或包括脂族桥联硅烷的有机-无机杂化芯。
在具体实施方案中,X为包括脂族桥联硅烷的有机-无机杂化芯。在某些其他具体实施方案中,脂族桥联硅烷的脂族基团为乙烯。
在某些其他实施方案中,芯材料X可为氧化铈、氧化锆或陶瓷材料。在某些其他实施方案中,芯材料X可具有色谱增强孔几何形状(CEPG)。CEPG包括这样的几何形状:已发现该几何形状例如与本领域的其他色谱介质不同,可以增强材料的色谱分离能力。例如,可以形成、选择或构造几何形状,并且可以使用各种性质和/或因素来确定例如与本领域已知或常规使用的几何形状相比,材料的色谱分离能力是否已经“增强”。这些因素的示例包括较高分离效率、较长柱寿命以及较高质量传递特性(如由例如减少的谱带扩展和良好的峰形所证实)。可以使用本领域公认的技术来测量或观察这些性质。例如,本发明的多孔无机/有机杂化颗粒的色谱增强孔几何形状与现有技术颗粒的区别在于不存在“墨瓶”或“壳形”孔几何形状或形态,这两者都是不希望的,因为它们会例如降低传质速率,从而导致效率降低。在仅含有少量微孔的杂化材料中发现了色谱增强孔几何形状。当直径为约
在某些实施方案中,芯材料X可用具有式Z
在另一个实施方案中,芯材料X可通过用聚合物涂覆进行表面改性。
在某些实施方案中,表面改性剂选自辛基三氯硅烷、十八烷基三氯硅烷、辛基二甲基氯硅烷和十八烷基二甲基氯硅烷。在一些实施方案中,表面改性剂选自辛基三氯硅烷和十八烷基三氯硅烷。在其他实施方案中,表面改性剂选自异氰酸酯或1,1′-羰基二咪唑(特别是当杂化基团含有(CH
在另一个实施方案中,材料已通过有机基团和硅烷醇基团改性的组合进行表面改性。
在再一个实施方案中,材料已通过有机基团改性和用聚合物涂覆的组合进行了表面改性。在另一个实施方案中,有机基团包含手性部分。
在又一个实施方案中,材料已通过硅烷醇基团改性和用聚合物涂覆的组合进行了表面改性。
在其他实施方案中,材料已通过在材料上的有机基团与改性试剂之间形成有机共价键进行了表面改性。
在其他实施方案中,材料已通过有机基团改性、硅烷醇基团改性和用聚合物涂覆的组合进行了表面改性。
在另一个实施方案中,材料已通过硅烷醇基团改性进行了表面改性。
在某些实施方案中,表面改性层可以是多孔的或无孔的。
在固定相材料的其他实施方案中,Q为亲水性基团、疏水性基团或不存在。
在固定相材料的一些实施方案中,其中Q为亲水性基团,Q为脂族基团。在其他实施方案中,所述脂族基团为脂族二醇。
在其他实施方案中,Q由式2表示
其中
n
n
R
Z表示:
通过在具有式3的部分的固定相材料表面之间形成共价键或非共价键所产生的表面连接基团:
(B
其中
a)x为1至3的整数,
b)y为0至2的整数,
c)z为0至2的整数,
d)并且x+y+z=3
R
B
b)通过直接碳-碳键形成或通过杂原子、酯、醚、硫醚、胺、酰胺、酰亚胺、脲、碳酸酯、氨基甲酸酯、杂环、三唑或聚氨基甲酸酯键与X的表面杂化基团的直接连接;或
c)未共价连接到固定相材料表面的吸附基团;
d)当W为氢时,通过与乙烯基或炔基基团反应,在固定相材料的表面之间形成共价键所产生的表面连接基团;
Y表示直接键合;杂原子键;酯键;醚键;硫醚键;胺键;酰胺键;酰亚胺键;脲键;硫脲键;碳酸酯键;氨基甲酸酯键;杂环键;三唑键;聚氨基甲酸酯键;二醇键;多元醇键;苯乙烯、乙二醇或丙二醇的低聚物;苯乙烯、乙二醇或丙二醇的聚合物;碳水化合物基团、多分支碳水化合物(multi-antennary carbohydrates)、树枝状化合物或树枝状体、或两性离子基团;并且
i.)亲水性端基;
ii.)氢、氟、氟代烷基、低级烷基或基团Z;或
iii.)可官能化基团。
在本发明的装置的某些实施方案中,其中Q为式2的脂族二醇,n
在固定相材料的其他实施方案中,其中Q为式2的脂族二醇,A表示i)亲水性端基,并且所述亲水性端基为醇、二醇、缩水甘油醚、环氧化物、三醇、多元醇、季戊四醇、季戊四醇乙氧基化物、1,3-二氧杂环己烷-5,5-二甲醇、三(羟甲基)氨基甲烷、三(羟甲基)氨基甲烷聚乙二醇醚、乙二醇、丙二醇、聚(乙二醇)、聚(丙二醇)的受保护或去保护形式;一价、二价或多价碳水化合物基团;多分支碳水化合物;含有周边亲水性基团的树枝状化合物;含有周边亲水性基团的树枝状体;或两性离子基团。
在固定相材料的其他实施方案中,其中Q为式2的脂族二醇,A表示ii.)氢、氟、甲基、乙基、正丁基、叔丁基、异丙基、低级烷基或基团Z。
在固定相材料的其他实施方案中,其中Q为式2的脂族二醇,A表示iii.)可官能化基团,并且所述可官能化基团为胺、醇、硅烷、烯烃、硫醇、叠氮化物或炔烃的受保护或去保护形式。在一些实施方案中,所述可官能化基团可在后续反应步骤中产生新的表面基团,其中所述反应步骤为偶联、复分解、自由基加成、氢化硅烷化、缩合、点击或聚合。
在其他实施方案中,基团Q可为表面改性剂。可用于这些材料的表面改性剂的非限制性示例包括:
其中A选自以下:
其中p为选自2至20的整数,或者
其中A选自以下:H、苯基、NHC(O)NHR
在本发明的装置的某些实施方案中,Z表示通过直接碳-碳键形成或通过杂原子、酯、醚、硫醚、胺、酰胺、酰亚胺、脲、碳酸酯、氨基甲酸酯、杂环、三唑或聚氨基甲酸酯键与表面有机官能化杂化基团的连接。
在其他实施方案中,Z表示未共价连接到材料表面的吸附表面基团。该表面基团可以是交联聚合物或其他吸附的表面基团。示例包括但不限于醇、胺、硫醇、聚胺、树枝状化合物或聚合物。
在本发明的装置的一些实施方案中,外壳配备有一种或多种玻璃料以容纳固定相材料。
在一些实施方案中,外壳配备有能够将装置放置成与进样装置、检测器或两者流体连通的一个或多个配件。
用于尺寸排阻色谱法的检测器的示例为但不限于折射率检测器、UV检测器、光散射检测器和质谱仪。
进样装置的示例包括但不限于柱上进样器、PTV进样器、气体取样阀、吹扫和捕集系统、多个进样器、分流进样器、不分流进样器和分流/不分流进样器。
如上文所用,术语“脂族基团”包括以通常具有介于1个至22个之间的碳原子的直链或支链为特征的有机化合物。
脂族基团包括烷基基团、烯基基团和炔基基团。在复杂结构中,链可以是支链或交联的。烷基基团包括具有一个或多个碳原子的饱和烃,包括直链烷基基团和支链烷基基团。这种烃部分可在一个或多个碳上被例如卤素、羟基、硫醇、氨基、烷氧基、烷羧基、烷硫基或硝基基团取代。除非碳的数目另有说明,如本文所用的“低级脂族”意指如上定义的脂族基团(例如低级烷基、低级烯基、低级炔基),但具有一至六个碳原子。代表性的此类低级脂族基团例如低级烷基基团为甲基、乙基、正丙基、异丙基、2-氯丙基、正丁基、仲丁基、2-氨基丁基、异丁基、叔丁基、3-硫代戊基等。如本文所用,术语“硝基”意指-NO
术语“脂环基团”包括三个或更多个碳原子的闭环结构。脂环基团包括为饱和环烃的环烷烃或环烷、具有两个或更多个双键的不饱和环烯烃以及具有三键的环乙炔。它们不包括芳族基团。环烷烃的示例包括环丙烷、环己烷和环戊烷。环烯烃的示例包括环戊二烯和环辛四烯。脂环基团还包括稠环结构和取代的脂环基团,诸如烷基取代的脂环基团。在脂环族的实例中,此类取代基还可包括低级烷基、低级烯基、低级烷氧基、低级烷硫基、低级烷基氨基、低级烷基羧基、硝基、羟基、-CF
术语“杂环基团”包括其中环中的一个或多个原子是除碳之外的元素例如氮、硫或氧的闭环结构。杂环基团可以是饱和的或不饱和的,并且杂环基团诸如吡咯和呋喃可以具有芳香性。它们包括稠环结构,诸如喹啉和异喹啉。杂环基团的其他示例包括吡啶和嘌呤。杂环基团也可在一个或多个组成原子处被例如卤素、低级烷基、低级烯基、低级烷氧基、低级烷硫基、低级烷基氨基、低级烷基羧基、硝基、羟基、-CF
术语“芳族基团”包括含有一个或多个环的不饱和环状烃。芳族基团包括可包含0至4个杂原子的5元和6元单环基团,例如苯、吡咯、呋喃、噻吩、咪唑、恶唑、噻唑、三唑、吡唑、吡啶、吡嗪、哒嗪和嘧啶等。芳族环可在一个或多个环位置处被例如卤素、低级烷基、低级烯基、低级烷氧基、低级烷硫基、低级烷基氨基、低级烷基羧基、硝基、羟基、-CF
术语“烷基”包括饱和脂族基团,包括直链烷基基团、支链烷基基团、环烷基(脂环)基团、烷基取代的环烷基基团和环烷基取代的烷基基团。在某些实施方案中,直链或支链烷基在其主链中具有30个或更少个碳原子,例如对于直链为C
此外,如整个说明书和权利要求中所用的术语“烷基”(包括“低级烷基”)包括“未取代的烷基”和“取代的烷基”,“取代的烷基”是指在烃主链的一个或多个碳原子上具有置换氢的取代基的烷基部分。这类取代基可包括例如卤素、羟基、烷基羰氧基、芳基羰氧基、烷氧基羰氧基、芳氧基羰氧基、羧酸酯、烷基羰基、烷氧基羰基、氨基羰基、烷硫基羰基、烷氧基、磷酸酯、膦酸酯、膦基、氰基、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰氨基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸酯、硫酸酯、磺酸酯、氨磺酰基、磺酰氨基、硝基、三氟甲基、氰基、叠氮基、杂环基、芳烷基或者芳族或杂芳族部分。本领域技术人员将理解,如果合适,在烃链上被取代的部分本身可被取代。环烷基可进一步例如被上述取代基所取代。“芳烷基”部分是被例如具有1个至3个独立或稠合的环以及6个至约18个碳环原子的芳基取代的烷基,例如苯甲基(苄基)。
术语“芳基”包括可包含0至4个杂原子的5元和6元单环芳族基团,例如未取代或取代的苯、吡咯、呋喃、噻吩、咪唑、恶唑、噻唑、三唑、吡唑、吡啶、吡嗪、哒嗪和嘧啶等。芳基基团还包括多环稠合芳族基团,诸如萘基、喹啉基、吲哚基等。芳族环可在一个或多个环位置处被此类取代基所取代,例如如上对烷基基团所述的取代基。合适的芳基基团包括未取代和取代的苯基基团。如本文所用的术语“芳氧基”是指其上连接有氧原子的如上所定义的芳基基团。
如本文所用的术语“芳烷氧基”是指其上连接有氧原子的如上所定义的芳烷基基团。合适的芳烷氧基基团具有1至3个独立或稠合的环以及6至约18个碳环原子,例如O-苄基。
如本文所用,术语“氨基”是指式-NR
如本文所用,术语“保护基团”是指有机合成领域熟知的官能团的化学改性。示例性保护基团可变化,并且大致描述于Protective Groups in Organic Synthesis[《有机合成中的保护基团》,T.W.Green和P.G.M.Wuts,约翰威立出版社,1999年]中。
“杂化”(包括“有机-无机杂化材料”)包括无机类结构,其中有机官能团与内部或“骨架”无机结构以及杂化材料表面均成一体。杂化材料的无机部分可以是例如氧化铝、二氧化硅、钛、铈或锆或其氧化物,或陶瓷材料。“杂化”包括无机类结构,其中有机官能团与内部或“骨架”无机结构以及杂化材料表面均形成一体。如上所述,示例性杂化材料在美国专利号4,017,528、6,528,167、6,686,035和7,175,913中示出。
如本文所用,术语“BEH”是指为乙烯桥联杂化材料的有机-无机杂化材料。
如本文所用,术语“吸附基团”表示非共价连接到芯材料上的交联或非交联的单体、低聚物或聚合物。在本发明的某些实施方案中,其中Z表示吸附基团,该基团可被吸附到芯材料X、芯材料X的表面或固定相材料的表面上。示例包括但不限于醇、胺、硫醇、聚胺、树枝状化合物或聚合物。
术语“官能化基团”或“可官能化基团”包括为固定相赋予一定色谱功能的有机官能团。
如本文所用,术语“端基”表示不能发生进一步反应的基团。在某些实施方案中,端基可为亲水性端基。亲水性端基包括但不限于醇、二醇、缩水甘油醚、环氧化物、三醇、多元醇、季戊四醇、季戊四醇乙氧基化物、1,3-二氧杂环己烷-5,5-二甲醇、三(羟甲基)氨基甲烷、三(羟甲基)氨基甲烷聚乙二醇醚、乙二醇、丙二醇、聚(乙二醇)、聚(丙二醇)的受保护或去保护形式;一价、二价或多价碳水化合物基团;多分支碳水化合物;含有周边亲水性基团的树枝状化合物;含有周边亲水性基团的树枝状体;或两性离子基团。
如本文所用,术语“表面连接基团”表示可进行反应以共价键合、非共价键合、吸附或以其他方式连接到芯材料、芯材料表面或固定相材料表面的基团。在某些实施方案中,表面连接基团通过硅氧烷键连接到芯材料表面。
对于本领域的技术人员而言,在查看下文所述的附图并阅读下面的具体实施方式之后,本发明的这些和其他特征和优点将显而易见。
本发明可通过以下描述色谱装置和方法的非限制性实施例进一步说明。
除非另有说明,否则所有试剂均按原样使用。本领域技术人员将认识到存在以下供应品和供应商的等同形式,因此,下面列出的供应商不应被解释为限制性的。
本领域技术人员将认识到存在以下仪器和供应商的等同形式,因此,下面列出的仪器不应被解释为限制性的。
将配制的英夫利昔单抗(Remicade,10mg/mL,杨森公司(Janssen))稀释至2mg/mL并注入到填充有1.7μm
柱:填充在7.8mm×50mm柱尺寸中的1.7μm
系统:Waters
流动相:100mM磷酸氢二钠pH 6.8,200mM NaCl
流速:1.0mL/min、2.0mL/min或3.0mL/min
运行时间:3.50分钟、1.50分钟、1.20分钟
柱温:30℃
UV检测:280nm,40Hz
样品:稀释的英夫利昔单抗(2mg/mL)
进样体积:5μL
- 生物分子的尺寸排阻色谱法
- 利用尺寸排阻色谱法的细胞外囊泡的分析方法及其用途
