一种用于检测泛素-蛋白酶体系统降解活性的生物探针
文献发布时间:2023-06-19 09:29:07
技术领域
本发明涉及生物技术领域,具体是通过构建一种荧光探针,实现细胞水平泛素磷酸化及泛素依赖的蛋白酶体活性的检测。
背景技术
泛素-蛋白酶体系统是细胞内蛋白质降解的主要途径,参与细胞内80%以上蛋白质的降解,蛋白质先被泛素(多肽)标记,然后被蛋白酶体识别和降解,以维持细胞内的蛋白质稳态。以蛋白酶体为靶点的药物在抗肿瘤(通常需要抑制剂)和神经退行性疾病(需要发展增强剂)有重要的研发价值。
泛素依赖的蛋白酶体活性的检测方法,不仅可以用于基础研究,还可以用于药物筛选。在2000年已经有研究者设计了一个用于检测泛素依赖的蛋白酶体活性的探针Ub-linker-GFP,在探针中的泛素(Ub)能够连接更多的泛素,形成泛素链,被蛋白酶体降解,这一探针在基础研究中有较多的应用。此外,还有一些基于去泛素化的探针,如Ub-R-GFP,探针中的泛素被去泛素酶水解后,形成R-GFP,在GFP的Lys上,会被泛素化,随后被蛋白酶体降解。这些探针因为使用GFP,荧光强度较强,使背景荧光较高。
课题组前期研究发现,泛素可以被磷酸化,被磷酸化后的表现也是抑制泛素依赖的蛋白酶体。泛素依赖的蛋白酶体降解蛋白质包括两个过程:(1)对待降解底物的泛素化;(2)泛素链与蛋白酶体结合。当泛素被磷酸化后,泛素结构会出现收缩态和舒张态两个态,在中性pH值两个态各占50%。其中舒张态能够被继续泛素化形成泛素链,同时也能够与蛋白酶体结合,而泛素一旦处于收缩态,则泛素链不能被延长,已经形成泛素链的泛素处于收缩态,则不能与蛋白酶体结合。而上述探针的GFP本身无感受蛋白质结构变化的功能,无法实现泛素的磷酸化检测。
cpEGFP是将GFP原本的N-端和C-端连接,在新的位点进行切割,形成新的N-端和C-端,这样GFP的11个β片段进行了重排,使荧光发光基团被一个处于N-端的,能够动态开、合的盖子松松的盖住,随着与其N-端相连接蛋白质的结构变化而打开(荧光强度减小)和关闭(荧光强度增加)。cpEGFP的优势是自身的荧光强度低,背景荧光弱,其最大的特点是由于盖子能够开、合,能够反应关联蛋白质的结构变化,故一般被用于检测蛋白质结构域之间或者蛋白质与蛋白质之间的相互作用。
因此,如何将泛素与cpEGFP有效结合使得cpEGFP的荧光强度与泛素的结构变化关联,是本领域技术人员需要解决的问题。
发明内容
本发明的目的在于提供一种能够针对泛素-蛋白酶体系统泛素磷酸化检测的荧光探针,增加对泛素磷酸化检测的灵敏度。
为实现上述目的,本发明采用如下技术方案:
一种用于检测泛素-蛋白酶体系统降解活性的生物探针,所述生物探针由泛素与环状序列改变的增强型绿色荧光蛋白融合而成;
所述环状序列改变的增强型绿色荧光蛋白的构建方法包括:将绿色荧光蛋白氨基酸序列的N-端和C-端连接,在绿色荧光蛋白的第144位与第145位之间断开,形成新的N末端和C末端,删除新的N末端的酪氨酸残基和天冬氨酸残基;
所述环状序列改变的增强型绿色荧光蛋白N末端的丝氨酸残基与泛素的C端进行连接。
本发明构建的生物荧光探针Ub-cpEGFP的工作原理如下:
生物荧光探针Ub-cpEGFP能够被泛素依赖的蛋白酶体降解。当泛素(Ub)亚基被泛素激酶磷酸化,生成pUb-cpEGFP,pUb处于收缩态,cpEGFP亚基也发生构象改变,使荧光基团在水溶液中的暴露程度发生改变,pUb与cpEGF发生相互作用,一方面增加收缩态的比例,另一方面增强cpEGFP的荧光强度。泛素一旦进入收缩态,则使探针不能够被泛素依赖的蛋白酶体降解,使荧光强度增加。当一些药物或者疾病条件下,导致蛋白酶体降解活性降低时,该探针也不能够被降解,表现出荧光强度增加。
故Ub-cpEGFP的降解受到激酶磷酸化的影响,以及泛素依赖的蛋白酶体活性的影响,据此,通过细胞水平检测荧光强度和Ub-cpEGFP的水平,就可以检测泛素磷酸化及泛素依赖的蛋白酶体降解蛋白质的活性,不仅用于相关的基础研究,还可用于泛素激酶和蛋白酶体激活剂、抑制剂的筛选。
本发明将经典的绿色荧光蛋白(GFP)通过分子克隆,进行环状重排,将原有的N-端和C-端结合,在GFP的N144位点切开获得新的N-端和C-端,并删除N-端的酪氨酸残基和天冬氨酸残基,获得cpEGFP(circular permutation GFP)。研究表明改造后的cpEGFP背景荧光减弱,而且以丝氨酸残基作为新的N末端与泛素(Ub)连接,使探针对泛素的磷酸化响应更加敏感。
进一步地,所述生物探针的氨基酸序列如SEQ ID NO.1所示。该序列中第1-76位为泛素(Ub),其76位的G突变为V,可以防止泛素被去泛素化酶水解;第77-319为cpEGFP,即GFP原本的N-端和C-端通过加入GGTGGSG连接,在GFP的N144断开,形成新的C末端,新的N末端删除YN,以-SH形成新的N末端,新的N末端与泛素的C端进行连接。
上述生物探针的编码序列如SEQ ID NO.2所示。
本发明提供了一种检测泛素-蛋白酶体系统降解活性的试剂盒,包括:包含核苷酸序列如SEQ ID NO.2所示的生物探针编码序列的重组质粒。
所述重组质粒导入细胞内表达出生物荧光探针Ub-cpEGFP,当存在泛素磷酸化物质或抑制泛素依赖的蛋白酶体活性的物质,减少泛素蛋白酶体系统对生物探针的降解,随着生物探针的累积,表现出荧光强度增强的特点。
重组质粒的原始载体可采用本领域细胞转染常用的质粒,如PCDNA3.1质粒。
本发明提供了所述的生物探针在制备检测泛素磷酸化的试剂盒中的应用。当泛素被磷酸化,生物探针表现出荧光强度增强,由此,可用于判断待测化合物是否导致泛素磷酸化。
例如泛素激酶会磷酸化泛素,因此,所述的生物探针可应用于筛选泛素激酶的激活剂或抑制剂。
本发明还提供了所述的生物探针在制备检测泛素依赖的蛋白酶体活性的试剂盒中的应用。当泛素依赖的蛋白酶体活性被抑制,生物探针表现出荧光强度增强,由此,可用于筛选泛素依赖的蛋白酶体的抑制剂或激活剂。
本发明还提供了一种筛选泛素-蛋白酶体系统活性抑制剂或激活剂的方法,所述方法包括以下步骤:
(1)将核苷酸序列如SEQ ID NO.2所示的DNA片段克隆到PCDNA3.1质粒中得到重组质粒;
(2)通过转染将重组质粒导入HEK293细胞中,使细胞表达生物探针Ub-cpEGFP;
(3)筛选抑制剂(包括蛋白酶体直接抑制剂或泛素激酶PINK1激活剂)时,往转染细胞中加入待测化合物,作用3~24h后,收集细胞,检测生物探针的荧光强度,与对照相比,如荧光强度增强,表明待测化合物抑制泛素-蛋白酶体系统活性;
筛选激活剂(包括蛋白酶体直接激活剂或泛素激酶PINK1抑制剂)时,往转染细胞中加入已知的抑制剂以提高荧光本底,或者共转染表达PINK1的重组质粒,增强PINK1的作用,提高荧光本底,再加入待测化合物,作用3~24h后,收集细胞,检测生物探针的荧光强度,与对照相比,如荧光强度减弱,表明待测化合物激活泛素-蛋白酶体系统活性。
步骤(3)中,采用流式细胞仪检测、固定细胞成像、荧光光谱检测、免疫印迹生化检测技术,来检测Ub-cpEGFP的变化。
与现有技术相比,本发明具备的有益效果:
(1)本发明对绿色荧光蛋白GFP进行了环状重排,获得了最适用的cpEGFP,与泛素(Ub)融合,将泛素在收缩态和舒张态的结构变化与cpEGFP关联,通过检测荧光强度变化反映泛素的结构变化;以cpEGFP N末端的-SH作为linker与泛素C末端连接,可以增加泛素被磷酸化后进入收缩态的比例,一方面收缩态的泛素刚好能够与cpEGFP发生相互作用,使N-端的盖子关闭,增强荧光,另一方面,收缩态的比例增加,更加不利于泛素依赖的蛋白酶体的降解。
(2)本发明提供的荧光探针用于细胞水平检测时基本无背景荧光,cpEGFP的荧光较弱,正常情况下,Ub-cpEGFP被泛素依赖的蛋白酶体途径快速降解。
(3)本发明提供的荧光探针使用方便,将探针通过转染,或者建立稳定细胞株,或者基于病毒的转染,就可以进行细胞水平的检测。
(4)本发明提供的荧光探针灵敏度高,在10μM MG132加入后1小时,荧光强度开始增加。
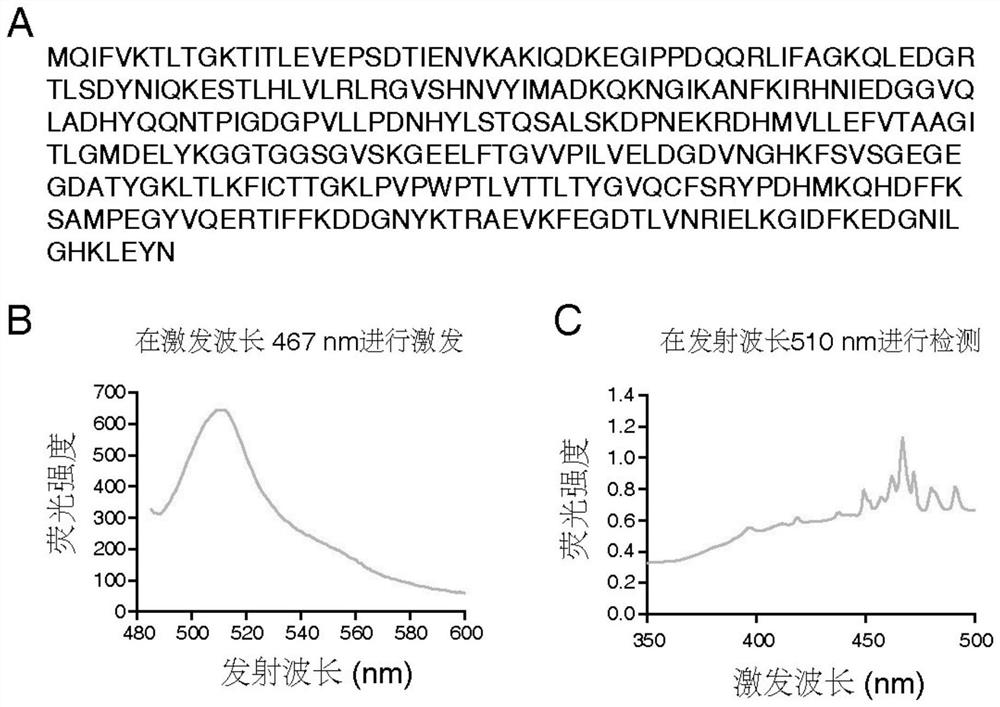
(5)本发明提供的荧光探针其激发、发射波长峰值与绿色荧光蛋白(GFP)基本一致,可采用常规的荧光显微镜、荧光光谱仪检测。
附图说明
图1为本发明中用于检测的Ub-cpEGFP生物探针的序列(A)以及激发(B)和发射光谱(C)。
图2为实施例2中利用生物探针通过流式细胞技术(A)和免疫印迹方法(B)检测MG132对泛素依赖的蛋白酶体降解蛋白质的抑制作用。
图3为实施例3中通过荧光显微镜检测共表达Ub-cpEGFP和泛素激酶PINK1,使探针发光。
图4为对比例1中通过荧光显微镜检测Ub与cpEGFP之间不同连接长度的探针的发光情况。
图5为对比例2中通过荧光显微镜检测Ub与cpEGFP之间不同氨基酸残基连接的探针的发光情况。
具体实施方式
下面将结合具体实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
下述实施例中涉及的质粒、细胞、试剂、药剂均为商品化产品。
实施例1
构建生物荧光探针Ub-cpEGFP
设计生物荧光探针Ub-cpEGFP的氨基酸序列如SEQ ID NO.1所示,其编码序列如SEQ ID NO.2所示。碱基序列委托公司合成,然后通过分子克隆到PCDNA3.1质粒的EcoRI和XhoI多克隆位点之间,得到PCDNA3.1/Ub-cpEGFP质粒。测序鉴定插入序列的正确性。
荧光探针的激发和发射光谱如图1所示。
实施例2
通过流式细胞仪和免疫印迹方法,检测蛋白酶体抑制剂MG132对泛素依赖蛋白酶体活性的抑制作用
a、在HEK293细胞中转染PCDNA3.1/Ub-cpEGFP质粒:将40万HEK293细胞种在6孔板的细胞培养板,24小时后,采用lipo3000脂质体进行转染,使细胞表达Ub-cpEGFP。
b、转染后24小时,加入10μM MG132(蛋白酶体抑制剂),在加入后0,1,2,3,4,5小时,分别通过胰酶消化,1000转/分钟,离心5分钟收集细胞。
c、将收到的细胞用磷酸盐缓冲液重悬,然后用流式细胞仪,检测cpEGFP的荧光强度,计算细胞的平均荧光强度,分析MG132对蛋白酶体的抑制作用。
d、流式检测后,回收细胞,采用细胞裂解试剂盒裂解细胞,SDS凝胶电泳检测,随后采用抗GFP抗体检测Ub-cpEGFP的水平,分析泛素依赖的蛋白酶体系统对Ub-cpEGFP的降解情况。
结果如图2所示,生物探针Ub-cpEGFP,在A图MG132未开始作用的时候,荧光很弱,而10μM MG132在作用1-5小时,就能够时间依赖的显著增加探针的荧光强度;在B图显示,Ub-cpEGFP水平随MG132的作用时间而增加,显示泛素依赖的蛋白酶体系统对Ub-cpEGFP的降解受到MG132的抑制。
实施例3
通过荧光显微镜检测方法,检测蛋白酶体抑制剂MG132或者共表达泛素激酶PINK1抑制泛素依赖蛋白酶体降解探针的作用
a、在HEK293细胞中单独转染PCDNA3.1/Ub-cpEGFP或单独转染PCDNA3.1/Ub-EGFP,或者共转染PCDNA3.1/Ub-cpEGFP和PCDNA3.1/sPINK1两个质粒,或者共转染PCDNA3.1/Ub-EGFP和PCDNA3.1/sPINK1两个质粒:以3万/孔的密度,将HEK293细胞种在底部加圆形盖玻片的24孔细胞培养板,采用脂质体转染的方法。
b、转染24小时后,往单独转染的PCDNA3.1/Ub-cpEGFP或PCDNA3.1/Ub-EGFP的细胞中加入10μM MG132处理5小时。所有细胞采用新鲜配制的4%多聚甲醛固定细胞。
c、采用共聚焦显微镜观察绿色荧光的表达。
结果如图3所示,单独转染两种探针,均可见微弱的绿色荧光,MG132作用5小时,使绿色荧光强度增强,共转染sPINK1也使绿色荧光增强,但PCDNA3.1/Ub-cpEGFP的荧光增强更加明显。
对比例1
本对比例比较了Ub与cpEGFP之间不同的连接长度,采用泛素L67S突变,使所有泛素的结构转变为收缩态,比较Ub-SH-cpEGFP、删除Ub末端两个Gly(即G75和G76)的UbΔ(G75,G76)-SH-cpEGFP、进一步删除-SH-的UbΔ(G75,G76)-cpEGFP。
参照实施例1、2的方法进行质粒构建、细胞转染,通过荧光显微镜检测,结果如图4所示,本发明构建的Ub-SH-cpEGFP探针,融合野生型泛素无明显荧光,融合L67S突变的泛素有很强的荧光。删除Ub末端两个Gly(G75和G76)使融合野生型和突变型的探针均表达强的荧光。进一步删除-SH-以后,融合野生型和突变型的探针均不能发光。
对比例2
本对比例比较了Ub与cpEGFP之间不同的氨基酸连接方式,将-SH-连接换成-LE-连接,构建Ub-LH-cpEGFP。
参照实施例1、2的方法进行质粒构建、细胞转染,通过荧光显微镜检测,结果如图5所示,两种质粒转染HEK293细胞后,均未见荧光,而加入蛋白酶体抑制剂MG132,均有荧光,但是-SH-连接的探针荧光强度更强,-LE-连接的探针荧光强度较弱。
序列表
<110> 浙江大学
<120> 一种用于检测泛素-蛋白酶体系统降解活性的生物探针
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 319
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 1
Met Gln Ile Phe Val Lys Thr Leu Thr Gly Lys Thr Ile Thr Leu Glu
1 5 10 15
Val Glu Pro Ser Asp Thr Ile Glu Asn Val Lys Ala Lys Ile Gln Asp
20 25 30
Lys Glu Gly Ile Pro Pro Asp Gln Gln Arg Leu Ile Phe Ala Gly Lys
35 40 45
Gln Leu Glu Asp Gly Arg Thr Leu Ser Asp Tyr Asn Ile Gln Lys Glu
50 55 60
Ser Thr Leu His Leu Val Leu Arg Leu Arg Gly Val Ser His Asn Val
65 70 75 80
Tyr Ile Met Ala Asp Lys Gln Lys Asn Gly Ile Lys Ala Asn Phe Lys
85 90 95
Ile Arg His Asn Ile Glu Asp Gly Gly Val Gln Leu Ala Asp His Tyr
100 105 110
Gln Gln Asn Thr Pro Ile Gly Asp Gly Pro Val Leu Leu Pro Asp Asn
115 120 125
His Tyr Leu Ser Thr Gln Ser Ala Leu Ser Lys Asp Pro Asn Glu Lys
130 135 140
Arg Asp His Met Val Leu Leu Glu Phe Val Thr Ala Ala Gly Ile Thr
145 150 155 160
Leu Gly Met Asp Glu Leu Tyr Lys Gly Gly Thr Gly Gly Ser Gly Val
165 170 175
Ser Lys Gly Glu Glu Leu Phe Thr Gly Val Val Pro Ile Leu Val Glu
180 185 190
Leu Asp Gly Asp Val Asn Gly His Lys Phe Ser Val Ser Gly Glu Gly
195 200 205
Glu Gly Asp Ala Thr Tyr Gly Lys Leu Thr Leu Lys Phe Ile Cys Thr
210 215 220
Thr Gly Lys Leu Pro Val Pro Trp Pro Thr Leu Val Thr Thr Leu Thr
225 230 235 240
Tyr Gly Val Gln Cys Phe Ser Arg Tyr Pro Asp His Met Lys Gln His
245 250 255
Asp Phe Phe Lys Ser Ala Met Pro Glu Gly Tyr Val Gln Glu Arg Thr
260 265 270
Ile Phe Phe Lys Asp Asp Gly Asn Tyr Lys Thr Arg Ala Glu Val Lys
275 280 285
Phe Glu Gly Asp Thr Leu Val Asn Arg Ile Glu Leu Lys Gly Ile Asp
290 295 300
Phe Lys Glu Asp Gly Asn Ile Leu Gly His Lys Leu Glu Tyr Asn
305 310 315
<210> 2
<211> 960
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
atgcagattt tcgtgaaaac cctgaccggt aaaaccatta ccctggaagt tgaaccgagt 60
gataccattg aaaatgttaa agcaaagatc caggataaag aaggtattcc gccggatcag 120
cagcgtctga tttttgcagg caaacagctg gaagatggtc gcaccctgag tgattataat 180
attcagaaag aaagcaccct gcatctggtt ctgcgcctgc gcggcgtgag ccataatgtg 240
tatattatgg ccgataaaca gaaaaatggc attaaggcca attttaaaat ccgtcataac 300
attgaagacg gcggcgttca gctggcagat cattatcagc agaatacccc gattggcgat 360
ggcccggttc tgctgccgga taatcattat ctgagcaccc agagtgcact gagcaaagat 420
ccgaatgaaa aacgtgatca catggtgctg ctggaatttg ttaccgccgc cggtattacc 480
ctgggcatgg atgaactgta taaaggcggt accggtggta gcggcgtgag caaaggtgaa 540
gaactgttta ccggtgtggt tccgattctg gtggaactgg atggtgacgt gaatggtcat 600
aaattttcag tgagcggcga aggtgaaggc gatgcaacct atggcaaact gaccctgaaa 660
ttcatttgca ccaccggtaa actgccggtt ccgtggccga ccctggttac caccctgacc 720
tatggcgttc agtgctttag ccgttatccg gatcacatga aacagcatga tttctttaaa 780
agcgcaatgc cggaaggtta tgtgcaggaa cgtaccattt tctttaaaga tgatggtaat 840
tacaagaccc gtgccgaagt gaaatttgaa ggcgataccc tggttaatcg cattgaactg 900
aaaggtattg attttaaaga ggatggtaac attctgggcc ataaactgga atataattaa 960
- 一种用于检测泛素-蛋白酶体系统降解活性的生物探针
- 一种用于检测泛素-蛋白酶体系统降解活性的生物探针
