治疗癌症并增强T细胞重定向治疗剂的功效的方法
文献发布时间:2023-06-19 09:52:39
技术领域
本发明公开了治疗癌症并增强T细胞重定向治疗剂的功效的方法。
背景技术
重定向杀伤的T细胞在许多治疗领域中是期望的作用模式。一般来讲,T细胞重定向分子被工程化以具有至少两个抗原结合位点,其中一个位点结合靶细胞上的表面抗原,并且另一个位点结合T细胞表面抗原。在T细胞表面抗原中,TCR蛋白质复合物的人CD3ε亚基一直是重定向T细胞杀伤的最主要目标。在临床前研究和临床研究两者中,各种双特异性抗体形式已显示出介导T细胞重定向(May C等人,Biochem Pharmacol,第84卷:第1105-1112页,2012年;Frankel S R和Baeuerle P A,Curr Opin Chem Biol,第17卷第3期:第385-392页,2013年)。
肿瘤通过产生免疫抑制肿瘤微环境(TME)逃避免疫识别。在TME中,在持续性抗原和炎症的条件下,T细胞耗尽或功能障碍,并且逐渐丧失其效应子功能和增殖能力。功能受损和可用数量的T细胞与介导T细胞重定向杀伤的治疗剂接合可损害治疗剂的抗肿瘤功效。因此,需要增强T细胞功能以实现介导T细胞重定向杀伤的治疗剂的最佳功效。
发明内容
本公开提供了一种治疗受试者的癌症的方法,包括向所述受试者施用治疗有效量的抗CD38抗体和T细胞重定向治疗剂以治疗所述癌症。
本公开还提供了一种杀伤受试者的肿瘤细胞的方法,包括向所述受试者施用抗CD38抗体和在所述肿瘤细胞上结合抗原的T细胞重定向治疗剂达足以杀死所述肿瘤细胞的时间。
本公开提供了一种增强T细胞重定向治疗剂在患有癌症的受试者中的功效的方法,包括向所述受试者施用抗CD38抗体。
本公开还提供了一种治疗受试者的癌症的方法,包括向所述受试者施用治疗有效量的BCMA×CD3双特异性抗体和抗CD38抗体以治疗所述癌症。
本公开还提供了一种治疗受试者的癌症的方法,包括向所述受试者施用治疗有效量的BCMA×CD3双特异性抗体以治疗所述癌症,其中在施用BCMA×CD3双特异性抗体之前,所述受试者已用抗CD38抗体进行治疗。
本公开还提供了一种治疗受试者的癌症的方法,包括向所述受试者施用治疗有效量的BCMA×CD3双特异性抗体以治疗所述癌症,其中所述受试者对于用先前的抗癌治疗剂进行治疗是复发性的或难治性的。
本公开还提供了一种治疗受试者的多发性骨髓瘤的方法,包括向所述受试者施用治疗有效量的BCMA×CD3双特异性抗体和抗CD38抗体以治疗所述多发性骨髓瘤。
本公开还提供了一种治疗受试者的多发性骨髓瘤的方法,包括向所述受试者施用治疗有效量的BCMA×CD3双特异性抗体以治疗所述多发性骨髓瘤,其中在施用所述BCMA×CD3双特异性抗体之前,所述受试者已用抗CD38抗体进行治疗。
本公开还提供了一种治疗受试者的多发性骨髓瘤的方法,包括向所述受试者施用治疗有效量的BCMA×CD3双特异性抗体以治疗所述多发性骨髓瘤,其中所述受试者对于用先前的多发性骨髓瘤治疗剂进行治疗是复发性的或难治性的。
本公开还提供了一种药物组合物,包含BCMA×CD3双特异性抗体和抗CD38抗体,所述BCMA×CD3双特异性抗体包含BCMA结合结构域和CD3结合结构域,所述BCMA结合结构域包含SEQ ID NO:29的VH和SEQ ID NO:30的VL,所述CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL,并且所述抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
本公开还提供了一种治疗受试者的癌症的方法,包括向所述受试者施用治疗有效量的结合GPRC5D的T细胞重定向治疗剂和抗CD38抗体以治疗所述癌症。
本公开还提供了一种治疗受试者的癌症的方法,包括向所述受试者施用治疗有效量的GPRC5D×CD3双特异性抗体以治疗所述癌症,其中所述受试者对于用先前的抗癌治疗剂进行治疗是复发性的或难治性的。
本公开还涉及一种药物组合,包含GPRC5D×CD3双特异性抗体和抗CD38抗体,所述GPRC5D×CD3双特异性抗体包含GPRC5D结合结构域和CD3结合结构域,所述GPRC5D结合结构域包含SEQ ID NO:43的HCDR1、SEQ ID NO:44的HCDR2、SEQ ID NO:45的HCDR3、SEQ ID NO:46的LCDR1、SEQ ID NO:47的LCDR2和SEQ ID NO:48的LCDR3,所述CD3结合结构域包含SEQID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3,并且所述抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
本公开还提供了一种治疗受试者的癌症的方法,包括向所述受试者施用治疗有效量的结合CD19的T细胞重定向治疗剂和抗CD38抗体以治疗所述癌症。
本公开还提供了一种增强结合CD19的T细胞重定向治疗剂在患有癌症的受试者中的功效的方法,包括在施用结合CD19的所述T细胞重定向治疗剂之前向所述受试者施用抗CD38抗体。
本公开还提供了一种药物组合,包含CD19×CD3双特异性抗体和抗CD38抗体,所述CD19×CD3双特异性抗体包含SEQ ID NO:53的博纳吐单抗,所述抗CD38抗体包含SEQ IDNO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ IDNO:10的LCDR2和SEQ ID NO:11的LCDR3。
本发明还提供了一种包含本公开的所述药物组合物的试剂盒。
附图说明
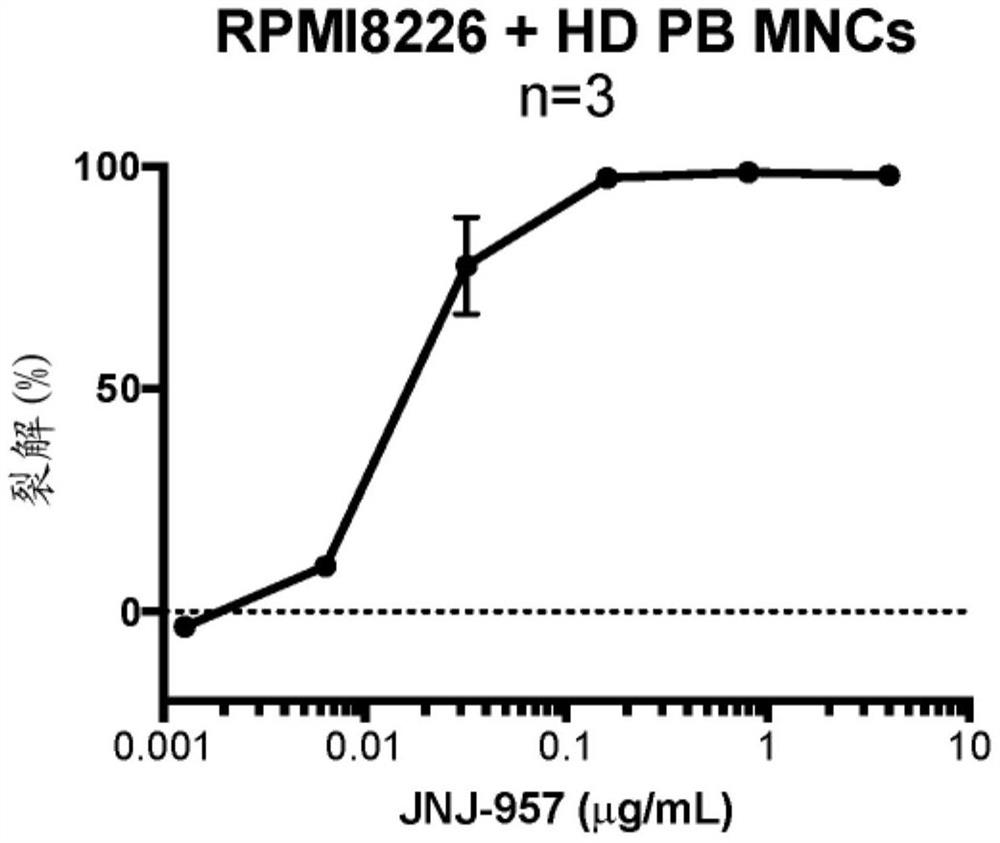
图1示出了JNJ-957介导的多发性骨髓瘤(MM)细胞系RPMI8226的裂解。健康供体外周血单核细胞(PB MNC)用作效应细胞。
图2示出了JNJ-957介导的多发性骨髓瘤(MM)细胞系UM9的裂解。健康供体外周血单核细胞(PB MNC)用作效应细胞。
图3示出了JNJ-957介导的多发性骨髓瘤(MM)细胞系U226的裂解。健康供体外周血单核细胞(PB MNC)用作效应细胞。
图4示出了JNJ-957介导的多发性骨髓瘤(MM)细胞系MM1的裂解。健康供体外周血单核细胞(PB MNC)用作效应细胞。
图5示出了在与健康供体PB MNC一起温育的RPMI 8226细胞的代表性示例(n=2)中,JNJ-957介导的MM细胞裂解伴随着CD4
图6示出了在与健康供体PB MNC一起温育的RPMI 8226细胞的代表性示例(n=2)中,JNJ-957介导的MM细胞裂解伴随着CD4
图7示出了在与健康供体PB MNC一起温育的RPMI 8226细胞的代表性示例(n=2)中,JNJ-957介导的MM细胞裂解伴随着CD4
图8示出了在与健康供体PB MNC一起温育的RPMI 8226细胞的代表性示例(n=2)中,JNJ-957介导的MM细胞裂解伴随着CD8
图9示出了在与健康供体PB MNC一起温育的RPMI 8226细胞的代表性示例(n=2)中,JNJ-957介导的MM细胞裂解伴随着CD8
图10示出了在与健康供体PB MNC一起温育的RPMI 8226细胞的代表性示例(n=2)中,JNJ-957介导的MM细胞裂解伴随着CD8
图11示出了体外达雷木单抗介导的来自新诊断的多发性骨髓瘤(NDMM)和未接受过达雷木单抗治疗的复发性/难治性MM(RRMM)患者的MM细胞的裂解。来自达雷木单抗难治性RRMM患者的多发性骨髓瘤细胞对达雷木单抗介导的裂解具有抗性****P<0.0001
图12示出了JNJ-957介导的浆细胞、T细胞和NK细胞在从新诊断的多发性骨髓瘤患者(NDMM,n=8)获得的完全自体同源骨髓(BM)MNC中的裂解的剂量反应。如图所示,在各种抗体浓度(0.0064μg/mL至4.0μg/mL)下测量裂解百分比。圆形(顶线):浆细胞;方形(中线):T细胞;三角形(底线):NK细胞。
图13示出了JNJ-957介导的浆细胞、T细胞和NK细胞在从多发性骨髓瘤(MM)患者获得的完全自体同源骨髓(BM)MNC中的裂解的剂量反应,该多发性骨髓瘤患者对来那度胺治疗(n=15)是难治性的。如图所示,在各种抗体浓度(0.0064μg/mL至4.0μg/mL)下测量裂解百分比。圆形(顶线):浆细胞;方形(中线):T细胞;三角形(底线):NK细胞。
图14示出了JNJ-957介导的浆细胞、T细胞和NK细胞在从MM患者获得的完全自体同源骨髓(BM)MNC中的裂解的剂量反应,该多发性骨髓瘤患者对用来那度胺和达雷木单抗进行治疗(n=11)是难治性的。如图所示,在各种抗体浓度(0.0064μg/mL至4.0μg/mL)下测量裂解百分比。圆形(顶线):浆细胞;方形(中线):T细胞;三角形(底线):NK细胞。
图15示出了JNJ-957介导的MM细胞裂解伴随着来自NDMM、未接受过达雷木单抗治疗的RRMM(RRMM)和达雷木单抗难治性RRMM(RRMM daraR)患者的BM样本中CD4
图16示出了JNJ-957介导的MM细胞裂解伴随着来自NDMM、未接受过达雷木单抗治疗的RRMM(RRMM)和达雷木单抗难治性RRMM(RRMM daraR)患者的BM样本中CD4
图17示出了双阳性CD25
图18示出了JNJ-957介导的MM细胞裂解伴随着来自NDMM、未接受过达雷木单抗治疗的RRMM(RRMM)和达雷木单抗难治性RRMM(RRMM daraR)患者的BM样本中CD8
图19示出了JNJ-957介导的MM细胞裂解伴随着来自NDMM、未接受过达雷木单抗治疗的RRMM(RRMM)和达雷木单抗难治性RRMM(RRMM daraR)患者的BM样本中CD8
图20示出了双阳性CD25
图21示出了NDMM、未接受过达雷木单抗治疗的RRMM和达雷木单抗难治性RRMM受试者中MM细胞上的BCMA表达水平(平均MFI±SEM)。使用Mann-Whitney U检验来计算指定组之间的P值;*P<0.05;ns:不显著。
图22示出了NDMM、未接受过达雷木单抗治疗的RRMM和达雷木单抗难治性RRMM受试者中MM细胞上的PD-L1表达水平(平均MFI±SEM)。使用Mann-Whitney U检验来计算指定组之间的P值;*P<0.05;ns:不显著。
图23示出了来自NDMM、未接受过达雷木单抗治疗的RRMM和达雷木单抗难治性RRMM的BM MNC中Treg的基线百分比。**p<0.01;ns:不显著。
图24示出了来自NDMM、未接受过达雷木单抗治疗的RRMM和达雷木单抗难治性RRMM的BM MNC中活化T细胞的基线百分比(如HLA-DR阳性所评估)。**p<0.01;ns:不显著。
图25示出了来自NDMM、未接受过达雷木单抗治疗的RRMM和达雷木单抗难治性RRMM的BM MNC中各种T细胞亚群的基线百分比。*p<0.05;**p<0.01;Ns:不显著。TEMRA:CD45RA
图26示出了JNJ-957介导的由自体同源BM MNC介导的来自NDMM患者的多发性骨髓瘤细胞的裂解。针对基线处Treg的频率(低≤50%,高>50%)对样本进行二分。Ns:不显著。
图27示出了JNJ-957介导的由自体同源BM MNC介导的来自未接受过达雷木单抗治疗的RRMM患者的多发性骨髓瘤细胞的裂解。针对基线处Treg的频率(低≤50%,高>50%)对样本进行二分。*p<0.05;**p<0.01;Ns:不显著。
图28示出了JNJ-957介导的由自体同源BM MNC介导的来自达雷木单抗难治性RRMM患者的多发性骨髓瘤细胞的裂解。针对基线处Treg的频率(低≤50%,高>50%)对样本进行二分。*p<0.05;ns:不显著。
图29示出了JNJ-957介导的来自NDMM(n=9)、未接受过达雷木单抗治疗的RRMM(n=18)和达雷木单抗-难治性RRMM(n=13)患者的BM样本的MM细胞在温育48小时之后的裂解。以平均值±SEM示出数据,使用学生t检验来计算P值。**P<0.01
图30示出了当与来自达雷木单抗治疗开始之前(“未接受过Dara治疗的”)的患者的样本进行比较时,JNJ-957介导的从复发性的/难治性的多发性骨髓瘤患者(RRMM)(n=8)获得的骨髓(BM)样本的MM细胞的裂解在来自已接受达雷木单抗(“暴露于Dara”)的相同患者的样本中增强。以平均值±SEM示出数据;使用配对t检验来计算P值。ns:不显著;*P<0.05,**P<0.01。
图31示出了在开始达雷木单抗之前(dara治疗之前)和达雷木单抗难治性疾病发展(暴露于dara)时来自RRMM患者的连续BM抽吸物中的Treg的百分比。ns:不显著。
图32示出了在开始达雷木单抗之前(dara治疗之前)和达雷木单抗难治性疾病发展(暴露于dara)时来自RRMM患者的连续BM抽吸物中的CD4
图33示出了在开始达雷木单抗之前(dara治疗之前)和达雷木单抗难治性疾病发展(暴露于dara)时来自RRMM患者的连续BM抽吸物中的CD8
图34示出了当与来自达雷木单抗治疗开始之前的患者的样本(“未接受过dara治疗的PBMNC”)(n=5)进行比较时,JNJ-957介导的使用患者来源的PB MNC作为效应细胞的RPMI8226多发性骨髓瘤细胞的裂解由来自已接受达雷木单抗的相同患者的PB MNC(“dara期间的PBMNC”)增强。以平均值±SEM示出数据;使用配对t检验来计算P值。ns:不显著;*P<0.05。
图35示出了来自未接受过达雷木单抗治疗的(dara治疗之前)和达雷木单抗难治性(dara治疗期间)RRMM患者的PB-MNC样本中Treg的百分比。
图36示出了来自未接受过达雷木单抗治疗的(dara治疗之前)和达雷木单抗难治性(dara治疗期间)RRMM患者的PB-MNC样本中CD4
图37示出了来自未接受过达雷木单抗治疗的(dara治疗之前)和达雷木单抗难治性(dara治疗期间)RRMM患者的PB-MNC样本中CD8
图38示出了达雷木单抗的添加增强了JNJ-957介导的MM细胞裂解。将来自NDMM(n=8)患者的BM单核细胞(MNC)单独用JNJ-957(0.032μg/mL至0.8μg/mL)治疗或与10μg/mL的达雷木单抗联合治疗48小时。将JNJ-957和达雷木单抗对所观察到的(Obs)MM细胞的裂解水平与预期的(Exp)裂解水平进行比较,其中这些裂解水平是在假设联合效应是通过如方法中所示的累加效应实现的情况下计算的。黑条示出组平均值±SEM。使用配对学生t检验来计算P值。ns:不显著。
图39示出了达雷木单抗的添加增强了JNJ-957介导的MM细胞裂解。将未接受过达雷木单抗治疗的RRMM(n=17)患者的BM MNC单独用JNJ-957(0.032μg/mL至0.8μg/mL)治疗或与10μg/mL的达雷木单抗联合治疗48小时。将JNJ-957和达雷木单抗对所观察到的(Obs)MM细胞的裂解水平与预期的(Exp)裂解水平进行比较,其中这些裂解水平是在假设联合效应是通过如方法中所示的累加效应实现的情况下计算的。黑条示出组平均值±SEM。使用配对学生t检验来计算P值。ns:不显著。
图40示出了达雷木单抗的添加增强了JNJ-957介导的MM细胞的裂解。将达雷木单抗难治性RRMM(n=14)患者的BM MNC单独用JNJ-957(0.032μg/mL至0.8μg/mL)治疗或与10μg/mL的达雷木单抗联合治疗48小时。将JNJ-957和达雷木单抗对所观察到的(O)MM细胞的裂解水平与预期的(E)裂解水平进行比较,其中这些裂解水平是在假设联合效应是通过如方法中所示的累加效应实现的情况下计算的。黑条示出组平均值±SEM。使用配对学生t检验来计算P值。图中JNJ-957被称为JNJ-7957。Dara:达雷木单抗。ns:不显著。
图41示出了博纳吐单抗介导的使用来自11名RRMM患者的连续PB样本作为效应细胞的Raji细胞系的裂解(E:T为10:1),这些样本直接在达雷木单抗治疗开始之前(黑色,底线)和达雷木单抗治疗期间(灰色,顶线)获得;治疗的中值持续时间7个月,范围为2个月至14个月。在存在这些PB-MNC的情况下,将Raji细胞与博纳吐单抗(0.01μg/mL至10μg/mL)一起温育48小时后,进行基于博纳吐单抗的细胞毒性测定。以平均值±SEM表示数据,一式两份进行实验。使用非线性回归分析计算指示组之间的统计显著性(P值)。
图42示出了JNJ-957介导的从六名原代浆细胞白血病(pPCL)患者获得的BM-MNC细胞的浆细胞、T细胞和NK细胞的裂解的剂量反应。如图所示,在各种抗体浓度(0.0064μg/mL至4.0μg/mL)下测量裂解百分比。顶线:浆细胞;底线:T细胞和NK细胞的重叠线。图中JNJ-957被称为JNJ-7957。
图43示出了抗GPRC5D×CD3抗体介导的使用来自11名RRMM患者的连续PB样本作为效应细胞的MM细胞系的裂解(E:T为10:1),这些样本直接在达雷木单抗治疗开始之前(底线)和达雷木单抗治疗期间(顶线)获得;治疗的中值持续时间7个月,范围为2个月至14个月。在存在这些PB-MNC的情况下,将Raji细胞与博纳吐单抗(0.01μg/mL至10μg/mL)一起温育48小时后,进行基于博纳吐单抗的细胞毒性测定。以平均值±SEM表示数据,一式两份进行实验。
图44示出了达雷木单抗的添加是抗GPRC5D×CD3双特异性抗体(JNJ-7564)介导的MM细胞裂解的添加剂。将未接受过达雷木单抗治疗的RRMM(n=17)患者的BM MNC单独用抗GPRC5D×CD3双特异性抗体(0.00128μg/mL至0.8μg/mL)治疗或与0.1μg/mL的达雷木单抗联合治疗48小时。将抗GPRC5D×CD3双特异性抗体和达雷木单抗对所观察到的(O)MM细胞的裂解水平与预期的(E)裂解水平进行比较,其中这些裂解水平是在假设联合效应是通过如方法中所示的累加效应实现的情况下计算的。黑条示出组平均值±SEM。使用配对学生t检验来计算P值。ns:不显著。Dara:达雷木单抗。
具体实施方式
结合形成本公开一部分的附图,并参考以下具体实施方式,可更容易地理解本发明所公开的方法。应当理解,本发明所公开的方法不限于本文所描述和/或示出的具体方法,并且本文所用的术语仅用于以举例方式描述具体实施方案,并不旨在限制受权利要求书保护的方法。本文引用的所有专利、公布的专利申请和出版物均以引用方式并入本文,如同在本文中进行了充分阐述。
如本文所用,单数形式“一个”、“一种”和“该”包括复数形式。
与说明书的各方面相关的各种术语在说明书和权利要求书中通篇使用。除非另外指明,否则此类术语被赋予本领域的普通含义。其它具体定义的术语应按照与本文所提供的定义相符的方式理解。
“约”当用于参考数值范围、临界值或特定值时意指处于如本领域的普通技术人员所确定的特定值的可接受误差范围之内,其将部分取决于该值是如何测量或确定的,即测量系统的限制。在测定、结果或实施方案的上下文中,除非实施例或说明书其他地方内另有明确说明,否则“约”意指在根据本领域惯例的一个标准偏差之内、或多至5%的范围(无论哪个更大)。
“抗体”广义上意指并包括免疫球蛋白分子,具体包括单克隆抗体(包括鼠科动物单克隆抗体、人单克隆抗体、人源化单克隆抗体和嵌合单克隆抗体),抗原结合片段,多特异性抗体(诸如双特异性抗体、三特异性抗体、四特异性抗体等),二聚、四聚或多聚抗体,单链抗体,结构域抗体以及包含具有所需特异性的抗原结合位点的免疫球蛋白分子的任何其他经修饰构型。“全长抗体”包含由二硫键互连的两条重链(HC)与两条轻链(LC)以及它们的多聚体(例如IgM)。每条重链由重链可变区(VH)和重链恒定区(由结构域CH1、铰链、CH2和CH3构成)构成。每条轻链由轻链可变区(VL)和轻链恒定区(CL)构成。VH和VL区可进一步细分为超变区,称为互补决定区(CDR),散步有框架区(FR)。各个VH和VL包含三个CDR和四个FR片段,并按以下顺序从氨基端至羧基端排列:FR1、CDR1、FR2、CDR2、FR3、CDR3和FR4。免疫球蛋白可根据重链恒定域氨基酸序列被指定为五种主要种类,即IgA、IgD、IgE、IgG和IgM。IgA和IgG进一步亚分类为同种型IgA1、IgA2、IgG1、IgG2、IgG3和IgG4。基于其恒定结构域的氨基酸序列,可将任何脊椎物种的抗体轻链指定为两种完全不同的类型即κ和λ中的一种。
“抗原结合片段”或“抗原结合结构域”是指免疫球蛋白分子的结合抗原的一部分。抗原结合片段可以是合成的、可通过酶促方法获得的或经遗传工程化的多肽,包括VH、VL、VH和VL、Fab、F(ab')2、Fd和Fv片段,由一个VH域或一个VL域组成的域抗体(dAb),鲨可变IgNAR域,骆驼化VH域,由模仿抗体的CDR的氨基酸残基组成的最小识别单元诸如FR3-CDR3-FR4部分、HCDR1、HCDR2和/或HCDR3和LCDR1、LCDR2和/或LCDR3。VH和VL域可经由合成接头连接在一起以形成各种类型的单链抗体设计,其中在VH和VL域由单独的单链抗体构建体表达的情况下,VH/VL域可在分子内或分子间配对,以形成单价抗原结合位点,诸如单链Fv(scFv)或双价抗体;例如在国际专利公布WO1998/44001、WO1988/01649、WO1994/13804和WO1992/01047中所描述的。
“BCMA”是指人B细胞成熟抗原,也称为CD269或TNFRSF17(UniProt Q02223)。BCMA的胞外结构域涵盖Q02223的残基1-54。人BCMA包含SEQ ID NO:2的氨基酸序列。
MLQMAGQCSQNEYFDSLLHACIPCQLRCSSNTPPLTCQRYCNASVTNSVKGTNAILWTCLGLSLIISLAVFVLMFLLRKINSEPLKDEFKNTGSGLLGMANIDLEKSRTGDEIILPRGLEYTVEECTCEDCIKSKPKVDSDHCFPLPAMEEGATILVTTKTNDYCKSLPAALSATEIEKSISAR
“双特异性”是指特异性结合两个不同抗原或同一抗原内的两个不同表位的抗体。双特异性抗体可能对其他相关的抗原具有交叉反应性,例如,对来自其他物种(同源)(诸如人或猴,例如食蟹猕猴(Macaca cynomolgus)(cynomolgus、cyno)、黑猩猩(Pantroglodytes)的相同抗原具有交叉反应性,或者可结合两个或更多个抗原之间所共享的表位。
“癌症”是指广泛的各种疾病,其特征在于身体中异常细胞的不受控制的生长。未受控制的细胞分裂和生长导致形成侵入相邻组织的恶性肿瘤,并且还可通过淋巴系统或血流转移到身体的远侧部分。“癌症”或“癌症组织”可包括肿瘤。
“CD123”是指具有SEQ ID NO:57中所示氨基酸序列的人白介素-3受体亚基α(IR3RA)。胞外结构域或CD123跨越SEQ ID NO:57的残基19-305。
MVLLWLTLLLIALPCLLQTKEDPNPPITNLRMKAKAQQLTWDLNRNVTDIECVKDADYSMPAVNNSYCQFGAISLCEVTNYTVRVANPPFSTWILFPENSGKPWAGAENLTCWIHDVDFLSCSWAVGPGAPADVQYDLYLNVANRRQQYECLHYKTDAQGTRIGCRFDDISRLSSGSQSSHILVRGRSAAFGIPCTDKFVVFSQIEILTPPNMTAKCNKTHSFMHWKMRSHFNRKFRYELQIQKRMQPVITEQVRDRTSFQLLNPGTYTVQIRARERVYEFLSAWSTPQRFECDQEEGANTRAWRTSLLIALGTLLALVCVFVICRRYLVMQRLFPRIPHMKDPIGDSFQNDKLVVWEAGKAGLEECLVTEVQVVQKT
“CD19”是指具有SEQ ID NO:58的氨基酸序列的人B-淋巴细胞抗原CD19。CD19的胞外结构域跨越SEQ ID NO:58的残基20-291。
MPPPRLLFFLLFLTPMEVRPEEPLVVKVEEGDNAVLQCLKGTSDGPTQQLTWSRESPLKPFLKLSLGLPGLGIHMRPLAIWLFIFNVSQQMGGFYLCQPGPPSEKAWQPGWTVNVEGSGELFRWNVSDLGGLGCGLKNRSSEGPSSPSGKLMSPKLYVWAKDRPEIWEGEPPCLPPRDSLNQSLSQDLTMAPGSTLWLSCGVPPDSVSRGPLSWTHVHPKGPKSLLSLELKDDRPARDMWVMETGLLLPRATAQDAGKYYCHRGNLTMSFHLEITARPVLWHWLLRTGGWKVSAVTLAYLIFCLCSLVGILHLQRALVLRRKRKRMTDPTRRFFKVTPPPGSGPQNQYGNVLSLPTPTSGLGRAQRWAAGLGGTAPSYGNPSSDVQADGALGSRSPPGVGPEEEEGEGYEEPDSEEDSEFYENDSNLGQDQLSQDGSGYENPEDEPLGPEDEDSFSNAESYENEDEELTQPVARTMDFLSPHGSAWDPSREATSLGSQSYEDMRGILYAAPQLRSIRGQPGPNHEEDADSYENMDNPDGPDPAWGGGGRMGTWSTR
“CD3”是指作为多分子T细胞受体(TCR)复合物的一部分在T细胞上表达并且由同源二聚体或异源二聚体组成的人抗原,该同源二聚体或异源二聚体由两个或四个受体链:CD3ε、CD3δ、CD3ζ和CD3γ的缔合形成。人CD3ε包含SEQ ID NO:3的氨基酸序列。SEQ ID NO:22示出了CD3ε的胞外结构域。
MQSGTHWRVLGLCLLSVGVWGQDGNEEMGGITQTPYKVSISGTTVILTCPQYPGSEILWQHNDKNIGGDEDDKNIGSDEDHLSLKEFSELEQSGYYVCYPRGSKPEDANFYLYLRARVCENCMEMDVMSVATIVIVDICITGGLLLLVYYWSKNRKAKAKPVTRGAGAGGRQRGQNKERPPPVPNPDYEPIRKGQRDLYSGLNQRRI
DGNEEMGGITQTPYKVSISGTTVILTCPQYPGSEILWQHNDKNIGGDEDDKNIGSDEDHLSLKEFSELEQSGYYVCYPRGSKPEDANFYLYLRARVCENCMEMD
“CD33”是指具有SEQ ID NO:97的氨基酸序列的髓样细胞表面抗原CD33。CD33的胞外结构域跨越SEQ ID NO:97的残基18-259。
MPLLLLLPLLWAGALAMDPNFWLQVQESVTVQEGLCVLVPCTFFHPIPYYDKNSPVHGYWFREGAIISRDSPVATNKLDQEVQEETQGRFRLLGDPSRNNCSLSIVDARRRDNGSYFFRMERGSTKYSYKSPQLSVHVTDLTHRPKILIPGTLEPGHSKNLTCSVSWACEQGTPPIFSWLSAAPTSLGPRTTHSSVLIITPRPQDHGTNLTCQVKFAGAGVTTERTIQLNVTYVPQNPTTGIFPGDGSGKQETRAGVVHGAIGGAGVTALLALCLCLIFFIVKTHRRKAARTAVGRNDTHPTTGSASPKHQKKSKLHGPTETSSCSGAAPTVEMDEELHYASLNFHGMNPSKDTSTEYSEVRTQ
“CD38”是指人CD38蛋白(UniProt登记号P28907)(同义词:ADP-核糖基环化酶1、cADPr水解酶1、环状ADP-核糖水解酶1)。人CD38具有如SEQ ID NO:1所示的氨基酸序列。CD38是单通II型跨膜蛋白,其具有代表胞质结构域的第1-21位氨基酸残基、代表跨膜结构域的第22-42位氨基酸残基、以及代表胞外结构域的第43-300位残基。
MANCEFSPVSGDKPCCRLSRRAQLCLGVSILVLILVVVLAVVVPRWRQQWSGPGTTKRFPETVLARCVKYTEIHPEMRHVDCQSVWDAFKGAFISKHPCNITEEDYQPLMKLGTQTVPCNKILLWSRIKDLAHQFTQVQRDMFTLEDTLLGYLADDLTWCGEFNTSKINYQSCPDWRKDCSNNPVSVFWKTVSRRFAEAACDVVHVMLNGSRSKIFDKNSTFGSVEVHNLQPEKVQTLEAWVIHGGREDSRDLCQDPTIKELESIISKRNIQFSCKNIYRPDKFLQCVKNPEDSSCTSEI
“CH3区”或“CH3结构域”是指免疫球蛋白的CH3区。人IgG1抗体的CH3区对应于氨基酸残基341-446。然而,CH3区也可以是如本文所述的其他抗体同种型中的任一种。
“嵌合抗原受体”或“CAR”是指将配体或抗原特异性移植到T细胞(例如幼稚T细胞、中央记忆型T细胞、效应记忆型T细胞或它们的组合)上的工程化T细胞受体。CAR也称为人造T细胞受体、嵌合T细胞受体或嵌合免疫受体。CAR包含能够与抗原结合的胞外结构域、跨膜结构域和至少一个胞内结构域。CAR胞内结构域包含已知用作传递信号以引起细胞中生物过程活化或抑制的结构域的多肽。跨膜结构域包含已知跨越细胞膜并且可起到连接胞外结构域和信号结构域的作用的任何肽或多肽。嵌合抗原受体可任选地包含铰链结构域,该铰链结构域充当胞外结构域和跨膜结构域之间的接头。
“联合”意指将两种或更多种治疗剂以混合物一起、作为单一药剂同时或作为单一药剂以任何顺序依次施用给受试者。
“互补决定区”(CDR)是结合抗原的抗体区域。CDR可使用各种描绘来定义,诸如Kabat(Wu等人,JExp Med第132卷:第211-250页,1970年)(Kabat等人,“Sequences ofProteins of Immunological Interest”,第5版,Public Health Service,NationalInstitutes of Health,Bethesda,Md.,1991年)、Chothia(Chothia等人,J Mol Biol第196卷:第901-917页,1987年)、IMGT(Lefranc等人,Dev Comp Immunol,第27卷,第55-77页,2003年)和AbM(Martin和Thornton,J Bmol Biol,第263卷:第800-815页,1996年)。描述了各种描绘和可变区编号之间的对应关系(参见例如Lefranc等人,Dev Comp Immunol,第27卷:第55-77页,2003年;Honegger和Pluckthun,JMol Biol,第309卷:第657-670页,2001年;国际免疫遗传学(IMGT)数据库;Web资源,http://www_imgt_org)。可用程序(诸如UCLBusiness PLC的abYsis)可用于描绘CDR。除非说明书中另有明确地说明,否则如本文所用,术语“CDR”、“HCDR1”、“HCDR2”、“HCDR3”、“LCDR1”、“LCDR2”和“LCDR3”包括由任何上述方法(Kabat、Chothia、IMGT或AbM)定义的CDR。
术语“包含”旨在包括由术语“基本上由……组成”和“由……组成”涵盖的示例;类似地,术语“基本上由……组成”旨在包括由术语“由……组成”涵盖的示例。除非上下文另外清楚要求,否则在整个说明书和权利要求书中,应将词语“包含”、“包括”等理解为具有包含意义,而不是排他性或穷举性意义;也就是说,“包括但不仅限于”的意义。
“Fcγ受体”(FcγR)是指熟知的FcγRI、FcγRIIa、FcγRIIb或FcγRIII。活化FcγR包括FcγRI、FcγRIIa和FcγRIII。
“GPRC5D”是指具有SEQ ID NO:98中所示氨基酸序列的人G蛋白偶联受体家族C组5成员D。
MYKDCIESTGDYFLLCDAEGPWGIILESLAILGIVVTILLLLAFLFLMRKIQDCSQWNVLPTQLLFLLSVLGLFGLAFAFIIELNQQTAPVRYFLFGVLFALCFSCLLAHASNLVKLVRGCVSFSWTTILCIAIGCSLLQIIIATEYVTLIMTRGMMFVNMTPCQLNVDFVVLLVYVLFLMALTFFVSKATFCGPCENWKQHGRLIFITVLFSIIIWVVWISMLLRGNPQFQRQPQWDDPVVCIALVTNAWVFLLLYIVPELCILYRSCRQECPLQGNACPVTAYQHSFQVENQELSRARDSDGAEEDVALTSYGTPIQPQTVDPTQECFIPQAKLSPQQDAGGV
“人抗体”是指当施用于人受试者时被优化以具有最小限度的免疫应答的抗体。人抗体的可变区来源于人免疫球蛋白序列。如果人抗体包含恒定区或恒定区的一部分,则该恒定区也来源于人免疫球蛋白序列。如果人抗体的可变区来源于使用人种系免疫球蛋白或重排免疫球蛋白基因的系统,则人抗体包含“来源于”人起源序列的重链可变区和轻链可变区。此类示例性系统是在噬菌体上展示的人免疫球蛋白基因文库,以及转基因非人动物,诸如携带人免疫球蛋白基因座的小鼠或大鼠。由于用于获得人抗体和人免疫球蛋白基因座的系统之间的差异、体细胞突变的引入、有意将置换引入框架或CDR,因此当与在人中表达的免疫球蛋白进行比较时“人抗体”通常含有氨基酸差异。通常,“人抗体”的氨基酸序列与由人种系免疫球蛋白基因或重排免疫球蛋白基因编码的氨基酸序列具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。在一些情况下,“人抗体”可包含来源于人框架序列分析的共有框架序列(例如在Knappik等人,(2000年)J Mol Biol,第296卷:第57-86页中所述);或结合到在噬菌体上展示的人免疫球蛋白基因文库中的合成HCDR3(例如Shi等人,(2010年)J MolBiol,第397卷:第385-396页中所述和国际专利公布WO2009/085462中所述)。“人抗体”的定义中不包括至少一个CDR来源于非人物种的抗体。
“人源化抗体”是指其中至少一个CDR来源于非人物种并且至少一个框架来源于人免疫球蛋白序列的抗体。人源化抗体在框架中可包含置换,使得该框架可能不是表达的人免疫球蛋白或人免疫球蛋白种系基因序列的精确拷贝。
“分离的”是指已经与分子产生于其中的系统(诸如重组细胞)中的其他组分基本上分离和/或从其中纯化出来的分子(诸如合成的多核苷酸或蛋白质,诸如抗体)的同质群体,以及已经受至少一个纯化或分离步骤的蛋白质。“分离的抗体”是指基本上不含其他细胞材料和/或化学物质的抗体,并且涵盖分离至更高纯度,诸如80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%纯度的抗体。
“单克隆抗体”是指从抗体分子的基本上同质群体获得的抗体,即包含该群体的各个抗体是相同的,不同的是可能的熟知改变,诸如从抗体重链移除C末端赖氨酸或翻译后修饰诸如氨基酸异构化或脱酰胺基、甲硫氨酸氧化或天冬酰胺或谷氨酰胺脱酰胺基。单克隆抗体通常结合一个抗原表位。双特异性单克隆抗体结合两个不同的抗原表位。单克隆抗体可在抗体群内具有异质糖基化。单克隆抗体可以是单特异性的或多特异性的,诸如双特异性的、单价的、二价的或多价的。
“突变”是指当与参考序列进行比较时,多肽或多核苷酸序列中工程化或天然存在的改变。该改变可以是一个或多个氨基酸或多核苷酸的置换、插入或缺失。
“非固定组合”是指在非特定间隔时间限制下T细胞重定向治疗剂和抗CD38抗体同时、并行或顺序地作为独立实体施用的独立药物组合物,其中此类施用在受试者体内提供有效水平的两种化合物。
“多特异性”是指特异性结合至少两个不同抗原或同一抗原内的至少两个不同表位的抗体。多特异性抗体可结合例如二个、三个、四个或五个不同抗原或同一抗原内的不同表位。
“药物组合物”是指包含活性成分和药学上可接受的载体的组合物。
“药学上可接受的载体”或“赋形剂”是指药物组合物中除活性成分之外的成分,该成分对受试者无毒。
“费城染色体”或“Ph”是指熟知的9号和22号染色体之间的染色体易位,从而导致具有组成型活性的酪氨酸激酶活性的致癌BCR-ABL基因融合。易位导致来自染色体22q11的BCR基因的一部分与来自染色体9q34的ABL基因的一部分融合,并根据人类细胞遗传学命名国际体制(International System for Human Cytogenetic Nomenclature)(ISCN)被命名为t(9;22)(q34;q11)。根据融合的精确位置,所得融合蛋白的分子量可在185kDa至210kDa的范围内。“费城染色体”是指由于(9;22)(q34;q11)易位而形成的所有BCR-ABL融合蛋白。
“PSMA”是指具有SEQ ID NO:99的氨基酸序列的人前列腺特异性膜抗原。胞外结构域跨越SEQ ID NO:99的44至750位残基。
MWNLLHETDSAVATARRPRWLCAGALVLAGGFFLLGFLFGWFIKSSNEATNITPKHNMKAFLDELKAENIKKFLYNFTQIPHLAGTEQNFQLAKQIQSQWKEFGLDSVELAHYDVLLSYPNKTHPNYISIINEDGNEIFNTSLFEPPPPGYENVSDIVPPFSAFSPQGMPEGDLVYVNYARTEDFFKLERDMKINCSGKIVIARYGKVFRGNKVKNAQLAGAKGVILYSDPADYFAPGVKSYPDGWNLPGGGVQRGNILNLNGAGDPLTPGYPANEYAYRRGIAEAVGLPSIPVHPIGYYDAQKLLEKMGGSAPPDSSWRGSLKVPYNVGPGFTGNFSTQKVKMHIHSTNEVTRIYNVIGTLRGAVEPDRYVILGGHRDSWVFGGIDPQSGAAVVHEIVRSFGTLKKEGWRPRRTILFASWDAEEFGLLGSTEWAEENSRLLQERGVAYINADSSIEGNYTLRVDCTPLMYSLVHNLTKELKSPDEGFEGKSLYESWTKKSPSPEFSGMPRISKLGSGNDFEVFFQRLGIASGRARYTKNWETNKFSGYPLYHSVYETYELVEKFYDPMFKYHLTVAQVRGGMVFELANSIVLPFDCRDYAVVLRKYADKIYSISMKHPQEMKTYSVSFDSLFSAVKNFTEIASKFSERLQDFDKSNPIVLRMMNDQLMFLERAFIDPLGLPDRPFYRHVIYAPSSHNKYAGESFPGIYDALFDIESKVDPSKAWGEVKRQIYVAAFTVQAAAETLSEVA
“重组体”是指当将来自不同来源的片段接合以产生重组DNA、抗体或蛋白质时,通过重组手段制备、表达、产生或分离的DNA、抗体和其他蛋白质。
“降低”或“降低的”是指当与对照分子进行比较时,测试分子的一种或多种功能降低,或者当与一个或多个对照分子进行比较时,测试分子的组合功能降低。可测量的示例性功能是肿瘤细胞杀伤、T细胞活化、相对或绝对T细胞数量、Fc介导的效应子功能(例如ADCC、CDC和/或ADCP)或与Fcγ受体(FcγR)或FcRn的结合。“降低的”可以是约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或更大的降低,或具有统计意义上显著性的降低。
“rHuPh20”是指具有SEQ ID NO:105的氨基酸序列的重组人透明质酸酶(hyalurodinase),该重组人透明质酸酶是在国际专利公布WO2004/078140中所述的重组透明质酸酶(
MGVLKFKHIFFRSFVKSSGVSQIVFTFLLIPCCLTLNFRAPPVIPNVPFLWAWNAPSEFCLGKFDEPLDMSLFSFIGSPRINATGQGVTIFYVDRLGYYPYIDSITGVTVNGGIPQKISLQDHLDKAKKDITFYMPVDNLGMAVIDWEEWRPTWARNWKPKDVYKNRSIELVQQQNVQLSLTEATEKAKQEFEKAGKDFLVETIKLGKLLRPNHLWGYYLFPDCYNHHYKKPGYNGSCFNVEIKRNDDLSWLWNESTALYPSIYLNTQQSPVAATLYVRNRVREAIRVSKIPDAKSPLPVFAYTRIVFTDQVLKFLSQDELVYTFGETVALGASGIVIWGTLSIMRSMKSCLLLDNYMETILNPYIINVTLAAKMCSQVLCQEQGVCIRKNWNSSDYLHLNPDNFAIQLEKGGKFTVRGKPTLEDLEQFSEKFYCSCYSTLSCKEKADVKDTDAVDVCIADGVCIDAFLKPPMETEEPQIFYNASPSTLSATMFIVSILFLIISSVASL
“难治性”是指不能接受外科手术干预并且最初对治疗无响应的癌症。
“复发性”是指对治疗有应答但随后又复发的癌症。
“受试者”包括任何人或非人动物。“非人动物”包括所有的脊椎动物,例如哺乳动物和非哺乳动物,诸如非人灵长类动物、绵羊、狗、猫、马、牛、鸡、两栖动物、爬行动物等。除非另外指出,否则术语“患者”或“受试者”可互换使用。
“T细胞重定向治疗剂”是指包含两个或更多个结合区的分子,其中结合区中的一个结合区特异性结合靶细胞或组织上的细胞表面抗原(诸如肿瘤相关抗原),并且其中分子的第二结合区特异性结合T细胞抗原(诸如CD3)。这种双重/多靶结合能力募集T细胞到靶细胞或组织,从而根除靶细胞或组织。
“TMEFF2”是指具有EGF样和两个卵泡抑素样结构域2的人跨膜蛋白,也称为脑肿瘤抑癌蛋白2。全长人TMEFF2的氨基酸序列示出在SEQ ID NO:101中。TMEFF2的胞外结构域跨越SEQ ID NO:101的残基40-374。
MVLWESPRQCSSWTLCEGFCWLLLLPVMLLIVARPVKLAAFPTSLSDCQTPTGWNCSGYDDRENDLFLCDTNTCKFDGECLRIGDTVTCVCQFKCNNDYVPVCGSNGESYQNECYLRQAACKQQSEILVVSEGSCATDAGSGSGDGVHEGSGETSQKETSTCDICQFGAECDEDAEDVWCVCNIDCSQTNFNPLCASDGKSYDNACQIKEASCQKQEKIEVMSLGRCQDNTTTTTKSEDGHYARTDYAENANKLEESAREHHIPCPEHYNGFCMHGKCEHSINMQEPSCRCDAGYTGQHCEKKDYSVLYVVPGPVRFQYVLIAAVIGTIQIAVICVVVLCITRKCPRSNRIHRQKQNTGHYSSDNTTRASTRLI
“治疗有效量”是指在所需剂量和时间段有效实现期望的治疗结果的量。治疗有效量可根据以下因素变化:诸如个体的疾病状态、年龄、性别和体重,以及治疗剂或治疗剂组合在个体中引发期望的应答的能力。有效的治疗剂或治疗剂的组合的示例性指标包括例如改善患者的健康。
“治疗”是指治疗性治疗以及预防性或防御性措施两者,其中目标是防止或减缓(减轻)不期望的生理变化或障碍。有益或期望的临床结果包括症状的减轻、疾病程度的减弱、疾病的稳定(即,未恶化)状态、疾病进展的延迟或减慢、疾病状态的改善或缓和,以及缓解(不论是部分缓解还是完全缓解),不论是可检测的还是不可检测的。“治疗”也可意指与受检者未接受治疗时的预期生存期相比延长生存期。需要治疗的个体包括已患有病症或障碍的个体以及易患病症或障碍的个体或者要预防病症或障碍的个体。
“肿瘤细胞”或“癌细胞”是指在体内、离体或组织培养物中的癌性、癌前或转化的细胞,其具有自发或诱导的表型变化。这些变化未必涉及新遗传物质的摄取。然而转化可由感染转化病毒以及结合新基因组核酸、摄取外源核酸而发生,或者其也可自发地发生或在暴露于致癌物之后发生,从而使内源基因突变。转化/癌症示例为合适的动物宿主(诸如裸小鼠等)中体外、体内和离体的形态变化、细胞永生、异常生长控制、病灶形成、增殖、恶性肿瘤、肿瘤特异性标记物水平的调整、侵入、肿瘤生长。
除非另有明确说明,否则在整个说明书中,抗体恒定区中的氨基酸残基根据EU索引编号,如Kabat等人,Sequences of Proteins of Immunological Interest,第5版Public Health Service,National Institutes of Health,Bethesda,MD.(1991)中有所描述。抗体恒定链编号可在例如ImMunoGeneTics网站、IMGT Scientific图表的IMGT Web资源中找到。
CH3区中的置换表示为第一重链的第一CH3结构域中的修饰位置/第二重链的第二CH3结构域中的修饰位置。例如,F405L/K409R是指第一CH3区中的F405L突变和第二CH3区中的K09R突变。L351Y_F405A_Y407V/T394W是指第一CH3区中的L351Y、F40FA和Y407V突变和第二CH3区中的T394W突变。D399FHKRQ/K409AGRH是指其中D399可被F、H、K、R或Q取代并且K409可被A、G、R或H取代的突变。
本文使用常规的单字母氨基酸代码和三字母氨基酸代码,如表1中所示。
本发明至少部分地基于以下发现:治疗剂JNJ-957或GPRC5D×CD3抗体和抗CD38抗体
CD38是多功能蛋白,其功能表现为受体介导的粘附和信号传导,以及经由其胞外酶活性介导钙动员,催化环状ADP核糖(cADPR)和ADPR的形成。CD38介导细胞因子的分泌以及淋巴细胞的活化和增殖(Funaro等人,J Immunol第145卷:第2390-2396页,1990年;Terhorst等人,Cell,第771-780页,1981年;Guse等人,Nature,第398卷:第70-73页,1999年)。CD38还经由其NAD糖水解酶活性来调节胞外NAD
本公开提供了一种治疗受试者的癌症的方法,包括向受试者施用治疗有效量的抗CD38抗体和T细胞重定向治疗剂以治疗癌症。
本公开还提供了一种杀伤受试者的肿瘤细胞的方法,包括向受试者施用抗CD38抗体和在肿瘤细胞上结合抗原的T细胞重定向治疗剂达足以杀死肿瘤细胞的时间。
本公开还提供了一种增强T细胞重定向治疗剂在患有癌症的受试者中的功效的方法,包括向受试者施用抗CD38抗体。
在一些实施方案中,在施用T细胞重定向治疗剂之前施用抗CD38抗体。
可在施用抗CD38抗体之前一天、两天、三天、四天、五天、六天、一周、两周、三周、一个月、五周、六周、七周、两个月、三个月、四个月、五个月、六个月或更长时间施用T细胞重定向治疗剂。
在一些实施方案中,T细胞重定向治疗剂结合肿瘤细胞上的抗原。
在一些实施方案中,肿瘤细胞上的抗原是BCMA、GPRC5D、CD33、CD123、CD19、PSMA、TMEFF2、CD20、CD10、CD21、CD22、CD25、CD30、CD34、CD37、CD44v6、CD45、CD52、CD133、ROR1、B7-H6、B7-H3、HM1.24、SLAMF7、Fms样酪氨酸激酶3(FLT-3、CD135)、硫酸软骨素蛋白聚糖4(CSPG4、黑素瘤相关的硫酸软骨素蛋白聚糖)、表皮生长因子受体(EGFR)、Her2、Her3、IGFR、IL3R、成纤维细胞活化蛋白(FAP)、CDCP1、Derlin1、腱生蛋白、卷曲蛋白1-10、VEGFR2(KDR/FLK1)、VEGFR3(FLT4、CD309)、PDGFR-α(CD140a)、PDGFR-β(CD140b)、内皮糖蛋白、CLEC14、Tem1-8或Tie2。肿瘤细胞上的另外的示例性抗原包括A33、CAMPATH-1(CDw52)、癌胚抗原(CEA)、碳酸酐酶IX(MN/CA IX)、de2-7、EGFRvIII、EpCAM、Ep-CAM、叶酸结合蛋白、G250、c-Kit(CD117)、CSF1R(CD115)、HLA-DR、IGFR、IL-2受体、IL3R、MCSP(黑素瘤相关的细胞表面硫酸软骨素蛋白聚糖)、Muc-1、前列腺干细胞抗原(PSCA)、前列腺特异性抗原(PSA)、hK2、TAG-72或肿瘤细胞新抗原。
在一些实施方案中,T细胞重定向治疗剂结合BCMA、GPRC5D、CD33、CD123、CD19、PSMA、TMEFF2、CD20、CD22、CD25、CD52、ROR1、HM1.24、CD38或SLAMF7。
在一些实施方案中,T细胞重定向治疗剂结合CD3ε(CD3ε)。
在一些实施方案中,T细胞重定向治疗剂结合CD3。
在一些实施方案中,T细胞重定向治疗剂结合CD8、KI2L4、NKG2E、NKG2D、NKG2F、BTNL3、CD186、BTNL8、PD-1、CD195或NKG2C。当与CD3进行比较时,这些抗原对CD8
在一些实施方案中,T细胞重定向治疗剂包含CD3结合结构域,包含:
SEQ ID NO:33的重链互补决定区1(HCDR1)、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的轻链互补决定区1(LCDR1)、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3;
SEQ ID NO:39的重链可变区(VH)和SEQ ID NO:40的轻链可变区(VL);
SEQ ID NO:74的HCDR1、SEQ ID NO:75的HCDR2、SEQ ID NO:76的HCDR3、SEQ IDNO:77的LCDR1、SEQ ID NO:78的LCDR2和SEQ ID NO:79的LCDR3;
SEQ ID NO:80的VH和SEQ ID NO:81的VL;
SEQ ID NO:53的CD3结合结构域的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3;或者
SEQ ID NO:53的CD3结合结构域的VH和VL。
在一些实施方案中,T细胞重定向治疗剂结合BCMA。
在一些实施方案中,T细胞重定向治疗剂包含
BCMA结合结构域和CD3结合结构域,BCMA结合结构域包含SEQ ID NO:23的HCDR1、SEQ ID NO:24的HCDR2、SEQ ID NO:25的HCDR3、SEQ ID NO:26的LCDR1、SEQ ID NO:27的LCDR2和SEQ ID NO:28的LCDR3,并且CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ IDNO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQID NO:38的LCDR3;以及/或者
BCMA结合结构域包含SEQ ID NO:29的VH和SEQ ID NO:30的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
在一些实施方案中,结合BCMA的T细胞重定向治疗剂包含SEQ ID NO:31的第一重链(HC1)、SEQ ID NO:32的第一轻链(LC1)、SEQ ID NO:41的第二重链(HC2)和SEQ ID NO:42的第二轻链(LC2)。
在一些实施方案中,结合BCMA的T细胞重定向治疗剂包括Seattle Genetics的ACTR癌症疗法、AFM-26、ALLO-715、CRISPR Therapeutics的抗BCMA同种异体CAR-T细胞疗法、Sorrento Therapeutics的抗BCMA CAR-T疗法、Hrain Biotechnology的抗CD19/BCMACAR-T细胞疗法、Chineo Med(北京)的BCMA CAR-T疗法、Triumvira Immunologics的BCMATAC-T细胞疗法、Shanghai Unicar-Therapy Biomed的BCMA-CAR T细胞疗法、Regeneron的BCMA/CD3抗体、NantKwest的CAR-NK细胞疗法、CC-93629、CMD-505、CTX-4419、CYAD-211、HDP-101、HPN-217、P-BCMA-ALLO1、TNB-383B、bb-2121、AUTO-2、Pregene的BCMA嵌合抗原受体疗法、Shanghai Bioray Laboratory的BCMA-CAR T细胞、CARsgen Therapeutics的BCMA-CAR-T细胞、Shenzhen BinDeBio的CAR-T/TCR-T细胞免疫疗法、ET-140、P-BCMA-101、REGN-5458、AMG-701、Cellular Biomedicine Group的抗BCMA CAR-T细胞疗法、bb-21217、BI-836909、CC-93269、Descartes-08、IM-21、JNJ-64007957、MEDI-2228或PF-06863135。
在一些实施方案中,T细胞重定向治疗剂包含如国际专利公布WO2017/031104中所述的BCMA结合结构域中的任一种。
在一些实施方案中,T细胞重定向治疗剂结合GPRC5D。
在一些实施方案中,T细胞重定向治疗剂包含
GPRC5D结合结构域和CD3结合结构域,GPRC5D结合结构域包含SEQ ID NO:43的HCDR1、SEQ ID NO:44的HCDR2、SEQ ID NO:45的HCDR3、SEQ ID NO:46的LCDR1、SEQ ID NO:47的LCDR2和SEQ ID NO:48的LCDR3,并且CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3;以及/或者
GPRC5D结合结构域包含SEQ ID NO:49的VH和SEQ ID NO:50的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
在一些实施方案中,结合GPRC5D的T细胞重定向治疗剂包含SEQ ID NO:51的HC1、SEQ ID NO:52的LC1、SEQ ID NO:41的HC2和SEQ ID NO:42的LC2。
在一些实施方案中,T细胞重定向治疗剂包含Eureka Therapeutics的GPRC5D抗体。
在一些实施方案中,T细胞重定向治疗剂包含如国际专利公布WO2018/0037651中所述的GPRC5D结合结构域中的任一种。
在一些实施方案中,T细胞重定向治疗剂结合CD33。
在一些实施方案中,T细胞重定向治疗剂包含
CD33结合结构域和CD3结合结构域,CD33结合结构域包含SEQ ID NO:84的HCDR1、SEQ ID NO:85的HCDR2、SEQ ID NO:86的HCDR3、SEQ ID NO:87的LCDR1、SEQ ID NO:88的LCDR2和SEQ ID NO:89的LCDR3,并且CD3结合结构域包含SEQ ID NO:74的HCDR1、SEQ IDNO:75的HCDR2、SEQ ID NO:76的HCDR3、SEQ ID NO:77的LCDR1、SEQ ID NO:78的LCDR2和SEQID NO:79的LCDR3;以及/或者
CD33结合结构域包含SEQ ID NO:90的VH和SEQ ID NO:91的VL,并且CD3结合结构域包含SEQ ID NO:80的VH和SEQ ID NO:81的VL。
在一些实施方案中,结合CD33的T细胞重定向治疗剂包含SEQ ID NO:92的HC1、SEQID NO:93的LC1、SEQ ID NO:82的HC2和SEQ ID NO:83的LC2。
在一些实施方案中,结合CD33的T细胞重定向治疗剂包括Shenzhen BinDeBio的CAR-T/TCR-T细胞免疫疗法、AMG-330、AMV-564、JNJ-67571244、ICG-144、AMG-673、Ziopharm的CD33 CAR-T疗法INXN 3004、huCD33-BsAb、VOR-33、HMBD-004A、GEM-333、TGB-3550或CD33.taNK。
在一些实施方案中,T细胞重定向治疗剂结合CD123。
在一些实施方案中,T细胞重定向治疗剂包含
CD123结合结构域和CD3结合结构域,CD123结合结构域包含SEQ ID NO:94的HCDR1、SEQ ID NO:95的HCDR2、SEQ ID NO:96的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:59的LCDR3,并且CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ IDNO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQID NO:38的LCDR3;以及/或者
CD123结合结构域包含SEQ ID NO:100的VH和SEQ ID NO:61的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
在一些实施方案中,结合CD123的T细胞重定向治疗剂包含SEQ ID NO:102的HC1、SEQ ID NO:63的LC1、SEQ ID NO:41的HC2和SEQ ID NO:42的LC2。
在一些实施方案中,结合CD123的T细胞重定向治疗剂包括TheraVectys的急性髓性白血病疗法、APVO-437、Nanjing Legend Biotech的抗CD123 CAR-T细胞疗法、APVO-436、Hebei Senlang Biotechnology的CD123 CAR-T细胞疗法、伏妥珠单抗、IM-23、JNJ-63709178、Mustang Bio的MB-102、UCART-123、XmAb-14045或Sanofi的CD3-CD123双特异性T细胞衔接器。
在一些实施方案中,T细胞重定向治疗剂包含如国际专利公布WO2016/036937中所述的CD123结合结构域中的任一种。
在一些实施方案中,T细胞重定向治疗剂结合CD19。
在一些实施方案中,T细胞重定向治疗剂包含
CD19结合结构域和CD3结合结构域,CD19结合结构域包含SEQ ID NO:53的CD19结合结构域的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3,并且CD3结合结构域包含SEQ IDNO:53的CD3结合结构域的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3;以及/或者
SEQ ID NO:53的氨基酸序列。
在一些实施方案中,结合CD19的T细胞重定向治疗剂包括axicabtageneciloleucel、博纳吐单抗、tisagenlecleucel-t、AMG-562、Cellular Biomedicine Group的AUTO-1CAR-T CD19、Ziopharm的CD19嵌合抗原受体T细胞疗法、ioceltech Therapeutics的CD19-CAR-T细胞疗法、Marino Biotechnology的CD19-CAR-T细胞疗法、Guangdong ZhaotaiInVivo的CD19-CAR-T2细胞疗法、Juno Therapeutics的CD19/4-1BBL装甲的CAR T细胞疗法、CSG-CD19、DI-B4、ET-190、GC-007F、GC-022、HRAIN Biotechnology的人CD19 T细胞疗法、Kite Pharma的人源化抗CD19对照CAR(第3代)、Immune Cell Therapy的ICAR-19CAR-T细胞、ICTCAR-003、Marino Biotechnology的iPD1 CD19 eCAR T细胞、JWCAR029、PTG-01、PZ01、Senl_1904A、Senl_1904B、UCART-19、UWC-19、AUTO-3、BinD-19、Shanghai Unicar-Therapy Biomed的CAR-T细胞疗法、Shenzhen BinDeBio的CAR-T/TCR-T细胞免疫疗法、Miltenyi Biotec的CD-19CAR-T细胞疗法、Miltenyi Biotec的CD19 CAR-T细胞、ShanghaiUnicar-Therapy Biomed的CD19-CART细胞疗法、Takara Bio的CD19-CAR T细胞疗法、Shanghai Bioray Laboratory的CD19-CART、Sinobioway的CD19靶向的嵌合抗原受体T细胞、Shanghai Longyao Biotechnology的CD19/CD20 CAR-T细胞疗法、CIK-CAR.CD19、ICTCAR-011、IM-19、JCAR-014、loncastuximab tesirine、MB-CART2019.1、OXS-1550、PBCAR-0191、PCAR-019、PCAR-119、Senl-001、TI-1007、XmAb-5871、inebilizumab、lisocabtagene maraleucel、XmAb-5574、Eden BioCell的第3代CD19-CART细胞+mbIL15、A-329、ALLO-501、Beijing Doing Biomedical Co的抗CD19抗CD20双特异性CAR重定向的自体同源T细胞、Allife Medical Science的抗CD19 CAR NK细胞疗法、Hrain Biotechnology的抗CD19/BCMA CAR-T细胞疗法、ATA-2431、Celularity的ATA-3219.AVA-008.CD19 CAR-T细胞疗法、Ziopharm的第三代CD19嵌合抗原受体T细胞疗法、Inovio的CD19 dBiTE、Bellicum的CD19 TCR细胞疗法、Wilex的CD19-ATAC、Chineo Med(北京)的CD19/20CAR-T疗法、EurekaTherapeutics的CD19/CD22双重靶向疗法、Helix BioPharma的嵌合抗原受体T细胞(CAR-T)疗法、CMD-502、CTX-110、CYAD-04、CYAD-221、ET-019002、FT-596、FT-819、TC Biopharm的γ-δCAR-T疗法、ICTCAR-014、iDD-002、KITE-037、NI-2201、RB-1916、Senl_002、TAC01-CD19、TC-110、TC-310、TCB-003或TI-7007。
在一些实施方案中,T细胞重定向治疗剂结合PSMA。
在一些实施方案中,T细胞重定向治疗剂包含
PSMA结合结构域和CD3结合结构域,PSMA结合结构域包含SEQ ID NO:54的HCDR1、SEQ ID NO:55的HCDR2、SEQ ID NO:56的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:59的LCDR3,并且CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ IDNO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQID NO:38的LCDR3;以及/或者
PSMA结合结构域包含SEQ ID NO:60的VH和SEQ ID NO:61的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
在一些实施方案中,结合PSMA的T细胞重定向治疗剂包含SEQ ID NO:62的HC1、SEQID NO:63的LC1、SEQ ID NO:41的HC2和SEQ ID NO:42的LC2。
在一些实施方案中,T细胞重定向治疗剂结合TMEFF2。
在一些实施方案中,T细胞重定向治疗剂包含
TMEFF2结合结构域和CD3结合结构域,TMEFF2结合结构域包含
SEQ ID NO:64的HCDR1、SEQ ID NO:65的HCDR2、SEQ ID NO:66的HCDR3、SEQ IDNO:67的LCDR1、SEQ ID NO:68的LCDR2和SEQ ID NO:69的LCDR3,并且CD3结合结构域包含SEQ ID NO:74的HCDR1、SEQ ID NO:75的HCDR2、SEQ ID NO:76的HCDR3、SEQ ID NO:77的LCDR1、SEQ ID NO:78的LCDR2和SEQ ID NO:79的LCDR3;以及/或者
TMEFF2结合结构域包含SEQ ID NO:70的VH和SEQ ID NO:71的VL,并且CD3结合结构域包含SEQ ID NO:80的VH和SEQ ID NO:81的VL。
在一些实施方案中,结合TMEFF2的T细胞重定向治疗剂包含SEQ ID NO:72的HC1、SEQ ID NO:73的LC1、SEQ ID NO:82的HC2和SEQ ID NO:83的LC2。
在一些实施方案中,T细胞重定向治疗剂结合CD20。
在一些实施方案中,T细胞重定向治疗剂结合CD22。
在一些实施方案中,T细胞重定向治疗剂结合CD25。
在一些实施方案中,T细胞重定向治疗剂结合CD52。
在一些实施方案中,T细胞重定向治疗剂结合ROR1。
在一些实施方案中,T细胞重定向治疗剂结合HM1.24。
在一些实施方案中,T细胞重定向治疗剂结合SLAMF7。
在一些实施方案中,T细胞重定向治疗剂是多特异性抗体、嵌合抗原受体(CAR)或包含CAR的T细胞。
在一些实施方案中,T细胞重定向治疗剂是CAR。
在一些实施方案中,T细胞重定向治疗剂是表达CAR的T细胞。
在一些实施方案中,T细胞重定向治疗剂是多特异性抗体。
在一些实施方案中,多特异性抗体是IgG1、IgG2、IgG3或IgG4同种型。
在一些实施方案中,多特异性抗体是IgG1同种型。
在一些实施方案中,多特异性抗体是IgG2同种型。
在一些实施方案中,多特异性抗体是IgG3同种型。
在一些实施方案中,多特异性抗体是IgG4同种型。
多特异性抗体可以是任何同种异型。预期同种异型对多特异性抗体的特性(诸如结合功能或Fc介导的效应子功能)没有影响。治疗性抗体的免疫原性与增大的输液反应风险和减小的治疗反应持续时间相关联(Baert等人,(2003)NEngl JMed 348:602-08)。治疗性抗体在宿主中诱导免疫应答的程度可部分通过抗体的同种异型来测定(Stickler等人,(2011)Genes and Immunity 12:213-21)。抗体同种异型与抗体的恒定区序列中特定位置的氨基酸序列变异相关。表2示出选择的IgG1、IgG2和IgG4同种异型。
在一些实施方案中,多特异性抗体包含降低多特异性抗体与Fcγ受体(FcγR)的结合的一个或多个Fc置换。降低多特异性抗体与FcγR的结合的置换降低了多特异性抗体的Fc效应子功能诸如ADCC、ADCP和/或CDC。与SEQ ID NO:103的野生型IgG1或SEQ ID NO:104的野生型IgG4相比,可进行特异性置换。
在一些实施方案中,该一个或多个Fc置换选自IgG4上的F234A/L235A、IgG1上的L234A/L235A、IgG2上的V234A/G237A/P238S/H268A/V309L/A330S/P331S、IgG4上的F234A/L235A、IgG4上的S228P/F234A/L235A、所有Ig同种型上的N297A、IgG2上的V234A/G237A、IgG1上的K214T/E233P/L234V/L235A/G236-缺失/A327G/P331A/D365E/L358M、IgG2上的H268Q/V309L/A330S/P331S、IgG1上的S267E/L328F、IgG1上的L234F/L235E/D265A、IgG1上的L234A/L235A/G237A/P238S/H268A/A330S/P331S、IgG4上的S228P/F234A/L235A/G237A/P238S和IgG4上的S228P/F234A/L235A/G236-缺失/G237A/P238S,其中残基根据EU索引进行编号。
在一些实施方案中,该一个或多个Fc置换是IgG4上的F234A/L235A。
在一些实施方案中,该一个或多个Fc置换是IgG1上的L234A/L235A。
在一些实施方案中,该一个或多个Fc置换是IgG2上的V234A/G237A/P238S/H268A/V309L/A330S/P331S。
在一些实施方案中,该一个或多个Fc置换是IgG4上的F234A/L235A。
在一些实施方案中,该一个或多个Fc置换是IgG4上的S228P/F234A/L235A。
在一些实施方案中,该一个或多个Fc置换是所有Ig同种型上的N297A。
在一些实施方案中,该一个或多个Fc置换是IgG2上的V234A/G237A。
在一些实施方案中,该一个或多个Fc置换是IgG1上的K214T/E233P/L234V/L235A/G236-缺失/A327G/P331A/D365E/L358M。
在一些实施方案中,该一个或多个Fc置换是IgG2上的H268Q/V309L/A330S/P331S。
在一些实施方案中,该一个或多个Fc置换是IgG1上的S267E/L328F。在一些实施方案中,该一个或多个Fc置换是IgG1上的L234F/L235E/D265A。
在一些实施方案中,该一个或多个Fc置换是IgG1上的L234A/L235A/G237A/P238S/H268A/A330S/P331S。
在一些实施方案中,该一个或多个Fc置换是IgG4上的S228P/F234A/L235A/G237A/P238S以及IgG4上的S228P/F234A/L235A/G236-缺失/G237A/P238S。
在一些实施方案中,多特异性抗体还包括S228P置换。
在一些实施方案中,多特异性抗体在第一CH3结构域或第二CH3结构域中或在第一CH3结构域和第二CH3结构域两者中包含一个或多个不对称置换。
在一些实施方案中,该一个或多个非对称置换选自F450L/K409R、野生型/F409L_R409K、T366Y/F405A、T366W/F405W、F405W/Y407A、T394W/Y407T、T394S/Y407A、T366W/T394S、F405W/T394S和T366W/T366S_L368A_Y407V、L351Y_F405A_Y407V/T394W、T366I_K392M_T394W/F405A_Y407V、T366L_K392M_T394W/F405A_Y407V、L351Y_Y407A/T366A_K409F、L351Y_Y407A/T366V_K409F、Y407A/T366A_K409F和T350V_L351Y_F405A_Y407V/T350V_T366L_K392L_T394W。
在一些实施方案中,该一个或多个非对称置换是F450L/K409R。
在一些实施方案中,该一个或多个非对称置换是野生型/F409L_R409K。
在一些实施方案中,该一个或多个非对称置换是T366Y/F405A。
在一些实施方案中,该一个或多个非对称置换是T366W/F405W。
在一些实施方案中,该一个或多个非对称置换是F405W/Y407A。
在一些实施方案中,该一个或多个非对称置换是T394W/Y407T。
在一些实施方案中,该一个或多个非对称置换是T394S/Y407A。
在一些实施方案中,该一个或多个非对称置换是T366W/T394S。
在一些实施方案中,该一个或多个非对称置换是F405W/T394S。
在一些实施方案中,该一个或多个非对称置换是T366W/T366S_L368A_Y407V。
在一些实施方案中,该一个或多个非对称置换是L351Y_F405A_Y407V/T394W。
在一些实施方案中,该一个或多个非对称置换是T366I_K392M_T394W/F405A_Y407V。
在一些实施方案中,该一个或多个非对称置换是T366L_K392M_T394W/F405A_Y407V。
在一些实施方案中,该一个或多个非对称置换是L351Y_Y407A/T366A_K409F。
在一些实施方案中,该一个或多个非对称置换是L351Y_Y407A/T366V_K409F。
在一些实施方案中,该一个或多个非对称置换是Y407A/T366A_K409F。
在一些实施方案中,该一个或多个非对称置换是T350V_L351Y_F405A_Y407V/T350V_T366L_K392L_T394W。
在一些实施方案中,癌症是血液恶性肿瘤或实体瘤。
在一些实施方案中,血液恶性肿瘤是多发性骨髓瘤、冒烟型多发性骨髓瘤、未明确诊断意义的单克隆丙种球蛋白病(MGUS)、急性淋巴母细胞白血病(ALL)、弥漫性大B细胞淋巴瘤(DLBCL)、伯基特淋巴瘤(BL)、滤泡性淋巴瘤(FL)、套细胞淋巴瘤(MCL)、华氏巨球蛋白血症、浆细胞白血病、轻链淀粉样变性(AL)、前体B细胞淋巴母细胞白血病、前体B细胞淋巴母细胞白血病、急性髓性白血病(AML)、骨髓增生异常综合征(MDS)、慢性淋巴细胞白血病(CLL)、B细胞恶性肿瘤、慢性髓性白血病(CML)、毛细胞白血病(HCL)、母细胞性浆细胞样树突状细胞瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、边缘区B细胞淋巴瘤(MZL)、粘膜相关淋巴组织淋巴瘤(MALT)、浆细胞白血病、间变性大细胞淋巴瘤(ALCL)、白血病或淋巴瘤。
在一些实施方案中,血液恶性肿瘤是多发性骨髓瘤。
在一些实施方案中,多发性骨髓瘤是新诊断的多发性骨髓瘤。
在一些实施方案中,多发性骨髓瘤是复发性或难治性多发性骨髓瘤。
在一些实施方案中,多发性骨髓瘤是高危多发性骨髓瘤。已知患有高危多发性骨髓瘤的受试者早期复发并且预后和结果不佳。如果受试者患有以下细胞遗传学异常中的一种或多种,则可将受试者分类为具有高危多发性骨髓瘤:t(4;14)(p16;q32)、t(14;16)(q32;q23)、del17p、1qAmp、t(4;14)(p16;q32)和t(14;16)(q32;q23)、t(4;14)(p16;q32)和del17p、t(14;16)(q32;q23)和del17p或者t(4;14)(p16;q32)、t(14;16)(q32;q23)和del17p。
在一些实施方案中,患有高危多发性骨髓瘤的受试者具有一种或多种染色体异常,该一种或多种染色体异常包括:t(4;14)(p16;q32)、t(14;16)(q32;q23)、del17p、1qAmp、t(4;14)(p16;q32)和t(14;16)(q32;q23)、t(4;14)(p16;q32)和del17p、t(14;16)(q32;q23)和del17p;或者t(4;14)(p16;q32)、t(14;16)(q32;q23)和del17p或它们的任何组合。
可以使用各种定性和/或定量的方法来确定疾病的复发或难治性质。可能相关的症状是例如:患者健康状况的下降或平稳,或与实体瘤相关的各种症状的重新建立或恶化,以及/或者身体中的癌细胞从一个部位扩散到其他器官、组织或细胞。
细胞遗传学异常可例如通过荧光原位杂交(FISH)来检测。在染色体易位中,癌基因易位到染色体14q32上的IgH区,从而导致这些基因失调。t(4;14)(p16;q32)涉及成纤维细胞生长因子受体3(FGFR3)和含多发性骨髓瘤SET结构域蛋白(MMSET)(也称为WHSC1/NSD2)的易位,并且t(14;16)(q32;q23)涉及MAF转录因子C-MAF的易位。17p(del17p)的缺失涉及p53基因座的丢失。
在一些实施方案中,多发性骨髓瘤对于用抗CD38抗体、来那度胺、硼替佐米、泊马度胺、卡非佐米、elotozumab、艾莎佐米、美法仑或沙利度胺或它们的任何组合进行治疗是复发性的或难治性的。
在一些实施方案中,多发性骨髓瘤对于用抗CD38抗体进行治疗是复发性的或难治性的。在一些实施方案中,多发性骨髓瘤对于用来那度胺进行治疗是复发性的或难治性的。在一些实施方案中,多发性骨髓瘤对于用硼替佐米进行治疗是复发性的或难治性的。在一些实施方案中,多发性骨髓瘤对于用泊马度胺进行治疗是复发性的或难治性的。在一些实施方案中,多发性骨髓瘤对于用卡非佐米进行治疗是复发性的或难治性的。在一些实施方案中,多发性骨髓瘤对于用elotozumab进行治疗是复发性的或难治性的。在一些实施方案中,多发性骨髓瘤对于用艾莎佐米进行治疗是复发性的或难治性的。在一些实施方案中,多发性骨髓瘤对于用美法仑进行治疗是复发性的或难治性的。在一些实施方案中,多发性骨髓瘤对于用沙利度胺进行治疗是复发性的或难治性的。
在一些实施方案中,血液恶性肿瘤是AML。
在一些实施方案中,AML是具有至少一种遗传异常的AML、具有多系发育异常的AML、治疗相关的AML、未分化的AML、具有最小成熟度的AML、具有成熟度的AML、急性髓单核细胞白血病、急性单核细胞白血病、急性红白血病、急性成巨核细胞白血病、急性嗜碱粒细胞白血病、急性全髓增生症伴纤维化或髓系肉瘤。
在一些实施方案中,AML是具有至少一种遗传异常的AML。在一些实施方案中,AML是具有多系发育异常的AML。在一些实施方案中,AML是治疗相关的AML。在一些实施方案中,AML是未分化的AML。在一些实施方案中,AML是具有最小成熟度的AML。在一些实施方案中,AML是具有成熟度的AML。在一些实施方案中,AML是急性髓单核细胞白血病。在一些实施方案中,AML是急性单核细胞白血病。在一些实施方案中,AML是急性红白血病。在一些实施方案中,AML是急性成巨核细胞白血病。在一些实施方案中,AML是急性嗜碱粒细胞白血病。在一些实施方案中,AML是急性全髓增生症伴纤维化。在一些实施方案中,AML是髓系肉瘤。
在一些实施方案中,该至少一种遗传异常是染色体8和21之间的易位,染色体16中的易位或倒位,染色体15和17之间的易位,染色体11的改变,或fms相关的酪氨酸激酶3(FLT3)、核仁磷酸蛋白(NPM1)、异柠檬酸脱氢酶1(IDH1)、异柠檬酸脱氢酶2(IDH2)、DNA(胞嘧啶-5)-甲基转移酶3(DNMT3A)、CCAAT/增强子结合蛋白α(CEBPA)、U2小核RNA辅助因子1(U2AF1)、zeste增强子2多梳抑制复合物2亚基(EZH2)、染色体1A的结构维持(SMC1A)或染色体3的结构维持(SMC3)的突变。
在一些实施方案中,该至少一种遗传异常是染色体8和21之间的易位。在一些实施方案中,该至少一种遗传异常是染色体16中的易位或倒位。在一些实施方案中,该至少一种遗传异常是染色体15和17之间的易位。在一些实施方案中,该至少一种遗传异常是染色体11的改变。在一些实施方案中,该至少一种遗传异常是fms相关的酪氨酸激酶3(FLT3)的突变。在一些实施方案中,该至少一种遗传异常是核仁磷酸蛋白(NPM1)的突变。在一些实施方案中,该至少一种遗传异常是异柠檬酸脱氢酶1(IDH1)的突变。在一些实施方案中,该至少一种遗传异常是异柠檬酸脱氢酶2(IDH2)的突变。在一些实施方案中,该至少一种遗传异常是DNA(胞嘧啶-5)-甲基转移酶3(DNMT3A)的突变。在一些实施方案中,该至少一种遗传异常是CCAAT/增强子结合蛋白α(CEBPA)的突变。在一些实施方案中,该至少一种遗传异常是U2小核RNA辅助因子1(U2AF1)的突变。在一些实施方案中,该至少一种遗传异常是zeste增强子2多梳抑制复合物2亚基(EZH2)的突变。在一些实施方案中,该至少一种遗传异常是染色体1A的结构维持(SMC1A)的突变。在一些实施方案中,该至少一种遗传异常是染色体3的结构维持(SMC3)的突变。
在一些实施方案中,该至少一种遗传异常是易位t(8;21)(q22;q22)、倒位inv(16)(p13;q22)、易位t(16;16)(p13;q22)、易位t(15;17)(q22;q12)、IDH1中的突变FLT3-ITD、突变R132H或R100Q/R104V/F108L/R119Q/I130V或IDH2中的突变R140Q或R172。
在一些实施方案中,该至少一种遗传异常是易位t(8;21)(q22;q22)。在一些实施方案中,该至少一种遗传异常是倒位inv(16)(p13;q22)。在一些实施方案中,该至少一种遗传异常是易位t(16;16)(p13;q22)。在一些实施方案中,该至少一种遗传异常是易位t(15;17)(q22;q12)。在一些实施方案中,该至少一种遗传异常是突变FLT3-ITD。在一些实施方案中,该至少一种遗传异常是IDH1中的突变R132H。在一些实施方案中,该至少一种遗传异常是IDH1中的突变R100Q/R104V/F108L/R119Q/I130V。在一些实施方案中,该至少一种遗传异常是IDH2中的突变R140Q。在一些实施方案中,该至少一种遗传异常是IDH2中的突变R172。
在一些实施方案中,血液恶性肿瘤是ALL。
在一些实施方案中,ALL是B细胞谱系ALL、T细胞谱系ALL、成人ALL或小儿ALL。
在一些实施方案中,ALL是B细胞谱系ALL。在一些实施方案中,ALL是T细胞谱系ALL。在一些实施方案中,ALL是成人ALL。在一些实施方案中,ALL是小儿ALL。
在一些实施方案中,患有ALL的受试者具有费城染色体或者对用BCR-ABL激酶抑制剂进行的治疗表现出抗性或者已获得对这种治疗的抗性。
在一些实施方案中,患有ALL的受试者具有费城染色体。在一些实施方案中,患有ALL的受试者对用BCR-ABL激酶抑制剂进行的治疗表现出抗性或者已获得对这种治疗的抗性。
Ph染色体存在于约20%的患有ALL的成人和一小部分患有ALL的儿童中,并且与不良预后相关联。在复发时,Ph+阳性ALL患者可采取酪氨酸激酶抑制剂(TKI)方案,因此可变得对TKI有抗性。因此,可将抗CD38抗体施用于已变得对选择性或部分选择性BCR-ABL抑制剂具有抗性的受试者。示例性BCR-ABL抑制剂是例如伊马替尼、达沙替尼、尼洛替尼、博舒替尼、普纳替尼、巴非替尼、塞卡替尼、陶扎色替或达鲁舍替。
在B谱系ALL患者中鉴定的其他染色体重排是t(v;11q23)(MLL重排)、t(1;19)(q23;p13.3);TCF3-PBX1(E2A-PBX1)、t(12;21)(p13;q22);ETV6-RUNX1(TEL-AML1)和t(5;14)(q31;q32);IL3-IGH。
在一些实施方案中,患有ALL的受试者具有t(v;11q23)(MLL重排)、t(1;19)(q23;p13.3);TCF3-PBX1(E2A-PBX1)、t(12;21)(p13;q22);ETV6-RUNX1(TEL-AML1)或t(5;14)(q31;q32);IL3-IGH染色体重排。
染色体重排可使用熟知的方法鉴定,例如荧光原位杂交、染色体核型分型、脉冲场凝胶电泳或测序。
在一些实施方案中,血液恶性肿瘤是冒烟型多发性骨髓瘤。
在一些实施方案中,血液恶性肿瘤是MGUS。
在一些实施方案中,血液恶性肿瘤是ALL。
在一些实施方案中,血液恶性肿瘤是DLBLC。
在一些实施方案中,血液恶性肿瘤是BL。
在一些实施方案中,血液恶性肿瘤是FL。
在一些实施方案中,血液恶性肿瘤是MCL。
在一些实施方案中,血液恶性肿瘤是华氏巨球蛋白血症。
在一些实施方案中,血液恶性肿瘤是浆细胞白血病。
在一些实施方案中,血液恶性肿瘤是AL。
在一些实施方案中,血液恶性肿瘤是前体B细胞淋巴母细胞白血病。
在一些实施方案中,血液恶性肿瘤是前体B细胞淋巴母细胞白血病。
在一些实施方案中,血液恶性肿瘤是骨髓增生异常综合征(MDS)。
在一些实施方案中,血液恶性肿瘤是CLL。
在一些实施方案中,血液恶性肿瘤是B细胞恶性肿瘤。
在一些实施方案中,血液恶性肿瘤是CML。
在一些实施方案中,血液恶性肿瘤是HCL。
在一些实施方案中,血液恶性肿瘤是母细胞性浆细胞样树突状细胞瘤。
在一些实施方案中,血液恶性肿瘤是霍奇金淋巴瘤。
在一些实施方案中,血液恶性肿瘤是非霍奇金淋巴瘤。
在一些实施方案中,血液恶性肿瘤是MZL。
在一些实施方案中,血液恶性肿瘤是MALT。
在一些实施方案中,血液恶性肿瘤是浆细胞白血病。
在一些实施方案中,血液恶性肿瘤是ALCL。
在一些实施方案中,血液恶性肿瘤是白血病。
在一些实施方案中,血液恶性肿瘤是淋巴瘤。
在一些实施方案中,实体瘤是前列腺癌、肺癌、非小细胞肺癌(NSCLC)、肝癌、宫颈癌、结肠癌、乳腺癌、卵巢癌、子宫内膜癌、胰腺癌、黑素瘤、食管癌、胃癌、胃部癌症、肾癌、膀胱癌、肝细胞癌、肾细胞癌、尿道上皮癌、头颈癌、胶质瘤、胶质母细胞瘤、结肠直肠癌、甲状腺癌、上皮癌、腺癌或晚期实体瘤。
在一些实施方案中,实体瘤是前列腺癌。
在一些实施方案中,实体瘤是肺癌。
在一些实施方案中,实体瘤是非小细胞肺癌(NSCLC)。
在一些实施方案中,实体瘤是肝癌。
在一些实施方案中,实体瘤是宫颈癌。
在一些实施方案中,实体瘤是结肠癌。
在一些实施方案中,实体瘤是乳腺癌。
在一些实施方案中,实体瘤是卵巢癌。
在一些实施方案中,实体瘤是子宫内膜癌。
在一些实施方案中,实体瘤是胰腺癌。
在一些实施方案中,实体瘤是黑素瘤。
在一些实施方案中,实体瘤是食管癌。
在一些实施方案中,实体瘤是胃癌。
在一些实施方案中,实体瘤是胃部癌症。
在一些实施方案中,实体瘤是肾癌。
在一些实施方案中,实体瘤是膀胱癌。
在一些实施方案中,实体瘤是肝细胞癌。
在一些实施方案中,实体瘤是肾细胞癌。
在一些实施方案中,实体瘤是尿道上皮癌。
在一些实施方案中,实体瘤是头颈癌。
在一些实施方案中,实体瘤是胶质瘤。
在一些实施方案中,实体瘤是胶质母细胞瘤。
在一些实施方案中,实体瘤是结肠直肠癌。
在一些实施方案中,实体瘤是甲状腺癌。
在一些实施方案中,实体瘤是上皮癌。
在一些实施方案中,实体瘤是腺癌。
在一些实施方案中,实体瘤是晚期实体瘤。
在一些实施方案中,前列腺癌是复发性前列腺癌、难治性前列腺癌、恶性前列腺癌或去势抵抗性前列腺癌或它们的任何组合。
在一些实施方案中,前列腺癌是复发性前列腺癌。在一些实施方案中,前列腺癌是难治性前列腺癌。在一些实施方案中,前列腺癌是恶性前列腺癌。在一些实施方案中,前列腺癌是去势抵抗性前列腺癌。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
在一些实施方案中,抗CD38抗体是IgG1同种型。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
用于本发明的方法中的其他抗CD38抗体可以是已知的抗体,诸如包含分别是SEQID NO:14和15的VH和VL序列的mAb003,并且在美国专利7,829,673中有所描述。mAb003的VH和VL可以表达为IgG1/κ;包含分别是SEQ ID NO:16和17的VH和VL序列的mAb024,并且在美国专利7,829,673中有所描述。mAb024的VH和VL可以表达为IgG1/κ;包含分别为SEQ ID NO:18和19的VH和VL序列的MOR-202(MOR-03087),并且在美国专利No.8,088,896中有所描述。MOR-202的VH和VL可以表达为IgG1/κ;或isatuximab;包含分别为SEQ ID NO:20和21的VH和VL序列,在美国专利8,153,765中有所描述。Isatuximab的VH和VL可表达为IgG1/κ。
EVQLLESGGGLVQPGGSLRLSCAVSGFTFNSFAMSWVRQAPGKGLEWVSAISGSGGGTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYFCAKDKILWFGEPVFDYWGQGTLVTVSS
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPTFGQGTKVEIK
SFAMS
AISGSGGGTYYADSVKG
DKILWFGEPVFDY
RASQSVSSYLA
DASNRAT
QQRSNWPPTF
EVQLLESGGGLVQPGGSLRLSCAVSGFTFNSFAMSWVRQAPGKGLEWVSAISGSGGGTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYFCAKDKILWFGEPVFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
QVQLVQSGAEVKKPGSSVKVSCKASGGTFSSYAFSWVRQAPGQGLEWMGRVIPFLGIANSAQKFQGRVTITADKSTSTAYMDLSSLRSEDTAVYYCARDDIAALGPFDYWGQGTLVTVSSAS
DIQMTQSPSSLSASVGDRVTITCRASQGISSWLAWYQQKPEKAPKSLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYNSYPRTFGQGTKVEIK
EVQLVQSGAEVKKPGESLKISCKGSGYSFSNYWIGWVRQMPGKGLEWMGIIYPHDSDARYSPSFQGQVTFSADKSISTAYLQWSSLKASDTAMYYCARHVGWGSRYWYFDLWGRGTLVTVSS
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPGLLIYDASNRASGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPLTFGGGTKVEIK
QVQLVESGGGLVQPGGSLRLSCAASGFTFSSYYMNWVRQAPGKGLEWVSGISGDPSNTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDLPLVYTGFAYWGQGTLVTVSS
DIELTQPPSVSVAPGQTARISCSGDNLRHYYVYWYQQKPGQAPVLVIYGDSKRPSGIPERFSGSNSGNTATLTISGTQAEDEADYYCQTYTGGASLVFGGGTKLTVLGQ
QVQLVQSGAEVAKPGTSVKLSCKASGYTFTDYWMQWVKQRPGQGLEWIGTIYPGDGDTGYAQKFQGKATLTADKSSKTVYMHLSSLASEDSAVYYCARGDYYGSNSLDYWGQGTSVTVSS
DIVMTQSHLSMSTSLGDPVSITCKASQDVSTVVAWYQQKPGQSPRRLIYSASYRYIGVPDRFTGSGAGTDFTFTISSVQAEDLAVYYCQQHYSPPYTFGGGTKLEIK
在一些实施方案中,抗CD38抗体包含:
SEQ ID NO:14的VH和SEQ ID NO:15的VL;
SEQ ID NO:16的VH和SEQ ID NO:17的VL;
SEQ ID NO:18的VH和SEQ ID NO:19的VL;或者
SEQ ID NO:20的VH和SEQ ID NO:21的VL。
在一些实施方案中,抗CD38抗体是IgG1同种型。
在一些实施方案中,T细胞重定向治疗剂是BCMA×CD3双特异性抗体、GPRC5D×CD3双特异性抗体、CD33×CD3双特异性抗体、CD19×CD3双特异性抗体、CD123×CD3双特异性抗体、PSMA×CD3双特异性抗体或TMEFF2×CD3双特异性抗体。
在一些实施方案中,T细胞重定向治疗剂是BCMA×CD3双特异性抗体。
在一些实施方案中,T细胞重定向治疗剂是GPRC5D×CD3双特异性抗体。
在一些实施方案中,T细胞重定向治疗剂是CD33×CD3双特异性抗体,
在一些实施方案中,T细胞重定向治疗剂是CD19×CD3双特异性抗体。
在一些实施方案中,T细胞重定向治疗剂是CD123×CD3双特异性抗体。
在一些实施方案中,T细胞重定向治疗剂是PSMA×CD3双特异性抗体。
在一些实施方案中,T细胞重定向治疗剂是TMEFF2×CD3双特异性抗体。
在一些实施方案中,该方法还包括向受试者施用一种或多种抗癌疗法。
在一些实施方案中,该一种或多种抗癌疗法选自自体同源干细胞移植(ASCT)、放射、外科手术、化学治疗剂、免疫调节剂和靶向癌症疗法。
在一些实施方案中,该一种或多种抗癌疗法是自体同源干细胞移植(ASCT)。在一些实施方案中,该一种或多种抗癌疗法是放射。在一些实施方案中,该一种或多种抗癌疗法是外科手术。在一些实施方案中,该一种或多种抗癌疗法是化学治疗剂。在一些实施方案中,该一种或多种抗癌疗法是免疫调节剂。在一些实施方案中,该一种或多种抗癌疗法是靶向癌症疗法。
在一些实施方案中,该一种或多种抗癌疗法选自来那度胺、沙利度胺、泊马度胺、硼替佐米、卡非佐米、elotozumab、艾莎佐米、美法仑、地塞米松、长春新碱、环磷酰胺、羟基柔红霉素、泼尼松、利妥昔单抗、伊马替尼、达沙替尼、尼洛替尼、博舒替尼、普纳替尼、巴非替尼、塞卡替尼、陶扎舍替或达鲁舍替、阿糖胞苷、柔红霉素、伊达比星、米托蒽醌、羟基脲、地西他滨、克拉屈滨、氟达拉滨、拓扑替康、依托泊苷6-硫鸟嘌呤、皮质类固醇、甲氨蝶呤、6-巯嘌呤、阿扎胞苷、三氧化二砷和全反式视黄酸或它们的任何组合。
在一些实施方案中,抗CD38抗体以介于约8mg/kg至约16mg/kg之间的剂量施用。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含在约25mM乙酸、约60mM氯化钠、约140甘露糖醇和约0.04%w/v聚山梨醇酯-20(PS-20)中的介于约20mg/mL至约120mg/mL之间的抗CD38抗体;pH为约5.5。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含约1,800mg的抗CD38抗体和约30,000U的rHuPH20。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含约120mg/mL的抗CD38抗体和约2,000U/mL的rHuPH20。
在一些实施方案中,CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含
介于约5mM至约15mM之间的组氨酸;
介于约100mM至约300mM之间的山梨糖醇;
介于约0.01%w/v至约0.04%w/v之间的PS-20;和
介于约1mg/mL至约2mg/mL之间的甲硫氨酸,pH为约5.5至5.6。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含
约1,800mg的抗CD38抗体;
约30,000U的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含
约120mg/mL的抗CD38抗体;
约2,000U/mL的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
本公开还提供了一种治疗受试者的癌症的方法,包括向受试者施用治疗有效量的BCMA×CD3双特异性抗体和抗CD38抗体以治疗癌症。
本公开还提供了一种治疗受试者的癌症的方法,包括向受试者施用治疗有效量的BCMA×CD3双特异性抗体以治疗癌症,其中在施用BCMA×CD3双特异性抗体之前,该受试者已用抗CD38抗体进行治疗。
本公开还提供了一种治疗受试者的癌症的方法,包括向受试者施用治疗有效量的BCMA×CD3双特异性抗体以治疗癌症,其中该受试者对于用先前的抗癌治疗剂进行治疗是复发性的或难治性的。
T细胞重定向治疗剂诸如BCMA×CD3双特异性抗体(诸如JNJ-957)将T细胞重定向至BCMA阳性肿瘤细胞(诸如多发性骨髓瘤细胞),然后穿孔素/颗粒酶释放或激活FASL/FAS途径,并最终导致BCMA阳性肿瘤细胞死亡。因此,T细胞重定向治疗剂诸如BCMA×CD3双特异性抗体的功效可受募集的T细胞的可用性和活性的影响,以及受肿瘤相关抗原诸如BCMA在肿瘤细胞上的可能调节的表达的影响。
在一些实施方案中,癌症是BCMA表达型癌症。
B细胞成熟抗原(BCMA)是细胞膜结合的肿瘤坏死因子受体家族成员,参与B细胞向浆细胞的分化。BCMA的表达限于B细胞谱系,其中BCMA主要在生发中心的滤泡间区中表达以及在分化的浆细胞和浆母细胞上表达。幼稚和记忆型B细胞上几乎不存在BCMA(Tai和Anderson,Immunotherapy,第7卷,第1187-1199页,2015年)。
在一些实施方案中,癌症是血液学恶性肿瘤。
在一些实施方案中,癌症是多发性骨髓瘤、冒烟型骨髓瘤、未明确诊断意义的单克隆丙种球蛋白病(MGUS)、B细胞急性淋巴母细胞白血病、弥漫性大B细胞淋巴瘤、伯基特淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤、华氏巨球蛋白血症、浆细胞白血病、轻链淀粉样变性或非霍奇金淋巴瘤。经验丰富的医师会进行癌症诊断。
在一些实施方案中,受试者对于用抗CD38抗体或来那度胺或它们的组合进行治疗是复发性的或难治性的。
在一些实施方案中,受试者对于用抗CD38抗体进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用来那度胺进行治疗是复发性的或难治性的。
在一些实施方案中,受试者对于用先前的抗癌治疗剂(诸如用于治疗多发性骨髓瘤或其他血液恶性肿瘤的治疗剂)进行治疗是复发性的或难治性的。
在一些实施方案中,受试者对于用
在一些实施方案中,受试者对于用
在一些实施方案中,BCMA×CD3双特异性抗体和抗CD38抗体是抗原结合片段。示例性抗原结合片段是Fab、F(ab')2、Fd和Fv片段。
在一些实施方案中,BCMA×CD3双特异性抗体是嵌合的、人源化的或人的。
在一些实施方案中,BCMA×CD3双特异性抗体是IgG1、IgG2、IgG3或IgG4同种型。
在一些实施方案中,BCMA×CD3双特异性抗体是IgG4同种型。
在一些实施方案中,BCMA×CD3双特异性抗体包含BCMA结合结构域和CD3结合结构域,BCMA结合结构域包含SEQ ID NO:23的HCDR1、SEQ ID NO:24的HCDR2、SEQ ID NO:25的HCDR3、SEQ ID NO:26的LCDR1、SEQ ID NO:27的LCDR2和SEQ ID NO:28的LCDR3,并且CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3。
在一些实施方案中,BCMA结合结构域包含SEQ ID NO:29的VH和SEQ ID NO:30的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
在一些实施方案中,BCMA×CD3双特异性抗体是IgG4同种型并且包含第一重链(HC1)中第405位处的苯丙氨酸和第409位处的精氨酸以及第二重链(HC2)中第405位处的亮氨酸和第409位处的赖氨酸,其中残基根据EU索引进行编号。
在一些实施方案中,BCMA×CD3双特异性抗体还包含HC1和HC2两者中第228位的脯氨酸、第234位的丙氨酸和第235位的丙氨酸。
在一些实施方案中,BCMA×CD3双特异性抗体包含SEQ ID NO:31的HC1、SEQ IDNO:32的第一轻链(LC1)、SEQ ID NO:41的HC2和SEQ ID NO:42的第二轻链(LC2)。
在一些实施方案中,BCMA×CD3双特异性抗体是BI 836909、PF-06863135、AMG-701或CC-93269。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:12的重链(HC)和SEQ ID NO:13的轻链(LC)。
在一些实施方案中,抗CD38抗体是
在一些实施方案中,抗CD38抗体包含:
SEQ ID NO:14的VH和SEQ ID NO:15的VL;
SEQ ID NO:16的VH和SEQ ID NO:17的VL;
SEQ ID NO:18的VH和SEQ ID NO:19的VL;或者
SEQ ID NO:20的VH和SEQ ID NO:21的VL。
在一些实施方案中,抗CD38抗体是嵌合的、人源化的或人的。
在一些实施方案中,抗CD38抗体是IgG1、IgG2、IgG3或IgG4同种型。
在一些实施方案中,抗CD38抗体是IgG1同种型。
在一些实施方案中,抗CD38抗体以介于约8mg/kg至约16mg/kg之间的剂量施用。
在一些实施方案中,BCMA×CD3双特异性抗体和抗CD38抗体通过静脉注射施用。
在一些实施方案中,BCMA×CD3双特异性抗体通过静脉注射施用,并且抗CD38抗体通过皮下注射施用。
在一些实施方案中,BCMA×CD3双特异性抗体和抗CD38抗体通过皮下注射施用。
在一些实施方案中,该方法还包括向受试者施用一种或多种抗癌疗法。
在一些实施方案中,该一种或多种抗癌疗法选自自体同源干细胞移植(ASCT)、放射、外科手术、化学治疗剂、免疫调节剂和靶向癌症疗法。
在一些实施方案中,该一种或多种抗癌疗法选自来那度胺、沙利度胺、泊马度胺、硼替佐米、卡非佐米、elotozumab、艾莎佐米、美法仑、泼尼松或地塞米松或它们的任何组合。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含在约25mM乙酸、约60mM氯化钠、约140甘露糖醇和约0.04%w/v聚山梨醇酯-20(PS-20)中的介于约20mg/mL至约120mg/mL之间的抗CD38抗体;pH为约5.5。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含约1,800mg的抗CD38抗体和约30,000U的rHuPH20。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含约120mg/mL的抗CD38抗体和约2,000U/mL的rHuPH20。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含
介于约5mM至约15mM之间的组氨酸;
介于约100mM至约300mM之间的山梨糖醇;
介于约0.01%w/v至约0.04%w/v之间的PS-20;和
介于约1mg/mL至约2mg/mL之间的甲硫氨酸,pH为约5.5至5.6。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含
约1,800mg的抗CD38抗体;
约30,000U的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含
约120mg/mL的抗CD38抗体;
约2,000U/mL的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
给予患有癌症(诸如多发性骨髓瘤)的受试者的BCMA×CD3双特异性抗体和抗CD38抗体的剂量足以缓解或至少部分地抑制所治疗的疾病(“治疗有效量”),并且包括抗体的约0.005mg/kg至约100mg/kg,例如约0.05mg/kg至约30mg/kg,或约5mg/kg至约25mg/kg,或约4mg/kg、约8mg/kg、约16mg/kg或约24mg/kg。合适的剂量包括例如约1mg/kg、2mg/kg、3mg/kg、4mg/kg、5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg、20mg/kg、21mg/kg、22mg/kg、23mg/kg、24mg/kg、25mg/kg、30mg/kg、40mg/kg、50mg/kg、60mg/kg、70mg/kg、80mg/kg、90mg/kg或100mg/kg。
也可给予BCMA×CD3双特异性抗体和/或抗CD38抗体的固定的单位剂量,例如50mg、100mg、200mg、500mg或1000mg,或者剂量可基于患者的表面积,例如500mg/m
BCMA×CD3双特异性抗体和/或抗CD38抗体可在一天、两天、三天、四天、五天、六天、一周、两周、三周、一个月、五周、六周、七周、两个月、三个月、四个月、五个月、六个月或更长时间之后重复施用。也可以重复治疗过程,按照慢性施用一样。重复施用可为相同剂量或不同剂量。例如,BCMA×CD3双特异性抗体和抗CD38抗体可通过静脉输注以8mg/kg或以16mg/kg按每周一次的时间间隔施用8周,接着以8mg/kg或以16mg/kg按每两周一次的方式再施用16周,然后以8mg/kg或以16mg/kg按每四周一次的方式施用。
BCMA×CD3双特异性抗体和抗CD38抗体可通过维持疗法施用,诸如例如按每周一次的方式持续6个月或更长时间。例如,BCMA×CD3双特异性抗体和抗CD38抗体可在治疗开始后第1天、第2天、第3天、第4天、第5天、第6天、第7天、第8天、第9天、第10天、第11天、第12天、第13天、第14天、第15天、第16天、第17天、第18天、第19天、第20天、第21天、第22天、第23天、第24天、第25天、第26天、第27天、第28天、第29天、第30天、第31天、第32天、第33天、第34天、第35天、第36天、第37天、第38天、第39天或第40天中的至少一天,或者另选地,在第1周、第2周、第3周、第4周、第5周、第6周、第7周、第8周、第9周、第10周、第11周、第12周、第13周、第14周、第15周、第16周、第17周、第18周、第19周或第20周中的至少一周或它们的任何组合,采用单次剂量或者每24小时、每12小时、每8小时、每6小时、每4小时或2小时一次的分次剂量或它们的任何组合,以约0.1mg/kg至约100mg/kg的量作为日剂量(诸如每天0.5mg/kg、0.9mg/kg、1.0mg/kg、1.1mg/kg、1.5mg/kg、2mg/kg、3mg/kg、4mg/kg、5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg、20mg/kg、21mg/kg、22mg/kg、23mg/kg、24mg/kg、25mg/kg、26mg/kg、27mg/kg、28mg/kg、29mg/kg、30mg/kg、40mg/kg、45mg/kg、50mg/kg、60mg/kg、70mg/kg、80mg/kg、90mg/kg或100mg/kg)提供。
还可以预防性地施用BCMA×CD3双特异性抗体和抗CD38抗体,以便降低罹患癌症(诸如多发性骨髓瘤)的风险、延迟癌症进展中事件的发作和/或在癌症缓解后降低复发的风险。
在一些实施方案中,在向受试者施用抗CD38抗体之后,将BCMA×CD3双特异性抗体施用于受试者。可在施用抗CD38抗体之后一周、两周、三周、一个月、五周、六周、七周、两个月、三个月、四个月、五个月、六个月或更长时间施用BCMA×CD3双特异性抗体。在一些实施方案中,施用BCMA×CD3抗体的受试者对于用抗CD38抗体进行治疗是有抗性的和/或难治性的。
本发明还提供了一种药物组合物,包含BCMA×CD3双特异性抗体和抗CD38抗体,BCMA×CD3双特异性抗体包含BCMA结合结构域和CD3结合结构域,BCMA结合结构域包含SEQID NO:29的VH和SEQ ID NO:30的VL,CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL,抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
在一些实施方案中,药物组合物包含BCMA×CD3双特异性抗体和抗CD38抗体,BCMA×CD3双特异性抗体包含SEQ ID NO:31的HC1、SEQ ID NO:32的LC1、SEQ ID NO:41的HC2、SEQ ID NO:42的LC2,抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
在一些实施方案中,药物组合物是非固定组合。
在一些实施方案中,药物组合物包含在约25mM乙酸、约60mM氯化钠、约140甘露糖醇和约0.04%w/v聚山梨酸酯-20(PS-20)中的约20mg/mL至约120mg/mL的抗CD38抗体;pH为约5.5。
BCMA×CD3双特异性抗体可配制为包含约20mg/mL至约120mg/mL的抗体、乙酸、组氨酸、氯化钠、甘露糖醇和/或聚山梨酸酯-20的药物组合物。
在一些实施方案中,药物组合物包含约1,800mg的抗CD38抗体和约30,000U的rHuPH20。
在一些实施方案中,药物组合物包含约120mg/mL的抗CD38抗体和约2,000U/mL的rHuPH20。
在一些实施方案中,药物组合物还包含一种或多种赋形剂。
在一些实施方案中,该一种或多种赋形剂是组氨酸、甲硫氨酸、山梨糖醇或聚山梨酸酯-20(PS-20)或它们的任何组合。
在一些实施方案中,药物组合物包含
在介于约5mM至约15mM之间的组氨酸中配制的介于约100mg/mL至约120mg/mL之间的抗CD38抗体;
介于约100mM至约300mM之间的山梨糖醇;
介于约0.01%w/v至约0.04%w/v之间的PS-20;和
介于约1mg/mL至约2mg/mL之间的甲硫氨酸,pH为约5.5至5.6。
在一些实施方案中,药物组合物包含约10mM的组氨酸。
在一些实施方案中,药物组合物包含约300mM的山梨糖醇。
在一些实施方案中,药物组合物包含约0.04%(w/v)的PS-20。
在一些实施方案中,药物组合物包含约1mg/mL的甲硫氨酸。
在一些实施方案中,药物组合物包含
约1,800mg的抗CD38抗体;
约30,000U的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
在一些实施方案中,药物组合物包含
约120mg/mL的抗CD38抗体;
约2,000U/mL的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
本公开还提供了一种包含药物组合物的试剂盒,该药物组合物包含BCMA×CD3双特异性抗体和抗CD38抗体。
本公开还提供了一种治疗受试者的癌症的方法,包括向受试者施用治疗有效量的BCMA×CD3双特异性抗体以治疗癌症,其中该受试者对于用先前的抗癌治疗剂进行治疗是复发性的或难治性的。
在一些实施方案中,BCMA×CD3双特异性抗体包含BCMA结合结构域和CD3结合结构域,BCMA结合结构域包含SEQ ID NO:23的HCDR1、SEQ ID NO:24的HCDR2、SEQ ID NO:25的HCDR3、SEQ ID NO:26的LCDR1、SEQ ID NO:27的LCDR2和SEQ ID NO:28的LCDR3,并且CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3。
在一些实施方案中,BCMA结合结构域包含SEQ ID NO:29的VH和SEQ ID NO:30的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
在一些实施方案中,BCMA×CD3双特异性抗体是IgG4同种型并且包含HC1中第405位处的苯丙氨酸和第409位处的精氨酸以及HC2中第405位处的亮氨酸和第409位处的赖氨酸,其中残基根据EU索引进行编号。
在一些实施方案中,BCMA×CD3双特异性抗体还包含HC1和HC2两者中第228位的脯氨酸、第234位的丙氨酸和第235位的丙氨酸。
在一些实施方案中,BCMA×CD3双特异性抗体包含SEQ ID NO:31的HC1、SEQ IDNO:32的LC1)、SEQ ID NO:41的HC2和SEQ ID NO:42的LC2。
在一些实施方案中,癌症是血液恶性肿瘤。
在一些实施方案中,血液恶性肿瘤是多发性骨髓瘤。
在一些实施方案中,多发性骨髓瘤是高危多发性骨髓瘤。
在一些实施方案中,患有高危多发性骨髓瘤的受试者具有一种或多种染色体异常,该一种或多种染色体异常包括:
t(4;14)(p16;q32);
t(14;16)(q32;q23);
del17p;
1qAmp;
t(4;14)(p16;q32)和t(14;16)(q32;q23);
t(4;14)(p16;q32)和del17p;
t(14;16)(q32;q23)和del17p;或者
t(4;14)(p16;q32)、t(14;16)(q32;q23)和del17p或它们的任何组合。
在一些实施方案中,受试者对于用抗CD38抗体、来那度胺、硼替佐米、泊马度胺、卡非佐米、elotozumab、艾莎佐米、美法仑或沙利度胺或它们的任何组合进行治疗是复发性的或难治性的。
在一些实施方案中,受试者对于用来那度胺进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用硼替佐米进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用泊马度胺进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用卡非佐米进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用elotozumab进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用艾莎佐米进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用美法仑进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用沙利度胺进行治疗是复发性的或难治性的。
在一些实施方案中,受试者对于用抗CD38抗体进行治疗是复发性的。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
在一些实施方案中,抗CD38抗体是IgG1同种型。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
在一些实施方案中,抗CD38抗体包含:
SEQ ID NO:14的VH和SEQ ID NO:15的VL;
SEQ ID NO:16的VH和SEQ ID NO:17的VL;
SEQ ID NO:18的VH和SEQ ID NO:19的VL;或者
SEQ ID NO:20的VH和SEQ ID NO:21的VL。
在一些实施方案中,抗CD38抗体是IgG1同种型。
在一些实施方案中,受试者是人。
在一些实施方案中,该方法还包括向受试者施用一种或多种抗癌疗法。
在一些实施方案中,该一种或多种抗癌疗法选自自体同源干细胞移植(ASCT)、放射、外科手术、化学治疗剂、免疫调节剂和靶向癌症疗法。
在一些实施方案中,该一种或多种抗癌疗法选自来那度胺、沙利度胺、泊马度胺、硼替佐米、卡非佐米、elotozumab、艾莎佐米、美法仑、泼尼松或地塞米松或它们的任何组合。
用结合GPRC5D的T细胞重定向治疗剂和抗CD38抗体的联合疗法
本公开还提供了一种治疗受试者的癌症的方法,包括向受试者施用治疗有效量的结合GPRC5D的T细胞重定向治疗剂和抗CD38抗体以治疗癌症。
在一些实施方案中,在施用结合GPRC5D的T细胞重定向治疗剂之前,将抗CD38抗体施用于受试者。
在一些实施方案中,受试者对于在用先前的抗癌治疗剂进行治疗是复发性的或难治性的。
在一些实施方案中,癌症是GPRC5D表达型癌症。
在一些实施方案中,GPRC5D表达型癌症是血液恶性肿瘤或实体瘤。
在一些实施方案中,血液恶性肿瘤是白血病、淋巴瘤或多发性骨髓瘤。
在一些实施方案中,血液恶性肿瘤是白血病。在一些实施方案中,血液恶性肿瘤是淋巴瘤。在一些实施方案中,血液恶性肿瘤是多发性骨髓瘤。
在一些实施方案中,实体瘤是卵巢癌、肺癌、胃部癌症、前列腺癌、肾癌、肝癌、胰腺癌、结肠癌、食管癌、膀胱癌、宫颈肿瘤或恶性黑素瘤。
GPRC5D已被公开为在这些肿瘤中表达,参见例如国际专利公布WO2018/147245。
在一些实施方案中,受试者对于用抗CD38抗体、来那度胺、硼替佐米、泊马度胺、卡非佐米、elotozumab、艾莎佐米、美法仑或沙利度胺或它们的任何组合进行治疗是复发性的或难治性的。
在一些实施方案中,受试者对于用来那度胺进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用硼替佐米进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用泊马度胺进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用卡非佐米进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用elotozumab进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用艾莎佐米进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用美法仑进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用沙利度胺进行治疗是复发性的或难治性的。在一些实施方案中,受试者对于用抗CD38抗体进行治疗是复发性的或难治性的。
在一些实施方案中,多发性骨髓瘤是新诊断的多发性骨髓瘤。
在一些实施方案中,多发性骨髓瘤是复发性或难治性多发性骨髓瘤。
在一些实施方案中,多发性骨髓瘤是高危多发性骨髓瘤。
在一些实施方案中,患有高危多发性骨髓瘤的受试者具有一种或多种染色体异常,该一种或多种染色体异常包括:
t(4;14)(p16;q32);
t(14;16)(q32;q23);
del17p;
1qAmp;
t(4;14)(p16;q32)和t(14;16)(q32;q23);
t(4;14)(p16;q32)和del17p;
t(14;16)(q32;q23)和del17p;或者
t(4;14)(p16;q32)、t(14;16)(q32;q23)和del17p或它们的任何组合。
在一些实施方案中,T细胞重定向治疗剂结合CD3、CD3ε(CD3ε)、CD8、KI2L4、NKG2E、NKG2D、NKG2F、BTNL3、CD186、BTNL8、PD-1、CD195或NKG2C。
在一些实施方案中,T细胞重定向治疗剂包含GPRC5D结合结构域和CD3结合结构域,GPRC5D结合结构域包含SEQ ID NO:43的HCDR1、SEQ ID NO:44的HCDR2、SEQ ID NO:45的HCDR3、SEQ ID NO:46的LCDR1、SEQ ID NO:47的LCDR2和SEQ ID NO:48的LCDR3,并且CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3。
在一些实施方案中,GPRC5D结合结构域包含SEQ ID NO:49的VH和SEQ ID NO:50的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
在一些实施方案中,结合GPRC5C的T细胞重定向治疗剂是多特异性抗体、CAR或表达CAR的T细胞。
在一些实施方案中,多特异性抗体是IgG1、IgG2、IgG3或IgG4同种型。
在一些实施方案中,多特异性抗体是IgG1同种型。在一些实施方案中,多特异性抗体是IgG2同种型。在一些实施方案中,多特异性抗体是IgG3同种型。在一些实施方案中,多特异性抗体是IgG4同种型。
在一些实施方案中,多特异性抗体包含降低多特异性抗体与Fcγ受体(FcγR)的结合的一个或多个Fc置换。
在一些实施方案中,该一个或多个Fc置换选自IgG4上的F234A/L235A、IgG1上的L234A/L235A、IgG2上的V234A/G237A/P238S/H268A/V309L/A330S/P331S、IgG4上的F234A/L235A、IgG4上的S228P/F234A/L235A、所有Ig同种型上的N297A、IgG2上的V234A/G237A、IgG1上的K214T/E233P/L234V/L235A/G236-缺失/A327G/P331A/D365E/L358M、IgG2上的H268Q/V309L/A330S/P331S、IgG1上的S267E/L328F、IgG1上的L234F/L235E/D265A、IgG1上的L234A/L235A/G237A/P238S/H268A/A330S/P331S、IgG4上的S228P/F234A/L235A/G237A/P238S和IgG4上的S228P/F234A/L235A/G236-缺失/G237A/P238S,其中残基根据EU索引进行编号。
在一些实施方案中,多特异性抗体还包括S228P置换。
在一些实施方案中,多特异性抗体在第一CH3结构域或第二CH3结构域中或在第一CH3结构域和第二CH3结构域两者中包含一个或多个不对称置换。
在一些实施方案中,一个或多个非对称置换选自F450L/K409R、野生型/F409L_R409K、T366Y/F405A、T366W/F405W、F405W/Y407A、T394W/Y407T、T394S/Y407A、T366W/T394S、F405W/T394S和T366W/T366S_L368A_Y407V、L351Y_F405A_Y407V/T394W、T366I_K392M_T394W/F405A_Y407V、T366L_K392M_T394W/F405A_Y407V、L351Y_Y407A/T366A_K409F、L351Y_Y407A/T366V_K409F、Y407A/T366A_K409F和T350V_L351Y_F405A_Y407V/T350V_T366L_K392L_T394W。
在一些实施方案中,多特异性抗体包含SEQ ID NO:51的HC1、SEQ ID NO:52的LC1)、SEQ ID NO:41的HC2和SEQ ID NO:42的LC2。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
在一些实施方案中,抗CD38抗体是IgG1同种型。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
在一些实施方案中,抗CD38抗体包含:
SEQ ID NO:14的VH和SEQ ID NO:15的VL;
SEQ ID NO:16的VH和SEQ ID NO:17的VL;
SEQ ID NO:18的VH和SEQ ID NO:19的VL;或者
SEQ ID NO:20的VH和SEQ ID NO:21的VL。
在一些实施方案中,抗CD38抗体是IgG1同种型。
在一些实施方案中,抗CD38抗体以介于约8mg/kg至约16mg/kg之间的剂量施用。
在一些实施方案中,结合GPRC5D的T细胞重定向治疗剂和抗CD38抗体通过静脉注射施用。
在一些实施方案中,结合GPRC5D的T细胞重定向治疗剂通过静脉注射施用,并且抗CD38抗体通过皮下注射施用。
在一些实施方案中,结合GPRC5D的T细胞重定向治疗剂和抗CD38抗体通过皮下注射施用。
在一些实施方案中,受试者是人。
在一些实施方案中,结合GPRC5D的T细胞重定向治疗剂是GPRC5D×CD3双特异性抗体。
在一些实施方案中,该方法还包括向受试者施用一种或多种抗癌疗法。
在一些实施方案中,该一种或多种抗癌疗法选自自体同源干细胞移植(ASCT)、放射、外科手术、化学治疗剂、免疫调节剂和靶向癌症疗法。
在一些实施方案中,该一种或多种抗癌疗法选自来那度胺、沙利度胺、泊马度胺、硼替佐米、卡非佐米、elotozumab、艾莎佐米、美法仑、地塞米松或泼尼松。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含在约25mM乙酸、约60mM氯化钠、约140甘露糖醇和约0.04%w/v聚山梨醇酯-20(PS-20)中的介于约20mg/mL至约120mg/mL之间的抗CD38抗体;pH为约5.5。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含约1,800mg的抗CD38抗体和约30,000U的rHuPH20。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含约120mg/mL的抗CD38抗体和约2,000U/mL的rHuPH20。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含
介于约100mg/mL至约120mg/mL之间的抗CD38抗体;
介于约5mM至约15mM之间的组氨酸;
介于约100mM至约300mM之间的山梨糖醇;
介于约0.01%w/v至约0.04%w/v之间的PS-20;和
介于约1mg/mL至约2mg/mL之间的甲硫氨酸,pH为约5.5至5.6。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含
约1,800mg的抗CD38抗体;
约30,000U的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
在一些实施方案中,抗CD38抗体以药物组合物形式施用或提供以用于施用,该药物组合物包含
约120mg/mL的抗CD38抗体;
约2,000U/mL的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
本公开还涉及一种药物组合,包含GPRC5D×CD3双特异性抗体和抗CD38抗体,GPRC5D×CD3双特异性抗体包含GPRC5D结合结构域和CD3结合结构域,GPRC5D结合结构域包含SEQ ID NO:43的HCDR1、SEQ ID NO:44的HCDR2、SEQ ID NO:45的HCDR3、SEQ ID NO:46的LCDR1、SEQ ID NO:47的LCDR2和SEQ ID NO:48的LCDR3,CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ IDNO:37的LCDR2和SEQ ID NO:38的LCDR3,抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ IDNO:11的LCDR3。
在一些实施方案中,GPRC5D结合结构域包含SEQ ID NO:49的VH和SEQ ID NO:50的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL,并且抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
在一些实施方案中,GPRC5D×CD3双特异性抗体包含SEQ ID NO:51的HC1、SEQ IDNO:52的LC1、SEQ ID NO:41的HC2和SEQ ID NO:42的LC2,并且抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
在一些实施方案中,药物组合是非固定组合。
在一些实施方案中,药物组合包含在约25mM乙酸、约60mM氯化钠、约140甘露糖醇和约0.04%w/v聚山梨酸酯-20(PS-20)中的约20mg/mL至约120mg/mL的抗CD38抗体;pH为约5.5。
在一些实施方案中,药物组合包含约1,800mg的抗CD38抗体和约30,000U的rHuPH20。
在一些实施方案中,药物组合包含约120mg/mL的抗CD38抗体和约2,000U/mL的rHuPH20。
在一些实施方案中,药物组合还包含一种或多种赋形剂。
在一些实施方案中,该一种或多种赋形剂是组氨酸、甲硫氨酸、山梨糖醇或聚山梨酸酯-20(PS-20)或它们的任何组合。
在一些实施方案中,药物组合物包含
介于约100mg/mL至约120mg/mL之间的抗CD38抗体;
介于约5mM至约15mM之间的组氨酸;
介于约100mM至约300mM之间的山梨糖醇;
介于约0.01%w/v至约0.04%w/v之间的PS-20;和
介于约1mg/mL至约2mg/mL之间的甲硫氨酸,pH为约5.5至5.6。
在一些实施方案中,药物组合包含约10mM的组氨酸。
在一些实施方案中,药物组合包含约300mM的山梨糖醇。
在一些实施方案中,药物组合包含约0.04%(w/v)的PS-20。
在一些实施方案中,药物组合包含约1mg/mL的甲硫氨酸。
在一些实施方案中,药物组合包含
约1,800mg的抗CD38抗体;
约30,000U的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
在一些实施方案中,药物组合包含
约120mg/mL的抗CD38抗体;
约2,000U/mL的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
本公开还提供了包含结合GPRC5D的T细胞重定向治疗剂和抗CD38抗体的药物组合。
本公开还提供了一种治疗受试者的癌症的方法,包括向受试者施用治疗有效量的GPRC5D×CD3双特异性抗体以治疗癌症,其中该受试者对于用先前的抗癌治疗剂进行治疗是复发性的或难治性的。
在一些实施方案中,GPRC5D×CD3双特异性抗体包含GPRC5D结合结构域和CD3结合结构域,GPRC5D结合结构域包含SEQ ID NO:43的HCDR1、SEQ ID NO:44的HCDR2、SEQ ID NO:45的HCDR3、SEQ ID NO:46的LCDR1、SEQ ID NO:47的LCDR2和SEQ ID NO:48的LCDR3,并且CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3。
在一些实施方案中,GPRC5D结合结构域包含SEQ ID NO:49的VH和SEQ ID NO:50的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
在一些实施方案中,GPRC5D×CD3双特异性抗体是IgG4同种型并且包含HC1中第405位处的苯丙氨酸和第409位处的精氨酸以及HC2中第405位处的亮氨酸和第409位处的赖氨酸,其中残基根据EU索引进行编号。
在一些实施方案中,GPRC5D×CD3双特异性抗体还包含HC1和HC2两者中第228位的脯氨酸、第234位的丙氨酸和第235位的丙氨酸。
在一些实施方案中,GPRC5D×CD3双特异性抗体包含SEQ ID NO:51的HC1、SEQ IDNO:52的LC1)、SEQ ID NO:41的HC2和SEQ ID NO:42的LC2。
在一些实施方案中,癌症是血液恶性肿瘤或实体瘤。
在一些实施方案中,癌症是多发性骨髓瘤、淋巴瘤、黑素瘤、乳腺癌、子宫内膜癌、卵巢癌、肺癌、胃部癌症、前列腺癌、肾癌、肝癌、胰腺癌、结肠癌、食管癌、膀胱癌或宫颈肿瘤。
在一些实施方案中,多发性骨髓瘤是高危多发性骨髓瘤。
在一些实施方案中,患有高危多发性骨髓瘤的受试者具有一种或多种染色体异常,该一种或多种染色体异常包括:
t(4;14)(p16;q32);
t(14;16)(q32;q23);
del17p;
1qAmp;
t(4;14)(p16;q32)和t(14;16)(q32;q23);
t(4;14)(p16;q32)和del17p;
t(14;16)(q32;q23)和del17p;或者
t(4;14)(p16;q32)、t(14;16)(q32;q23)和del17p或它们的任何组合。
在一些实施方案中,受试者对于用抗CD38抗体、来那度胺、硼替佐米、泊马度胺、卡非佐米、elotozumab、艾莎佐米、美法仑或沙利度胺或它们的任何组合进行治疗是难治性的或复发性的。
在一些实施方案中,受试者对于用抗CD38抗体进行治疗是复发性的或难治性的。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
在一些实施方案中,抗CD38抗体是IgG1同种型。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
在一些实施方案中,抗CD38抗体包含:
SEQ ID NO:14的VH和SEQ ID NO:15的VL;
SEQ ID NO:16的VH和SEQ ID NO:17的VL;
SEQ ID NO:18的VH和SEQ ID NO:19的VL;或者
SEQ ID NO:20的VH和SEQ ID NO:21的VL。
在一些实施方案中,抗CD38抗体是IgG1同种型。
在一些实施方案中,受试者是人。
在一些实施方案中,该方法还包括向受试者施用一种或多种抗癌疗法。
在一些实施方案中,该一种或多种抗癌疗法选自自体同源干细胞移植(ASCT)、放射、外科手术、化学治疗剂、免疫调节剂和靶向癌症疗法。
在一些实施方案中,该一种或多种抗癌疗法选自来那度胺、沙利度胺、泊马度胺、硼替佐米、卡非佐米、elotozumab、艾莎佐米、美法仑、地塞米松、长春新碱、环磷酰胺、羟基柔红霉素、泼尼松、利妥昔单抗、伊马替尼、达沙替尼、尼洛替尼、博舒替尼、普纳替尼、巴非替尼、塞卡替尼、陶扎舍替或达鲁舍替、阿糖胞苷、柔红霉素、伊达比星、米托蒽醌、羟基脲、地西他滨、克拉屈滨、氟达拉滨、拓扑替康、依托泊苷6-硫鸟嘌呤、皮质类固醇、甲氨蝶呤、6-巯嘌呤、阿扎胞苷、三氧化二砷和全反式视黄酸或它们的任何组合。
本公开还提供了一种治疗受试者的癌症的方法,包括向受试者施用治疗有效量的结合CD19的T细胞重定向治疗剂和抗CD38抗体以治疗癌症。
在一些实施方案中,在施用结合CD19的T细胞重定向治疗剂之前,受试者已用抗CD38抗体进行治疗。
本公开还提供了一种增强结合CD19的T细胞重定向治疗剂在患有癌症的受试者中的功效的方法,包括在施用结合CD19的T细胞重定向治疗剂之前向该受试者施用抗CD38抗体。
在一些实施方案中,受试者对于在用先前的抗癌治疗剂进行治疗是复发性的或难治性的。
在一些实施方案中,癌症是血液恶性肿瘤或实体瘤。
在一些实施方案中,血液恶性肿瘤是淋巴瘤、B细胞恶性肿瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、DLBLC、FL、MCL、边缘区B细胞淋巴瘤(MZL)、粘膜相关淋巴组织淋巴瘤(MALT)、CLL、ALL、AML、华氏巨球蛋白血症或T细胞淋巴瘤。
在一些实施方案中,实体瘤是肺癌、肝癌、宫颈癌、结肠癌、乳腺癌、卵巢癌、胰腺癌、黑素瘤、胶质母细胞瘤、前列腺癌、食管癌或胃癌。WO2019057124A1公开了易于用结合CD19的T细胞重定向治疗剂进行治疗的癌症。
在一些实施方案中,T细胞重定向治疗剂结合CD3ε(CD3ε)、CD8、KI2L4、NKG2E、NKG2D、NKG2F、BTNL3、CD186、BTNL8、PD-1、CD195或NKG2C。
在一些实施方案中,结合CD19的T细胞重定向治疗剂包含以下各项的CD19结合结构域:博纳吐单抗、axicabtagene ciloleucel、tisagenlecleucel-t、inebilizumab、lisocabtagene maraleucel、XmAb-5574、CIK-CAR.CD19、ICTCAR-011、IM-19、JCAR-014、loncastuximab tesirine、MB-CART2019.1、OXS-1550、PBCAR-0191、PCAR-019、PCAR-119、Senl-001、TI-1007、XmAb-5871、PTG-01、PZ01、Senl_1904A、Senl_1904B、UCART-19、CSG-CD19、DI-B4、ET-190、GC-007F或GC-022。
在一些实施方案中,结合CD19的T细胞重定向治疗剂包含:博纳吐单抗、axicabtagene ciloleucel、tisagenlecleucel-t、inebilizumab、lisocabtagenemaraleucel、XmAb-5574、CIK-CAR.CD19、ICTCAR-011、IM-19、JCAR-014、loncastuximabtesirine、MB-CART2019.1、OXS-1550、PBCAR-0191、PCAR-019、PCAR-119、Senl-001、TI-1007、XmAb-5871、PTG-01、PZ01、Senl_1904A、Senl_1904B、UCART-19、CSG-CD19、DI-B4、ET-190、GC-007F或GC-022。
在一些实施方案中,结合CD19的T细胞重定向治疗剂是多特异性抗体、CAR或表达CAR的T细胞。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
在一些实施方案中,抗CD38抗体是IgG1同种型。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
在一些实施方案中,抗CD38抗体包含:
SEQ ID NO:14的VH和SEQ ID NO:15的VL;
SEQ ID NO:16的VH和SEQ ID NO:17的VL;
SEQ ID NO:18的VH和SEQ ID NO:19的VL;或者
SEQ ID NO:20的VH和SEQ ID NO:21的VL。
在一些实施方案中,抗CD38抗体是IgG1同种型。
在一些实施方案中,抗CD38抗体以介于约8mg/kg至约16mg/kg之间的剂量施用。
在一些实施方案中,结合CD19的T细胞重定向治疗剂和抗CD38抗体通过静脉注射施用。
在一些实施方案中,结合CD19的T细胞重定向治疗剂通过静脉注射施用,并且抗CD38抗体通过皮下注射施用。
在一些实施方案中,结合CD19的T细胞重定向治疗剂和抗CD38抗体通过皮下注射施用。
在一些实施方案中,受试者是人。
在一些实施方案中,结合CD19的T细胞重定向治疗剂是CD19×CD3双特异性抗体。
在一些实施方案中,该方法还包括向受试者施用一种或多种抗癌疗法。
在一些实施方案中,该一种或多种抗癌疗法选自自体同源干细胞移植(ASCT)、放射、外科手术、化学治疗剂、免疫调节剂和靶向癌症疗法。
本公开还提供了一种药物组合,包含CD19×CD3双特异性抗体和抗CD38抗体,CD19×CD3双特异性抗体包含SEQ ID NO:53的博纳吐单抗,并且抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
在一些实施方案中,抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
在一些实施方案中,药物组合是非固定组合。
在一些实施方案中,药物组合包含在约25mM乙酸、约60mM氯化钠、约140甘露糖醇和约0.04%w/v聚山梨酸酯-20(PS-20)中的约20mg/mL至约120mg/mL的抗CD38抗体;pH为约5.5。
在一些实施方案中,药物组合包含约1,800mg的抗CD38抗体和约30,000U的rHuPH20。
在一些实施方案中,药物组合包含约120mg/mL的抗CD38抗体和约2,000U/mL的rHuPH20。
在一些实施方案中,药物组合还包含一种或多种赋形剂。
在一些实施方案中,该一种或多种赋形剂是组氨酸、甲硫氨酸、山梨糖醇或聚山梨酸酯-20(PS-20)或它们的任何组合。
在一些实施方案中,药物组合包含
介于约100mg/mL至约120mg/mL之间的抗CD38抗体;
介于约5mM至约15mM之间的组氨酸;
介于约100mM至约300mM之间的山梨糖醇;
介于约0.01%w/v至约0.04%w/v之间的PS-20;和
介于约1mg/mL至约2mg/mL之间的甲硫氨酸,pH为约5.5至5.6。
在一些实施方案中,药物组合包含
约10mM的组氨酸。
在一些实施方案中,药物组合包含约300mM的山梨糖醇。
在一些实施方案中,药物组合包含约0.04%(w/v)的PS-20。
在一些实施方案中,药物组合包含约1mg/mL的甲硫氨酸。
在一些实施方案中,药物组合包含
约1,800mg的抗CD38抗体;
约30,000U的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
在一些实施方案中,药物组合包含
约120mg/mL的抗CD38抗体;
约2,000U/mL的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
在一些实施方案中,药物组合包含35mcg的用一水合柠檬酸(3.35mg)、赖氨酸盐酸盐(23.23mg)、聚山梨酸酯80(0.64mg)、二水合海藻糖(95.5mg)和氢氧化钠配制以将pH调节至7.0的博纳吐单抗。
在一些实施方案中,用3mL的不含防腐剂的注射用无菌水(USP)重构博纳吐单抗。
本公开提供了一种试剂盒,包含药物组合,该药物组合包含SEQ ID NO:53的博纳吐单抗以及包含含有SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3的抗CD38抗体。
T细胞重定向治疗剂可以是多特异性分子,诸如双特异性抗体。各种多特异性和/或双特异性格式包括本文所述的格式和重组IgG样双靶向分子,其中该分子的两侧各自含有至少两种不同抗体的Fab片段或Fab片段的一部分;IgG融合分子,其中全长IgG抗体与额外的Fab片段或Fab片段的部分融合;Fc融合分子,其中单链Fv分子或稳定的双体抗体与重链恒定域、Fc区或其部分融合;Fab融合分子,其中不同的Fab片段融合在一起;基于ScFv和双体的重链抗体(例如结构域抗体、纳米抗体),其中不同的单链Fv分子或不同的双体或不同的重链抗体(例如结构域抗体、纳米抗体)彼此融合或与另一蛋白或载体分子融合,或通过臂交换产生的多特异性抗体。示例性多特异性和/或双特异性形式包括双靶向分子,包括双靶向(DT)-Ig(GSK/Domantis)、二合一抗体(Genentech)和mAb2(F-Star)、双可变结构域(DVD)-Ig(Abbott)、Ts2Ab(MedImmune/AZ)和BsAb(Zymogenetics),HERCULES(BiogenIdec)和TvAb(Roche)、ScFv/Fc融合体(Academic Institution)、SCORPION(EmergentBioSolutions/Trubion、Zymogenetics/BMS)和双亲和力阻滞技术(Fc-DART)(MacroGenics)、F(ab)2(Medarex/AMGEN)、双作用或Bis-Fab(Genentech)、Dock-and-Lock(DNL)(ImmunoMedics)、二价双特异性(Biotecnol)和Fab-Fv(UCB-Celltech)、双特异性T细胞衔接器(BITE)(Micromet)、Tandem Diabody(Tandab)(Affimed)、双亲和力再靶向技术(DART)(MacroGenics)、单链二抗体(Academic)、TCR样抗体(AIT,ReceptorLogics)、人血清白蛋白ScFv融合体(Merrimack)和COMBODY(Epigen Biotech)、双靶向纳米抗体(Ablynx)、双靶向仅重链结构域抗体。已经描述了多种形式的双特异性抗体,例如在Chames和Baty(2009年)Curr Opin Drug Disc Dev,第12卷:第276页中和在Nunez-Prado等人,(2015年)Drug Discovery Today,第20卷第5期:第588-594页中所述。
用于本发明的方法中的结合特异性抗原的抗体也可从头选自例如噬菌体展示文库,其中噬菌体被工程化以表达人免疫球蛋白或其部分,诸如Fab、单链抗体(scFv)或者未配对或配对抗体可变区(Knappik等人,J Mol Biol第296卷:第57-86页,2000年;Krebs等人,J Immunol Meth254:67-84,2001;Vaughan等人,Nature Biotechnology,第14卷,第309-314页,1996年;Sheets等人,PITAS(USA),第95卷:第6157-6162页,1998年;Hoogenboom和Winter,J Mol Biol,第227卷第381页,1991年;Marks等人,J Mol Biol,第222卷:第581页,1991年)。将抗体重链可变区和轻链可变区表达为具有噬菌体pIX外壳蛋白的融合蛋白的噬菌体展示文库,如Shi等人,(2010年)J.Mol.Biol.第397卷:第385-396页和国际专利公布WO2009/085462中所述。可从抗体文库中筛选结合到期望抗原诸如BCMA、CD3、CD38、CD123、CD19、CD33、PSMA或TMEFF2胞外结构域的抗体,并可进一步表征所获得的阳性克隆,从克隆裂解物中分离Fab,然后将其克隆为全长抗体。此类用于分离人抗体的噬菌体展示方法在本领域是已建立的。参见例如:美国专利5,223,409;美国专利5,403,484;美国专利5,571,698;美国专利5,427,908;美国专利5,580,717;美国专利5,969,108;美国专利6,172,197;美国专利5,885,793;美国专利6,521,404;美国专利6,544,731;美国专利6,555,313;美国专利6,582,915;以及美国专利6,593,081。
T细胞重定向双特异性抗体可通过如下过程在无细胞环境中体外产生:根据国际专利公布WO2011/131746所述的方法,在两个单特异性同源二聚抗体的CH3区域中引入非对称突变,并在允许二硫键异构化的还原条件下由两个亲本单特异性同源二聚抗体形成双特异性异源二聚抗体。在该方法中,两种单特异性二价抗体被工程化以在CH3结构域处具有某些促进异源二聚体稳定性的置换;将这些抗体在足以使铰链区中的半胱氨酸发生二硫键异构化的还原条件下一起温育;从而通过Fab臂交换产生双特异性抗体。温育条件最理想地可恢复到非还原条件。可使用的示例性还原剂为2-巯基乙胺(2-MEA)、二硫苏糖醇(DTT)、二硫赤藓糖醇(DTE)、谷胱甘肽、三(2-羧乙基)膦(TCEP)、L-半胱氨酸和β-巯基乙醇,优选地为选自2-巯基乙胺、二硫苏糖醇和三(2-羧乙基)膦的还原剂。例如,可使用如下条件:在至少25mM 2-MEA的存在下或至少0.5mM二硫苏糖醇的存在下,在5-8的pH例如pH7.0或pH7.4,至少20℃的温度下,温育至少90分钟。
可用于双特异性抗体的第一重链和第二重链的示例性CH3突变是K409R和/或F405L。
可使用的附加CH3突变包括技术诸如
Knob-in-hole突变公开于例如WO1996/027011中,并且包括CH3区的界面上的突变,其中具有小侧链(臼(hole))的氨基酸被引入第一CH3区,并且具有大侧链(杵(knob))的氨基酸被引入第二CH3区,从而导致第一CH3区和第二CH3区之间的优先相互作用。形成杵和臼的示例性CH3区突变是T366Y/F405A、T366W/F405W、F405W/Y407A、T394W/Y407T、T394S/Y407A、T366W/T394S、F405W/T394S和T366W/T366S_L368A_Y407V。
重链异源二聚体的形成可通过使用静电相互作用,通过置换第一CH3区域上的带正电残基和第二CH3区域上的带负电残基来促进,如在US2010/0015133、US2009/0182127、US2010/028637或US2011/0123532中所述。
可用于促进重链异源二聚化的其他非对称突变是L351Y_F405A_Y407V/T394W、T366I_K392M_T394W/F405A_Y407V、T366L_K392M_T394W/F405A_Y407V、L351Y_Y407A/T366A_K409F、L351Y_Y407A/T366V_K409F、Y407A/T366A_K409F或T350V_L351Y_F405A_Y407V/T350V_T366L_K392L_T394W,如在US2012/0149876或US2013/0195849中所述。
SEEDbody突变涉及将选择的IgG残基置换为IgA残基以促进重链异源二聚化,如在US20070287170中所述。
可以使用的其他示例性突变是如在WO2007/147901、WO2011/143545、WO2013157954、WO2013096291和US2018/0118849中所述的R409D_K370E/D399K_E357K、S354C_T366W/Y349C_T366S_L368A_Y407V、Y349C_T366W/S354C_T366S_L368A_Y407V、T366K/L351D、L351K/Y349E、L351K/Y349D、L351K/L368E、L351Y_Y407A/T366A_K409F、L351Y_Y407A/T366V_K409F、K392D/D399K、K392D/E356K、K253E_D282K_K322D/D239K_E240K_K292D、K392D_K409D/D356K_D399K。
可用作T细胞重定向治疗剂的附加双特异性或多特异性结构包括双可变结构域免疫球蛋白(DVD)(国际专利公布WO2009/134776;DVD是包含具有结构VH1-接头-VH2-CH的重链和具有结构VL1-接头-VL2-CL的轻链的全长抗体;接头是任选的)、包括各种二聚化结构域以连接具有不同特异性的两个抗体臂的结构(诸如亮氨酸拉链或胶原二聚化结构域(国际专利公布WO2012/022811、美国专利5,932,448;美国专利6,833,441)),缀合在一起的两个或更多个结构域抗体(dAb)、双体、仅重链抗体(诸如骆驼抗体和工程化骆驼抗体)、双靶向(DT)-Ig(GSK/Domantis)、二合一抗体(Genentech)、交联Mab(Karmanos CancerCenter)、mAb2(F-Star)和CovX体(CovX/Pfizer)、IgG样双特异性抗体(InnClone/EliLilly)、Ts2Ab(MedImmune/AZ)和BsAb(Zymogenetics)、HERCULES(Biogen Idec)和TvAb(Roche)、ScFv/Fc融合体(Academic Institution)、SCORPION(Emergent BioSolutions/Trubion、Zymogenetics/BMS)、双亲和力重定向技术(Fc-DART)(MacroGenics)和双(ScFv)
T细胞重定向治疗剂诸如双特异性或多特异性抗体或抗CD38抗体的Fc区可在Fc区中包含至少一个置换,该至少一个置换降低T细胞重定向治疗剂与活化Fcγ受体(FcγR)的结合和/或降低Fc效应子功能,诸如C1q结合、补体依赖性细胞毒性(CDC)、抗体依赖性细胞介导的细胞毒性(ADCC)或吞噬作用(ADCP)。
可以被置换以降低Fc与活化FcγR的结合并随后降低效应子功能的Fc位置是IgG1上的置换L234A/L235A、IgG2上的V234A,/G237A/P238S/H268A/V309L/A330S/P331S、IgG4上的F234A/L235A、IgG4上的S228P/F234A/L235A、所有Ig同种型上的N297A、IgG2上的V234A/G237A、IgG1上的K214T/E233P/L234V/L235A/G236-缺失/A327G/P331A/D365E/L358M、IgG2上的H268Q/V309L/A330S/P331S、IgG1上的S267E/L328F、IgG1上的L234F/L235E/D265A、IgG1上的L234A/L235A/G237A/P238S/H268A/A330S/P331S、IgG4上的S228P/F234A/L235A/G237A/P238S以及IgG4上的S228P/F234A/L235A/G236-缺失/G237A/P238S。
可用于降低CDC的Fc置换是K322A置换。
熟知的S228P置换还可在IgG4抗体中进行,以增强IgG4稳定性。
示例性野生型IgG1包含SEQ ID NO:103的氨基酸序列。
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
示例性野生型IgG4包含SEQ ID NO:104的氨基酸序列。
ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK
“抗体依赖性细胞的细胞毒性”、“抗体依赖性细胞介导的细胞毒性”或“ADCC”是诱导细胞死亡的机制,该机制依赖于抗体包被靶细胞与具有裂解活性的效应细胞(诸如自然杀伤细胞(NK)、单核细胞、巨噬细胞和中性粒细胞)经由效应细胞上表达的Fcγ受体(FcγR)发生的相互作用。例如,NK细胞表达FcγRIIIa,而单核细胞表达FcγRI、FcγRII和FcγRIIIa。抗体的ADCC活性可使用体外测定,使用表达抗体所结合的蛋白质的细胞作为靶细胞和NK细胞作为效应细胞来评估。根据从裂解的细胞中释放的标记物(例如放射性底物、荧光染料或天然胞内蛋白)来检测细胞裂解。在示例性测定中,可以按1个靶细胞与4个效应细胞的比率使用靶细胞。将靶细胞用BATDA预先标记并与效应细胞和测试抗体组合。将样本温育2小时,并且通过测量释放到上清液中的BATDA来测量细胞裂解。使数据针对使用0.67%Triton X-100(Sigma Aldrich)的最大细胞毒性和通过在不存在任何抗体的情况下来自靶细胞的BATDA自发释放测定的最小对照标准化。
“抗体依赖性细胞吞噬作用”(“ADCP”)是指通过吞噬细胞(诸如巨噬细胞或树突状细胞)的内化作用消除抗体包被的靶细胞的机制。ADCP可通过如下方式评价:使用单核细胞来源的巨噬细胞作为效应细胞,以及表达抗体所结合的蛋白质的细胞作为也经工程化以表达GFP或另一标记分子的靶细胞。在示例性测定中,效应细胞:靶细胞比例可以是例如4:1。可在含或不含本发明抗体的情况下,将效应细胞与靶细胞一起温育4小时。在温育后,可使用细胞消化液(accutase)分离细胞。可使用偶联至荧光标记的抗-CD11b抗体和抗-CD14抗体鉴定巨噬细胞,并且可使用标准方法基于CD11
“补体依赖性细胞毒性”(CDC)是指诱导细胞死亡的机制,其中靶结合抗体的Fc效应域结合并激活补体成分C1q,C1q继而激活补体级联,从而导致靶细胞死亡。补体的激活也可导致补体成分沉积在靶细胞表面上,这些补体成分通过结合白细胞上的补体受体(例如,CR3)来促进CDC。可例如通过如下方式测量细胞的CDC:将Daudi细胞以1×10
可使用流式细胞术在经工程化以表达每个受体的细胞上评定抗体与FcγR或FcRn的结合。在示例性结合测定中,将2×10
嵌合抗原受体(CAR)是遗传工程受体。这些工程化受体可根据本领域已知的技术容易地插入免疫细胞(包括T细胞)中并由其表达。对于CAR,单个受体可被编程为识别特异性抗原,并且当与该抗原结合时,激活免疫细胞以攻击和破坏携带该抗原的细胞。当这些抗原存在于肿瘤细胞上时,表达CAR的免疫细胞可靶向并杀伤肿瘤细胞。
CAR通常包含结合抗原的胞外结构域(例如前列腺新抗原)、任选的接头、跨膜结构域和包含共刺激结构域和/或信号结构域的胞质结构域。
CAR的胞外域可含有结合期望抗原(例如前列腺新抗原)的任何多肽。胞外域可包括scFv、抗体的一部分或另选的支架。CAR也可被工程化以结合两种或更多种期望抗原,该抗原可串联排列并由接头序列隔开。例如,可经由接头一前一后地组织一种或多种结构域抗体、scFvs、schma VHH抗体或其他仅VH的抗体片段,以向CAR提供双特异性或多特异性。
CAR的跨膜结构域可来源于CD8、T细胞受体的α、β或ζ链、CD28、CD3ε、CD45、CD4、CD5、CD8、CD9、CD16、CD22、CD33、CD37、CD64、CD80、CD86、CD134、CD137、CD154、KIRDS2、OX40、CD2、CD27、LFA-1(CDI la、CD18)、ICOS(CD278)、4-1BB(CD137)、4-1BBL、GITR、CD40、BAFFR、HVEM(LIGHTR)、SLAMF7、NKp80(KLRFI)、CD160、CD19、IL2Rβ、IL2Rγ、IL7R a、ITGA1、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CDI Id、ITGAE、CD103、ITGAL、CDIla、LFA-1、ITGAM、CDI lb、ITGAX、CDI lc、ITGB1、CD29、ITGB2、CD18、LFA-1、ITGB7、TNFR2、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(Tactile)、CEACAM1、CRT AM、Ly9(CD229)、CD160(BY55)、PSGL1、CD100(SEMA4D)、SLAMF6(NTB-A、Lyl08)、SLAM(SLAMF1、CD150、IPO-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、PAG/Cbp、NKp44、NKp30、NKp46、NKG2D和/或NKG2C的跨膜结构域。
CAR的胞内共刺激结构域可来源于一种或多种共刺激分子的胞内结构域。共刺激分子是熟知的除抗原受体或Fc受体之外的细胞表面分子,其提供T淋巴细胞在与抗原结合时有效活化和功能所需的第二信号。可用于CAR的示例性共刺激结构域是4-1BB、CD2、CD7、CD27、CD28、CD30、CD40、CD54(ICAM)、CD83、CD134(OX40)、CD150(SLAMF1)、CD152(CTLA4)、CD223(LAG3)、CD270(HVEM)、CD278(ICOS)、DAP10、LAT、NKD2C SLP76、TRIM和ZAP70的胞内结构域。
CAR的胞内信号结构域可来源于例如Ο′O3ζ、CD3ε、CD22、CD79a、CD66d或CD39的信号结构域。“胞内信号结构域”是指CAR多肽参与将有效CAR与靶抗原结合的信息转导到免疫效应细胞内部以引发效应细胞功能的部分,例如,活化、细胞因子的产生、增殖和细胞毒性活性,包括细胞毒性因子向CAR结合的靶细胞的释放,或在抗原结合到胞外CAR结构域后引发的其他细胞应答。
定位在胞外结构域和跨膜结构域之间的CAR的任选接头可以是长度为约2割至100个氨基酸的多肽。接头可包括柔性残基(诸如甘氨酸和丝氨酸)或由柔性残基构成,使得相邻的蛋白质结构域相对于彼此自由移动。当希望确保两个相邻结构域不会在空间上彼此干扰时,可使用较长的接头。接头可以是可裂解的或不可裂解的。可裂解接头的示例包括2A接头(例如T2A)、2A样接头或它们的功能等同物以及它们的组合。接头还可来源于铰链区或任何免疫球蛋白的铰链区的部分。
可使用的示例性CAR是例如CAR,其包含结合本发明的前列腺新抗原的胞外结构域、CD8跨膜结构域和CD3ζ信号结构域。其他示例性CAR包含结合本发明前列腺新抗原的胞外结构域、CD8或CD28跨膜结构域、CD28、41BB或OX40共刺激结构域和CD3ζ信号结构域。
通过标准分子生物学技术生成CAR。结合期望抗原的胞外结构域可来源于使用本文所述的技术产生的抗体或其抗原结合片段。
虽然已经概括地描述了本发明,但是本发明的实施方案还将在以下实施例中进一步公开,以下实施例不应理解为限制权利要求的范围。
下文根据本文别处的公开内容陈述了本发明的某些其他实施方案。上文陈述为与本文所公开的发明相关的本发明的实施方案的特征还涉及所有这些其他带编号的实施方案中的每一者。
实施方案1.一种用于与T细胞重定向治疗剂联合治疗患有癌症的受试者的抗CD38抗体。
实施方案2.一种用于增强患有癌症的受试者中T细胞重定向治疗剂的功效的抗CD38抗体。
实施方案3.抗CD38抗体与T细胞重定向治疗剂联合用于制备治疗患有癌症的患者的药物或药物组合物的用途。
实施方案4.抗CD38抗体与T细胞重定向治疗剂联合的用途,其特征在于用于制备可用于在对其有需要的患者中治疗患有癌症的受试者的组合。
实施方案5.根据实施方案1至4中任一项使用的所述抗CD38抗体,其中所述抗CD38抗体在施用所述T细胞重定向治疗剂之前施用。
实施方案6.根据实施方案1至5中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂结合BCMA、GPRC5D、CD33、CD123、CD19、PSMA、TMEFF2或CD20。
实施方案7.根据实施方案1至6中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂结合CD3、CD3ε(CD3ε)、CD8、KI2L4、NKG2E、NKG2D、NKG2F、BTNL3、CD186、BTNL8、PD-1、CD195或NKG2C。
实施方案8.根据实施方案1至7中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含CD3结合结构域,所述CD3结合结构域包含
SEQ ID NO:33的重链互补决定区1(HCDR1)、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的轻链互补决定区1(LCDR1)、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3;
SEQ ID NO:39的重链可变区(VH)和SEQ ID NO:40的轻链可变区(VL);
SEQ ID NO:74的HCDR1、SEQ ID NO:75的HCDR2、SEQ ID NO:76的HCDR3、SEQ IDNO:77的LCDR1、SEQ ID NO:78的LCDR2和SEQ ID NO:79的LCDR3;
SEQ ID NO:80的VH和SEQ ID NO:81的VL;
SEQ ID NO:53的CD3结合结构域的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3;或者
SEQ ID NO:53的CD3结合结构域的VH和VL。
实施方案9.根据实施方案1至8中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含
BCMA结合结构域和CD3结合结构域,所述BCMA结合结构域包含SEQ ID NO:23的HCDR1、SEQ ID NO:24的HCDR2、SEQ ID NO:25的HCDR3、SEQ ID NO:26的LCDR1、SEQ ID NO:27的LCDR2和SEQ ID NO:28的LCDR3,并且所述CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3;以及/或者
BCMA结合结构域包含SEQ ID NO:29的VH和SEQ ID NO:30的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
实施方案10.根据实施方案1至9中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含SEQ ID NO:31的第一重链(HC1)、SEQ ID NO:32的第一轻链(LC1)、SEQID NO:41的第二重链(HC2)和SEQ ID NO:42的第二轻链(LC2)。
实施方案11.根据实施方案1至10中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含
GPRC5D结合结构域和CD3结合结构域,所述GPRC5D结合结构域包含SEQ ID NO:43的HCDR1、SEQ ID NO:44的HCDR2、SEQ ID NO:45的HCDR3、SEQ ID NO:46的LCDR1、SEQ IDNO:47的LCDR2和SEQ ID NO:48的LCDR3,并且所述CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3;以及/或者
GPRC5D结合结构域包含SEQ ID NO:49的VH和SEQ ID NO:50的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
实施方案12.根据实施方案111中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含SEQ ID NO:51的HC1、SEQ ID NO:52的LC1、SEQ ID NO:41的HC2和SEQ IDNO:42的LC2。
实施方案13.根据实施方案1至12中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含
CD33结合结构域和CD3结合结构域,所述CD33结合结构域包含SEQ ID NO:84的HCDR1、SEQ ID NO:85的HCDR2、SEQ ID NO:86的HCDR3、SEQ ID NO:87的LCDR1、SEQ ID NO:88的LCDR2和SEQ ID NO:89的LCDR3,并且所述CD3结合结构域包含SEQ ID NO:74的HCDR1、SEQ ID NO:75的HCDR2、SEQ ID NO:76的HCDR3、SEQ ID NO:77的LCDR1、SEQ ID NO:78的LCDR2和SEQ ID NO:79的LCDR3;以及/或者
CD33结合结构域包含SEQ ID NO:90的VH和SEQ ID NO:91的VL,并且CD3结合结构域包含SEQ ID NO:80的VH和SEQ ID NO:81的VL。
实施方案14.根据实施方案1至13中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含SEQ ID NO:92的HC1、SEQ ID NO:93的LC1、SEQ ID NO:82的HC2和SEQID NO:83的LC2。
实施方案15.根据实施方案1至14中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含
CD123结合结构域和CD3结合结构域,所述CD123结合结构域包含SEQ ID NO:94的HCDR1、SEQ ID NO:95的HCDR2、SEQ ID NO:96的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:59的LCDR3,并且所述CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3;以及/或者
CD123结合结构域包含SEQ ID NO:100的VH和SEQ ID NO:61的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
实施方案16.根据实施方案1至15中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含SEQ ID NO:102的HC1、SEQ ID NO:63的LC1、SEQ ID NO:41的HC2和SEQID NO:42的LC2。
实施方案17.根据实施方案1至16中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含
CD19结合结构域和CD3结合结构域,所述CD19结合结构域包含SEQ ID NO:53的CD19结合结构域的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3,并且所述CD3结合结构域包含SEQ ID NO:53的CD3结合结构域的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3;以及/或者SEQ ID NO:53的氨基酸序列。
实施方案18.根据实施方案1至17中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含
PSMA结合结构域和CD3结合结构域,所述PSMA结合结构域包含SEQ ID NO:54的HCDR1、SEQ ID NO:55的HCDR2、SEQ ID NO:56的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:59的LCDR3,并且所述CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3;以及/或者
PSMA结合结构域包含SEQ ID NO:60的VH和SEQ ID NO:61的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
实施方案19.根据实施方案1至18中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含SEQ ID NO:62的HC1、SEQ ID NO:63的LC1、SEQ ID NO:41的HC2和SEQID NO:42的LC2。
实施方案20.根据实施方案1至19中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含
TMEFF2结合结构域和CD3结合结构域,所述TMEFF2结合结构域包含SEQ ID NO:64的HCDR1、SEQ ID NO:65的HCDR2、SEQ ID NO:66的HCDR3、SEQ ID NO:67的LCDR1、SEQ IDNO:68的LCDR2和SEQ ID NO:69的LCDR3,并且所述CD3结合结构域包含SEQ ID NO:74的HCDR1、SEQ ID NO:75的HCDR2、SEQ ID NO:76的HCDR3、SEQ ID NO:77的LCDR1、SEQ ID NO:78的LCDR2和SEQ ID NO:79的LCDR3;以及/或者
TMEFF2结合结构域包含SEQ ID NO:70的VH和SEQ ID NO:71的VL,并且CD3结合结构域包含SEQ ID NO:80的VH和SEQ ID NO:81的VL。
实施方案21.根据实施方案1至20中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂包含SEQ ID NO:72的HC1、SEQ ID NO:73的LC1、SEQ ID NO:82的HC2和SEQID NO:83的LC2。
实施方案22.根据实施方案1至21中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂是多特异性抗体、嵌合抗原受体(CAR)或包含所述CAR的T细胞。
实施方案23.根据实施方案22使用的所述抗CD38抗体,其中所述多特异性抗体是IgG1、IgG2、IgG3或IgG4同种型。
实施方案24.根据实施方案22或23使用的所述抗CD38抗体,其中所述多特异性抗体包含降低所述多特异性抗体与Fcγ受体(FcγR)的结合的一个或多个Fc置换。
实施方案25.根据实施方案22至24中任一项使用的所述抗CD38抗体,其中所述一个或多个Fc置换选自IgG4上的F234A/L235A、IgG1上的L234A/L235A、IgG2上的V234A/G237A/P238S/H268A/V309L/A330S/P331S、IgG4上的F234A/L235A、IgG4上的S228P/F234A/L235A、所有Ig同种型上的N297A、IgG2上的V234A/G237A、IgG1上的K214T/E233P/L234V/L235A/G236-缺失/A327G/P331A/D365E/L358M、IgG2上的H268Q/V309L/A330S/P331S、IgG1上的S267E/L328F、IgG1上的L234F/L235E/D265A、IgG1上的L234A/L235A/G237A/P238S/H268A/A330S/P331S、IgG4上的S228P/F234A/L235A/G237A/P238S和IgG4上的S228P/F234A/L235A/G236-缺失/G237A/P238S,其中残基根据EU索引进行编号。
实施方案26.根据实施方案25使用的所述抗CD38抗体,其中所述多特异性抗体还包含S228P置换。
实施方案27.根据实施方案22至26中任一项使用的所述抗CD38抗体,其中所述多特异性抗体在第一CH3结构域或在第二CH3结构域中或在所述第一CH3结构域和所述第二CH3结构域两者中包含一个或多个非对称置换。
实施方案28.根据实施方案27中任一项使用的所述抗CD38抗体,其中所述一个或多个非对称置换选自F450L/K409R、野生型/F409L_R409K、T366Y/F405A、T366W/F405W、F405W/Y407A、T394W/Y407T、T394S/Y407A、T366W/T394S、F405W/T394S和T366W/T366S_L368A_Y407V、L351Y_F405A_Y407V/T394W、T366I_K392M_T394W/F405A_Y407V、T366L_K392M_T394W/F405A_Y407V、L351Y_Y407A/T366A_K409F、L351Y_Y407A/T366V_K409F、Y407A/T366A_K409F和T350V_L351Y_F405A_Y407V/T350V_T366L_K392L_T394W。
实施方案29.根据实施方案1至28中任一项使用的所述抗CD38抗体,其中所述受试者患有新诊断的癌症。
实施方案30.根据实施方案1至29中任一项使用的所述抗CD38抗体,其中所述受试者对于先前的抗癌疗法是复发性的或难治性的。
实施方案31.根据实施方案1至30中任一项使用的所述抗CD38抗体,其中所述癌症是血液恶性肿瘤或实体瘤。
实施方案32.根据实施方案1至31中任一项使用的所述抗CD38抗体,其中所述血液恶性肿瘤是多发性骨髓瘤、冒烟型多发性骨髓瘤、未明确诊断意义的单克隆丙种球蛋白病(MGUS)、急性淋巴母细胞白血病(ALL)、弥漫性大B细胞淋巴瘤(DLBCL)、伯基特淋巴瘤(BL)、滤泡性淋巴瘤(FL)、套细胞淋巴瘤(MCL)、华氏巨球蛋白血症、浆细胞白血病、轻链淀粉样变性(AL)、前体B细胞淋巴母细胞白血病、前体B细胞淋巴母细胞白血病、急性髓性白血病(AML)、骨髓增生异常综合征(MDS)、慢性淋巴细胞白血病(CLL)、B细胞恶性肿瘤、慢性髓性白血病(CML)、毛细胞白血病(HCL)、母细胞性浆细胞样树突状细胞瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、边缘区B细胞淋巴瘤(MZL)或粘膜相关淋巴组织淋巴瘤(MALT)、浆细胞白血病、间变性大细胞淋巴瘤(ALCL)、白血病或淋巴瘤。
实施方案33.根据实施方案1至32中任一项使用的所述抗CD38抗体,其中所述多发性骨髓瘤是新诊断的多发性骨髓瘤。
实施方案34.根据实施方案1至32中任一项使用的所述抗CD38抗体,其中所述多发性骨髓瘤是复发性的或难治性的多发性骨髓瘤。
实施方案35.根据实施方案1至34中任一项使用的所述抗CD38抗体,其中所述多发性骨髓瘤是高危多发性骨髓瘤。
实施方案36.根据实施方案35使用的所述抗CD38抗体,其中患有所述高危多发性骨髓瘤的所述受试者具有一种或多种染色体异常,所述一种或多种染色体异常包括:
t(4;14)(p16;q32);
t(14;16)(q32;q23);
del17p;
1qAmp;
t(4;14)(p16;q32)和t(14;16)(q32;q23);
t(4;14)(p16;q32)和del17p;
t(14;16)(q32;q23)和del17p;或者
t(4;14)(p16;q32)、t(14;16)(q32;q23)和del17p或它们的任何组合。
实施方案37.根据实施方案1至36中任一项使用的所述抗CD38抗体,其中所述多发性骨髓瘤对于用所述抗CD38抗体、来那度胺、硼替佐米、泊马度胺、卡非佐米、elotozumab、艾莎佐米、美法仑或沙利度胺或它们的任何组合进行治疗是复发性的或难治性的。
实施方案38.根据实施方案1至37中任一项使用的所述抗CD38抗体,其中所述实体瘤是前列腺癌、肺癌、肝癌、宫颈癌、结肠癌、乳腺癌、卵巢癌、子宫内膜癌、胰腺癌、黑素瘤、胶质母细胞瘤、食管癌、胃癌、胃部癌症、肾癌、结肠癌、膀胱癌、宫颈肿瘤、黑素瘤、肝细胞癌、肾细胞癌、尿道上皮癌、头颈癌、胶质瘤或胶质母细胞瘤。
实施方案39.根据实施方案38使用的所述抗CD38抗体,其中所述前列腺癌是复发性前列腺癌、难治性前列腺癌、恶性前列腺癌或去势抵抗性前列腺癌或它们的任何组合。
实施方案40.根据实施方案32使用的所述抗CD38抗体,其中所述AML是具有至少一种遗传异常的AML、具有多系发育异常的AML、治疗相关的AML、未分化的AML、具有最小成熟度的AML、具有成熟度的AML、急性髓单核细胞白血病、急性单核细胞白血病、急性红白血病、急性成巨核细胞白血病、急性嗜碱粒细胞白血病、急性全髓增生症伴纤维化或髓系肉瘤。
实施方案41.根据实施方案40使用的所述抗CD38抗体,其中所述至少一种遗传异常是染色体8和21之间的易位,染色体16中的易位或倒位,染色体15和17之间的易位,染色体11的改变,或fms相关的酪氨酸激酶3(FLT3)、核仁磷酸蛋白(NPM1)、异柠檬酸脱氢酶1(IDH1)、异柠檬酸脱氢酶2(IDH2)、DNA(胞嘧啶-5)-甲基转移酶3(DNMT3A)、CCAAT/增强子结合蛋白α(CEBPA)、U2小核RNA辅助因子1(U2AF1)、zeste增强子2多梳抑制复合物2亚基(EZH2)、染色体1A的结构维持(SMC1A)或染色体3的结构维持(SMC3)的突变。
实施方案42.根据实施方案41使用的所述抗CD38抗体,其中所述至少一种遗传异常是易位t(8;21)(q22;q22)、倒位inv(16)(p13;q22)、易位t(16;16)(p13;q22)、易位t(15;17)(q22;q12)、IDH1中的突变FLT3-ITD、突变R132H或R100Q/R104V/F108L/R119Q/I130V或IDH2中的突变R140Q或R172。
实施方案43.根据实施方案32使用的所述抗CD38抗体,其中所述ALL是B细胞谱系ALL、T细胞谱系ALL、成人ALL或小儿ALL。
实施方案44.根据实施方案43使用的所述抗CD38抗体,其中患有ALL的所述受试者具有费城染色体或者对用BCR-ABL激酶抑制剂进行的治疗表现出抗性或者已获得对这种治疗的抗性。
实施方案45.根据实施方案1至44中任一项使用的所述抗CD38抗体,其中所述抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ IDNO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
实施方案46.根据实施方案1至45中任一项使用的所述抗CD38抗体,其中所述抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
实施方案47.根据实施方案1至46中任一项使用的所述抗CD38抗体,其中所述抗CD38抗体是IgG1同种型。
实施方案48.根据实施方案1至47中任一项使用的所述抗CD38抗体,其中所述抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
实施方案49.根据实施方案1至44中任一项使用的所述抗CD38抗体,其中所述抗CD38抗体包含
SEQ ID NO:14的VH和SEQ ID NO:15的VL;
SEQ ID NO:16的VH和SEQ ID NO:17的VL;
SEQ ID NO:18的VH和SEQ ID NO:19的VL;或者
SEQ ID NO:20的VH和SEQ ID NO:21的VL。
实施方案50.根据实施方案49使用的所述抗CD38抗体,其中所述抗CD38抗体是IgG1同种型。
实施方案51.根据实施方案1至50中任一项使用的所述抗CD38抗体,其中所述T细胞重定向治疗剂是BCMA×CD3双特异性抗体、GPRC5D×CD3双特异性抗体、CD33×CD3双特异性抗体、CD19×CD3双特异性抗体、CD123×CD3双特异性抗体、PSMA×CD3双特异性抗体或TMEFF2×CD3双特异性抗体。
实施方案52.根据实施方案1至51中任一项使用的所述抗CD38抗体,还包括向所述受试者施用一种或多种抗癌疗法。
实施方案53.根据实施方案1至52中任一项使用的所述抗CD38抗体,其中所述一种或多种抗癌疗法选自自体同源干细胞移植(ASCT)、放射、外科手术、化学治疗剂、免疫调节剂和靶向癌症疗法。
实施方案54.根据实施方案1至53中任一项使用的所述抗CD38抗体,其中所述一种或多种抗癌疗法选自来那度胺、沙利度胺、泊马度胺、硼替佐米、卡非佐米、elotozumab、艾莎佐米、美法仑、地塞米松、长春新碱、环磷酰胺、羟基柔红霉素、泼尼松、利妥昔单抗、伊马替尼、达沙替尼、尼洛替尼、博舒替尼、普纳替尼、巴非替尼、塞卡替尼、陶扎舍替或达鲁舍替、阿糖胞苷、柔红霉素、伊达比星、米托蒽醌、羟基脲、地西他滨、克拉屈滨、氟达拉滨、拓扑替康、依托泊苷6-硫鸟嘌呤、皮质类固醇、甲氨蝶呤、6-巯嘌呤、阿扎胞苷、三氧化二砷和全反式视黄酸或它们的任何组合。
实施方案55.根据实施方案1至54中任一项使用的所述抗CD38抗体,其中所述抗CD38抗体以介于约8mg/kg至约16mg/kg之间的剂量施用。
实施方案56.根据实施方案1至55中任一项使用的所述抗CD38抗体,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含在约25mM乙酸、约60mM氯化钠、约140甘露糖醇和约0.04%w/v聚山梨醇酯-20(PS-20)中的介于约20mg/mL至约120mg/mL之间的所述抗CD38抗体;pH为约5.5。
实施方案57.根据实施方案1至53中任一项使用的所述抗CD38抗体,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含约1,800mg的所述抗CD38抗体和约30,000U的rHuPH20。
实施方案58.根据实施方案57使用的所述抗CD38抗体,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含约120mg/mL的所述抗CD38抗体和约2,000U/mL的rHuPH20。
实施方案59.根据实施方案57至58中任一项使用的所述抗CD38抗体,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含
介于约5mM至约15mM之间的组氨酸;
介于约100mM至约300mM之间的山梨糖醇;
介于约0.01%w/v至约0.04%w/v之间的PS-20;和
介于约1mg/mL至约2mg/mL之间的甲硫氨酸,pH为约5.5至5.6。
实施方案60.根据实施方案57至59中任一项使用的所述抗CD38抗体,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含
约1,800mg的所述抗CD38抗体;
约30,000U的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
实施方案61.根据实施方案57至60中任一项使用的所述抗CD38抗体,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含
约120mg/mL的所述抗CD38抗体;
约2,000U/mL的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
实施方案62.一种用于与抗CD38抗体联合治疗患有癌症的受试者的BCMA×CD3双特异性抗体。
实施方案63.根据实施方案62使用的BCMA×CD3双特异性抗体,其中在施用所述BCMA×CD3双特异性抗体之前,所述受试者已用抗CD38抗体进行治疗。
实施方案64.根据实施方案62或63使用的所述BCMA×CD3双特异性抗体,其中所述BCMA×CD3双特异性抗体包含BCMA结合结构域和CD3结合结构域,所述BCMA结合结构域包含SEQ ID NO:23的HCDR1、SEQ ID NO:24的HCDR2、SEQ ID NO:25的HCDR3、SEQ ID NO:26的LCDR1、SEQ ID NO:27的LCDR2和SEQ ID NO:28的LCDR3,并且所述CD3结合结构域包含SEQID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3。
实施方案65.根据实施方案62至64中任一项使用的所述BCMA×CD3双特异性抗体,其中所述BCMA结合结构域包含SEQ ID NO:29的VH和SEQ ID NO:30的VL,并且所述CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
实施方案66.根据实施方案62至65中任一项使用的所述BCMA×CD3双特异性抗体,其中所述BCMA×CD3双特异性抗体是IgG4同种型并且包含HC1中第405位处的苯丙氨酸和第409位处的精氨酸以及HC2中第405位处的亮氨酸和第409位处的赖氨酸,其中残基根据EU索引进行编号。
实施方案67.根据实施方案62至66中任一项使用的所述BCMA×CD3双特异性抗体,其中所述BCMA×CD3双特异性抗体还包含HC1和HC2两者中第228位的脯氨酸、第234位的丙氨酸和第235位的丙氨酸。
实施方案68.根据实施方案62至67中任一项使用的所述BCMA×CD3抗体,其中所述BCMA×CD3双特异性抗体包括SEQ ID NO:31的HC1、SEQ ID NO:32的LC1、SEQ ID NO:41的HC2和SEQ ID NO:42的LC2。
实施方案69.根据实施方案62至68中任一项使用的所述BCMA×CD3双特异性抗体,其中所述癌症是BCMA表达型癌症。
实施方案70.根据实施方案62至69中任一项使用的所述BCMA×CD3双特异性抗体,其中所述癌症是血液恶性肿瘤。
实施方案71.根据实施方案62至70中任一项使用的所述BCMA×CD3双特异性抗体,其中所述受试者对于用所述抗CD38抗体、来那度胺、硼替佐米、泊马度胺、卡非佐米、elotozumab、艾莎佐米、美法仑或沙利度胺或它们的任何组合进行治疗是复发性的或难治性的。
实施方案72.根据实施方案62至71中任一项使用的所述BCMA×CD3双特异性抗体,其中所述受试者对于用所述抗CD38抗体进行治疗是复发性的或难治性的。
实施方案73.根据实施方案62至72中任一项使用的所述BCMA×CD3双特异性抗体,其中所述血液恶性肿瘤是多发性骨髓瘤、骨髓瘤、DLBLC、CLL、华氏高丙种球蛋白血症或非霍奇金淋巴瘤。
实施方案74.根据实施方案73使用的所述BCMA×CD3双特异性抗体,其中所述多发性骨髓瘤是新诊断的多发性骨髓瘤。
实施方案75.根据实施方案74使用的所述BCMA×CD3双特异性抗体,其中所述多发性骨髓瘤是复发性的或难治性的多发性骨髓瘤。
实施方案76.根据实施方案74使用的所述BCMA×CD3双特异性抗体,其中所述多发性骨髓瘤是高危多发性骨髓瘤。
实施方案77.根据实施方案76使用的所述BCMA×CD3双特异性抗体,其中患有所述高危多发性骨髓瘤的所述受试者具有一种或多种染色体异常,所述一种或多种染色体异常包括:
t(4;14)(p16;q32);
t(14;16)(q32;q23);
del17p;
1qAmp;
t(4;14)(p16;q32)和t(14;16)(q32;q23);
t(4;14)(p16;q32)和del17p;
t(14;16)(q32;q23)和del17p;或者
t(4;14)(p16;q32)、t(14;16)(q32;q23)和del17p或它们的任何组合。
实施方案78.根据实施方案62至77中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
实施方案79.根据实施方案62至78中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
实施方案80.根据实施方案62至79中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体是IgG1同种型。
实施方案81.根据实施方案62至80中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
实施方案82.根据实施方案62至77中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体包含
SEQ ID NO:14的VH和SEQ ID NO:15的VL;
SEQ ID NO:16的VH和SEQ ID NO:17的VL;
SEQ ID NO:18的VH和SEQ ID NO:19的VL;或者
SEQ ID NO:20的VH和SEQ ID NO:21的VL。
实施方案83.根据实施方案82使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体是IgG1同种型。
实施方案84.根据实施方案62至83中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体以介于约8mg/kg至约16mg/kg之间的剂量施用。
实施方案85.根据实施方案62至84中任一项使用的所述BCMA×CD3双特异性抗体,其中所述BCMA×CD3双特异性抗体和所述抗CD38抗体通过静脉注射施用。
实施方案86.根据实施方案62至84中任一项使用的所述BCMA×CD3双特异性抗体,其中所述BCMA×CD3双特异性抗体通过静脉注射施用,并且所述抗CD38抗体通过皮下注射施用。
实施方案87.根据实施方案62至86中任一项使用的所述BCMA×CD3双特异性抗体,其中所述受试者是人。
实施方案88.根据实施方案62至87中任一项使用的所述BCMA×CD3双特异性抗体,还包括向所述受试者施用一种或多种抗癌疗法。
实施方案89.根据实施方案88使用的所述BCMA×CD3双特异性抗体,其中所述一种或多种抗癌疗法选自自体同源干细胞移植(ASCT)、放射、外科手术、化学治疗剂、免疫调节剂和靶向癌症疗法。
实施方案90.根据实施方案88至89中任一项使用的所述BCMA×CD3双特异性抗体,其中所述一种或多种抗癌疗法选自来那度胺、沙利度胺、泊马度胺、硼替佐米、卡非佐米、elotozumab、艾莎佐米、美法仑、泼尼松或地塞米松或它们的任何组合。
实施方案91.根据实施方案62至90中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含在约25mM乙酸、约60mM氯化钠、约140甘露糖醇和约0.04%w/v聚山梨醇酯-20(PS-20)中的介于约20mg/mL至约120mg/mL之间的所述抗CD38抗体;pH为约5.5。
实施方案92.根据实施方案62至90中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含约1,800mg的所述抗CD38抗体和约30,000U的rHuPH20。
实施方案93.根据实施方案92使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含约120mg/mL的所述抗CD38抗体和约2,000U/mL的rHuPH20。
实施方案94.根据实施方案92至93中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含
介于约5mM至约15mM之间的组氨酸;
介于约100mM至约300mM之间的山梨糖醇;
介于约0.01%w/v至约0.04%w/v之间的PS-20;和
介于约1mg/mL至约2mg/mL之间的甲硫氨酸,pH为约5.5至5.6。
实施方案95.根据实施方案92至94中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含
约1,800mg的所述抗CD38抗体;
约30,000U的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
实施方案96.根据实施方案92至95中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含
约120mg/mL的所述抗CD38抗体;
约2,000U/mL的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
实施方案97.一种用于治疗患有癌症的受试者的BCMA×CD3双特异性抗体,其中所述受试者对于用先前的抗癌治疗剂进行治疗是复发性的或难治性的。
实施方案98.根据实施方案97使用的所述BCMA×CD3双特异性抗体,其中所述BCMA×CD3双特异性抗体包含BCMA结合结构域和CD3结合结构域,所述BCMA结合结构域包含SEQID NO:23的HCDR1、SEQ ID NO:24的HCDR2、SEQ ID NO:25的HCDR3、SEQ ID NO:26的LCDR1、SEQ ID NO:27的LCDR2和SEQ ID NO:28的LCDR3,并且所述CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ IDNO:37的LCDR2和SEQ ID NO:38的LCDR3。
实施方案99.根据实施方案97或98使用的所述BCMA×CD3双特异性抗体,其中所述BCMA结合结构域包含SEQ ID NO:29的VH和SEQ ID NO:30的VL,并且所述CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
实施方案100.根据实施方案97至99中任一项使用的所述BCMA×CD3双特异性抗体,其中所述BCMA×CD3双特异性抗体是IgG4同种型并且包含HC1中第405位处的苯丙氨酸和第409位处的精氨酸以及HC2中第405位处的亮氨酸和第409位处的赖氨酸,其中残基根据EU索引进行编号。
实施方案101.根据实施方案100使用的所述BCMA×CD3双特异性抗体,其中所述BCMA×CD3双特异性抗体还包含HC1和HC2两者中第228位的脯氨酸、第234位的丙氨酸和第235位的丙氨酸。
实施方案102.根据实施方案97至101中任一项使用的所述BCMA×CD3抗体,其中所述BCMA×CD3双特异性抗体包括SEQ ID NO:31的HC1、SEQ ID NO:32的LC1、SEQ ID NO:41的HC2和SEQ ID NO:42的LC2。
实施方案103.根据实施方案97至102中任一项使用的所述BCMA×CD3双特异性抗体,其中所述癌症是血液恶性肿瘤。
实施方案104.根据实施方案103使用的所述BCMA×CD3双特异性抗体,其中所述血液恶性肿瘤是高危多发性骨髓瘤。
实施方案105.根据实施方案104使用的所述BCMA×CD3双特异性抗体,其中所述多发性骨髓瘤是高危多发性骨髓瘤。
实施方案106.根据实施方案105使用的所述BCMA×CD3双特异性抗体,其中患有所述高危多发性骨髓瘤的所述受试者具有一种或多种染色体异常,所述一种或多种染色体异常包括:
t(4;14)(p16;q32);
t(14;16)(q32;q23);
del17p;
1qAmp;
t(4;14)(p16;q32)和t(14;16)(q32;q23);
t(4;14)(p16;q32)和del17p;
t(14;16)(q32;q23)和del17p;或者
t(4;14)(p16;q32)、t(14;16)(q32;q23)和del17p或它们的任何组合。
实施方案107.根据实施方案97至106中任一项使用的所述BCMA×CD3双特异性抗体,其中所述受试者对于用所述抗CD38抗体、来那度胺、硼替佐米、泊马度胺、卡非佐米、elotozumab、艾莎佐米、美法仑或沙利度胺或它们的任何组合进行治疗是难治性的或复发性的。
实施方案108.根据实施方案97至107中任一项使用的所述BCMA×CD3双特异性抗体,其中所述受试者对于用所述抗CD38抗体进行治疗是复发性。
实施方案109.根据实施方案97至108中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
实施方案110.根据实施方案97至109中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
实施方案111.根据实施方案97至110中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体是IgG1同种型。
实施方案112.根据实施方案97至111中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
实施方案113.根据实施方案97至108中任一项使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体包含
SEQ ID NO:14的VH和SEQ ID NO:15的VL;
SEQ ID NO:16的VH和SEQ ID NO:17的VL;
SEQ ID NO:18的VH和SEQ ID NO:19的VL;或者
SEQ ID NO:20的VH和SEQ ID NO:21的VL。
实施方案114.根据实施方案113使用的所述BCMA×CD3双特异性抗体,其中所述抗CD38抗体是IgG1同种型。
实施方案115.根据实施方案97至114中任一项使用的所述BCMA×CD3双特异性抗体,其中所述受试者是人。
实施方案116.根据实施方案97至115中任一项使用的所述BCMA×CD3双特异性抗体,还包括向所述受试者施用一种或多种抗癌疗法。
实施方案117.根据实施方案116使用的所述BCMA×CD3双特异性抗体,其中所述一种或多种抗癌疗法选自自体同源干细胞移植(ASCT)、放射、外科手术、化学治疗剂、免疫调节剂和靶向癌症疗法。
实施方案118.根据实施方案116使用的所述BCMA×CD3双特异性抗体,其中所述一种或多种抗癌疗法选自来那度胺、沙利度胺、泊马度胺、硼替佐米、卡非佐米、elotozumab、艾莎佐米、美法仑、泼尼松或地塞米松或它们的任何组合。
实施方案119.一种药物组合物,包含BCMA×CD3双特异性抗体和抗CD38抗体,所述BCMA×CD3双特异性抗体包含BCMA结合结构域和CD3结合结构域,所述BCMA结合结构域包含SEQ ID NO:29的VH和SEQ ID NO:30的VL,所述CD3结合结构域包含SEQ ID NO:39的VH和SEQID NO:40的VL,所述抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
实施方案120.根据实施方案119所述的药物组合物,其中所述BCMA×CD3双特异性抗体包含SEQ ID NO:31的HC1、SEQ ID NO:32的LC1、SEQ ID NO:41的HC2和SEQ ID NO:42的LC2,并且所述抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
实施方案121.根据实施方案119或120所述的药物组合物,所述药物组合物是非固定组合。
实施方案122.根据实施方案121所述的药物组合物,包含在约25mM乙酸、约60mM氯化钠、约140甘露糖醇和约0.04%w/v聚山梨酸酯-20(PS-20)中的约20mg/mL至约120mg/mL的所述抗CD38抗体;pH为约5.5。
实施方案123.根据实施方案121所述的药物组合物,包含约1,800mg的所述抗CD38抗体和约30,000U的rHuPH20。
实施方案124.根据实施方案123所述的药物组合物,包含约120mg/mL的所述抗CD38抗体和约2,000U/mL的rHuPH20。
实施方案125.根据实施方案124所述的药物组合物,还包含一种或多种赋形剂。
实施方案126.根据实施方案125所述的药物组合物,其中所述一种或多种赋形剂是组氨酸、甲硫氨酸、山梨糖醇或聚山梨醇酯-20(PS-20)或它们的任何组合。
实施方案127.根据实施方案126所述的药物组合物,其中所述药物组合物包含
介于约100mg/mL至约120mg/mL之间的所述抗CD38抗体;
介于约5mM至约15mM之间的组氨酸;
介于约100mM至约300mM之间的山梨糖醇;
介于约0.01%w/v至约0.04%w/v之间的PS-20;和
介于约1mg/mL至约2mg/mL之间的甲硫氨酸,pH为约5.5至5.6。
实施方案128.根据实施方案127所述的药物组合物,包含约10mM的组氨酸。
实施方案129.根据实施方案127或128所述的药物组合物,包含约300mM的山梨糖醇。
实施方案130.根据实施方案127至129中任一项所述的药物组合物,包含约0.04%(w/v)的PS-20。
实施方案131.根据实施方案127至130中任一项所述的药物组合物,包含约1mg/mL甲硫氨酸。
实施方案132.根据实施方案127至131中任一项所述的药物组合物,包含
约1,800mg的所述抗CD38抗体;
约30,000U的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
实施方案133.根据实施方案127至132中任一项所述的药物组合物,包含
约120mg/mL的所述抗CD38抗体;
约2,000U/mL的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
实施方案134.一种试剂盒,包含根据实施方案119至133中任一项所述的药物组合物。
实施方案135.一种结合GPRC5D以用于与抗CD38抗体联合治疗患有癌症的受试者的T细胞重定向治疗剂。
实施方案136.根据实施方案135使用的所述结合GPRC5D的T细胞重定向治疗剂,其中在施用所述结合GPRC5D的T细胞重定向治疗剂之前将所述抗CD38抗体施用于受试者。
实施方案137.根据实施方案135或136使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述受试者对于用先前的抗癌治疗剂进行治疗是复发性的或难治性的。
实施方案138.根据实施方案135至137中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述癌症是GPRC5D表达型癌症。
实施方案139.根据实施方案135至138中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述GPRC5D表达型癌症是血液恶性肿瘤或实体瘤。
实施方案140.根据实施方案139使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述血液恶性肿瘤是白血病、淋巴瘤或多发性骨髓瘤。
实施方案141.根据实施方案139使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述实体瘤是卵巢癌、肺癌、胃部癌症、前列腺癌、肾癌、肝癌、胰腺癌、结肠癌、食管癌、膀胱癌、宫颈肿瘤或恶性黑素瘤。
实施方案142.根据实施方案135至141中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述受试者对于用所述抗CD38抗体、来那度胺、硼替佐米、泊马度胺、卡非佐米、elotozumab、艾莎佐米、美法仑或沙利度胺或它们的任何组合进行治疗是复发性的或难治性的。
实施方案143.根据实施方案135至142中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述受试者对于用所述抗CD38抗体进行治疗是复发性的或难治性的。
实施方案144.根据实施方案140至143中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述多发性骨髓瘤是新诊断的多发性骨髓瘤。
实施方案145.根据实施方案140至143中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述多发性骨髓瘤是复发性的或难治性的多发性骨髓瘤。
实施方案146.根据实施方案140至145中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述多发性骨髓瘤是高危多发性骨髓瘤。
实施方案147.根据实施方案146使用的所述结合GPRC5D的T细胞重定向治疗剂,其中患有所述高危多发性骨髓瘤的所述受试者具有一种或多种染色体异常,所述一种或多种染色体异常包括:
t(4;14)(p16;q32);
t(14;16)(q32;q23);
del17p;
1qAmp;
t(4;14)(p16;q32)和t(14;16)(q32;q23);
t(4;14)(p16;q32)和del17p;
t(14;16)(q32;q23)和del17p;或者
t(4;14)(p16;q32)、t(14;16)(q32;q23)和del17p或它们的任何组合。
实施方案148.根据实施方案135至147中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述T细胞重定向治疗剂结合CD3、CD3ε(CD3ε)、CD8、KI2L4、NKG2E、NKG2D、NKG2F、BTNL3、CD186、BTNL8、PD-1、CD195或NKG2C。
实施方案149.根据实施方案135至148中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述T细胞重定向治疗剂包含GPRC5D结合结构域和CD3结合结构域,所述GPRC5D结合结构域包含SEQ ID NO:43的HCDR1、SEQ ID NO:44的HCDR2、SEQ ID NO:45的HCDR3、SEQ ID NO:46的LCDR1、SEQ ID NO:47的LCDR2和SEQ ID NO:48的LCDR3,并且所述CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3。
实施方案150.根据实施方案135至149中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述GPRC5D结合结构域包含SEQ ID NO:49的VH和SEQ ID NO:50的VL,并且所述CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
实施方案151.根据实施方案135至150中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述结合GPRC5C的T细胞重定向治疗剂是多特异性抗体、CAR或表达所述CAR的T细胞。
实施方案152.根据实施方案151使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述多特异性抗体是IgG1、IgG2、IgG3或IgG4同种型。
实施方案153.根据实施方案151至152中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述多特异性抗体包含降低所述多特异性抗体与Fcγ受体(FcγR)的结合的一个或多个Fc置换。
实施方案154.根据实施方案151至153中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述一个或多个Fc置换选自IgG4上的F234A/L235A、IgG1上的L234A/L235A、IgG2上的V234A/G237A/P238S/H268A/V309L/A330S/P331S、IgG4上的F234A/L235A、IgG4上的S228P/F234A/L235A、所有Ig同种型上的N297A、IgG2上的V234A/G237A、IgG1上的K214T/E233P/L234V/L235A/G236-缺失/A327G/P331A/D365E/L358M、IgG2上的H268Q/V309L/A330S/P331S、IgG1上的S267E/L328F、IgG1上的L234F/L235E/D265A、IgG1上的L234A/L235A/G237A/P238S/H268A/A330S/P331S、IgG4上的S228P/F234A/L235A/G237A/P238S和IgG4上的S228P/F234A/L235A/G236-缺失/G237A/P238S,其中残基根据EU索引进行编号。
实施方案155.根据实施方案154使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述多特异性抗体还包含S228P置换。
实施方案156.根据实施方案151至155中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述多特异性抗体在第一CH3结构域或在第二CH3结构域中或在所述第一CH3结构域和所述第二CH3结构域两者中包含一个或多个非对称置换。
实施方案157.根据实施方案156中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述一个或多个非对称置换选自F450L/K409R、野生型/F409L_R409K、T366Y/F405A、T366W/F405W、F405W/Y407A、T394W/Y407T、T394S/Y407A、T366W/T394S、F405W/T394S和T366W/T366S_L368A_Y407V、L351Y_F405A_Y407V/T394W、T366I_K392M_T394W/F405A_Y407V、T366L_K392M_T394W/F405A_Y407V、L351Y_Y407A/T366A_K409F、L351Y_Y407A/T366V_K409F、Y407A/T366A_K409F和T350V_L351Y_F405A_Y407V/T350V_T366L_K392L_T394W。
实施方案158.根据实施方案151至157中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述多特异性抗体包含SEQ ID NO:51的HC1、SEQ ID NO:52的LC1、SEQ IDNO:41的HC2和SEQ ID NO:42的LC2。
实施方案159.根据实施方案135至158中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ IDNO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
实施方案160.根据实施方案135至159中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
实施方案161.根据实施方案135至160中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体是IgG1同种型。
实施方案162.根据实施方案135至161中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
实施方案163.根据实施方案135至158中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体包含
SEQ ID NO:14的VH和SEQ ID NO:15的VL;
SEQ ID NO:16的VH和SEQ ID NO:17的VL;
SEQ ID NO:18的VH和SEQ ID NO:19的VL;或者
SEQ ID NO:20的VH和SEQ ID NO:21的VL。
实施方案164.根据实施方案163使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体是IgG1同种型。
实施方案165.根据实施方案135至164中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体以介于约8mg/kg至约16mg/kg之间的剂量施用。
实施方案166.根据实施方案135至165中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述结合GPRC5D的T细胞重定向治疗剂和所述抗CD38抗体通过静脉注射施用。
实施方案167.根据实施方案135至165中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述结合GPRC5D的T细胞重定向治疗剂通过静脉注射施用,并且所述抗CD38抗体通过皮下注射施用。
实施方案168.根据实施方案135至167中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述受试者是人。
实施方案169.根据实施方案135至168中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述结合GPRC5D的T细胞重定向治疗剂是GPRC5D×CD3双特异性抗体。
实施方案170.根据实施方案135至170中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,还包括向所述受试者施用一种或多种抗癌疗法。
实施方案171.根据实施方案170使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述一种或多种抗癌疗法选自自体同源干细胞移植(ASCT)、放射、外科手术、化学治疗剂、免疫调节剂和靶向癌症疗法。
实施方案172.根据实施方案170使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述一种或多种抗癌疗法选自来那度胺、沙利度胺、泊马度胺、硼替佐米、卡非佐米、elotozumab、艾莎佐米、美法仑、地塞米松或泼尼松。
实施方案173.根据实施方案135至172中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含在约25mM乙酸、约60mM氯化钠、约140甘露糖醇和约0.04%w/v聚山梨醇酯-20(PS-20)中的介于约20mg/mL至约120mg/mL之间的所述抗CD38抗体;pH为约5.5。
实施方案174.根据实施方案135至172中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含约1,800mg的所述抗CD38抗体和约30,000U的rHuPH20。
实施方案175.根据实施方案174使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含约120mg/mL的所述抗CD38抗体和约2,000U/mL的rHuPH20。
实施方案176.根据实施方案174或175使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含
介于约100mg/mL至约120mg/mL之间的所述抗CD38抗体;
介于约5mM至约15mM之间的组氨酸;
介于约100mM至约300mM之间的山梨糖醇;
介于约0.01%w/v至约0.04%w/v之间的PS-20;和
介于约1mg/mL至约2mg/mL之间的甲硫氨酸,pH为约5.5至5.6。
实施方案177.根据实施方案174至176中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含
约1,800mg的所述抗CD38抗体;
约30,000U的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
实施方案178.根据实施方案174至177中任一项使用的所述结合GPRC5D的T细胞重定向治疗剂,其中所述抗CD38抗体以药物组合物形式施用或提供以用于施用,所述药物组合物包含
约120mg/mL的所述抗CD38抗体;
约2,000U/mL的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
实施方案179.一种用于治疗患有癌症的受试者的GPRC5D×CD3双特异性抗体,其中所述受试者对于用先前的抗癌治疗剂进行治疗是复发性的或难治性的。
实施方案180.根据实施方案179使用的所述GPRC5D×CD3双特异性抗体,其中所述GPRC5D×CD3双特异性抗体包含GPRC5D结合结构域和CD3结合结构域,所述GPRC5D结合结构域包含SEQ ID NO:43的HCDR1、SEQ ID NO:44的HCDR2、SEQ ID NO:45的HCDR3、SEQ ID NO:46的LCDR1、SEQ ID NO:47的LCDR2和SEQ ID NO:48的LCDR3,并且所述CD3结合结构域包含SEQ ID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3。
实施方案181.根据实施方案179或180使用的所述GPRC5D×CD3双特异性抗体,其中所述GPRC5D结合结构域包含SEQ ID NO:49的VH和SEQ ID NO:50的VL,并且所述CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL。
实施方案182.根据实施方案179至181中任一项使用的所述GPRC5D×CD3双特异性抗体,其中所述GPRC5D×CD3双特异性抗体是IgG4同种型并且包含HC1中第405位处的苯丙氨酸和第409位处的精氨酸以及HC2中第405位处的亮氨酸和第409位处的赖氨酸,其中残基根据EU索引进行编号。
实施方案183.根据实施方案182使用的所述GPRC5D×CD3双特异性抗体,其中所述GPRC5D×CD3双特异性抗体还包含HC1和HC2两者中第228位的脯氨酸、第234位的丙氨酸和第235位的丙氨酸。
实施方案184.根据实施方案179至183中任一项使用的所述GPRC5D×CD3双特异性抗体,其中所述GPRC5D×CD3双特异性抗体包括SEQ ID NO:51的HC1、SEQ ID NO:52的LC1、SEQ ID NO:41的HC2和SEQ ID NO:42的LC2。
实施方案185.根据实施方案179至184中任一项使用的所述GPRC5D×CD3双特异性抗体,其中所述癌症是血液恶性肿瘤或实体瘤。
实施方案186.根据实施方案185使用的所述GPRC5D×CD3双特异性抗体,其中所述癌症是多发性骨髓瘤、淋巴瘤、黑素瘤、乳腺癌、子宫内膜癌、卵巢癌、肺癌、胃部癌症、前列腺癌、肾癌、肝癌、胰腺癌、结肠癌、食管癌、膀胱癌或宫颈肿瘤。
实施方案187.根据实施方案186使用的所述GPRC5D×CD3双特异性抗体,其中所述多发性骨髓瘤是高危多发性骨髓瘤。
实施方案188.根据实施方案187使用的所述GPRC5D×CD3双特异性抗体,其中患有所述高危多发性骨髓瘤的所述受试者具有一种或多种染色体异常,所述一种或多种染色体异常包括:
t(4;14)(p16;q32);
t(14;16)(q32;q23);
del17p;
1qAmp;
t(4;14)(p16;q32)和t(14;16)(q32;q23);
t(4;14)(p16;q32)和del17p;
t(14;16)(q32;q23)和del17p;或者
t(4;14)(p16;q32)、t(14;16)(q32;q23)和del17p或它们的任何组合。
实施方案189.根据实施方案179至188中任一项使用的所述GPRC5D×CD3双特异性抗体,其中所述受试者对于用所述抗CD38抗体、来那度胺、硼替佐米、泊马度胺、卡非佐米、elotozumab、艾莎佐米、美法仑或沙利度胺或它们的任何组合进行治疗是难治性的或复发性的。
实施方案190.根据实施方案179至189中任一项使用的所述GPRC5D×CD3双特异性抗体,其中所述受试者对于用所述抗CD38抗体进行治疗是复发性的或难治性的。
实施方案191.根据实施方案179至190中任一项使用的所述GPRC5D×CD3双特异性抗体,其中所述抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
实施方案192.根据实施方案179至191中任一项使用的所述GPRC5D×CD3双特异性抗体,其中所述抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
实施方案193.根据实施方案179至192中任一项使用的所述GPRC5D×CD3双特异性抗体,其中所述抗CD38抗体是IgG1同种型。
实施方案194.根据实施方案179至193中任一项使用的所述GPRC5D×CD3双特异性抗体,其中所述抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
实施方案195.根据实施方案179至190中任一项使用的所述GPRC5D×CD3双特异性抗体,其中所述抗CD38抗体包含
SEQ ID NO:14的VH和SEQ ID NO:15的VL;
SEQ ID NO:16的VH和SEQ ID NO:17的VL;
SEQ ID NO:18的VH和SEQ ID NO:19的VL;或者
SEQ ID NO:20的VH和SEQ ID NO:21的VL。
实施方案196.根据实施方案195使用的所述GPRC5D×CD3双特异性抗体,其中所述抗CD38抗体是IgG1同种型。
实施方案197.根据实施方案179至196中任一项使用的所述GPRC5D×CD3双特异性抗体,其中所述受试者是人。
实施方案198.根据实施方案179至197中任一项使用的所述GPRC5D×CD3双特异性抗体,还包括向所述受试者施用一种或多种抗癌疗法。
实施方案199.根据实施方案198使用的所述GPRC5D×CD3双特异性抗体,其中所述一种或多种抗癌疗法选自自体同源干细胞移植(ASCT)、放射、外科手术、化学治疗剂、免疫调节剂和靶向癌症疗法。
实施方案200.根据实施方案198使用的所述GPRC5D×CD3双特异性抗体,其中所述一种或多种抗癌疗法选自来那度胺、沙利度胺、泊马度胺、硼替佐米、卡非佐米、elotozumab、艾莎佐米、美法仑、地塞米松、长春新碱、环磷酰胺、羟基柔红霉素、泼尼松、利妥昔单抗、伊马替尼、达沙替尼、尼洛替尼、博舒替尼、普纳替尼、巴非替尼、塞卡替尼、陶扎舍替或达鲁舍替、阿糖胞苷、柔红霉素、伊达比星、米托蒽醌、羟基脲、地西他滨、克拉屈滨、氟达拉滨、拓扑替康、依托泊苷6-硫鸟嘌呤、皮质类固醇、甲氨蝶呤、6-巯嘌呤、阿扎胞苷、三氧化二砷和全反式视黄酸或它们的任何组合。
实施方案201.一种药物组合,包含GPRC5D×CD3双特异性抗体和抗CD38抗体,所述GPRC5D×CD3双特异性抗体包含GPRC5D结合结构域和CD3结合结构域,所述GPRC5D结合结构域包含SEQ ID NO:43的HCDR1、SEQ ID NO:44的HCDR2、SEQ ID NO:45的HCDR3、SEQ ID NO:46的LCDR1、SEQ ID NO:47的LCDR2和SEQ ID NO:48的LCDR3,所述CD3结合结构域包含SEQID NO:33的HCDR1、SEQ ID NO:34的HCDR2、SEQ ID NO:35的HCDR3、SEQ ID NO:36的LCDR1、SEQ ID NO:37的LCDR2和SEQ ID NO:38的LCDR3,所述抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
实施方案202.根据实施方案201所述的药物组合,其中所述GPRC5D结合结构域包含SEQ ID NO:49的VH和SEQ ID NO:50的VL,并且所述CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL,并且所述抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
实施方案203.根据实施方案201或202所述的药物组合,其中所述GPRC5D×CD3双特异性抗体包含SEQ ID NO:51的HC1、SEQ ID NO:52的LC1、SEQ ID NO:41的HC2和SEQ IDNO:42的LC2,并且所述抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
实施方案204.根据实施方案201至203中任一项所述的药物组合,所述药物组合是非固定组合。
实施方案205.根据实施方案204所述的药物组合,包含在约25mM乙酸、约60mM氯化钠、约140甘露糖醇和约0.04%w/v聚山梨酸酯-20(PS-20)中的约20mg/mL至约120mg/mL的所述抗CD38抗体;pH为约5.5。
实施方案206.根据实施方案204所述的药物组合,包含约1,800mg的所述抗CD38抗体和约30,000U的rHuPH20。
实施方案207.根据实施方案206所述的药物组合物,包含约120mg/mL的所述抗CD38抗体和约2,000U/mL的rHuPH20。
实施方案208.根据实施方案207所述的药物组合,还包含一种或多种赋形剂。
实施方案209.根据实施方案208所述的药物组合,其中所述一种或多种赋形剂是组氨酸、甲硫氨酸、山梨糖醇或聚山梨醇酯-20(PS-20)或它们的任何组合。
实施方案210.根据实施方案209所述的药物组合,其中所述药物组合物包含
介于约100mg/mL至约120mg/mL之间的所述抗CD38抗体;
介于约5mM至约15mM之间的组氨酸;
介于约100mM至约300mM之间的山梨糖醇;
介于约0.01%w/v至约0.04%w/v之间的PS-20;和
介于约1mg/mL至约2mg/mL之间的甲硫氨酸,pH为约5.5至5.6。
实施方案211.根据实施方案209或210所述的药物组合,包含约10mM的组氨酸。
实施方案212.根据实施方案209至211中任一项所述的药物组合,包含约300mM的山梨糖醇。
实施方案213.根据实施方案209至212中任一项所述的药物组合,包含约0.04%(w/v)的PS-20。
实施方案214.根据实施方案209至213中任一项所述的药物组合,包含约1mg/mL的甲硫氨酸。
实施方案215.根据实施方案209至214中任一项所述的药物组合,包含
约1,800mg的所述抗CD38抗体;
约30,000U的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
实施方案216.根据实施方案209至215中任一项所述的药物组合,包含
约120mg/mL的所述抗CD38抗体;
约2,000U/mL的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
实施方案217.一种试剂盒,包含根据实施方案201至215中任一项所述的药物组合。
实施方案218.一种结合CD19以用于与抗CD38抗体联合治疗患有癌症的受试者的T细胞重定向治疗剂。
实施方案219.一种用于在患有癌症的受试者中增强结合CD19的T细胞重定向治疗剂的功效的抗CD38抗体,其中在施用所述结合CD19的T细胞重定向治疗剂之前,所述受试者已用抗CD38抗体进行治疗。
实施方案220.根据实施方案218或219使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述受试者对于用先前的抗癌治疗剂进行治疗是复发性的或难治性的。
实施方案221.根据实施方案218至221中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述癌症是血液恶性肿瘤或实体瘤。
实施方案222.根据实施方案221使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述血液恶性肿瘤是淋巴瘤、B细胞恶性肿瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、DLBLC、FL、MCL、边缘区B细胞淋巴瘤(MZL)、粘膜相关淋巴组织淋巴瘤(MALT)、CLL、ALL、AML、华氏巨球蛋白血症或T细胞淋巴瘤。
实施方案223.根据实施方案221使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述实体瘤是肺癌、肝癌、宫颈癌、结肠癌、乳腺癌、卵巢癌、胰腺癌、黑素瘤、胶质母细胞瘤、前列腺癌、食管癌或胃癌。
实施方案224.根据实施方案218至223中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述T细胞重定向治疗剂结合CD3ε(CD3ε)、CD8、KI2L4、NKG2E、NKG2D、NKG2F、BTNL3、CD186、BTNL8、PD-1、CD195或NKG2C。
实施方案225.根据实施方案218至224中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述结合CD19的T细胞重定向治疗剂包含以下各项的CD19结合结构域:博纳吐单抗、axicabtagene ciloleucel、tisagenlecleucel-t、inebilizumab、lisocabtagene maraleucel、XmAb-5574、CIK-CAR.CD19、ICTCAR-011、IM-19、JCAR-014、loncastuximab tesirine、MB-CART2019.1、OXS-1550、PBCAR-0191、PCAR-019、PCAR-119、Senl-001、TI-1007、XmAb-5871、PTG-01、PZ01、Senl_1904A、Senl_1904B、UCART-19、CSG-CD19、DI-B4、ET-190、GC-007F或GC-022。
实施方案226.根据实施方案218至225中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述结合CD19的T细胞重定向治疗剂包含:博纳吐单抗、axicabtagene ciloleucel、tisagenlecleucel-t、inebilizumab、lisocabtagenemaraleucel、XmAb-5574、CIK-CAR.CD19、ICTCAR-011、IM-19、JCAR-014、loncastuximabtesirine、MB-CART2019.1、OXS-1550、PBCAR-0191、PCAR-019、PCAR-119、Senl-001、TI-1007、XmAb-5871、PTG-01、PZ01、Senl_1904A、Senl_1904B、UCART-19、CSG-CD19、DI-B4、ET-190、GC-007F或GC-022。
实施方案227.根据实施方案218至226中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述结合CD19的T细胞重定向治疗剂是多特异性抗体、CAR或表达所述CAR的T细胞。
实施方案228.根据实施方案218至227中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述抗CD38抗体包含SEQ ID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQ ID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
实施方案229.根据实施方案218至228中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述抗CD38抗体包含SEQ ID NO:4的VH和SEQ ID NO:5的VL。
实施方案230.根据实施方案218至229中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述抗CD38抗体是IgG1同种型。
实施方案231.根据实施方案218至230中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
实施方案232.根据实施方案218至227中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述抗CD38抗体包含
SEQ ID NO:14的VH和SEQ ID NO:15的VL;
SEQ ID NO:16的VH和SEQ ID NO:17的VL;
SEQ ID NO:18的VH和SEQ ID NO:19的VL;或者
SEQ ID NO:20的VH和SEQ ID NO:21的VL。
实施方案233.根据实施方案232使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述抗CD38抗体是IgG1同种型。
实施方案234.根据实施方案218至233中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述抗CD38抗体以介于约8mg/kg至约16mg/kg之间的剂量施用。
实施方案235.根据实施方案218至234中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述结合CD19的T细胞重定向治疗剂和所述抗CD38抗体通过静脉注射施用。
实施方案236.根据实施方案218至234中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述结合CD19的T细胞重定向治疗剂通过静脉注射施用,并且所述抗CD38抗体通过皮下注射施用。
实施方案237.根据实施方案218至236中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述受试者是人。
实施方案238.根据实施方案218至237中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述结合CD19的T细胞重定向治疗剂是CD19×CD3双特异性抗体。
实施方案239.根据实施方案218至238中任一项使用的所述T细胞重定向治疗剂或所述抗CD38抗体,还包括向所述受试者施用一种或多种抗癌疗法。
实施方案240.根据实施方案238使用的所述T细胞重定向治疗剂或所述抗CD38抗体,其中所述一种或多种抗癌疗法选自自体同源干细胞移植(ASCT)、放射、外科手术、化学治疗剂、免疫调节剂和靶向癌症疗法。
实施方案241.一种药物组合,包含CD19×CD3双特异性抗体和抗CD38抗体,所述CD19×CD3双特异性抗体包含SEQ ID NO:53的博纳吐单抗,并且所述抗CD38抗体包含SEQID NO:6的HCDR1、SEQ ID NO:7的HCDR2、SEQ ID NO:8的HCDR3、SEQ ID NO:9的LCDR1、SEQID NO:10的LCDR2和SEQ ID NO:11的LCDR3。
实施方案242.根据实施方案241所述的药物组合,其中所述抗CD38抗体包含SEQID NO:4的VH和SEQ ID NO:5的VL。
实施方案243.根据实施方案241或242所述的药物组合,其中所述抗CD38抗体包含SEQ ID NO:12的HC和SEQ ID NO:13的LC。
实施方案244.根据实施方案241至243中任一项所述的药物组合,所述药物组合是非固定组合。
实施方案245.根据实施方案241至244中任一项所述的药物组合,包含在约25mM乙酸、约60mM氯化钠、约140甘露糖醇和约0.04%w/v聚山梨酸酯-20(PS-20)中的约20mg/mL至约120mg/mL的所述抗CD38抗体;pH为约5.5。
实施方案246.根据实施方案241至243中任一项所述的药物组合,包含约1,800mg的所述抗CD38抗体和约30,000U的rHuPH20。
实施方案247.根据实施方案246所述的药物组合,包含约120mg/mL的所述抗CD38抗体和约2,000U/mL的rHuPH20。
实施方案248.根据实施方案246或257所述的药物组合,还包含一种或多种赋形剂。
实施方案249.根据实施方案246至248中任一项所述的药物组合,其中所述一种或多种赋形剂是组氨酸、甲硫氨酸、山梨糖醇或聚山梨酸酯-20(PS-20)或它们的任何组合。
实施方案250.根据实施方案246至249中任一项所述的药物组合,其中所述药物组合包含
介于约100mg/mL至约120mg/mL之间的所述抗CD38抗体;
介于约5mM至约15mM之间的组氨酸;
介于约100mM至约300mM之间的山梨糖醇;
介于约0.01%w/v至约0.04%w/v之间的PS-20;和
介于约1mg/mL至约2mg/mL之间的甲硫氨酸,pH为约5.5至5.6。
实施方案251.根据实施方案246至250中任一项所述的药物组合,包含约10mM的组氨酸。
实施方案252.根据实施方案246至251中任一项所述的药物组合,包含约300mM的山梨糖醇。
实施方案253.根据实施方案246至252中任一项所述的药物组合,包含约0.04%(w/v)的PS-20。
实施方案254.根据实施方案246至253中任一项的药物组合,包含约1mg/mL的甲硫氨酸。
实施方案255.根据实施方案246至254中任一项所述的药物组合,包含
约1,800mg的所述抗CD38抗体;
约30,000U的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
实施方案256.根据实施方案246至255中任一项所述的药物组合物,包含
约120mg/mL的所述抗CD38抗体;
约2,000U/mL的rHuPH20;
约10mM的组氨酸;
约300mM的山梨糖醇;
约0.04%(w/v)的PS-20;和
约1mg/mL的甲硫氨酸,pH为约5.6。
实施方案257.一种试剂盒,包含根据实施方案241至256中任一项所述的药物组合物。
提供以下实施例以进一步描述本文所公开的实施方案中的一些。这些实施例旨在说明而非限制本发明所公开的实施方案。
抗BCMA/抗CD3抗体JNJ-957(在WO2017031104A1中描述)和达雷木单抗由杨森制药(Janssen Pharmaceuticals)制备。CNTO7008(CD3×空白)、BC3B4(BCMA×空白)和3930(IgG同种型对照)(均由杨森制药(Janssen Pharmaceuticals)制备)被用作对照抗体。JNJ-957也称为JNJ-7957。
JNJ-957包含BCMA结合臂BCMB69和CD3结合臂CD3B219,它们的氨基酸序列分别在表3和表4中示出。
通过Ficoll-Hypaque密度梯度离心法分离来自健康供体和MM患者的外周血单核细胞(PBMC)以及来自MM患者BM抽吸物的骨髓单核细胞(BM-MNC)。
在补充有10%的胎牛血清(FBS;Lonza)和抗生素(100单位/mL青霉素、100μg/ml链霉素;两者均得自Life Technologies公司)的RPMI 1640(Invitrogen公司)中培养经荧光素酶(LUC)转导的多发性骨髓瘤细胞系UM9、RPMI8226、U266和MM1.S以及未经转导的多发性骨髓瘤细胞系NCI-H929和RPMI8226。
鉴定定位BM的MM细胞,并通过用HuMax-003(CD38)FITC(该抗体与不同于达雷木单抗所结合的表位的表位结合,杨森制药(Janssen Pharmaceuticals))、CD138 PE、CD56PC7、CD45 Krome Orange(均得自贝克曼库尔特公司(Beckman Coulter))、CD269(BCMA)APC(百进公司(Biolegend))、CD274(PD-L1)BV421和CD19 APC-H7(均得自贝迪医疗公司(Becton Dickinson))染色1.0×10
使用7激光LSRFORTESSA(贝迪医疗公司(Becton Dickinson))进行流式细胞术。每天使用荧光标记的珠(CS&T珠,贝迪医疗公司(Becton Dickinson))来监测流式细胞仪的性能并验证光学路径和料流流动。该过程实现了受控的标准化结果,并且允许确定流式细胞仪内的长期漂移和附带变化。未观察到可影响这些结果的变化。使用补偿珠确定光谱重叠,使用Diva软件自动计算补偿。使用FACS Diva软件分析流式细胞术数据。
包含肿瘤细胞以及自体同源效应细胞的来源于MM患者的BM-MNC用于裂解测定。温育时的样本活力超过98%,如通过使用7-AAD(贝迪医疗公司(Becton Dickinson))所评估。对于裂解测定,在96孔U形底板中将BM-MNC在具有对照抗体或JNJ-957(0.0064μg/mL至4.0μg/mL)和/或达雷木单抗(10μg/mL)的RPMI+10%的胎牛血清中温育48小时。BM-MNC中原代CD138
分别通过CD25和CD107a细胞表面表达的流式细胞术检测来分析JNJ-957诱导的CD4
在96孔U形底板中将BCMA阳性MM细胞系与来自健康供体或MM患者的PB MNC以9:1的效应子与靶标比在存在对照抗体或JNJ-957(0.00256μg/mL至4.0μg/mL)的情况下共培养48小时。通过如上所述的流式细胞术测定MM细胞的存活率。
在存在或不存在从新诊断的MM患者(n=12)获得的合并的BM基质细胞(BMSC)的情况下,将经LUC转导的MM细胞系培养16小时,然后以9:1的效应子与靶标比将其与效应细胞(来自健康供体的新鲜分离的PBMC)一起温育,然后在96孔平底板(Greiner-Bio-One)中连续稀释JNJ-957(0.00256μg/mL至4.0μg/mL)或对照抗体48小时。在添加底物荧光素(150μg/mL;Promega)10分钟后,通过BLI确定LUC
为了评价用达雷木单抗单一疗法对PB MNC进行体内预处理对JNJ-957功效的影响,还将经LUC转导的MM细胞系4与在达雷木单抗单一疗法开始之前和对达雷木单抗单一疗法有最佳应答时(效应子与靶标比9:1)从MM患者获得的PB MNC进行共培养。如之前所述进行BLI测定。
通过荧光原位杂交(FISH)和单核苷酸多态性(SNP)阵列评估纯化的MM细胞中的细胞遗传学异常。高危疾病由del(17p)、del(1p)、ampl(1q)、t(4;14)或t(14;16)
根据制造商推荐的规程,使用MSD GOLD
根据制造商规程,使用MSD R-Plex Granzyme B测定板(Meso ScaleDiagnostics)在细胞培养上清液中测量颗粒酶B。
根据制造商规程,使用V-Plex Proinflammatory Panel 1Human Kit(Meso ScaleDiagnostics)分析细胞培养上清液中的细胞因子[干扰素-γ(IFN-γ)、白介素(IL)-2、IL-6、IL-8、IL-10和肿瘤坏死因子-α(TNF-α)]。
在数据不遵循正态分布的情况下,使用双尾(配对)学生t检验或Mann-Whitney U检验或Wilcoxon配对符号秩检验来进行变量之间的比较。变量之间的关联性采用Spearman秩相关系数进行描述。低于0.05的P值被认为是显著的。就JNJ-957和达雷木单抗的联合治疗而言,使用下式计算预期裂解值以测试JNJ-957和达雷木单抗之间仅有加性效应的零假设:预期裂解%=(JNJ-957的裂解%+达雷木单抗的裂解%)–(JNJ-957的裂解%×达雷木单抗的裂解%),如之前
在JNJ-957(0.00128μg/mL至4.0μg/mL)的浓度范围内,使用健康供体(HD)外周血单核细胞作为效应细胞来评估JNJ-957对介导RPMI8226(图1)、UM9(图2)、U226(图3)和MM1.S(图4)多发性骨髓瘤细胞系的裂解的影响。JNJ-957以剂量依赖性方式介导了所有测试细胞系的裂解,并在约0.1μg/ml的抗体浓度下实现了几乎100%的最大效力,这取决于图1、图2、图3和图4中所见的细胞系。
先前已表明,BMSC保护MM细胞抵抗各种抗MM药剂(包括达雷木单抗和MM反应性T细胞)。因此评估了BMSC-MM细胞相互作用对JNJ-957功效的潜在影响。BMSC的存在不影响JNJ-957对MM细胞系RPMI-8226、UM9和U266的活性(数据未示出)。尽管在较低浓度(P<0.0001)下,MM1.S细胞中的BMSC适度地抑制了JNJ-957介导的MM细胞裂解,但通过增加JNJ-7957剂量可完全消除这种影响。
在RPMI 8226细胞系中评估T细胞活化。用JNJ-957处理导致CD4
在从11名新诊断的MM患者、21名未接受过达雷木单抗治疗的复发性/难治性的MM患者和17名达雷木单抗难治性的复发性/难治性的MM患者(达雷木单抗复发性的/难治性的患者参加了达雷木单抗联合全反式视黄酸(ATRA)的1期和2期研究;临床试验标识符NCT02751255)和原代浆细胞白血病中获得的55个BM抽吸物中(pPCL;n=6)评估BCMA的表达水平、免疫细胞亚群的组成以及JNJ-957的离体功效。在达雷木单抗单一疗法即将开始之前和达雷木单抗治疗期间进行性疾病时,从DARA/ATRA研究中治疗的8名患者获得了连续BM样本。在同一项研究中,我们从10位患者的连续外周血样本中获得了达雷木单抗单一疗法即将开始之前以及达雷木单抗达到最大应答时的结果。
在DARA/ATRA研究(NCT02751255)中,患有MM的患者需要全身治疗,并且从≥2治疗项的复发性或难治性开始复发。患者≥18岁,预期寿命≥3个月,WHO性能状态≤2和可测量的疾病。
在本研究的第一阶段期间,根据推荐的剂量和计划表(每周一次16mg/kg,持续8周,然后每2周一次持续16周,并且每4周一次直至PD)施用达雷木单抗。研究现场伦理委员会或机构审查委员会批准了该方案,该方案是根据赫尔辛基宣言、国际协调会议和临床实践指南规范的原理制定的。所有患者均签署了知情同意书。
表5和表6中示出了参加1期和2期研究NCT02751255的患者的基线特征。RRMM患者平均接受过5项(范围1至9)先前的疗法,RRMM dara R患者接受过平均6项(范围3至12)先前的疗法。表7示出了参加1期和2期研究的患者的基线特征的更新汇总。
*高危疾病由del(17p)、del(1p)、ampl(1q)、t(4;14)或t(14;16)的存在来定义。
**根据多发性骨髓瘤国际统一疗效标准,难治性的疾病被定义为在治疗期间的进行性疾病,无应答(小于PR),或在停止治疗的60天内的进行性疾病。
#在达雷木单抗单一疗法(n=15)期间发展成进行性疾病时立即获得BM抽吸物,而在达雷木单抗单一疗法期间发展成进行性后22个月和48个月,分别在3个和5个其他治疗项之后获得2个BM样本。
§另外,19名患者中有1名是来那度胺不耐受的;
缩写:MM,多发性骨髓瘤;NDMM,新诊断的MM;RRMM,复发性/难治性的MM;Dara,达雷木单抗;pPCL,原代浆细胞白血病;n,数量;IgG,免疫球蛋白G;IgA、免疫球蛋白A;FLC,游离轻链;del,缺失;amp,扩增;t,易位;PI,蛋白酶体抑制剂;IMiD,免疫调节药物;
达雷木单抗介导来自新诊断的(NDMM)和复发性的/难治性的未接受过达雷木单抗治疗的患者的MM细胞的有效裂解,而来自RRMM达雷木单抗难治性的患者的细胞对裂解具有抗性(图11)。
在新诊断的(ND)MM患者样本(n=8)中,4.0μg/mL下的JNJ-957对MM细胞的平均裂解率为79%(范围:66%至92%;图12)。来那度胺(LEN)难治性的患者样本(n=15;4.0μg/mL下的平均裂解率:69%;范围:24%至98%;图13)也达到了类似的MM裂解,但变化较大,这些患者样本也是硼替佐米难治性患者(平均裂解率为73%),泊马度胺(82)%以及卡非佐米(9%)。JNJ-957在来自达雷木单抗(DARA)难治性的MM患者的样本中也是有效的(n=11;4.0μg/mL下的平均裂解率:83%;范围:52%至99%;图14)。在测试样本的任一者中,NK-和T细胞频率均未受到影响。
当与JNJ-957进行比较时,CD3×空白对照抗体和BCMA×空白对照抗体在不同患者样本中显示出显著较低的活性,这表明需要交联MM细胞和效应T细胞,以及不存在BCMA阻断的直接作用。
JNJ-957介导的原代MM细胞的裂解与活化CD4
还评估了来自未接收达雷木单抗治疗的和达雷木单抗难治性的RRMM患者的JNJ-957处理的BM-MNC上清液中颗粒酶B和各种细胞因子的水平。JNJ-957介导的T细胞活化导致颗粒酶B、IFN-γ、IL-2、IL-6、IL-8、IL-10和TNF-α的水平剂量依赖性增加(数据未显示)。
在所有BM样本中,JNJ-957在介导MM细胞杀伤方面的功效既不与肿瘤特征(BCMA或PD-L1表达,标准或高危细胞遗传学异常的存在)相关,也不与患者的特征(诸如效应子:靶标比、T细胞系统的组成或T细胞上的PD-1/HLA-DR表达)相关。然而,当单独分析患者类别时,与NDMM患者相比,RRMM患者中BCMA(图21)和PD-L1(图22)的表达水平显著更高,而不考虑达雷木单抗暴露。尽管患者数量很小,但JNJ-957的活性与未接受过达雷木单抗治疗的RRMM患者中的PD-L1表达水平负相关(p=0.045)。
对BM抽吸物NDMM、未接受过达雷木单抗治疗的RRMM和达雷木单抗RRMM样本中免疫细胞的组成进行评价,以获得对从三个患者亚组获得的样本中JNJ-957的差异效应的了解。在组合的患者组中,高T细胞频率(p=0.034)和高E:T比(p=0.029)与增强的JNJ-7957介导的MM细胞的裂解相关。其他免疫参数(T细胞、Treg、PD-1
在亚组分析中,当与NDMM患者进行比较时,RRMM患者的Treg(图23)和活化的T细胞(由HLA-DR的表达限定)(图24)的频率显著更高,并且幼稚T细胞的频率更低。此外,达雷木单抗难治性的患者样本含有比未接受过达雷木单抗治疗的样本显著更多的TEMRA T细胞(图25)。然而,在该亚组分析中,活化的、幼稚、中央记忆型(CM)、效应记忆型(EM)或TEMRA T细胞的频率与对JNJ-7957的应答不相关。高基线百分比的Treg对RRMM患者样本中的JNJ-957介导的MM细胞裂解显示出负面影响,这可通过最佳剂量来克服。评估了由自体同源效应细胞介导的、根据Treg的基线百分比二分的JNJ-597介导的NDMM的裂解(图26)、未接受过达雷木单抗治疗的RRMM(图27)和达雷木单抗难治性的RRMM(图28)患者样本。第50个百分位数用于根据Treg含量将样本分类为“低”或“高”:NDMM:低:≤7.34%,高:>7.34%。未接受过达雷木单抗治疗的RRMM:低≤15.57%,高>15.57%。达雷木单抗难治性的RRMM:低≤11.24%,高>11.24%。较高的Treg浓度抑制了MM细胞在JNJ-957介导的未接受过达雷木单抗治疗的RRMM和达雷木单抗难治性的RRMM样本中的裂解。在较高的JNJ-957浓度下消除了Treg效应。
三个患者组中PD-1
通过评估在48小时的温育之后来自NDMM(n=9)、未接受过达雷木单抗治疗的RRMM(n=18)和达雷木单抗难治性的RRMM患者(n=13)的BM样本中JNJ-957介导的裂解来评价达雷木单抗治疗对JNJ-957功效的影响。在相对较低浓度的JNJ-957(0.0064μg/mL至0.032μg/mL)下,与未接收达雷木单抗治疗的RRMM和NDMM患者相比,在暴露于达雷木单抗的患者中肿瘤细胞裂解显著更好。图29示出了患者群体中的裂解百分比。以平均值±SEM示出数据,使用学生t检验来计算P值。
由于最近发现的DARA免疫刺激效应可有助于肿瘤降低的改善,因此在DARA治疗前后分析来自MM患者的连续BM抽吸物(n=5)。此处我们观察到,与DARA开始前的样本相比,在DARA期间疾病进展之后获得的样本中BCMA表达相当,但JNJ-957的MM细胞裂解有所改善(4.0μg/mL下的平均裂解率:93%与74%;图30)。在这些BM抽吸物中,未接受过达雷木单抗治疗的患者样本与暴露于达雷木单抗的患者样本中Treg(图31)和CD4
JNJ-957介导的RPMI 8226多发性骨髓瘤细胞系的裂解使用来自RRMM患者的连续PB MNC样本在达雷木单抗治疗之前和期间作为效应细胞进行测试。在达雷木单抗治疗期间,从具有良好应答(部分应答、非常良好的部分应答或完全应答)且达雷木单抗治疗持续时间中值为11个月(范围为7个月至14个月)的患者获得暴露于达雷木单抗的PB MNC。图34示出了使用来自暴露于dara的患者的PB MNC增强JNJ-957介导的RPMI 8226裂解。在PB-MNC样本中,未接受过达雷木单抗治疗的患者样本与暴露于达雷木单抗的患者样本中Treg(图35)和CD4+细胞(图36)的百分比略微降低,而CD8+细胞(图37)的百分比增加。在该研究中,样本是从达雷木单抗治疗的患者中位持续时间为3(1至7)个月的患者中获得的。
还测试了JNJ-957和达雷木单抗的联合在杀伤从NDMM或RRMM未接受过dara治疗的患者获得的MM细胞中的功效。图38示出了单独用JNJ-957(0.032μg/mL至0.8μg/mL)或与10μg/mL的达雷木单抗联合治疗48小时的新诊断的MM(NDMM)患者(n=8)的BM MNC的裂解百分比。将JNJ-957和达雷木单抗对所观察到的(obs)MM细胞的裂解水平与预期的(exp)裂解水平进行比较,其中这些裂解水平是在假设联合效应是通过如方法中所示的累加效应实现的情况下计算的。黑条示出组平均值±SEM。使用配对学生t检验来计算P值。图39示出了BMMNC在RRNN未接受过dara治疗的患者中的裂解百分比。图40示出了BM MNC在RRMM达雷木单抗难治性的患者中的裂解百分比。
因此,研究表明,JNJ-957在新诊断的且重度预处理的MM患者样本中是有效的。高百分比或调节性T细胞在低剂量下对JNJ-957功效产生负面影响,然而通过JNJ-957的剂量增加克服了该负面影响。达雷木单抗在体内的预处理增强了JNJ-957抗MM细胞的功效。
JNJ-957与达雷木单抗的联合离体显示出加性功效;此外,用达雷木单抗进行的体内预处理增强了BCMA×CD3的离体功效。
为了评估达雷木单抗治疗是否也有益于其他T细胞重定向疗法,使用来自11名MM患者的成对未接受过达雷木单抗治疗的和暴露于达雷木单抗的PB-MNC,用博纳吐单抗(FDA批准的用于治疗急性淋巴母细胞白血病的CD19×CD3 BiTE)治疗CD19
DIQLTQSPASLAVSLGQRATISCKASQSVDYDGDSYLNWYQQIPGQPPKLLIYDASNLVSGIPPRFSGSGSGTDFTLNIHPVEKVDAATYHCQQSTEDPWTFGGGTKLEIKGGGGSGGGGSGGGGSQVQLQQSGAELVRPGSSVKISCKASGYAFSSYWMNWVKQRPGQGLEWIGQIWPGDGDTNYNGKFKGKATLTADESSSTAYMQLSSLASEDSAVYFCARRETTTVGRYYYAMDYWGQGTTVTVSSGGGGSDIKLQQSGAELARPGASVKMSCKTSGYTFTRYTMHWVKQRPGQGLEWIGYINPSRGYTNYNQKFKDKATLTTDKSSSTAYMQLSSLTSEDSAVYYCARYYDDHYCLDYWGQGTTLTVSSVEGGSGGSGGSGGSGGVDDIQLTQSPAIMSASPGEKVTMTCRASSSVSYMNWYQQKSGTSPKRWIYDTSKVASGVPYRFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSNPLTFGAGTKLELKHHHHHH
在来自6名新诊断的pPCL的患者的BM样本中评价了JNJ-957的离体活性,该活性通过积极的临床行为来表征。JNJ-957介导的这些pPCL样本中的肿瘤细胞裂解类似于在NDMM和未接受过达雷木单抗治疗的RRMM样本中观察到的裂解,但低于在达雷木单抗难治性的RRMM患者样本中观察到的裂解(p=0.0014)(图42)。尽管pPCL样本中的E:T中值比降低了大约8倍,但当与NDMM比较时,pPCL中的CD4
从6名pPCL患者获得了BM-MNC,并与JNJ-957(0.0064至4.0μg/mL)或对照抗体3930、BC3B4和7008(4.0μg/mL)一起温育48小时,之后使用流式细胞术分析对存活的CD138
为了进一步评估达雷木单抗治疗是否也有益于其他T细胞重定向疗法,使用来自11名MM患者的成对未接受过达雷木单抗治疗的和暴露于达雷木单抗的PB-MNC用GPRC5D×CD3双特异性抗体治疗RPMI MM细胞(样本从与上文实施例中所述相同的患者获得)。作为对照,使用其中CD3或GPRC5D结合VH/VL结构域被结合无关抗原(gp120)的空白结构域替换的抗体(对照mAb 3930空白×空白,对照mAb 7008:空白×CD3,对照mAb GPRC5D×空白)。在0.00064至4.0μg/ml的浓度下测试抗体。GPRC5D×CD3双特异性抗体以类似效力介导未接受过达雷木单抗治疗的和达雷木单抗难治性的样本两者中的MM细胞裂解(图43)。
还测试了GPRC5D×CD3双特异性抗体和达雷木单抗的联合在杀伤从NDMM或RRMM未接受过dara治疗的患者获得的MM细胞中的功效。图44示出了由GPRC5D×CD3双特异性抗体(0.0128μg/mL至0.8μg/mL)单独或与0.1μg/mL的达雷木单抗联合介导原代MM细胞的BM MNC裂解百分比48小时。将GPRC5D×CD3双特异性抗体和达雷木单抗对所观察到的(O)MM细胞的裂解水平与预期的(E)裂解水平进行比较,其中这些裂解水平是在假设联合效应是通过如方法中所示的累加效应实现的情况下计算的。黑条示出组平均值±SEM。使用配对学生t检验来计算P值。与达雷木单抗共温育增强了GPRC5D×CD3双特异性抗体以附加方式进行的MM细胞裂解。
GPRC5D×CD3双特异性抗体包含GPRC5D结合臂GC5B596和CD3结合臂CD3B219。表8中示出了GC5B596的氨基酸序列。表4中示出了CD3B219的氨基酸序列。
实验中使用的GPRC5D×CD3双特异性抗体在WO20180037651A1中有所描述并且包含以下序列:
GPRC5D结合结构域和CD3结合结构域,GPRC5D结合结构域分别包含SEQ ID NO:43、44、45、446、47和48的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3,并且CD3结合结构域分别包含SEQ ID NO:33、34、35、36、37和38的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3;
GPRC5D结合结构域包含SEQ ID NO:49的VH和SEQ ID NO:50的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL;以及
SEQ ID NO:51的第一重链(HC1)、SEQ ID NO:52的第一轻链(LC1)、SEQ ID NO:41的第二重链(HC2)和SEQ ID NO:42的第二轻链(LC2)。
抗GPRC5D×CD3双特异性抗体是IgG4同种型。
HC1包含S228P、F234A和L235A置换。
HC2包含S228P、F234A、L235A、F405L和R409K置换。
类似于实施例1至5所述的那样评估将另外的T细胞重定向疗法与抗CD38抗体联合的效应。测试该联合对介导杀伤由T细胞重定向疗法靶向的肿瘤细胞(即,表达由T细胞重定向疗法结合的抗原的肿瘤细胞)的加性效应或协同效应。如实施例中所述,评估抗CD38抗体的预处理对T细胞重定向疗法的功效的影响。
与抗CD38抗体联合测试的T细胞重定向疗法包括PSMA×CD3、TMEFF2×CD3、CD123×CD3和CD33×CD3双特异性抗体。
示例性PSMA×CD3双特异性抗体是PS3B27,包含PSMA结合结构域PSMB127和CD3结合结构域CD3B219。表9示出了PS3B27的氨基酸序列。表4中示出了CD3B219的氨基酸序列。
实验中使用的示例性PSMA×CD3双特异性抗体包含以下序列:
PSMA结合结构域和CD3结合结构域,PSMA结合结构域分别包含SEQ ID NO:54、55、56、9、10和59的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3,并且CD3结合结构域分别包含SEQ ID NO:33、34、35、36、37和38的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3;
PSMA结合结构域包含SEQ ID NO:60的VH和SEQ ID NO:61的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL;以及
SEQ ID NO:62的第一重链(HC1)、SEQ ID NO:63的第一轻链(LC1)、SEQ ID NO:41的第二重链(HC2)和SEQ ID NO:42的第二轻链(LC2)。
抗PSMA×CD3双特异性抗体是IgG4同种型。
HC1包含S228P、F234A和L235A置换。
HC2包含S228P、F234A、L235A、F405L和R409K置换。
示例性TMEFF2×CD3双特异性抗体是TMCB150,包含TMEFF2结合臂TMEB762和CD3结合臂CD3B376。表10示出了TMEB762的氨基酸序列。表11示出了CD3B376的氨基酸序列。
实验中使用的示例性TMEFF2×CD3双特异性抗体是TMCB150并且包含以下序列:
TMEFF2结合结构域和CD3结合结构域,TMEFF2结合结构域分别包含SEQ ID NO:64、65、66、67、68和69的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3,并且CD3结合结构域分别包含SEQ ID NO:74、75、76、77、78和79的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3;
TMEFF2结合结构域包含SEQ ID NO:70的VH和SEQ ID NO:71的VL,并且CD3结合结构域包含SEQ ID NO:80的VH和SEQ ID NO:81的VL;以及
SEQ ID NO:72的第一重链(HC1)、SEQ ID NO:73的第一轻链(LC1)、SEQ ID NO:82的第二重链(HC2)和SEQ ID NO:83的第二轻链(LC2)。
抗TMEFF2×CD3双特异性抗体是IgG4同种型。
HC1包含S228P、F234A和L235A置换。
HC2包含S228P、F234A、L235A、F405L和R409K置换。
示例性CD33×CD3双特异性抗体是C3CB189,包含CD33结合臂C33B904和CD3结合臂CD3B376。表12示出了C33B904的氨基酸序列。
表11中示出了CD3B376的氨基酸序列。
实验中使用的示例性CD33×CD3双特异性抗体是C3CB189并且包含以下序列:
CD33结合结构域和CD3结合结构域,CD33结合结构域分别包含SEQ ID NO:84、85、86、87、88和89的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3,并且CD3结合结构域分别包含SEQ ID NO:74、75、76、77、78和79的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3;
CD33结合结构域包含SEQ ID NO:90的VH和SEQ ID NO:91的VL,并且CD3结合结构域包含SEQ ID NO:80的VH和SEQ ID NO:81的VL;以及
SEQ ID NO:92的第一重链(HC1)、SEQ ID NO:93的第一轻链(LC1)、SEQ ID NO:82的第二重链(HC2)和SEQ ID NO:83的第二轻链(LC2)。
抗CD33×CD3双特异性抗体是IgG4同种型。
HC1包含S228P、F234A和L235A置换。
HC2包含S228P、F234A、L235A、F405L和R409K置换。
示例性CD123×CD3双特异性抗体是8747,包含CD123结合臂I3RB218和CD3结合臂CD3B219。8747在WO2016036937A1中有所描述。表13示出了I3RB218的氨基酸序列。表4中示出了CD3B219的氨基酸序列。
实验中使用的示例性CD123×CD3双特异性抗体是8747并且包含以下序列:
CD123结合结构域和CD3结合结构域,CD123结合结构域分别包含SEQ ID NO:94、95、96、9、10和59的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3,并且CD3结合结构域分别包含SEQ ID NO:33、34、35、36、37和38的HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3;
CD123结合结构域包含SEQ ID NO:100的VH和SEQ ID NO:61的VL,并且CD3结合结构域包含SEQ ID NO:39的VH和SEQ ID NO:40的VL;以及
SEQ ID NO:102的第一重链(HC1)、SEQ ID NO:63的第一轻链(LC1)、SEQ ID NO:41的第二重链(HC2)和SEQ ID NO:42的第二轻链(LC2)。
抗CD123×CD3双特异性抗体是IgG4同种型。
HC1包含S228P、F234A和L235A置换。
HC2包含S228P、F234A、L235A、F405L和R409K置换。
为了评估用抗CD38抗体预处理对通过T细胞重定向治疗剂杀伤肿瘤的功效的影响,从具有表达T细胞重定向治疗剂所结合的抗原(诸如CD123、CD33、PSMA、TMEFF2等)或使用已建立的肿瘤细胞系的受试者分离肿瘤细胞。如实施例所述,通过将肿瘤细胞与从暴露于抗CD38抗体或未接受过抗CD38抗体治疗的受试者获得的PB-MNC共同孵育来对肿瘤细胞的杀伤作用进行离体评估,并评估每组中肿瘤细胞的裂解百分比。在单独的实施例中,将T细胞重定向治疗剂和抗CD38抗体与靶细胞和效应细胞一起或单独温育,并评估由联合治疗剂相对于个体治疗剂介导的肿瘤细胞杀伤。
使用CD123阳性肿瘤细胞(诸如AML肿瘤)或细胞系(诸如AML细胞系KG1a、HL60或MOLM13)作为靶细胞来评估抗CD38抗体对CD123×CD3双特异性抗体介导的肿瘤细胞杀伤的影响。
使用CD33阳性肿瘤细胞(诸如AML肿瘤)或细胞系(诸如AML细胞系KG1a、HL60或MOLM13)作为靶细胞来评估抗CD38抗体对CD33×CD3双特异性抗体介导的肿瘤细胞杀伤的影响。
使用TMEFF2阳性肿瘤细胞(诸如LnCP细胞)作为靶细胞来评估抗CD38抗体对TMEFF2×CD3双特异性抗体介导的肿瘤细胞杀伤的影响。
使用TMEFF2阳性肿瘤细胞(诸如LnCP细胞)作为靶细胞来评估抗CD38抗体对PSMA×CD3双特异性抗体介导的肿瘤细胞杀伤的影响。
从已接受抗CD38抗体或未接受过抗CD38抗体治疗的受试者分离的PBMC或BM-MNC用作效应细胞。
本领域的技术人员将会知道可对本发明的优选实施方案作出许多改变和修改,而且此类改变和修改可在不脱离本发明的实质的情况下进行。因此,所附权利要求书旨在覆盖落入本发明的真实实质和范围内的所有此类等同变化。
本文档所引用或描述的每项专利、专利申请和专利公开的公开内容均以引用方式全文并入本文。
- 治疗癌症并增强T细胞重定向治疗剂的功效的方法
- 治疗癌症并增强T细胞重定向治疗剂的功效的方法
