兴奋性氨基酸转运载体2在制备调节免疫细胞炎性反应的药物中的应用
文献发布时间:2023-06-19 19:33:46
技术领域
本发明属于医药技术领域,具体涉及兴奋性氨基酸转运载体2(EAAT2)在制备调节免疫细胞炎性反应的药物中的应用。
背景技术
免疫系统的细胞主要可分为淋巴细胞(包括T细胞和B细胞),嗜中性粒细胞,树突状细胞,单核细胞和巨噬细胞。基本上所有组织都发现巨噬细胞,例如肝细胞中的库普弗细胞,肺中的肺泡巨噬细胞和中枢神经系统的小胶质细胞。巨噬细胞通过拉伸丝状伪足吞噬细胞碎片,微生物,癌细胞和异物。巨噬细胞通常会极化为两个不同的子集:经典激活的(M1)和交替激活的(M2)巨噬细胞,它们分别在抗炎和促炎功能中发挥关键作用。当暴露于T-helper 1(Th 1)型细胞因子或炎性介质(例如IFN-γ和LPS)时,巨噬细胞会极化为M1表型,以发挥其清除病原体和肿瘤细胞的功能,或者暴露于“替代激活”的巨噬细胞Th2细胞因子如IL-4和IL-10发挥其抗炎,伤口愈合和抗肿瘤的功能。活化的巨噬细胞会产生多种化学物质,例如补体蛋白,细胞因子和酶。除此之外,巨噬细胞具有抗原呈递的能力。作为免疫系统中的重要一环,调控巨噬细胞的功能对于疾病防治至关重要。
兴奋性氨基酸转运载体(Excitatory amino acid transporters,EAATs)在中枢神经系统(Central nervous system,CNS)中将神经突触中的谷氨酸和天冬氨酸转运至细胞内,现已鉴定出5种形式的EAATs(EAAT1-5),而EAAT2承担了CNS中大部分谷氨酸的摄取和转运。EAAT2由Slc1a2基因编码,目前为止,尚不清楚EAAT2在巨噬细胞中的分布及其功能。现有一些氨基酸转运载体被证明在巨噬细胞极化过程中扮演重要角色,例如Slc6A8,Slc36A9等,通过调控这些转运载体的表达从而改变巨噬细胞功能是切实可行的。目前尚未有关于EAAT2参与免疫细胞炎性反应的报道。
发明内容
有鉴于此,本发明的目的在于提供一种兴奋性氨基酸转运载体2在制备调节免疫细胞炎性反应的药物中的应用,为免疫细胞炎症防治提供了新手段。
本发明提供了兴奋性氨基酸转运载体2在制备调节免疫细胞炎性反应的药物中的应用。
优选的,所述兴奋性氨基酸转运载体2的氨基酸序列如SEQ ID NO:1所示。
优选的,所述免疫细胞包括巨噬细胞。
优选的,所述巨噬细胞包括M1型巨噬细胞。
优选的,所述M1型巨噬细胞包括腹腔巨噬细胞、骨髓来源巨噬细胞和ANA.1细胞系中一种或几种。
本发明提供了一种抑制兴奋性氨基酸转运载体2或Slc1a2基因表达的试剂或敲除Slc1a2基因的试剂在制备抑制M1型巨噬细胞极化的药物中的应用。
本发明提供了一种抑制兴奋性氨基酸转运载体2或Slc1a2基因表达的试剂或敲除Slc1a2基因的试剂在制备预防和/或治疗M1型巨噬细胞极化相关疾病的药物中的应用。
优选的,所述M1型巨噬细胞极化相关疾病包括以下一种或几种:败血症、肥胖和糖尿病。
优选的,所述抑制兴奋性氨基酸转运载体2的试剂为WAY213613。
优选的,所述敲除Slc1a2基因的试剂为含sgRNA的CRISPR/Cas9系统;
所述sgRNA的核苷酸序列如SEQ ID NO:18。
本发明提供了兴奋性氨基酸转运载体2在制备调节免疫细胞炎性反应的药物中的应用。实验表明,LPS/IFN-γ刺激巨噬细胞,导致巨噬细胞Slc1a2基因的表达量增高,进一步WB分析结果表明LPS通过NF-κB信号通路提高EAAT2表达量;并且通过抑制EAAT2表达或者敲除巨噬细胞中Slc1a2基因,抑制了炎性小体分泌,并且抑制NF-κB信号通路中p65亚基磷酸化,以及抑制Caspase-1,IL-1β、TNF-α的蛋白表达,减少了M1型巨噬细胞炎性小体的组装、抑制免疫细胞的极化,从而抑制免疫细胞炎性反应。本发明提供的应用为巨噬细胞相关疾病的防治提供了理论依据。
本发明提供了一种抑制兴奋性氨基酸转运载体2或Slc1a2基因表达的试剂或敲除Slc1a2基因的试剂在制备预防和/或治疗M1型巨噬细胞极化相关疾病的药物中的应用。本发明动物实验表明,相比野生型小鼠,Slc1a2基因敲除小鼠对LPS诱导的败血症模型有更高的存活率,同时对高脂日粮诱导的肥胖、糖尿病的体重有缓解作用,对葡萄糖耐受和胰岛素耐受有一定的提高作用。
附图说明
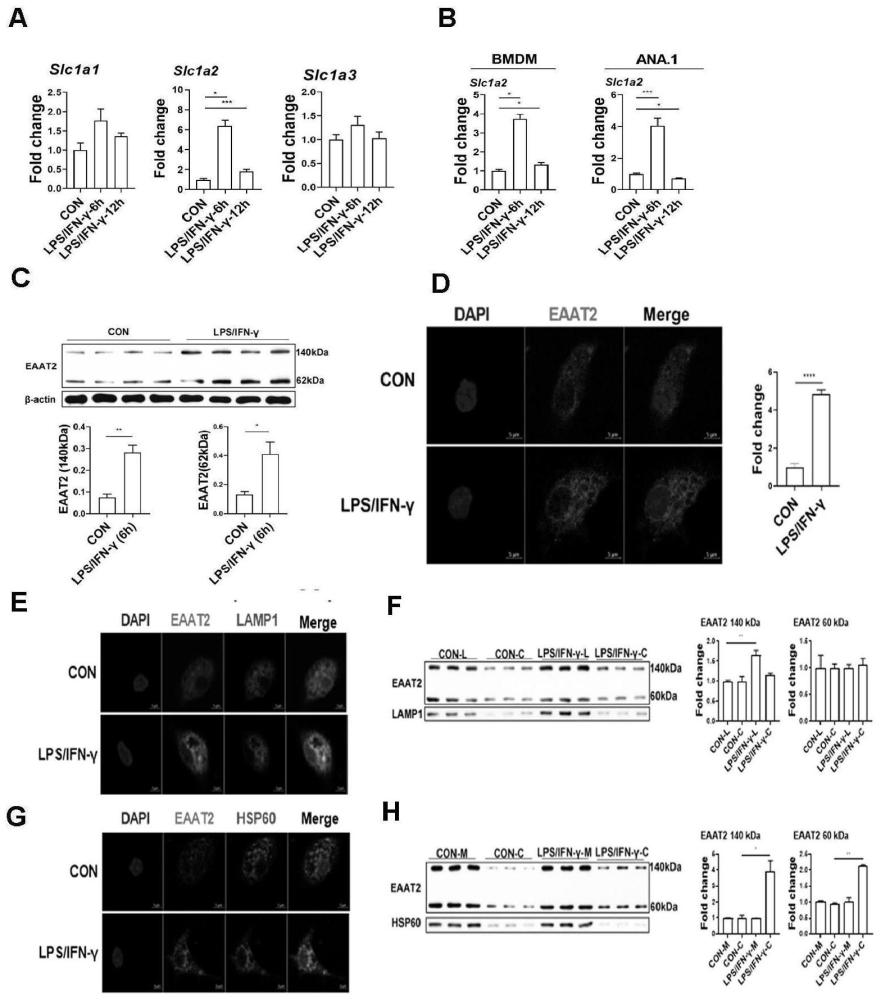
图1为M1型巨噬细胞中Slc1a2基因及EAAT2蛋白的表达和分布情况;A:LPS/IFN-γ刺激后小鼠腹腔巨噬细胞(PEM)编码EAAT2的Slc1a2基因表达量提高;B:骨髓来源巨噬细胞(BMDM)和巨噬细胞细胞系ANA.1中Slc1a2的mRNA表达提高;C:LPS/IFN-γ刺激后腹腔巨噬细胞EAAT2的蛋白表达提高;D:静息和M1型巨噬细胞中EAAT2主要分布在细胞质中且M1型巨噬细胞EAAT2的荧光强度更高;E:荧光共定位分析EAAT2蛋白和溶酶体marker LAMP1共定位;F:WB检测发现巨噬细胞的溶酶体有EAAT2表达且M1型巨噬细胞溶酶体中EAAT2表达量提高;G:荧光共定位结果发现EAAT2蛋白和线粒体marker HSP60共定位;H:WB检测发现巨噬细胞线粒体有EAAT2表达,而去除线粒体的细胞质蛋白中EAAT2的表达量提高;所有数据使用T检验分析,结果表示为平均值±SEM;*P<0.05,**P<0.01,***P<0.001,****P<0.0001;
图2为LPS/IFN-γ影响巨噬细胞中EAAT2表达的通路探究;A:通过相关抑制剂发现,LPS通过NF-κB信号通路提高Slc1a2基因的表达;B:WB实验发现LPS提高巨噬细胞中NF-κB信号通路的表达,IL-1β以及EAAT2的表达,应用IKK抑制剂则部分消除了这一现象;C:chIP-qPCR结果发现使用LPS提高了Slc1a2基因的丰度;D:双荧光报告实验结果发现NF-κB的p65亚基过表达提高了Slc1a2启动子的表达,但不能提高突变的Slc1a2启动子的表达;所有数据使用T检验分析,结果表示为平均值±SEM;*P<0.05,**P<0.01,***P<0.001,****P<0.0001;
图3为抑制EAAT2后对M1型巨噬细胞极化的影响;A:抑制EAAT2后LPS/IFN-γ刺激的巨噬细胞其M1型marker基因Il1b、Inos的mRNA表达量降低;B:抑制EAAT2后LPS/IFN-γ刺激的巨噬细胞IL-1β和TNF-α的分泌减少;C:抑制EAAT2可以减少使用LPS刺激的巨噬细胞IL-1β和TNF-α的分泌;D:抑制EAAT2可以减少尼日霉素刺激的巨噬细胞IL-1β的分泌;E:抑制EAAT2可以抑制LPS/IFN-γ刺激的ANA.1细胞系IL-1β和TNF-α分泌;F:抑制EAAT2可以抑制LPS/IFN-γ刺激的骨髓来源巨噬细胞IL-1β的分泌;G:抑制EAAT2后抑制了LPS/IFN-γ刺激的巨噬细胞中p65,Caspase-1和IL-1β蛋白表达;H:抑制EAAT2后减少了LPS/IFN-γ刺激的巨噬细胞中炎性小体的组装;所有数据使用T检验分析,结果表示为平均值±SEM;*P<0.05,**P<0.01,***P<0.001,****P<0.0001;
图4为过表达EAAT2提高了M1型巨噬细胞极化;A:过表达EAAT2提高了LPS/IFN-γ刺激的巨噬细胞IL-1β和TNF-α的分泌;B:过表达EAAT2提高了LPS/IFN-γ刺激的巨噬细胞Caspase-1,IL-1β,EAAT2蛋白的表达;所有数据使用T检验分析,结果表示为平均值±SEM;*P<0.05,**P<0.01,***P<0.001,****P<0.0001;
图5为巨噬细胞特异性敲除Slc1a2基因的CKO小鼠构建策略及鉴定;A:CKO小鼠的构建策略;B:CKO小鼠基因型鉴定结果;
图6为巨噬细胞特异性敲除Slc1a2基因后抑制了腹腔M1型巨噬细胞极化;A:巨噬细胞特异性敲除Slc1a2后抑制了M1型巨噬细胞释放IL-1β和TNF-α;B:巨噬细胞特异性敲除Slc1a2抑制了Caspase-1和IL-1β蛋白表达以及EAAT2蛋白表达;C:巨噬细胞特异性敲除Slc1a2后减少了LPS/IFN-γ刺激的巨噬细胞炎性小体组装;所有数据使用T检验分析,结果表示为平均值±SEM;*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
图7为巨噬细胞特异性敲除Slc1a2基因后提高了LPS诱导败血症模型小鼠的存活率并缓解了高脂日粮诱导的小鼠肥胖;A:巨噬细胞特异性敲除Slc1a2基因后的败血症模型小鼠的存活率结果;B:巨噬细胞特异性敲除Slc1a2基因后的败血症模型小鼠血清IL-1β和TNF-α水平;C:巨噬细胞特异性敲除Slc1a2基因后的肥胖小鼠的体重变化结果;D:巨噬细胞特异性敲除Slc1a2基因后的肥胖小鼠体重增长结果;E:巨噬细胞特异性敲除Slc1a2基因后的肥胖小鼠的葡萄糖耐受结果;F:巨噬细胞特异性敲除Slc1a2基因后的肥胖小鼠的胰岛素耐受结果;G:巨噬细胞特异性敲除Slc1a2基因后的肥胖小鼠的皮下脂肪IL-1β和TNF-α水平;H:巨噬细胞特异性敲除Slc1a2基因后的肥胖小鼠的附睾脂肪IL-1β和TNF-α水平;I:巨噬细胞特异性敲除Slc1a2基因后的肥胖小鼠的肾周脂肪IL-1β和TNF-α水平;所有数据使用T检验分析,结果表示为平均值±SEM;*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
具体实施方式
本发明提供了兴奋性氨基酸转运载体2在制备调节免疫细胞炎性反应的药物中的应用。
在本发明中,所述兴奋性氨基酸转运载体2的氨基酸序列优选如SEQ ID NO:1(MASTEGANNMPKQVEVRMHDSHLSSDEPKHRNLGMRMCDKLGKNLLLSLTVFGVILGAVCGGLLRLASPIHPDVVMLIAFPGDILMRMLKMLILPLIISSLITGLSGLDAKASGRLGTRAMVYYMSTTIIAAVLGVILVLAIHPGNPKLKKQLGPGKKNDEVSSLDAFLDLIRNLFPENLVQACFQQIQTVTKKVLVAPPSEEANTTKAVISMLNETMNEAPEETKIVIKKGLEFKDGMNVLGLIGFFIAFGIAMGKMGEQAKLMVEFFNILNEIVMKLVIMIMWYSPLGIACLICGKIIAIKDLEVVARQLGMYMITVIVGLIIHGGIFLPLIYFVVTRKNPFSFFAGIFQAWITALGTASSAGTLPVTFRCLEDNLGIDKRVTRFVLPVGATINMDGTALYEAVAAIFIAQMNGVILDGGQIVTVSLTATLASIGAASIPSAGLVTMLLILTAVGLPTEDISLLVAVDWLLDRMRTSVNVVGDSFGAGIVYHLSKSELDTIDSQHRMQEDIEMTKTQSIYDDKNHRESNSNQCVYAAHNSVVIDECKVTLAANGKSADCSVEEEPWKREK)所示。编码所述兴奋性氨基酸转运载体2的基因为Slc1a2基因。所述Slc1a2基因的核苷酸序列优选如SEQ ID NO:2(atggcatcaacagagggtgccaacaatatgcccaagcaggtagaagtgcgcatgcatgacagccacctcagctccgatgagccaaagcaccgaaacctgggcatgcgcatgtgcgacaagctggggaaaaatctcctgctctcactgactgtgtttggtgtcatcctgggagcagtgtgtggcgggctgcttcgcttggcatcgcccatccaccctgatgtggtcatgttgatagccttcccgggggacatactcatgaggatgctgaagatgctcatcctccctcttatcatctccagtttaatcacagggttgtcaggcctggatgctaaagccagcggccgcctaggcacgagagctatggtgtattacatgtccacgaccatcattgccgccgtgctgggggtcatcctggtgttggccatccacccaggcaatcccaaactcaagaagcagctagggcccgggaagaagaacgacgaggtgtctagcctggatgccttcctggatctcattagaaatctcttcccggagaacctggtgcaagcctgtttccagcagattcagacagtgacaaagaaagttctggtggcacctccatctgaggaggccaataccaccaaggcggtcatctccatgttgaatgaaaccatgaacgaggcccctgaagaaactaagatcgttatcaagaagggcctggagttcaaggacgggatgaacgtcttaggtctgatcggattctttattgctttcggcattgccatggggaagatgggtgaacaggccaagctgatggtggagttcttcaacattctgaatgagatcgtgatgaagttagtgatcatgatcatgtggtactcccctctgggtatcgcctgcttgatttgtgggaagatcatcgccatcaaggacttagaagtggttgctaggcagctggggatgtacatgatcaccgtgatcgtgggcctcatcattcacgggggcatctttctccccttgatttactttgtagtgaccagaaaaaatccattctccttttttgctggcatattccaagcctggatcactgctctgggaactgcttccagtgctggaactttgcctgttaccttccgttgcttggaagataatctagggattgacaagcgtgtgaccagattcgtcctcccagtcggagcaaccattaacatggatggcacagccctttacgaggctgtggcagccatcttcatagcccaaatgaatggggtcatcttggatggaggtcagattgtgactgtaagccttacagccaccctggcgagcattggtgcagccagtattcccagcgccgggctggtcaccatgctcctcattctcacagctgtgggcctgccaacggaggatatcagtctgctggtggcggtggactggctgctggatagaatgagaacttcagtcaatgtggtgggcgattcttttggggctgggattgtctatcacctttccaagtctgagctggacaccattgactcccaacaccgaatgcaggaagacatcgaaatgaccaagacgcagtccatttacgacgacaagaaccacagggaaagcaactctaatcagtgtgtctatgccgcacacaactctgtcgtaatagatgagtgcaaggtaactctggcggccaatggaaagtcagctgactgcagtgttgaggaagaaccttggaaacgtgaaa aataa)所示。
在本发明中,所述免疫细胞优选包括巨噬细胞。所述巨噬细胞优选包括M1型巨噬细胞。所述M1型巨噬细胞优选包括腹腔巨噬细胞、骨髓来源巨噬细胞和ANA.1细胞系中一种或几种。在本发明实施例中,分别验证了腹腔巨噬细胞、骨髓来源巨噬细胞和ANA.1细胞系三种来源的巨噬细胞,结果表明Slc1a2基因表达量经LPS/IFN-γ刺激6h或12h后均有显著提高,并且以刺激6h时Slc1a2基因的表达量提高的最为明显。同时在蛋白水平上,利用Western-blot(WB)技术测定了EAAT2的蛋白表达,结果显示EAAT2蛋白在M1型巨噬细胞中表达量也提高。而通过改变EAAT2蛋白或其编码基因表达,影响M1型巨噬细胞的功能,具体为抑制或敲除EAAT2蛋白或其编码基因表达,抑制M1型巨噬细胞极化。所述抑制M1型巨噬细胞极化包括抑制了M1型腹腔巨噬细胞中M1型巨噬细胞marker基因Il1b以及Inos的基因表达量、抑制了M1型巨噬细胞分泌IL-1β和TNF-α分泌、抑制巨噬细胞分泌炎性小体、抑制了NF-κB信号通路中p65亚基磷酸化,以及Caspase-1,IL-1β的蛋白表达、减少了M1型巨噬细胞中炎性小体组装。而过表达EAAT2蛋白会促进M1型巨噬细胞极化。鉴于M1型巨噬细胞极化与炎症反应的发生直接相关,因此抑制M1型巨噬细胞极化,有利于提高抑制炎症反应。
在本发明中,鉴于EAAT2蛋白或其编码基因在M1型巨噬细胞中表达提高,为了明确EAAT2蛋白的分布,利用免疫荧光检测技术检测EAAT2蛋白的分布,结果表明EAAT2分布在巨噬细胞细胞质中,结合共定位分析表明EAAT2在溶酶体和线粒体中均有分布。
本发明提供了一种抑制兴奋性氨基酸转运载体2或Slc1a2基因表达的试剂或敲除Slc1a2基因的试剂在制备抑制M1型巨噬细胞极化的药物中的应用。
本发明对所述抑制兴奋性氨基酸转运载体2的试剂没有特殊限制,采用本领域所熟知的兴奋性氨基酸转运载体2的抑制剂即可,例如WAY213613。所述WAY213613的抑制浓度优选为10μM。本发明对所述抑制Slc1a2基因表达的试剂没有特殊限制,采用本领域所熟知的抑制基因表达的试剂均可,例如含有抑制Slc1a2基因表达的sgRNA、siRNA或shRNA的质粒。所述防止M1型巨噬细胞极化与上述抑制M1型巨噬细胞极化的表现相同,在此不做赘述。
本发明提供了一种抑制兴奋性氨基酸转运载体2或Slc1a2基因表达的试剂或敲除Slc1a2基因的试剂在制备预防和/或治疗M1型巨噬细胞极化相关疾病的药物中的应用。
在本发明中,所述M1型巨噬细胞极化相关疾病优选包括以下一种或几种:败血症和肥胖。
在本发明中,所述抑制兴奋性氨基酸转运载体2的试剂优选为WAY213613。所述敲除Slc1a2基因的试剂优选为含sgRNA的CRISPR/Cas9系统。所述sgRNA的核苷酸序列如SEQID NO:18(sgRNA1 ATTCTGATGTCAATGGCAGC)和SEQIDNO:19(sgRNA2 CAAGGATATCTCCGAATG)所示。
在本发明中,以巨噬细胞敲除了Slc1a2基因的小鼠为实验动物,分别采用LPS诱导得到败血症小鼠模型,和用高脂日粮喂食诱导肥胖模型,评估巨噬细胞敲除了Slc1a2基因对败血症小鼠的存活率的影响,以及巨噬细胞敲除了Slc1a2基因对肥胖模型小鼠的体重以及葡萄糖耐受和胰岛素耐受的影响。结果表明,巨噬细胞特异性敲除Slc1a2基因明显提高小鼠的存活率。巨噬细胞特异性敲除Slc1a2基因显著降低肥胖小鼠体重及体重增长。巨噬细胞特异性敲除Slc1a2基因显著提高肥胖小鼠的葡萄糖耐受和胰岛素耐受,说明巨噬细胞特异性敲除Slc1a2基因对小鼠肥胖有一定的改善作用。
综合上述结果表明,EAAT2在巨噬细胞活化过程中发挥重要作用,可作为败血症以及肥胖、糖尿病等巨噬细胞相关疾病的研究靶点,用于药物的研究。
下面结合实施例对本发明提供的一种兴奋性氨基酸转运载体2在制备调节免疫细胞炎性反应的药物中的应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
M1型巨噬细胞中Slc1a2基因表达量提高
为了研究M1型巨噬细胞中编码兴奋性氨基酸转运载体的基因表达情况,使用LPS/IFN-γ刺激腹腔巨噬细胞、骨髓来源巨噬细胞及ANA.1细胞系。其中LPS浓度为1g/mL,IFN-γ为20ng/mL,处理时间为6h及12h。之后使用荧光定量PCR检测三个基因的表达,具体引物序列如下:。
β-actin(NM_007393):
F:GGT GGG AAT GGG TCA GAA GG(SEQ ID NO:3);
R:GTA CA TGGC TGG GGT GTT GA(SEQ ID NO:4);
Slc1a1(NM_009199):
F:TCG CTG CAC TGG ATT CCA AT(SEQ ID NO:5);
R:TCA GGT CCA ACA TGG CAT CC(SEQ ID NO:6);
Slc1a2(NM_001077514):
F:TCT AGC CTG GAT GCC TTC CT(SEQ ID NO:7);
R:CCT GTT CAC CCA TCT TCC CC(SEQ ID NO:8);
Slc1a3(NM_148938):
F:AGA GAT TGC AGC AAG GGG TC(SEQ ID NO:9);
R:AAG ACC AGC ATC TGC AGC AT(SEQ ID NO:10);
反应体系:10μl体系,通过SYBR Green在Q uant Studio 6Real-time PCR体系上进行RT-PCR反应,通过2
结果表明,经LPS/IFN-γ刺激6h或12h后,三种来源的巨噬细胞Slc1a2基因的表达量均提高,以6h的结果更加明显(图1中A和图1中B)。这些结果表明,M1型巨噬细胞中Slc1a2基因的表达量提高。
实施例2
M1型腹腔巨噬细胞中EAAT2蛋白表达提高,且分析其分布
为了验证Slc1a2基因编码的EAAT2蛋白在M1型腹腔巨噬细胞中的表达,使用Western-blot(WB)技术测定了实施例1方法处理的腹腔巨噬细胞中EAAT2的蛋白表达。
结果显示,EAAT2蛋白在M1型巨噬细胞中表达量提高(图1中C)。
之后使用免疫荧光检测发现EAAT2分布在巨噬细胞细胞质中,结合共定位分析发现EAAT2在溶酶体和线粒体中均有分布(图1中D、图1中E和图1中G)。
使用溶酶体分离试剂盒(CatNO.89839,Thermo Fisher)分离溶酶体,使用线粒体分离试剂盒(Cat NO.C3601,碧云天生物科技有限公司)分离线粒体,并提取其蛋白进行Western-blot检验,发现其有EAAT2蛋白表达。
实施例3
LPS通过NF-κB信号通路提高Slc1a2的表达
为了探究LPS/IFN-γ影响M1型巨噬细胞Slc1a2基因和EAAT2蛋白表达的通路,使用了IKK 16(1.5μM)抑制NF-κB信号通路的IKK亚基,以及GLPG-0634(10μM)、CEP33779(10μM)抑制JAK/STAT信号通路的STAT1/STAT2。处理方式为:加入含有抑制剂的完全培养基培养细胞1小时后,更换含有LPS和/或IFN-γ的完全培养基。
试验结果显示,单独使用LPS可以使Slc1a2基因的表达量提高(图2中A),抑制IKK消除了这一现象,单独使用IFN-γ则不能使Slc1a2基因表达量提高。
WB技术检测LPS以及LPS+IIK16刺激后的M1型巨噬细胞中NF-κB信号通路相关蛋白以及EAAT2表达量。结果进一步验证了LPS通过NF-κB信号通路使EAAT2表达量提高(图2中B)。
染色质免疫共沉淀-荧光定量PCR(chIP-qPCR)和双荧光素酶报告实验验证NF-κB信号通路中p65亚基能结合Slc1a2基因启动子上并促进Slc1a2基因的表达。使用的试剂盒为:chIP:
结果表明,过表达NF-κB信号通路中的p65亚基可以使Slc1a2的启动子丰度提高(图2中C和D)。以上结果表明LPS可以通过结合巨噬细胞中Slc1a2的启动子促进其表达。
实施例4
抑制EAAT2抑制了M1型巨噬细胞极化
为验证EAAT2在M1型腹腔巨噬细胞极化中的作用。使用10M WAY213613(EAAT2的选择性抑制剂)处理M1型腹腔巨噬细胞,采用荧光定量PCR检测M1型巨噬细胞marker基因Il1b以及Inos的基因表达量。
荧光定量PCR检测用引物如下:
Inos(M87039.1):
F:GCAGAGATTGGAGGCCTTGT(SEQ ID NO:14)
R:CCTGATCCAAGTGCTGCAGA(SEQ ID NO:15)
Il1b(NM_013693):
F:CAC AGA AAG CAT GAT CCG CG(SEQ ID NO:16)
R:ACT GAT GAG AGG GAG GCC AT(SEQ ID NO:17)。扩增方法同实施例1记载。
结果表明,使用10μM WAY213613抑制了M1型腹腔巨噬细胞中M1型巨噬细胞marker基因Il1b以及Inos的基因表达量(图3中A)。
同时,使用ELISA试剂盒检测发现抑制EAAT2抑制了M1型巨噬细胞分泌IL-1β和TNF-α分泌(图3中B)。
抑制EAAT2也可以抑制LPS(图3中C)以及尼日霉素刺激的巨噬细胞(图3中D)IL-1β和TNF-α分泌。
在ANA.1细胞系(图3中E)及骨髓来源巨噬细胞(图3中F)抑制EAAT2也可以抑制炎性因子分泌。
随后,使用Western-Blot检测,结果发现抑制EAAT2抑制了NF-κB信号通路中p65亚基磷酸化,以及Caspase-1、IL-1β的蛋白表达(图3中G)。
免疫荧光结果发现抑制EAAT2减少了M1型巨噬细胞中炎性小体组装(图3中H)。
实施例5
过表达EAAT2促进M1型巨噬细胞极化
使用Lipofectamine
结果表明,过表达EAAT2可以使静息巨噬细胞分泌更多的IL-1β和TNF-α,并使LPS/IFN-γ刺激的巨噬细胞释放更多的IL-1β,但对TNF-α的释放影响不大(图4中A)。
WB结果表明,过表达EAAT2可以提高Caspase-1蛋白和IL-1β蛋白的表达(图4中B)。以上结果表明过表达EAAT2有促进M1型巨噬细胞极化的功能。
实施例6
巨噬细胞特异性敲除Slc1a2基因影响M1型腹腔巨噬细胞极化。
巨噬细胞特异性敲除Slc1a2基因的小鼠由带有Slc1a2 flox基因的C57bl6J小鼠与Lyz2-cre工具小鼠繁育而成(图5)。其步骤为:将Slc1a2 flox的纯合小鼠与Lyz2-cre阴性小鼠配繁,其子代为Slc1a2
荧光定量PCR检测实验结果显示,腹腔特异性敲除Slc1a2基因的CKO小鼠(Slc1a2
WB结果显示,巨噬细胞特异性敲除Slc1a2基因抑制了M1型巨噬细胞Caspase-1、IL-1β和EAAT2的蛋白表达量(图6中B)。
免疫荧光结果显示,特异性敲除Slc1a2基因减少了M1型巨噬细胞炎性小体的组装(图6中C)。
实施例7
巨噬细胞特异性敲除Slc1a2基因对LPS诱导败血症模型小鼠存活率的影响
以实施例6制备的巨噬细胞特异性敲除Slc1a2基因的小鼠(基因型Slc1a2
结果表明,较WT鼠巨噬细胞特异性敲除Slc1a2基因明显提高小鼠的存活率(图7中A)。此外,注射LPS 3小时之后,CKO小鼠的血清IL-1β和TNF-α水平较WT小鼠更低(图7中B)。
实施例8
巨噬细胞特异性敲除Slc1a2基因对高脂日粮诱导的小鼠肥胖的影响
以实施例6制备的巨噬细胞特异性敲除Slc1a2基因的小鼠(基因型Slc1a2
可以看到,巨噬细胞特异性敲除Slc1a2基因显著降低肥胖小鼠体重及体重增长(图7中C和D)。
此外,巨噬细胞特异性敲除Slc1a2基因显著提高肥胖小鼠的葡萄糖耐受(图7中E)和胰岛素耐受(图7中F),说明巨噬细胞特异性敲除Slc1a2基因对小鼠肥胖有一定的改善作用。
在小鼠饲喂至14周时处死小鼠并收集小鼠皮下脂肪、附睾脂肪以及肾周脂肪,通过ELISA试剂盒检测三种脂肪组织中IL-1β和TNF-α的水平(图7中G~I)。结果表明相较于WT小鼠CKO小鼠脂肪组织中炎性因子的水平较低。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种用于治疗抑郁症的中药组合物在调节免疫炎性反应中的应用
- 一种核苷酸和该核苷酸的重组载体及其在制备抗肿瘤药物中的应用
- 一种多肽及其在制备抗心衰和炎性反应药物中的应用
- 一种多肽及其在制备抗心衰和炎性反应药物中的应用
