一种用于检测HVP基因分型的引物荧光探针、方法及应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明属于生物技术与医学技术领域,涉及一种用于检测HVP基因分型的引物荧光探针、方法及应用。
背景技术
宫颈癌是妇科常见恶性肿瘤,原位癌高发年龄为30至35岁,浸润癌为45至55岁,国家癌症中心2018年发布的数据显示,90%的宫颈癌患者确诊时已经发展成浸润癌,生存率大大降低,预后也较差,因此,宫颈癌早期筛查是有效预防宫颈癌的重要途径,宫颈癌早筛方案也为降低宫颈癌发病率和死亡率提供了有利支撑。
目前,临床上用于HPV检测的方法主要包括细胞学方法、免疫组化、荧光原位杂交、斑点杂交、熔解曲线和荧光PCR等,不同检测方法各有优缺点。实时荧光PCR检测方法是HPV诊断的最常见检测方法,在完全封闭的系统中运行,能有效避免污染,加入特异性探针,既提高了检测的灵敏度和特异性,又可以实时荧光监测扩增过程。但也存在一些不足,常规的荧光PCR只有四个通道,每一个通道只能检测一种靶标基因,通量比较小,不利于分型检测。反向点杂交法,优点是通过大,灵敏度高,适用于分型检测,缺点是成本高,易于污染。Digene公司推出的杂交捕获第二代检测技术(Hybrid Capture Test-Ⅱ,HC2),灵敏度较高,但容易发生交叉反应,成本高,操作不方便。高度多重熔解曲线检测是基于熔解曲线技术,结合TaqMan探针检测法,设计与靶标结合的TaqMan探针,探针的Tm值不同,产生的熔解峰Tm也不同,使得单荧光可以检测出多种靶标基因。高度多重溶解曲线法,具备熔解曲线法和荧光探针的优点,检测通量大、操作简便、高效廉价,适用于宫颈癌筛查。
现有HPV检测产品,部分产品不具有分型功能,HPV荧光分型产品,每条通道只能检测一种靶标,单次检测样本通量少,极大地增加了试剂成本和人工成本。现有获批的熔解曲线分型检测产品较少,且灵敏度不高,检测限在500-1000拷贝/反应,显著低于其它方法学检测产品。
因此,亟需提供一种高灵敏、低成本的HPV分型检测试剂盒,用于HPV的分型检测。
发明内容
针对现有技术的不足和实际需求,本发明提供一种用于检测HVP基因分型的引物荧光探针、方法及应用,采用共探针标记及通用引物扩增,减少探针和引物数量,降低引物探针之间的相互抑制,使反应更加高效,极大地提高灵敏度和特异性;单管分型检测21种HPV型别及内参,增加检测通量,降低材料成本,缩短检测时间,节省人工;采用双淬灭探针,降低荧光本底,能够有效地减少非特异峰的产生,进一步提高特异性。
为达到此发明目的,本发明采用以下技术方案:
第一方面,本发明提供了一种用于检测HVP基因分型的引物及荧光探针,所述引物的核酸序列包括SEQ ID NO.1-SEQ ID NO.38所示的序列中的任意一个或至少两个的组合;所述荧光探针的核酸序列包括SEQ ID NO.39-SEQ ID NO.56所示的序列中的任意一个或至少两个的组合;所述HVP基因分型包括HPV16、HPV18、HPV26、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV53、HPV56、HPV58、HPV59、HPV66、HPV68、HPV73、HPV82、HPV6、HPV11或HPV81中的任意一个或至少两个的组合。
本发明采用共探针标记及通用引物扩增,减少探针和引物数量,降低引物探针之间的相互抑制,使反应更加高效,极大地提高灵敏度和特异性;单管分型检测21种HPV型别及内参,增加检测通量,降低材料成本,缩短检测时间,节省人工;采用双淬灭探针,降低荧光本底,能够有效地减少非特异峰的产生,进一步提高特异性。
引物探针序列如表1所示。
表1
优选地,所述荧光探针的5’端含有荧光基团,3’端含有淬灭基团。
优选地,所述荧光基团包括FAM、VIC、ROX或CY5中任意一种或至少两种的组合。
优选地,所述淬灭基团包括BHQ1、BHQ2、DBQ1或BHQ3中任意一种或至少两种的组合。
第二方面,本发明提供了第一方面所述的用于检测HVP基因分型的引物及荧光探针在制备用于检测HVP基因分型的产品中的应用。
第三方面,本发明提供了一种用于检测HVP基因分型的试剂盒,所述试剂盒包括第一方面所述的用于检测HVP基因分型的引物及荧光探针。
第四方面,本发明提供了第一方面所述的用于检测HVP基因分型的引物及荧光探针在检测检测HVP基因分型中的应用。
第五方面,本发明提供了一种非疾病诊断和/或治疗为目的的检测HVP基因分型的方法,所述方法包括:
以待测样本的核酸为模板,利用第一方面所述的用于检测HVP基因分型的引物及荧光探针进行荧光PCR扩增,根据荧光PCR扩增结果进行判断。
优选地,所述荧光PCR扩增的靶点包括HPVE6基因序列和HPVE7区基因序列。
以E6和E7区作为检测靶点,能够有效地避免HPV整合过程的基因丢失(如L1和E1基因丢失)导致假阴性。
优选地,所述HVP基因分型包括HPV16、HPV18、HPV26、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV53、HPV56、HPV58、HPV59、HPV66、HPV68、HPV73、HPV82、HPV6、HPV11或HPV81中的任意一个或至少两个的组合。
优选地,所述荧光PCR扩增的体系包括第一方面所述的用于检测HVP基因分型的引物及荧光探针。
优选地,所述荧光PCR扩增的体系还包括:PCRbuffer缓冲液、dNTP、Taq酶、UDG酶和模板。
本发明中,PCR反应体系为25μL体系,PCRbuffer缓冲液含Mg
优选地,所述dNTP的浓度为0.20-0.8mmol/L;所述Taq酶的浓度为2.0-4.0U;所述引物中上游引物的终浓度为0.10-0.30mmol/L;所述引物中下游引物的终浓度为0.30-0.80mmol/L;所述荧光探针的终浓度为0.20-0.40mmol/L;所述UDG酶的终浓度为0.20-0.80U;所述模板的用量为1-3μL。
上述0.20-0.8mmol/L中的具体点值可以选择0.20mmol/L、0.30mmol/L、0.40mmol/L、0.50mmol/L、0.60mmol/L、0.70mmol/L、0.8mmol/L等。
上述2.0-4.0U中的具体点值可以选择2.0U、3.0U、4.0U等。
上述0.20-0.80U中的具体点值可以选择0.20U、0.30U、0.40、0.50U、0.60、0.70、0.80U等。
上述1-3μL中的具体点值可以选择1μL、2μL、3μL等。
50-52℃3-5min,93-95℃2-5min,1个循环;93-95℃6-10s,64-68℃20-40s,72-75℃10-20s,40-50个循环;93-95℃10-20s,40-45℃2-5min,40-78℃以0.05℃/s升温且期间连续采荧光,40-45℃10-20s,1个循环。
上述50-52℃中的具体点值可以选择50℃、51℃、52℃等。
上述3-5min中的具体点值可以选择3min、4min、5min等。
上述93-95℃中的具体点值可以选择93℃、94℃、95℃等。
上述2-5min中的具体点值可以选择2min、3min、4min、5min等。
上述6-10s中的具体点值可以选择6s、7s、8s、9s、10s等。
上述64-68℃中的具体点值可以选择64℃、65℃、66℃、67℃、68℃等。
上述20-40s中的具体点值可以选择20s、25s、30s、35s、40s等。
上述72-75℃中的具体点值可以选择72℃、73℃、74℃、75℃等。
上述10-20s中的具体点值可以选择10s、12s、14s、16s、18s、20s等。
上述40-50个循环中的具体点值可以选择40个循环、42个循环、44个循环、46个循环、48个循环、50个循环等。
上述40-45℃中的具体点值可以选择40℃、41℃、42℃、43℃、44℃、45℃等。
上述40-78℃中的具体点值可以选择40℃、50℃、60℃、70℃、72℃、74℃、78℃等。
与现有技术相比,本发明具有如下有益效果:
(1)本发明方法基于熔解曲线技术基础,结合TaqMan探针技术,使得单荧光通道可以检测出更多的靶标基因,荧光PCR仪包含多条荧光通道,使检测的靶标数量大大增加,熔解曲线探针的设计决定熔解峰Tm值,探针的长度和靶序列的匹配度,可以直接反映在Tm值上,因此,本发明在同一条探针的3‘端和5’端同时设计两个检测靶标,且两个靶标的Tm值不一致,根据Tm值的不同,单条探针可以同时检测出两个靶标基因,提高检测测通量;
(2)引物设计在保守区,不同亚型可以共用相同引物,减少引物的数量,减少反应体系引物探针之间的抑制,提高灵敏度;
(3)常规的实时荧光PCR法,一般分为4个荧光通道,每个通道检测一个基因,通量较小,在本发明中,实现单管四通道分型检测21种型别,检测通量大,操作方便快捷,提高检测效率,降低成本,一个反应管内可以同时分型检测出21种HPV型别(HPV16,HPV18,HPV26,HPV31,HPV33,HPV35,HPV39,HPV45,HPV51,HPV52,HPV53,HPV56,HPV58,HPV59,HPV66,HPV68,HPV73,HPV82,HPV6,HPV11,HPV81),操作方便,价格低廉,适用于宫颈癌早筛;
(4)本发明采用双淬灭探针,在淬灭探针新增了一个探针内部淬灭基团,降低荧光本底,使淬灭更彻底,背景信号更低,减少不同通道的干扰,能够有效地减少非特异峰的产生降低非特异,提高灵敏度;
(5)防污染的PCR反应体系,在PCR反应液配制时,将dUTP和dTTP按一定的比例混用,使得扩增产物都含有脱氧尿嘧啶,进行PCR扩增前,在PCR混合液添加UDG酶,消除PCR扩增中的残余污染,确保实验的准确性。
附图说明
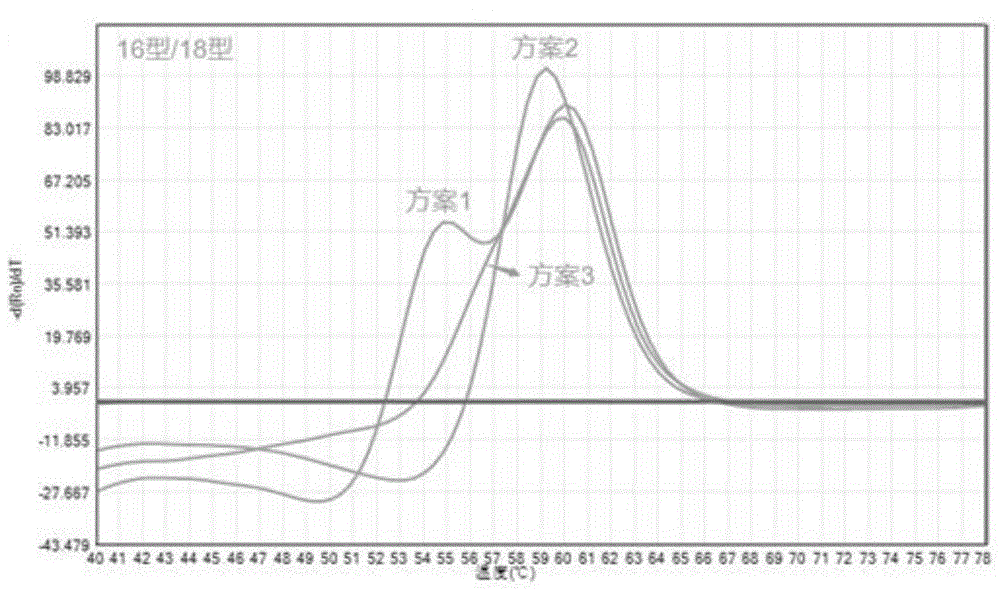
图1A为常规探针测试图(16型);
图1B为常规探针测试图(18型);
图1C为共用探针测试图;(16、18型)
图2A为双淬灭探针测试图(11型);
图2B为双淬灭探针测试图(45型);
图3A非兼并引物测试图(56、66型);
图3B兼并/非兼并引物混合测试图(56、66型);
图3C兼并/非兼并引物混合测试图(56、66型);
图3D兼并引物测试图(56、66型);
图4A为UDG酶的优化测试图(无UDG酶对照体系);
图4B为UDG酶的优化测试图(UDG酶0.1U/反应);
图4C为UDG酶的优化测试图(UDG酶0.2U/反应);
图4D为UDG酶的优化测试图(UDG酶0.4U/反应);
图4E为UDG酶的优化测试图(UDG酶0.8U/反应);
图5A为HPV熔解曲线法的建立图(阳性样本);
图5B为HPV熔解曲线法的建立图(阴性质控);
图6A为HPV熔解曲线检测限结果图(FAM通道示例);
图6B为HPV熔解曲线检测限结果图(VIC通道示例);
图6C为HPV熔解曲线检测限结果图(ROX通道示例);
图6D为HPV熔解曲线检测限结果图(CY5通道示例)。
具体实施方式
为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
实施例1
常规探针与共探针的比较研究。
针对16型和18型设计特异性探针和引物,每种型别设计三套引物探针,分别筛选出16型和18型最佳引物探针组合;设计三套16/18型共用探针,筛选出最优引物探针组合,比较最佳常规探针与最佳共用探针的灵敏及特异性。共用探针的长度一般不超过50bp,如果探针太长,也会影响探针的结合效率,配制16型和18型常规探针和共用探针反应体系(见表2),分别测试10例16型和18型阳性样本,比较常规探针和共用探针的准确率和灵敏度。
表2
常规/共探针的测试结果见表3。
表3
检测结果:常规探针的检测限为80copies/反应,共用探针的检测限为40copies/反应,具体结果见表3,共用探针的灵敏度显著高于常规探针灵敏度,见图1A-1C。
实施例2
双淬灭探针的设计及测试。
双淬灭探针有利于降低荧光本底,减少非特异峰产生,针对个测试过程中本底较高的型别(11型和45型),设计单淬灭和双淬灭探针,评估单/双淬灭探针的熔解峰效果。
检测结果:相对于单淬灭探针,双淬灭探针的本底更低,熔解峰更高,不容易产生非特异峰,更有利于熔解峰值的判读,见图2A-2B。
实施例3
兼并引物和特异性探针的设计及测试。
针对同源性较高的HPV型别,设计兼并引物,在探针设计上,选择高特异区段作为探针序列,根据表4引物探针组合,配制反应体系,评估引物探针的灵敏度。
表4
兼并/非兼并引物的测试结果见表5。
表5
检测结果:当上下游为非兼并引物,56型和66型灵敏度都为100copies/反应;当上游为兼并引物,当下游为非兼并引物,56型和66型灵敏度都为60copies/反应;当上游为非兼并引物,当下游为兼并引物,56型和66型灵敏度都为40copies/反应;当上下游为兼并引物,56型和66型灵敏度都为20copies/反应,见表5和图3A-3D。使用兼并引物,减少反应体系中引物数量,进而减少引物之间的相互抑制,减少抑制,提高灵敏度。
实施例4
防污染体系的建立。
在PCR体系加入5×10
检测结果:在0.2U/反应、0.4U/反应、0.8U/反应的浓度下,能够将含dUTP的PCR扩增产物全部清除(见图4A-4E),为了节约成本,选择0.2U/反应作为体系的反应浓度。
实施例5
高危HPV检测试剂盒反应体系的建立。
将单体系优化过的21种HPV型别和内参的引物/探针分配到1个反应管,见表6。
表6
1.1样本采集
收集HPV阳性样本和阴性样本,提取样本DNA,用于评估HPV检测试剂盒的性能。
1.2PCR引物/探针浓度的优化
在反应体系中,将引物/探针浓度稀释到0.1μmol/L、0.2μmol/L、0.3μmol/L、0.4μmol/L、0.6μmol/L、0.8μmol/L,稀释后进行检测,分析实验结果,确定试剂盒前引物终浓度为0.10μmol/L,后引物终浓度为0.30μmol/L,探针终浓度为0.20μmol/L。
1.3Taq DNA聚合酶(Taq酶)用量的优化
通过比较Taq酶用量(1.0U、2.0U、3.0U、4.0U、5.0U)的优化实验结果,选定2.0U作为试剂盒反应体系中Taq酶的用量。
1.4dNTP浓度的优化
反应体系中加入不同的dNTP浓度(0.10mmol/L、0.20mmol/L、0.30mmol/L、0.40mmol/L)进行检测,综合评估后选0.20mmol/L作为试剂盒反应体系中dNTP的使用量。
1.5UDG酶用量的优化
通过比较UDG酶用量(0.1U、0.2U、0.4U、0.8U)的优化实验结果,选定0.2U作为试剂盒反应体系中UDG酶的用量。
利用上述引物和探针进行反应体系的建立,最后确定采用的荧光PCR反应体系为25μL体系,所需各组分及相应浓度见表5。
表7
2.仪器检测通道的选择:
在进行荧光PCR反应时,应对所用仪器中反应管荧光信号的收集进行设置,选择的荧光检测通道与探针所标记的荧光报告基团一致。
3.PCR条件选择如下:
50℃3min,95℃2min,1个循环;95℃8s,64℃30s,72℃10s,50个循环;95℃15s,40℃2min,40-78℃以0.05℃/s升温且期间连续采荧光,40℃10s,1个循环。
4.利用建立的反应体系对提取样本DNA进行检测,阳性样本内参与对应型别处均有典型熔解峰且为正峰(见图5A),且峰值大于等10,阴性质控无熔解峰(见图5B)。
实施例5
测试试剂盒的检测下限。
合成HPV16,HPV18,HPV26,HPV31,HPV33,HPV35,HPV39,HPV45,HPV51,HPV52,HPV53,HPV56,HPV58,HPV59,HPV66,HPV68,HPV73,HPV82,HPV6,HPV11,HPV81的质粒,每个型别按2个拷贝/反应、2×10
实施例6
临床样本的检测。
用A1公司的单管检测试剂盒(备案号20183400427),A2公司的多管检测试剂盒(备案号20153400364)和本发明试剂盒分别测试118例HPV阳性样本(21种型别,每种型别各2-10例)和36例阴性样本,检测结果见表8。
表8
检测结果:本发明试剂盒和A2公司的多管检测试剂盒的准确率为99.3%,A1公司的单管检测试剂盒的准确率为95.0%。结果表明本发明试剂盒的准确性高,单管检测,操作方便,价格低廉,适用于HPV分型检测。
综上所述,本发明采用共探针标记及通用引物扩增,减少探针和引物数量,降低引物探针之间的相互抑制,使反应更加高效,极大地提高灵敏度和特异性;单管分型检测21种HPV型别(HPV16,HPV18,HPV26,HPV31,HPV33,HPV35,HPV39,HPV45,HPV51,HPV52,HPV53,HPV56,HPV58,HPV59,HPV66,HPV68,HPV73,HPV82,HPV6,HPV11,HPV81)及内参,增加检测通量,降低材料成本,缩短检测时间,节省人工;采用双淬灭探针,降低荧光本底,能够有效地减少非特异峰的产生,进一步提高特异性。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 一种雾化金属粉末的分级处理系统及其使用方法
- 一种针对葬坑土遗址的超声波雾化补水系统
- 一种雾化器、雾化系统及雾化系统的操作方法
- 雾化系统的雾化方法及雾化系统
