用于使用纳米孔装置检测分子的感测组合物、方法和装置
文献发布时间:2023-06-19 11:26:00
本申请根据35 U.S.C.119(e)要求2018年9月7日提交的美国临时申请第62/728,672号和2018年9月7日提交的美国临时申请第62/728,584号的优先权,其每一个通过引用全部并入本文。
背景技术
纳米孔装置是使用多孔膜(例如,单个或阵列的孔)用于检测和定量溶液中的单个生物分子如蛋白质、DNA和病毒颗粒的通用装置。摩擦(例如粘度)、电泳力和热运动之间的相互影响对生物分子的检测和分辨施加了限制。
纳米孔检测领域中的持续挑战是开发能够以更好的准确性检测和分辨样品中生物分子的特性的更好的感测技术,所述特性可能具有彼此相似的物理特性,如电荷、尺寸、浓度或结构构象。
在研究纳米孔检测方法时,我们发现通常较小尺寸或分子量的聚醚剂促进通过纳米孔装置的孔检测靶分子。该发现提高了纳米孔装置中特定分析物和生物分子的检测或分辨的准确性,其在之前使用常规的纳米孔缓冲液无法检测或分辨。
本公开提供用于使用纳米孔装置来检测或表征分析物和生物分子的组合物、方法、装置、系统和试剂盒。本发明的这些方面对于检测和分辨具有相似物理特性(例如长度、电荷、浓度和/或结构)并且否则其将不容易被检测、彼此分辨或能够表征的生物分子分析物特别有用。
本公开的组合物、方法、系统和试剂盒可用于需要精确鉴定生物分子的任何应用中。这种应用包括用于生物标志物测试的诊断、感染性疾病测试、基因筛选(例如,遗传基因座的鉴定、插入的转基因(例如,遗传修饰的生物)、拷贝数或突变)以及药物或化学试剂筛选。
本发明的各个方面至少部分地基于以下发现:某些试剂在感测溶液中使用时,当目标分析物分子通过纳米多孔膜的纳米孔转位时,可以促进电流信号的灵敏检测。
本公开提供了用于检测或表征样品中的生物分子的各种含聚醚剂的感测溶液组合物。所述聚醚剂可以是50个或更少的单体单元的聚合物,其中单体单元可以是包含氧原子和C(2-4)烷基或取代的C(2-4)烷基的烷氧基或取代的烷氧基单元。在某些情况下,所述聚醚剂是单体或二聚体。当多个单体单元连接在一起时,它们通常形成饱和的聚烷二醇链。该链可具有各种端基,包括羟基或烷氧基端基。本文所述的感测溶液、装置、方法和试剂盒中有用的示例性目的聚醚剂包括但不限于乙二醇、(聚)乙二醇、丙二醇、(聚)丙二醇、丁二醇、(聚)丁二醇,其取代的形式和其烷基化的形式。
本公开内容提供了许多包含用于检测或表征样品中的生物分子的含盐溶液的感测溶液组合物。该发现对于促进增强较大纳米孔中小分子的增强检测特别有用。
本公开还提供了用于检测或表征样品中的生物分子的纳米孔装置。还提供了使用纳米孔装置检测或表征分析物(例如生物分子)的各种方法、系统和试剂盒。
附图说明
通过参考下文的详细描述将获得对本公开的特征和优点的更好理解,下文详细描述阐述了其中利用了本发明的原理的说明性实施方案,以及附图,其中:
图1示出三甘醇(TEG)的结构。
图2示出乙二醇的单个单元的结构,所述乙二醇是构成聚乙二醇(PEG)的重复单元。
图3A-3C显示来自10%PEG 200感测溶液的数据。图3A显示108bp和309bp dsDNA的事件群体。图3B显示108bp和309bp dsDNA群体在对数尺度上的事件持续时间。图3C在柱状图中显示108bp和309bp群体的每一个的最大事件深度。
图4A-4E显示来自7%PEG 200感测溶液的数据。图4A显示分离时217bp和353bpdsDNA的事件图。图4B显示217bp和353bp dsDNA群体在对数尺度上的事件持续时间(秒)。图4C显示217bp和353bp事件群体的最大dG。图4D显示217bp与353bp dsDNA的25%、50%和75%混合物的停留时间的柱状图。图4E显示来自217bp和353bp dsDNA混合样品中25%、50%和75%的事件群体的柱状图。
图5A-5D显示来自25%TEG感测溶液的数据。图5A显示74bp、108bp和217bp dsDNA的事件群体。图5B显示对数尺度(秒)上的事件群体。图5C显示每个事件群体的最大dG信号的柱状图。图5D显示在对数尺度上的每个事件区域群体的柱状图。
图6A-6B显示来自4M LiCl标准缓冲液和72nm纳米孔中的15%TEG感测溶液的数据。图6A显示在217bp和309bp dsDNA的4M LiCl缓冲液中的事件群体。图6B显示在217bp和309bp dsDNA的15%TEG感测溶液中的事件区域群体。
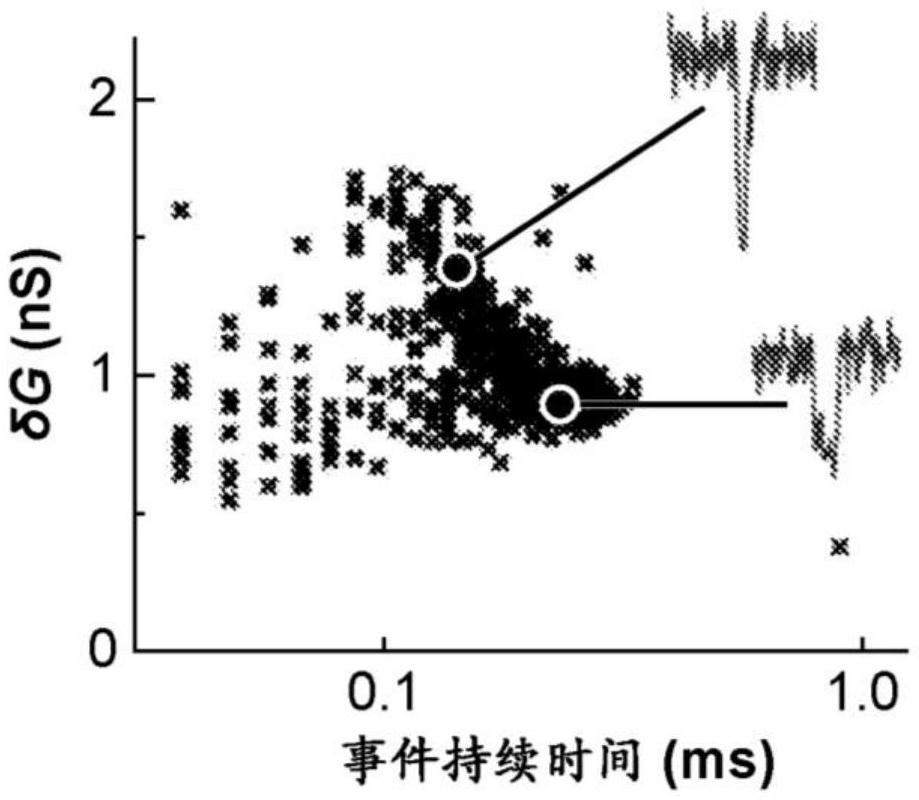
图7A-7C显示纳米孔装置的示意图,即在分子转位通过纳米孔期间检测到的离子电流的实例,并从1M LiCl缓冲液检测到事件。图7A示出了纳米孔的示意图,其具有带有用于在纳米孔上施加电压的电极的电路图。图7B显示由于在施加电压下生物分子通过孔的转位而引起的代表性事件。图7C显示从大dsDNA样品的27nm直径的纳米孔的1M LiCl缓冲液中检测到的事件,并将电流变化(δG)绘制为事件持续时间(ms)的函数。
图8A-8B显示从标准缓冲液1M KCl、1M LiCl和1M CsCl感测溶液产生的数据。图8A显示使用CsCl感测溶液在27nm直径的纳米孔中从具有108bp dsDNA的样品中检测到的事件图。使用KCl或LiCl缓冲液在任何孔中均未检测到事件。图8B显示使用CsCl感测溶液在30nm直径的纳米孔中从具有108bp dsDNA的样品中检测到的事件图。使用KCl或LiCl缓冲液在任何孔中均未检测到事件。
图9A-9B显示从具有30nm纳米孔的CsCl感测溶液的浓度从1M增加到3M所产生的数据。图9A显示使用1M CsCl(菱形)、2M CsCl(正方形)或3M CsCl(圆圈)缓冲液从108bpdsDNA检测到的事件图。图9B显示基于电流变化(δG)为每个缓冲液检测到的事件的概率柱状图。
图10A-10B显示由具有增加摩尔比的CsCl梯度溶液产生的数据。图10A显示使用1M/0.5M CsCl(菱形)、2M/1M CsCl(正方形)或3M/1.5M CsCl(圆圈)在30nm直径的纳米孔中从108bp dsDNA样品检测到的事件图。图10B显示基于电流变化(δG)为每个CsCl梯度溶液检测到的事件的概率柱状图。
图11A-11C显示从具有65nm纳米孔的3M/1.5M CsCl梯度感测溶液产生的数据。图11A显示针对58bp dsDNA样品检测到的事件图。图11B显示针对74bp dsDNA样品检测到的事件图。图11C显示针对108bp dsDNA样品检测到的事件图。
图12显示针对20、25、30、35或40个扩增循环后收集的109bp dsDNA扩增子,在具有25nm纳米孔的3M/1.5M CsCl缓冲液梯度感测溶液中检测到的事件图。
图13显示针对20、25、30、35或40个扩增循环后收集的109bp dsDNA扩增子,在具有32nm纳米孔的3M/1.5M CsCl梯度感测溶液中检测到的事件图。
图14显示针对浓度为13nM的109bp dsDNA样品或浓度为20nM的74bp dsDNA样品,在具有90nm纳米孔的3M/1.5M CsCl梯度感测溶液中检测到的事件图。
图15显示在具有102nm纳米孔的3M/1.5M CsCl梯度感测溶液中检测到的事件图。上图显示浓度为13nM的109bp dsDNA样品(圆圈),浓度为1.3nM的109bp dsDNA样品(正方形)。下图显示浓度为20nM的74bp dsDNA样品(圆圈)、浓度为6.66nM的74bp dsDNA样品(正方形)或浓度为20nM的58bp DNA(菱形)。
图16A-16B显示在具有53nm纳米孔的1M CaCl
图17显示针对74bp dsDNA样品,在具有73nm纳米孔的1MCaCl
图18A-18B显示针对在30nm纳米孔中分离运行的74bp dsDNA和217dsDNA收集的来自4M LiCL缓冲液中的代表性数据。图18A显示检测到的事件图。图18B显示检测到的事件停留时间的对数的柱状图。
图19A-19B显示针对分离运行的74bp dsDNA和217dsdsDNA,来自具有26nm纳米孔的20%麦芽糖感测溶液的数据。图19A显示检测到的事件图。图19B显示检测到的事件停留时间的对数的柱状图。
图20A-20B显示针对分离运行的108bp和309bp dsDNA,来自具有37nm纳米孔的30%乙二醇感测溶液的数据。图20A显示检测到的事件图。图20B显示检测到的事件停留时间的对数的柱状图。
图21A-21B显示针对分离运行的74bp和217bp dsDNA,来自具有30nm纳米孔的15%三甘醇(TEG)感测溶液的数据。图21A显示检测到的事件图。图21B显示检测到的事件停留时间的对数的柱状图。
图22A-22B显示针对分离运行的74bp和217bp dsDNA,来自具有30nm纳米孔的10%三丙二醇(TPG)感测溶液的数据。图22A显示检测到的事件图。图22B显示检测到的事件停留时间的对数的柱状图。
图23A-23B显示针对分离运行的108bp和217bp dsDNA,来自具有31nm的纳米孔的10%的四乙二醇二甲醚(TTEG-DME)感测溶液的数据。图23A显示检测到的事件图。图23B显示检测到的事件停留时间的对数的柱状图。
图24A-24B显示针对分离运行的108bp和217bp dsDNA,来自具有34nm的纳米孔的10%的三丙二醇单甲醚(TPG-MME)感测溶液的数据。图24A显示检测到的事件图。图24B显示检测到的事件的对数的柱状图。
图25A-25B显示针对分离运行的88bp和266bp dsDNA,来自具有35nm的纳米孔的不对称10%PEG 200(顺式)/10%麦芽糖(反式)感测溶液的数据。图25A显示检测到的事件图。图25B显示检测到的事件停留时间的对数的柱状图。
图26A-26B显示针对分离运行的88bp和266bp dsDNA,来自具有35nm的纳米孔的不对称10%麦芽糖(顺式)/10%PEG 200(反式)感测溶液的数据。图26A显示检测到的事件。图26B显示检测到的事件停留时间的对数的柱状图。
图27A-27B显示针对分离运行的74bp和217bp dsDNA,来自具有32nm的纳米孔的PEG 8000感测溶液的代表性数据。图27A显示检测到的事件。图27B显示检测到的事件停留时间的对数的柱状图。
图28A-28B显示针对分离运行的217bp和309bp dsDNA,来自具有32nm的纳米孔的PEG 8000感测溶液的数据。图28A显示检测到的事件。图28B显示检测到的事件停留时间的对数的柱状图。
图29A-29B显示与纳米孔装置一起使用的计算机系统的图表,以对原始电流数据进行分析并向用户或向用户提供数据的公司提供概要分析。
5.1.定义
除非另有定义,否则本文中使用的所有技术和科学术语具有本发明所属领域的技术人员通常理解的含义。如本文所用,以下术语具有下文赋予它们的含义。
所有包括范围的数值表达,例如距离、大小、温度、时间、电压和浓度,是近似值,其按照0.1的增量变化((+)或(-))。需要明白的是,虽然并不总是明示说明所有数值表达前加术语“大约”。也需要明白,尽管并不总是明确地表述,此处所描述的成分只是示例性的,并且此类成分的等价物是本领域中已知的。
术语“孔”或“纳米孔”是指任何材料类型的膜中的单个开口或开口阵列。孔可以具有允许分子或分析物通过膜转位的任何尺寸。孔可以具有任何形状。
术语“生物分子”是指核酸(例如,多核苷酸如DNA、RNA或LNA)、蛋白质、肽、抗体、小分子、适配子、分析物或任何药物试剂。生物分子可以来自天然来源。生物分子可以合成制备。可以将生物分子连接或缀合至检测装置。
术语“扩增”或“扩增反应”是指从靶多核苷酸序列产生包含靶多核苷酸序列的多个克隆扩增子的反应。扩增反应试剂包括进行靶多核苷酸序列的扩增所必需的任何分子。扩增反应试剂可包括但不限于游离引物、dNTP(三磷酸脱氧核苷酸、dATP、dGTP、dCTP、dTTP)、聚合酶(例如Taq或Pfu)、盐(氯化镁、硫酸镁、硫酸铵、氯化钠、氯化钾)、BSA(牛血清白蛋白)稳定剂和洗涤剂(例如triton X-100)。扩增反应可以包括但不限于例如PCR、连接酶链反应(LCR)、转录介导的扩增(TMA)、逆转录酶引发的PCR、DNA或RNA杂交技术、测序、等温扩增和环介导的等温扩增(LAMP)。从靶多核苷酸序列产生扩增子的扩增技术是本领域技术人员众所周知的。
术语“电流测量”是指在施加的电压下随时间流过纳米孔的电流的一系列测量。电流被表示为用于量化事件的量度,并且按照电压(电导)标准化的电流也用于定量事件。
术语“开放通道”是指在噪声范围内通过纳米孔通道的电流的基线水平,其中该电流不偏离由分析软件定义的值的阈值。
术语“事件”是指一组电流阻抗测量值,该值从电流测量偏离开放通道值达到定义的阈值时开始,并且当电流返回到开放通道值的阈值之内时结束。
术语“电流阻抗特征”是指在检测到的事件中从靶分子或已被修饰以增强检测的靶分子(例如,探针、标记、染料或电压敏感部分)确定的电流测量值和/或模式的集合。“电流阻抗特征”与“电流特征”可以互换使用。在事件中也可能存在多个特征以增强分子类型之间的区分。特征的实例包括但不限于计算的事件停留时间、平均事件幅度、最大事件幅度、中值事件幅度、事件面积或本领域已知的其他。本领域技术人员将理解,特征还可以包括计算的事件停留时间、平均事件幅度、最大事件幅度、中值事件幅度或事件面积的任何组合。
术语“捕获速率”是指在纳米孔装置中随时间检测到的事件的数量。在一些实施方案中,捕获速率可以具体指与特定的靶分子例如DNA扩增子的转位相关的事件的捕获和/或转位的速率。如本文所述,与在类似的纳米孔条件下具有相似质/荷比的对照相比,捕获速率可用于推断浓度。
如本文所用,我们将“顺式”表示为纳米孔装置中分子被装载其中和捕获到纳米孔中的腔室或体积(可互换使用),以及将“反式”表示为分子通过纳米孔后进入的相对的腔室或体积。
如本文所用,除非上下文另外明确指出,单数形式“一”、“一个”和“所述”包括复数对象。除非另外明确指出,术语“包括”、“例如”等旨在传达包括但不限于。
本文提供的范围应理解为该范围内的所有值的简化,包括所记载的端点。例如,1-50的范围应理解为包括任何数字、数字的组合或来自由1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49和50组成的组的子范围。
除非特别说明或从上下文中显而易见,否则如本文所用,术语“约”应理解为在本领域的正常公差范围内,例如在平均值的2个标准偏差之内。“约”可以理解为所规定值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%之内。
5.2.概述
在研究纳米孔检测方法的同时,我们发现聚醚和阳离子盐试剂能够或促进通过纳米孔装置的孔的靶分子的检测和表征,这些靶分子之前无法使用常规的纳米孔缓冲液检测或分辨。本公开提供了解决了针对多种类型的生物分子的纳米孔检测中的一些挑战性问题的各种感测溶液组合物、方法、装置、系统和试剂盒。
本公开内容的方法、装置、系统和试剂盒包括感测溶液,当靶分子通过纳米多孔膜的纳米孔转位时,所述感测溶液能够或促进对电流信号的检测和辨别,从而提供提高的准确性。在某些实施方案中,探针、电压敏感部分或其他标记可与本公开的方法、装置、系统和试剂盒一起使用以进一步增强生物分子的检测。
本公开提供的各种创造性方面对于检测和分辨样品中具有相似物理特性(例如长度、电荷和/或结构)并且否则其不容易被检测、彼此分辨或能够使用标准(例如常规)纳米孔缓冲液表征的分子特别有用。
需要准确检测和表征生物分子(例如,分析物、核酸和蛋白质)的任何应用都可以利用本公开的组合物、方法、系统和试剂盒。因此,本公开的组合物、方法、系统和试剂盒可以应用于诸如诊断、感染性疾病测试、基因筛选以及药物或化学试剂筛选的应用。
5.3.感测溶液组合物
本公开提供用于使用纳米孔装置来检测和表征生物分子的各种感测溶液组合物。本公开提供的组合物特别适用于检测和分辨样品中具有相似物理特性(例如长度、电荷、结构或其组合)并且否则其不能被检测、彼此分辨或使用纳米孔装置在标准缓冲液中表征的生物分子。
预期本公开的组合物可以以有效量与本公开的方法、装置、系统和试剂盒一起使用。还预期本公开的组合物可以以有效量与本领域已知的方法、装置、系统和试剂盒一起使用。
5.3.1.聚醚剂
本公开提供用于使用纳米孔装置检测或表征样品中的生物分子的各种基于聚醚的感测溶液。我们发现,当通常较小尺寸或分子量的聚醚剂用于感测溶液以检测纳米孔装置中的分析物时,其促进通过纳米孔装置的纳米孔的分析物靶分子的检测。
聚醚剂可以是50个或更少的单体单元(例如,40个或更少的单体单元、30个或更少的单体单元、20个或更少的单体单元)的线性聚合物。聚醚剂的单体单元可以是包含氧原子和C
应理解,可以将末端修饰并入本文所述的任何聚醚剂中以提供期望的性质。这种末端修饰可以例如通过衍生末端羟基(例如形成醚、酯或氨基甲酸酯末端修饰),或通过并入例如包含官能团如氨基、羧酸基或丙烯酸酯基的可任选进一步衍生化(例如,作为酰胺、氨基甲酸酯、酯或羟胺)的端基来实现。在一些情况下,末端基团包括适合与目标分子缀合的化学选择性官能团。因此,目标端基包括但不限于丙烯酸酯(-COCH=CH
在一些实施方案中,所述聚醚剂具有式(I):
其中:
m是1-3;
n是1-30;
每个R
R
在一些实施方案中,所述聚醚剂具有式(Ia):
其中:
m是1-3;
n是1-30;
R
R
在式(I)-(Ia)的某些实施方案中,R
在式(I)-(Ia)的某些实施方案中,R
5.3.2.(聚)乙二醇剂
本公开提供各种可用于使用纳米孔装置检测或表征样品中的生物分子的基于(聚)乙二醇(PEG)的感测溶液。在式(I)-(Ia)的一些实施方案中,其中m为1且R
在式(I)-(Ia)的一些实施方案中,所述聚醚剂是式(II):
其中n是1-30;并且每个R
在式(II)的一些实施方案中,每个R
在式(II)的一些实施方案中,n为1并且每个R
在式(II)的一些实施方案中,所述聚醚剂是分子量为约120-3000的(聚)乙二醇或(聚)乙二醇醚。在式(II)的一些实施方案中,聚醚的分子量为3000或更小,例如2500或更小、2000或更小、1500或更小或1000或更小。应理解,由于聚醚剂的多分散性,本文所述的任何分子量可以是指平均分子量,即,这种聚合物可以包括具有可取决于其制备方法的分子量分布的分子。在式(II)的一些实施方案中,所述聚醚剂的分子量为100-120、120-140、140-160、160-180、180-200、200-300、300-400、400-500、500-600、600-700、700-800、800-900、900-1000、1000-1100、1100-1200、1200-1300、1300-1400、1400-1500、1500-1600、1600-1700、1700-1800、1800-1900、1900-2000、2000-2200、2200-2400、2400-2600、2600-2800、2800-3000、3000-4000、4000-5000、5000-6000、6000-7000或7000-8000。应理解,可以调整选择用于感测溶液中的特定聚醚剂的大小或分子量,以提供期望的检测灵敏度或准确性,并且其取决于多种条件,例如目标分析物(例如生物分子)、分析物探针(如果使用)和探针的物理特性或化学性质。
在式(II)的一些实施方案中,聚醚剂是PEG 120-160分子量。在式(II)的一些实施方案中,聚醚剂是PEG 160-200分子量。在式(II)的一些实施方案中,聚醚剂是PEG 200-400分子量。在式(II)的一些实施方案中,聚醚剂是PEG 200-600分子量。在式(II)的一些实施方案中,聚醚是PEG 3000分子量或更小。
5.3.3.(聚)丙二醇剂
本公开内容提供了多种包含用于使用纳米孔装置检测和表征样品中的生物分子的(聚)丙二醇(PPG)的感测溶液。在式(I)-(Ia)的一些实施方案中,其中m为1且一个R
在式(I)的一些实施方案中,所述聚醚剂是式(III):
其中n是1-30;并且R
在式(III)的一些实施方案中,R
在式(III)的一些实施方案中,n为2,且R
在式(I)的一些实施方案中,所述聚醚剂是式(IIIa)和/或(IIIb):
其中n是1-30,q为1-29;每个R
在式(IIIa)的一些实施方案中,R
在式(IIIa)的一些实施方案中,q为1,且R
在某些实施方案中,所述聚醚剂是二丙二醇。在某些实施方案中,聚醚剂是三丙二醇。应理解,聚丙二醇(例如二-或三-丙二醇)可以包括不同的异构体形式。二丙二醇可以一种或多种异构体存在,即4-氧杂-2,6-庚二醇、4-氧杂-1,6-庚二醇、2-(-羟基-丙氧基)-丙-1-醇和/或2-(2-羟基-1-甲基-乙氧基)-丙-1-醇。在一些情况下,所用的二丙二醇是4-氧杂-2,6-己二醇和4-氧杂-1,6-己二醇的混合物。
在式(III)-(IIIb)的一些实施方案中,所述聚醚剂是分子量为约120-3000的(聚)丙二醇或(聚)丙二醇醚。在式(III)-(IIIb)的一些实施方案中,聚醚的分子量为3000或更小,例如2500或更小、2000或更小、1500或更小或1000或更小。在式(III)-(IIIb)的一些实施方案中,聚醚剂的分子量为100-120、120-140、140-160、160-180、180-200、200-300、300-400、400-500、500-600、600-700、700-800、800-900、900-1000、1000-1100、1100-1200、1200-1300、1300-1400、1400-1500、1500-1600、1600-1700、1700-1800、1800-1900、1900-2000、2000-2200、2200-2400、2400-2600、2600-2800、2800-3000、3000-4000、4000-5000、5000-6000、6000-7000或7000-8000。
在式(III)-(IIIb)的一些实施方案中,聚醚剂是PEG 120-160分子量。在式(III)-(IIIb)的一些实施方案中,聚醚剂是PEG 160-200分子量。在式(III)-(IIIb)的一些实施方案中,聚醚剂是PEG 200-400分子量。在式(III)-(IIIb)的一些实施方案中,聚醚剂是PEG200-600分子量。在式(III)的一些实施方案中,聚醚是PEG 3000分子量或更小。
5.3.4.(聚)丁二醇剂
在式(I)的一些实施方案中,其中m为2-3且R
在式(I)的一些实施方案中,所述聚醚剂是式(IV):
其中p是1或2;n是1-30;R
在式(IV)的一些实施方案中,每个R
在式(IV)的一些实施方案中,当p为1时,R
在式(IV)的一些实施方案中,聚醚剂是分子量为约120-3000的(聚)丁二醇或(聚)丁二醇醚。在式(IV)的一些实施方案中,聚醚的分子量为3000或更小,例如2500或更小、2000或更小、1500或更小或1000或更小。在式(IV)的一些实施方案中,聚醚剂的分子量为100-120、120-140、140-160、160-180、180-200、200-300、300-400、400-500、500-600、600-700、700-800、800-900、900-1000、1000-1100、1100-1200、1200-1300、1300-1400、1400-1500、1500-1600、1600-1700、1700-1800、1800-1900、1900-2000、2000-2200、2200-2400、2400-2600、2600-2800、2800-3000、3000-4000、4000-5000、5000-6000、6000-7000或7000-8000。
5.3.5.(聚)烷二醇醚剂
如上所述,式(I)-(IV)的聚醚剂的方面包括以烷氧基封端的线性聚合物,即,在式(I)-(Ia)中,R
在某些实施方案中,本公开为感测溶液提供有效量的乙酸酯、丙烯酸酯、如聚(乙二醇)甲基醚丙烯酸酯(CAS 32171-39-4)等。
5.3.6.阳离子盐剂
本公开提供用于使用纳米孔装置检测和表征生物分子的阳离子盐剂。本公开的阳离子盐剂以有效量用于感测溶液以提供使用纳米孔装置对生物分子的增强的检测和分辨。本领域技术人员将理解,术语“盐剂”可以与术语“电解质”互换使用。
本公开提供各种包含有效的至少一种单价阳离子或单价阳离子盐的感测溶液。在一些实施方案中,一价阳离子可以是Li、Na、K或Cs。在一些实施方案中,一价阳离子盐是CsCl、LiCl、NaCl或KCl。一价阳离子或一价阳离子盐可以基于待检测的生物分子以各种摩尔浓度用于感测溶液中。在一些实施方案中,一价阳离子或一价阳离子盐在感测溶液中的总浓度可为约0.5M、约1M、约1.5M、约2M、约2.5M、约3M、约3.5M、约4M、约5M或约6M。
本公开还提供了各种包含有效的至少一种二价阳离子或一种或二价阳离子盐的感测溶液。在一些实施方案中,二价阳离子可以是Ca
本公开提供各种用于使用纳米孔装置检测和表征生物分子的包含CsCl剂的感测溶液组合物。CsCl剂可在感测溶液中包含有效量。
CsCl剂的有效量将取决于所使用的生物分子、方法或应用。在一些实施方案中,CsCl剂的有效量为约0.5M、约1M、约1.5M、约2M、约2.5M、约3M、约3.5M或约4M。
本公开提供的CsCl剂可以以各种浓度施加以便在纳米孔装置中跨膜形成梯度感测溶液。例如,可以将较高浓度的CsCl施加至顺式腔室,并且可以将较低浓度的CsCl施加至反式腔室。一些非限制性实例包括1M/0.5M CsCl、2M/1M CsCl或3M/1.5M CsCl。在另一个实施方案中,可以将较低浓度的CsCl施加至顺式腔室,并且可以将较高浓度的CsCl施加至反式腔室。
本公开提供各种用于使用纳米孔装置检测和表征生物分子的包含CaCl
CaCl
本公开提供的CaCl
5.3.7.有效量
在感测溶液中所述聚醚剂的有效量将取决于所使用的应用、生物分子或方法。
有效量通常允许增加纳米孔装置中生物分子的检测或表征的准确性。参见使用描述于5.3.9节的本发明的感测溶液来实现增加的准确性的非限制性方式。
在一些实施方案中,感测溶液中聚醚剂的有效量(例如,如本文所述)为:约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、或约30%v/v。在一些实施方案中,感测溶液中聚醚剂的有效量为30%v/v。
在一些实施方案中,感测溶液中聚醚剂的有效量(例如,如本文所述)为:约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、或约30重量%。在一些实施方案中,在感测溶液中所述聚醚剂的有效量为聚醚剂重量的30%或更低(例如,如本文所述)。
类似于聚醚剂,CaCl
在一些实施方案中,CaCl
5.3.8.额外试剂
感测溶液可以包含已知在缓冲液中的任何其他试剂或化学物质。如本领域技术人员将理解,可以包括在本公开的感测溶液中的非限制性实例包括缓冲溶液、盐和螯合剂,碳水化合物,或糖。将预期,可以使用纳米孔检测的标准筛选方法用感测溶液优化任何一种额外试剂(例如,针对浓度)。
预期可以将二价或单价阳离子或盐添加至本公开的感测溶液中。可以作为额外试剂添加到感测溶液中的阳离子或盐的非限制性实例为:LiCl、NaCl、KCl、MgCl
在一些实施例中,本公开的感测溶液可包含螯合剂。可以如本文所述添加到感测溶液中的螯合剂包括但不限于EDTA、EGTA或本领域已知的任何其他螯合剂。可以将螯合剂以不同的浓度添加到感测溶液中。例如,可以以大于0.01M、0.02M、0.05M、0.1M、0.2M、0.5M、1M、1.5M、2M的摩尔浓度或与感测溶液配合以增加准确性的任何浓度使用螯合剂。
也可以将缓冲溶液添加到本公开的感测溶液中。可以添加到感测溶液中的缓冲溶液的非限制性实例是TRIS-HCl、硼酸盐、CHES、Bis-tris丙烷、CAPS、磷酸钾、TRIS或HEPES。可以以各种浓度添加缓冲溶液。例如,可以以大于0.01M、0.02M、0.05M、0.1M、0.2M、0.5M、1M、1.5M、2M、2.5M、3M、3.5M、4M、4.5M、5M、6M、7M,9M,10M,11M或与感测溶液配合以增加准确性的任何浓度使用缓冲溶液。
此外,取决于所使用的应用、生物分子或方法,本公开的感测溶液也可以省略某些试剂。
在一些应用中,感测溶液将不包含甘油。
在一些应用中,感测溶液将不包含大于7000的PEG。在一些应用中,本公开提供的感测溶液将不包含PEG 8000。
5.3.9.增加的准确性
与标准缓冲液相比,本发明的感测溶液在使用纳米孔装置的生物分子的检测和表征中提供了提高的准确性。使用本公开的感测溶液的增加的准确性将取决于待测定的生物分子的类型、方法、应用或特性。
在一些实施方案中,增加的准确性可以是检测否则在标准缓冲液中将无法检测到的生物分子或其修饰。
在一些应用中,增加的准确性可以是检测通过标准缓冲液中的孔的分子的大量事件。经过合理的时间量后,大量事件可以是100、200、300、400、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900或2000个。
合理的时间量将取决于样品中背景分子(例如,非靶分子)的水平。例如,如果已知核酸或蛋白质在样品中是罕见的,例如来自干细胞的生物标志物,则与针对干细胞群而言基本上纯化的样品相比,合理的时间量将更长。在一些实施例中,合理的时间量将是约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30分钟。在一些实施方案中,合理的时间量将是约1、2、3、4、5、6、7、8、9或10分钟。
在一些应用中,增加的准确性可以是测定否则在标准缓冲液中将无法检测到的生物分子的一个或多个特征(例如,长度、大小、结构、浓度、修饰等)。
在一些应用中,增加的准确性可以是确定具有相似长度的样品中两个或更多个生物分子的长度差异。在一些实施方案中,增加的准确性可以是区分样品中生物分子的不同长度或大小。在一些实施方案中,区分小于50bp、100bp、150bp、200bp、250bp、300bp、350bp、400bp、450bp或500bp的长度差异。
在一些实施方案中,增加的准确性可以是区分样品中生物分子的不同大小。在一些实施方案中,不同大小的生物分子之间的区分可以是小于10、20、30、40、50、60、70、80、90或100kDa大小的差异。在一些实施方案中,在不同大小的生物分子之间的区分可以大于10、20、30、40、50、60、70、80、90或100kDa。
在一些应用中,增加的准确性可以是分辨具有相似结构的样品中两个或更多个生物分子的结构差异。在一些应用中,增加的准确性可以是分辨结构相似的样品中两种或更多种蛋白质的结构差异。在一些应用中,增加的准确性可以是确定具有相似结构的样品中两个或多个核酸的结构差异。
在一些应用中,增加的准确性可以是分辨具有相似修饰(例如电荷、长度和/或大小)的样品中两种或更多种生物分子的化学修饰差异。
在一些应用中,增加的准确性可以是分辨蛋白质或核酸上的修饰数目。
在一些应用中,增加的准确性可以是分辨蛋白质或核酸上修饰的存在或不存在。可以在生物分子上检测或表征的修饰的非限制性实例包括但不限于:甲基化、磷酸化、乙酰化等。
5.3.10.标准缓冲液
与本文提供的感测溶液相比,用于确定增加的准确性的标准缓冲液可以是本领域已知的任何纳米孔缓冲液、运行缓冲液或感测缓冲液。取决于待确定的生物分子的类型、方法、应用或特性,标准缓冲液组合物将不同。
在一些实施方案中,标准纳米孔缓冲液可包含有效量的LiCl、KCl或NaCl或其单价缓冲液。“有效量”的标准缓冲液是指允许生物分子以合理的速率通过孔转位,但不会导致具有相似物理特性的两种或更多种生物分子的检测、分辨或表征增加的标准缓冲液。
在一些实施方案中,标准缓冲液包含LiCl、KCl、NaCl或其单价离子,其摩尔浓度可以小于0.5M、1M、2M、3M、4M或5M。在一些实施方案中,标准缓冲液是4.0M LiCl、10mM TrisHCl pH 8.8、1mM EDTA。
在一些实施方案中,标准缓冲液不包含本公开的聚醚剂。在一些实施方案中,标准缓冲液不包含有效量的式(II)-(IV)的聚醚。
在一些实施方案中,标准缓冲液可以进一步包含一种或多种缓冲化学品或试剂。标准缓冲液中使用的缓冲化学品或试剂可以包括但不限于Tris、Tris-HCL、硼酸盐、CHES、Bis-tris丙烷、CAPS或本领域已知的其他物质。
在一些实施方案中,标准缓冲液可以进一步包含螯合剂。可以包含在标准缓冲液中的螯合剂包括但不限于EDTA、EGTA或本领域已知的其他螯合剂。在一些应用中,标准缓冲液可以包含浓度小于0.5mM、1mM、2mM、3mM或4mM的螯合剂。在一些应用中,标准缓冲液可以包含浓度大于0.5mM、1mM、2mM、3mM或4mM的螯合剂。
在一些实施方案中,标准缓冲液将包含分子量大于3000、4000、5000、6000或7000的PEG。在一些实施方案中,标准缓冲液将包含PEG 8000分子量。在一些实施方案中,标准缓冲液包含有效量的甘油。
标准缓冲液通常不包含有效量的聚醚剂。在一些实施方案中,标准缓冲液不包含有效量的式(I)或其实施方案;式(II)或其实施方案;式(III)或其实施方案;式(IV)或其实施方案或其组合。
5.4.方法
本公开提供各种使用纳米孔装置检测和表征样品中的生物分子的方法。
本公开的方法对于检测和分辨具有相似物理特性(例如长度、电荷、结构、浓度或其组合)并且否则其将无法检测、彼此分辨或能够使用纳米孔装置中的标准缓冲液表征的生物分子分析物特别有用。标准缓冲液可以包括本领域已知的任何纳米孔缓冲液以及第5.3.10节中描述的缓冲液。
与在标准缓冲液中进行的相同方法相比,本公开提供的方法还提供准确性增加的检测或表征。标准缓冲液可以包括本领域已知的任何纳米孔缓冲液以及第5.3.10节中提供的缓冲液。
通常,本公开的方法将使用来自靶分子或已被修饰以增强检测(例如,探针、标记、染料或电压敏感部分)的靶分子的电流特征。电流特征可以包括一个功能或多于一个特征。电流特征的非限制性实例包括但不限于计算的事件停留时间、平均事件幅度、最大事件幅度、中值事件幅度、事件面积或本领域已知的其他。本领域技术人员将理解,特征还可以包括计算的事件停留时间、平均事件幅度、最大事件幅度、中值事件幅度或事件面积的任何组合。在一些实施方案中,事件内还可以存在多个特征以增强分子类型之间的区分。在一些实施方案中,电流特征是电流测量值的集合。在一些实施例中,电流特征是在检测到的事件内鉴定的模式。
在一些实施方案中,用于检测或表征样品中生物分子的方法包括以下步骤:(a)使疑似包含生物分子的样品与本公开的任一种感测溶液接触,其中所述感测溶液接触纳米多孔膜,并且其中所述纳米多孔膜将装置的空间分隔成顺式体积和反式体积;(b)在纳米多孔膜的纳米孔上施加电压,从而诱导生物分子转位通过纳米多孔膜;和(c)在生物分子转位期间检测电流(如果存在);并且如果存在,则检测或表征生物分子,其中顺式体积和反式体积包含相同的感测溶液。
在一些实施方案中,用于检测或表征样品中生物分子的方法包括以下步骤:(a)使疑似包含生物分子的样品与本公开的任一种感测溶液接触,其中所述感测溶液接触纳米多孔膜,并且其中所述纳米多孔膜将空间分隔成顺式体积和反式体积;(b)在纳米多孔膜的纳米孔上施加电压,从而诱导生物分子转位通过纳米多孔膜;和(c)在生物分子转位期间检测电流(如果存在);并且如果存在,则检测或表征生物分子,其中顺式体积和反式体积包含彼此不同的感测溶液。
在一些实施方案中,用于检测或表征样品中生物分子的方法包括以下步骤:(a)使疑似包含生物分子的样品与本公开的任一种感测溶液接触,其中所述感测溶液接触纳米多孔膜,并且其中所述纳米多孔膜将空间分隔成顺式体积和反式体积;(b)在纳米多孔膜的纳米孔上施加电压,从而诱导生物分子转位通过纳米多孔膜;和(c)在生物分子转位期间检测电流(如果存在);并且如果存在,则检测或表征生物分子,其中顺式体积和反式体积包含彼此摩尔浓度不同的梯度感测溶液。
取决于应用,可以为应用定制所施加的电流类型。例如,如果期望通过碱基检测进行测序,则可以将隧穿电流与本文提供的方法一起使用。在某些实施方案中,可以使用能使用离子电流的测序方法。
本公开提供了用于确定样品中蛋白质或核酸的存在或不存在的方法。即,所述方法用于确定样品中是否存在特定的靶蛋白或靶核酸。这种方法可以应用于其中寻找独特的生物标志物或突变的诊断应用。该方法还可以应用于感染性疾病筛查,其中针对指示特定微生物、病毒或微生物或宿主感染标志物的蛋白质或基因的存在测试样品。
本公开提供用于测定蛋白质或核酸的量的方法。在一些实施方案中,所述量可以是遗传基因座的分子数或拷贝数,例如转基因插入(例如,遗传修饰的生物)、转位、插入或缺失。该方法可以应用于各种筛选应用,例如,筛选人的特定基因组突变、已知与疾病状态相关的某些染色体或遗传基因座的拷贝数、癌症活检中的体细胞突变或筛选插入植物或农业样品中的转基因。
在一些实施方案中,本文提供的方法可用于确定蛋白质或核酸的身份。可以通过测序或通过检测探针或本领域已知的改变已知改变电流的物理特性(例如,电压敏感部分)的任何其他分子修饰来确定身份。该方法对于各种筛选应用可以是有效的,例如筛选小的遗传突变如单核苷酸多态性、小的插入或缺失突变、CRISPR的精确突变、或特定蛋白质结合结构域的表达。
本公开提供用于检测和表征蛋白质或核酸的修饰的方法。可以与本公开的方法一起使用的修饰的实例包括但不限于甲基化、乙酰化、磷酸化等。所述方法可用于确定特定蛋白质是否在样品中通过在某些目标残基处的磷酸化状态、在某些基因座处的染色质状态、甲基化、乙酰化、抑癌基因或癌基因的磷酸化状态而被激活。
本公开提供确定蛋白质或核酸的结构的方法。可以与本公开一起使用的结构的实例包括但不限于发夹形、β折叠、α螺旋或由DNA折纸技术制成的结构(例如,DNA结等),
本公开提供用于测定蛋白质或核酸的序列的方法。在一些实施方案中,所述方法可以测定存在于多核苷酸或多肽中的核酸碱基或氨基酸的序列。在一些实施方案中,所述方法可以通过碱基对(例如,C-G、A-T等)测定序列。在一些实施方案中,所述方法可以通过鉴定使用包括使用本文提供的探针的方法的片段来测定序列。
本公开提供用于确定以下两个或更多个特征的方法:生物分子的存在或不存在、数量、同一性、修饰、结构、浓度或序列。
本公开提供的方法也可以全部或部分自动化。
5.4.1.样品
本公开提供用于检测或表征样品中的生物分子的方法。如本领域技术人员将理解,取决于样品的来源或样品的加工或处理,样品可基本上包含一种生物分子。但是,在某些应用中,样品将包含若干种不同的生物分子类型。
生物分子本身或被表征的生物分子的方面可能对纳米孔检测高度敏感,并且可能不需要广泛的样品加工或处理,例如扩增、分离和衍生化等。但是,对于某些生物分子,样品加工或处理将是需要的,例如可以与本公开的方法、系统和试剂盒一起使用的扩增(例如PCR扩增或通过质粒复制)、分离和衍生化或检测探针和标记。
可与本公开的方法一起使用的样品的实例包括但不限于生物样品、临床样品、环境样品(例如,空气、水、农业或土壤)或农业样品(例如植物、藻类或真菌)。
与本文提供的方法一起使用的样品可以来自受试者。受试者可以是动物、植物或人。
动物可以是鸟,例如鸡。动物可以是哺乳动物。哺乳动物可以是例如狗、猫、马、牛、小鼠、大鼠或猪。哺乳动物可以是灵长类动物,例如人、黑猩猩、猩猩或大猩猩。
人可以是男性或女性。在一些实施方案中,样品可以来自人胚胎或人胎儿。在一些实施方案中,样品可以来自人或动物的特定器官类型,例如:心脏、皮肤、肝、肺、乳房、胃、胰腺、膀胱、结肠、肠、胆囊或脑。
样品可来自患有特定疾病、失调或病症,或疑似患有(或处于患病风险)特定疾病、失调或病症的受试者。疾病、失调或病症的实例包括但不限于遗传病、增殖性疾病如癌症、衰老病症或感染性疾病。
样品可获自包含核酸或蛋白质或肽或其片段(例如无细胞DNA)的各种来源。可以与本公开一起使用的样品来源的实例包括但不限于:水状液、玻璃状液、胆汁、全血、血清、血浆、母乳、脑脊液、耳垢、内淋巴、外淋巴、胃液、粘液、腹膜液、唾液、皮脂、精液、汗液、汗水、泪液、阴道分泌物、呕吐物、粪便或尿液。
样品还可以获自细胞系(例如原代或培养的)、基因组DNA、无细胞血浆、福尔马林固定的石蜡包埋的(FFPE)样品或速冻组织或血液样品。
5.4.2.生物分子
术语“生物分子”包括但不限于核酸(例如,DNA或RNA)、蛋白质、肽、抗体、小分子、适配子、分析物或药物试剂。生物分子还可包含一种或多种修饰。生物分子可以来自天然来源。生物分子可以合成制备。
关于样品,取决于样品中生物分子的丰度,方法可以包括生物分子的处理或加工以便在检测之前增加生物分子的丰度。在一些实施方案中,生物分子是基本上纯化的。可以通过使用本领域已知的粗纯化方法或可商购的纯化试剂盒进行生物分子的大量纯化。
可通过使用分子探针、标记(例如,光学标记、唯一标识符或条形码)、染料或本领域已知的任何其他检测分子来直接检测生物分子(没有其他分子)或间接检测生物分子。
本公开还提供了用于检测或表征核酸的方法。核酸可以是线粒体DNA、基因组DNA、mRNA、siRNA、miRNA、shRNA、cRNA、单链DNA、双链DNA、单链RNA、双链RNA、tRNA、rRNA或cDNA。可以将核酸片段化。在一些实施方案中,样品可以包含杂合多核苷酸,如RNA/DNA杂合体、PNA/DNA杂合体或RNA/PNA杂合体。在一些实施方案中,多核苷酸与蛋白质(例如抗体或蛋白结合分子)结合。
所述方法可用于检测或表征具有各种大小的蛋白质。核酸的长度可以不超过4kb、3kb、2kb、1kb、500bp、400bp、300bp、200bp或100bp。在一些实施方案中,核酸的长度差异小于约1kb、500bp、400bp、300bp、200bp、100bp、50bp、30bp、20bp或10bp。
本公开还提供用于检测蛋白质的方法。通过本公开的方法检测的蛋白质可以是完整蛋白质、肽、小分子或药物如抗体、蛋白质模拟物等。
所述方法可以用于检测或表征具有从约10kDa到最高达500kDa的范围的各种大小的蛋白质。在一些实施方案中,所述蛋白质为至少100-200kDa、200-300kDa、300-400kDa或500-600kDa。
取决于通过纳米孔装置检测生物分子的敏感性,方法可包括修饰生物分子以增强检测。可以与本公开的方法一起使用的修饰的非限制性实例包括将生物分子连接至电压敏感部分。电压敏感部分可以是已知改变电流的物理特性的分子修饰。分子修饰的非限制性实例可包括染料、分子探针(通过氨基酸残基或核酸互补碱基配对的缀合或类似(例如PNA)连接)、珠、分子柄、条形码、唯一标识符或光学标签。
5.4.3.感测溶液
预期在第5.3节中,本公开提供的任何感测溶液组合物可以有效量与本公开提供的方法一起使用。如本文所讨论的,本领域技术人员将容易地认识到可以将额外试剂添加到感测缓冲液中。
在一些实施方案中,所述方法包括对称施加的第5.3节的感测溶液组合物,即,纳米孔装置的顺式和反式体积包括相同的感测溶液。在一些实施方案中,所述方法包括不对称施加的第5.3节的感测溶液组合物,即例如:纳米孔装置的顺式体积和反式体积包含不同的感测溶液;顺式体积包含感测溶液和反式体积包含标准缓冲液;顺式体积包含感测溶液和反式体积包含碳水化合物溶液,或者反之亦然。
预期本公开的组合物可以以有效量与本文提供的方法、装置、系统和试剂盒一起使用。在一些实施方案中,聚醚剂的有效量如第5.3.7节中所提供。
本文所述的任何聚醚剂可用于感测溶液中。在一些实施方案中,方法可以使用包含有效量的式(I)的聚醚的感测溶液:
其中:m为1-3;n为1-30;每个R
在一些实施方案中,方法可以包括包含有效量的式(Ia)-(IV)的聚醚的感测溶液。
5.4.4.不对称的与梯度的感测溶液
对于一些应用,使用不对称感测溶液来检测或表征靶分子将是有利的。在该方法中,纳米孔装置包括纳米多孔膜,其将内部空间分为顺式体积(例如,第一体积)和反式体积(例如,第二体积),以便可以将不同的感测溶液应用于装置,例如,至纳米多孔膜的相对侧。在一些实施方案中,分析物(例如生物分子)通过纳米多孔膜从顺式体积中的第一感测溶液转位到反式体积中的第二感测溶液。转位期间可以检测分析物。
在不对称感测溶液方法中,上诉装置包括顺式体积和反式体积,它们各自在顺式体积和反式体积中包含不同的组合物。例如,不对称感测溶液可以具有顺式体积中的感测溶液、碳水化合物溶液或标准缓冲液,以及反式体积中的感测溶液、碳水化合物溶液或标准缓冲液,只要它们不相同。
在一些实施方案中,上述装置包括包含本文所述的感测溶液的顺式体积和包含本领域已知的任何标准缓冲液的反式体积。在一些实施方案中,装置包括包含本文所述的感测溶液的顺式体积和包含本文所述的标准缓冲液的反式体积。在一些实施例中,装置包括包含本文所述的感测溶液的顺式体积和包含有效量的LiCl、KCl的反式体积。在一些实施方案中,装置包括包含本文所述的感测溶液的顺式体积和包含4.0M LiCl、10mM Tris HCl pH8.8、1mM EDTA的反式体积。
在一些实施方案中,装置包括包含本文所述的任一种感测溶液的顺式体积和包含碳水化合物溶液的反式体积。在一些实施方案中,装置包括包含碳水化合物溶液的顺式体积和包含本文所述的任一种感测溶液的反式体积。
预期在纳米孔装置中不对称使用的碳水化合物溶液可以增加一些生物分子的检测或表征的准确性。在一些实施方案中,装置包括包含任一种感测溶液的顺式体积和包含碳水化合物溶液的反式体积。
碳水化合物溶液可包含麦芽糖、甘油、山梨醇、葡萄糖或麦芽糖糊精。在一些实施方案中,碳水化合物溶液包含至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%.22%、23%、24%、25%、26%、27%、28%、29%或30%v/v。在优选的实施方案中,反式体积包含至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%.27%、28%、29%、或30%v/v的麦芽糖。
在一些实施方案中,装置包括包含PEG 200感测溶液的顺式体积和包含碳水化合物溶液的反式体积。在一些实施方案中,装置包括包含PEG 200感测溶液的顺式体积和包含麦芽糖碳水化合物溶液的反式体积。
在一些实施方案中,相对于靶生物分子表征样品的方法包括:提供疑似包含靶生物分子的样品;将所述样品装载到纳米孔装置的第一体积中,其中所述纳米孔装置包括将装置的内部空间分隔成第一体积和第二体积的层,其中所述层包含纳米孔;其中所述第一和第二体积通过所述纳米孔流体连通,并且其中所述第一体积或所述第二体积包含含有乙二醇的感测溶液;在所述纳米孔上施加电势以引起带电分子通过所述纳米孔从第一体积转位到第二体积;在所述带电分子转位通过所述纳米孔期间检测包含通过所述孔的电流的信号;和从所述信号测定所述样品相对于所述靶生物分子的特征。
在一些实施方案中,在第一体积和第二体积中均存在包含乙二醇的感测溶液。在一些实施方案中,乙二醇感测溶液以0.01%v/v或更大、0.02%v/v或更大、0.05%v/v或更大、0.1%v/v或更大、0.2%v/v或更大、0.5%v/v或更大、1%v/v或更大、2%v/v或更大、5%v/v或更大、10%v/v或更大、15%v/v或更大、20%v/v或更大或25%v/v或更大的浓度存在于所述第一体积或所述第二体积中。在一些实施方案中,所述乙二醇感测溶液以至少0.01M、0.05M、0.1M、0.2M、0.5M或1M的浓度存在于所述第一体积或所述第二体积中。
在一些实施方案中,在第一体积和第二体积中均存在包含CsCl或CaCl
在一些实施方案中,所述盐剂感测溶液呈梯度,其CsCl或CaCl
在一些实施方式中,CsCl或CaCl
在一些实施方案中,本文提供相对于靶标dsDNA表征样品的方法,所述方法包括:提供疑似包含长度为74bp-108bp的靶标dsDNA的样品;将样品加载到纳米孔装置的第一体积中,其中纳米孔装置包括将装置的内部空间分隔成第一体积和第二体积的层,其中所述层包含最小直径为27nm-73nm的纳米孔;其中第一体积和第二体积通过纳米孔流体连通,并且其中第一体积或第二体积包含包含1MCaCl
在一些实施方案中,本文提供相对于靶标dsDNA表征样品的方法,所述方法包括:提供疑似包含长度为58bp-108bp的靶标dsDNA的样品;将样品加载到纳米孔装置的第一体积中,其中纳米孔装置包括将装置的内部空间分隔成第一体积和第二体积的层,其中所述层包含最小直径为27nm-102nm的纳米孔;其中第一体积和第二体积通过纳米孔流体连通,并且其中第一体积或第二体积包含包含1M-3M CsCl的感测溶液;在纳米孔上施加电势以引起靶标dsDNA(如果存在的话)通过所述纳米孔从第一体积转位到第二体积;在靶标dsDNA通过纳米孔转位期间检测包含电流的信号;和从信号测定样品相对于靶标dsDNA的特征。
5.4.5.使用乙二醇感测溶液的方法
本公开提供使用以下在以下实施方案中概述的乙二醇感测溶液的各种额外的方法。本领域技术人员将理解,术语“缓冲液”可以与单词“感测溶液”互换使用。
实施方案1.相对于靶生物分子表征样品的方法,其包括:提供疑似包含靶生物分子的样品;将所述样品装载到纳米孔装置的第一体积中,其中所述纳米孔装置包括将装置的内部空间分隔成第一体积和第二体积的层,其中所述层包含纳米孔;其中所述第一和第二体积通过所述纳米孔流体连通,并且其中所述第一体积或所述第二体积包含含有乙二醇的感测溶液;在所述纳米孔上施加电势以引起带电分子通过所述纳米孔从第一体积转位到第二体积;在所述带电分子转位通过所述纳米孔期间检测包含通过所述孔的电流的信号;和从所述信号测定所述样品相对于所述靶生物分子的特征。
实施方案2.实施方案1的方法,其中所述乙二醇是聚乙二醇。
实施方案3.实施方案2的方法,其中所述聚乙二醇是三乙二醇、聚乙二醇200或聚乙二醇400。
实施方案4.实施方案1的方法,其中所述乙二醇包括以下结构:
其中n为1-10。
实施方案5.实施方案1的方法,其中所述纳米孔感测溶液包含盐。
实施方案6.实施方案5的方法,其中所述盐是NaCl、KCl或LiCl。
实施方式7.实施方式5的方法,其中所述盐以大于0.01M、大于0.02M、大于0.05M、大于0.1M、大于0.2M、大于0.5M、大于1M、大于2M或大于3M的浓度存在于所述感测溶液中。
实施方案8.实施方案1的方法,其中所述靶生物分子是多核苷酸。
实施方案9.实施方案8的方法,其中所述多核苷酸是dsDNA、ssDNA、RNA或RNA/DNA杂合体。
实施方案10.实施方案8的方法,其中所述多核苷酸的长度不超过2kb、1kb、500个碱基、400个碱基、300个碱基、200个碱基或100个碱基。
实施方案11.实施方案9的方法,其中所述靶标dsDNA的长度小于500bp。
实施方案12.实施方案9的方法,其中所述靶标dsDNA的长度为10bp-500bp。
实施方案13.实施方案1的方法,其中所述纳米孔的直径为10nm-150nm。
实施方案14.实施方案1的方法,其中所述纳米孔的特征在于最小直径大于4nm、5nm、6nm、7nm、8nm、9nm、10nm、15nm、20nm、25nm、30nm、35nm、40nm、45nm、50nm、55nm、60nm或65nm。
实施方案15.权利要求1的方法,其中所述纳米孔的特征在于最小直径小于70nm、75nm、80nm、85nm、90nm、95nm、100nm、105nm或110nm。
实施方案16.实施方案1的方法,其中所述纳米孔具有小于1000nm、小于500nm、小于200nm、小于100nm或小于50nm的最小直径。
实施方案17.实施方案1的方法,其中所述纳米孔的特征在于最小直径为65nm-100nm。
实施方案18.实施方案1的方法,其中所述纳米孔的特征在于最小直径为5nm-100nm。
实施方案19.实施方案8的方法,其中所述多核苷酸的长度不超过500个碱基,并且所述纳米孔的最小直径为10nm。
实施方案20.实施方案1的方法,其中所述表征包括定量所述靶生物分子。
实施方案21.实施方案9的方法,其中所述表征包括区分所述样品中dsDNA的长度。
实施方案30.实施方案21的方法,其中所述区分是在小于50bp、小于100bp、小于200bp、小于300bp、小于400bp或小于500bp的dsDNA长度差异之间。
实施方式31.实施方案1的方法,其中与在所述感测溶液中不存在所述聚乙二醇的情况下进行的相同方法的表征相比,所述表征的准确性提高。
实施方式32.实施方案1所述的方法,其中所述表征选自:存在或不存在、数量、同一性、修饰、结构、浓度或序列。
实施方案33.实施方案24的方法,其中通过将每单位时间的转位信号的数目与阈值比较来确定所述靶生物分子的存在或不存在,高于阈值则确定所述靶生物分子存在于所述样品中,低于阈值则确定所述靶生物分子不存在于所述样品中。
实施方案34.上述实施方案中任一项的方法,其中所述包含乙二醇的感测溶液同时存在于第一体积和第二体积中。
实施方案35.上述实施方案中任一项的方法,其中所述乙二醇以0.01%v/v或更大、0.02%v/v或更大、0.05%v/v或更大、0.1%v/v或更大、0.2%v/v或更大、0.5%v/v或更大、1%v/v或更大、2%v/v或更大、5%v/v或更大、10%v/v或更大、15%v/v或更大、20%v/v或更大或25%v/v或更大的浓度存在于所述第一体积或所述第二体积中。
实施方案36.实施方案1的方法,其中所述乙二醇以至少0.01M、0.05M、0.1M、0.2M、0.5M或1M的浓度存在于所述第一体积或所述第二体积中。
实施方案37.上述实施方案中任一项的方法,其中所述方法在所述纳米孔中产生所述靶生物分子的检测速率为至少1/min、至少2/min、至少3/min、至少4/min、至少5/min、至少10/min、至少15/min、至少20/min、至少25/min、至少30/min、至少40/min、至少50/min、至少60/min、至少70/min、至少80/min、至少90/min、至少100/min、至少150/min、至少200/min,at least 250/min、至少350/min、至少450/min、至少550/min、至少650/min、至少750/min、至少850/min、至少950/min、至少1150/min、至少1250/min、至少1350/min、至少1450/min、至少1550/min、至少1650/min或至少1750/min。
实施方案38.上述实施方案中任一项的方法,其中所述装置包括用于在所述纳米孔上施加电压并监测通过所述纳米孔从一个腔室到另一个腔室的电流的电极,其中所述电极连接到电源。
实施方案39.上述实施方案中任一项的方法,其中所述样品包含所述多核苷酸,并且其中施加所述电压在施加所述电势时驱动所述多核苷酸通过所述纳米孔从第一腔室到第二腔室,从而产生偏离明渠电信号的电信号。
实施方案40.上述实施方案中任一项的方法,其中所述第一和第二体积仅通过所述纳米孔流体连通。
5.4.6.使用CsCl或CaCl
本公开提供使用CsCl和CaCl
在一些实施方案中,本文提供相对于样品中的靶生物分子表征样品的方法,所述方法包括:提供疑似包含靶生物分子的样品;将样品加载到纳米孔装置的第一体积中,其中纳米孔装置包括将装置的内部空间分隔成第一体积和第二体积的层,其中所述层包含最小直径大于4nm的纳米孔;其中第一体积和第二体积通过纳米孔流体连通,并且其中第一体积或第二体积包含含有CsCl或CaCl
在一些实施方案中,感测溶液包含1M CsCl,并且其中纳米孔的最小直径为102nm或更小,并且其中多核苷酸为58bp或更大。在一些实施方案中,感测溶液包含1M CsCl,并且其中纳米孔的最小直径为27nm或更大,其中多核苷酸为108bp或更小。在一些实施方案中,感测溶液包含1M CaCl
本公开提供了使用CaCl或CaCl
实施方案1.相对于靶标dsDNA表征样品的方法,其包括:提供疑似包含长度为58bp-108bp的靶标dsDNA的样品;将所述样品装载到纳米孔装置的第一体积中,其中所述纳米孔装置包括将装置的内部空间分隔成第一体积和第二体积的层,其中所述层包含最小直径为27nm-102nm的纳米孔;其中所述第一和第二体积通过所述纳米孔流体连通,并且其中所述第一体积或所述第二体积包含含有1M-3M CsCl的感测溶液;在所述纳米孔上施加电势以引起靶标dsDNA(如果存在的话)通过所述纳米孔从第一体积转位到第二体积;在所述靶标dsDNA转位通过所述纳米孔期间检测包含通过所述孔的电流的信号;和从所述信号测定所述样品相对于所述靶标dsDNA的特征。
实施方案2.相对于靶标dsDNA表征样品的方法,其包括:提供疑似包含长度为74bp-108bp的靶标dsDNA的样品;将所述样品装载到纳米孔装置的第一体积中,其中所述纳米孔装置包括将装置的内部空间分隔成第一体积和第二体积的层,其中所述层包含最小直径为27nm-73nm的纳米孔;其中所述第一和第二体积通过所述纳米孔流体连通,并且其中所述第一体积或所述第二体积包含含有1MCaCl
实施方案3.实施方式1或实施方案2所述的方法,其中所述表征选自:存在或不存在、数量、同一性、浓度、修饰、结构或序列。
实施方案4.实施方案3的方法,其中通过将每单位时间的转位信号的数目与阈值比较来确定所述靶标dsDNA的存在或不存在,高于阈值则确定所述靶标dsDNA存在于所述样品中,低于阈值则确定所述靶标dsDNA不存在于所述样品中。
实施方案5.相对于样品中的靶生物分子表征样品的方法,其包括:提供疑似包含靶生物分子的样品;将所述样品装载到纳米孔装置的第一体积中,其中所述纳米孔装置包括将装置的内部空间分隔成第一体积和第二体积的层,其中所述层包含最小直径大于4nm的纳米孔;其中所述第一和第二体积通过所述纳米孔流体连通,并且其中所述第一体积或所述第二体积包含含有CsCl或CaCl
实施方案6.实施方案5的方法,其中所述靶生物分子是多核苷酸。
实施方案7.实施方案6的方法,其中所述多核苷酸是dsDNA、ssDNA、RNA或RNA/DNA杂合体。
实施方案8.实施方案6或实施方案7的方法,其中所述多核苷酸的长度不超过2kb、1kb、500个碱基、400个碱基、300个碱基、200个碱基或100个碱基。
实施方案9.上述实施方案中任一项的方法,其中所述纳米孔的特征在于最小直径大于4nm、5nm、6nm、7nm、8nm、9nm、10nm、15nm、20nm、25nm、30nm、35nm、40nm、45nm、50nm、55nm、60nm或65nm。
实施方案10.上述实施方案中任一项的方法,其中所述纳米孔的特征在于最小直径小于70nm、75nm、80nm、85nm、90nm、95nm、100nm、105nm或110nm。
实施方案11.上述实施方案中任一项的方法,其中所述纳米孔具有小于1000nm、小于500nm、小于200nm、小于100nm或小于50nm的最小直径。
实施方案12.上述实施方案中任一项的方法,其中所述纳米孔的特征在于最小直径为65nm-100nm。
实施方案13.上述实施方案中任一项的方法,其中所述纳米孔的特征在于最小直径为5nm-100nm。
实施方案14.上述实施方案中任一项的方法,其中所述多核苷酸的长度不超过500个碱基,并且所述纳米孔的最小直径为65nm。
实施方案15.上述实施方案中任一项的方法,其中所述包含CsCl或CaCl
实施方案16.上述实施方案中任一项的方法,其中所述CsCl或CaCl
实施方案17.实施方案15的方法,其中所述CsCl或所述CaCl
实施方案18.实施方案17的方法,其中所述盐梯度是所述CsCl或所述CaCl
实施方案19.实施方案17的方法,其中所述盐梯度是所述CsCl或所述CaCl
实施方案20.上述实施方案中任一项的方法,其中所述CsCl或CaCl
实施方案21.上述实施方案中任一项的方法,其中所述CsCl或CaCl
实施方案22.上述实施方案中任一项的方法,其中所述CsCl或CaCl
实施方案23.上述实施方案中任一项的方法,其中所述CsCl或CaCl
实施方案24.上述实施方案中任一项的方法,其中所述感测溶液包含1M CsCl,并且其中所述纳米孔的最小直径为102nm或更小,并且其中所述多核苷酸为58bp或更大。
实施方案25.上述实施方案中任一项的方法,其中所述感测溶液包含1M CsCl,并且其中所述纳米孔的最小直径为27nm或更大,并且其中所述多核苷酸为108bp或更小。
实施方案26.上述实施方案中任一项的方法,其中所述感测溶液包含1M CaCl
实施方案27.上述实施方案中任一项的方法,其中所述感测溶液包含1M CaCl
实施方案28.上述实施方案中任一项的方法,其中所述感测溶液包含1M CsCl,并且其中所述纳米孔的最小直径为27nm-102nm,并且其中所述多核苷酸为108bp-58bp。
实施方案29.上述实施方案中任一项的方法,其中所述感测溶液包含1M CsCl,并且其中所述纳米孔的最小直径为27nm-73nm,并且其中所述多核苷酸为58bp-74bp。
实施方案30.上述实施方案中任一项的方法,其中所述方法在所述纳米孔中产生所述靶生物分子的检测速率为至少1/min、至少2/min、至少3/min、至少4/min、至少5/min、至少10/min、至少15/min、至少20/min、至少25/min、至少30/min、至少40/min、至少50/min、至少60/min、至少70/min、至少80/min、至少90/min、至少100/min。
实施方案31.上述实施方案中任一项的方法,其中所述装置包括用于在所述纳米孔上施加电压并监测通过所述纳米孔从一个腔室到另一个腔室的电流的电极,其中所述电极连接到电源。
实施方案32.上述实施方案中任一项的方法,其中所述样品包含所述多核苷酸,并且其中施加所述电压在施加所述电势时驱动所述多核苷酸通过所述纳米孔从第一腔室到第二腔室,从而产生偏离明渠电信号的电信号。
实施方案33.上述实施方案中任一项的方法,其中所述第一和第二体积仅通过所述纳米孔流体连通。
5.4.7.装置
任何纳米孔装置可与本公开提供的组合物、方法、系统或试剂盒一起使用。可以与本公开一起使用的装置的实例包括但不限于固态纳米孔装置、生物纳米孔装置或混合纳米孔装置。
本公开的方法可以使用本领域已知的任何装置或膜。在一些实施方案中,本公开的方法可以使用在5.5节中描述的膜。
在阅读了本公开之后,技术人员将选择合适的纳米孔装置和膜。在一些应用中,装置可具有大于约20nm、约25nm或约30nm的孔径尺寸。在其他应用中,装置可具有大于约60nm、约70nm、约80nm、约90nm、约100nm、约110nm或约120nm的孔径尺寸。
5.4.8.探针和电压敏感部分
取决于应用,所述方法可包括使用分子探针。在美国申请第15/513,472号中描述了使用探针以增强使用纳米孔装置的检测,该申请通过引用并入本文。
取决于分子和探针类型,可能期望在分析之前附加或连接探针。在分析之前,探针与分子的连接可以在外部(在装置外部)或在纳米孔设备中,但在分析之前。
本领域技术人员将理解,可以使用本领域众所周知的各种方法将探针连接至分子,包括但不限于杂交、缀合、链接化学以及通过各种化学键(例如,共价键、氢键等)。
探针能够特异性结合待检测或表征的分子上的位点。探针的结合位点通常可以是待检测或表征的序列、修饰或结构。
可用于本公开的探针分子的实例包括但不限于单链DNA、PNA(蛋白质核酸)、bis-PNA、γ-PNA、增加PNA的大小或电荷的PNA-缀合物。探针分子的其他实例选自天然或重组蛋白、蛋白融合、蛋白的DNA结合结构域、肽、核酸、寡核苷酸、TALEN、CRISPR、PNA(蛋白质核酸)、bis-PNA、γ-PNA、增加尺寸、电荷、荧光或功能性的PNA-缀合物(例如寡核苷酸标记的),或任何其他PNA衍生的聚合物、以及化合物。
在一些方面,探针包含γ-PNA。γ-PNA在肽样主链上,特别是在N-(2-氨基乙基)甘氨酸主链的γ位上具有简单修饰,从而产生手性中心(Rapireddy S.,et al.,2007.J.Am.Chem.Soc.,129:15596-600;He G,et al.,2009,J.Am.Chem.Soc.,131:12088-90;Chema V,et al.,2008,Chembiochem 9:2388-91;Dragulescu-Andrasi,A.,et al.,2006,J.Am.Chem.Soc.,128:10258-10267)。与bis-PNA不同,γ-PNA可以结合dsDNA而不受序列限制,留下两条DNA链之一可用于进一步杂交。
在一些方面,探针的功能是通过补体碱基配对与具有靶序列的多核苷酸杂交以形成稳定的复合物。PNA分子可另外结合其他分子以形成具有足够大横截面表面积的复合物,从而在信号幅度上产生超过背景信号的可检测的变化或对比,其是对应于未结合探针的多核苷酸片段的中值或平均信号幅度。
多核苷酸靶序列与PNA分子的结合稳定性是重要的,以便使其被纳米孔装置检测到。在携带靶标的多核苷酸通过纳米孔转位的整个过程中,必须保持结合稳定性。如果稳定性弱或不稳定,则探针可与靶多核苷酸分离,并且当携带靶标的多核苷酸通过纳米孔时将不会被检测到。
在特定的实施方案中,探针的实例是PNA-缀合物,其中PNA部分特异性识别核苷酸序列,并且缀合物部分增加不同PNA-缀合物之间的大小/形状/电荷差异。
可以将不同的反应性部分掺入配体中以提供标记可以与其缀合的化学处理。反应性部分的实例包括但不限于伯胺、羧酸、酮、酰胺、醛、硼酸、腙、硫醇、马来酰亚胺、醇和羟基以及生物素。
在一些实施方案中,可以修饰PNA配体以增加配体电荷,并因此促进通过纳米孔检测。具体而言,通过在PNA分子上的碱基与靶DNA中的碱基之间的互补碱基配对和Hoogsteen碱基配对结合DNA序列的该配体将半胱氨酸残基掺入主链中,这提供提供游离硫醇化学标记处理。在此,将半胱氨酸通过马来酰亚胺接头标记至2-氨基乙基甲硫基磺酸盐/酯(MTSEA)肽,这提供检测配体是否结合其靶序列的手段,因为标记/肽提供配体电荷增加。与未标记的PNA相比,这种较大的电荷导致通过孔的电流变化更大。
在一些方面,为了增加配体结合的多核苷酸与样品中存在的其他背景分子之间的变化对比,可以对假肽主链进行修饰以改变配体(例如,PNA)的整体大小以增加对比。
另外,小颗粒、分子、蛋白质、肽或聚合物(例如PEG)可与假肽主链缀合,以增强配体和携带靶标的多核苷酸复合物的体积或横截面表面积。增强的体积用于改进信号幅度对比,以便可以容易地检测到由体积增大引起的任何差分信号。可与假肽主链缀合的小颗粒、分子、蛋白质或肽的实例包括但不限于α螺旋形成肽、纳米尺寸的金颗粒或棒(例如3nm)、量子点、聚乙二醇(PEG)。分子缀合的方法在本领域是众所周知的,例如在美国专利号5,180,816、6,423,685、6,706,252、6,884,780和7,022,673,其以其整体通过引用合并于此。
以上实施方案描述了通过半胱氨酸残基进行PEG标记,但是也可以使用其他残基。例如,赖氨酸残基容易与半胱氨酸残基互换,从而能够使用NHS-酯和游离胺进行链接化学。同样,PEG可以容易地与双功能接头和PNA之间的其他增加体积的成分(如Dendron、珠或棒)互换,或直接耦合Dendron。本领域技术人员将认识到该系统的灵活性,因为可以改变该氨基酸并改变该特定氨基酸(例如丝氨酸反应性异氰酸酯)的链接化学。下表列出可用于该反应的链接化学的一些实例。
表1:链接化学
在一些实施方案中,已经被修饰以增加探针大小的PNA探针包含表位、包含ssDNA寡聚体、包含荧光团、额外的电荷或额外的大小,以促进检测或检测两个紧密接近的探针。
可以将不同的反应性部分掺入探针中以提供标记可以与其缀合的化学处理。反应性部分的实例包括但不限于伯胺、羧酸、酮、酰胺、醛、硼酸、腙、硫醇、马来酰亚胺、醇和羟基以及生物素。
用于掺入化学处理的常用方法是将特定氨基酸包括在探针的主链中。实例包括但不限于半胱氨酸(提供硫醇盐)、赖氨酸(提供游离胺)、苏氨酸(提供羟基)、谷氨酸和天冬氨酸(提供羧酸)。
如本领域技术人员在阅读本公开时将理解,可以将不同类型的标记物添加至探针或部分以进一步辅助或增强对靶生物分子的检测。
在一些实施方案中,将该标记添加至探针。标记可以是分子条形码、反应性部分、唯一标识符、珠等。
在一些实施方案中,添加至探针的标记是反应性部分。反应部分包括以下标记之一:增加探针(例如生物素/链霉亲和素、肽、核酸)的大小,改变探针的电荷,例如带电的肽(6×HIS)或蛋白质(例如蝎毒素)或小分子或肽(例如MTSET),改变或向探针添加荧光(例如常见的荧光团、FITC、若丹明、Cy3、Cy5等)或提供表位或相互作用位点以结合第三种分子(例如,用于结合抗体的肽)。
5.4.9.增加的准确性
本公开的方法通常提供检测或表征样品中的生物分子的增加的准确性。取决于应用,可以通过下文详细描述的不同方式来实现增加的准确性。
在一些实施方案中,检测或表征的增加的准确性可包括检测否则在标准(例如常规)纳米孔缓冲液中将无法检测到的分子。
在一些应用中,检测或表征生物分子的增加的准确性可以包括检测通过标准缓冲液中的孔的分子的大量事件。经过合理的时间量后,大量事件可以是约100、200、300、400、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900或2000个事件。
合理的时间量将取决于样品中背景分子的水平以及施加的电压。例如,如果已知核酸、蛋白质或分析物在样品中是罕见的,例如来自血液样品中的干细胞的生物标志物,则与针对干细胞而言基本上纯化的样品相比,合理的时间量将更长。在一些实施方案中,合理的时间量将是约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30分钟。在一些实施方案中,合理的时间量将是约1、2、3、4、5、6、7、8、9或10分钟。
在一些应用中,增加的准确性可以是测定否则在标准纳米孔缓冲液中将无法检测到的生物分子的一个或多个特征(例如,长度、大小、结构、化学修饰、浓度等)。
在一些应用中,增加的准确性可以是分辨具有相似长度(例如,以碱基对(bp)或氨基酸(AA)表示)的样品中两个或更多个生物分子的长度差异。在一些实施方案中,增加的准确性可以是区分样品中生物分子的不同长度或大小。在一些实施方案中,区分小于50bp、100bp、150bp、200bp、250bp、300bp、350bp、400bp、450bp或500bp的长度差异。在一些实施方案中,区分小于10、20、30、40、50、60、70、80、90、100、150或200个氨基酸的长度差异。
在一些实施方案中,增加的准确性可以是区分样品中生物分子的不同大小。在一些实施方案中,不同大小之间的区分可以是小于10、20、30、40、50、60、70、80、90或100kDa大小的差异。在一些实施方案中,在不同大小之间的区分可以大于10、20、30、40、50、60、70、80、90或100kDa。
在一些应用中,增加的准确性可以分辨具有相似结构、构象或基序的样品中两个或更多个生物分子的结构、构象或基序的差异。
在一些应用中,增加的准确性可以分辨具有相似修饰(例如电荷和/或大小)的样品中两个或更多个生物分子的化学修饰差异。
在一些应用中,增加的准确性可以分辨蛋白质或核酸上修饰的存在或不存在。生物分子上的修饰的实例包括但不限于:甲基化、磷酸化、乙酰化、以及本领域已知在蛋白质或核酸上的所有其他修饰。
用于比较的标准缓冲液可以是本领域已知的任何纳米孔运行缓冲液或感测缓冲液。标准纳米孔缓冲液的实例包括但不限于包含二价LiCl、KCl或NaCl的缓冲液或其单价缓冲液。
在一些实施方案中,缓冲液包含有效量的LiCl、KCl或NaCl或其单价缓冲液。“有效量”的标准缓冲液是指允许生物分子以合理的速率通过孔转位,但不会导致具有相似物理特性的两种或更多种生物分子的检测、分辨或表征增加的标准缓冲液。
在一些实施方案中,标准缓冲液包含LiCl、KCl、NaCl或其单价离子,其摩尔浓度可以小于0.5M、1M、2M、3M、4M或5M。在一些实施方案中,标准缓冲液是1M KCL、1M LiCl或4.0MLiCl、10mM Tris HCl pH 8.8、1mM EDTA。
在一些实施方案中,标准缓冲液不包含聚醚剂(例如如本文所描述)。在一些实施方案中,缓冲液不包含有效量的式(II)-(IV)的聚醚或其实施方案。
在一些实施方案中,标准缓冲液可以进一步包含一种或多种缓冲化学品或试剂。标准缓冲液中使用的缓冲化学品或试剂可以包括但不限于Tris、Tris-HCL、硼酸盐、CHES、Bis-tris丙烷、CAPS磷酸钾缓冲液、HEPES或本领域已知的其他物质。
在一些实施方案中,标准缓冲液可以进一步包含螯合剂。可以在标准缓冲液中使用的螯合剂的非限制性实例包括但不限于EDTA、EGTA等。
标准缓冲液可以进一步包含已知包含在标准纳米孔缓冲液中的任何其他试剂。
5.5.纳米孔装置
本公开提供纳米孔装置,其包含有效量的如第5.3节中所提供的感测溶液和无孔膜。
本领域已知的任何无孔膜可以与本公开的装置一起使用。无孔膜的非限制性实例包括固态膜、生物膜或混合膜。可以与本公开的装置一起使用的膜基质的其他实例在第5.5节中描述。与本公开的装置一起使用的膜可包括任何尺寸的孔径,只要它被设置为允许靶分子(例如,待检测或表征、修饰或未修饰的分子)转位通过膜。
5.5.1.装置
纳米孔装置可包括至少一个在将装置的内部空间分隔成两个体积的结构中形成开口的孔,以及至少一个被设置为鉴别物体(例如,通过检测指示物体的参数的变化)通过孔的传感器。用于本公开的装置可以具有任何结构的孔(例如,圆形、漏斗形等)。用于本公开的装置可以具有单个孔、双重孔,或者它可以具有若干个孔,例如孔的阵列。
用于本文描述的方法的纳米孔装置还公开于PCT公开WO/2013/012881中,其通过引用整体并入本文。
纳米孔装置通常包含分隔两个体积或腔室的膜,其中膜具有通过该膜的纳米孔,该膜允许两个体积之间的流体连通。无孔膜可以由生物基质(例如脂质膜)或非生物基质(例如固体基质)或本领域已知的任何其他基质制成。在一些实施方案中,纳米孔装置可以是固态纳米孔装置、生物纳米孔装置或混合纳米孔装置。
当所述两个体积包含电解质如盐时,电流可通过例如经由孔的任一侧上的电极在孔上施加电势而流过孔。使用低噪声跨阻放大器,纳米孔装置监测通过分隔两个腔室或两个体积的单个孔的离子电流。
在膜上施加电压,产生通过纳米孔的电流(例如,离子电流),将其过滤、采样并记录以进行分析。当电压捕获单个分子(例如DNA、RNA或蛋白质)时,它穿过孔并暂时移动电流,产生单个分子“事件”。使用例如在通过引用并入本文的美国专利申请公布号2016/0266089“具有纳米孔的靶标检测”中描述的多种技术,可以通过分析记录的事件的分布从背景分子群体中检测和定量特定靶标分子的存在。
本文还提供了一种纳米孔装置,其包括将装置的内部空间分隔成第一体积和第二体积的层,其中所述层包括纳米孔;其中所述第一和第二体积通过所述纳米孔流体连通,并且其中所述第一体积或所述第二体积包含含有乙二醇的缓冲液。在一些实施方案中,系统进一步包括在所述第一体积中的第一电极和在所述第二体积中的第二电极,其中所述第一和第二电极被设置为在所述纳米孔上施加电势。在一些实施方案中,系统进一步包括在所述第一体积或所述第二体积中的靶生物分子,其中所述电势引起所述靶生物分子转位通过所述纳米孔。
5.5.2.感测溶液
预期可以将本公开的任何装置与第5.3节中提供的任何组合物一起使用。
在一些实施方案中,本公开的纳米孔装置包含有效量的如第5.3节所述的感测溶液和纳米多孔膜。装置的感测溶液可以不对称应用,其中顺式体积和反式体积具有不同的感测溶液。
取决于所检测的生物分子的特征,本领域的技术人员在阅读本公开后将知晓哪种装置和感测溶液将最适合该应用。有效量是与标准缓冲液相比能够增强对一种或多种待检测生物分子特征的检测的量。
在一些实施方案中,感测溶液中聚醚剂的有效量(例如,如本文所述)为:约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、或约30%v/v。
在一些实施方案中,感测溶液中聚醚剂的有效量(例如,如本文所述)为:约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、或约30%重量。
在一些实施方案中,感测溶液中聚醚剂的有效量为聚醚剂重量的30%或更少(例如,如本文所述)。
在一些实施方案中,一种方法可以包括包含有效量的式(I)-(IV)的聚醚的感测溶液。在一些实施方案中,装置包括在第5.4.4节中描述的不对称感测溶液。
5.5.3.固态膜
本公开可以与固态膜一起使用。固态膜是通过使用本领域已知的各种固体材料,例如聚合物膜、氧化铝、嵌段共聚物膜等,通过在固态基质中钻孔或蚀刻开口而工程化的膜。
取决于使用本文提供的方法检测的靶标或生物分子,技术人员将选择合适的固体基质。可以在本公开的固态纳米孔装置中使用的固体基质的实例包括但不限于基于硅的膜,包括单氮化硅(SiN)、氮化二硅(Si2 N)、四氮化三硅(silicon sesquinitride)(Si3N4)和二氧化硅(SiO2)。
在一些实施方案中,固体基质可以是氧化铝(Al
在一些实施方案中,固体基质可以是石墨烯。在一些实施方案中,可以通过用TiO
在一些实施方案中,固体基质可以是氮化硼(BN)。在一些实施方案中,固体基质可以是二氧化铪(HfO
在一些实施方案中,可以改变或修饰纳米孔壁的表面性质以增强检测。在一些实施方案中,通过有机硅烷分子的共价结合、氧化铝的原子层沉积(ALD)或具有与纳米孔壁表面相反的电荷的分子的静电吸附来修饰纳米孔壁,所述分子可以增强检测或降低噪声或其组合。
5.5.4.生物膜
本公开的方法或装置可包括生物膜。生物纳米孔是提供由脂质膜中的蛋白质孔形成的纳米级开口的生物基质。可以通过本领域已知的标准技术未修饰或工程化生物基质以进一步增强检测。
因为生物纳米孔提供固定的和原子精确的几何形状,因此它们对于特定的应用可以更有利,固态纳米孔的直径范围取决于用于形成纳米孔的制造技术。
能够形成纳米孔(例如,漏斗形、通道形或瓶颈形)的任何生物和合成蛋白都可以与本公开的方法、系统或试剂盒一起使用。在一些应用中,脂质双层中的合成DNA折纸孔可用于本公开。DNA工程技术提供的DNA折纸的灵活性允许技术人员设计具有针对特定应用定制的新结构和特性的孔。
如本领域技术人员将理解,可以使用方法如定点诱变或掺入特定适配子来进一步工程化生物纳米孔,以使孔适应特定的感测应用。位点特异性诱变允许通过使用特定的寡核苷酸序列产生突变体,所述特定的寡核苷酸序列编码包含所需突变的DNA序列以及足够数量的相邻核苷酸,以提供足够大小的引物序列并进行进一步修饰。
在一些应用中,通过位点特异性诱变的突变可用于改进、改变、减少、修饰或以其他方式改变多核苷酸本身的性质,和/或改变所编码的多肽的性质、活性、组成、稳定性或一级序列。
在一些应用中,多核苷酸的诱变可以改变多肽的一种或多种物理性质。例如,位点诱变可用于去除带负电荷的氨基酸或向孔中添加带正电荷的残基,以更好促进分析物的转位。在其他应用中,可以使用位点诱变将氨基酸替换为非天然氨基酸。
取决于待检测的靶分子,技术人员将为所需的应用选择合适的膜。
在一些实施方案中,生物膜包含耻垢分枝杆菌孔蛋白A(Mycobacteriumsmegmatis porin A,MspA)纳米孔。在一些实施方案中,生物膜包含耻垢分枝杆菌孔蛋白A(MspA)纳米孔。在一些实施方案中,耻垢分枝杆菌孔蛋白A(MspA)包含一个或多个突变。在一些实施方案中,耻垢分枝杆菌孔蛋白A(MspA)包含一个或多个突变和用于增加检测的进一步修饰,例如探针等。
在一些实施方案中,生物膜包含葡萄球菌α-溶血素纳米孔。在一些实施方案中,α-溶血素包含一种或多种突变。在一些实施方案中,α-溶血素纳米孔包含一个或多个突变和用于增加检测的进一步修饰,例如探针等。
在一些实施方案中,生物膜包含气溶素(AeL),其是七聚体纳米孔,其在细胞外入口处具有狭窄的瓶颈形结构以及直径为约1nm的小细胞外口。
在一些实施方案中,生物膜包含基于噬菌体phi29马达的纳米孔。由于phi29马达的尺寸较大,因此纳米孔对于蛋白质检测应用特别有用。在一些实施方案中,phi29马达纳米孔包含一个或多个突变。在一些实施方案中,phi29马达纳米孔包含一个或多个突变和用于增加检测的进一步修饰,例如探针等。
在一些实施方案中,生物膜包含来自伤寒沙门氏菌(Salmonella typhi)纳米孔的溶细胞素A(ClyA)。在一些实施方案中,ClyA纳米孔包含一个或多个突变。在一些实施方案中,ClyA纳米孔包含一个或多个突变和用于增加检测的进一步修饰,例如探针等。
在一些实施方案中,生物膜包含外膜蛋白G(OmpG)纳米孔。在一些实施方案中,OmpG纳米孔包含一个或多个突变。在一些实施方案中,OmpG纳米孔包含一个或多个突变和用于增加检测的进一步修饰。
5.5.5.混合膜
本公开的方法或装置可包括混合膜。本公开还提供了具有混合纳米孔装置的组合物、方法、系统、试剂盒,混合纳米孔装置包含由生物基质和固态基质制成的孔,从而形成混合孔。
在一些实施方案中,混合纳米孔装置可以是如本文提供和本领域已知的固体基质的纳米孔,其涂覆有脂质双层。在一些实施方案中,混合纳米孔可包含仿生核孔复合物。在一些实施方案中,混合纳米孔装置可包括玻璃移液管,其具有尖端开口处捕获的离子通道。
在一些实施方案中,混合纳米孔包含包埋入脂质双层或活细胞膜内的碳纳米管(CNT)。在一些实施方案中,混合纳米孔在SiNx孔内包含α-HL孔。在一些实施方案中,混合纳米孔在SiNx孔内包含3D DNA折纸结构。
5.5.6.孔的制备
预期固态孔、生物孔或混合孔可以与本公开的组合物、方法、系统和试剂盒一起使用。取决于在阅读本公开时待检测的生物分子,技术人员将选择待使用的合适的孔。
术语“固态”在本文中通常是指非生物材料。可以以本领域技术人员已知的几种方式通过膜来制备孔。例如,孔可以是插入脂质双层膜中的蛋白质通道,或者可以通过在固态基质如二氧化硅、氮化硅、石墨烯或这些或其他材料的组合形成的层上钻孔、蚀刻或以其他方式形成孔来工程化,以形成带孔膜。一方面,这些材料包括介电材料,例如但不限于硅、氮化硅、二氧化硅、石墨烯、碳纳米管、TiO
固态纳米孔可以各种尺寸制备,其中尺寸的特征在于孔的有效直径和长度。孔的长度由膜厚度隐含限定,该膜在形成纳米孔之前被制造为硅基基质中的独立式膜。通过各种制造步骤(包括沉积和蚀刻),可以将厚度制成1-100nm,或者大于100nm。孔形成过程控制孔的几何结构、形状和有效直径。
使用聚焦束(Ga
更具体地,可以用具有5-100nm厚的硅、氮化硅或二氧化硅窗口的透射电子显微镜(TEM)网格来制造带孔膜。可以使用绝缘体(例如SU-8、光致抗蚀剂、PECVD氧化物、ALD氧化物、ALD氧化铝或蒸发的金属材料(例如Ag、Au或Pt))将间隔器用于分隔膜,并在膜之间的腔室B的另外的水性部分中占据较小的体积。将固定器放置在由最大体积的腔室B部分组成的水浴中。通向膜密封的较大直径的通道(用于降低进入阻力)可通向腔室A和C。
聚焦的电子束或离子束可用于通过膜钻孔,使它们自然对齐。通过将正确的光束聚焦到每一层,也可以将孔雕刻(缩小)为较小的尺寸。考虑到给定方法可能的钻孔深度和膜厚度,任何单一的纳米孔钻孔方法也可用于在两个膜中钻孔对。将微孔预钻至规定深度,然后穿过其余膜的纳米孔也可以进一步改进膜厚度。
5.5.7.孔大小
如本领域技术人员将理解,膜中的孔大小必须足够大以容纳靶分子(用检测手段如探针或其他电压敏感部分修饰或未修饰)转位通过膜。这样,纳米孔装置中的一个或多个孔可以是纳米级或微米级的。
一方面,每个膜孔的大小均允许小分子或大分子或微生物通过。一方面,每个孔的直径为至少约1nm。或者,每个孔的直径为至少约2nm、3nm、4nm、5nm、6nm、7nm、8nm、9nm、10nm、11nm、12nm、13nm、14nm、15nm、16nm、17nm、18nm、19nm、20nm、25nm、30nm、35nm、40nm、45nm、50nm、60nm、70nm、80nm、90nm或100nm。
一方面,膜孔的直径不大于约200nm。或者,孔的直径不大于约195nm、190nm、185nm、180nm、175nm、170nm、165nm、160nm、155nm、150nm、145nm、140nm、135nm、130nm、125nm、120nm、115nm、110nm、105nm、100nm、95nm、90nm、85nm、80nm、75nm、70nm、65nm、60nm、55nm、50nm、45nm、40nm、35nm、30nm、25nm、20nm、15nm或10nm。
一方面,膜孔的直径为约10nm-约200nm、或替代地约10nm-约180nm、或约10nm-约170nm、或约10nm-约160nm、或约10nm-约150nm、或约10nm-约140nm或约15nm-约50nm。
在一些方面,孔的长度或深度足够大以形成连接两个否则分开的体积的通道。在一些这样的方面,每个孔的深度大于20nm、30nm、40nm、50nm、60nm、70nm、80nm、90nm、100nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm或900nm。在一些方面,每个孔的深度不大于2000nm或1000nm。在一些方面,孔的深度为约30nm。在一些方面,孔的深度为10–100nm。
在一些应用中,装置可以具有孔径尺寸大于约20nm、约25nm或约30nm的膜。在其他应用中,装置可以具有大于约60nm、约70nm、约80nm、约90nm、约100nm、约110nm或约120nm的孔径尺寸。
在一些方面,膜孔具有基本上圆形的形状。如本文所使用的,“基本上圆形”是指呈圆柱体形式的至少约80%或90%的形状。在一些实施方案中,孔的形状为正方形、矩形、三角形、椭圆形或六边形。
在一方面,膜孔的深度为约1nm-约10,000nm,或替代地约2nm-约9,000nm,或约3nm-约8,000nm等。
通过使用更简单的工艺技术和更廉价的在半导体铸造厂中更广泛普及的图案化设备,可以更廉价地以高体积制造大得多的孔(例如,直径为65nm或更大)。重要的是,此类工具和工艺技术可以在高通量晶圆级步骤中形成孔。例如,可以使用的一种制造技术是图案化技术,其将氟化氩(ArF)光学光刻(193nm波长光源)与等离子蚀刻或沉积技术相结合。根据定义,这种工艺技术可以制造65和90nm的特征尺寸,包括独立膜结构中的纳米孔。因此,如果可以在感兴趣的纳米孔感测应用中采用较大的纳米孔径(例如65nm、90nm和更大),则可以明显更廉价并且以高体积制造固态纳米孔芯片。
5.5.8.传感器
在一些实施方案中,本公开的纳米孔装置可包括一个或多个传感器以进行靶生物分子的检测。
装置中使用的传感器可以主要涉及设置为通过测量与靶生物分子转位通过纳米孔相关的电流变化或电压变化来鉴别靶生物分子的传感器。然而,传感器可以包括适合于鉴别靶多核苷酸的任何传感器。例如,传感器可以设置为通过测量与聚合物相关的电流、电压、pH值、光学特征或停留时间来鉴别靶多核苷酸。在其他方面,传感器可以设置为鉴别靶多核苷酸的一种或多种单个组分或结合或附着于靶多核苷酸的一种或多种组分。传感器可以由设置为检测可测量参数的变化的任何部件形成,其中变化指示靶生物分子、靶生物分子的组分或结合或附着于靶生物分子的组分。
在一个优选的实施方案中,传感器包括一对电极,其置于孔的两侧以测量当生物分子或其他实体,特别是靶多核苷酸移动通过孔时穿过孔的离子电流。这在本文中称为电检测的一种。在某些方面,当穿过孔的靶多核苷酸片段结合至有效载荷分子时,穿过孔的离子电流可测量地变化。电流的这种变化可以以可预测的、可测量的方式变化,对应于例如存在的靶多核苷酸分子的存在、不存在和/或大小。
在优选的实施方案中,所述传感器包括施加电压并用于测量跨纳米孔隙的电流的电极。分子转位通过纳米孔隙提供了电阻抗(Z),其根据欧姆定律,V=IZ,影响通过纳米孔隙的电流,其中V是施加的电压,I是通过纳米孔隙的电流,和Z是阻抗。相反地,监测电导G=1/Z以通知和定量纳米孔隙事件。当分子在电场中(例如,在施加的电压下)转位通过纳米孔隙时的结果是,当进一步分析电流信号时,可能与穿过纳米孔隙的分子相关的电流特征。
当使用来自电流特征的停留时间测量时,基于通过感测设备所花费的时间长度,可以将组分的大小与特定组分相关联。
当小生物分子通过纳米孔时,其导致电流减少。可以通过感测实体通过使用交流电(AC)或直流电(DC)测量值来测量通过纳米孔的电流。
可通过使用位于膜的适当侧上的两个Ag/AgCl电极之间的AC或DC测量值来测量通过纳米孔的电流,所述膜分隔经由纳米孔通过膜流体连通的两个体积。全文使用包含电解质以携带电流的水性溶液(例如,KCl)。本文提供使用特定电解质以促进较大纳米孔(例如25nm或更大)中较小分子(例如长度小于500bp的多核苷酸)的检测的方法。
传感器可以设置为通过测量与带电聚合物或带电聚合物的一种或多种单个组分相关的电流、电压、pH、光学特征或停留时间来鉴别带电聚合物。在一些实施方案中,传感器包括一对电极,其置于孔的相对侧,以在分子或颗粒,特别是带电的聚合物(例如,多核苷酸)移动通过孔时,测量通过孔的离子电流。
在某些实施方案中,传感器测量聚合物或聚合物组分(或单元)的光学特征。这种测量的一个实例包括通过红外(或紫外)光谱法鉴别特定单元特有的吸收带。
当使用停留时间测量值时,它们将基于通过感测设备所花费的时间长度将单元的尺寸与特定单元相关联。
在一些实施方案中,传感器用与每个探针形成不同的非共价键的试剂功能化。在这方面,间隙可以较大并且仍然允许有效的测量。例如,5nm间隙可用于检测测量大约5nm的探针/靶标复合物。具有功能化传感器的隧道感测称为“识别隧道效应”。使用带有识别隧道的扫描隧道显微镜(STM),可以容易地鉴别与目标基序结合的探针。
因此,本技术的方法可以为一个或多个识别隧穿位点提供带电的多核苷酸(例如,DNA)递送速率控制,每个识别隧穿位点位于一个或两个纳米孔通道中或在孔之间,并且电压控制可以确保每个探针/靶标复合物在每个位点中保留足够长的时间以进行稳健的鉴定。
本公开的装置和方法中的传感器可以包括金、铂、石墨烯或碳或其他合适的材料。在特定方面,传感器包括由石墨烯制成的部件。石墨烯可以充当导体和绝缘体,因此穿过石墨烯并穿过纳米孔的隧穿电流可以对转位DNA进行测序。
在一些实施方案中,隧道间隙的宽度为约1nm-约20nm。一方面,间隙的宽度为至少约1nm,或替代地至少约1.5、2、2.5、3、3.5、4、4.5、5、6、7、8、9、10、12或15nm。另一方面,间隙的宽度不大于约20nm,或者替代地不大于约19、18、17、16、15、14、13、12、11、10、9、8、7、6,5、4、3或2nm。在一些方面,宽度为约1nm-约15nm、约1nm-约10nm、约2nm-约10nm、约2.5nm-约10nm或约2.5nm-约5nm。
在一些实施方案中,传感器是电传感器。在一些实施方案中,当探针具有标记以产生独特的荧光特征时,传感器检测荧光检测装置。出口处的辐射源可用于检测该特征。
在一些实施方案中,当通过测量电流变化或电压变化的传感器进行检测时,事件的深度应具有至少六个的信噪比(SNR),并且事件持续时间必须是低通滤波器上升时间的至少两倍以达到全深度。使用标准仪器的公开数据和模型表明,孔径必须远低于50nm以实现DNA检测。例如,通过将过滤器截止频率增加到例如30kHz,短至330bp的DNA可以击中全深度,但是将噪音提高到~25pA RMS意味着孔径必须为16nm或更小。通常,当使用标准的纳米孔仪器、缓冲液和装置时,在直径为65nm或更大的纳米孔中无法检测到500bp或更短的DNA。因此,在一些实施方案中,乙二醇感测溶液为在直径为10nm-150nm的纳米孔中的小分子例如500bp或更短的多核苷酸的纳米孔装置中的检测提供最显著的增强。
5.5.9.电极&转位
一方面,装置在腔室内具有连接到一个或多个电源的电极。在一些方面,电源可以是电压钳或膜片钳,其可以在孔上供应电压并测量通过孔的电流。
借助于孔处存在的电压,一个体积中的带电分子可以被孔上方的电场捕获并被拉过孔以进入另一体积中。电场的大小和强度、转位的速度以及运动的方向可以通过电压的大小和极性来控制。
一个实例涉及靶多核苷酸。第一步,将多核苷酸装载到顺式腔室中。由于其在生理条件下在约7.4的pH下带负电荷,可将多核苷酸拉入并移动通过其上施加电压的孔。
在一些实施方案中,装置包括电极,该电极用于在所述纳米孔上施加电压并用于监测通过所述纳米孔从一个腔室到另一个腔室的电流,其中所述电极连接到电源。在一些实施方案中,样品包含所述多核苷酸,并且其中施加所述电压在施加所述电势时驱动所述多核苷酸通过所述纳米孔从第一腔室到第二腔室,从而产生偏离明渠电信号的电信号。在一些实施方案中,第一和第二体积仅通过所述纳米孔流体连通。
在一些实施方案中,装置包括电极,该电极用于在所述纳米孔上施加电压并用于监测通过所述纳米孔从一个腔室到另一个腔室的电流,其中所述电极连接到电源。在一些实施方案中,第一和第二体积仅通过所述纳米孔流体连通。在一些实施方案中,第一电极和第二电极进一步设置为检测从所述靶生物分子通过所述纳米孔的所述通道产生的差分电信号。在一些实施方案中,差分信号是通过所述纳米孔的电流的变化。
在一些实施方案中,装置包括电极,该电极用于在所述纳米孔上施加电压并用于监测通过所述纳米孔从一个腔室到另一个腔室的电流,其中所述电极连接到电源。在一些实施方案中,样品包含多核苷酸,并且施加所述电压在施加所述电势时驱动所述多核苷酸通过所述纳米孔从第一腔室到第二腔室,从而产生偏离明渠电信号的电信号。在一些实施方案中,第一和第二体积仅通过所述纳米孔流体连通。
5.5.10.检测速率
取决于应用,可以增加方法、装置、系统和试剂盒的检测速率。
在一些实施方案中,所述方法在所述纳米孔中产生所述靶生物分子的检测速率为至少1/min、至少2/min、至少3/min、至少4/min、至少5/min、至少10/min、至少15/min、至少20/min、至少25/min、至少30/min、至少40/min、至少50/min、至少60/min、至少70/min、至少80/min、至少90/min、至少100/min、至少150/min、至少200/min或至少250/min。
在一些应用中,可以将本文提供的方法的捕获标准化,以比较大小或重量不同的两个分子的捕获速率。可以使用本领域已知的标准方法将速率标准化。如本文所用,标准化捕获速率由星号“*”表示。
在一些实施方案中,方法产生的标准化检测速率为至少1/nM*min、至少2/nM*min、至少3/nM*min、至少4/nM*min、至少5/nM*min、至少10/nM*min、至少15/nM*min、至少20/nM*min、至少25/nM*min、至少30/nM*min、至少40/nM*min、至少50/nM*min、至少60/nM*min、至少70/nM*min、至少80/nM*min、至少90/nM*min或至少100/nM*min。
5.6.应用
本文提供的组合物、装置、方法、系统和试剂盒可用于检测或表征生物分子。生物分子的表征可以包括测定引起可测量的电特征变化的分子的任何性质(被探针或电压敏感部分修饰或未修饰)。表征可以包括测定样品中分子的浓度。此类应用的实例包括但不限于诊断生物标志物测试、感染性疾病检测、遗传筛选(例如,植物中的遗传基因座/突变或GMO)以及药物或化学试剂筛选。
在一些实施方案中,计算机可读介质存储检测转位通过用于特定应用的检测或表征的纳米孔装置的代码。在一些实施方案中,计算机可读介质存储代码,所述代码检测转位通过纳米孔装置瞬态电流下降,并使用算法来鉴别与测定的基线电流相比具有显著标准偏差的事件。取决于应用,与测定的基线相比,显著的标准偏差可以包括1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个标准偏差。
5.6.1.多核苷酸
本公开提供多核苷酸的检测或表征。所述组合物、方法、系统和试剂盒可以应用于需要检测和分析样品中的生物分子的各种应用。在这种应用中,可以通过将每单位时间的转位信号的数目与阈值比较来确定所述靶生物分子的存在或不存在,高于阈值则确定所述靶生物分子存在于所述样品中,低于阈值则确定所述靶生物分子不存在于所述样品中。
本公开的创造性方面可以应用于任何遗传诊断。可以与本公开一起使用的遗传诊断元件的实例包括但不限于基因、SNP、miRNA、shRNA或CRISPR诱导的修饰。
本公开的方法可以应用于感染性疾病检测,其中使用本公开测定所检测或表征的多核苷酸来自微生物、微生物、病原体、病毒、朊病毒或细菌。
本公开的创造性方面可以应用于遗传筛选。遗传筛查可以应用于活检样本或研究样本。可与本公开一起使用的各种类型的遗传筛选元件的实例包括:SNP、插入、缺失、拷贝数(例如拷贝数变异)、转位、GMO含量或CRISPR诱导的修饰筛选。如技术人员将理解,小的遗传修饰(例如,诸如SNP)的检测可以进一步使用探针分子等以增强或辅助检测。对于研究样品,可以与本公开一起使用的各种类型的遗传筛选元件包括:序列的修饰、基因组中的位置、质粒上等,或者可以表征多核苷酸的数目。
本公开的创造性方面可以应用于癌症筛选。可以与本公开一起使用的癌症筛选的类型的实例包括:甲基化状态、癌基因激活状态、癌基因突变状态或肿瘤抑制基因的突变状态。
5.6.2.蛋白质
本公开提供对结合其他分子如多核苷酸、探针、珠或染料的蛋白质、肽、抗体或蛋白质的检测或表征。
本公开提供的组合物、装置、方法、系统和试剂盒可以应用于蛋白质,以用于诊断生物标志物测试、感染性疾病检测、遗传筛选以及药物或化学试剂筛选。
本公开的创造性方面可以应用于蛋白质诊断。可以与本公开一起使用的蛋白质生物标志物筛选包括:靶蛋白的检测和表征(存在或不存在、拷贝数、表达水平)或靶蛋白的修饰,以确定其在特定信号转导通路中的激活状态(例如在某些残基处需要的磷酸化或活化)。
本公开的创造性方面可以应用于感染性疾病检测,其中所检测或表征的蛋白质来自微生物、微生物、病原体、病毒、朊病毒或细菌。
本公开的创造性方面可以应用于基因产物的遗传筛选,其中将蛋白质检测并表征结果编码突变,所述结果编码突变来自由SNP、插入、缺失、拷贝数(例如,拷贝数变异)、转位、插入的转基因(例如GMO含量)、CRISPR诱导的修饰或用于产生抗体和T细胞受体的V(D)J重组引起的模板中的遗传修饰。
本公开的创造性方面可以应用于药物或化学试剂的筛选。药物或化学试剂包括但不限于小分子、肽、结合分子或抗体。对于这种应用,可以通过测定这种反应期间蛋白质发生的结构变化(构象变化或基序变化)来检测蛋白质的特征,从而监测特定分析物的化学和生化反应。
5.7.系统
本公开还提供用于检测或表征样品中的生物分子的系统。本公开还提供用于进行本公开的方法的系统。
系统可以包括纳米孔装置;本公开的感测溶液;用于检测电流的传感器;处理器;以及用于存储代码的计算机可读介质,在由处理器执行时,所述代码使处理器检测或表征生物分子。
取决于用户的需求,可以调整系统的计算机系统(例如,处理器和计算机可读介质)以满足他们的需求。在一些实施方案中,计算机系统是在图29A或图29B中部分或全部描述的系统。
通常,本公开的系统将包括存储检测转位通过纳米孔装置的代码的计算机可读介质。
在一些实施方案中,计算机可读介质存储代码,所述代码通过鉴别与测定的基线电流(例如,平均值)相比具有显著标准偏差的一个或多个事件来将转位检测为电流的瞬时下降。取决于应用,与测定的基线相比,显著的标准偏差可包括约1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个标准偏差。
可以通过在假定事件之前或之后(例如,到样品中的背景分子)的给定时间段内的平均幅度和RMS噪音来建立测定的基线电流。还可以通过在假定事件之前或之后(例如,到运行缓冲液中的背景分子)的给定时间段内的平均幅度和RMS噪音来建立测定的基线电流。
在一些进一步的实施方案中,计算机可读介质存储算法,所述算法鉴别针对特定生物分子类型、修饰、结构、分子检测手段已经预先确定或已知的一个或多个电流特征,所述分子检测手段可以包括但不包括但不限于探针、电压敏感部分、珠、染料等。
5.7.1.纳米孔装置
本公开提供的系统可以与本领域已知的任何纳米孔装置或膜一起使用。可以与本公开一起使用的装置的实例包括但不限于固态纳米孔装置、生物纳米孔装置或混合纳米孔装置。
本公开的系统包括在第5.5节中描述的任何装置或膜。如本领域技术人员将理解,膜中的孔大小必须足够大以容纳靶分子(用检测手段如探针或其他电压敏感部分修饰或未修饰)转位通过膜。这样,纳米孔装置中的一个或多个孔可以是纳米级或微米级的。
在一些应用中,装置可以具有大于约20nm、约25nm或约30nm的孔径尺寸。在其他应用中,装置可具有大于约60nm、约70nm、约80nm、约90nm、约100nm、约110nm或约120nm的孔径尺寸。
在阅读本公开之后,技术人员将选择合适的纳米孔装置和膜。
5.7.2.感测溶液
预期由第5.3节中的本公开提供的任何感测溶液组合物可以以有效量与本公开的系统一起使用。如本文所讨论,本领域技术人员将容易地认识到可以将额外试剂添加到感测溶液中。
本文所述的任何聚醚剂可用于感测溶液中。在一些实施方案中,系统可包含含有有效量的式(I)-(IV)的聚醚的感测溶液。在一些实施方案中,系统包括如第5.4.4节中所述的不对称或梯度感测溶液。
5.7.3.具有CsCl或CaCl
本公开提供了用于包含如下概述的CsCl或CaCl
实施方案34.一种包含纳米孔装置的系统,其中所述纳米孔装置包括将装置的内部空间分隔成第一体积和第二体积的层,其中所述层包含纳米孔;其中所述第一和第二体积通过所述纳米孔流体连通,并且其中所述第一体积或所述第二体积包含含有CsCl或CaCl
实施方案35.实施方案34的系统,其进一步包含在所述第一体积中的第一电极和在所述第二体积中的第二电极,其中所述第一和第二电极设置为在所述纳米孔上施加电势。
实施方案36.实施方案35的系统,其进一步包含在所述第一体积或所述第二体积中的靶生物分子,其中所述电势引起所述靶生物分子转位通过所述纳米孔。
实施方案37.实施方案36的系统,其中所述第一和第二电极还设置为检测由所述靶生物分子通过所述纳米孔的所述通道产生的差分电信号。
实施方案38.实施方案37的系统,其中所述差分信号是通过所述纳米孔的电流变化。
5.7.4.具有乙二醇感测溶液的系统
本公开提供了用于包含如下概述的乙二醇感测溶液的系统的额外的实施方案。本领域技术人员将理解,术语“缓冲液”可以与单词“感测溶液”互换使用。
实施方案33.一种包含纳米孔装置的系统,其中所述纳米孔装置包括将装置的内部空间分隔成第一体积和第二体积的层,其中所述层包含纳米孔;其中所述第一和第二体积通过所述纳米孔流体连通,并且其中所述第一体积或所述第二体积包含含有乙二醇的感测溶液。
实施方案34.实施方案33的系统,其进一步包含在所述第一体积中的第一电极和在所述第二体积中的第二电极,其中所述第一和第二电极设置为在所述纳米孔上施加电势。
实施方案35.实施方案34的系统,其进一步包含在所述第一体积或所述第二体积中的靶生物分子,其中所述电势引起所述靶生物分子转位通过所述纳米孔。
实施方案36.实施方案35的系统,其中所述第一和第二电极还设置为检测由所述靶生物分子通过所述纳米孔的所述通道产生的差分电信号。
实施方案37.实施方案36的系统,其中所述差分信号是通过所述纳米孔的电流变化。
实施方案38.实施方案33-37任一项的系统,其中所述乙二醇是聚乙二醇。
实施方案39.实施方案38的系统,其中所述聚乙二醇是三乙二醇、聚乙二醇200或聚乙二醇400。
实施方案40.实施方案33-37任一项的系统,其中所述乙二醇包括以下结构:
其中n为1-10。
实施方案41.实施方案33-37任一项的系统,其中所述纳米孔感测溶液包含盐。
实施方案42.实施方案41的系统,其中所述盐是NaCl、KCl或LiCl。
实施方案43.实施方案41的系统,其中所述盐以大于0.01M、大于0.02M、大于0.05M、大于0.1M、大于0.2M、大于0.5M、大于1M、大于2M或大于3M的浓度存在于所述感测溶液中。
实施方案44.实施方案任一项的系统,其中所述靶生物分子是多核苷酸。
实施方案45.实施方案44的系统,其中所述多核苷酸是dsDNA、ssDNA、RNA或RNA/DNA杂合体。
实施方案46.实施方案44的系统,其中所述多核苷酸的长度不超过2kb、1kb、500个碱基、400个碱基、300个碱基、200个碱基或100个碱基。
实施方案47.实施方案45的系统,其中所述靶标dsDNA的长度小于500bp。
实施方案48.实施方案45的系统,其中所述靶标dsDNA的长度为10bp-500bp。
实施方案49.实施方案33-37任一项的系统,其中所述纳米孔的直径为10nm-150nm。
实施方案50.实施方案33-37任一项的系统,其中所述纳米孔的特征在于最小直径大于4nm、5nm、6nm、7nm、8nm、9nm、10nm、15nm、20nm、25nm、30nm、35nm、40nm、45nm、50nm、55nm、60nm或65nm。
实施方案51.实施方案33-37任一项的系统,其中所述纳米孔的特征在于最小直径小于70nm、75nm、80nm、85nm、90nm、95nm、100nm、105nm或110nm。
实施方案52.实施方案33-37任一项的系统,其中所述纳米孔具有小于1000nm、小于500nm、小于200nm、小于100nm或小于50nm的最小直径。
实施方案53.实施方案33-37任一项的系统,其中所述纳米孔的特征在于最小直径为65nm-100nm。
实施方案54.实施方案33-37任一项的系统,其中所述纳米孔的特征在于最小直径为5nm-100nm。
实施方案55.实施方案44的系统,其中所述多核苷酸的长度不超过500个碱基,并且所述纳米孔的最小直径为10nm。
实施方案56.实施方案33-37任一项的系统,其中所述包含乙二醇的感测溶液同时存在于第一体积和第二体积中。
实施方案33-37任一项的系统,其中所述乙二醇以0.1%v/v或更大、0.2%v/v或更大、0.5%v/v或更大、1%v/v或更大、2%v/v或更大、5%v/v或更大、10%v/v或更大、15%v/v或更大、20%v/v或更大或25%v/v或更大的浓度存在于所述第一体积或所述第二体积中。
实施方案57.实施方案33-37任一项的系统,其中所述乙二醇以至少0.01M、0.05M、0.1M、0.2M、0.5M或1M的浓度存在于所述第一体积或所述第二体积中。
实施方案58.实施方案33-37任一项的系统,其中所述装置包括用于在所述纳米孔上施加电压并监测通过所述纳米孔从一个腔室到另一个腔室的电流的电极,其中所述电极连接到电源。
实施方案59.实施方案33-37任一项的系统,其中所述第一和第二体积仅通过所述纳米孔流体连通。
5.7.5.传感器
本公开的系统通常包括传感器。传感器是一种装置、模块、机器或子系统,其目的是检测其环境中的事件或变化并将信息发送到其他电子设备,通常是计算机处理器。
在一些应用中,传感器可以是本领域中已知的任何传感器。在某些实施方案中,传感器可以是第5.5.8节中描述的传感器。
5.7.6.计算机系统
通常,本公开的系统可以与存储用于处理和分析来自纳米孔装置的电流数据的代码的计算机系统、处理器和计算机可读介质一起使用。所描述的计算机系统的变体是可能的,只要它们提供本公开提供的系统和方法。
图29A显示根据一个实施方案用于检测电流测量值、对该数据进行分析并且提供摘要分析的分析系统100。分析系统可以包括客户端计算装置110、纳米孔装置130、应用服务器125、数据库服务器120和网络135。虽然图29A仅显示分析系统100的大多数组件的单个实例,但在实践中可以存在多于一个的每个组件,并且可以使用更多或更少的组件。
客户端装置110是计算机系统。下文参照图29B更完整地描述实例物理实施方式。客户端装置110是一个或多个能够经由网络135接收用户输入以及发送和/或接收数据的计算装置。在一个实施方案中,客户端装置110是常规的计算机系统,例如台式计算机或手提计算机。或者,客户端装置110可以是具有计算机功能的装置,例如个人数字助理(PDA)、移动电话、智能电话或另一合适的装置。在一些实施方案中,客户端装置110执行允许客户端装置110的用户与网络上的其他实体(例如服务器或其他客户端装置)进行交互的应用。例如,在一些情况下,客户端装置110可以执行浏览器应用程序,以允许客户端装置110和应用程序服务器125或数据库服务器120之间通过网络135进行交互。在另一个实施方案中,客户端装置110通过在客户端装置110的本地操作系统如
纳米孔装置130可以包括其自己的网络适配器(未示出),该网络适配器通过有线连接或更典型地通过无线射频连接与客户端装置110通信。在一个实施方案中,网络适配器是蓝牙低功耗(BTLE)无线发射机,但是在其他实施方案中,可以使用其他类型的无线通信(例如,红外,102.11)。在一个实施方案中,纳米孔装置是本领域已知的任何纳米孔装置。在另一个实施方案中,与该系统一起使用的纳米孔装置是在第5.7节中描述的装置。
应用服务器125是计算机或计算机网络。尽管在图29B中示出了简化的实例,与例如用作客户端装置110的典型计算系统相比,应用服务器通常将是使用强大的处理器、大内存和更快的网络组件的服务器类系统。例如,使用RAID(独立磁盘冗余阵列)阵列和/或通过与签约存储、交换和传输数据的独立的内容发布网络(CDN)建立关系,服务器通常具有大的二级存储。另外,计算系统包括操作系统,例如,UNIX操作系统、LINUX操作系统或WINDOWS操作系统。操作系统管理应用服务器125的硬件和软件资源,并且还提供各种服务,例如,过程管理、数据的输入/输出、外围设备的管理等。操作系统提供各种功能来管理存储在装置上的文件,例如,创建新文件、移动或复制文件、将文件传输到远程系统等。
应用服务器125包括用于支持许多不同的客户端装置110通过网络135访问和使用分析系统100的软件架构,因此在高水平上通常可以将其表征为基于云的系统。应用服务器125通常为用户111和公司112提供平台以报告由与纳米孔装置130相关联的传感器记录的数据。
通常,应用服务器125设计为处理各种各样的数据。应用服务器125包括执行各种功能的逻辑例程,包括检查输入数据的有效性、在必要时解析和格式化数据、将处理后的数据传递给数据库服务器120以进行存储以及确认数据库服务器120已更新。
应用服务器125至少部分地在逐个用户的基础上存储和管理数据。为此,应用服务器125为每个用户创建用户配置文件。用户配置文件可以进一步指定设备标识符,例如鉴定被授权向用户提交数据的一个或多个客户端装置110或纳米孔装置130的唯一介质访问控制(MAC)地址。
数据库服务器120根据定义的数据库模式存储数据。通常,由于基础数据库结构中的实现差异,即使存储相同类型的数据(包括云应用程序事件日志和日志指标)时,跨不同数据源的数据存储模式显著改变。数据库服务器120还可以存储不同类型的数据,例如结构化数据、非结构化数据或半结构化数据。数据库服务器120中的数据可以与用户相关联。
网络135代表客户端装置110、纳米孔设备130、应用服务器125和数据库服务器120之间的各种有线和无线通信路径。网络135可以包括局域网和/或广域网的任何组合。例如,网络135可以使用标准互联网通信技术和/或协议。因此,网络135可以包括使用技术如以太网、801.11、IEEE 102.11、集成服务数字网络(ISDN)、异步传输模式(ATM)、全球微波接入互通性(WiMAX)、3G、4G、码分多址(CDMA)、数字用户线(DSL)的链接。类似地,在网络135上使用的联网协议可以包括传输控制协议/互联网协议(TCP/IP)、多协议标签交换(MPLS)、超文本传输协议(HTTP)、简单邮件传输协议(SMTP)、文件传输协议(FTP)等。可以使用包括超文本标记语言(HTML)、可扩展标记语言(XML)等技术和/或格式来表示通过网络135交换的数据。此外,可以使用常规加密技术(例如安全套接层(SSL)、安全HTTP(HTTPS)和/或虚拟专用网(VPN))对所有或一些链接进行加密。在另一个实施方案中,实体可以使用定制的和/或专用的数据通信技术来代替上述方法,或者除了上述方法之外,实体还可以使用定制的和/或专用的数据通信技术。
通常,客户端装置110中使用的确切物理组件的大小、功率要求和性能将与应用服务器125和数据库服务器120中使用的那些不同。例如,通常是家用计算机、平板计算机、手提计算机或智能电话的客户端装置110将包括相对较小的存储容量和处理能力,但将包括输入设备和显示器。这些组件适用于数据的主题输入以及接收、显示以及与应用程序服务器125提供的通知进行交互。相反,应用服务器125可以包括许多物理上分离的本地网络计算机,每台计算机具有相当大的处理能力以进行上文介绍的COPD风险分析。在一个实施方案中,由如Amazon Web Services
图29B是高水平框图,显示实例计算机140的物理组件,根据一个实施方案,该实例计算机可以用作来自图29A的客户端装置110、应用服务器125和/或数据库服务器120的一部分。示出了耦合到至少一个处理器145的芯片组150。与芯片组150耦合的是易失性存储器155、网络适配器160、一个或多个输入/输出(I/O)设备165、表示非易失性存储器的存储设备170和显示器175。在一个实施方案中,芯片组150的功能由存储器控制器151和I/O控制器152提供。在另一个实施方案中,存储器155直接耦合到处理器145而不是芯片组150。在一些实施方案中,存储器155包括高速随机存取存储器(RAM),例如DRAM、SRAM、DDR、RAM或其他随机存取固态存储器设备。
存储设备170是任何非暂时性计算机可读存储介质,例如硬盘驱动器、光盘只读存储器(CD-ROM)、DVD或固态存储设备。存储器155保存处理器145使用的指令和数据。I/O设备165可以是触摸输入表面(电容性或其他)、鼠标、跟踪球或其他类型的指示设备、键盘或其他形式的输入设备。显示器175显示来自计算机140的图像和其他信息。网络适配器160将计算机140耦合到网络135。
如本领域已知,计算机140可以具有与图29B所示的组件不同的组件和/或其他组件。另外,计算机140可以缺少某些示出的组件。在一个实施方案中,充当服务器120的计算机140可缺少专用的I/O设备165。此外,存储设备170可以在计算机140的本地和/或远程(例如,体现在存储区域网络(SAN)内)。并且,在一个实施方案中,存储设备170不是CD-ROM设备或DVD设备。如本领域已知,计算机140适于执行计算机程序模块以提供本文所述的功能。可以用硬件、固件和/或软件来实施模块。在一个实施方案中,程序模块存储在存储装置170上,加载到存储器155中,并由处理器145执行。
5.8.试剂盒
本公开提供用于使用纳米孔装置检测或表征生物分子的试剂盒。使用纳米孔装置检测或表征样品中生物分子的试剂盒可包含第5.3节的感测溶液和说明书。
本公开的组合物和方法适合于制备试剂盒,并且可根据众所周知的程序容易地生产。试剂盒的试剂或组分可包括与说明书有关的鉴别性描述或标签。试剂盒可包括容器,每个容器包含试剂盒提供的至少一种试剂或组分。
本公开提供了用于进行本公开的方法的试剂盒。此外,可以为特定应用定制试剂盒。在一些实施方案中,可以定制试剂盒以表征:生物分子的存在或不存在、数量、同一性、修饰、结构或序列。与在标准缓冲液中进行的相同方法相比,试剂盒通常提供改进的准确性。
取决于应用、样品类型或用户需求,试剂盒可以具有用于进行方法或应用的其他试剂或组分。
在一些实施方案中,用于使用纳米孔装置检测或表征样品中的生物分子的试剂盒可包含第5.3节的感测溶液、说明书以及用于样品处理、样品检测或取决于用户需求的其他试剂或组分(例如设备、软件等)。
本公开还提供用于进行需要准确的单分子水平的鉴定和表征的特定应用的试剂盒。可以定制试剂盒的应用的非限制性实例包括但不限于诊断测试、感染性疾病测试、遗传筛选(包括但不限于癌症基因、遗传基因座、遗传修饰如拷贝数、突变,插入的转基因含量)或药物/化学试剂筛选。
5.8.1.感测溶液
预期第5.3节中提供的任何感测溶液组合物均可与本公开的试剂盒一起使用。如本文所讨论的,本领域技术人员将容易地认识到可以将额外试剂添加到感测溶液中。
本文所述的任何聚醚剂可用于感测溶液中。在一些实施方案中,试剂盒可以使用包含有效量的式(I)的聚醚的感测溶液:
其中:m是1-3;n是1-30;每个R
在一些实施方案中,试剂盒包含具有有效量的式(Ia)-(IV)的聚醚或其实施方案的感测溶液。
在一些实施方案中,试剂盒包含如第5.4.4节中所述的不对称或梯度感测溶液。
5.8.2.说明书
通常,本公开的试剂盒将包含用于在纳米孔装置中使用感测溶液的说明书。说明书可以在纸上、以计算机代码存储或以电子方式提供给用户。
试剂盒中的说明书可以针对特定的方法、应用或样品类型、特征或生物分子类型来定制。说明书可以定制为:诊断生物标志物测试、感染性疾病检测、基因筛选(例如,遗传基因座/突变或植物中的插入的转基因)以及药物或化学试剂筛选。在一些实施方案中,说明书可以针对第5.6节中描述的任何应用来定制。
5.8.3.额外的试剂盒试剂和组分
预期试剂盒将针对特定方法、应用、样品类型、特征或生物分子类型来定制。因此,试剂盒通常将具有额外组分或试剂。同样,在某些实施方案中,试剂盒中包含的额外组分和试剂将进一步取决于用户的需求。
在一些实施方案中,用于使用纳米孔装置检测或表征样品中的生物分子的试剂盒包括:感测溶液、说明书以及一种或多种选自以下的组分:缓冲液(例如,HEPES、TRIS等)、用于检测的手段(例如探针、染料、电压敏感部分等)、碳水化合物溶液、电极、电源、电压钳放大器、一种或多种用于样品制备的溶液、包含膜的纳米孔装置或其组合。
试剂盒可包括本领域已知的任何纳米孔装置或本公开的第5.5节中提供的装置。如本领域技术人员将理解,膜中的孔大小必须足够大以容纳靶分子(用检测手段如探针或其他电压敏感部分修饰或未修饰)转位通过膜。这样,纳米孔装置中的一个或多个孔可以是纳米级或微米级的。
在一些应用中,装置可以具有大于约20nm、约25nm或约30nm的孔径尺寸。在其他应用中,装置可以具有大于约60nm、约70nm、约80nm、约90nm、约100nm、约110nm或约120nm的孔径尺寸。
试剂盒通常可以包括计算机可读介质,该计算机可读介质引导用于检测或表征样品中生物分子的操作系统,或者计算机可读介质存储将通过纳米孔装置的转位检测为电流的瞬时下降的代码,并使用鉴别与测定的基线电流相比具有显著的标准偏差的事件的算法。
具体实施方式
下文是用于实施本发明的具体实施方案的实施例。这些实施例仅出于说明性目的而提供,且不以任何方式限制本发明的范围。已经尽力确保所使用的数字(例如,数量、温度等)的准确性,但是,当然应该允许一些实验误差和偏差。
除非另有说明,本发明的实施将采用本领域技术范围内的蛋白质化学、生物化学、重组DNA技术和药理学的常规方法。这种技术充分解释于文献中。例如参见T.E.Creighton,Proteins:Structures and Molecular Properties(W.H.Freeman and Company,1993);A.L.Lehninger,Biochemistry(Worth Publishers,Inc.,current addition);Sambrook等人,Molecular Cloning:A Laboratory Manual(第二版,1989);Methods In Enzymology(S.Colowick和N.Kaplan编者.,Academic Press,Inc.);Remington′s PharmaceuticalSciences,第18版(Easton,Pennsylvania:Mack Publishing Company,1990);Carey andSundberg Advanced Organic Chemistry 3rd Ed.(Plenum Press)卷A和B(1992)。
5.9.1.实施例1:标准的1M LiCl缓冲液可以在27nm纳米孔中检测3.2kb或更大的较大dsDNA
固态纳米孔隙是在分隔两个水性体积的薄的固体膜中形成的纳米级开口。电压钳放大器在测量通过开放孔隙的离子电流的同时施加跨膜的电压V(图7A)。与任何其他单分子传感器不同,纳米孔隙装置可以以非常低的成本封装成手持形式因素。当单一带电分子如双链DNA(dsDNA)通过电泳被捕获并被驱动通过孔时,测量的与基线的电流变化(δI)(产生事件)及电导偏移深度(δG=δI/V)和持续时间被用于表征事件(图7B)。
值δG(也标记为ΔG)可以被计算为平均电流偏移除以电压。值δG(也标记为ΔG)也可以被计算为最大电流偏移除以电压。持续时间被计算为偏移宽度。
我们将0.1nM 3.2kb dsDNA置于具有27nm直径纳米孔的纳米孔装置中。纳米孔装置中的缓冲溶液包含1M LiCl。我们施加跨纳米孔的100mV电压以诱导dsDNA跨纳米孔的转位。事件通过电流传感器检测和如下所述进行分析。
在实验期间记录许多事件之后,分析事件的分布以确定特定靶分子的检测和表征。图7C显示在电压V=100mV(于1M LiCl中)下穿过27nm直径纳米孔的浓度为0.1nM的3.2kb dsDNA的事件特征,产生在10分钟内记录的713个事件。
结论:我们观察到,使用标准的1M LiCl缓冲液可以在27nm直径的纳米孔中检测到3.2kb或更大的较大dsDNA。参见图7C。
5.9.2.实施例2:标准的4M LiCL缓冲液无法在30nm纳米孔中检测和分辨74bp和217bp的小dsDNA
如实施例1所示,1M LiCl缓冲液可以检测大dsDNA。进行这项研究以测试使用标准4M LiCl缓冲液检测和分辨小dsDNA(74bp和217bp)的能力。
简言之,使用PCR扩增制备不同长度的长度分别为74bp和217bp的小双链DNA(dsDNA)。接着,将1-2ul PCR扩增的dsDNA单独稀释于4.0M LiCl、10mM Tris HCl pH 8.8、1mM EDTA中以产生5nM的终浓度。
将样品装载到29nm厚的具有大小为约30nm的孔的SiN膜的纳米孔装置上。接着,将10ul样品注入原型纳米孔芯片保持器中,并使用原型电压钳放大器将100mV偏压施加于纳米孔芯片(反面为正)。使用软件以125kHz的采样率记录约5分钟或足够的时间以收集~1000个分子转位事件的离子电流数据。使用4极Bessel过滤器以30kHz将数据重新过滤。
将通过孔的DNA转位检测为离子电流的瞬时下降。使用事件发现算法从原始离子电流数据检测这些转位事件,所述算法鉴别与基线电流相比具有显著标准偏差的事件。代表性数据示于图18A-18B。
结论:我们观察到标准的4M LiCl缓冲液无法检测74bp的dsDNA,并且在74bp和217bp的dsDNA之间不存在分辨。参见图18A-18B。
5.9.3.实施例3:基于碳水化合物的感测溶液无法在26nm纳米孔中检测或分辨74bp-550bp的dsDNA分子
进行该研究以检验基于碳水化合物的感测溶液应增强纳米孔检测和分辨74bp-550bp的小dsDNA分子的假说。
使用标准PCR扩增产生不同长度的小双链DNA(dsDNA):74bp、217bp、309bp和550bp。接着,将1-2ul PCR扩增的dsDNA单独稀释于碳水化合物溶液中,该溶液包含在4.0MLiCl、10mM Tris HCl pH 8.8、1mM EDTA中的20%v/v甘油、山梨醇、葡萄糖、麦芽糖或麦芽糖糊精。
接着,将样品加载到29nm厚的具有大小为约26nm的孔的SiN膜的纳米孔装置上。将10ul样品注入纳米孔芯片保持器中,并使用电压钳放大器将100mV偏压施加于纳米孔芯片(反面为正)。
使用软件以125kHz的采样率记录原始离子电流数据约5分钟或足够的时间以收集大约1000个分子转位事件。使用4极Bessel过滤器以30kHz将数据重新过滤。从20%麦芽糖感测溶液收集的数据显示于图19A-19B中。未显示来自甘油、山梨醇、葡萄糖、麦芽糖或麦芽糖糊精的数据。
结论:我们的结果表明,基于碳水化合物的感测溶液通常对于检测和分辨小dsDNA无效。使用基于甘油、山梨醇、葡萄糖或麦芽糖糊精的感测溶液,我们未检测到事件(数据未显示)。
此外,20%麦芽糖碳水化合物感测溶液不能有效检测74bp dsDNA,在5分钟后仅检测2个事件。因此,74bp dsDNA基本上是不可检测的。此外,数据表明在74bp和217bp dsDNA之间不存在分辨。参见图19A-19B。最后,尽管可以检测到217bp dsDNA,但无法从309bp和550bp的较大dsDNA中分辨(数据未显示)。
5.9.4.实施例4A:7%PEG 200感测溶液检测和区分217bp与353bp dsDNA,并能够定量dsDNA分子
我们测试了包含短PEG试剂的感测溶液,该短PEG试剂包含7%PEG 200v/v、4MLiCl、10mM Tris、1mM EDTA,pH 8.8以确定该溶液是否可以在35nm纳米孔中检测和区分217bp dsDNA与353bp dsDNA。图2阐明构成聚乙二醇(PEG)的重复单元的乙二醇的单个单元的结构。
将217bp dsDNA和353bp dsDNA的每个片段分离运行,并且根据停留时间和其电流阻断绘制其各自的事件群体(图4A)。片段表现出不同的停留时间(图4B)。描绘各群体的最大电流阻断的柱状图表明与217bp相比,353bp阻断更多电流(图4C)。
运行217bp和353bp的50/50混合物,并将其作为校准物用于下游计算溶液中217bp的%。将50/50校准物的停留时间柱状图与分别包含25%或75%217bp的两个片段的已知混合物的柱状图进行比较(图4D)。
特定片段的dsDNA分子数目的量(例如浓度)估计值可以如以引用方式并入本文的WO2018081178中所述来测定。简言之,通过以下方法估计dsDNA分子。随着样品中217bpdsDNA百分比的增加,代表217bp dsDNA片段的峰逐渐增加,从25%增至50%和75%。类似地,可以生成比较其他事件特征参数(包括面积)的柱状图(图4E)。然后,可以使用这些特征来估计溶液中217bp的%。
结论:估计25%和75%混合物分别为22.99%和76.61%。综上所述,这些结果表明7%PEG 200感测溶液可以检测并区分217bp和353bp dsDNA,从而实现准确的分数丰度估算。
5.9.5.实施例4B:10%PEG 200感测溶液可以通过停留时间或最大电流阻断来在28nm纳米孔中检测和区分108bp和309bp dsDNA
我们测试了包含短PEG试剂的感测溶液,所述短PEG试剂包含10%PEG 200v/v、4MLiCl、10mM Tris、1mM EDTA,pH 8.8以确定该溶液是否可以通过其对数停留时间(例如,事件持续时间)或其最大电流阻断在28nm纳米孔(施加电压100mV)中检测和区分108bp dsDNA和309bp dsDNA。
将每个DNA片段分离运行,并且根据观察到的事件持续时间(秒)和最大电流阻断(nanosiemens;图3A),将其各自群体绘制在全事件图上。图3B以对数刻度显示108bp和309bp dsDNA群体的事件持续时间。图3C在柱状图中显示108bp和309bp群体中每一个的最大事件深度。
结论:基于对数停留时间,我们观察到108bp dsDNA分子和309bp dsDNA分子表现出非常不同的事件持续时间,并且所述群体在10%PEG 200感测溶液中明显分离(图3B)。类似地,309bp和108bp dsDNA各自在PEG感测溶液中的最大电流阻断中提供明显的不同。参见图3A。这些数据表明,长度较短的PEG缓冲液可以有效地增强纳米孔的检测。
5.9.6.实施例5:25%TEG感测溶液检测并区分分离运行的74bp、108bp和217bp的dsDNA
该研究的目的是确定25%TEG感测溶液是否可以区分74bp-217bp的不同长度的dsDNA。
TEG的结构如图1所示。我们测试了包含25%(v/v)三乙二醇、3M LiCl、10mM Tris、1mM EDTA,pH 8.8的感测溶液以确定该溶液是否可以通过其对数停留时间(例如,事件持续时间)或其最大电流阻断在28nm纳米孔(施加电压100mV)中检测并区分74bp dsDNA与108bp和217bp dsDNA。
每个dsDNA片段74bp、108bp和217bp在28nm纳米孔中分离运行。代表性数据示于图5A-5D。容易检测到每个dsDNA片段,形成三个群体(图5A)。对于每个DNA片段(图5B)观察到不同的停留时间以及不同的电流阻断(图5C)。每个事件群体的面积显示不同的群体峰(图5D)。
结论:这些结果表明基于25%TEG的感测溶液可以通过其独特的停留时间或电流阻断来检测和区分74bp、108bp和217bp的dsDNA。这些数据表明,基于25%TEG的感测溶液可用于同时复用至少三个分离的DNA片段,以进行检测、区分和定量。
5.9.7.实施例6:与标准4M LiCl缓冲液相比,15%TEG感测溶液增强分离运行的74bp、108bp、217bp和309bp的小dsDNA的检测和分辨
用15%TEG(v/v)感测溶液和标准4M LiCl缓冲液在71-73nm纳米孔中单独分析一组跨108bp-309bp的dsDNA片段。
结论:在标准的4M LiCl缓冲液中,我们观察到无法检测108bp dsDNA。但是,以分别约为42和47个事件/分钟的适度速度检测到217bp和309bp dsDNA。但是,我们观察到这两个群体在事件群体、dG或停留时间方面均没有差异,因此标准的4M LiCl缓冲液在217bp和309bp dsDNA之间产生了相当大的重叠。参见图6A。
相反,15%TEG(v/v)感测溶液导致检测速率的急剧增加以及所测试的dsDNA群体之间的分离。15%TEG感测溶液以28个事件/分钟的速度检测到108bp dsDNA,而以上升至307个事件/分钟的速度检测到217bp dsDNA,并以上升至256个事件/分钟的速度检测到309bp dsDNA。此外,15%TEG感测溶液显示dG的增加,并且停留时间导致每个群体的分离增加。参见图6B。这些数据表明基于TEG的感测溶液可用于同时复用至少三个分离的DNA片段,以进行检测、区分和定量。
5.9.8.实施例7:30%乙二醇感测溶液增强37nm纳米孔中108bp和309bp的小dsDNA的检测和分辨。
进行该研究以测试与图18A-18B中所示的标准4M LiCl缓冲液相比,30%乙二醇感测溶液检测和分辨小dsDNA单个群体的能力。
使用标准PCR扩增制备不同大小的dsDNA:74bp、217bp、108bp和309bp。将PCR扩增的dsDNA分离运行,并稀释于30%乙二醇(v/v)、4.0M LiCl、10mM Tris HCl pH 8.8、1mMEDTA至最终浓度为5nM。
接着,将样品加载到29nm厚的具有大小为约37nm的孔的SiN膜的固态纳米孔装置上。将10ul制备的样品注入纳米孔芯片保持器中,并使用原型电压钳放大器将100mV偏压施加于纳米孔芯片(反面为正)。
使用定制软件以125kHz的采样率记录约5分钟或足够的时间以收集~1000个分子转位事件的离子电流数据。使用4极Bessel过滤器以30kHz将数据重新过滤。代表性数据显示于图20A-20B中。
结论:我们观察到,与标准LiCl缓冲液相比,在30%乙二醇感测溶液中可以稳健地检测到108bp和309bp的小dsDNA片段。此外,在标准LiCl中未观察到30%乙二醇感测溶液显示的108bp和309bp dsDNA之间的分辨。但是,30%乙二醇感测溶液似乎不能检测长度差异较小的dsDNA片段,例如74bp和217bp dsDNA。
5.9.9.实施例8:15%三乙二醇(TEG)感测溶液能够在30nm纳米孔中检测和分辨74bp和217bp的小dsDNA
进行该研究以测试与图18A-18B中所示的标准LiCl缓冲液相比,15%三乙二醇(TEG)纳米孔感测溶液单独检测和分辨小dsDNA群体的能力。
使用标准PCR扩增制备不同长度的小双链DNA(dsDNA):74bp和217bp。将PCR扩增的dsDNA分离运行,并稀释于15%TEG(v/v)、4.0M LiCl、10mM Tris HCl pH 8.8、1mM EDTA至终浓度5nM。
将样品加载到29nm厚的具有大小为约30nm的孔的SiN膜的固态纳米孔装置上。将10ul样品注入原型纳米孔芯片保持器中,并使用原型电压钳放大器将100mV偏压施加于纳米孔芯片(反面为正)。
使用软件以125kHz的采样率记录约5分钟或足够的时间以收集~1000个分子转位事件的原始离子电流数据。使用4极Bessel过滤器以30kHz将数据重新过滤。代表性数据显示于图21A-21B中。
结论:与标准LiCl缓冲液不同,我们观察到15%TEG感测溶液能够检测和彼此分辨74bp和217bp dsDNA。
5.9.10.实施例9:10%三丙二醇(TPG)感测溶液可以在30nm纳米孔中检测并分辨74bp和217bp的小dsDNA分子
进行该研究以测试与图18A-18B中所示的标准LiCl缓冲液相比,10%三丙二醇(TPG)纳米孔感测溶液检测和分辨小DNA群体的能力。
使用标准PCR扩增制备两种不同大小的双链DNA(dsDNA):74bp和217bp。将PCR扩增的dsDNA分离运行,并稀释于10%TPG(v/v)、4.0M LiCl、10mM Tris HCl pH 8.8、1mM EDTA至终浓度5nM。
将样品加载到29nm厚的具有大小为约30nm的孔的SiN膜的固态纳米孔装置上。将10ul样品注入原型纳米孔芯片保持器中,并使用电压钳放大器将100mV偏压施加于纳米孔芯片(反面为正)。
使用软件以125kHz的采样率记录约5分钟或足够的时间以收集~1000个分子转位事件的原始离子电流数据。使用4极Bessel过滤器以30kHz将数据重新过滤。代表性数据显示于图22A-22B中。
结论:与标准LiCl缓冲液不同,我们观察到10%TPG感测溶液能够检测和彼此分辨74bp和217bp dsDNA。
5.9.11.实施例10:10%四乙二醇二甲醚(TTEG-DME)感测溶液为31nm纳米孔中108bp和217bp的小dsDNA提供稳健的检测和分辨
进行该研究以测试与图18A-18B中所示的标准LiCl缓冲液相比,10%四乙二醇二甲醚(TTEG-DME)纳米孔感测溶液检测和分辨小DNA群体的能力。
使用标准PCR扩增制备不同长度的双链DNA(dsDNA):108bp和217bp。接着,将PCR扩增的dsDNA样品单独稀释于10%TTEG-DME(v/v)、4.5M LiCl、10mM Tris HCl pH 8.8、1mMEDTA至终浓度5nM。
将样品加载到29nm厚的具有大小为约31nm的孔的SiN膜的纳米孔装置上。将10ul样品注入纳米孔芯片保持器中,并使用电压钳放大器将100mV偏压施加于纳米孔芯片(反面为正)。
使用软件以125kHz的采样率记录约5分钟或足够的时间以收集~1000个分子转位事件的原始离子电流数据。使用4极Bessel过滤器以30kHz将数据重新过滤。代表性数据显示于图23A-23B中。
结论:与标准LiCl缓冲液不同,我们观察到10%TTEG-DME感测溶液对108bp和217bp的小dsDNA提供稳健的检测和分辨。
5.9.12.实施例11:10%三丙二醇单甲醚(TPG-MME)感测溶液为34nm纳米孔中108bp、217bp的小dsDNA提供稳健的检测和分辨
进行该研究以测试与图18A-18B中所示的标准LiCl缓冲液相比,10%三丙二醇单甲醚(TPG-MME)纳米孔感测溶液检测和分辨小DNA群体的能力。
使用标准PCR扩增制备不同大小的双链DNA(dsDNA):108bp和217bp。接着,将PCR扩增的样品单独运行并且稀释于10%TPG-MME(v/v)、4.5M LiCl、50mM Tris HCl pH 8.8、5mMEDTA至终浓度5nM。
将样品加载到29nm厚的具有大小为约34nm的孔的SiN膜的固态纳米孔装置上。将10ul样品注入纳米孔芯片保持器中,并使用电压钳放大器将100mV偏压施加于纳米孔芯片(反面为正)。
使用软件以125kHz的采样率记录约5分钟或足够的时间以收集~1000个分子转位事件的原始离子电流数据。使用4极Bessel过滤器以30kHz将数据重新过滤。代表性数据显示于图24A-24B中。
结论:与标准LiCl缓冲液不同,我们观察到10%TPG-MME感测溶液对108bp和217bp的小dsDNA提供稳健的检测和分辨。
5.9.13.实施例12:不对称的10%PEG 200(顺式)/10%麦芽糖(反式)感测溶液可在33nm纳米孔中检测88bp和266bp的小dsDNA
进行该研究以测试固态纳米孔装置的顺或反面上的不对称PEG200感测溶液的有效性。
通过PCR扩增制备不同长度的双链DNA(dsDNA):88bp和266bp。接着,将PCR扩增的dsDNA样品单独在下文概述的以下感测溶液中以1:100的比例稀释。
首先,我们测试了在顺面具有不对称PEG感测溶液的固态纳米孔装置。设置设备使得10%PEG(v/v)、4.5M LiCl、50mM Tris HCl pH8.8、5mM EDTA溶液位于孔的顺面,并且10%麦芽糖w/v、4.5M LiCl、50mM Tris HCl pH 8.8、5mM EDTA溶液位于孔的反面。将样品稀释到10%PEG 200v/v、4.5M LiCl、50mM Tris HCl pH 8.8、5mM EDTA中以匹配顺式腔室。
将样品加载到29nm厚的具有大小为约33nm的孔的SiN膜的固态纳米孔装置上。将10ul样品注入纳米孔芯片保持器中,并使用电压钳放大器将100mV偏压施加于纳米孔芯片(反面为正)。代表性数据显示于图25A-25B中。
接着,我们测试了在顺面具有不对称麦芽糖感测溶液的固态纳米孔装置。设置设备使得10%麦芽糖w/v、4.5M LiCl、50mM Tris HCl pH 8.8、5mM EDTA溶液位于孔的顺面,并且10%PEG 200v/v 4.5MLiCl、50mM Tris HCl pH 8.8、5mM EDTA溶液位于孔的反面。将样品稀释至10%麦芽糖w/v、4.5M LiCl、50mM Tris HCl pH 8.8、5mM EDTA中,以匹配顺面腔室,然后将10ul注入纳米孔芯片保持器中。
将样品加载到29nm厚的具有大小为约33nm的孔的SiN膜的固态纳米孔装置上。将10ul样品注入纳米孔芯片保持器中,并使用电压钳放大器将100mV偏压施加于纳米孔芯片(反面为正)。代表性数据显示于图26A-26B中。
对于每个测试,使用软件以125kHz的采样率记录约5分钟或足够的时间以收集~1000个分子转位事件的原始离子电流数据。使用4极Bessel过滤器以30kHz将数据重新过滤。
结论:我们观察到,在孔的顺面含10%麦芽糖感测溶液且在孔的反面含10%PEG感测溶液的纳米孔装置仅能较弱地检测并且不能分辨88bp和266bp的dsDNA群体。参见图26A-26B。
然而,在孔的顺面含10%PEG感测溶液且在孔的反面含10%麦芽糖感测溶液的纳米孔装置可以检测和分辨88bp和266bp的小dsDNA。参见图25A-25B。
5.9.14.实施例13:PEG 8000感测溶液不能检测或仅提供最小的检测并且不能在32nm纳米孔中分辨小DNA分子
进行该研究以确定与以上测试的较短的PEG相比,较长的PEG(PEG 8000)感测溶液检测和分辨小dsDNA分子的能力。
使用标准PCR扩增制备不同长度的双链DNA(dsDNA):74bp、217bp、309bp和500bp。接着,将PCR扩增的dsDNA单独稀释于75μM PEG 8000、2.0M LiCl、10mM Tris HCl pH 8.8、1mM EDTA至最终浓度5nM。
将样品加载到29nm厚的具有大小为约32nm的孔的SiN膜的纳米孔装置上。将约10ul的稀释样品注入原型纳米孔芯片保持器中,并使用原型电压钳放大器将100mV偏压施加于纳米孔芯片(反面为正)。
使用软件以125kHz的采样率记录约5分钟或足够的时间以收集~1000个分子转位事件的原始离子电流数据。使用4极Bessel过滤器以30kHz将数据重新过滤。代表性数据显示于图27A-27B和图28A-28B中。
结论:我们观察到使用PEG 8000感测溶液几乎不能检测74bp dsDNA,并且不能分辨74bp和217bp dsDNA群体。箭头指出检测到的十二个74bp事件中的三个。参见图27A-27B。此外,我们观察到在PEG 8000缓冲液中最小检测到大小为217bp和309bp的dsDNA,并且如柱状图中完全重叠的群体所示,不能分辨217bp和309bp dsDNA。参见图28A-28B。
综上所述,以上实施例中提供的我们的结果表明,本公开的感测溶液,特别是包含较短聚醚剂的感测溶液,比其他试剂和各种测试的标准缓冲液更有效地感测纳米孔装置中各种尺寸的生物分子。
因为所测试的dsDNA分子的大小近似于蛋白质分子的大小,所以本公开的感测溶液也可以应用于肽、蛋白质和抗体的检测。
在下文提供的实施例14-21中,我们聚焦于测试包含阳离子盐剂的纳米孔感测溶液,并将其性能与其他标准(例如常规)纳米孔缓冲液进行比较。
在这里,我们测试了低于500bp的DNA长度,并使用了直径至少为25nm的纳米孔。以下实施例中使用的孔是使用氦离子显微镜(HIM)在30nm的氮化硅膜中形成。在实施例中,使用DNA清除试剂盒清洁和纯化扩增的dsDNA片段(New England BioLabs,Cat.#T1030S)。
对于以下实施例,当样品降至开放通道信号的标准偏差(σ)的6倍以下时,将电流信号标记为事件,并使用每对标记事件之间的周期计算σ。如果它们没有返回至1σ之内;如果最小样品的信噪比除以σ小于6;或如果持续时间超过10毫秒,则将拒绝分析事件。对于每个事件,报告的持续时间是半高度(half maximum)处的时间宽度。每个事件的δG值是在整理对应于上升时间(tr)的事件开始和结束时样品数目之后,所有低于1σ的样品的平均值,从而去除低通过滤器的影响。tr的值由放大器和带宽设置确定,如下所示:使用有效带宽与30kHz Bessel过滤器带宽匹配的MultiClamp 700B(Molecular Devices,LLC),10-90上升时间(tr)为12μs。对于短于2tr的事件,我们报告了δG的最大值。
5.9.15.实施例14:1M LiCl或1M KCl标准缓冲液无法在27nm或30nm纳米孔中检测108bp的小dsDNA
进行该研究以确定使用标准的1M LiCl或1M KCl缓冲液在直径为27nm和30nm的固态纳米孔中是否可检测108bp dsDNA。
简言之,我们将包含1M LiCl或1M KCl的缓冲液添加到包含27nm直径纳米孔或30nm直径纳米孔的纳米孔装置的顺式和反式体积中。
接着,我们将包含108bp dsDNA的样品添加到纳米孔装置的顺式体积中,最终浓度为10nM。然后,我们在纳米孔上施加了100mV的电势以诱导转位并检测108bp dsDNA。在施加电势期间,连续监测通过纳米孔的离子电流。
然后,分析由电流产生的信号是否存在由108bp dsDNA分子转位通过27nm纳米孔触发的事件。图8A-8B显示从上述实验中检测到的事件图,其特征在于电流(最大δG)和事件持续时间(s)的变化。
结论:在包含1M KCl或1M LiCl标准缓冲液的27nm直径的纳米孔中未检测到事件。同样,在包含标准1M KCl或1M LiCl缓冲液的30nm直径的纳米孔中未检测到任何事件。我们的结果表明,使用标准纳米孔缓冲液1M KCl或1M LiCl,不可能在较大的纳米孔中检测较小的分子,如108bp dsDNA。参见图8A-8B。
5.9.16.实施例15:1M CsCl感测溶液可以在27nm和30nm纳米孔中检测108bp的小dsDNA
在我们的以上研究表明1M LiCl和1M KCl缓冲液均不能在27nm和30nm纳米孔装置中检测108bp dsDNA之后,我们测试了1MCsCl感测溶液在27nm和30nm纳米孔中检测108bpdsDNA的能力。
制备基于氯化铯(Fisher Scientific,Cat.#BP1595-1)的纳米孔记录缓冲液,该缓冲液的最终浓度为10mM Tris和1mM EDTA,pH为8.8。制备后,使用0.22um膜(Millipore,Cat.#SCGP00525)将缓冲液无菌过滤,并在将其引入纳米孔之前脱气30分钟。
将1M CsCl感测溶液施加于包含27nm直径的纳米孔或30nm直径的纳米孔的纳米孔装置的顺式和反式体积。
我们将终浓度为10nM的dsDNA样品加载至具有27nm直径的纳米孔装置的顺式体积。接着,我们在纳米孔上施加了100mV的电势以诱导转位并检测108bp dsDNA。在施加电势期间,连续监测通过纳米孔的离子电流。然后分析由电流产生的信号中是否存在由108bpdsDNA分子转位通过27nm纳米孔触发的事件。图8A显示从上述实验检测到的事件图,其特征在于电流(最大δG)和事件持续时间(s)的变化。图8B显示与在含有1M CsCl缓冲液的30nm直径的纳米孔中检测108bp dsDNA相关的事件图。
结论:我们观察到包含1M CsCl的27nm装置能够检测108bp dsDNA,其中捕获速率为88/min。类似地,含有1M CsCl的直径为30nm的纳米孔装置能够检测108bp dsDNA,其中捕获速率为66/min。我们的结果表明,使用1M CsCl感测溶液可以容易地检测较小的分子,例如108bp dsDNA,但不能在标准LiCl或KCL缓冲液中检测到。参见图8A-8B。
5.9.17.实施例16:1M CaCl
该研究的目的是测试1M CaCl
使用直径为53nm的固态纳米孔装置和直径为73nm的固态纳米孔装置,每个装置的顺式和反式体积包含1M CaCl
图16A显示以100mV(正方形)和150mV(圆圈)运行的包含1M CaCl
图17还显示以100mV下运行的包含1M CaCl
结论:我们的结果表明1M CaCl
5.9.18.实施例17:2M和3M CsCl感测溶液增强信噪比,可用于检测较大孔中的较小分子
该研究的目的是确定不同浓度的CsCl感测溶液如何影响大纳米孔中的小分子检测。我们发现高摩尔浓度的CsCl增强108bp DNA转位通过具有30nm纳米孔的固态纳米孔所产生的事件的信噪比。
在直径为30nm的固态纳米孔中,我们在装置的顺式和反式腔室中分别测试了1MCsCl、2M CsCl或3M CsCl。
我们将包含108bp dsDNA的样品以10nM的终浓度加载至顺式体积,并在纳米孔上施加100mV的电压。如实施例14所述收集和分析来自纳米孔装置的信号。
图9A显示用1M CsCl(菱形)、2M CsCl(正方形)和3M CsCl(圆圈)的缓冲液中检测的事件。图9B显示基于电流变化(δG)针对每个缓冲液检测的事件的概率柱状图。
结论:我们观察到较高浓度的CsCl增强检测信噪比,如事件分布向从1M CsCl到2MCsCl以及从2M CsCl到3M CsCl的较大的最大δG的变化所表明。参见图9A-9B。这种增强的信噪比促进检测较大纳米孔中的较小分子。此外,我们观察到标准化捕获率常数从等度的1MCsCl(7/nM*min)到2M CsCl(98/nM*min)增加大于10倍。但是,捕获率没有从2M CsCl增加到3M CsCl(53/nM*min)。
5.9.19.实施例18:摩尔浓度增加的CsCl梯度感测溶液进一步增强信噪比
进行该研究以确定增加的摩尔浓度的CsCl梯度对通过较大纳米孔的小分子产生的信噪比的影响。
单独运行具有30nm直径的孔的固态纳米孔装置,其在顺式体积中具有较高浓度的CsCl,并且在反式体积中具有较低浓度的CsCl,以建立CsCl的梯度。具体而言,以增加的摩尔浓度测试以下梯度:1M/0.5M CsCl、2M/1M CsCl或3M/1.5M CsCl(以顺式体积/反式体积浓度表示)。
接着,我们将包含108bp dsDNA的样品以终浓度10nM 108bp dsDNA添加至顺式体积。在纳米孔上施加100mV的电压。如实施例14所述收集并分析信号。
图10A显示在30nm纳米孔中由10nM 108bp dsDNA产生的事件图,其中缓冲液为1M/0.5M CsCl(菱形)、2M/1M CsCl(正方形)和3M/1.5M CsCl(圆圈),其中浓度是纳米孔两侧的纳米孔装置的顺式/反式腔室的浓度。每个梯度的标准化捕获率随所用CsCl浓度的增加而增加(1M/0.5M CsCl为7/nm*min,2M/1M CsCl为20/nm*min,3M/1.5M CsCl为61/nm*min)。图10B显示针对每个样品获得的最大δG的分布。当与使用等度缓冲液的图9中的类似图比较时,我们观察到使用梯度增加信噪比,从而增强对较大纳米孔中小分子的检测。
结论:我们观察到CsCl梯度感测溶液进一步提高检测信噪比。此外,我们观察到较高浓度的CsCl梯度感测溶液在较高摩尔浓度下显示出捕获率的持续增加,并且使用梯度增加信噪比。例如,当使用的缓冲液是顺式/反式体积中的3M/1.5M CsCl梯度时,最大δG的概率曲线的峰值为约2nS,而当两个腔室中均使用3M CsCl时,最大δG的概率曲线的峰值为约1.2nS。
5.9.20.实施例19:CsCl梯度3M/1.5M感测溶液在90nm和120nm纳米孔中检测74bp和109bp的较小dsDNA
我们使用具有3M/1.5M CsCl梯度(顺式/反式体积)的纳米孔装置在直径为90nm的孔中检测109bp和74bp dsDNA扩增产物。
使用Taq聚合酶根据制造商的说明书(Biotium,Cat.#31014)产生长度为109bp和74bp dsDNA片段。扩增后,使用DNA清洁试剂盒(New England BioLabs,Cat.#T1030S)清洁和纯化dsDNA片段。使用Qubit 3荧光计(ThermoFisher,Cat.#Q33216)测定扩增子的浓度,然后稀释至记录用于纳米孔分析的纳米孔中缓冲液的指定浓度。
我们将来自扩增反应的包含13nM 109bp dsDNA扩增子或20nM 74bp dsDNA扩增子的样品添加至纳米孔装置的顺式腔室,并针对每个样品在纳米孔上施加100mV的电压。如实施例14所述收集并分析信号。
图14显示在具有90nm纳米孔的3M/1.5M CsCl梯度感测溶液中针对浓度为13nM的109bp dsDNA样品或浓度为20nM的74bp dsDNA样品检测的事件图。
结论:我们观察到使用具有3M/1.5M CsCl梯度缓冲液的直径为90nm的纳米孔检测13nM的109bp dsDNA扩增子和20nM的74bp dsDNA扩增子。如所示,容易检测109bp dsDNA和74bp dsDNA。参见图14。
接着,我们使用具有3M/1.5M CsCl梯度的纳米孔装置用102nm纳米孔检测109bp、74bp和58bp dsDNA扩增产物。
如上所述产生长度为109bp、74bp和58bp的dsDNA扩增片段。我们将来自扩增反应的包含13nM 109bp dsDNA扩增子、1.3nM 109bp dsDNA扩增子、20nM 74bp dsDNA扩增子、6.66nM 74bp dsDNA扩增子或20nM 58bp dsDNA扩增子的样品添加到纳米孔装置的顺式腔室,并针对每个样品在纳米孔上施加100mV的电压。如实施例14所述收集并分析信号。
图15显示使用102nm直径的纳米孔和3M/1.5M CsCl梯度感测溶液对每个上述样品进行纳米孔检测的结果。
结论:我们观察到使用CsCl缓冲液可以在102nm纳米孔中容易地检测到58bp、74bp和109bp的dsDNA。此外,几乎所有检测到的事件都在直径为90nm和102nm的孔中达到全深度(持续时间>=72us)。指定浓度下每个dsDNA扩增子的捕获率(事件/分钟)如图15所示。
5.9.21.实施例20:CsCl梯度3M/1.5M感测溶液可以在65nm纳米孔中检测58bp、74bp和108bp的小dsDNA
本研究的目的是测试具有3M/1.5M CsCl梯度的纳米孔装置(顺式/反式腔室)是否能够检测直径为65nm的固态纳米孔中的58bp dsDNA、74bp dsDNA或108bp dsDNA。
具体地,我们提供直径为65nm的固态纳米孔,其顺式体积包含3M CsCl并且反式体积包含1.5M CsCl。对于单个装置,我们将包含108bp dsDNA(终浓度为10nM)、74bp dsDNA(终浓度为5nM)或58bp dsDNA(终浓度为16nM)的样品添加到纳米孔装置的顺式体积中,并在纳米孔上施加100mV的电压。如实施例14所述收集并分析信号。CsCl梯度3M/1.5M感测溶液中由每个58bp dsDNA、74bp dsDNA和108bp dsDNA样品产生的代表性数据显示于图11A-11C。图11A显示针对58bp dsDNA样品检测的事件图。图11B显示针对74bp dsDNA样品检测的事件图。图11C显示针对108bp dsDNA样品检测的事件图。
结论:我们观察到CsCl梯度3M/1.5M感测溶液可以在单独运行的具有65nm纳米孔检测58bp、74bp和108bp dsDNA样品。
5.9.22.实施例21:CsCl梯度3M/1.5M感测溶液可以容易地检测低浓度下25nm和32nm纳米孔中109bp的小dsDNA(20个PCR循环)
本研究的目的是用3M/1.5M CsCl梯度感测溶液测试纳米孔装置,以在各种浓度和不同电压下检测25nm或32nm纳米孔中的109bp dsDNA。
使用上文指定的膜在顺式体积包含3M CsCl和反式体积包含1.5M CsCl的直径25nm的固态纳米孔上运行样品。
使用Taq聚合酶根据制造商的说明书(Biotium,Cat.#31014)通过PCR扩增反应产生109bp dsDNA片段。扩增进行了不同的循环数以提供具有变化的dsDNA浓度的样品。在此,在20个循环、25个循环、30个循环、35个循环和40个循环的扩增之后收集dsDNA样品,以观察在这些条件下在不同浓度下捕获率的变化。扩增后,使用DNA清洁试剂盒清洁和纯化dsDNA片段(New England BioLabs,Cat.#T1030S)。
我们将包含109bp dsDNA的样品添加至顺式体积,并针对每个收集的样品在纳米孔上施加100mV或150mV的电压。如实施例14所述收集并分析信号。
图12显示在不同浓度下(即20个循环、25个循环、30个循环、35个循环和40个循环的扩增)针对109bp dsDNA扩增子使用25nm纳米孔的3M/1.5M CsCl梯度感测溶液的数据。
接着,我们使用上文指定的膜测试顺式体积包含3M CsCl和反式体积包含1.5MCsCl的32nm固态纳米孔。
图13显示在不同浓度下(即20个循环、25个循环、30个循环、35个循环和40个循环的扩增)针对109bp dsDNA扩增子使用32nm纳米孔的3M/1.5M CsCl梯度感测溶液的数据。
结论:我们观察到使用CsCl梯度3M/1.5M感测溶液和25nm或32nm纳米孔,即使在较低的浓度(20个扩增循环)下也可以容易地检测109bp dsDNA样品。
尽管本发明关于几种描述的实施方式相当详细地和具体地进行了说明,但其不是意图将本发明限制于任何这种特例或实施方式或者任何特定实施方式,而是应参照所附权利要求来解释以基于现有技术提供对这些权利要求的最宽的可能解释并因此有效地涵盖本发明的预期范围。另外,段落标题、材料、方法和实施例仅为说明性的而不旨在是限制性的。
6.通过引用并入
本申请中引用的所有出版物、专利、专利申请和其他文献以其整体出于所有目的通过引用并入于此,其程度与单独指出每个单独的出版物、专利、专利申请或其他文献出于所有目的通过引用并入的程度相同。
7.等价物
尽管已经示出和描述了各种具体实施方式,但是以上说明书不是限制性的。应当理解,在不脱离本发明的精神和范围的情况下,可以进行各种改变。通过阅读本说明书,许多变化对于本领域技术人员而言将变得显而易见。
- 用于使用纳米孔装置检测分子的感测组合物、方法和装置
- 用于可逆的离子和分子感测或迁移的纳米孔装置
