3-羟基吡啶-4(H)-酮类衍生物及其制备方法与应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及有机合成和药物化学领域,具体涉及基于3-羟基吡啶-4(H)-酮结构的化合物及其制备方法,以及其在抑制铁死亡中的应用。
背景技术
铁元素在细胞和生物体的基本代谢过程中是必不可少的。人体中的铁不能以一种有规律的方式从体内排出,所以铁的吸收需要严格控制。人体内的铁一旦超载,就会通过铁调节途径引起铁死亡,铁死亡是一种依赖铁离子及活性氧诱导脂质过氧化导致的调节性细胞死亡,其在形态学、生物学及基因水平上区别于细胞凋亡、细胞坏死、细胞自噬的新型的细胞程序性死亡方式。其主要有两种途径:铁调节途径和磷脂氧化的改变,在铁调节途径中,铁转铁蛋白受体1(TfR1)与转铁蛋白结合形成Fe
目前为止,临床上使用的铁螯合剂有去铁胺、去铁酮、地拉罗齐等,但是它们都有一定的缺点。去铁酮是目前临床上用于延缓PD患者症状的比较好的药物,有较好的清除铁效果,但是它容易被葡萄糖代谢掉,后来引入一个代替牺牲位点羟基与葡萄糖发生作用,而使3-羟基吡啶-4(H)-酮更好的发挥螯合铁的能力,已经能证明引入一个羟基后被代谢的速率明显降低,而且能发挥与去铁酮相当的pFe
综上所述,选择3-羟基吡啶-4(H)-酮片段作为铁螯合活性部分,与非天然氨基醇连接可以改善其脂溶性,延缓代谢速度。本发明的化合物通过螯合体中过多的铁和抗氧化以抑制铁死亡而达到治疗相关疾病的作用。
发明内容
本发明基于计算机辅助药物设计、类药性规则、血脑屏障通透性的网址预测等手段设计合成了新型3-羟基吡啶-4(H)-酮类衍生物,基于金属络合基团的抗氧化能力,通过螯合体内过量的铁和抗氧化来达到抑制铁死亡的效果。
为了实现上述目的,本发明提供如下技术方案:
第一方面,本发明提供了一种式(Ⅰ)所示3-羟基吡啶-4(H)-酮类衍生物及其药学上可接受的盐:
式(Ⅰ)中,R
R
进一步,所述3-羟基吡啶-4(H)-酮类衍生物为如下结构:
取代基相同的情况下,S构型普遍比R构效的衍生物铁死亡活性更好。
优选的,R
具体地,式(Ⅰ)所示3-羟基吡啶-4-酮类衍生物为下列化合物之一:
本发明特别优选所述3-羟基吡啶-4(H)-酮类衍生物为化合物3、4、9、10、17、18、19、20、21、22、23、24、27或28,最优选化合物24。
具体地,所述药学上可接受的盐为式(Ⅰ)所示3-羟基吡啶-4(H)-酮类衍生物的盐酸盐。
第二方面,本发明还提供一种上述式(Ⅰ)所示3-羟基吡啶-4(H)-酮类衍生物及其药学上可接受的盐在制备通过抑制铁死亡治疗相关疾病的药物中的应用。优选的,所述疾病为神经退行性疾病或急性肾衰竭。
进一步,所述3-羟基吡啶-4(H)-酮类衍生物为如下结构:
进一步优选所述3-羟基吡啶-4(H)-酮类衍生物为化合物1-32之一。
本发明特别优选所述3-羟基吡啶-4(H)-酮类衍生物为化合物3、4、9、10、17、18、19、20、21、22、23、24、27或28,最优选化合物24。
第三方面,本发明还提供一种式(Ⅰ)所示3-羟基吡啶-4(H)-酮类衍生物的制备方法,合成思路为:式a所示的羟基保护的吡啶酮的制备方法请参考专利CN 112552232A;以式b所示的不同取代基取代的2-溴乙酮为原料合成得到式c所示的N-位侧链取代的3-羟基保护吡啶酮,再通过加入金属催化剂将侧链上的羰基选择性还原为羟基(R和S构型)得到式d所示的化合物,最后脱保护得到式(Ⅰ)所示的目标化合物。
具体地,本发明所述的(Ⅰ)所示3-羟基吡啶-4(H)-酮类衍生物具体按照如下方法制备:
(1)将式a所示羟基保护的吡啶酮、式b所示2-溴乙酮类化合物以及碳酸钾溶于N,N-二甲基甲酰胺(DMF)中,在室温条件下搅拌反应4h,所得反应液A经后处理A,得到式c化合物;所述的式a所示羟基保护的吡啶酮、式b所示2-溴乙酮类化合物与碳酸钾的物质的量之比为1:1.1:1.1;
(2)将步骤(1)所述式c化合物溶于甲醇中,加入金属钌催化剂,在氮气保护、室温条件下室温搅拌1h,再滴加三乙胺和甲酸的混合溶液,滴完后继续室温搅拌反应3h,得到反应液B;所述金属催化剂与式c化合物的物质的量的比是1:0.05~0.15;所述三乙胺和甲酸以式c化合物的物质的量的比是1:0.004:0.0024;所述金属钌催化剂为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌或(S,S)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌;
(3)将步骤(2)所述的式d化合物溶于二氯甲烷中,在氮气保护、-10℃下缓慢滴加1.0mol/L三氯化硼的二氯甲烷溶液,滴毕,继续-10℃下反应30min,转移到室温继续搅拌反应8-12h,所得反应液C经后处理C,得到式(Ⅰ)所示3-羟基吡啶-4(H)-酮类衍生物;步骤(3)中所述的式d化合物与三氯化硼的二氯甲烷溶液中三氯化硼的物质的量之比为1:3~6;
进一步,步骤(1)中所述N,N-二甲基甲酰胺的体积以所述的式a所示2-溴乙酮类化合物的物质的量之计为4-5mL/mmol。
进一步,步骤(1)中所述后处理A为:将所述反应液A倒入分液漏斗水洗、乙酸乙酯萃取,干燥,以100:1、80:1、50:1的二氯甲烷和甲醇的体积比混合溶液进行柱硅胶层析纯化,收集目标产物的洗脱液,减压浓缩、干燥得到式c所示化合物。
进一步,步骤(2)中所述甲醇以式c化合物的物质的量的比是5-10mL/mmol;步骤(2)中所述后处理B为:将反应液B减压浓缩除去溶剂,二氯甲烷萃取,水洗,干燥,以2:1、1:1的石油醚和乙酸乙酯的混合溶剂进行柱层析纯化,收集目标产物的洗脱液,减压浓缩、干燥得到式d化合物。
进一步,步骤(3)中所述二氯甲烷的体积以式d化合物的物质的量计为10-20mL/mmol。
在本发明的一个实施例中,步骤(3)中所述后处理C为:所得反应液C滴加甲醇A淬灭反应,减压蒸馏(除去溶剂),65℃下,滴加甲醇B溶解固体,完全溶解后自然冷却至室温(使产物缓慢析出),(缓慢)加入乙醚,-20℃冷却2h(产物不再析出),抽滤,所得滤饼真空干燥,得到式(Ⅰ)所示3-羟基吡啶-4(H)-酮类衍生物;所述甲醇B与乙醚的体积比为1:5。
进一步,所述甲醇A的体积以式d化合物的物质的量计为15-30mL/mmol。
以上各步骤中的A、B、C等字母只是为了区别不同阶段的物质,无其他特殊含义。
与现有技术相比,本发明有益效果在于:目前存在的铁螯合剂抗铁死亡活性不好,本发明合成了一些新颖的3-羟基吡啶-4(H)-酮类铁螯合剂,创新性的改善了铁螯合剂的抗铁死亡活性,能够有效地抑制铁死亡来治疗相关疾病。
附图说明
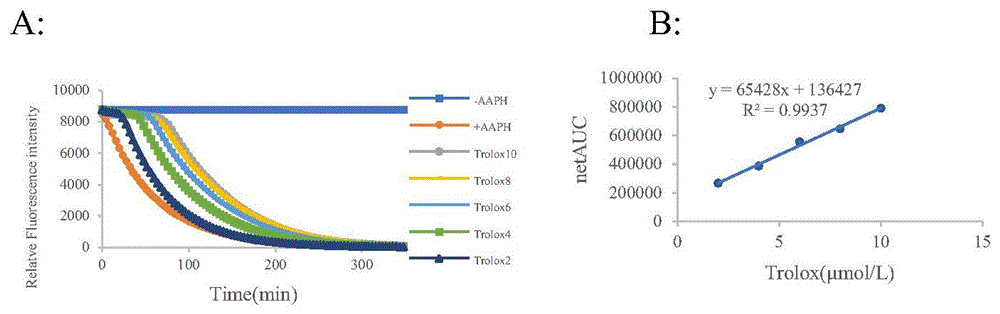
图1Trolox系列浓度溶液荧光衰减曲线(A)及净AUC与浓度标准曲线(B)
图2化合物对HT22细胞毒性
具体实施方式
下面结合具体实例对本发明作进一步的阐述,但本发明不局限于这些实施例。
实施例1
(R)-3-羟基-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮(1)的制备方法:
(1)于单口瓶中加入2-溴苯乙酮(4.38g,22mmol)、3-羟基-2-甲基吡啶-4(1H)-酮(4.31g,20mmol)、碳酸钾(3.04g,22mmol)和DMF(80mL),室温下搅拌4h,反应结束后乙酸乙酯(30mL)萃取,水洗(100mL×6),有机层无水硫酸钠干燥1h。干燥好后过滤,加压浓缩,以100:1、80:1、50:1的二氯甲烷和甲醇的体积比进行柱硅胶层析纯化,收集含目标化合物的洗脱液,减压浓缩得黄色固体3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮(3.28g),收率为56%。
(2)于单口瓶中加入上述黄色固体3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮(1.01g,3mmol),催化剂(S,S)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol)和甲醇(15mL),N
(3)于单口瓶中加入上述灰色固体(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮(335.40mg,1mmol)和二氯甲烷(10mL),氮气保护,-10℃条件下搅拌15min,1.0mol/L的三氯化硼(3mL,溶剂为二氯甲烷)缓慢滴加进反应体系,滴加完后继续-10℃下搅拌30min后转移到室温下反应12h,反应完后滴加甲醇淬灭反应(15mL),结束后将反应液减压浓缩(除去溶剂),将反应瓶放置在65℃的水浴锅中,缓慢滴加甲醇溶解,完全溶解后自然冷却至室温使产物缓慢析出,此时缓慢加入5倍体积量的乙醚,放置冰箱冷却2h至产物不再析出,抽滤,真空干燥,得到白色固体(R)-3-羟基-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮(191.20mg),收率为68%。
m.p.251~252℃;
Hz,1H),7.46(d,J=7.6Hz,2H),7.38(d,J=7.1Hz,3H),7.33(d,J=7.2Hz,1H),6.05(s,1H),4.97(dd,J=9.3,3.4Hz,1H),4.56(dd,J=14.1,3.5Hz,1H),4.41(dd,J=14.0,9.1Hz,1H),2.56(s,3H).
实施例2
(S)-3-羟基-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮(2)的制备方法:
(1)操作步骤同实施例1步骤(1),区别只在于得黄色固体3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮(3.76g,),收率为56%。
(2)操作步骤同实施例1步骤(2),区别只在于将催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol)得到灰色固体(S)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮(653.14mg),收率为65%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮(335.40mg,1mmol),得到白色固体(S)-3-羟基-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮(201.4g),收率为72%。
m.p.251~252℃;
Hz,1H),7.50(d,J=7.0Hz,3H),7.37(dd,J=8.4,6.9Hz,2H),7.32–7.28(m,1H),5.99(s,1H),5.09(dd,J=8.7,3.2Hz,1H),4.45(dd,J=10.1,3.2Hz,1H),4.21(dd,J=10.0,8.7Hz,1H),2.54(s,3H).
实施例3
(R)-1-(2-(4-氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)酮(3)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-4’-氟苯乙酮(4.77g,22mmol),得黄色固体3-(苄氧基)-1-(2-(4-氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.78g),收率为54%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(4-氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.05g,3mmol),得到灰色固体(R)-3-(苄氧基)-1-(2-(4-氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(829.06mg),收率为78%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(4-氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(353.40mg,1mmol),得到白色固体(R)-1-(2-(4-氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)酮(177.74mg),收率为59%。
m.p.230~231℃;
Hz,1H),7.58-7.48(m,3H),7.24-7.16(m,2H),6.01(s,1H),5.09(dd,J=8.5,3.3Hz,1H),4.44(dd,J=10.1,3.4Hz,1H),4.21(dd,J=10.1,8.5Hz,1H),2.53(s,3H).
实施例4
(S)-1-(2-(4-氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)酮(4)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-4’-氟苯乙酮(4.77g,22mmol),得黄色固体3-(苄氧基)-1-(2-(4-氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.87g),收率为55%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(4-氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.05g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol)得到灰色固体(S)-3-(苄氧基)-1-(2-(4-氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(735.77mg),收率为69%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(4-氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(353.40mg,1mmol),得到白色固体(S)-1-(2-(4-氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)酮(148.36mg),收率为50%。
m.p.229~230℃;
7.0,3.6Hz,1H),7.59-7.46(m,3H),7.25-7.15(m,2H),6.00(s,1H),5.09(dd,J=8.5,3.3Hz,1H),4.44(dd,J=10.1,3.4Hz,1H),4.21(ddd,J=12.4,8.9,3.6Hz,1H),2.53(d,J=1.2Hz,3H).
实施例5
(R)-3-羟基-1-(2-羟基-2-(对甲苯基)乙基)-2-甲基吡啶-4(1H)-酮(5)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-4’-甲基苯乙酮(4.69g,22mmol),得黄色固体3-(苄氧基)-2-甲基-1-(2-氧代-2-(对甲苯基)乙基)吡啶-4(1H)-酮(3.50g),收率为50%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-2-甲基-1-(2-氧代-2-(对甲苯基)乙基)吡啶-4(1H)-酮(1.04g,3mmol),得到灰色固体(R)-3-(苄氧基)-1-(2-(4-甲基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(718.08mg),收率为69%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(4-甲基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(349.43mg,1mmol),得到白色固体(R)-3-羟基-1-(2-羟基-2-(对甲苯基)乙基)-2-甲基吡啶-4(1H)-酮(176.57mg),收率为60%。
m.p.226~227℃;
实施例6
(S)-3-羟基-1-(2-羟基-2-(对甲苯基)乙基)-2-甲基吡啶-4(1H)-酮(6)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-4’-甲基苯乙酮(4.69g,22mmol),得黄色固体3-(苄氧基)-2-甲基-1-(2-氧代-2-(对甲苯基)乙基)吡啶-4(1H)-酮(3.37g),收率为49%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-2-甲基-1-(2-氧代-2-(对甲苯基)乙基)吡啶-4(1H)-酮(1.04g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),甲醇(18mL),得到灰色固体(S)-3-(苄氧基)-1-(2-(4-甲基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(738.00mg),收率为70%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(4-甲基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(349.43mg,1mmol),得到白色固体(S)-3-羟基-1-(2-羟基-2-(对甲苯基)乙基)-2-甲基吡啶-4(1H)-酮(207.91mg),收率为70%。
m.p.226~227℃;
实施例7
(R)-1-(2-(4-氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)酮(7)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-4’-氯苯乙酮(5.14g,22mmol),得黄色固体3-(苄氧基)-1-(2-(4-氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.64g),收率为50%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(4-氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.10g,3mmol),得到灰色固体(R)-3-(苄氧基)-1-(2-(4-氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(763.37mg),收率为69%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(4-氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(369.85mg,1mmol),得到白色固体(R)-1-(2-(4-氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)酮(187.49mg),收率为59%。
m.p.227~228℃;
实施例8
(S)-1-(2-(4-氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)酮(8)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-4’-氯苯乙酮(5.14g,22mmol),DMF(90mL),得黄色固体3-(苄氧基)-1-(2-(4-氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.31g),收率为45%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(4-氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.10g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),得到灰色固体(S)-3-(苄氧基)-1-(2-(4-氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(757.82mg),收率为68%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(4-氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(369.85mg,1mmol),得到白色固体(S)-1-(2-(4-氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)酮(192.24mg),收率为61%。
m.p.224~225℃;
实施例9
(R)-3-羟基-1-(2-羟基-2-(4-甲氧基苯基)乙基)-2-甲基吡啶-4(1H)-酮(9)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-4’-甲氧基苯乙酮(5.04g,22mmol),DMF(90mL),得黄色固体3-(苄氧基)-1-(2-(4-甲氧基苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.74g),收率为51%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(4-甲氧基苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.09g,3mmol),得到灰色固体(R)-3-(苄氧基)-1-(2-(4-甲氧基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(748.77mg),收率为68%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(4-甲氧基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(365.43mg,3mmol),得到白色固体(R)-3-羟基-1-(2-羟基-2-(4-甲氧基苯基)乙基)-2-甲基吡啶-4(1H)-酮(191.11mg),收率为61%。
m.p.227~228℃;
6.6,3.1Hz,1H),7.59-7.46(m,2H),7.30(t,J=8.0Hz,1H),7.01(ddd,J=10.3,7.5,2.7Hz,2H),5.89(s,1H),5.34(d,J=8.6Hz,1H),4.40(d,J=10.4Hz,1H),4.09(t,J=9.5Hz,1H),3.83(d,J=2.6Hz,3H),2.54(s,3H).
实施例10
(S)-3-羟基-1-(2-羟基-2-(4-甲氧基苯基)乙基)-2-甲基吡啶-4(1H)-酮(10)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-4’-甲氧基苯乙酮(5.04g,22mmol),DMF(90mL),得黄色固体3-(苄氧基)-1-(2-(4-甲氧基苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.04g),收率为42%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(4-甲氧基苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.09g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),甲醇(18mL),得到灰色固体(S)-3-(苄氧基)-1-(2-(4-甲氧基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(743.29mg),收率为68%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(4-甲氧基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(365.43mg,3mmol),得到白色固体(S)-3-羟基-1-(2-羟基-2-(4-甲氧基苯基)乙基)-2-甲基吡啶-4(1H)-酮(185.81mg),收率为60%。
m.p.226~227℃;
实施例11
(R)-3-羟基-1-(2-羟基-2-(4-(三氟甲基)苯基)乙基)-2-甲基吡啶-4(1H)-酮(11)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-4’-三氟甲基苯乙酮(5.87g,22mmol),DMF(90mL),得黄色固体3-(苄氧基)-2-甲基-1-(2-氧代-2-(4-(三氟甲基)苯基)乙基)吡啶-4(1H)-酮(4.11g),收率为51%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-2-甲基-1-(2-氧代-2-(4-(三氟甲基)苯基)乙基)吡啶-4(1H)-酮(1.20g,3mmol),得到灰色固体(R)-3-(苄氧基)-1-(2-(4-(三氟甲基)苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(1.21g),收率为69%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(4-(三氟甲基)苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(403.40mg,1mmol),得到白色固体(R)-3-羟基-1-(2-羟基-2-(4-(三氟甲基)苯基)乙基)-2-甲基吡啶-4(1H)-酮(208.79mg),收率为60%。
m.p.231~232℃;
实施例12
(S)-3-羟基-1-(2-羟基-2-(4-(三氟甲基)苯基)乙基)-2-甲基吡啶-4(1H)-酮(12)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-4’-三氟甲基苯乙酮(5.87g,22mmol),DMF(90mL),得黄色固体3-(苄氧基)-2-甲基-1-(2-氧代-2-(4-(三氟甲基)苯基)乙基)吡啶-4(1H)-酮(4.15g),收率为52%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-2-甲基-1-(2-氧代-2-(4-(三氟甲基)苯基)乙基)吡啶-4(1H)-酮(1.20g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),得到灰色固体(S)-3-(苄氧基)-1-(2-(4-(三氟甲基)苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(843.51mg),收率为70%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(4-(三氟甲基)苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(403.40mg,1mmol),得到白色固体(S)-3-羟基-1-(2-羟基-2-(4-(三氟甲基)苯基)乙基)-2-甲基吡啶-4(1H)-酮(212.64mg),收率为61%。
m.p.231~232℃;
6.6,2.5Hz,1H),7.75(d,J=2.1Hz,4H),7.56-7.47(m,1H),6.22(s,1H),5.21(dd,J=8.5,3.5Hz,1H),4.51(dd,J=10.1,3.4Hz,1H),4.23(t,J=8.9Hz,1H),2.54(s,3H).
实施例13
(R)-1-(2-(2-氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(13)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-2’-氯苯乙酮(5.14g,22mmol),DMF(90mL),得黄色固体3-(苄氧基)-1-(2-(2-氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.64g),收率为50%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(2-氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.10g,3mmol),甲醇(18mL),得到灰色固体(R)-3-(苄氧基)-1-(2-(2-氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(763.37mg),收率为69%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(2-氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(369.85mg,1mmol),得到白色固体(R)-1-(2-(2-氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(187.49mg),收率为59%。
m.p.220~221℃;
实施例14
(S)-1-(2-(2-氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(14)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-2’-氯苯乙酮(5.14g,22mmol),得黄色固体3-(苄氧基)-1-(2-(2-氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.31g),收率为45%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(2-氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.10g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),得到灰色固体(S)-3-(苄氧基)-1-(2-(2-氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(757.82mg),收率为68%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(2-氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(369.85mg,1mmol),得到白色固体(S)-1-(2-(2-氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(192.24mg),收率为61%。
m.p.220~221℃;
实施例15
(R)-1-(2-(2-氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(15)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-2’-氟苯乙酮(4.77g,22mmol),DMF(90mL),得黄色固体3-(苄氧基)-1-(2-(2-氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.78g),收率为54%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(2-氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.05g,3mmol),甲醇(18mL),得到灰色固体(R)-3-(苄氧基)-1-(2-(2-氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(829.06mg),收率为78%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(2-氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(353.40g,1mmol),得到白色固体(R)-1-(2-(2-氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(177.74mg),收率为59%。
m.p.219~220℃;
Hz,1H),7.65(td,J=7.7,1.9Hz,1H),7.51(d,J=6.7Hz,1H),7.37(q,J=6.9Hz,1H),7.22(dt,J=15.5,5.1Hz,2H),6.13(s,1H),5.33(dd,J=8.5,2.8Hz,1H),4.43(dd,J=10.1,3.2Hz,1H),4.28(t,J=9.6Hz,1H),2.53(s,3H).
实施例16
(S)-1-(2-(2-氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(16)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-2’-氟苯乙酮(4.77g,22mmol),得黄色固体3-(苄氧基)-1-(2-(2-氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.87g),收率为55%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(2-氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.05g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),甲醇(18mL),得到灰色固体(S)-3-(苄氧基)-1-(2-(2-氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(735.77mg),收率为69%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(2-氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(353.40g,1mmol),得到白色固体(S)-1-(2-(2-氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(148.36mg),收率为50%。
m.p.209~210℃;
实施例17
(R)-3-羟基-1-(2-羟基-2-(2-甲氧基苯基)乙基)-2-甲基吡啶-4(1H)-酮(17)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-2’-甲氧基苯乙酮(5.04g,22mmol),得黄色固体3-(苄氧基)-1-(2-(2-甲氧基苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.74g),收率为51%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(2-甲氧基苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.09g,3mmol),得到灰色固体(R)-3-(苄氧基)-1-(2-(2-甲氧基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(748.77mg),收率为68%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(2-甲氧基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(365.43mg,3mmol),得到白色固体(R)-3-羟基-1-(2-羟基-2-(2-甲氧基苯基)乙基)-2-甲基吡啶-4(1H)-酮(191.11mg),收率为61%。
m.p.218~219℃;
6.8,2.6Hz,1H),7.59-7.44(m,2H),7.30(t,J=7.9Hz,1H),7.07–6.95(m,2H),5.87(s,1H),5.34(d,J=8.6Hz,1H),4.40(dd,J=10.4,2.9Hz,1H),4.16-4.05(m,1H),3.83(d,J=2.0Hz,3H),2.54(s,3H).
实施例18
(S)-3-羟基-1-(2-羟基-2-(2-甲氧基苯基)乙基)-2-甲基吡啶-4(1H)-酮(18)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-2’-甲氧基苯乙酮(5.04g,22mmol),得黄色固体3-(苄氧基)-1-(2-(2-甲氧基苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.04g),收率为42%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(2-甲氧基苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.09g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),得到灰色固体(S)-3-(苄氧基)-1-(2-(2-甲氧基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(743.29mg),收率为68%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(2-甲氧基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(365.43mg,3mmol),得到白色固体(S)-3-羟基-1-(2-羟基-2-(2-甲氧基苯基)乙基)-2-甲基吡啶-4(1H)-酮(185.81mg),收率为60%。
m.p.216~217℃;
6.6,3.1Hz,1H),7.59-7.46(m,2H),7.30(t,J=8.1Hz,1H),7.01(td,J=7.8,4.0Hz,2H),5.89(s,1H),5.34(d,J=8.6Hz,1H),4.40(d,J=10.4Hz,1H),4.09(t,J=9.5Hz,1H),3.83(d,J=2.5Hz,3H),2.54(s,3H).
实施例19
(R)-1-(2-(3-氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(19)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-3’-氯苯乙酮(5.14g,22mmol),得黄色固体3-(苄氧基)-1-(2-(3-氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.64g),收率为50%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(3-氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.10g,3mmol),得到灰色固体(R)-3-(苄氧基)-1-(2-(3-氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(763.37mg),收率为69%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(3-氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(369.85mg,1mmol),得到白色固体(R)-1-(2-(3-氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(187.49mg),收率为59%。
m.p.217~218℃;
实施例20
(S)-1-(2-(3-氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(20)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-3’-氯苯乙酮(5.14g,22mmol),得黄色固体3-(苄氧基)-1-(2-(3-氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.31g),收率为45%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(3-氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.10g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),得到灰色固体(S)-3-(苄氧基)-1-(2-(3-氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(757.82mg),收率为68%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(3-氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(369.85mg,1mmol),得到白色固体(S)-1-(2-(3-氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(192.24mg),收率为61%。
m.p.215~216℃;
Hz,1H),7.58(s,1H),7.54-7.45(m,2H),7.39(dq,J=13.7,8.2,6.6Hz,2H),6.12(s,1H),5.11(dd,J=8.5,3.4Hz,1H),4.48(dd,J=9.9,3.1Hz,1H),4.23(q,J=8.9,8.1Hz,1H),2.53(s,3H).
实施例21
(R)-1-(2-(3-氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(21)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-3’-氟苯乙酮(4.77g,22mmol),得黄色固体3-(苄氧基)-1-(2-(3-氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.78g),收率为54%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(3-氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.05g,3mmol),得到灰色固体(R)-3-(苄氧基)-1-(2-(3-氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(829.06mg),收率为78%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(3-氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(353.40mg,1mmol),得到白色固体(R)-1-(2-(3-氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(177.74mg),收率为59%。
m.p.202~203℃;
实施例22
(S)-1-(2-(3-氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(22)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-3’-氟苯乙酮(4.77g,22mmol),得黄色固体3-(苄氧基)-1-(2-(3-氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.87g),收率为55%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(3-氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.05g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),甲醇(18mL),得到灰色固体(S)-3-(苄氧基)-1-(2-(3-氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(735.77mg),收率为69%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(3-氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(353.40mg,1mmol),得到白色固体(S)-1-(2-(3-氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(148.36mg),收率为50%。
m.p.201~202℃;
Hz,1H),7.58-7.46(m,1H),7.46-7.38(m,1H),7.34(d,J=8.8Hz,2H),7.14(d,J=8.8Hz,1H),6.08(s,1H),5.12(dd,J=8.5,3.3Hz,1H),4.48(dd,J=10.0,3.3Hz,1H),4.23(q,J=8.8Hz,1H),2.53(s,3H).
实施例23
(R)-1-(2-(3,4-二氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(23)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-3’,4’-二氟苯乙酮(5.17g,22mmol),DMF(90mL),得黄色固体3-(苄氧基)-1-(2-(3,4-二氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.71g),收率为50%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(3,4-二氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.11g,3mmol),得到灰色固体(R)-3-(苄氧基)-1-(2-(3,4-二氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(793.29mg),收率为71%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(3,4-二氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(371.39mg,1mmol),得到白色固体(R)-1-(2-(3,4-二氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(210.23mg),收率为60%。
m.p.221~222℃;
6.6,3.4Hz,1H),7.58(dd,J=11.8,8.2Hz,1H),7.53-7.39(m,2H),7.36(d,J=8.4Hz,1H),6.19(s,1H),5.10(dd,J=8.5,3.3Hz,1H),4.47(dd,J=10.1,3.3Hz,1H),4.25-4.16(m,1H),2.53(s,3H).
实施例24
(S)-1-(2-(3,4-二氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(24)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-3’,4’-二氟苯乙酮(5.17g,22mmol),DMF(90mL),得黄色固体3-(苄氧基)-1-(2-(3,4-二氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.68g),收率为50%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(3,4-二氟苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.11g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),得到灰色固体(S)-3-(苄氧基)-1-(2-(3,4-二氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(784.38mg),收率为70%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(3,4-二氟苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(371.39mg,1mmol),得到白色固体(S)-1-(2-(3,4-二氟苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(215.48mg),收率为62%。
m.p.221~222℃;
6.5,2.5Hz,1H),7.57(dd,J=11.8,8.1Hz,1H),7.52-7.40(m,2H),7.36(d,J=8.4Hz,1H),6.17(s,1H),5.10(dd,J=8.6,3.4Hz,1H),4.47(dd,J=10.1,3.4Hz,1H),4.21(t,J=8.8Hz,1H),2.53(s,3H).
实施例25
(R)-1-(2-(3,4-二甲氧基苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(25)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-3’,4’-二甲氧基苯乙酮(5.70g,22mmol),得黄色固体3-(苄氧基)-1-(2-(3,4-二甲氧基苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.95g),收率为50%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(3,4-二甲氧基苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.18g,3mmol),得到灰色固体(R)-3-(苄氧基)-1-(2-(3,4-二甲氧基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(815.04mg),收率为69%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(3,4-二甲氧基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(395.46mg,1mmol),得到白色固体(R)-1-(2-(3,4-二甲氧基苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(177.49mg),收率为50%。
m.p.224~225℃;
Hz,1H),7.49(d,J=6.7Hz,1H),7.10(s,1H),6.99(d,J=8.4Hz,1H),6.93(d,J=8.3Hz,1H),5.85(s,1H),5.01(d,J=8.2Hz,1H),4.41(d,J=9.4Hz,1H),4.21(t,J=9.3Hz,1H),3.75(d,J=10.5Hz,6H),2.53(s,3H).
实施例26
(S)-1-(2-(3,4-二甲氧基苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(26)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-3’,4’-二甲氧基苯乙酮(5.70g,22mmol),得黄色固体3-(苄氧基)-1-(2-(3,4-二甲氧基苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(4.03g),收率为51%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(3,4-二甲氧基苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.18g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),得到灰色固体(S)-3-(苄氧基)-1-(2-(3,4-二甲氧基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(775.89mg),收率为65%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(3,4-二甲氧基苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(395.46mg,1mmol),得到白色固体(S)-1-(2-(3,4-二甲氧基苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(181.06mg),收率为51%。
m.p.221~222℃;
Hz,1H),7.49(d,J=6.7Hz,1H),7.10(s,1H),6.99(d,J=8.5Hz,1H),6.93(d,J=8.3Hz,1H),5.85(s,1H),5.01(d,J=8.2Hz,1H),4.41(d,J=9.4Hz,1H),4.21(t,J=9.3Hz,1H),3.75(d,J=10.5Hz,6H),2.53(s,3H).
实施例27
(R)-1-(2-(3,4-二氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(27)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-3’,4’-二氯苯乙酮(5.89g,22mmol),得黄色固体3-(苄氧基)-1-(2-(3,4-二氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(4.15g),收率为52%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(3,4-二氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.20g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),甲醇(18mL),得到灰色固体(R)-3-(苄氧基)-1-(2-(3,4-二氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(839.30mg),收率为69%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(3,4-二氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(404.29mg,1mmol),得到白色固体(R)-1-(2-(3,4-二氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(170.75mg),收率为49%。
m.p.224~225℃;
实施例28
(S)-1-(2-(3,4-二氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(28)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-3’,4’-二氯苯乙酮(5.89g,22mmol),得黄色固体3-(苄氧基)-1-(2-(3,4-二氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(3.82g),收率为48%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-1-(2-(3,4-二氯苯基)-2-氧代乙基)-2-甲基吡啶-4(1H)-酮(1.20g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),得到灰色固体(S)-3-(苄氧基)-1-(2-(3,4-二氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(839.30mg),收率为69%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(3,4-二氯苯基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(404.29mg,1mmol),得到白色固体(S)-1-(2-(3,4-二氯苯基)-2-羟乙基)-3-羟基-2-甲基吡啶-4(1H)-酮(176.01mg),收率为50%。
m.p.223~224℃;
实施例29
(R)-3-羟基-1-(2-羟基-2-(萘-2-基)乙基)-2-甲基吡啶-4(1H)-酮(29)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-2’-萘乙酮(5.46g,22mmol),得黄色固体3-(苄氧基)-2-甲基-1-(2-(萘-2-基)-2-氧代乙基)吡啶-4(1H)-酮(3.97g),收率为52%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-2-甲基-1-(2-(萘-2-基)-2-氧代乙基)吡啶-4(1H)-酮(1.15g,3mmol),得到灰色固体(R)-3-(苄氧基)-1-(2-(萘-2-基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(832.60mg),收率为72%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-(萘-2-基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(385.46mg,1mmol),得到白色固体(R)-3-羟基-1-(2-羟基-2-(萘-2-基)乙基)-2-甲基吡啶-4(1H)-酮(175.19mg),收率为53%。
m.p.203~204℃;
8.27(dd,J=6.8,2.3Hz,1H),8.16(s,1H),8.05-7.89(m,3H),7.75(d,J=8.6Hz,1H),7.69-7.63(m,1H),7.57(dt,J=5.9,2.5Hz,2H),5.75(dd,J=8.2,4.9Hz,1H),5.06-4.96(m,1H),4.96-4.86(m,1H),2.54(s,3H).
实施例30
(S)-3-羟基-1-(2-羟基-2-(萘-2-基)乙基)-2-甲基吡啶-4(1H)-酮(30)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为2-溴-2’-萘乙酮(5.46g,22mmol),得黄色固体3-(苄氧基)-2-甲基-1-(2-(萘-2-基)-2-氧代乙基)吡啶-4(1H)-酮(3.73g),收率为49%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-2-甲基-1-(2-(萘-2-基)-2-氧代乙基)吡啶-4(1H)-酮(1.15g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),得到灰色固体(S)-3-(苄氧基)-1-(2-(萘-2-基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(823.35mg),收率为71%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-(萘-2-基)-2-羟乙基)-2-甲基吡啶-4(1H)-酮(385.46mg,1mmol),得到白色固体(S)-3-羟基-1-(2-羟基-2-(萘-2-基)乙基)-2-甲基吡啶-4(1H)-酮(187.13mg),收率为56%。
m.p.203~204℃;
Hz,1H),8.16(s,1H),8.02-7.92(m,3H),7.75(d,J=8.6Hz,1H),7.65(d,J=6.8Hz,1H),7.58(dd,J=6.5,3.3Hz,2H),5.75(dd,J=8.2,4.9Hz,1H),5.01(t,J=9.7Hz,1H),4.91(dd,J=11.7,4.8Hz,1H),2.54(s,3H).
实施例31
(R)-3-羟基-1-(2-羟基-2-(吡啶-3-基)乙基)-2-甲基吡啶-4(1H)-酮(31)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为3-(2-溴乙酰基)吡啶氢溴酸盐(4.38g,22mmol),得黄色固体3-(苄氧基)-2-甲基-1-(2-氧代-2-(吡啶-3-基)乙基)吡啶-4(1H)-酮(3.39g),收率为51%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-2-甲基-1-(2-氧代-2-(吡啶-3-基)乙基)吡啶-4(1H)-酮(1.00g,3mmol),得到灰色固体(R)-3-(苄氧基)-1-(2-羟基-2-(吡啶-3-基)乙基)-2-甲基吡啶-4(1H)-酮(701.38mg),收率为70%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(R)-3-(苄氧基)-1-(2-羟基-2-(吡啶-3-基)乙基)-2-甲基吡啶-4(1H)-酮(336.39mg,1mmol),得到白色固体(R)-3-羟基-1-(2-羟基-2-(吡啶-3-基)乙基)-2-甲基吡啶-4(1H)-酮(144.75mg),收率为51%。
m.p.240~241℃;
实施例32
(S)-3-羟基-1-(2-羟基-2-(吡啶-3-基)乙基)-2-甲基吡啶-4(1H)-酮(32)的制备方法
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为3-(2-溴乙酰基)吡啶氢溴酸盐(4.38g,22mmol),得黄色固体3-(苄氧基)-2-甲基-1-(2-氧代-2-(吡啶-3-基)乙基)吡啶-4(1H)-酮(3.97g),收率为59%。
(2)操作步骤同实施例1步骤(2),区别只在于将3-(苄氧基)-2-甲基-1-(2-氧代-2-苯基乙基)吡啶-4(1H)-酮替换为3-(苄氧基)-2-甲基-1-(2-氧代-2-(吡啶-3-基)乙基)吡啶-4(1H)-酮(1.00g,3mmol),催化剂替换为(R,R)-N-(对甲苯磺酰)-1,2-二苯乙烷二胺(对异丙基苯)氯化钌(95.43mg,0.15mmol),得到灰色固体(S)-3-(苄氧基)-1-(2-羟基-2-(吡啶-3-基)乙基)-2-甲基吡啶-4(1H)-酮(699.36mg),收率为69%。
(3)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为(S)-3-(苄氧基)-1-(2-羟基-2-(吡啶-3-基)乙基)-2-甲基吡啶-4(1H)-酮(336.39mg,1mmol),得到白色固体(S)-3-羟基-1-(2-羟基-2-(吡啶-3-基)乙基)-2-甲基吡啶-4(1H)-酮(143.06mg),收率为51%。
m.p.240~241℃;
实施例33
3-羟基-2-甲基-1-苯乙基吡啶-4(H)-酮(33)的制备方法:
(1)操作步骤同实施例1步骤(1),区别只在于将2-溴苯乙酮替换为β-溴苯乙烷(4.07g,22mmol),得黄色固体3-(苄氧基)-2-甲基-1-苯乙基吡啶-4(1H)-酮(3.77g),收率为59%。
(2)操作步骤同实施例1步骤(3),区别只在于将(R)-3-(苄氧基)-1-(2-羟基-2-苯基乙基)-2-甲基吡啶-4(1H)-酮替换为3-(苄氧基)-2-甲基-1-苯乙基吡啶-4(1H)-酮(319.16mg,1mmol),得到白色固体3-羟基-2-甲基-1-苯乙基吡啶-4(H)-酮(116.93mg),收率为51%。
m.p.231~232℃;
Hz,1H),7.34–7.24(m,4H),7.22(d,J=1.7Hz,1H),7.20(d,J=1.3Hz,1H),4.58(dd,J=8.1,6.7Hz,2H),3.10(t,J=7.4Hz,2H),2.51(s,3H).
实施例34
以下是本发明部分化合物的药理实验数据:
1、化合物对铁离子螯合能力的测定
根据分光光度法原理,采用一套自动滴定系统对pK
pK
Logβ1的测定:向光路为50mm的石英比色皿中加入45mL浓度为0.1M的氯化钾溶液,校正基线,用1.5M的盐酸酸化至pH约为2.1。加入60μL浓度为50mM的工作溶液,稳定2min。按照配体/铁离子=1.1/1加入FeCl
Logβ2和Logβ3的测定:向光程为50mm的石英比色皿中加45mL浓度为0.1M的KCl溶液。待光谱稳定再校正基线。采用1.5M的盐酸酸化至pH约为2.5。加入浓度为50mM的待测化合物溶液,稳定2min。按配体/铁离子=5/1的比例加入FeCl
以上pH稳定的判定标准为:当pH值在3秒内变化不超过0.001时,可认为pH读数稳定,过程所测得的所有数据都通过内部的Visual Basic程序记录并备份,根据以上方法测定的pK
结果表明实施例1~32中半数以上的pFe
表1.实施例1~32的pFe
a:Compounds were measured in 0.1M KCl.
b:文献Xie YY,Lu ZD,Kong XL,Zhou T,Bansal S,Hider R.Systematiccomparison of the mono-,dimethyl-and trimethyl3-hydroxy-4(1H)-pyridones-Attempted optimization of the orally active iron chelator,deferiprone.Eur JMed Chem 2016;115:132-140)报道的Deferiprone
2.化合物抗氧化能力的测定
化合物进行抗氧化活性研究,采用ABTS和ORAC两种测试方案对化合物进行抗氧化研究,综合两种方案结果筛选出抗氧化活性较好的化合物。
2.1ABTS
ABTS(2,2’-叠氮基-双-(3-乙基苯并二氢噻唑啉)-6-磺酸)与过硫酸钾(K
抗氧化结果如表2所示,可以明显看出大部分化合物的抗氧化能力都比Trolox强,其中10的抗氧化能力最强(5.22±1.61),综合数据结果,S构型的抗氧化能力要比R构型更优。
表2实施例1~31的ABTS抗氧化结果
2.2ORAC
抗氧化能力指数(Oxygen radical absorbance capacity,ORAC)检测方法是目前抗氧化研究领域较常用的一种方法。此方法利用荧光素钠(Sodium Fluorescein)为荧光指示剂,2,2'-偶氮二异丁基脒二盐酸盐(AAPH)提供过氧自由基,维生素E水溶性类似物Trolox为定量标准,以抗氧化物对荧光强度的衰减作为其抗氧化能力的标准。(1)标准溶液Trolox和待测样品溶液配制:精密称取Trolox标准品和化合物配置成10mM的浓度作为母液,-20℃避光储存。将母液用磷酸盐缓冲液(PBS,pH=7.4)稀释至20、40、60、80、100μM系列浓度。(2)荧光素钠溶液的配制:精密称取荧光素钠用DMSO配制成10mM的母液,再用PBS稀释至65nM。(3)AAPH溶液的配制:精密称取AAPH直接用PBS配制成20mM。设置酶标仪参数,将上述所示的溶液配制好,先用移液枪将40μL不同浓度的待测化合物或Trolox加入到黑色96孔板中,再用排枪将80μL的荧光素钠溶液加入到黑色96孔板中,在37℃下孵育并振摇5min,最后在1min内用排枪向96孔中加入80μL的AAPH,震荡30s后进行读数。以激发波长(Excitation wavelength,Ex)485nm、发射波长(Emission wavelength,Em)538nm连续测定荧光强度,整个体系保持37℃,每隔5min测定一次荧光强度,测定300min,每个组平行测定三次,结果如图1所示。
用GraphPad Prism 8.0软件计算化合物不同浓度下的净面积(net AUC),根据回归方程分别计算不同浓度下的待测化合物的ORAC当量(μmol/L Trolox eq.),选取两个浓度的ORAC结果如表3所示,实施例24的抗氧化活性最高。
表3实施例1~32的ORAC结果
综合ABTS和ORAC的抗氧化活性以及铁螯合活性的结果,实施例3、4、9、10、17、18、19、20、21、22、23、24、27、28的抗氧化活性以及铁螯合活性是最好的,抑制铁死亡的方法都是从这两个方面出发,所以,所述化合物具有抑制铁死亡活性的潜力。接下来对实施例3、4、9、10、17、18、19、20、21、22、23、24、27、28进行对erastin诱导的铁死亡的抑制活性研究。
3.化合物对HT22细胞的毒性
HT22(小鼠海马神经元细胞)对铁死亡敏感,先研究了实施例3、4、9、10、17、18、19、20、21、22、23、24、27、28对HT22的毒性,排除自身毒性对结果的影响。将HT22细胞接种于96孔板(8000/孔)中,培养箱中培养24h。弃去培养基,加入含不同浓度的药物的培养基,设置不含有药物的培养基为空白对照,培养箱中培养24h。MTT法测定细胞存活率,结果如图2所示。可以发现,所选化合物和阳性药DFP一样在150μM时都没有表现出明显的毒性,在200μM时虽表现些许毒性但细胞存活率都在90%以上。综上所述,所述化合物对HT22细胞基本没有表现出明显的毒性。
4.体外抑制HT22细胞铁死亡的活性检测
将HT22细胞接种于96孔板(8000/孔)中,培养箱中培养24h。弃去培养基,加入含不同浓度的药物的培养基和含有erastin(10μM)的培养基,设置不含有药物的培养基为空白对照,培养箱中培养24h。24h后MTT法测定细胞存活率,GraphPad Prism 8软件计算EC
表4所选实施例的抑制铁死亡EC
注:化合物33为专利CN 115850163 A所设计的化合物,CN128为专利CN111170936A所设计的化合物。
/>
- 2,3-二氢-1H-喹啉-4-酮类缩氨基硫脲衍生物及其制备方法和应用
- 4-羟基-3-取代-噻唑烷-2-酮类化合物的制备方法
- 3-羟基吡啶-4-酮类衍生物及在抑制肾细胞铁死亡中的应用
- 一种3-氰基-4-羟基-2-吡啶酮类化合物及其制备和应用
