灭活形式的人腺病毒5型在制备核酸标准物质中的应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于生物技术领域,涉及灭活形式的人腺病毒5型在制备核酸标准物质中的应用。
背景技术
病毒、细菌、支原体、真菌等病原微生物是临床常见呼吸道感染源,可通过接触、飞沫和气溶胶传播。随着分子生物学技术的发展和核酸检测技术的普及,核酸检测已广泛应用于呼吸道病原微生物快速检测,多种呼吸道病原微生物核酸检测试剂盒被设计开发和应用,实现对患者的快速精准诊断。
核酸标准物质可以保证核酸检测结果的可靠与一致,可以实现核酸检测的计量溯源与质量控制。现有的核酸标准物质多为体外制备核酸片段(DNA或RNA片段)、提取基因组核酸或包含部分片段的假病毒等形式,各种形式的标准物质都各有利弊,体外制备的核酸分子,一般纯度较高,定值可靠,但是容易受核酸酶(RNase)降解,稳定性差,且体外制备核酸分子结构简单,与病毒粒子不同,无须经过病毒裂解、核酸释放的过程,不能对核酸提取过程进行质控;假病毒形式的标准物质具有蛋白质外壳结构,内含特异性病毒RNA,在形态和结构上与天然病毒粒子相似,但是假病毒形式的标准物质一般只能包装较短的核酸片段,无法包含病毒的全基因组序列核酸,无法包含试剂盒的所有检测靶点。同时,现有的核酸标准物质研发多集中于新型冠状病毒核酸检测领域,其他的呼吸道传播病原微生物诊断方法缺乏有证标准物质,无法保证相关检测结果的量值溯源。
综上所述,现有核酸标准物质与实际病原体差距较大,不能实现所有方法检测靶标的覆盖,或不能实现检测方法全过程质控,不适应现有检测技术的发展,现有的商品化呼吸道病原微生物核酸检测试剂盒中,作为阳性对照的质控品多由各厂家自行制备提供,缺乏统一的质量控制和量值标定,不具备公正、可靠的计量溯源功能,因此,急需研制开发与病原体高度接近核酸标准物质。
发明内容
针对现有技术的不足和实际需求,本发明提供灭活形式的人腺病毒5型在制备核酸标准物质中的应用,以期解决现有的核酸标准物质不能涵盖样品提取环节或不能包括病原体全基因组核酸等问题。
为达上述目的,本发明采用以下技术方案:
第一方面,本发明提供灭活形式的人腺病毒5型Human adenovirus 5VR-1516在制备核酸标准物质中的应用。
本发明中,为填补现有技术空白,本发明针对人腺病毒5型,研制了灭活病毒形式的标准物质,通过病毒培养与浓缩、病毒灭活方法研究、病毒灭活效果验证、核酸提取方法研究、定值方法建立与优化、均匀性检验、稳定性监测等研究,确保标准物质的生物安全性、适用性及量值准确性,大大提升标准物质的实用性,并在多家试剂盒生产企业开展应用验证,为相关呼吸道病原微生物核酸检测市场监管提供计量技术保障。
优选地,所述标准物质中灭活形式的人腺病毒5型Human adenovirus 5VR-1516的浓度为800~1400拷贝数(copies)/μL,包括但不限于810拷贝数/μL、850拷贝数/μL、900拷贝数/μL、950拷贝数/μL、1000拷贝数/μL、1200拷贝数/μL、1300拷贝数/μL、1350拷贝数/μL或1380拷贝数/μL等,不再一一列举。
第二方面,本发明提供第一方面所述的核酸标准物质的制备方法,所述方法包括:
制备人腺病毒5型Human adenovirus 5VR-1516的病毒液,对所述病毒液进行灭活处理,即得到所述核酸标准物质。
优选地,所述病毒液的制备方法包括:
对人腺病毒5型Human adenovirus 5VR-1516进行传代培养,收集上清,去除细胞和细胞碎片,得到病毒液。
优选地,所述传代培养使用的宿主细胞包括Hela-229细胞。
优选地,所述传代培养的培养基为EMEM培养基(1%双抗,2%FBS)。
优选地,所述灭活处理包括:
将所述病毒液与β-丙内酯混合,进行灭活反应。
优选地,所述灭活反应的温度为18~25℃,包括但不限于19℃、20℃、21℃、22、23℃或24℃等,时间为18~24h,包括但不限于19h、20h、21h、22h或23h等。
优选地,所述β-丙内酯的工作浓度为0.05%~0.15%,包括但不限于0.08%、0.1%、0.12%、0.13%或0.14%等。
第三方面,本发明提供一种第一方面所述的核酸标准物质的定值方法,所述方法包括:
以第一方面所述的核酸标准物质中核酸为模板,与引物和探针及扩增试剂混合,进行数字PCR,根据数字PCR结果计算灭活形式的人腺病毒5型Human adenovirus 5VR-1516的浓度。
优选地,所述引物的核酸序列包括SEQ ID NO.1和SEQ ID NO.2所示的序列。
优选地,所述探针的核酸序列包括SEQ ID NO.3所示的序列。
SEQ ID NO.1:GGACAGGACGCTTCGGAGTA。
SEQ ID NO.2:CTTGTTCCCCAGACTGAAGTAGGT。
SEQ ID NO.3:TGCAGTTCGCCCGCGCC。
优选地,所述引物的浓度为200~600nM,包括但不限于210nM、220nM、240nM、300nM、400nM或500nM,探针的浓度为100~400nM,包括但不限于110nM、150nM、200nM、300nM、350nM或380nM,优选为引物600nM、探针100nM。
优选地,所述数字PCR的退火温度为50℃~60℃,包括但不限于51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃或59℃,优选为54℃。
本发明针对标准物质设计特定的定值检测方法,能够实现高准确性、特异性、稳定性和灵敏度检测。
第四方面,本发明提供第一方面所述的核酸标准物质在检测人腺病毒5型中的应用。
第五方面,本发明提供一种检测人腺病毒5型的试剂盒,所述试剂盒包括第一方面所述的核酸标准物质。
第六方面,本发明提供一种检测人腺病毒5型的方法,所述方法以第一方面所述的核酸标准物质为质控品进行检测。
本发明的检测人腺病毒5型的方法还可应用于以非疾病诊断为目的的环境样本检测、病毒基础研究等等领域。
与现有技术相比,本发明具有以下有益效果:
本发明针对人腺病毒5型,通过病毒培养与浓缩、病毒灭活方法研究、病毒灭活效果验证、核酸提取方法研究、定值方法建立与优化、均匀性检验、稳定性监测等研究,确保标准物质的生物安全性、适用性及量值准确性,并在多家试剂盒生产企业开展应用验证,为相关呼吸道病原微生物核酸检测市场监管提供计量技术保障。
附图说明
图1为人腺病毒5型引物探针数字PCR扩增信号区分图;
图2为数字PCR特异性验证扩增结果;
图3为人腺病毒5型标准物质试剂盒扩增结果。
具体实施方式
为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道购买获得的常规产品。
实施例1
本实施例制备人腺病毒5型核酸标准物质。
1、人腺病毒5型的培养
选择来源于美国美国细胞培养物收藏中心(American Type CultureCollection,ATCC)的人腺病毒5型作为标准物质制备原料,病毒具体编号、名称及毒株信息见表1。
表1
由中国科学院上海免疫与感染研究所对病毒进行培养与浓缩,宿主细胞及培养方式见表2。
表2
病毒具体的培养步骤如下:
(1)将病毒进行全基因组测序,确认病毒序列无误;
(2)按照上述表2中的方式培养宿主细胞和病毒;
(3)收集病毒(P2实验室中进行),将保存毒株活化培养传代后培养4天,收集上清,2000rpm离心10分钟,去除细胞和细胞碎片,使用0.45μm滤膜过滤除去细小颗粒;
(4)通过TCID
TCID
A.向96板中加入2W个细胞,放置于适当温度。5%CO
B.洗掉培养基,加入100μL经10倍倍比稀释的病毒(10
C.吸出病毒液,分两次加入含有1μg/mL TPCK,1%双抗的EMEM,洗掉残留的病毒液,最后加入新鲜的上述培养基放在最适温度,5%CO
D.测定血凝。用Reed-Muench方法测病毒滴度并表示为TCID
2、病毒灭活
(1)在冰浴条件下,取病毒液500μL,加入β-丙内酯,使其终浓度为0.1%。然后置于25℃反应,轻轻摇晃过夜;
(2)灭活好的病毒离心使沉淀的病毒颗粒化。取上清液进行细胞培养,确定是否仍存在活性病毒;
(3)测定灭活后的病毒浓度,采用荧光PCR法测定灭活后病毒的Ct值,估算灭活过程中的损失。
3、病毒灭活后活性测定
1)为了确保灭活后的病毒没有活性,将灭活后的病毒重新接种培养,再培养病毒稀释浓度为10
2)向细胞培养孔中加入病毒后每次取样取出500μL培养液(250μL*2管),再补充500μL的培养基,用于荧光PCR法测定病毒浓度Ct值,连续培养一周;
3)起初,灭活后病毒浓度有一个Ct值,随着培养的进行,没有活性的病毒Ct值不会变小,而有活性的病毒Ct值会变小。
通过活性测定实验结果得出,病毒的灭活效率达100%。培养过程中,通过显微镜观察,灭活前、灭活后和空白对照细胞状态,可发现明显差异。灭活后流病毒稀释再培养,可看出灭活后病毒培养无病毒繁殖。灭活前病毒Ct值在降低,可证明病毒在繁殖,灭活后病毒Ct值在上升,证明病毒在后续培养中没有繁殖现象。
4、灭活病毒颗粒的的分装
将病毒进行数字PCR初步定值,按照一定的比例进行稀释,稀释液为广州邦德盛生物公司生产的样品保存液(粤穗械备20160299号)。随后进行分装,每种灭活病毒分别分装200管,每管210μL,分装完成后立即置于-80℃~-70℃条件下保存。
实施例2
本实施例建立灭活病毒标准物质数字PCR定值方法。
1、病毒核酸提取方法优化
1.1病毒核酸提取试剂盒的选择
选取5种市场上较常见的病毒核酸提取试剂盒(英潍捷基(货号12280050)、宝生物工程Takara(货号9766)、QIAGEN(货号52904)、Thermofisher(货号K0821)等),对加入人工血清的新冠病毒RNA标准物质(GBW(E)091111)进行核酸提取,接着对N基因片段进行数字PCR定值,结果如表3所示,优选提取效率接近于100%的提取试剂盒进行下一步灭活病毒标准物质的提取,选择编号B的病毒核酸提取试剂盒作为灭活病毒标准物质核酸提取试剂盒。
表3
2、高准确度数字PCR绝对定量方法的建立
数字PCR技术是将实时荧光定量PCR体系等量均分到相互隔离的大数量(大于10000个)微小的反应单元(芯片微孔或者微滴液珠),经过PCR扩增反应,反应单元相应的表现为有荧光(阳性)或无荧光(阴性),通过统计微反应单元的阳性率和泊松分布概率函数计算出核酸模板的拷贝数。数字PCR的技术特点是,不需要建立工作曲线,具有相对较高的准确度,是一种潜在的绝对定量方法。
测试样品中拷贝数浓度C可由公式(1)~(3)计算:
λ=-lnP…………………………………………………(1)
C=T
公式(1)~(3)中:
P—阴性反应孔数与总反应孔数的比值,v—每个反应孔的体积,λ—每个反应孔的平均分子数,T
本实施例对数字PCR定值方法的引物探针序列、浓度、退火温度等参数进行了控制,从而确定一套最优的数字PCR方法用于灭活病毒标准物质候选物的定值。
2.1数字PCR引物探针序列优化
针对病毒标准物质的序列,设计4套引物探针用于病毒标物的定值筛选,序列如表4。
表4
以提取的病毒核酸为模板,使用以上引物探针分别进行数字PCR扩增,选取阴阳性信号区分较好、扩增结果数值较高且重复性较好的一套引物探针作为最终灭活病毒标准物质定值的引物探针,人腺病毒5型引物探针数字PCR扩增信号区分图如图1所示,人腺病毒5型引物探针数字PCR检测结果如表5所示,扩增信号及数字PCR检测结果表明,引物探针组ADV-5hexon-1扩增阴阳性信号区分明显,中间雨帘信号点较少,数字PCR检测结果高于其他引物探针组,重复性良好,故选取引物探针组ADV-5hexon-1作为标准物质数字PCR定值的引物探针。
表5
2.2数字PCR引物探针浓度优化
设置多种引物-探针浓度组合,分别进行数字PCR扩增,优选扩增结果高的、阴阳性信号区分好、重复性较好的引物探针浓度比例(引物600nM、探针100nM)作为最终数字PCR定值的引物探针浓度。具体引物探针浓度优化数据见表6。
表6
2.3数字PCR引物探针退火温度优化
设置梯度温度(50℃~60℃)作为数字PCR的退火温度进行扩增,选择扩增结果高的、阴阳性信号区分好、重复性较好的退火温度作为数字PCR定值的温度,具体退火温度优化数据见表7,经优化,人腺病毒5型灭活病毒标准物质选择56℃为最佳退火温度。
表7
2.5确立优化的数字PCR检测方案
A.病毒核酸提取
将标准物质解冻后平衡至25℃,瞬时离心后吸取200μL标准物质,按以下方案进行核酸提取。
(1)向200μL标准物质中加入200μL的Buffer VGB、20μL的Proteinase K和1μL的Carrier RNA,充分混匀后于56℃孵育10分钟;
(2)向裂解液中加入200μL的无水乙醇,充分吸打混匀;
(3)将离心柱安置于收集管中,溶液转移至离心柱中,12,000rpm离心2分钟;
(4)将500μL的Buffer RWA加入至离心柱中,12,000rpm离心1分钟,弃滤液;
(5)将700μL的Buffer RWB加入离心柱中,12,000rpm离心1分钟,弃滤液(请沿离心柱管壁四周加入Buffer RWB,有助于完全冲洗沾附于管壁上的盐分);
(6)重复操作步骤(5);
(7)将离心柱安置于收集管中,12,000rpm离心2分钟;
(8)将离心柱安置于新的1.5mL无酶离心管中,在离心柱膜的中央处加入(50~200)μL的无Rnase水,室温静置5分钟;
(9)12,000rpm离心2分钟洗脱核酸;
(10)将洗脱的核酸置于-80℃~-70℃温度下备用,避免反复冻融。
B.引物/探针信息
数字PCR定值扩增灭活病毒标准物质,引物探针序列信息见表4(VR26ADV-5hexon-1-F、ADV-5hexon-1-R和ADV-5hexon-1-P)。在配制反应体系前,要让引物/探针溶液充分溶解。
C.数字PCR反应体系配制
灭活病毒标准物质参照表8进行数字PCR反应体系配制。
表8
PCR反应体系配完之后,放在漩涡振荡器上(或轻弹、上下颠倒混匀)混匀,注意不要有气泡产生,如有气泡,轻轻用手指弹一弹,离心除去,重复操作,直到气泡全无。之后根据数字PCR平台的要求进行微滴生成或其他方式独立微滴分布操作。
D.PCR扩增程序
灭活病毒标准物质的数字扩增程序参考表9。
表9
2.5数字PCR方法的重复性考察
重复性考察方案:将各标准物质样品各取8管,核酸提取后将核酸加入数字PCR扩增体系,独立重复测试8次,记录8次检测数据的相对标准偏差(RSD),即为定值方法的重复性,灭活病毒标准物质的重复性考察数据见表10,结果表明,8次重复检测数值的相对标准偏差小于5%,重复性良好。
表10
2.6数字PCR方法的特异性验证
特异性验证实验方案:选取6种其他呼吸道病毒标准品(本发明研制,见表11)作为核酸模板,用本发明中的定值方法去扩增标准品,观察是否有非特异扩增。
数字PCR特异性验证扩增结果如图2所示,通过扩增结果可知,用本发明中的定值方法去扩增这标准品结果为阴性,无非特异扩增,证明本发明的方法特异性良好。
表11
2.8数字PCR方法的检测限与定量限测定
根据Eurachem发布的The Fitness for Purpose of Analytical Methods标准规定,对于定量检测方法首先确定95%置信度水平下能够稳定检测的非0结果的最低浓度,计算该浓度标准偏差(s)。根据标准偏差s,计算该方法的最低检测限(LOD)为3s,最低定量限(LOQ)为10s。
为了测定灭活病毒标准物质数字PCR定值方法的检测限(LOD)和定量限(LOQ),将标准物质稀释至理论浓度2copies/μL、1copies/μL、0.5copies/μL,用相对应的数字PCR方法分别进行检测,每个浓度重复检测20次。标准物质数字PCR方法能够稳定检测的非0结果的标准偏差s如表12所示,根据s计算出方法的LOD(3s)及LOQ(10s),结果表明,本数字PCR方法的检测限为0.90copies/μL,定量限为3.00copies/μL,方法灵敏度较高,满足病毒检测或标准物质定值的需求。
表12
综上所述,本发明建立的标准物质定值方法具备良好的准确性、可重复性、特异性和灵敏度。
实施例3
本实施例进行灭活病毒标准物质均匀性检验。
1、灭活病毒标准物质的均匀性检验方案
根据我国《JJF1343-2012标准物质定值的通用原则及统计学原理》中规定的检验方法对灭活病毒标准物质进行统计检验。
本批灭活病毒标准物质每种共制备分装200瓶(单元),对样品随机选取11瓶,每瓶取样3次。采用数字PCR方法对标准物质进行检测,采用方差分析法(F检验)进行均匀性检验。
方差分析法是用来统计检验均匀性的最常用方法。此法是通过组间方差和组内方差的比较来判断各组测量值之间有无系统性差异,如果二者的比小于统计检验的临界值,则认为样品是均匀的。
为检验样品均匀性,设抽取了m个样品,用精密度高的实验方法,在相同条件下得m组等精度测量数据如下:
1.
2.
…………
m,
设
则组间差方和
组内差方和
记
ν
ν
作统计量F:
由此可见,该统计量是自由度(ν
根据自由度(ν
瓶间均匀性标准偏差可以用以下公式计算,等同于管间不均匀性导致的不确定度分量u
当均匀性检验的测量方法重复性较差,有可能导致
2、灭活病毒标准物质的均匀性检验结果
对分装完毕的200瓶样品随机选取11瓶,每瓶取样3次,每次取样50μL进行检测。对样品核酸进行提取,采用数字PCR方法分别对灭活病毒标准物质的浓度进行检测。均匀性检验中检测结果如下表。对计算得到灭活病毒标准物质的拷贝数进行F检验,灭活病毒标准物质的均匀性检验结果(单位:copies/μL)如表13,灭活病毒标准物质的均匀性检验统计分析结果如表14,由于F<Fcrit,表明灭活病毒标准物质溶液的均匀性良好。
表13
表14
3、最小取样量
使用灭活病毒标准物质采用数字PCR方法进行测定,不需要绘制标准曲线,我们在进行瓶间均匀性实验时标准物质取样量为50μL,均匀性评估结果良好,因此确定了样品的最小取样量为50μL。
实施例4
本实施例进行灭活病毒标准物质稳定性考察。
稳定保存是生物类标准物质研制的关键环节,保持样品稳定性的措施必须贯穿标准物质研制的全过程。本部分我们采用数字PCR方法,对灭活病毒标准物质的稳定性进行了考察。为了保障标准物质样品传递,考察了特殊温度条件(-20℃和4℃)下标准物质的短期稳定性;灭活病毒标准物质的长时间保存通常采用-80℃~-70℃超低温冰箱保存,因此考察了灭活病毒标准物质候选物在-80℃~-70℃条件下长期保存的稳定性。目前监测结果证明灭活病毒标准物质在-20℃和4℃下可稳定保存14天,满足运输条件(干冰运输,运输时间不超过14天);在-80℃~-70℃条件下可稳定保存3个月以上,仍在继续对其长期稳定性进行持续监测。
1、标准物质在-20℃和4℃条件下的短期稳定性
短期稳定性考察采用数字PCR方法对灭活病毒标准物质进行检测,测定标准物质在-20℃及4℃温度下放置0天、1天、3天、7天、10天、14天后,标准物质浓度量值随着保存时间延长是否有量值变化的情况。采用同步稳定性评估,标准物质在-20℃保存条件下的短期稳定性检测结果见表15,标准物质在-20℃下的短期稳定性统计结果见表16。通过回归曲线方法来进行稳定性监测,以判断标准物质量值是否有单方向变化的趋势。标准物质在4℃保存条件下的短期稳定性检测结果见表17,标准物质在4℃下的短期稳定性统计结果见表18,上述结果表明,标准物质在-20℃及4℃温度下放置14天量值保存稳定,短期稳定性满足样品传递运输要求。
表15
表16
表17
表18
2、标准物质在-80℃~-70℃条件下的长期稳定性
标准物质的长期稳定性考察采用数字PCR方法,测定灭活病毒标准物质候选物在-80℃~-70℃条件下放置0月、1月、2月、3月、4月、5月后浓度量值随着保存时间延长是否有量值变化的情况,采用经典稳定性评估方法进行评估。灭活病毒标准物质长期稳定性监测结果见表19,通过回归曲线方法来进行稳定性监测,以判断标准物质量值是否有单方向变化的趋势,标准物质在-80℃~-70℃下的长期稳定性统计结果见表20,上述结果表明,标准物质在-80℃~-70℃下可稳定保存5个月,稳定性良好,满足用户长期使用的需求。
表19
表20
灭活病毒标准物质在-80℃~-70℃下的长期稳定性统计结果表明,|β
实施例5
灭活病毒标准物质的定值。
1、定值方案
本发明研制的灭活病毒标准物质采用数字PCR方法,经5~7家实验室合作定值,筛选出符合JJF 1343-2012《标准物质定值的通用原则及统计学原理》要求的定值数据。研制过程中,对数字PCR方法进行了充分优化,考察了提取效率、重复性、特异性、定量限和检出限等关键参数,满足了核酸标准物质定值要求。定值方法采用本发明建立的定值方法。
2、参与定值实验室
由上海市计量测试技术研究院负责组织,对灭活病毒标准物质进行了多家实验室合作定值工作,参与定值实验室情况见表21。
表21
3、联合定值结果
3.1合作定值原始数据见表22
表22
/>
由PT-1及PT-2的数据可以换算出每家定值单位的提取效率,再将各实验室的原始数据除以各实验室的提取效率,即是最终的定值数据,如表23所示。
表23
之后对最终除以提取效率后的定值数据进行数据统计处理,按以下方案进行处理:
a.汇总全部原始数据,用偏态系数和峰态系数法检验得知全部原始数据符合正态分布;
b.对每一组独立测量结果分别用狄克逊(Dixon)法和t-检验法从统计上检验,剔除离群值;
c.对各组数据的标准偏差用科克伦法进行等精度检验,剔除可疑数据组;
d.以狄克逊(Dixon)法检验数据,剔除平均值存在显著性差异的数据组;将符合要求的平均值再次计算平均值。
最终得到的标准物质数字PCR定值浓度如表24所示,即为灭活病毒标准物质的标准值。
表24
实施例6
灭活病毒标准物质的不确定度评估。
灭活病毒标准物质的不确定度来源由三部分组成。第一部分为标准物质的均匀性引起的不确定度;第二部分为标准物质在有效期内的变动性引起的不确定度;第三部分为标准物质的定值过程带来的不确定度,包括数据统计引入的不确定度和通过对定值方法中测量影响因素进行分析评定的不确定度。
1、标准物质均匀性引入的不确定度(u
标准物质的瓶间均匀性标准偏差可以用以下公式计算,等同于管间不均匀性导致的不确定度分量u
/>
当均匀性检验的测量方法重复性较差,有可能导致
标准物质由均匀性引入的相对不确定度见表25。
表25
2、标准物质稳定性引入的不确定度(u
根据各标准物质长期稳定性考察数据,由以下公式计算标准物质的长期稳定性引入的不确定度。
u
经计算,标准物质长期稳定性引入的不确定度数据见表26,结果表明,由稳定性引入的相对不确定度为6.9%。
表26
3、定值过程引入的不确定度(u
3.1数据统计引入的不确定度(u
标准物质按照统计方法计算出的不确定度即是由多家实验室测量数据统计引入的不确定度。与总平均值相关的合成标准不确定度的基础是标准偏差,可由下列公式获得:
式中:
合成标准不确定度为
标准物质测量数据统计引入的不确定度评定结果见表27,结果表明,由测量数据统计引入的相对不确定度为4.5%。
表27
3.2测量影响因素引入的不确定度(u
在数字PCR对RNA分子定量的过程中,最终RNA的拷贝数由下式计算得来:
式中:T—标准物质中RNA的含量,copies/μL;D—稀释因子;Vp—单反应室体积,μL;M—每个反应室的拷贝数。
从以上数学模型可知,影响RNA标准物质测量结果的不确定因素有:测量重复性引入的不确定度;微滴体积大小引入的不确定度。因此,灭活病毒标准物质测量结果相对标准不确定度传播率为:
其中标准物质中RNA含量T的标准不确定度用
(一)重复性M引入的不确定度
建立的各标准物质数字PCR方法重复性的不确定度与方法的精密度有关,将各片段方法重复性考察的标准偏差除以
表28
(二)微滴体积Vp的相对标准不确定度
在制备微滴的过程中,会发生微滴体积不一致的情况,中国计量科学研究院发表的论文中给出了微滴体积引入的相对不确定度为0.8%,本研究选取此测量不确定度作为微滴体积不一致引入的不确定度,则其相对不确定度为0.8%。
(三)测量过程影响因素引入的合成不确定度
将测量过程影响因素引入的不确定度各分量按以下公式进行合成,各个标准物质定值测量过程影响因素引入的合成不确定度计算结果见表29,结果表明,测量过程影响因素合成相对不确定度为1.20%。
表29
3.3定值过程引入的合成不确定度(u
将标准物质定值数据统计引入的不确定度和测量影响因素引入的不确定度按以下公式进行合成,标准物质定值过程引入的合成相对不确定度计算结果见表30,结果表明,定值过程引入的合成相对不确定度为4.5%。
表30
3.4合成相对不确定度及相对扩展不确定度
将均匀性引入的相对不确定度、稳定性引入的相对不确定度、定值过程引入的相对不确定度分量合成,并将合成相对标准不确定度乘以包含因子k(对应置信概率95%,取k=2),即为灭活病毒标准物质特性量值标准值的扩展不确定度。各标准物质的合成相对不确定度及相对扩展不确定如表31所示,结果表明,标准物质的相对扩展不确定度为18%(k=2)。
表31
灭活病毒标准物质定值结果及不确定度列表见表32。
表32
实施例7
灭活病毒标准物质应用性验证。
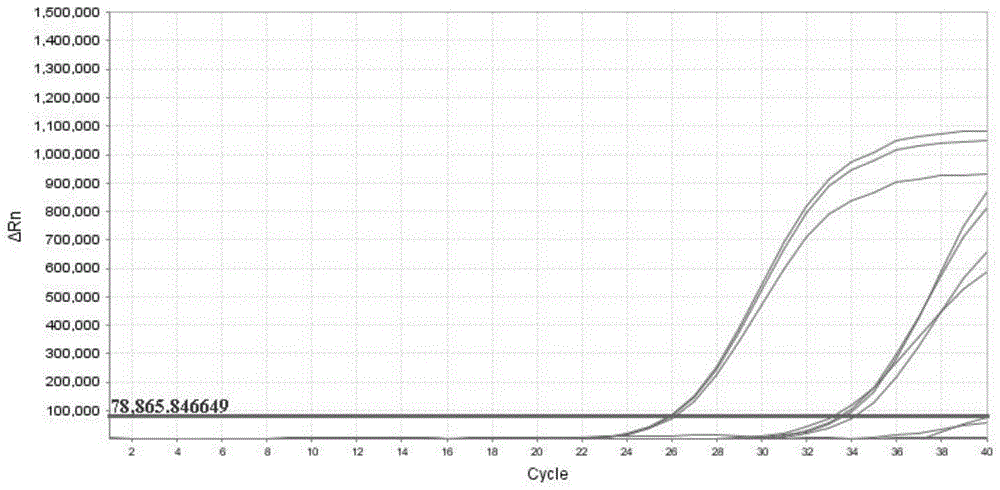
为确认灭活病毒标准物质的应用性能,选取了1种腺病毒核酸检测试剂盒(PCR荧光探针法)(表33),以本发明中灭活病毒标准物质为检测对象进行检测,观察检测结果是否为阳性。
表33
扩增结果如图3所示,本发明中的灭活病毒标准物质可以在腺病毒核酸检测试剂盒中扩增,结果为阳性,证明灭活病毒标准物质的应用性良好。
同时本发明也邀请了上海伯杰医疗科技股份有限公司、广州市金圻睿生物科技有限责任公司等对本发明的灭活病毒标准物质进行应用验证,示例性结果参见表34,验证结果均显示检测结果为阳性,方法精密度CV值为0.70%,最低检测限检出率为100%,表明灭活病毒标准物质均能在客户端成功检测,实际应用效果良好。
表34
综上所述,本发明针对人腺病毒5型呼吸道感染病毒,研制了灭活病毒形式的标准物质,通过病毒培养与浓缩、病毒灭活方法研究、病毒灭活效果验证、核酸提取方法研究、定值方法建立与优化、均匀性检验、稳定性监测等研究,确保标准物质的生物安全性、适用性及量值准确性,大大提升标准物质的实用性,并在多家试剂盒生产企业开展应用验证,为相关呼吸道病原微生物核酸检测市场监管提供计量技术保障。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 灭活形式的人呼吸道合胞病毒在制备核酸标准物质中的应用
- 含猪圆环病毒2型ORF2基因的重组腺病毒在核酸扩增检测中作为标准样品的应用
