一种评价间充质干细胞治疗脑梗死疗效的试剂盒和方法
文献发布时间:2023-06-19 11:57:35
技术领域
本发明属于医药技术领域,尤其涉及一种评价间充质干细胞治疗脑梗死疗效的试剂盒和方法。
背景技术
脑梗死旧称脑梗塞,又称缺血性脑卒中(cerebral ischemic stroke),是指因脑部血液供应障碍,缺血、缺氧所导致的局限性脑组织的缺血性坏死或软化。脑梗塞包括常见的脑动脉硬化血栓形成性脑梗塞(简称脑血栓)和脑栓塞。脑梗塞是老年人中的常见缺血性脑血管病,并可使大部分病人致残,并丧失劳动力造成生活的诸多不便。
脑梗塞需及时治疗,选择治疗方法极为关键。脑梗塞传统的治疗方法主要有药物、手术以及康复训练,由于条件的限制,这三种方法对脑梗塞的治疗效果不甚理想。药物治疗不能从根本上解决脑细胞再生的问题,并具有复发的可能性;开颅手术具有一定的风险性,也可能存在后遗症性,术后也无法使受损伤的脑组织恢复功能;康复训练仅仅是有助于患者进一步的康复,并不能起到治疗的作用。
近年来,干细胞移植治疗脑梗死得到了越来越多学者的关注。移植的干细胞具有分泌神经生长因子,改善微环境,促进神经再生、抑制炎症反应的作用。
间充质干细胞能够调节神经炎症,肿瘤坏死因子α(TNF-α)是缺血性中风发炎的重要参与者,渗透到大脑的神经胶质细胞和免疫细胞,例如单核细胞,淋巴细胞,中性粒细胞中,可能参与了与神经炎症相关的TNF-α表达。
但是目前对于间充质干细胞治疗脑梗死疗效尚没有一种有效的评价方法。
发明内容
有鉴于此,本发明的目的在于提供一种评价间充质干细胞治疗脑梗死疗效的试剂盒和方法。
为了实现上述发明目的,本发明提供了以下技术方案:
本发明提供了一种评价间充质干细胞治疗脑梗死疗效的试剂盒,包括检测大脑皮层梗死区星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞数量的试剂以及检测TNF-α表达量的试剂。
优选的,包括用于鉴别星型胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞的标记物以及用于检测TNF-α的多克隆抗体。
优选的,用于鉴别星型胶质细胞的标记物为GFAP,用于鉴别小胶质细胞的标记物为Iba-1和CD68,用于鉴别单核细胞的标记物为CD14,用于鉴别中性粒细胞的标记物为Neutrophil弹性蛋白酶,用于鉴别淋巴细胞的标记物为CD3。
优选的,所述用于检测TNF-α的多克隆抗体为生物素偶联的兔抗TNF-α抗体。
本发明提供了一种评价间充质干细胞治疗脑梗死疗效的方法,分别检测间充质干细胞移植前、后,大脑皮层梗死区星形胶质细胞、单核细胞和淋巴细胞的数量以及TNF-α表达量,如果间充质干细胞移植后,星形胶质细胞、单核细胞和淋巴细胞的数量低于移植前,并且星形胶质细胞、单核细胞和淋巴细胞中TNF-α表达量低于移植前,则认为疗效良好。
优选的,检测星形胶质细胞、单核细胞和淋巴细胞中TNF-α表达量比例,当所述星形胶质细胞中TNF-α的表达量低于星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞中TNF-α表达量总量的60%,当所述单核细胞中TNF-α的表达量低于星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞中TNF-α表达量总量的19%,并且当所述淋巴细胞中TNF-α的表达量低于星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞中TNF-α表达量总量的16%时,认为疗效良好。
优选的,所述间充质干细胞为骨髓间充质干细胞。
优选的,所述间充质干细胞移植的对象为大脑中动脉远端阻塞大鼠脑缺血模型。
本发明的有益效果:本发明提供的评价间充质干细胞治疗脑梗死疗效的试剂盒通过检测间充质干细胞移植前后大脑皮层梗死区星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞数量以及检测大脑皮层梗死区星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞中TNF-α表达量来判定间充质干细胞移植治疗脑梗死的疗效,能够高效、准确的评价间充质干细胞治疗脑梗死疗效。
附图说明
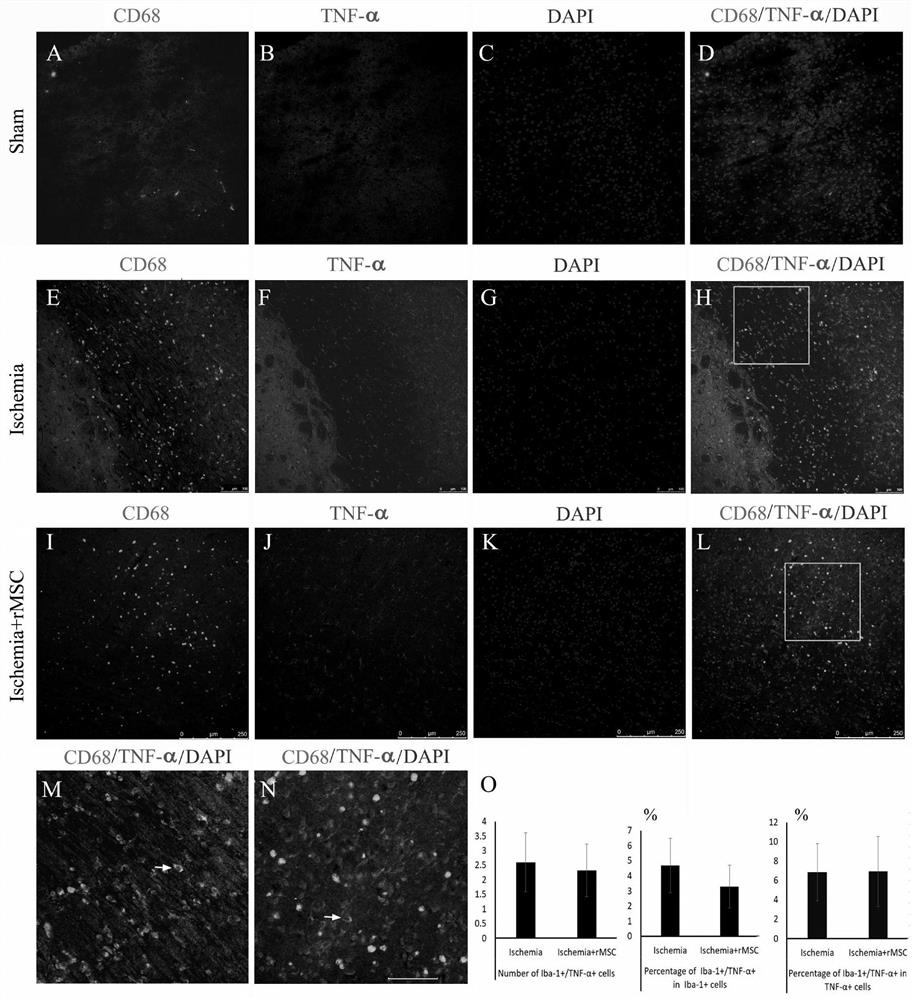
图1为间充质干细胞移植前后,CD68+小胶质细胞TNF-α的表达情况,其中A,E:CD68染成绿色;B,F:TNF-染色为红色;C,G:CD68染色为白色;D,H:TNF-α,CD68和蓝色DAPI核染色的合并图像;A-D:在MSC移植之前,TNF-α+和CD68+细胞在梗塞区域的分布;E-H:MSC移植后,梗死区TNF-α+和CD68+细胞的分布;I(D处的正方形):缺血组中CD68和TNF-α的合并图像的放大图;J(H中的正方形):MSC移植组中CD68和TNF-α融合图像的放大图;K:在整个TNF-α+细胞群体中CD68+/TNF-α+细胞少于10%,而MSC移植并没有改变CD68+/TNF-α+细胞的数量或百分比;箭头:TNF-α和CD68双阳性细胞;标尺=250μm。
图2为间充质干细胞移植前后,Iba-1+小胶质细胞TNF-α的表达情况;其中A,E:Iba-1染成绿色;B,F:TNF-α染成红色;C,G:DAPI核染成蓝色;D,H:Iba-1+和TNF-α+的合并图像;A-D:MSC移植前,缺血皮层中TNF-α+和Iba-1+细胞的分布模式相似;E-H:MSC移植后,TNF-α+和Iba-1+细胞在皮层梗塞中的分布;I:(D中的正方形):在缺血组的梗塞区域中,Iba-1+/TNF-α+细胞的放大图;J:(H中的正方形):在MSC移植组的梗塞区域中,Iba-1+/TNF-α+细胞的放大率;K:在缺血组中,几乎没有发现Iba-1+和TNF-α+双阳性细胞;在移植组中,MSC输注并没有诱导更多的小胶质细胞表达TNF-α;箭头:TNF-α和Iba-1双标记细胞;标尺=250μm。
图3为间充质干细胞移植前后,CD68+-Iba-1+小胶质细胞TNF-α的表达情况,其中A-D:在缺血对照组中,CD68,Iba-1和TNF-α+的三重染色;E-H:(D中的正方形):D中三重染色正方形的放大倍数;A,E:Iba-1染成绿色;B,F:TNF-α染成红色;C,G:CD68染色为白色。D,H:蓝色的CD68,Iba-1+,TNF-α+和DAPI核染色的合并图像;I:(E中的箭头I):CD68,Iba-1和TNF-α三重标记细胞的高倍视野显示,Iba-1+/TNF-α+细胞的一部分也为CD68+;J:(E中的箭头J):Iba-1/TNF-α双阳性但CD68阴性细胞的高倍视野;K:(E中的箭头K):CD68/Iba-1双阳性但TNF-α阴性细胞的高倍视野;L:(E中的箭头L):大多数TNF-α+细胞既不是CD68+也不是Iba-1+;A-D标尺=100μm,E-H标尺=50μm,I-L标尺=20μm。
图4为间充质干细胞移植前后,单核细胞TNF-α的表达情况;其中A,E:CD14染成绿色;B,F:TNF-α染成红色;C,G:DAPI核染成蓝色;D,H:CD1+和TNF-α+的合并图像;A-D:在MSC移植之前,TNF-α+和CD14+细胞在梗塞区域的分布;E-H:MSC移植后,TNF-α+和CD14+细胞在梗塞区域的分布;I:(D中的正方形):局部缺血组中双阳性细胞的放大倍数,在CD14+单核细胞中,TNF-α双阳性占15%;J:(H中的正方形):MSC移植组中双阳性细胞的高倍视野;K:MSC的移植后不仅显着降低了CD14+/TNF-α+双阳性细胞的数量,而且显着降低了所有CD14+细胞中CD14+/TNF-α+的百分比;箭头:TNF-α和CD14双标记细胞;标尺=250μm。
图5为间充质干细胞移植前后,GFAP+星形胶质细胞TNF-α的表达情况;其中,A,E:GFAP染色;B,F:TNF-α染色;C,G:DAPI核染色;D,H:GFAP,TNF-α和DAPI的合并图像;A-D:在缺血对照组中,GFAP+和TNF-α+/GFAP+细胞的分布主要位于梗塞区域;E-H:在MSC输注后,GFAP+和TNF-α+细胞的分布仍被限制在大脑皮层梗塞区域;MSC减少了大脑中GFAP+细胞的数量,并降低了整个GFAP+细胞中TNF-α+/GFAP+细胞的百分比;I:(D中的正方形):局部缺血组中TNF-α+/GFAP+双染色细胞的高倍视野;J:(H中的正方形):MSC移植组中TNF-α+/GFAP+双重染色细胞的高倍视野;K:在GFAP+星形胶质细胞中,TNF-α双阳性细胞占55%;MSC移植显着降低GFAP+/TNF-α+双阳性细胞数量,并降低所有GFAP+细胞中GFAP+/TNF-α+的百分比;箭头:GFAP+/TNF-α+双标记细胞,标尺=250μm。
图6为间充质干细胞移植前后,纹状体和胼胝体中GFAP+星形胶质细胞TNF-α的表达情况,其中A,E:GFAP染色;B,F:TNF-α染色;C,G:DAPI核染色;D,H:GFAP,TNF-α和DAPI的合并图像;A-D:在缺血对照组中,除了梗塞区域外,GFAP+和TNF-α+细胞的分布均主要位于纹状体和胼胝体中;E-H:MSC移植后,GFAP+和TNF-α+细胞的分布仍包括纹状体和胼胝体;MSC减少了大脑中GFAP+细胞的数量,并降低了整个GFAP+细胞中TNF-α+细胞的百分比;I:(D中的正方形):局部缺血组中TNF-α+/GFAP+双染色细胞的高倍视野;J:(H中的正方形):MSC移植组中TNF-α+/GFAP+双重染色细胞的高倍视野;K:在GFAP+星形胶质细胞中,缺血组55%的TNF-α双阳性;MSC的注入显着降低了GFAP+/TNF-α+双阳性细胞的数量,并降低了所有TNF-α+细胞中GFAP+/TNF-α+的百分比;箭头:TNF-α和GFAP双标记细胞;标尺=250μm。
图7为间充质干细胞移植前后,CD3+细胞TNF-α的表达情况,其中A,E:CD3染色;B,F:TNF-α;C,G:DAPI核染色;D,H:双染色的CD3+/TNF-α+细胞;A-D:在缺血对照组的梗塞中可以发现大量的CD3+和TNF-α+/CD3+细胞;E-H:通过MSC移植,可显着减少梗死区域CD3+和TNF-α+/CD3+细胞的数量;I:(D中的正方形):局部缺血组中TNF-α+/GFAP+双染色细胞的高倍视野;J:(H中的正方形):MSC移植组中TNF-α+/GFAP+双重染色细胞的高倍视野;K:在CD3+淋巴细胞中,缺血组中TNF-α双阳性的占15%;MSC的移植显着降低了所有GFAP+细胞中CD3+/TNF-α+双阳性细胞的数量,以及CD3+/TNF-α+的百分比;箭头:CD3+/TNF-α+双标记细胞;标尺=250μm。
具体实施方式
本发明提供了一种评价间充质干细胞治疗脑梗死疗效的试剂盒,包括检测大脑皮层梗死区星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞数量的试剂以及检测大脑皮层梗死区星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞中TNF-α表达量的试剂。
在本发明中,检测大脑皮层梗死区星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞数量的试剂优选的包括用于鉴别星型胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞的标记物;在本发明中,用于鉴别星型胶质细胞的标记物优选为GFAP,用于鉴别小胶质细胞的标记物优选为Iba-1和CD68,用于鉴别单核细胞的标记物优选为CD14,用于鉴别中性粒细胞的标记物优选为Neutrophil弹性蛋白酶,用于鉴别淋巴细胞的标记物为优选为CD3;本发明对所述标记物的来源和制备方法没有特殊限定,采用本领域常规的来源和制备方法即可。
在本发明中,检测大脑皮层梗死区星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞中TNF-α表达量的试剂优选为TNF-α的多克隆抗体,更优选为生物素偶联的兔抗TNF-α抗体;所述生物素偶联的兔抗TNF-α抗体优选的采用市售产品。
本发明提供了一种评价间充质干细胞治疗脑梗死疗效的方法,分别检测间充质干细胞移植前、后,大脑皮层梗死区星形胶质细胞、单核细胞和淋巴细胞的数量以及TNF-α表达量,如果间充质干细胞移植后,星形胶质细胞、单核细胞和淋巴细胞的数量低于移植前,并且星形胶质细胞、单核细胞和淋巴细胞中TNF-α表达量低于移植前,则认为疗效良好。
在本发明中,优选的检测星形胶质细胞、单核细胞和淋巴细胞中TNF-α表达量比例,当所述星形胶质细胞中TNF-α的表达量低于星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞中TNF-α表达量总量的60%,当所述单核细胞中TNF-α的表达量低于星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞中TNF-α表达量总量的19%,并且当所述淋巴细胞中TNF-α的表达量低于星形胶质细胞、小胶质细胞、单核细胞、中性粒细胞和淋巴细胞中TNF-α表达量总量的16%时,认为疗效良好。
在本发明中,所述间充质干细胞优选为骨髓间充质干细胞。所述间充质干细胞移植的对象优选为大脑中动脉远端阻塞大鼠脑缺血模型。
在本发明中,所述大脑皮层梗死区星形胶质细胞、单核细胞和淋巴细胞的数量以及TNF-α表达量的检测优选的通过免疫组织化学染色的方法进行,本发明对所述免疫组织化学染色的具体步骤没有特殊限定,采用本领域常规的免疫组织化学染色即可。
在本发明中,制备间充质干细胞移植前后的大脑中动脉远端阻塞大鼠脑缺血模型的大脑冠状切片。本发明对所述大脑冠状切片的制备方法没有特殊限定,采用本领域常规的方法即可。在本发明中,优选的将所述大脑冠状切片与生物素偶联的兔抗TNF-α抗体孵育染色;然后洗涤,并与生物素化二抗孵育;二抗孵育后的大脑冠状切片在缓冲液中洗涤后,再与鉴别细胞类型的标记物孵育过夜;然后将切片与3,3-二氨基联苯胺和0.01%过氧化氢在磷酸盐缓冲液中的温育显示出反应产物;最后,将切片脱水、封固在糊化的玻片上,用于图像分析。
在本发明中,所述图像分析包括总计用CD68,Iba-1,GFAP,CD14,CD3和中性粒细胞弹性蛋白酶(NE)双重染色的TNF-α的阳性细胞数量。计算整个TNF-α+细胞中各个双标记细胞的百分比。在本发明中,如果间充质干细胞移植后,星形胶质细胞、单核细胞和淋巴细胞的数量低于移植前,并且星形胶质细胞、单核细胞和淋巴细胞中TNF-α表达量低于移植前,则认为疗效良好。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
本实验已经过首都医科大学宣武医院伦理委员会审核通过。
将动物圈养在SPF室中并自由进食。
从雄性供体Sprague-Dawley大鼠(4周龄,150-200g)中获得大鼠骨髓基质细胞的原代培养物,并分离了BMSCs,具体方法参见如下文献记载:赵春松,邹海强,闫晓明,关云谦,陈凌,王佳茵,张愚.人脐带间充质干细胞对帕金森病患者外周血淋巴细胞增生的抑制.首都医科大学学报.2014年6月第35(3):344-352.)。
在第2天的时间点,将30只雄性Sprague-Dawley幼鼠(8周大,280-320g)随机分为假手术组、缺血组、缺血+rMSCs组(每组n=10)。在每组中,分别将动物用于免疫荧光染色。
细胞移植
用3.5%的异氟烷麻醉动物,并吸入百分含量为1.0~2.0%的异氟烷的N
免疫组织化学染色
将动物置于深度麻醉下,并用磷酸盐缓冲的4%多聚甲醛(PFA,pH 7.4)固定液灌注。取出大脑,并在4℃下于4%PFA中储存过夜。使用前,将大脑保持在-20℃的防冻溶液中。为了进行免疫组织化学评估,用玻璃纤维刀(Leica)将大脑冠状切成40mm厚的切片。
梗死皮层计数区域的划分与Gelosa相似(Paolo Gelosa,Davide Lecca,MartaFumagalli,Dorota Wypych,Alice Pignieri,Mauro Cimino,Claudia Verderio,MalinEnerba¨ck,Elham Nikookhesal,Elena Tremoli,Maria PAbbracchio and LuigiSironi.Microglia is a key player in the reduction ofstroke damage promotedbythe new antithrombotic agent ticagrelor.Journal ofCerebral BloodFlow&Metabolism(2014)34,979–988.)。简而言之,计数区域位于内梗死边界区(IBZ),该区域位于后梗死区,距正常和梗死区的边界线400μm。
使用生物素偶联的兔抗TNF-α抗体(Jacson,丹麦)对TNF-α进行免疫组织化学染色。对于立体分析,使用LeicaTCS SP5 IIAOBS激光扫描共聚焦显微镜(Leica,德国韦茨拉尔)。
从每只大鼠的4个冠状切片中计数大脑中的TNF-α阳性细胞(厚度为40μm,间隔为480μm,位于距前囟的-2.0mm至2.0mm之间),对于每张玻片,均在显微镜下拍摄2个正方形图像。细胞计数以数量/视野表示,我们的显微镜视野为800×800μm(200×)。
切片在适度摇动下在自由漂浮的上进行免疫组织化学染色。在缓冲液中洗涤几次后,在4℃下与生物素偶联的TNF-α兔多克隆抗体以1:600(WAKO)稀释孵育过夜。
然后将切片在缓冲液中洗涤,并在室温下与曲霉抗生物素蛋白偶联的驴抗兔生物素化二抗(1:600,BA-1000;VectorLabs)孵育2小时。在缓冲液中洗涤几次后,将切片与其他细胞类型标记物的标记物一起孵育过夜,这些标记物包括:Iba-1和CD68(用于小胶质细胞),GFAP(用于星形胶质细胞),CD14(用于单核细胞),Neutrophil弹性蛋白酶(用于中性粒细胞)和CD3(用于淋巴细胞)。
在室温下用抗生物素蛋白-生物素-过氧化物酶复合物稀释90min(1:500稀释,PK-6100;VectorABC Elite Kit)。通过将切片与3,3-二氨基联苯胺(Sigma-Aldrich)和0.01%过氧化氢在0.1M磷酸盐缓冲液中的温育显示出反应产物。然后,将切片脱水,用封固剂(Vectamount,Vector)封固在糊化的玻片上,并用于图像分析。
总计用CD68,Iba-1,GFAP,CD14,CD3和中性粒细胞弹性蛋白酶(NE)双重染色的TNF-α的阳性细胞数量。计算整个TNF-α+细胞中双标记细胞的百分比,结果如图1~7所示。
小胶质细胞不是TNF-α+的主要来源
通过免疫组织化学染色,假手术组的大脑皮层中几乎没有TNF-α信号。在缺血后第2天的缺血对照组中,TNF-α信号主要位于皮质梗死区域,该区域在梗死区域与梗塞周围区域之间的边界附近(如图1中的A-D所示)。
缺血组的TNF-α+细胞数为40.338.07/视野,MSC移植后TNF-α+细胞数量减少至33.095.13/视野(图1中的E-H所示)。
高倍镜证实(如图1中的I-J所示),极少有CD68+细胞(活化的小胶质细胞)促成梗死灶中TNF-α的表达。缺血组TNF-α+/CD68+双阳性细胞为1.93±1.43/视野。MSC输注后,发现TNF-α+/CD68+双阳性细胞维持在1.46±1.08/视场(如图1中的K所示)。
在缺血组中,所有TNF-α+细胞和CD68+细胞中TNF-α+/CD68+细胞的百分比分别为4.62±2.93%和3.69±3.54%(图1中的K)。MSC输注后,所有TNF-α+细胞和CD68+细胞中TNF-α+/CD68+细胞的百分比维持在4.34±2.28%和2.77±2.28%(图1中的K)。
可见,在大脑中动脉远端阻塞大鼠脑缺血模型中,CD68+细胞不是TNF-α表达的主要细胞来源,并且不能被MSC移植诱导表达更多的TNF-α。
与CD68相比,Iba-1标记的小胶质细胞范围更广;Iba-1标记的小胶质细胞标记了活化的和休眠的小胶质细胞。在假手术组中,在皮质,纹状体或胼胝体中未检测到明显的IGF-1+或TNF-α信号。dMCAO发作后两天,TNF-α+和Iba-1+信号均增加,并且在皮层梗塞中尤其是在计数区域很容易检测到,并且Iba-1+细胞和TNF-α+的分布方式细胞是相似的(如图2中的A-D)。意外的是,在梗死区仅能偶尔观察到TNF-α+和Iba-1+双阳性细胞(图图2中的E)。
MSC输注后,TNF-α+和Iba-1+信号仍主要分布在梗塞区域(如图2中的I-L)。与缺血组相比,TNF-α+/Iba-1+双阳性细胞的数量,以及总Iba-1+细胞和TNF-α中TNF-α+/Iba-1+双阳性细胞的百分比MSC的α+细胞(2.531.59/视野,4.78±3.52%和7.95±6.17%)没有显著变化(2.33±1.81/视野,3.68±2.96%和8.34±7.34%)。
为了验证Iba-1+细胞群中的TNF-α表达是否为来自CD68+/TNF-α+双阳性细胞,对Iba-1(绿色),TNF-α(红色)和CD68(白色)进行了三重免疫组织化学染色(如图3中的A-D)。
在放大的视图中(图3中的E-H),近60-70%的TNF-α+/Iba-1+细胞确实是CD68+细胞(图3中的I)。
有TNF-α阳性但不是CD68阳性的Iba-1+细胞如图3中的J所示,TNF-α阴性的CD68+/Iba-1+小胶质细胞如图3中的K所示。
另外,大多数CD68+/Iba-1+双阳性细胞对TNF-α都不呈阳性,相应地,大多数TNF-α+信号呈分支形态,而CD68和Iba-1都不呈阳性(如图3中的L所示)。
上述结果证实小胶质细胞不是TNF-α+的主要来源。
CD14+/TNF-α+细胞通过缺血增加,但通过MSC输注明显减少。
在dMCAO后的第2天,CD14信号散布在表达TNF-α的细胞周围并随机共定位在细胞质内(如图4中的A-D)。在皮层计数区域,每个视野中有7.671.88TNF-α+/CD14+细胞;17.574.49%的CD14+细胞共表达TNF-α,而19.715.97%的TNF-α+细胞共表达CD14(如图4中A-D、K所示)。通过图4中的I-J的放大图确认双阳性细胞。
可见,MSC处理不仅使TNF-α+/CD14+细胞的数量减少到3.931.48/视野,而且使CD14+群体中TNF-α+/CD14+细胞的百分比减少到13.783.88%。因此,TNF-α+细胞中的TNF-α+/CD14+细胞的百分比也降低至13.76.47%(如图4中的E-H和图4中的K)。
有部分CD14+单核细胞能够表达TNF-α,而在此实验环境中,CD14+细胞是TNF-α表达的细胞来源之一。
除了部分CD14+单核细胞表达TNF-α外,在dMCAO模型的缺血性大脑皮层中还有许多其他的TNF-α表达细胞,其中很大一部分是分枝形态。GFAP阳性星形胶质细胞是另一种主要具有分支形态的细胞群。由于TNF-α阳性信号和GFAP+星形胶质细胞在形态和分布上都相似,因此采用双荧光免疫染色来区分它们的空间关系。
在dMCAO后48小时检测到星形胶质增高,在MSC组中,与缺血对照组相比(48.43±9.67/视野),GFAP+星形胶质细胞的数量(42.3±5.2/视野)显著减少。
如图5所示,与假手术组相比(图5中的A-D),在注入MSCs后,缺血组梗死区TNF-α+/GFAP+双阳性细胞的数量(图5中的E-H)从27.53±5.35/视野降低为20.933.53/视野。结果,GFAP+星形胶质细胞中TNF-α+/GFAP+双阳性细胞的百分比从缺血对照组的57.80±11.29%显着降低至MSC组的49.51±7.82%。TNF-α+/GFAP+双阳性细胞在缺血组所有TNF-α+细胞中的百分比(68.49±5.12%)显着降低至63.36±9.91%图5中的I-K),这表明MSC处理能够降低星形胶质细胞表达TNF-α。
dMCAO大鼠梗塞区域中存在的GFAP+星形胶质细胞是TNF-α表达的主要来源之一。
GFAP+星形胶质细胞是纹状体和胼胝体中TNF-α的主要来源
除梗死皮层外,假手术组的纹状体和胼胝体中GFAP+星形胶质细胞和TNF-α+细胞均很多。
与缺血对照组相比(图6中的A-D),在MSC输注后,GFAP+星形胶质细胞明显减少(图6中的E-H),GFAP+/TNF-α+双阳性细胞数量显着减少(p<0.05)从22.67±3.62/视野降低至17.26±2.86/视野(图6中的I-J,K)。
MSC输注前,所有GFAP+星形胶质细胞中GFAP+/TNF-α+双阳性细胞的百分比为61.14±7.39%,MSC输注后,降低至55.19±6.67%。同样,MSC的移植使所有TNF-α+细胞中GFAP+/TNF-α+双阳性细胞的百分比从73.68±7.48%降至64.91±11.28%。
在梗塞区域,纹状体和胼胝体中,TNF-α+/GFAP+细胞构成了TNF-α+细胞的主要部分。
CD3+淋巴细胞是TNF-α表达的细胞来源之一
在假手术组的大脑皮层中,几乎没有检测到CD3+淋巴细胞。在缺血对照组中,在梗塞区域观察到大量的CD3+细胞(如图7中的A-D)。双重染色显示TNF-+/CD3+细胞主要分布在梗塞区域(图7中的E-H)。
MSC移植使CD3+细胞数量从缺血组的6.531.41/视野减少到MSC移植组的3.800.98/视野。
MSC处理后,整个CD3+细胞中CD3+/TNF-α+的比例也从20.456.96%降至15.834.45%(图7中的I-K)。
在缺血组中,TNF-α+细胞中CD3+/TNF-α+细胞的百分比为16.784.96%,通过MSC输注显着降低至11.813.59%(图7中的I-K)。
结果表明,CD3+细胞能够表达TNF-α,并且可以被MSC调控。鉴于CD3+/TNF-α+细胞占整个TNF-α+细胞的15%,CD3+淋巴细胞也是dMCAO后脑皮质梗死中TNF-α的细胞资源之一。
中性粒细胞在dMCAO大鼠脑中不表达TNF-α
通过嗜中性粒细胞弹性蛋白酶(NE)(嗜中性粒细胞的标志物)来确定嗜中性粒细胞参与梗死后TNF-α表达。结果显示NE+细胞全部位于梗塞处。我们在大脑中未发现任何NE+TNF-α+细胞。MSC移植并未增加或减少同侧缺血皮层和纹状体中表达TNF-a的中性粒细胞的数量。
梗死区域中活化的GFAP+可能产生神经营养因子,例如IGF-1,和(或)炎性细胞因子,例如TNF-α。与小胶质细胞/巨噬细胞的“M1”和“M2”表型类别类似,最近的研究报道,神经炎症和局部缺血可诱导两种类型的反应性星形胶质细胞,分别称为“A1”和“A2”。由于总GFAP细胞中IGF-1和TNF-α的表达率均超过50%,因此一定有GFAP+星形胶质细胞在同一细胞中同时表达IGF-1和TNF-α;这意味着dMCAO后的这些星形胶质细胞是多功能的。
dMCAO脑的同侧半球中的CD14+单核细胞和CD3+淋巴细胞是缺血性梗塞区和纹状体周围及胼胝体中TNF-α的另外两个次要来源。像小胶质细胞一样,单核细胞也可能是异质的。单核细胞不仅可能表达促炎性细胞因子,例如TNF-α和IL-1β,而且可能是神经营养蛋白的主要来源。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种评价间充质干细胞治疗脑梗死疗效的试剂盒和方法
- 一种间充质干细胞应用于帕金森病治疗效果评价方法
