用于检测猪δ冠状病毒的免疫层析速测卡及其制备方法
文献发布时间:2023-06-19 18:27:32
技术领域
本发明属于动物疫病检测的技术领域,具体涉及一种用于检测猪δ冠状病毒的胶体金免疫层析速测卡及其制备方法。
背景技术
猪δ冠状病毒(Porcine Deltacoronavirus,PDCoV)为δ冠状病毒属成员,是2012年新发现的一种感染猪的冠状病毒,临床特征是引起母猪和仔猪腹泻症状,以呕吐、水样腹泻、脱水和食欲下降为基本特征,发病仔猪中的死亡率为30%~40%。
目前国内外对PDCoV病原的检测多用常规的RT-PCR或RT-qPCR核酸检测方法,但该方法需要专门的实验室场地,需要借助专门的仪器设备,对操作人员要求较高,需要有相当的专业知识、技能和操作经验,样品处理复杂,所需时间较长且检测过程易污染,一般只能应用于实验室检测,而无法在猪场进行现场快速检测。
胶体金免疫层析技术(Gold-immunochromatography assay,GICA)是近年发展起来的一种以胶体金为标记物,其原理是通过硝酸纤维素膜的毛细管虹吸作用,使抗原、抗体在膜上定向流动并在特定区域发生特异性结合,胶体金标记沉淀显色,从而实现靶标的检测。该反应可在15min内完成,且不需要昂贵的仪器和专业人员的操作,具有快速简便、成本低、特异性强、结果直观、环保安全等优点,被广泛用于疾病诊断、毒品检测和环境监测中。
由于本病临床表现与猪流行型腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)引起的仔猪腹泻症状基本相同,无法通过临床症状加以区分,因此开发出一种能在猪场现场快速检测出该病原的技术手段,对猪场防控猪德尔塔冠状病毒引起的疾病具有重要意义。
发明内容
本发明的目的在于克服现有技术的不足,提供一种检测猪δ冠状病毒的胶体金免疫层析速测卡(简称“PDCoV胶体金速测卡”),用于对待检样品诸如猪粪便样本中的PDCoV进行快速、现场和灵敏的检测。
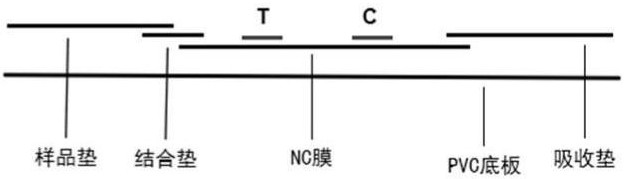
本发明所提供的检测PDCoV的胶体金免疫层析速测卡包括卡壳和设置在卡壳内的试纸条,所述试纸条包括PVC底板、依次相连地粘贴在所述PVC底板上的样品垫、结合垫、硝酸纤维素膜和吸收垫,所述卡壳上设置有加样孔和检测区。所述硝酸纤维素膜上固定有抗PDCoV特异性单克隆抗体用于形成检测线T,所述结合垫上固定有胶体金标记的抗PDCoV特异性单克隆抗体。
优选地,所述抗PDCoV特异性单克隆抗体是利用于2021年2月2日保藏在位于中国武汉市武汉大学的中国典型培养物保藏中心、保藏号为CCTCC NO:C202132的交瘤细胞株FL125-32和/或保藏在中国典型培养物保藏中心、保藏号为CCTCC NO:C202133的杂交瘤细胞株FL125-33制备得到的。
优选地,所述硝酸纤维素膜上固定有利用2021年2月2日保藏在中国典型培养物保藏中心、保藏号为CCTCC NO:C202133的杂交瘤细胞株FL125-33所产生的抗PDCoV特异性单克隆抗体。所述结合垫上固定有胶体金标记的利用保藏在中国典型培养物保藏中心、保藏号为CCTCC NO:C202132的杂交瘤细胞株FL125-32所产生的抗PDCoV特异性单克隆抗体。
优选地,所述硝酸纤维素膜上固定的所述抗PDCoV特异性单克隆抗体的量为0.4μg~1.2μg,所述结合垫上固定的胶体金标记的抗PDCoV特异性单克隆抗体的量为5ng~50ng。
本发明另一方面还提供一种制备检测PDCoV胶体金速测卡的方法,包括以下步骤:1)用抗猪δ冠状病毒的特异性第一抗体在硝酸纤维素膜上形成检测线,用羊抗鼠IgG在所述硝酸纤维素膜形成质控线,得到含有所述检测线和所述质控线的硝酸纤维素膜;2)制备结合垫,所述结合垫上固定有胶体金标记的抗猪δ冠状病毒的特异性第二抗体;3)组装所述免疫层析速测卡:在PVC底板上依次粘贴设置样品垫、所述结合垫、所述硝酸纤维素膜和吸收垫,其中所述样品垫位于所述结合垫上方且所述结合垫与所述样品垫具有1mm~1.5mm的重叠区,所述硝酸纤维素膜位于所述结合垫下方且所述硝酸纤维素膜与所述结合垫具有1mm~2mm的重叠区,所述吸收垫位于所述硝酸纤维素膜的上方且所述吸收垫与所述硝酸纤维素膜具有1mm~2mm的重叠区,所述样品垫是大小为4mm×15mm的玻璃纤维膜;(4)安装卡壳使得其覆盖住所述试纸条,其中所述卡壳上的加样孔位于所述样品垫上方,所述检测区位于所述硝酸纤维素膜上方使得能露出所述检测线和所述质控线所在的位置。
优选地,所述第一抗体和所述第二抗体分别是单克隆抗体。
优选地,所述第一抗体是利用保藏在中国典型培养物保藏中心、保藏号为CCTCCNO:C202133的杂交瘤细胞株FL125-33所产生的抗猪δ冠状病毒单克隆抗体,所述第二抗体是利用保藏在中国典型培养物保藏中心、保藏号为CCTCC NO:C202132的杂交瘤细胞株FL125-32所产生的抗猪δ冠状病毒单克隆抗体。
本发明还提供一种应用上述免疫胶体金速测卡检测PDCoV的方法,其包括以下步骤:(1)样本处理:向猪的新鲜粪便样品中加入的PBS缓冲液(0.2M、pH7.4)作为提取缓冲液,静置或离心,取上清;(2)加样:取100μL步骤(1)中的上清液加入到所述速测卡的加样孔中,孵育8~10min;(3)结果判定:从所述检测区观察速测卡中检测线和质控线的颜色变化。当仅有质控线显色而检测线不显色时,判定待检样品中PDCoV为阴性;当质控线和检测线均显色时,判定待检样品中PDCoV为阳性;当质控线不显色、检测线无论显色或不显色,则结果均无效,需要重新检测。
本发明所提供的PDCoV胶体金速测卡对粪便样本或细胞样本具有较好的抗干扰效果,可为检测部门提供快速、现场和灵敏的检测手段,尤其适用于猪粪便样本的现场检测。速测卡的使用操作简单、检测快速、灵敏度高且特异性强,检测结果清晰、易于判断,整个检测过程无需任何仪器、操作人员无需任何专业培训。
附图说明
图1A为本发明的速测卡结构图,图1B为速测卡中试纸条组成的分解结构示意图。
图2为本发明速测卡检测后的结果显示示意图,其中A为阳性结果示意图,B为阴性结果示意图,C和D均为无效结果示意图。
图3A~图3F是示出实施例2中将六株单克隆抗体进行配对试验结果的图,其中图3A是用单克隆抗体FL125-15在划线作为检测线时进行初步配对试验的结果,图3B是用单克隆抗体FL125-29在硝酸纤维素膜上划线作为检测线时进行初步配对试验的结果,图3C是用单克隆抗体FL125-32在硝酸纤维素膜上划线作为检测线时进行初步配对试验的结果,图3D是用单克隆抗体FL125-33在硝酸纤维素膜上划线作为检测线时进行初步配对试验的结果,图3E是用单克隆抗体FL125-36在硝酸纤维素膜上划线作为检测线时进行初步配对试验的结果,图3F是用单克隆抗体FL125-37在硝酸纤维素膜上划线作为检测线时进行初步配对试验的结果。
图4是示出实施例2中进一步优化配对试验结果的图。
图5A是本发明实施例的速测卡对空白样品PBS检测时结果的图像。
图5B为本发明实施例的速测卡对含PDCoV病毒粒子的溶液样本检测时结果的图像。
图6为本发明实施例的速测卡对PDCoV阴性粪便样本提取液检测时结果的图像。
图7为本发明实施例的速测卡对PDCoV阳性粪便样本提取液检测时结果的图像。
具体实施方式
下面结合附图并通过具体实施方式来进一步描述本发明的技术方案,本发明的优点和特点将会随着描述而更为清楚。但是应当理解,实施例仅是示例性的,不对本发明的范围构成限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
在下文的描述中,所涉及的方法如无特别说明,则均为本领域的常规方法。所涉及的原料如无特别说明,则均是能从公开商业途径获得的原料。
本发明提供一种能检测PDCoV的免疫胶体金速测卡,图1A示意性地示出了速测卡的大体结构,该速测卡主要包括卡壳和设置在卡壳内的试纸条。卡壳上设置有加样孔和检测区,加样孔的尺寸优选为3mm×7mm,检测区的尺寸优选为4mm×18mm。
如图1B所示,试纸条由PVC底板以及依次相连地粘贴在PVC底板上的样品垫、结合垫、硝酸纤维素膜(下文简称为NC膜)和吸收垫组成。其中样品垫位于结合垫上方且结合垫与样品垫具有1mm-1.5mm的重叠区,NC膜位于结合垫下方且NC膜与结合垫具有1mm-2mm的重叠区,吸收垫位于NC膜的上方且吸收垫与NC膜具有1mm-2mm的重叠区。样品垫优选是尺寸为4mm×15mm的玻璃纤维膜。结合垫可以是由本领域技术人员已知的任何合适的材料制成的,尺寸优选为3mm×4mm。NC膜的尺寸优选为4mm×28mm。吸收垫可以是由本领域技术人员已知的任何合适的材料制成的,尺寸优选为4mm×19mm。
NC膜上固定有抗PDCoV单克隆抗体和羊抗鼠IgG,它们分别用于形成针对病毒的检测线T和质控线C。NC膜上单克隆抗体的量优选为0.4μg-1.2μg。抗PDCoV单克隆抗体是利用保藏在中国典型培养物保藏中心、保藏号为CCTCC NO:202133的交瘤细胞株FL125-33制备得到的。
结合垫上固定有胶体金标记的抗PDCoV特异性单克隆抗体,单克隆抗体的量优选为5ng-50ng。该抗PDCoV特异性单克隆抗体是利用保藏在中国典型培养物保藏中心、保藏号为CCTCC NO:202132的交瘤细胞株FL125-32制备得到的。
用上述速测卡检测猪粪便样品中的PDCoV时,首先向加样孔中加入100μL预处理过的样品溶液并水平静置,样品溶液会沿着样品垫向结合垫的方向渗透,静置8~10min后,从检测区观察质控线C、检测线T处的颜色变化。当质控线C和检测线T均显色时,判定待检样品为PDCoV阳性(见图2中的A);当仅有质控线C显色而检测线T不显色时,判定待检样品为PDCoV阴性(见图2中的B);当质控线C不显色、检测线T无论显色或不显色,则结果均无效(见图2中的C和D),需要重新检测。
通过人工合成的方式获得序列优化后的PDCoVN基因片段,该N基因片段具有SEQID NO:1所示的DNA序列。将N基因片段克隆至原核表达载体pET30a,得到质粒载体pET30a-PDCoV。
用质粒载体pET30a-PDCoV转化大肠杆菌BL21(DE3),得到用于外源表达重组PDCoVN蛋白的重组大肠杆菌pET30a-PDCoV(BL21)。将重组大肠杆菌pET30a-PDCoV(BL21)在IPTG诱导条件下培养之后,利用组氨酸标签蛋白亲和纯化填料从培养物中纯化获得重组PDCoVN蛋白。最终纯化获得的重组PDCoVN蛋白的分子量约为46kD,纯度为85%,蛋白浓度为1mg/mL。
将上述纯化获得的重组PDCoVN蛋白制成疫苗,用于免疫6周龄的雌性Balb/c小鼠。第一次免疫所用佐剂为弗氏完全佐剂,将重组PDCoVN蛋白与等体积佐剂混合乳化均匀成油包水的状态,通过皮下多点注射的方式免疫小鼠,每只小鼠每次免疫25μg重组PDCoVN蛋白。第一次免疫28天后进行第二次免疫,第二次免疫所用佐剂为弗氏不完全佐剂,将重组PDCoVN蛋白与等体积佐剂混合乳化均匀成油包水的状态,通过皮下多点注射的方式免疫小鼠。第二次免疫14天后进行第三次免疫,第三次免疫用等量生理盐水与重组PDCoVN蛋白(1mg/mL)混合,通过腹腔注射的方式免疫小鼠。第三次免疫结束后一周进行断尾取血,并分离血清用于检测各免疫小鼠的抗体效价。
接下来,进行细胞融合。
第三次免疫结束后两周,取血清抗体效价最高的小鼠,通过腹腔注射25μg重组PDCoVN蛋白来进行加强免疫。三天后从免疫后小鼠取出脾脏,磨碎,过80目筛网,得到脾细胞,加入SP2/0骨髓瘤细胞,在PEG4000的作用下进行细胞融合。
将融合好的细胞铺进96孔板,用HAT培养液(购自sigma)进行培养,三天后换液,改用HT培养液(购自sigma)培养。10天后,取细胞培养上清,采用间接ELISA方法检测上清中抗体的效价(方法同上)。取反应阳性的孔中的细胞进行亚克隆。
接下来,使用有限稀释法对各阳性孔中的细胞进行亚克隆和建株,10天后进行检测,将检测为阳性的克隆继续采用有限稀释法进行亚克隆,直到得到的所有亚克隆都为阳性。获得六株能够分泌抗PDCoVN蛋白单克隆抗体的杂交瘤细胞株,分别编号为FL125-15、FL125-29、FL125-32、FL125-33、FL125-36和FL125-37,将它们分别扩大培养。为了便于描述,六株杂交瘤细胞株分泌产生的相应单克隆抗体也采用相同的编号。
取6-8周龄的BALB/c小鼠,每只小鼠腹腔注射0.2mL液体石蜡。10天后,将上述培养获得的杂交瘤细胞腹腔接种小鼠来制备相应的单克隆抗体。待小鼠腹部明显膨大时,用弯头滴管采集腹水,通过间接ELISA测定腹水抗体的效价。
从小鼠腹水中分别提纯获取六株以上六株杂交瘤细胞株对应的抗PDCoV单克隆抗体。
将实施例1的六株单克隆抗体进行配对试验,以筛选适用于制备检测PDCoV的胶体金免疫层析速测卡的抗体。
首先,进行初步配对试验。具体过程如下。
1.用单克隆抗体在NC膜上形成检测线
将每株单克隆抗体分别用PBS溶液(0.01M、pH7.4)稀释到1.0mg/mL,用划膜喷金机将各单克隆抗体以1.0μL/cm在NC膜(Pall vivid 170)上划线作为检测线。同时以相同的方式用1.0mg/mL的羊抗鼠IgG(购自杭州隆基生物技术有限公司)在各NC膜上形成质控线。将划线之后的NC膜在37℃下烘24h。
2.在结合垫上固定胶体金标记的单克隆抗体
(1)胶体金颗粒的制备
1)准备:将500mL烧杯、20mL小烧杯、转子、棕色瓶、玻璃棒等洗净后放入酸缸(重铬酸钾:浓硫酸:超纯水=120g:200mL:1000mL)中浸泡24h。取出先用自来水冲洗3次~4次,再用超纯水冲洗3次~4次,置于37℃烘箱中烘干备用。
2)烧金溶液A的配制:用塑料称量匙称取1.00g氯金酸粉末(购自sigma)于棕色瓶中,加入99.0mL超纯水充分溶解,4℃避光保存。
3)烧金溶液B的配制:称取1.00g柠檬酸三钠(购自Sigma)溶解于99.0mL超纯水中,混匀。
4)胶体金的制备:量取99.0mL超纯水于烧杯中,加入1.0mL烧金溶液A,置于恒温磁力搅拌器上搅拌混匀,开启加热至溶液沸腾,迅速加入2.0mL新制备的烧金溶液B,继续搅拌加热,溶液逐渐变为蓝黑色,然后紫黑,再加热出现红色,继续沸煮出现透明的橙红色,继续沸煮10min,自然冷却至室温,加超纯水定容至100mL,倒入棕色瓶,4℃避光保存,得到胶体金溶液,其中胶体金的粒径为40nm,浓度为0.01%。
(2)对单克隆抗体进行标记
1)标记抗体:取1.5mL上述(1)制备好的胶体金溶液,用0.1M的碳酸钾(K
2)纯化标记后的抗体:将上述静置产物在1500rpm下离心弃去由凝聚的金胶粒形成的沉淀,收集上清液;再将上清液于8500rpm下离心30min,仔细吸去上清液,收集沉淀,用含1%BSA的PBS复溶沉淀,得到胶体金标记的单克隆抗体溶液,其浓度为30μg/mL,4℃保存。
(3)喷金与划膜:将上述制备的30μg/mL的胶体金标记的各单克隆抗体以2.0μL/cm分别喷于预处理过的结合垫,烘干,得到固定有胶体金标记的特异性单克隆抗体的结合垫。
3.组装试纸条并进行配对试验
以两两交叉的方式将结合垫与样品垫组装形成胶体金试纸条,NC膜两端分别贴样品垫和吸水纸,将作为待检样品的浓度为0.2ppm的重组PDCoVN蛋白滴加在样品垫上,同时设置空白对照。反应后选取质控线显色、阳性样品检测线显色,而空白对照检测线不显色的单克隆抗体作为配对单抗。
结果如图3A~图3F所示,结果表明在初步配对试验中,当采用单克隆抗体FL125-33形成检测线、胶体金标记的单克隆抗体FL125-15、FL125-32、FL125-36和FL125-37作为标记物时,阳性样品的显色效果较好。
接下来,基于以上初步配对试验的结果,对单克隆抗体FL125-33与FL125-15、FL125-32、FL125-36和FL125-37进行进一步的优化配对试验。
用PBS溶液将单克隆抗体FL125-33稀释到1.0mg/mL后包被NC膜,将单克隆抗体FL125-15、FL125-32、FL125-36和FL125-37分别进行胶体金标记后喷于预处理过的结合垫,将结合垫与样品垫组装形成胶体金测试条,NC膜两端分别贴样品垫和吸水纸。以浓度为0、0.1ppm和0.2ppm的重组PDCoVN蛋白作为待检样品滴加在样品垫上。结果如图4所示,结果表明当采用单克隆抗体FL125-33形成检测线、胶体金标记的单克隆抗体FL125-32作为标记物时,0.1ppm和0.2ppm的重组PDCoVN蛋白均显色效果优异。
鉴于以上配对试验结果,将编号为FL125-33和FL125-32的杂交瘤细胞株在位于中国湖北省武汉市武汉大学的中国典型培养物保藏中心进行保藏,保藏日为2021年2月2日,杂交瘤细胞株FL125-33的保藏号为CCTCC NO:C202133,杂交瘤细胞株FL125-32的保藏号为CCTCC NO:C202132。
基于实施例2配对试验的结果,本实施例利用单克隆抗体FL125-33和FL125-32制备胶体金免疫层析速测卡并建立检测PDCoV的方法。
1、在NC膜形成检测线T和质控线C
用划膜喷金机将浓度为1.0mg/mL的单克隆抗体FL125-33溶液在NC膜(Pall vivid170)上划线作为检测线,同时将浓度为1.0mg/mL的羊抗鼠IgG溶液在NC膜(Pall vivid170)上划线作为质控线C。将划线之后的NC膜在37℃下烘24h,得到含有检测线T和质控线C的NC膜。
2、在结合垫上固定胶体金标记的单克隆抗体
按与实施例2相同的方法制备胶体金标记的单克隆抗体FL125-32。
将制备好的浓度为30μg/mL的胶体金标记的PDCoV单克隆抗体B以2.0μL/cm喷于预处理过的结合垫,烘干,得到固定有胶体金标记的单克隆抗体的结合垫。
3、组装形成试纸条
在PVC底板上依次相连地粘贴样品垫、结合垫、NC膜和吸收垫,形成试纸条。其中,样品垫的一端覆盖在结合垫上,使得样品垫与结合垫具有1mm~1.5mm的重叠区,NC膜位于结合垫下方且NC膜与结合垫具有1mm~2mm的重叠区,吸收垫位于NC膜的上方且吸收垫与NC膜具有1mm~2mm的重叠区。将卡壳覆盖安装在试纸条上,使得加样孔位于样品垫上方以便露出样品垫的一部分,检测区位于NC膜上方以便露出检测线T、质控线C所在的位置。至此完成试纸条的组装。
将试纸条封装到卡壳里,即得到胶体金免疫层析速测卡成品。
用PBS缓冲液配制的PDCoV病毒粒子的溶液对上述速测卡进行检测以评价该速测卡的效果。含1μg/mL PDCoV病毒粒子的溶液作为待测样品,同时用PBS缓冲液(0.2M、pH7.4)(具体配方为:8.0g氯化钠、3.35g十二水合磷酸氢二钠、0.20g磷酸二氢钾、0.20g氯化钾,双蒸水溶解定容至1000mL)作为空白对照。
向各速测卡的加样孔中分别加入100μL待测样品溶液,在室温条件下反应8~10min,从检测区观察显色结果并以拍照的方式记录检测结果。
对于空白对照,结果如图5A所示,可观察到质控线C处呈现明显显色,检测线T处不显色。
对于含1μg/mL PDCoV病毒粒子的溶液,结果如图5B所示,可观察到质控线C和检测线T处均呈现明显显色。
上述结果表明,所制备的速测卡能够准确地检测并鉴别出样品中的PDCoV病毒粒子。
用按实施例3制备的速测卡对以下粪便样本中的PDCoV存在情况进行检测:PDCoV阴性的粪便(图6中的样品1和样品2),PDCoV阳性的粪便(图7中的样品3~样品6)。
首先,按照以下步骤制备各粪便样本的提取液。
(1)用大吸管吸取1mL PBS(0.2M、pH7.4)作为提取缓冲液加入离心管,PBS的具体配制方法为8.0g氯化钠、3.35g十二水合磷酸氢二钠、0.20g磷酸二氢钾和0.20g氯化钾,双蒸水溶解定容至1000mL;
(2)棉签直接蘸取新鲜粪便后立即插入到装有提取缓冲液的离心管,将棉签在管壁上反复用力旋转至少10次,并与管中的溶液混匀,然后在液面上方的管壁上挤压棉签,使液体尽可能被挤出,丢弃棉签;
(3)静置1~2min,优选4000rpm下离心5min;
(4)取上清作为提取液用于后续的检测。
接下来,将上述制备的提取液各取100μL分别加入到速测卡的加样孔中,在室温条件下反应8~10min后,从检测区中观察显色结果并以拍照的方式记录检测结果。
对于PDCoV阴性的粪便样本,结果如图6所示,可观察到质控线C处呈现明显显色,检测线T处不显色。
对于PDCoV阳性的粪便样本,结果如图7所示,可观察到质控线C和检测线T处均呈现明显显色。
上述结果表明,按实施例3所制备的速测卡能够准确地检测并鉴别出粪便样品中的PDCoV,该速测卡可用于针对猪粪便样本中的PDCoV进行快速、现场化且灵敏的检测。
申请人声明,本发明专利通过上述实施例来说明本发明专利的技术方案,所属技术领域的技术人员应该明了,上述的说明不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的,对本发明专利申请进行的这些修改和替代,均落在本发明的专利保护范围内。
SEQUENCE LISTING
<110> 江苏省农业科学院
<120> 用于检测猪δ冠状病毒的免疫层析速测卡及其制备方法
<130> JAAS2021-4
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 1026
<212> DNA
<213> 人工序列
<400> 1
atggcagcac ctgtagtccc aactaccgat gcaagctggt tccaggtgct gaaagcccag 60
aacaagaaag ctacccaccc gcagttccgt ggtaacggtg tccctctgaa cagcgcaatc 120
aaaccagtgg agaaccacgg ctactggctg cgttacaccc gtcagaaacc gggtggtact 180
ccaatccctc cttcctacgc attctactac acgggcaccg gtccacgtgg taacctgaaa 240
tacggcgagc tgccaccaaa cgacactccg gcaactactc gtgtgacttg ggtgaaaggc 300
agcggtgcag atacgagcat caaaccgcac gtggctaaac gcaacccgaa caacccgaaa 360
caccagctgc tgccgctgcg tttcccgact ggtgacggtc cggctcaagg ttttcgtgtt 420
gatccgttta acgctcgtgg tcgtccgcaa gaacgtggtt ctggtccgcg ttctcaatct 480
gtaaactccc gtggtactgg taaccagccg cgtaaacgtg accagtctgc tccggctgct 540
gtacgtcgca agacgcaaca tcaggctccg aaacgcaccc tgccgaaagg caaaaccatt 600
tctcaggttt tcggcaaccg ctctcgcacc ggcgcgaatg ttggctctgc cgatacggag 660
aagaccggca tggcggatcc gcgcatcatg gcgctggcgc gccatgttcc gggcgtacag 720
gaaatgctgt ttgccggcca cctggaatcc aatttccagg ccggcgcgat caccctgacc 780
ttctcctatt ccattaccgt taaagaaggc agcccggatt atgaacgcct gaaagatgcg 840
ctgaataccg ttgttaacca gacctatgaa ccgccgacca aaccgaccaa agacaagaaa 900
ccggataaac aggaccagtc cgccaaaccg aaacagcaga agaaaccgaa gaaagttacc 960
ctgccggcgg acaaacagga ctgggaatgg gacgacgcgt tcgaaattaa gcaggaaagc 1020
gcggcg 1026
- 一种糖皮质激素免疫层析广谱检测卡及其制备方法与应用
- 用于检测犬冠状病毒抗原的免疫荧光层析检测卡与制备方法
- 一种拟除虫菊酯类农药胶体金免疫层析速测卡及其制备方法和使用方法
