盐酸多柔比星脂质体注射液中溶血卵磷脂的检测方法和应用
文献发布时间:2023-06-19 18:30:43
技术领域
本发明涉及化学药物分析方法技术领域,尤其是涉及一种盐酸多柔比星脂质体注射液中溶血卵磷脂的检测方法和应用。
背景技术
盐酸多柔比星脂质体注射液是一种新剂型抗肿瘤药物,在治疗卵巢癌方面具有明显的效果。盐酸多柔比星脂质体是以磷脂和胆固醇为主要成分的纳米微球,将盐酸多柔比星包裹在空腔中,大大减少了盐酸多柔比星与人体正常组织的直接接触,从而显著降低了其毒副作用。
溶血卵磷脂是盐酸多柔比星脂质体注射液在生产过程和放置过程中磷脂降解产生的有害杂质,从而影响药物的质量。并且溶血卵磷脂具有较强的表面活性,能使红细胞及其它细胞膜破裂,引起溶血或细胞坏死。盐酸多柔比星脂质体注射液降解产生的为溶血卵磷脂(18﹕0)及其异构体,因此盐酸多柔比星脂质体注射液中对于该溶血卵磷脂的控制至关重要。
陈华等(《药物分析杂志》,2014年第34卷第3期,442-446页)发表了利用HPLC-ELSD同时测定丙泊酚注射液中溶血磷脂酰胆碱和溶血磷脂酰乙醇胺的含量的方法,然而该方法虽然能够同时进行溶血磷脂酰胆碱和溶血磷脂酰乙醇胺的检验,但在该方法中,溶血磷脂酰胆碱呈现双峰且不能实现完全分离,不能进行准确定量计算。
梁亚龙等(《西北药学杂质》,2020年第35卷第1期,49-52页)发表了利用HPLC-ELSD测定丙泊酚中/长链脂肪乳注射液中溶血磷脂酰胆碱和溶血磷脂酰乙醇胺的含量的方法,该方法虽运行时长较短(17min),但所使用的色谱柱为固定色谱柱Lichroshpher 100 DIOL(250mm×4mm,5μm),相对较昂贵,且该方法对色谱柱选择耐用性不好。
公开号为CN114324622A的专利申请公开了一种改进的药物制剂中溶血磷脂酰胆碱的检测方法,该方法采用高效液相色谱法(蒸发光散射检测器)对氟比洛芬酯注射液中溶血磷脂酰胆碱进行检测,其中以二羟基键合硅胶为填充剂,以甲醇-冰乙酸-三乙胺-异丙醇的混合溶液为流动相,通过调节流动相pH值以减缓对色谱柱的损坏。但该方法使用液相正相系统,不适用于液相反相系统。
因而,开发一种简单、耐用性好且适用于反相液相系统的方法对于盐酸多柔比星脂质体制剂中的溶血卵磷脂的检测十分必要。
有鉴于此,特提出本发明。
发明内容
本发明的一个目的在于提供盐酸多柔比星脂质体注射液中溶血卵磷脂的检测方法,以解决现有技术中存在的检测方法耐用性差及不适用于反相液相系统等的技术问题。
本发明的另一目的在于提供盐酸多柔比星脂质体注射液中溶血卵磷脂的检测方法在盐酸多柔比星脂质体注射液制剂的质量控制中的应用。
为了实现本发明的上述目的,特采用以下技术方案:
盐酸多柔比星脂质体注射液中溶血卵磷脂的检测方法,包括如下步骤:
采用HPLC-ELSD对供试品溶液进行检测;
所述HPLC-ELSD的检测条件包括:
采用流动相A和流动相B进行梯度洗脱;流动相A为体积比为79﹕(7~9)的甲醇和四氢呋喃的混合溶剂,流动相B为水;
所述梯度洗脱程序如下:
在本发明的具体实施方式中,所述梯度洗脱程序如下:
本发明的盐酸多柔比星脂质体注射液中溶血卵磷脂的检测方法,能够一次性高效的分离溶血磷脂酰胆碱的两异构体峰,这种限量的检测方法有利于制剂的质量控制,保证制剂的有效性。并且,本发明所建立的方法准确度高、专属性强、重复性好、耐用性良好。通过对盐酸多柔比星脂质体注射液中溶血卵磷脂的含量控制,提高产品质量。
如在不同实施方式中,流动相A中,甲醇和四氢呋喃的体积比可以为79﹕7、79﹕7.5、79﹕8、79﹕8.5、79﹕9等等,优选为79﹕(7.5~8.5),更优选为79﹕8。
在本发明的具体实施方式中,色谱柱为十八烷基硅烷键合硅胶色谱柱。进一步的,所述色谱柱为Agilent 5 TC-C18(2),250mm×4.6mm,5μm或Waters Symmetry C18,250mm×4.6mm,5μm。
在本发明的具体实施方式中,色谱柱的柱温为30~40℃。
如在不同实施方式中,色谱柱的柱温可以为30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃等等,优选为34~36℃,更优选为35℃。
在本发明的具体实施方式中,所述梯度洗脱的流速为0.8~1.2mL/min,优选为0.9~1.1mL/min,更优选为1mL/min。
如在不同实施方式中,所述梯度洗脱的流速可以为0.8mL/min、0.85mL/min、0.9mL/min、0.95mL/min、1.0mL/min、1.05mL/min、1.1mL/min、1.15mL/min、1.2mL/min等等。
在本发明的具体实施方式中,蒸发光散射检测器的载气流速为1L/min,蒸发温度为48~52℃。
如在不同实施方式中,蒸发温度可以为48℃、49℃、50℃、51℃、52℃等等,优选为49~51℃,更优选为50℃。
在本发明的具体实施方式中,所述溶血卵磷脂包括溶血磷脂酰胆碱18﹕0及其异构体。
在本发明的具体实施方式中,所述供试品溶液的制备包括:采用溶剂溶解并稀释供试品,过滤,取续滤液作为供试品溶液;其中,所述溶剂为体积比为3﹕1的甲醇和氯仿的混合溶剂。进一步的,所述稀释的倍数为8~12倍,如10倍。进一步的,所述供试品为盐酸多柔比星脂质体注射液。
在本发明的具体实施方式中,系统适用性溶液的制备包括:采用甲醇溶解溶血磷脂酰胆碱对照品,先加入盐酸溶液于室温下放置2~3h后,再加入氢氧化钠溶液,定容摇匀,得到系统适用性溶液。进一步的,所述系统适用性溶液的制备包括:采用适量甲醇溶解溶血磷脂酰胆碱对照品4mg,先加入1mol/L盐酸溶液5mL,于室温下放置2h后加入1mol/L氢氧化钠溶液5mL,用甲醇稀释至25mL,摇匀。系统适用性溶液的制备可根据实际情况放大或缩小规格。
在本发明的具体实施方式中,所述方法还包括:采用标准曲线法对所述供试品溶液中的溶血卵磷脂的含量进行计算。进一步的,所述方法包括:将溶血磷脂酰胆碱标准系列工作溶液分别注入高效液相色谱仪中,在与所述供试品溶液相同的条件下测定相应的色谱图,以标准系列工作溶液的浓度的对数值作为横坐标,对应的峰面积的对数值为纵坐标,绘制标准曲线;以所述供试品溶液的色谱图中溶血磷脂酰胆碱及其异构体的峰面积之和作为供试品的峰面积,代入标准曲线中,计算得到所述供试品溶液中溶血磷脂酰胆碱的浓度。进一步的,所述标准系列工作溶液中,溶血磷脂酰胆碱的浓度范围可以为15~150μg/mL,如可以为15μg/mL、30μg/mL、50μg/mL、100μg/mL、150μg/mL等等。具体的含量计算公式可参考标准曲线法公式:
在本发明的具体实施方式中,所述检测条件包括:
色谱柱:Agilent 5 TC-C18(2),250mm×4.6mm,5μm;
柱温:35℃;
流动相A为体积比为79﹕8的甲醇和四氢呋喃的混合溶剂;
梯度洗脱流速为1mL/min;
梯度洗脱程序为:
载气流速为1L/min;
蒸发温度为50℃。
本发明还提供了上述任意一种所述盐酸多柔比星脂质体注射液中溶血卵磷脂的检测方法在盐酸多柔比星脂质体注射液的质量控制中的应用。
与现有技术相比,本发明的有益效果为:
(1)本发明的盐酸多柔比星脂质体注射液中溶血卵磷脂的检测方法,能够一次性高效的分离溶血磷脂酰胆碱的两异构体峰,这种限量的检测方法有利于制剂的质量控制,保证制剂的有效性;
(2)本发明所建立的方法准确度高、专属性强、重复性好、耐用性良好;通过对盐酸多柔比星脂质体注射液中溶血卵磷脂的含量控制,可提高盐酸多柔比星脂质体注射液产品的质量。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例1提供的供试品溶液的色谱图;
图2为本发明实施例1提供的系统适用性溶液的色谱图;
图3为本发明实施例提供的溶血磷脂酰胆碱对照品的线性关系图。
具体实施方式
下面将结合附图和具体实施方式对本发明的技术方案进行清楚、完整地描述,但是本领域技术人员将会理解,下列所描述的实施例是本发明一部分实施例,而不是全部的实施例,仅用于说明本发明,而不应视为限制本发明的范围。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
具体实施方式中的对专属性、检测限与定量限、精密度、线性与范围、准确度、溶液稳定性等项目的验证,按照《化学药物质量控制分析方法验证技术指导原则》、《化学药物质量标准建立的规范化过程技术指导原则》、《化学药物杂质研究技术指导原则》、《化学药物残留溶剂研究技术指导原则》以及现行版《中华人民共和国药典》附录中有关的指导原则进行方法学验证。
下述实施例中盐酸多柔比星脂质体注射液来源于振东制药股份有限公司。
实施例1
本实施例提供了盐酸多柔比星脂质体注射液中溶血卵磷脂的检测方法,包括如下步骤:
(1)溶液配制
供试品溶液:精密量取盐酸多柔比星脂质体注射液1mL,置10mL量瓶中,用体积比为3﹕1的甲醇和氯仿的混合溶剂溶解并稀释至刻度,摇匀,作为供试品溶液;
系统适用性溶液:取溶血磷脂酰胆碱对照品约4mg,置25mL量瓶中,加甲醇适量使其溶解,先加入1mol/L盐酸溶液5mL,于室温下放置2h后加入1mol/L氢氧化钠溶液5mL,用甲醇稀释至刻度,摇匀,即得。
(2)高效液相色谱检测条件
仪器:Agilent 1260高效液相色谱仪;
检测器:Agilent 385蒸发光散射检测器;
载气流速:1L/min;
蒸发温度:50℃;
色谱柱:Agilent TC-C18(5μm,250×4.6mm)色谱柱;
流动相:采用流动相A和流动相B按照表1进行梯度洗脱;其中,流动相A的配制包括:取甲醇790mL与四氢呋喃80mL混匀;流动相B为水;
流动相流速:1mL/min;
柱温:35℃;
进样体积:20μL。
表1梯度洗脱程序表(体积分数)
(3)检测步骤
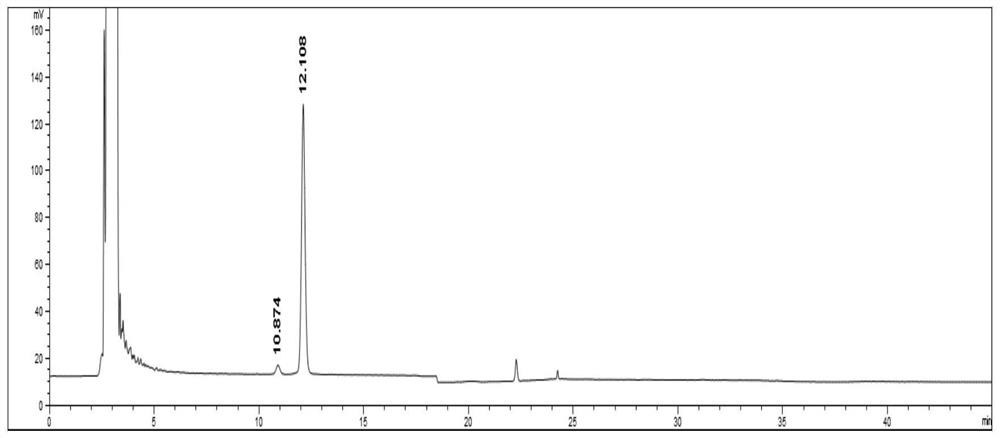
精密量取系统适用性溶液、供试品溶液各20μL,注入液相色谱仪,按照步骤(2)中的条件进行检测,记录色谱图,系统适用性溶液和供试品溶液的色谱图分别如图1和图2所示。色谱图中,溶血磷脂酰胆碱两异构体峰之间的分离度良好。
实施例2
本实施例参考实施例1的检测方法,区别仅在于:步骤(2)的高效液相色谱检测条件中,柱温为30℃。
实施例3
本实施例参考实施例1的检测方法,区别仅在于:步骤(2)的高效液相色谱检测条件中,柱温为40℃。
实施例4
本实施例参考实施例1的检测方法,区别仅在于:步骤(2)的高效液相色谱检测条件中,流动相流速为0.8mL/min。
实施例5
本实施例参考实施例1的检测方法,区别仅在于:步骤(2)的高效液相色谱检测条件中,流动相流速为1.2mL/min。
实施例6
本实施例参考实施例1的检测方法,区别仅在于:步骤(2)的高效液相色谱检测条件中,蒸发温度48℃。
实施例7
本实施例参考实施例1的检测方法,区别仅在于:步骤(2)的高效液相色谱检测条件中,蒸发温度52℃。
实施例8
本实施例参考实施例1的检测方法,区别仅在于:步骤(2)的高效液相色谱检测条件中,流动相A为体积比为79﹕7的甲醇和四氢呋喃的混合溶剂。
实施例9
本实施例参考实施例1的检测方法,区别仅在于:步骤(2)的高效液相色谱检测条件中,流动相A为体积比为79﹕9的甲醇和四氢呋喃的混合溶剂。
实施例10
本实施例参考实施例1的检测方法,区别仅在于:步骤(2)的高效液相色谱检测条件中,色谱柱为Waters Symmetry C18(5μm,250×4.6mm)。
实施例1~10的测试结果见表2。
表2不同检测条件下各成分之间的而分离数据
实施例11
本实施例提供了盐酸多柔比星脂质体注射液中溶血卵磷脂的检测方法的系统适用性试验,包括如下步骤:
(1)溶液配制
空白溶剂:体积比为3﹕1的甲醇和氯仿。
空白原辅料溶液:
精密称定胆固醇79.8mg、培化磷脂酰乙醇胺79.8mg,置于25mL量瓶中,加空白溶剂溶解并稀释至刻度,摇匀,作为贮备液(1);
另取盐酸多柔比星原料50mg置于另一个25mL量瓶中,缓慢加入蔗糖缓冲液(精密称取蔗糖5.0g、组氨酸77.6mg、硫酸铵30mg置烧杯中,加水40mL使溶解,并用2mol/L盐酸溶液调节pH值至6.5±0.1,再加水至50mL,摇匀)使其溶解并稀释至刻度,摇匀,作为贮备液(2);
分别精密量取贮备液(1)和贮备液(2)各1mL于10mL量瓶中,用空白溶剂稀释至刻度,摇匀,滤过,作为空白原辅料溶液。
系统适用性溶液:取溶血磷脂酰胆碱对照品约4mg,置25mL量瓶中,加甲醇适量使其溶解,先加入1mol/L盐酸溶液5mL,于室温下放置2h后加入1mol/L氢氧化钠的水溶液5mL,用甲醇稀释至刻度,摇匀,即得。
对照品贮备液(0.2mg/mL):取溶血磷脂酰胆碱对照品约10mg,精密称定,置50mL量瓶中,加空白溶剂溶解并稀释至刻度,摇匀。
对照品溶液(0.1mg/mL):取对照品贮备液5mL置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
(2)分别精密量取上述空白原辅料溶液、系统适用性溶液、对照品溶液各20μL,注入液相色谱仪(对照品溶液连续进样5次,其它溶液1次),按照实施例1中的检测条件进行检测,记录色谱图;测试结果见表3和表4。
空白溶剂、空白原辅料均不干扰待测成分检测;系统适用性溶液中,溶血磷脂酰胆碱两异构体峰之间的分离度大于1.5;且进样精密度良好。
表3系统适用性溶液结果
表4进样精密度实验结果
实验例1
专属性试验
1、滤膜吸附试验
(1)溶液配制
对照品溶液、对照品贮备液、空白原辅料溶液、系统适用性溶液、对照品溶液均使用实施例11的(1)中的;
供试品溶液:精密量取供试品2mL、对照品贮备液10mL置20mL量瓶中,用体积比为3﹕1的甲醇和氯仿的混合溶剂溶解并稀释至刻度,摇匀。
离心供试品溶液:取供试品溶液适量离心(10000rpm,5min)处理后,取上清液。
滤膜干扰样品:取供试品溶液适量,用尼龙滤膜(0.22μm)过滤,分别弃去不同的体积(1、3、5mL)初滤液,作为过滤供试品溶液-1ml,过滤供试品溶液-3ml,过滤供试品溶液-5ml。
(2)分别精密量取上述空白原辅料溶液、系统适用性溶液、对照品溶液、离心供试品溶液及过滤供试品溶液各20μL,注入液相色谱仪,按照实施例1中的检测条件进行检测,记录色谱图;测试结果见表5。
滤膜吸附试验中,弃去不同体积后的供试品溶液溶血磷脂酰胆碱峰面积与离心供试品溶液溶血磷脂酰胆碱峰面积的百分比,在98.0%~102.0%之间,无吸附。符合验证要求。
表5滤膜吸附试验结果
2、降解实验
(1)溶液配制
空白溶剂、空白原辅料溶液、对照品溶液同实施例11中(1)对应的溶液。
供试品溶液:精密量取供试品1mL置10mL量瓶中,用空白溶剂溶解并稀释至刻度,摇匀,滤过。
酸降解供试品溶液:精密量取供试品1mL,置10mL量瓶中,加0.05mol/L的盐酸溶液0.5mL,摇匀,置50℃电热鼓风干燥箱中放置1h,取出,冷却至室温,加0.05mol/L的氢氧化钠溶液0.5mL中和,加空白溶剂溶解并稀释至刻度,摇匀,过滤,取续滤液作为酸降解供试品溶液。(同法配制酸降解空白溶液)
碱降解供试品溶液:精密量取供试品1mL,置10mL量瓶中,加0.1mol/L的氢氧化钠溶液0.5mL,摇匀,室温放置40min,加0.1mol/L的盐酸溶液0.5mL中和,加空白溶剂溶解并稀释至刻度,摇匀,过滤,取续滤液作为碱降解供试品溶液。(同法配制碱降解空白溶液)
氧化降解供试品溶液:精密量取供试品1mL,置10mL量瓶中,加30%过氧化氢溶液0.5mL,摇匀,室温放置2h,加空白溶剂溶解并稀释至刻度,摇匀,过滤,取续滤液作为氧化降解供试品溶液。(同法配制氧化降解空白溶液)
高温降解供试品溶液:精密量取供试品1mL,置10mL量瓶中,置80℃电热恒温干燥箱中放置2h,取出,放冷至室温,加空白溶剂溶解并稀释至刻度,摇匀,过滤,取续滤液作为高温降解供试品溶液。
强光降解供试品溶液:精密量取供试品1mL,置10mL量瓶中,置可扩展试验箱(光照5000Lux,紫外1.0wh/m
(2)分别精密量取上述空白原辅料溶液、系统适用性溶液、对照品溶液及各降解供试品溶液各20μL,注入液相色谱仪,按照实施例1中的检测条件进行检测,记录色谱图;测试结果见表6。
各降解条件下,与溶血磷脂酰胆碱两异构体相邻的降解杂质分离度均大于1.5。各降解条件降解杂质均不影响溶血卵磷脂检测。均符合验证要求。
表6各降解条件中供试品溶液分离度考察结果
备注:分离度一列中的“—”表示未降解出干扰杂质
实验例2
灵敏度试验
(1)溶液配制
空白溶剂:体积比为3﹕1的甲醇和氯仿。
系统适用性溶液:取溶血磷脂酰胆碱对照品约4mg,置25mL量瓶中,加甲醇适量使其溶解,先加入1mol/L盐酸溶液5mL,于室温下放置2h后加入1mol/L氢氧化钠溶液5mL,用甲醇稀释至刻度,摇匀,即得。
对照品贮备液(0.2mg/mL):取溶血磷脂酰胆碱对照品约10mg精密称定,置50mL量瓶中,加空白溶剂溶解并稀释至刻度,摇匀。
对照品溶液(0.1mg/mL):取对照品贮备液5mL置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
定量限溶液(0.015mg/mL):精密量取对照品贮备液0.75mL置10mL量瓶中,加空白溶剂稀释至刻度,摇匀,作为定量限溶液。
检测限溶液(0.005mg/mL):精密量取对照品贮备液0.25mL置10mL量瓶中,加空白溶剂稀释至刻度,摇匀,作为检测限溶液。
(2)分别精密量取上述系统适用性溶液、定量限溶液及检测限溶液各20μL,注入液相色谱仪,按照实施例1中的检测条件进行检测,记录色谱图;测试结果见表7。
定量限、检测限结果均小于标准规定(每1mL含溶血卵磷脂不得过1.0mg),均符合验证要求。
表7溶血磷脂酰胆碱灵敏度测试结果
实验例3
线性考察
(1)溶液配制
空白溶剂:体积比为3﹕1的甲醇和氯仿。
对照品贮备液(0.2mg/mL):取溶血磷脂酰胆碱对照品约10mg,精密称定,置50mL量瓶中,加空白溶剂溶解并稀释至刻度,摇匀。
对照品溶液(0.1mg/mL):精密量取对照品贮备液5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
各浓度线性溶液:
线性溶液1(15%)(0.015mg/mL):精密量取对照品贮备液1.5mL,置20mL量瓶中,加空白溶剂稀释至刻度,摇匀。
线性溶液2(30%)(0.03mg/mL):精密量取对照品贮备液1.5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
线性溶液3(50%)(0.05mg/mL):精密量取对照品贮备液2.5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
线性溶液4(100%):同对照品溶液。
线性溶液5(150%)(0.15mg/mL):精密量取对照品贮备液7.5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
(2)分别精密量取上述线性溶液1~5各20μL,注入液相色谱仪,按照实施例1中的检测条件进行检测,记录色谱图;以各线性溶液浓度的对数值对相对应峰面积的对数值进行线性回归计算,线性关系图如图3所示,测试结果见表8。
线性相关系数≥0.990,y轴截距小于100%浓度峰面积对数的10.0%,各浓度点响应因子RSD小于5.0%,均符合验证要求。
表8溶血磷脂酰胆碱线性结果
实验例4
重复性试验
(1)溶液配制
空白溶剂:体积比为3﹕1的甲醇和氯仿。
系统适用性溶液:取溶血磷脂酰胆碱对照品约4mg,置25mL量瓶中,加甲醇适量使其溶解,先加入1mol/L盐酸溶液5mL,于室温下放置2h后加入1mol/L氢氧化钠溶液5mL,用甲醇稀释至刻度,摇匀,即得。
对照品溶液(0.1mg/mL):取溶血磷脂酰胆碱对照品约10mg,精密称定,置100mL量瓶中,加空白溶剂溶解并稀释至刻度,摇匀。
对照品贮备液(0.2mg/mL):取溶血磷脂酰胆碱对照品约10mg,精密称定,置50mL量瓶中,加空白溶剂溶解并稀释至刻度,摇匀。
对照品溶液-1(0.015mg/mL):精密量取对照品贮备液0.75mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
对照品溶液-2(0.03mg/mL):精密量取对照品贮备液1.5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
对照品溶液-3(0.05mg/mL):精密量取对照品贮备液2.5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
对照品溶液-4(0.10mg/mL):精密量取对照品贮备液5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
对照品溶液-5(0.15mg/mL):精密量取对照品贮备液7.5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
供试品溶液:精密量取供试品1mL、对照品贮备液5mL置10mL量瓶中,用空白溶剂溶解并稀释至刻度,摇匀,滤过。平行配制6份。
(2)分别精密量取上述线性对照品1~5溶液及供试品溶液各20μL,注入液相色谱仪,按照实施例1中的检测条件进行检测,记录色谱图;测试结果见表9。
6份供试品含量结果的RSD小于5.0%,符合验证要求。
表9重复性测试结果
实验例5
准确度试验
(1)溶液配制
空白溶剂:体积比为3﹕1的甲醇和氯仿。
系统适用性溶液:取溶血磷脂酰胆碱对照品约4mg,置25mL量瓶中,加甲醇适量使其溶解,先加入1mol/L盐酸溶液5mL,于室温下放置2h后加入1mol/L氢氧化钠溶液5mL,用甲醇稀释至刻度,摇匀,即得。
对照品溶液(0.1mg/mL):取溶血磷脂酰胆碱对照品约10mg,精密称定,置100mL量瓶中,加空白溶剂溶解并稀释至刻度,摇匀。
对照品贮备液(0.2mg/mL):取溶血磷脂酰胆碱对照品约20mg,精密称定,置100mL量瓶中,加空白溶剂溶解并稀释至刻度,摇匀。
供试品溶液:精密量取供试品1mL,置10mL量瓶中,加空白溶剂溶解并稀释至刻度,摇匀,滤过。
对照品溶液-1(0.015mg/mL):精密量取对照品贮备液0.75mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
对照品溶液-2(0.03mg/mL):精密量取对照品贮备液1.5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
对照品溶液-3(0.05mg/mL):精密量取对照品贮备液2.5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
对照品溶液-4(0.10mg/mL):精密量取对照品贮备液5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
对照品溶液-5(0.15mg/mL):精密量取对照品贮备液7.5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
50%回收率溶液:精密量取供试品1mL、对照品贮备液2.5mL置10mL量瓶中,用空白溶剂溶解并稀释至刻度,摇匀,滤过,作为50%回收率溶液。(同法配制3份)
100%回收率溶液:精密量取供试品1mL、对照品贮备液5mL置10mL量瓶中,用空白溶剂溶解并稀释至刻度,摇匀,滤过,作为100%回收率溶液。(同法配制3份)
150%回收率溶液:精密量取供试品1mL、对照品贮备液7.5mL置10mL量瓶中,用空白溶剂溶解并稀释至刻度,摇匀,滤过,作为150%回收率溶液。(同法配制3份)
(2)分别精密量取上述所有溶液各20μL,注入液相色谱仪,按照实施例1中的检测条件进行检测,记录色谱图;测试结果见表10。
各浓度水平的回收率均在90.0%~110.0%之间;3个水平回收率RSD:1.3%,小于5.0%,均符合验证要求。
表10回收率测试结果
实验例6
稳定性试验
(1)溶液配制
空白溶剂:体积比为3﹕1的甲醇和氯仿。
系统适用性溶液:取溶血磷脂酰胆碱对照品约4mg,置25mL量瓶中,加甲醇适量使其溶解,先加入1mol/L盐酸溶液5mL,于室温下放置2h后加入1mol/L氢氧化钠溶液5mL,用甲醇稀释至刻度,摇匀,即得。
对照品贮备液(0.2mg/mL):取溶血磷脂酰胆碱对照品约10mg,精密称定,置50mL量瓶中,加空白溶剂溶解并稀释至刻度,摇匀。
对照品溶液(0.1mg/mL):精密量取对照品贮备液5mL,置10mL量瓶中,加空白溶剂稀释至刻度,摇匀。
供试品溶液:精密量取供试品1mL、对照品贮备液5mL置10mL量瓶中,用空白溶剂溶解并稀释至刻度,摇匀,滤过。
(2)分别精密量取上述系统适用性溶液、对照品溶液及供试品溶液各20μL,注入液相色谱仪,按照实施例1中的检测条件进行检测,记录色谱图;测试结果见表11和表12。
计算各时间点溶血磷脂酰胆碱峰面积与0h溶血磷脂酰胆碱峰面积的百分比,对照品和供试品溶液每个时间点的结果与初始结果相比,相对含量在95.0%~105.0%之间,溶液稳定性良好。
表11对照品溶液稳定性结果
表12供试品溶液稳定性结果
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 盐酸多柔比星脂质体注射液中铵根含量的测定方法
- 盐酸多柔比星脂质体注射液中硫酸根含量的测定方法
