一种鲜乳中外泌体规模化提取方法
文献发布时间:2023-06-19 19:07:35
技术领域
本发明属于提取工艺技术领域,具体涉及一种规模化提取鲜乳中外泌体的方法。
背景技术
外泌体是一类由细胞释放的脂质双层膜的代谢产物,透射电镜下呈圆形或杯状,直径为30~150nm。大量研究表明,外泌体含有多种蛋白质、核酸、脂质等成分。从目前的研究中发现外泌体具有十分光明的应用前景,它含有丰富的标志物,可应用于疾病的监测、治疗等方面。而且不同组织、细胞来源的外泌体都有其来源组织、细胞的特性,在外泌体介导的细胞间物质、信息交流过程中发挥关键作用。同时外泌体在临床治疗、载体药物、临床检测等方面有广大的应用前景,肿瘤细胞外泌体中的蛋白、脂质、RNA、miRNA等组分可作为癌症诊断和预兆。
在目前研究的鲜乳中也发现大量的外泌体存在,已有研究表明,鲜乳外泌体有助于免疫调节,调节肠道的发育以及对一些疾病有所缓解。国内对于鲜乳外泌体研究主要集中在外泌体的提取和鉴定以及作为药物载体、疾病筛查标志物的研究上,国外对牛乳外泌体的研究更多一点不仅涉及到人体免疫系统、肠道发育、癌症预防、肥胖、糖尿病等慢性疾病发展带来的风险。最近鲜乳外泌体的研究越来越深入,作为一种产品,研究方向,功能性研究需求量也在增多,因此大量提取鲜乳外泌体的方法有待解决。
目前提取外泌体的技术有很多,主要有超速离心法、试剂盒法,蔗糖密度梯度离心法是最常用的外泌体提取纯化手段。这几种方法提取的数量有限,过程也比较费时,对设备要求高,回收率也有限,纯度也达不到要求。以上几种方法都不能解决大规模提取纯化的要求,限制了外泌体产业化的应用范围。
鲜乳中外泌体的分离提取方法文献报道的也不多,现有的各种提取方法也存在各种利弊,尤其是大规模提取方面少之又少,很难达到批量化生产。而且,鲜乳中乳脂肪以脂肪球的状态分散在乳浆中,一般直径为0.1~10μm,绝大数为2~5μm,影响外泌体提取的最大阻碍因素就是脂肪颗粒,它在鲜乳中的含量一般为3%~5%,且不溶于水,呈微球状分散于鲜乳中,形成乳浊液,不能通过普通的过滤去除。因此,寻找一种成本低廉、高效、适用性广的鲜乳外泌体规模化提取并同时能去除脂肪颗粒的方法显得尤为重要。
发明内容
本发明的目的是针对鲜乳外泌体提取技术存在的问题,提供一种大规模提取鲜乳中外泌体的方法。
为实现上述目的,本发明采用的鲜乳中外泌体规模化提取方法包括以下步骤:
1.将鲜乳用亲水疏脂的纳米界面网膜进行过滤,除去鲜乳中的脂肪颗粒,收集滤液。
2.将步骤1收集的滤液通过孔径100kDa~300kDa超滤膜的切向流超滤装置进行超滤,对除去脂肪颗粒的滤液进行浓缩。
3.将步骤2收集的浓缩鲜乳和双水相溶液充分混合后进行离心分离,弃上相,收集下相;下相重复该步骤1~2次,进一步浓缩外泌体溶液;所述双水相溶液是将聚乙二醇和葡聚糖溶解在蒸馏水或者PBS缓冲液中配制而成,双水相溶液中聚乙二醇的浓度为20~40g/L、葡聚糖的浓度为14~20g/L。
4.将步骤3中浓缩的外泌体溶液用稀释液稀释后经过凝胶柱进一步分离,所述凝胶柱采用高度交联琼脂糖作为填料,稀释液为含150mM NaCl的20mM pH=7.2Tris-HCl缓冲液。
上述步骤1中,所述鲜乳包括鲜牛奶、鲜羊奶、鲜人乳、骆驼乳中任意一种或多种。
上述步骤1中,所述亲水疏脂的纳米界面网膜的涂层为聚乙烯醇/二氧化硅纳米复合薄膜,该薄膜与水的接触角为0
上述步骤3中,优选将步骤2收集的浓缩鲜乳和双水相溶液按体积比为1:3~3:1充分混合后进行离心分离。
上述步骤3中,所述聚乙二醇的分子量5kDa~35kDa,葡聚糖的分子量7kDa~65kDa。
上述步骤3中,所述离心分离的离心力是1000~3000g,离心时间是10~40分钟。
上述步骤4中,所述高度交联琼脂糖的分子量为600kDa~800kDa,粒径为75~95μm。
本发明的有益效果如下:
1.本发明首先通过亲水疏脂的纳米界面网膜对鲜乳进行过滤,收集澄清液,除去鲜乳中的脂肪颗粒,解决了由于脂肪对纯化的影响;接着用孔径100kDa~300kDa超滤膜的切向流超滤装置超滤,进行第一次浓缩,除去部分小分子的蛋白和水分,澄清的鲜乳被浓缩了10~20倍;浓缩处理后的鲜乳澄清滤液用聚乙二醇和葡聚糖组合配制成的双水相溶液进行离心分离,进行第二次浓缩和初步纯化,外泌体被压缩到葡聚糖相,除去上相,此过程重复1~2次后,此时澄清的外泌体已被浓缩了60~150倍,使生产级别的量变成实验室级别的量,外泌体达到高度浓缩,使得使用凝胶柱分离成为可能;最后以高度交联琼脂糖为填料的凝胶柱分离去除其他的杂蛋白和凋亡小体,纯化出不同粒径大小的外泌体和细胞外囊泡,实现对鲜乳中外泌体的规模化提取。
2.本发明整个操作过程简单,避免了高速离心对提取规模的限制,适合大规模提取和浓缩,通过近百倍高度浓缩,克服了凝胶柱上样量有限的问题,解决了大规模提取的难度。整个实验过程没有引入变性能力较强的化学试剂和剧烈的反应,对外泌体的损伤较小,不需要超速离心机、免疫磁珠,可以做到工业化生产,无需复杂的过程,可以处理大量的不同来源的外泌体,提取的外泌体经过活性的鉴定、电镜检测、粒径分析、纳米颗粒示踪分析、蛋白含量检测等一系列鉴定验证,损伤率小,突变率小,性质稳定。
附图说明
图1是鲜牛奶除去脂肪颗粒前(a)以及采亲水疏脂的纳米界面网膜除去脂肪颗粒后(b)和采用化学试剂沉淀法除去脂肪颗粒后(c)的显微镜观察图片。
图2是实施例1中切向流超滤装置超滤浓缩后进行的粒径分析(NTA)验证所得到的颗粒粒径分布图。
图3是实施例1中双水相溶液提取的外泌体进行粒径分析(NTA)验证所得到的颗粒粒径分布图片。
图4是实施例1中凝胶柱提取的外泌体的透射电镜(TEM)验证图片。
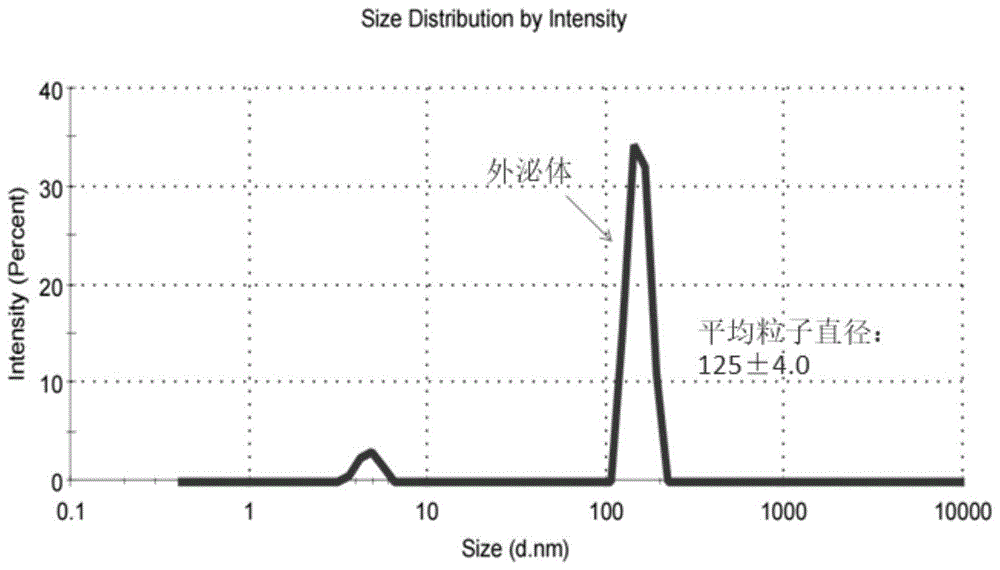
图5是实施例1中凝胶柱提取的外泌体进行粒径分析(NTA)验证所得到的颗粒粒径分布图片。
图6是实施例1中高度交联琼脂糖凝胶柱分离后不同大小囊泡的分布图。
图7是图6中峰1和峰2物质使用外泌体蛋白标志物CD63进行验证图(westernblot)。
具体实施方式
首先,本发明以新鲜牛奶为例,比较亲水疏脂的纳米界面网膜(涂层为聚乙烯醇/二氧化硅复合薄膜)分离除去脂肪颗粒和化学试剂沉淀去除脂肪颗粒的效果。具体实验为:取1000mL新鲜牛奶通过以聚乙烯醇/二氧化硅复合薄膜为涂层的亲水疏脂的纳米界面网膜进行过滤,去除鲜牛奶中的脂肪颗粒,收集穿过液;另取1000mL新鲜牛奶置于烧杯中,加热至40℃,加入0.2M pH 4.6的醋酸钠缓冲溶液,边加边晃动,用质量浓度为1%的NaOH水溶液或体积浓度为10%的醋酸水溶液调节pH值为4.8,冷却至室温,放置5分钟,用滤纸过滤,除去沉淀物,再用1.4μm孔径的微滤(MF)膜过滤,除去大部分脂肪颗粒,收集穿过液。对比图1中a、b、c图可以看出,聚乙烯醇/二氧化硅复合薄膜除去脂肪颗粒更干净,效果更好。
接着,本发明以新鲜牛奶为例,考察普通超滤和切向流超滤方式对外泌体浓缩效果影响的影响。具体实验为:将1000mL新鲜牛奶通过以聚乙烯醇/二氧化硅复合薄膜为涂层的亲水疏脂的纳米界面网膜进行过滤,去除鲜牛奶中的脂肪颗粒,收集滤液。将一部分收集的滤液通过普通0.45μm孔径超滤膜进行超滤(压力比0.22μm的小),收集超滤液,再用孔径100kDa超滤膜过滤,除去部分小分子的蛋白和水分,收集超滤膜上的浓缩液体,液体浓缩了15倍,但是过滤过程压力增大,后续过滤很难进行,溶液堵塞滤膜,中途需要换滤器。将另一部分收集的滤液通过孔径100kDa聚醚砜超滤膜的切向流超滤装置进行超滤,除去部分小分子的蛋白和水分,超滤膜上的浓缩液体,液体浓缩了近10倍,和普通超滤相比浓缩时间缩短一倍以上;将浓缩液体进一步与双水相溶液(由分子量为35kDa的聚乙二醇和分子量为50kDa的葡聚糖充分溶解在蒸馏水中配制而成,其中聚乙二醇的浓度为33.5g/L、葡聚糖的浓度为16.5g/L)以1:1体积比混合,3000g离心20分钟,弃上相,收集的下相溶液,再将收集的下相与双水相溶液以体积比为1:1混合,重复离心分离一次,除去上相中90%左右的液体,最后剩余液体相对于新鲜牛奶浓缩了125倍左右。双水相浓缩后的外泌体溶液经过电镜鉴定和粒径分析,已经基本能够满足实验的要求。
然后,本发明以新鲜牛奶为例,考察了切向流超滤装置超滤过程中超滤膜孔径变化对外泌体浓缩效果影响。具体实验为:每组取2000mL新鲜牛奶通过以聚乙烯醇/二氧化硅复合薄膜为涂层的亲水疏脂的纳米界面网膜进行过滤,去除鲜牛奶中的脂肪颗粒,收集滤液,然后将收集的滤液通过表1所示的不同孔径大小聚醚砜超滤膜的切向流超滤装置进行超滤,除去部分小分子的蛋白和水分,超滤效果见表1。
表1不同孔径大小超滤膜超滤结果对比
由上述表1中实验结果可见,超滤膜选择孔径在300kDa,浓缩效果最好,随着超滤膜孔径的缩小,超滤时间延长,效率变差,但对提取结果影响不大,能够满足实验要求,当超滤孔径选用10kDa时,除了以上特点外,提取的外泌体粒径增大,经检测杂颗粒增多。因此,本发明选择孔径100kDa~300kDa超滤膜。
最后,本发明以新鲜牛奶为例,考察不同分子量大小的聚乙二醇(PEG)和葡聚糖(DEX)组成的双水相溶液对外泌体浓缩效果的影响。具体实验为:每组取200mL新鲜牛奶通过以聚乙烯醇/二氧化硅复合薄膜为涂层的亲水疏脂的纳米界面网膜进行过滤,去除鲜牛奶中的脂肪颗粒,收集滤液,然后将收集的滤液通过孔径300kDa聚醚砜超滤膜的切向流超滤装置进行超滤,除去部分小分子的蛋白和水分,收集超滤膜上的浓缩液体,将浓缩液体与表2中所示的由不同分子量大小的PEG和DEX组成的双水相溶液(由PEG和DEX充分溶解在蒸馏水中配制而成,其中PEG的浓度为33.5g/L、DEX的浓度为16.5g/L)以1:1体积比混合,3000g离心20分钟,弃上相,收集下相葡聚糖中回收的外泌体溶液。外泌体的回收率如下表2。
表2不同分子量PEG和DEX组成的双水相溶液提取外泌体回收率
注:表中回收率是指下相中外泌体所占的体积浓度。
由上表2可以看出,PEG35kDa和DEX50kDa组合配制的双水相溶液提取外泌体的回收率最高,其余组合随着分子量的变化回收率逐渐减少,但均满足使用要求。
下面具体结合附图和实施例对本发明进行进一步详细描述,但本发明的保护范围并不仅限于此。
实施例1
以鲜牛奶为例,提取鲜牛奶中的外泌体
1、将2000mL鲜牛奶通过以聚乙烯醇/二氧化硅复合薄膜为涂层的亲水疏脂的纳米界面网膜进行过滤,去除鲜牛奶中的脂肪颗粒,收集滤液。
2、将步骤1收集的滤液通过孔径100kDa聚醚砜超滤膜的切向流超滤装置进行超滤,除去部分小分子的蛋白和水分,收集超滤浓缩液约200mL,液体浓缩了近10倍。由图2可见,超滤浓缩后所提取的外泌体有三个峰,经验证有外泌体、囊泡和凋亡小体。
3、选取13.4g分子量为35kDa的聚乙二醇和6.6g分子量为50kDa的葡聚糖充分溶解在蒸馏水中后定容至400mL,配制成双水相溶液,所述双水相双水相溶液中聚乙二醇的浓度为33.5g/L、葡聚糖的浓度为16.5g/L。然后将步骤2收集的超滤浓缩液与双水相溶液以1:1体积比混合,3000g离心20分钟,弃上相,收集的下相溶液大约40mL。再将收集的下相与双水相溶液以体积比为1:1混合,重复离心分离一次,除去上相中80%的液体,最后剩余13mL液体,相对于鲜牛奶浓缩了150倍左右。由图3的粒径分析,双水相溶液提取后,前面一个峰是杂蛋白,后一个峰是外泌体。
4、将色谱仪连接以粒径为600~800kDa,粒径为75~95μm高度交联琼脂糖为填料的凝胶柱,上样前先用含0.1M NaCl的20mM pH 7.2PB缓冲液平衡柱子,流速为0.5mL/min,待电导及紫外吸收值基线稳定后,将步骤3浓缩后最后剩余的16mL外泌体溶液用含150mMNaCl的20mM pH=7.2Tris-HCl缓冲液稀释至30mL后进行上样,上样流速0.5mL/min,直至出现流穿峰。分别收集各个分离峰,其中第一、第二个峰均是目标峰外泌体,第三个峰为外囊泡。收集完成后用洗柱液(含1M NaOH的体积浓度为30%的异丙醇水溶液)进行柱子清洗。对收集的各个峰的外泌体溶液进行鉴定,其余分装储存在-80℃即可。由图4电镜检测和图5粒径分析可见,所提取的外泌体平均粒径为125±4.0nm,纯度较高。进一步将提取的外泌体溶液穿过交联琼脂糖为填料的凝胶柱得到图6,经过分析所分峰1和峰2均为外泌体,峰3为细胞分泌的囊泡;将分峰1和峰2提取的外泌体使用标志物CD63进行蛋白标志物验证,由图7westernblot可见,峰1和峰2均为外泌体。
实施例2
在实施例1的步骤3中,将步骤2收集的超滤浓缩液与双水相溶液以3:1体积比混合,3000g离心20分钟,弃上相,下相比例较多,收集的下相溶液大约200mL。再将收集的下相与双水相溶液以体积比为3:1混合,重复离心分离2次,除去上相中的液体,最后剩余33mL液体,相对于鲜牛奶浓缩了60倍左右。其他步骤与实施例1相同。
实施例3
在实施例1的步骤3中,将步骤2收集的超滤浓缩液与双水相溶液以1:3体积比混合,3000g离心20分钟,弃上相,收集的下相溶液大约100mL。再将收集的下相与双水相溶液以体积比为1:3混合,重复离心分离2次,除去上相中的液体,最后剩余20mL液体,相对于鲜牛奶浓缩了100倍左右。其他步骤与实施例1相同。
- 一种提取乳外泌体的方法
- 一种用于捕获血液中外泌体的磁性纳米颗粒的制备方法及其应用
- 一种快速提取血浆中外泌体的方法和提取试剂
- 一种人脐带间充质干细胞外泌体提取液的制备及外泌体乳霜的制备方法
