包含纳米颗粒的组合物、其制备方法和用途
文献发布时间:2023-06-19 19:07:35
相关申请
本专利申请要求提交于2020年4月10日,名称为“包含纳米颗粒的组合物、其制备方法和用途”,发明人名称为Maria Ines MITRANI的美国临时专利申请号63/008,355的优先权。前述专利申请的全部内容通过引用并入本文。
发明概述
在某些方面,本文提供了无细胞治疗性组合物,其包含改良的人羊水(HAF)。在某些方面,本文提供了无细胞治疗性组合物,其包含(a)改良的人羊水(HAF);和(b)HAF衍生的纳米颗粒;其中纳米颗粒的直径大于50nm,并且组合物中颗粒的浓度为至少1x10
此外,本文在某些方面提供了治疗有此需要的受试者的肺部疾病或肺部病症的方法,其包括向受试者施用治疗有效量的本文公开的治疗性组合物,其中肺部疾病或病症选自急性呼吸综合征、慢性阻塞性肺疾病(COPD)和支气管肺发育不良。
此外,在某些方面,本文提供了预防或治疗有此需要的受试者的关节炎的方法,其包括向受试者施用治疗有效量的本文公开的治疗性组合物。在某些实施方案中,关节炎是骨关节炎或类风湿性关节炎。
此外,在某些方面,本文提供了预防或治疗有此需要的受试者的急性脑损伤的方法,其包括向受试者施用治疗有效量的本文公开的治疗性组合物。在某些实施方案中,急性脑损伤可以由急性呼吸综合征冠状病毒,如COVID-19引起。
此外,在某些方面,本文提供了预防或治疗有此需要的受试者的急性器官衰竭的方法,其包括向受试者施用治疗有效量的本文公开的治疗性组合物。在某些实施方案中,急性器官衰竭或急性序贯器官衰竭(acute sequential organ failure)可以由急性呼吸综合征冠状病毒,如COVID-19引起。
附图简述
附图例示了本技术的实施方案并且不是限制性的。为了清楚和便于说明,附图未按比例绘制,并且在一些情况下,可以将各个方面夸大或放大显示以促进对特定实施方案的理解。
图1A-1C显示了Organicell Flow和Organicell Flow-XL的纳米颗粒分析。图1A显示了Organicell Flow的实施方案的纳米颗粒分布。图1B显示了Organicell Flow-XL的实施方案的纳米颗粒分布。图1C显示了Organicell Flow和Organicell Flow-XL之间的纳米颗粒浓度比较。具有正斜率的连接线代表Flow-XL和Flow之间增加的纳米颗粒浓度(N=4,p值<0.005,t检验)。
图2显示了Organicell Flow(Flow)和Organicell Flow-XL(Flow-XL)中外泌体标志物CD63的浓度测定。y轴显示CD63的浓度(pg/ml)。具有正斜率的连接线代表Flow-XL和Flow之间增加的CD63浓度(N=3)。
图3显示了Organicell Flow和Organicell Flow XL产品的Bradford分析结果(对于Flow为n=11,对于Flow XL为n=6)。
图4显示了代表性的斑点印迹分析(分析#1),其表明在本文所述的治疗性组合物(例如,Organicell Flow XL)中所选细胞因子和生长因子的存在及其相对浓度。Organicell Flow的结果在该测定中提供了相似的结果。定位并标记相应的蛋白质,同时由相对于阳性对照点平均值的倍数表达强度确定相对表达水平。
图5A-5C显示了代表性细胞因子测定的额外结果,其表明在本文所述的治疗性组合物(例如,Organicell Flow XL)中所选细胞因子和生长因子的存在及其相对浓度。Organicell Flow XL和Organicell Flow的结果在这些测定中提供了相似的结果。定位并标记相应的蛋白质,同时由相对于阳性对照点平均值的表达强度倍数确定相对表达水平。
图6显示了图4和5的斑点印迹分析的汇总,其表明在本文所述的治疗性组合物(例如,Organicell Flow XL)中所选细胞因子和生长因子的存在及其相对浓度。OrganicellFlow的结果在该测定中提供了相似的结果。通过相较于阳性对照点平均值的表达强度倍数计算相对表达。完成的斑点印迹分析揭示了调节组织再生和修复的各个方面的若干细胞因子(参见颜色图例)。
图7显示了Organicell Flow(Flow)和Organicell Flow XL(Flow XL)产品中透明质酸的浓度。
图8A-8C显示了Organicell Flow(Flow)和Organicell Flow XL(Flow XL)产品中纳米颗粒分布(图8A)、纳米颗粒浓度(图8B)和纳米颗粒模式粒径(图8C)的代表性分析。所分析产品的数量:Flow=12/Flow XL=5。
图9显示了外泌体(纳米颗粒)表面标志物的代表性分析,其显示了它们在分离的外泌体上的相对量。
图10显示了在分离的外泌体上阳性表达的表面标志物的平均中位荧光强度(Y轴)(所分析产品的数量=3)。
图11显示了通过质谱法分析的3种独立的Organicell Flow组合物的Vin图分析以及观察到的共同和独特蛋白质的量化。
图12显示了按蛋白质类型分类的在Organicell Flow中检测到的1225种共同蛋白质。
图13显示了Organicell Flow蛋白质货物的生物信息学分析,其揭示了参与DNA损伤修复调节的40种独特蛋白质。使用Qiagen IPA软件完成数据分析。仅已知具有实验观察到的关系的那些蛋白质包括在分析中。
图14显示了从Organicell Flow外泌体测序的102种共同成熟miRNA。
图15显示了已鉴定的Organicell Flow miRNA的1216个RNA靶标的最高典型途径分析。该分析揭示了最有可能受miRNA货物递送调节的最高途径。
图16A-16B显示了在建立的支气管肺发育不良(BPD)体内大鼠模型中OrganicellFlow-XL的评估。图16A显示了在常氧(空心条)和高氧条件(黑色条)下,Organicell Flow-XL(羊膜外泌体)与盐水对照(PBS)相比对右心室收缩压(RVSP)的影响。图16B显示了在常氧(空心条)和高氧条件(黑色条)下,Organicell Flow-XL(羊膜外泌体)与盐水对照(PBS)相比对右心室肥大的影响(对于盐水n=4,对于flow-XL n=11,**p值<0.005)。
图17显示了经处理动物和对照动物的IVIS活体成像。左:无染料对照;中:盐水染料对照;右:外泌体染料处理。
图18显示了参与细胞因子介导的免疫应答的Organicell miRNA靶标。
图19显示了与ARDS相关联的Organicell miRNA基因靶标。
图20显示了Organicell的60种不同途径,鉴定了与ARDS基因相关的29种miRNA。
图21显示了在第0、30和90天的疼痛(图A)、僵硬(图B)、身体机能(图C)和总WOMAC(图D)的西安大略和麦克马斯特大学骨关节炎指数(Western Ontario and McMasterUniversities Osteoarthritis Index,WOMAC)分量表评分。数据表示为平均值±SD(n=5)。不同时间点间具体WOMAC分量表评分的比较通过单因素ANOVA进行,p=0.01(A),p=0.07(B),p=0.003(C),p=0.003(D)。使用Tukey事后检验来比较每个时间点之间的特定WOMAC评分的差异,*p<0.05,**p<0.01。
图22显示了第0、30和90天个体患者的疼痛(图A)、僵硬(图B)、身体机能(图C)和总WOMAC(图D)的WOMAC分量表评分。每条线代表一名患者在第0、30和90天的具体WOMAC评分。
图23A显示了第30天和第90天的WOMAC评分相较于第0天的平均降低。图23B显示了第90天的WOMAC评分相较于第30天的平均降低。数据表示为平均降低%±SD(n=5)。
图24显示了Organicell Flow-XL施用对肺结构和巨噬细胞浸润的影响:(A-C)显示接受Organicell Flow-XL的HYP动物中肺泡结构得到改善的代表性肺切片。(D-F)显示HYP组中血管假性血友病因子(Von Willebrand Factor,vWF)免疫染色(绿色)减少的代表性免疫荧光染色。(G-I)显示HYP组中肺血管肌化增加的肺切片的代表性免疫荧光染色,绿色=vWF,红色=α-平滑肌肌动蛋白。(J-L)用MAC-3抗体(棕色)免疫染色的代表性肺切片,其显示接受Organicell Flow-XL的HYP组中MAC-3染色减少。(M)接受Organicell Flow-XL的HYP组中降低的平均线性截距(n=4-7/组)。(N)HYP组中的血管密度无显著差异(n=6/组)。(O)肌化血管的平均百分比的量化揭示了接受Organicell Flow-XL的HYP组中血管重塑减少(n=5-6/组)。(P)所有组中MAC-3+细胞的平均数量的量化(n=4-5/组)。误差棒表示平均值的标准差。*p值<0.05,***p值<0.001,****p值<0.0001。
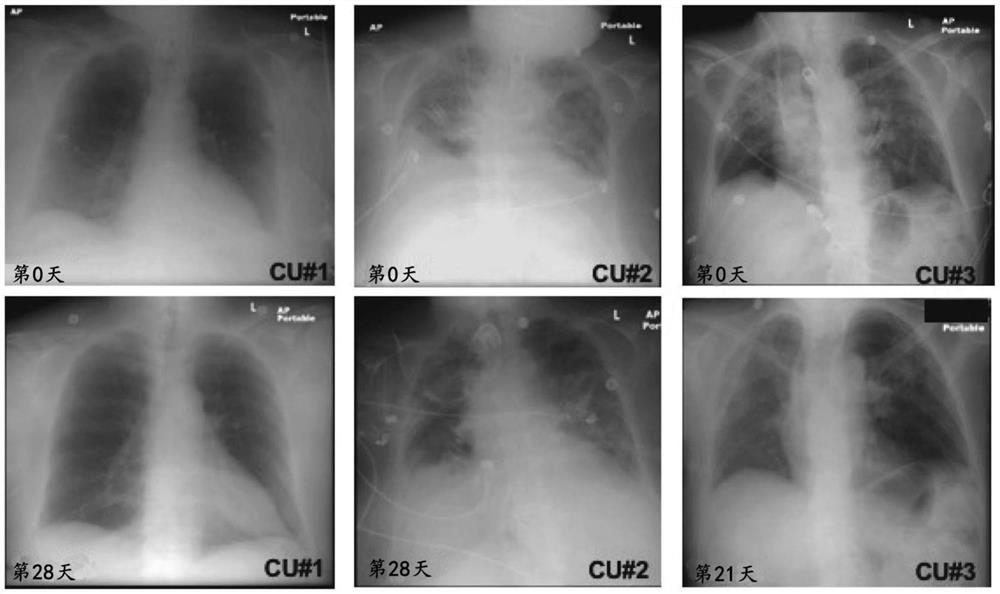
图25显示了胸部X射线图像。患者CU#1在第0天和第28天的胸部X射线图像(左)。患者CU#2在第0天和第28天的胸部X射线图像(中)。患者CU#3在第0天和第21天的胸部X射线图像(右)。
发明详述
本文部分提供了衍生自人羊水(HAF)的新型无细胞治疗性组合物。HAF是部分表征的保护性流体,其包含在妊娠期间围绕胎儿的羊膜囊内。HAF含有水、盐、蛋白质、碳水化合物、脂质、磷脂、尿素、细胞因子、生长因子、乳酸、丙酮酸、酶、激素、牛磺酸、氨基酸、乳铁蛋白碎片和细胞的复杂混合物。HAF还含有称为胎毛的衍生自胎儿的细毛和为覆盖在胎儿皮肤上的蜡状或奶酪状白色物质的胎脂。胎脂由专门的胎儿细胞产生,在胎儿发育期间和出生后数小时内赋予保护作用。
HAF也包括细胞。在HAF中发现的各种细胞包括来自胎儿皮肤、呼吸道、消化道和泌尿道的细胞,以及衍生自羊膜的细胞,以及巨噬细胞、造血祖细胞和干细胞。认为造血祖细胞和干细胞赋予HAF愈合、再生和发育特性,而认为巨噬细胞提供一定水平的免疫防御。从HAF中分离出的一些细胞表达神经标志物,如巢蛋白(Nestin)、β3-微管蛋白、GFAP、NEFH,以及胚胎干细胞(ESC)的若干标志物,如SSEA-4、Oct4和Nanog。这些细胞表现出成骨、成脂、成肌和神经分化。它们也可以分化为肝细胞和内皮细胞。
组合物
本文提供了HAF衍生的组合物,在本文中称为治疗性组合物。然而,本文提供的治疗性组合物在含量和功能上都明显不同于天然存在的HAF。在一些实施方案中,治疗性组合物是无细胞的或基本上无细胞的。因此,在某些实施方案中,治疗性组合物不含真核细胞或原核细胞。在某些实施方案中,治疗性组合物不含真核细胞,真核细胞的非限制性实例包括母体衍生的细胞、胎儿衍生的细胞、胎盘衍生的细胞、红细胞、有核细胞、白血细胞(whiteblood cell)或白细胞(leukocyte)、巨噬细胞、造血祖细胞、干细胞、上皮细胞等及其组合。在某些实施方案中,治疗性组合物不含原核细胞,原核细胞的非限制性实例包括细菌细胞,其非限制性实例包括丙酸杆菌属(例如,痤疮丙酸杆菌)、棒状杆菌属、短杆菌属和葡萄球菌属(例如,表皮葡萄球菌)。
在某些实施方案中,治疗性组合物不含病原体,病原体的非限制性实例包括病毒、细菌、真菌、酵母和寄生物。在某些实施方案中,治疗性组合物不含病毒。
在一些实施方案中,治疗性组合物包含改良的HAF。在某些实施方案中,改良的HAF是经处理以去除细胞、病原体、胎脂、胎毛和/或大颗粒(例如,直径大于400nm、大于300nm或大于200nm的颗粒)中的一种或多种的组合物。在一些实施方案中,改良的HAF基本上或完全无细胞、病原体、胎脂、胎毛和大颗粒。在一些实施方案中,改良的HAF基本上无纳米颗粒。在某些实施方案中,改良的HAF是过滤的HAF。在一些实施方案中,改良的HAF是通过具有0.2μm或更大,或0.1μm或更大的孔径的过滤器过滤的HAF。在一些实施方案中,改良的HAF是通过具有0.1μm至1μm、0.2μm至1μm或0.2μm至0.5μm的孔径的过滤器过滤的HAF。在某些实施方案中,改良的HAF是在100xg至2500xg或200xg至2000xg下离心合适时间段的HAF。
在一些实施方案中,治疗性组合物包含0%至99%(vol/vol)的改良的HAF。在某些实施方案中,治疗性组合物包含50%至99%、60%-99%、70%-99%、70%-95%或70%-90%的改良的HAF。
在一些实施方案中,治疗性组合物包含纳米颗粒。在一些实施方案中,治疗性组合物包含HAF衍生的纳米颗粒。在一些实施方案中,治疗性组合物包含1%至50%(vol/vol)的纳米颗粒。在一些实施方案中,治疗性组合物包含1%至40%、1%至30%、1%至25%、5%至40%、5%至30%、5%至25%或10%至40%(vol/vol)的纳米颗粒。
在一些实施方案中,治疗性组合物包含至少1x10
在一些实施方案中,治疗性组合物包含透明质酸。在一些实施方案中,治疗性组合物包含至少100ng/ml、至少200ng/ml、至少250ng/ml、至少300ng/ml、至少350ng/ml、至少400ng/ml、至少550ng/ml、至少600ng/ml或至少700ng/ml的量的透明质酸。在一些实施方案中,治疗性组合物包含在100-5000ng/ml、200-5000ng/ml、300-5000ng/ml、400-5000ng/ml、500-5000ng/ml、200-3000ng/ml、200-2000ng/ml、200-1000ng/ml、200-500ng/ml、300-500ng/ml、500-800ng/ml或600-800ng/ml的范围内的平均、中位或绝对量的透明质酸。在一些实施方案中,治疗性组合物包含衍生自或天然存在于HAF中的透明质酸。在一些实施方案中,治疗性组合物包含重组产生的透明质酸。在一些实施方案中,治疗性组合物包含从非人来源表达、产生、分离和/或纯化的透明质酸。
在一些实施方案中,治疗性组合物包含选自图4、5A、5B、5C和6中所示的细胞因子、可溶性受体和生长因子的一种或多种细胞因子、可溶性受体和/或生长因子。在一些实施方案中,治疗性组合物包含一种或多种细胞因子、可溶性受体和/或生长因子,其非限制性实例包括血管生成素(ANG)、BLC、EGF(表皮生长因子)、FGF-6(成纤维细胞生长因子6)、GCP-2(CXCL6)、IGFBP-1(胰岛素样生长因子结合蛋白1)、IGF-BP2(胰岛素样生长因子结合蛋白2)、IGF-BP4(胰岛素样生长因子结合蛋白4)、IL-1RA(白细胞介素1受体拮抗剂)、IL-6、瘦素、MCP-1(CCL2)、MIG(CXCL9)、MIP-1DELTA、NAP-2、脂联素(ACRP30)、GRO-A、HCC-4、HGF、ICAM-1、IGFBP-6、IL-1R4、IL-6R、IL-8、OPG、sTNFRII、sTNFRI、TIMP-1、TIMP-2和UPAR。在一些实施方案中,治疗性组合物包含选自以下列表的两种或更多种细胞因子、可溶性受体和/或生长因子:血管生成素(ANG)、BLC、EGF、FGF-6、GCP-2、IGFBP-1、IGF-BP2、IGF-BP4、IL-1RA、IL-6、瘦素、MCP-1、MIG、MIP-1DELTA、NAP-2、脂联素(ACRP30)、GRO-A、HCC-4、HGF、ICAM-1、IGFBP-6、IL-1R4、IL-6R、IL-8、OPG、sTNFRII、sTNFRI、TIMP-1、TIMP-2和UPAR。在一些实施方案中,治疗性组合物包含选自以下列表的一种或多种、三种或更多种、四种或更多种、五种或更多种、六种或更多种、八种或更多种或者十种或更多种细胞因子、可溶性受体和/或生长因子:血管生成素(ANG)、BLC、EGF、FGF-6、GCP-2、IGFBP-1、IGF-BP2、IGF-BP4、IL-1RA、IL-6、瘦素、MCP-1、MIG、MIP-1DELTA、NAP-2、脂联素(ACRP30)、GRO-A、HCC-4、HGF、ICAM-1、IGFBP-6、IL-1R4、IL-6R、IL-8、OPG、sTNFRII、sTNFRI、TIMP-1、TIMP-2和UPAR。在一些实施方案中,治疗性组合物包含ANG、IL-1RA、MCP-1、IL-6、UPAR、FGF-6、EGF、HGF、LEPTIN和ACRP30。在一些实施方案中,治疗性组合物包含选自以下列表的一种或多种、三种或更多种、四种或更多种、五种或更多种、六种或更多种、八种或更多种或者十种或更多种细胞因子、可溶性受体和/或生长因子:ACRP30、AGRP、ANGPT2、AREG、AXL、B-NGF、BFGF、BTC、CCL28、CTAK、DTK、EGFR、ENA-78、FAS、FGF-4、FGF-9、G-CSF、GITR、GITR配体、GRO、GRO-ALPHA、HCC-4、HGF、I-TAC、ICAM-1、ICAM-3、IGF-1SR、IGFBP-3、IGFBP-6、IL-11、IL-12P40、IL-12P70、IL-17、IL-1R1、IL-2R ALPHA、IL-6R、IL-8、IL1R4、MIF、MIP-1ALPHA、MIP-2BETA、MIP-3BETA、MSPALPHA、NT-4、OPG、OSM、PLGF、SGP130、sTNFRI、sTNFRII、TECK、THPO、TIMP-1、TIMP-2、TRAILR3、TRAIL R4、UPAR、VEGF、VEGF-D、XCL1、ANG、BDNF、BLC、BMP4、BMP6、CCL23、CNTP、EGF、Eoxtanin 1、Eoxtanin 2、Eoxtaxin 3、FGF-6、FGF-7、FLT3-配体、分形趋化因子(FRACTALKINE)、GCP-2、GDNF、GMCSF、I-309、IGF-1、IGFBP1、IGFBP2、IGFBP4、IL-10、IL-13、IL-15、IL-16、IL-1B、IL-1RA、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL1-A、IFN GAMMA(IFNγ)、瘦素、LIGHT、M-CSF、MCP-1、MCP-2、MCP-3、MCP4、MDC、MIG、MIP-1A、MIP-3A、NAP-2、NT-3、PARC、PDGFBB、RANTES、SCF、SDF1A、TARC、TGF-B1、TGF-B3、TNFA和TNFB。在一些实施方案中,治疗性组合物包含衍生自或天然存在于HAF中的细胞因子或生长因子。在一些实施方案中,治疗性组合物包含重组产生的细胞因子或生长因子。在一些实施方案中,治疗性组合物包含从非人来源表达、产生、分离和/或纯化的细胞因子或生长因子。
在一些实施方案中,治疗性组合物包含至少10pg/ml、至少100pg/ml、至少1ng/ml、至少50ng/ml、至少100ng/ml、至少200ng/ml、至少250ng/ml、至少300ng/ml、至少400ng/ml、至少500ng/ml、至少600ng/ml或至少700ng/ml的量的细胞因子或生长因子。在一些实施方案中,治疗性组合物包含在1-5000ng/ml、10-5000ng/ml、100-5000ng/ml、200-5000ng/ml、300-5000ng/ml、400-5000ng/ml或500-5000ng/ml的范围内的平均、中位或绝对量的细胞因子或生长因子。
在一些实施方案中,治疗性组合物包含至少10pg/ml、至少100pg/ml、至少200pg/ml、至少300pg/ml、至少400pg/ml、至少500pg/ml、至少1ng/ml、至少50ng/ml、至少100ng/ml、至少200ng/ml、至少250ng/ml、至少300ng/ml、至少400ng/ml、至少500ng/ml、至少600ng/ml或至少700ng/ml的量的CD63。在一些实施方案中,治疗性组合物包含在100pg/ml-1000ng/ml、300pg/ml-1000ng/ml、400pg/ml-1000ng/ml或450pg/ml-1000ng/ml的范围内的平均、中位或绝对量的CD63。
纳米颗粒
在一些实施方案中,治疗性组合物包含纳米颗粒(例如,多个纳米颗粒)。在一些实施方案中,治疗性组合物包含HAF衍生的纳米颗粒(例如,多个纳米颗粒)或由HAF衍生的纳米颗粒(例如,多个纳米颗粒)组成。在一些实施方案中,纳米颗粒包含外泌体或由外泌体组成。在一些实施方案中,纳米颗粒包含核内体或由核内体组成。在一些实施方案中,纳米颗粒或外泌体包含膜结合或膜包封的囊泡。在一些实施方案中,纳米颗粒包含膜结合或膜包封的囊泡,其中膜组分包含磷脂双层。在一些实施方案中,纳米颗粒衍生自HAF。在一些实施方案中,纳米颗粒是合成的膜包封的囊泡,其可以装载选择的膜结合货物或囊泡内货物。
如本文所公开的,衍生自HAF的纳米颗粒或外泌体不同于衍生自其他来源的外泌体。HAF衍生的外泌体在其miRNA含量以及蛋白质含量上不同于在其他体液(如乳汁、血液、尿液)中发现的外泌体。不受理论的限制,衍生自HAF的外泌体是独特的,因为它们由母体、胎儿和胎盘组织,以及与羊水接触的许多不同细胞类型衍生和/或产生。
在一些实施方案中,纳米颗粒具有至少10nm、至少25nm、至少40nm、至少50nm、至少55nm、至少60nm、至少70nm、至少80nm、至少90nm或至少100nm的平均、中位或绝对直径。在一些实施方案中,纳米颗粒具有至少50nm的平均、中位或绝对直径。在一些实施方案中,纳米颗粒具有约10nm至300nm、30nm至300nm、40nm至300nm、50nm至300nm、50nm至250nm、50nm至250nm、50nm至200nm、75nm至200nm或100nm至150nm的范围内的平均、中位或绝对直径。在一些实施方案中,纳米颗粒具有约100nm至200nm的范围内的平均、中位或绝对直径。在一些实施方案中,纳米颗粒具有约100nm、125nm、150nm、175nm或约200nm的平均、中位或绝对直径。
在一些实施方案中,纳米颗粒包含一种或多种表面结合蛋白,其非限制性实例包括CD9、CD63、CD81、CD326、CD133、CD14、CD24、CD42a、CD44、CD29、CD146、HLA-DR、HLA-DP和HLA-DQ。在一些实施方案中,纳米颗粒包含选自以下的两种或更多种、五种或更多种、或十种或更多种表面结合蛋白:CD9、CD63、CD81、CD326、CD133、CD14、CD24、CD42a、CD44、CD29、CD146、HLA-DR、HLA-DP和HLA-DQ。在一些实施方案中,纳米颗粒包含选自CD9、CD63、CD81、CD326和CD133的三种或更多种表面结合蛋白。在一些实施方案中,纳米颗粒包含选自CD14、CD24、CD42a、CD44、CD29、CD14和CD146的两种或更多种表面结合蛋白。在一些实施方案中,纳米颗粒包含表面结合的CD9、CD63、CD81、CD326和CD133。在一些实施方案中,纳米颗粒包含表面结合的CD14、CD24、CD42a、CD44、CD29、CD14和CD146。在一些实施方案中,纳米颗粒包含表面结合的HLA-DR、HLA-DP和HLA-DQ。在一些实施方案中,纳米颗粒包含表面结合的CD63。
在一些实施方案中,纳米颗粒包含一个或多个微小RNA(miRNA)。在某些实施方案中,miRNA是小的非编码RNA分子,有时含有约22个核苷酸,通常在RNA沉默和基因表达的转录后调节中发挥作用。在一些实施方案中,纳米颗粒包含选自表1的一个或多个miRNA。在一些实施方案中,纳米颗粒包含选自表1的两个、三个、四个、五个、十个、二十个、二十五个或三十个或更多个miRNA。在一些实施方案中,纳米颗粒包含选自以下的五个或更多个miRNA:hsa-let-7b、hsa-mir-200c、hsa-mir-30d、hsa-mir-125a、hsa-mir-483、hsa-mir-34c、hsa-mir-200a、hsa-mir-148a、hsa-mir-191、hsa-mir-21、hsa-mir-146a、hsa-mir-26b、hsa-mir-92b、hsa-mir-342、hsa-mir-34b、hsa-mir-423、hsa-mir-205、hsa-mir-203a、hsa-mir-99b、hsa-mir-375、hsa-mir-10b、hsa-mir-449c、hsa-mir-320a和hsa-let-7f-2。在一些实施方案中,纳米颗粒包含选自以下的五个或更多个、或者十个或更多个miRNA:hsa-let-7b、hsa-mir-200c、hsa-mir-30d、hsa-mir-125a、hsa-mir-483、hsa-mir-34c、hsa-mir-200a、hsa-mir-148a、hsa-mir-191、hsa-mir-21、hsa-mir-146a、hsa-mir-26b、hsa-mir-92b、hsa-mir-342、hsa-mir-34b、hsa-mir-423、hsa-mir-205、hsa-mir-203a、hsa-mir-99b、hsa-mir-375、hsa-mir-10b、hsa-mir-449c、hsa-mir-320a、hsa-let-7f-2、hsa-mir-23a、hsa-mir-27b、hsa-mir-93、hsa-mir-221、hsa-mir-425、hsa-mir-151a、hsa-mir-190b、hsa-mir-223、hsa-mir-1180、hsa-mir-184、hsa-mir-361、hsa-mir-182、hsa-mir-92a-1、hsa-mir-29a、hsa-mir-183、hsa-mir-204、hsa-mir-574、hsa-mir-532、hsa-mir-28、hsa-mir-744、hsa-mir-2110、hsa-mir-140、hsa-mir-1307、hsa-mir-193b、hsa-mir-660、hsa-mir-224、hsa-mir-196b、hsa-mir-339、hsa-mir-186、hsa-mir-3065、hsa-mir-378a、hsa-mir-16-1、hsa-mir-338、hsa-mir-126、hsa-mir-95、hsa-mir-142、hsa-mir-328、hsa-mir-335、hsa-mir-125b-2、hsa-mir-149和hsa-mir-150。在一些实施方案中,纳米颗粒包含选自hsa-mir-30d、hsa-mir-191、hsa-mir-21和hsa-mir-146a的两个或更多个miRNA。在一些实施方案中,纳米颗粒包含hsa-mir-30d、hsa-mir-191、hsa-mir-21和hsa-mir-146a。
在一些实施方案中,纳米颗粒包含一种或多种可溶性蛋白质,其非限制性实例包括酶、激素、细胞因子和生长因子。在一些实施方案中,纳米颗粒包含DNA聚合酶β、DNA聚合酶λ、端粒酶逆转录酶和RAD50中的一种或多种。在一些实施方案中,纳米颗粒包含DNA聚合酶β、DNA聚合酶λ、端粒酶逆转录酶和RAD50。
方法
在某些实施方案中,本文提供了治疗、预防或延迟疾病或病症的发作,或抑制、延迟发作、降低严重性、或减轻本文公开的疾病或疾病的一种或多种症状或继发性并发症的方法,其中该方法包括将本文公开的组合物施用于有此需要的受试者。在一些实施方案中,治疗或预防有此需要的受试者的疾病或病症的方法包括向受试者施用治疗有效量的本文公开的治疗性组合物或药物组合物。
在一些实施方案中,疾病或病症包含选自急性呼吸综合征、慢性阻塞性肺病(COPD)和支气管肺发育不良(BPD)的肺部疾病或肺部病症。在一些实施方案中,肺部疾病或肺部病症包含急性呼吸综合征(例如,突发性急性呼吸综合征)。在一些实施方案中,肺部疾病或肺部病症包含冠状病毒感染诱发的急性呼吸综合征或由冠状病毒感染诱发的急性呼吸综合征组成。在一些实施方案中,肺部疾病或肺部病症包含COVID19感染或SARS相关冠状病毒(SARS-CoV)感染诱发的急性呼吸综合征或由COVID19感染或SARS相关冠状病毒(SARS-CoV)感染诱发的急性呼吸综合征组成。在某些实施方案中,该方法包括预防、延迟发作、降低严重性或减轻支气管肺发育不良(BPD)的一种或多种症状或继发性并发症。BPD的继发性并发症可以包括肺动脉高压或心脏功能障碍。因此,在某些实施方案中,该方法包括在患有、诊断患有或疑似患有支气管肺发育不良(BPD)的受试者中预防、延迟发作、降低严重性或减轻肺动脉高压或心脏功能障碍。
在某些实施方案中,该方法包括治疗、预防或延迟发作关节炎或关节的慢性或急性炎症。在某些实施方案中,该方法包括抑制、延迟发作、降低严重性或减轻关节炎或关节的慢性或急性炎症的一种或多种症状。在一些实施方案中,关节炎是骨关节炎或类风湿性关节炎。
受试者
术语“受试者”是指哺乳动物。可以通过本文所述的方法或组合物治疗任何合适的哺乳动物。哺乳动物的非限制性实例包括人、非人灵长类动物(例如,猿、长臂猿、黑猩猩、猩猩、猴、猕猴等)、家养动物(例如,犬和猫)、农场动物(例如,马、牛、山羊、绵羊、猪)和实验动物(例如,小鼠、大鼠、兔、豚鼠)。在一些实施方案中,受试者是非人灵长类动物或人。在一些实施方案中,受试者是人。受试者可以是任何年龄或处于任何发育阶段(例如,成人、青少年、儿童、婴儿或子宫内的哺乳动物)。受试者可以是雄性或雌性。
在一些实施方案中,受试者是感染有冠状病毒的受试者。在一些实施方案中,受试者是感染有COVID19或SARS相关冠状病毒(SARS-CoV)的受试者。
药物组合物
在一些实施方案中,药物组合物包含本文所述的治疗性组合物。在一些实施方案中,药物组合物包含治疗有效量的本文所述的治疗性组合物。在一些实施方案中,药物组合物包含本文所述的治疗性组合物,用于治疗或预防受试者的疾病或病症,或其一种或多种症状。在一些实施方案中,药物组合物包含本文所述的治疗性组合物和药学上可接受的赋形剂、稀释剂、添加剂或载剂。
药物组合物可以配制用于合适的施用途径。在一些实施方案中,药物组合物配制用于经口、皮下(s.c.)、皮内、肌肉内、气管内、关节内、腹膜内和/或静脉内(i.v.)施用。在某些实施方案中,药物组合物含有用于改变、维持或保存例如组合物的pH、同渗容摩(osmolarity)、粘度、澄清度、颜色、等渗性、气味、无菌性、稳定性、溶解或释放速率、吸附或渗透的配制剂材料。在某些实施方案中,合适的配制剂材料包括但不限于氨基酸(如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸);抗菌剂;抗氧化剂(如抗坏血酸、亚硫酸钠或亚硫酸氢钠);缓冲液(如硼酸盐、碳酸氢盐、Tris-HCl、柠檬酸盐、磷酸盐(例如,磷酸盐缓冲盐水)或合适的有机酸);填充剂(如甘露醇或甘氨酸);螯合剂(如乙二胺四乙酸(EDTA));络合剂(如咖啡因、聚乙烯吡咯烷酮、β-环糊精或羟丙基-β-环糊精);蛋白质(如血清白蛋白、明胶或免疫球蛋白);着色剂、调味剂和稀释剂;乳化剂;亲水性聚合物(如聚乙烯吡咯烷酮);低分子量多肽;成盐抗衡离子(counter ion)(如钠);溶剂(如甘油、丙二醇或聚乙二醇);稀释剂;赋形剂和/或药物佐剂。特别地,药物组合物可以包含如“Remington:The ScienceAnd Practice Of Pharmacy”Mack Publishing Co.,Easton,PA,第19版,(1995)(以下简称Remington’95),或“Remington:The Science And Practice Of Pharmacy”,Pharmaceutical Press,Easton,PA,第22版,(2013)(以下简称Remington 2013)中列出的任何合适的载剂、配制剂或成分等或其组合,其内容通过引用整体并入本文。
在某些实施方案中,药物组合物包含合适的赋形剂,其非限制性实例包括抗粘附剂(例如,硬脂酸镁)、粘合剂、填充剂、单糖、二糖、其他碳水化合物(例如,葡萄糖、甘露糖或糊精)、糖醇(例如,甘露糖醇或山梨糖醇)、包衣(例如,纤维素、羟丙基甲基纤维素(HPMC)、微晶纤维素、合成聚合物、虫胶、明胶、玉米蛋白玉米醇溶蛋白、肠溶剂或其他多糖)、淀粉(例如,马铃薯、玉米或小麦淀粉)、二氧化硅、色素、崩解剂、调味剂、润滑剂、防腐剂、吸附剂、甜味剂、媒介物、悬浮剂、表面活性剂和/或湿润剂(如普朗尼克、PEG、脱水山梨糖醇酯、聚山梨醇酯如聚山梨醇酯20、聚山梨醇酯80、triton、氨丁三醇、卵磷脂、胆固醇、泰洛沙泊)、稳定性增强剂(如蔗糖或山梨糖醇)和张力增强剂(如碱金属卤化物、氯化钠或氯化钾、甘露醇、山梨糖醇)和/或Remington’95或Remington 2013中公开的任何赋形剂。本文所用的术语“粘合剂”是指有助于保持药物混合物结合的化合物或成分。合适的粘合剂用于制备药物配制剂,并且常用于制备药物片剂、胶囊剂和颗粒剂。
在一些实施方案中,药物组合物包含合适的药学上可接受的添加剂和/或载剂。合适的添加剂的非限制性实例包括合适的pH调节剂、舒缓剂、缓冲剂、含硫还原剂、抗氧化剂等。含硫还原剂的非限制性实例包括具有巯基(例如,硫醇)的那些,如N-乙酰半胱氨酸、N-乙酰高半胱氨酸、硫辛酸、硫二甘醇、硫乙醇胺、硫代甘油、硫代山梨糖醇、巯基乙酸及其盐、硫代硫酸钠、谷胱甘肽和C1-C7硫代烷酸。抗氧化剂的非限制性实例包括异抗坏血酸、二丁基羟基甲苯、丁基羟基苯甲醚、α-生育酚、生育酚乙酸酯、L-抗坏血酸及其盐、L-抗坏血酸棕榈酸酯、L-抗坏血酸硬脂酸酯、亚硫酸氢钠、亚硫酸钠、没食子酸三戊酯和没食子酸丙酯,以及螯合剂如乙二胺四乙酸二钠(EDTA)、焦磷酸钠和偏磷酸钠。此外,稀释剂、添加剂和赋形剂可以包含其他常用成分,例如无机盐如氯化钠、氯化钾、氯化钙、磷酸钠、磷酸钾和碳酸氢钠,以及有机盐如柠檬酸钠、柠檬酸钾和乙酸钠。
本文所用的药物组合物可以在延长的时间段,例如月或年的数量级内保持稳定。在一些实施方案中,药物组合物包含一种或多种合适的防腐剂。防腐剂的非限制性实例包括苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸、过氧化氢等和/或其组合。防腐剂可以包含季铵化合物,如苯扎氯铵、苯并氯铵、苄索氯铵、西曲溴胺、司帕氯铵、西吡氯铵或度米芬
在一些实施方案中,本文所述的治疗性组合物或药物组合物基本上无污染物(例如,细胞、血细胞、血小板、多肽、矿物质、血源性化合物或化学品、病毒、细菌、真菌、酵母、病原体、毒素、寄生物等)。在某些实施方案中,本文所述的治疗性组合物或药物组合物基本上没有胎毛和/或胎脂。
在一些实施方案中,本文所述的治疗性组合物或药物组合物基本上无内毒素。在一些实施方案中,本文所述的治疗性组合物或药物组合物包含少于5EU/ml、少于2.5EU/ml、少于1EU/ml、少于0.5EU/ml、少于0.1EU/ml或少于0.05EU/ml的内毒素。在一些实施方案中,本文所述的治疗性组合物或药物组合物是无菌的(sterile)或防腐的(aseptic)。
本文所述的药物组合物可以根据使用它们的疗法以任何合适的形式和/或数量配置用于施用至受试者。例如,配置用于胃肠外施用(例如,通过注射或输注)的药物组合物可以采取在油性或水性媒介物中的混悬液、溶液或乳剂的形式,并且药物组合物可以含有配制剂、赋形剂、添加剂和/或稀释剂如水性或非水性溶剂、助溶剂、悬浮剂、防腐剂、稳定剂和/或分散剂。在一些实施方案中,适用于胃肠外施用的药物组合物可以含有一种或多种赋形剂。在一些实施方案中,药物组合物被冻干成干粉形式。在一些实施方案中,药物组合物被冻干成干粉形式,其适用于用合适的药物溶剂(例如,水、盐水、等渗缓冲溶液(例如,PBS)、DMSO、其组合等)重构。在某些实施方案中,复溶形式的冻干药物组合物适用于胃肠外施用(例如,静脉内施用)至哺乳动物。
在某些实施方案中,药物组合物被配置用于经口施用并且可以被配制为片剂、微片剂、小片剂、微丸剂、粉末、颗粒剂、胶囊剂(例如,填充有微片剂、微丸剂、粉末或颗粒剂的胶囊剂)、乳剂、溶液等或其组合。配置用于经口施用的药物组合物可以包含合适的包衣以延迟或持续释放活性成分,合适包衣的非限制性实例包括肠溶包衣,如脂肪酸、蜡、虫胶、塑料、丙烯酸甲酯-甲基丙烯酸共聚物、醋酸邻苯二甲酸纤维素(CAP)、乙酸琥珀酸纤维素、邻苯二甲酸羟丙基甲基纤维素、醋酸羟丙基甲基纤维素琥珀酸酯(醋酸羟丙甲纤维素琥珀酸酯)、聚乙酸乙烯邻苯二甲酸酯(PVAP)、甲基丙烯酸甲酯-甲基丙烯酸共聚物、乙酸偏苯三酸纤维素、海藻酸钠、玉米醇溶蛋白、植物纤维等及其组合。
在一些实施方案中,本文所述的药物组合物可以配置用于外用施用并且可以包括粘合剂和/或润滑剂、聚合二醇、明胶、可可脂或其他合适的蜡或脂肪中的一种或多种。在一些实施方案中,本文所述的药物组合物被掺入外用配制剂中,该外用配制剂含有通常适合外用药物施用的外用载剂并且包含本领域技术人员已知的任何合适的材料。在某些实施方案中,药物组合物的外用配制剂被配制用于从外用贴剂施用本文所述的治疗性组合物。
在某些实施方案中,最佳药物组合物由本领域技术人员根据例如预期施用途径、递送形式和期望剂量来确定(参见例如,Remington’95或Remington2013,同上)。药物组合物可以通过任何合适的方式制备,包括例如通过常规的混合、溶解、制粒、糖衣丸制造、磨细(levigating)、乳化、包封、包埋或压片工艺(例如,参见Remington’95或Remington 2013中描述的方法)。
施用途径
可以使用任何合适的方法向受试者施用本文所述的治疗性组合物或药物组合物。任何合适的配制剂和/或施用途径均可用于本文所述的治疗性组合物或药物组合物的施用(例如,参见Fingl等人1975,“The Pharmacological Basis of Therapeutics”,其通过整体引用并入本文)。合适的配制剂和/或施用途径可以由医疗专业人员(例如,医师)考虑例如受试者的病症、疾病、风险、年龄和/或健康状况来选择。施用途径的非限制性实例包括外用或局部(例如,透皮或皮肤(例如,在皮肤或表皮上)、眼内或眼上、鼻内、经粘膜、耳中、耳内(例如,在耳鼓膜后)、肠内(例如,通过胃肠道递送,例如,经口(例如,作为片剂、胶囊剂、颗粒剂、液体剂、乳化剂、锭剂或其组合)、舌下、通过胃饲管、经直肠等),通过胃肠外施用(例如,胃肠外,例如,静脉内、动脉内、肌内、腹膜内、皮内、皮下、腔内、颅内、关节内、进入关节间隙、心内(进入心脏)、海绵体内注射、病灶内(进入皮肤病变)、骨内输注(进入骨髓)、鞘内(进入椎管)、子宫内、阴道内、膀胱内输注、玻璃体内)等及其组合。
在一些实施方案中,使用合适的方法将本文所述的治疗性组合物或本文所述的药物组合物施用至肺、支气管通道、气管、食道、鼻窦或鼻道,该方法的非限制性实例包括鼻内施用、气管内滴注和经口吸入施用(例如,通过使用吸入器,例如,单剂量/多剂量干粉吸入器、喷雾器等)。
在一些实施方案中,向受试者提供本文公开的治疗性组合物或药物组合物。例如,向受试者提供的组合物有时向受试者提供用于自行施用或由另一人(例如,非医疗专业人员)施用至受试者。作为另一个实例,组合物可以作为执业医师所写的指示提供,其授权患者待提供本文所述的组合物或治疗(例如,处方)。在又一个实例中,可以向受试者提供组合物,其中受试者例如通过经口、静脉内或通过吸入器自行施用组合物。
替代性地,可以以局部而非全身方式施用本文所述的组合物,例如,经由直接应用于皮肤、黏膜或感兴趣的区域进行治疗,包括使用储库或缓释配制剂。
在某些实施方案中,包含本文所述组合物的药物组合物单独施用(例如,作为单一活性成分(AI或例如,作为单一活性药物成分(API))。在其他实施方案中,包含本文所述治疗性组合物的药物组合物联合一种或多种额外的AI/API施用,例如,作为两种单独的组合物或作为单一组合物,其中一种或多种额外的AI/API与本文所述的治疗性或药物组合物混合或一起配制。
剂量和治疗有效量
在一些实施方案中,本文所述的治疗性或药物组合物的量是治疗有效量。在一些实施方案中,将治疗有效量的本文所述的治疗性或药物组合物施用于受试者。在一些实施方案中,本文所述的治疗性或药物组合物的治疗有效量是获得有效治疗结果所需的量。在某些实施方案中,治疗有效量是足以预防、治疗、降低严重性、延迟发作和/或抑制、减少或减轻肺部疾病或肺部病症的一种或多种症状或继发性并发症的量,肺部疾病或肺部病症选自急性呼吸系统综合症(例如,由冠状病毒感染诱发的急性呼吸系统综合症)、慢性阻塞性肺病(COPD)和支气管肺发育不良。在某些实施方案中,治疗有效量是足以预防、治疗、降低严重性、延迟发作和/或抑制、减少或减轻关节炎(例如,骨关节炎或类风湿性关节炎)的一种或多种症状的量。治疗有效量的确定完全在本领域技术人员的能力范围内,尤其是根据本文提供的详细公开内容。
在某些实施方案中,治疗有效量是足够高以提供有效治疗效果(例如,有益治疗效果)的量和足够低以最小化不需要的不良反应的量。因此,在某些实施方案中,本文所述的治疗性组合物的治疗有效量可能因受试者而异,通常取决于受试者的年龄、体重、一般健康状况、正在治疗病症的严重性和/或向受试者施用的药物的特定组合。因此,在一些实施方案中,治疗有效量是经验性确定的。因此,本领域普通技术人员可以基于例如在动物或临床研究中发现有效的量、医师的经验和建议的剂量范围或给药指南来确定向受试者施用的本文所述治疗性组合物的治疗有效量。
在某些实施方案中,以合适的剂量(例如,以合适的体积、频率和/或浓度,这通常取决于受试者的体重、年龄和/或状况)施用治疗有效量的本文所述的组合物(例如,治疗性或药物组合物)旨在获得可接受的治疗结果。在某些实施方案中,本文所述治疗性组合物的治疗有效量包含选自以下的一个或多个剂量:至少0.001mg/kg(例如,本文所述组合物的总蛋白质的mg/kg受试者体重)、至少0.01mg/kg、至少0.1mg/kg、至少1mg/kg、至少10mg/kg或至少100mg/kg。在某些实施方案中,本文所述组合物的治疗有效量选自约0.001mg/kg(例如,本文所述治疗性组合物的mg/kg受试者体重)至约5000mg/kg、0.01mg/kg至1000mg/kg、0.01mg/kg至500mg/kg、0.1mg/kg至1000mg/kg、1mg/kg至1000mg/kg、10mg/kg至1000mg/kg、100mg/kg至1000mg/kg、0.1mg/kg至500mg/kg、0.1mg/kg至250mg/kg、0.1mg/kg至150mg/kg、0.1mg/kg至100mg/kg、0.1mg/kg至75mg/kg、0.1mg/kg至50mg/kg、0.1mg/kg至25mg/kg、0.1mg/kg至10mg/kg、0.1mg/kg至5mg/kg和0.5mg/kg至5mg/kg,中间量及其组合中的一个或多个剂量。在一些方面,向受试者施用的本文所述的组合物的治疗有效量包含约0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.7mg/kg、0.8mg/kg、0.9mg/kg、1mg/kg、2mg/kg、3mg/kg、4mg/kg、5mg/kg、6mg/kg、7mg/kg、8mg/kg、10mg/kg、50mg/kg、100mg/kg、500mg/kg,和中间量及其组合中的一个或多个剂量。在一些实施方案中,本文所述的治疗性组合物的治疗有效量在约0.1mg/kg至约50mg/kg之间。
在某些实施方案中,确定治疗性或药物组合物中纳米颗粒的量。因此,在一些实施方案中,治疗有效量的本文所述的组合物(例如,治疗性或药物组合物)作为旨在获得可接受的治疗结果的合适剂量的纳米颗粒施用。在某些实施方案中,本文所述组合物的治疗有效量包含选自以下的一个或多个剂量:至少1.1x10
在一些实施方案中,施用治疗有效量的本文所述的组合物包括以获得有效治疗结果所需的频率或间隔施用合适的剂量。在一些实施方案中,施用治疗有效量的本文所述的组合物包括如下施用合适的剂量:每小时、每两小时、每4小时、每6小时、每天三次、每天两次、每天一次、每周六次、每周五次、每周四次、每周三次、每周两次、每周一次、每月一次、每季度一次、每半年一次、每年一次,以其组合,和/或以其定期或不定期的间隔,和/或仅以需要或医疗专业人员建议的频率或间隔。在一些实施方案中,治疗有效量的本文所述的组合物通过例如静脉内施用连续施用。
试剂盒
在一些实施方案中,本文提供包含本文所述的治疗性组合物或药物组合物(即,组合物)的试剂盒。在一些实施方案中,试剂盒包含一剂或多剂本文所述的组合物。在一些实施方案中,试剂盒包含一个或多个包装和/或一个或多个分配装置,其可以含有一剂或多剂本文所述的组合物。包装的非限制性实例包括金属、玻璃或塑料容器、注射器或泡罩包装,其包含合适量或剂量的本文所述的组合物。在某些实施方案中,试剂盒包含分配装置如注射器或吸入器,其可以包含或不包含本文所述的组合物。包装和/或分配器装置可以附有施用说明。包装或分配器还可以附有与容器相关的通知,通知采用管理药品制备、使用或销售的政府机构规定的形式,该通知反映了该机构对用于人或兽医施用的药物形式的批准。例如,此类通知可以是美国食品和药物管理局批准的处方药标签,或批准的产品说明书。
在一些实施方案中,试剂盒或包装包含足以治疗患者以下时间的量的药物组合物:1天至1年、1天至180天、1天至120天、1天至90天、1天至60天、1天至30天、1-24小时、1-12小时、1-4小时或其间的时间量。
试剂盒任选地包括产品标签和/或一个或多个包装插页,其提供组分的描述或其中组分的体外、体内或离体使用说明。示例性说明可以包括处理方案或治疗方案的说明。在某些实施方案中,试剂盒包含包装材料,其指试剂盒的物理结构外壳组件。包装材料可以维持组分无菌并且可以由通常用于此类目的的材料(例如,纸、波纹纤维、玻璃、塑料、箔、安瓿、小瓶、管等)制成。产品标签或插页包括“印刷品”,例如纸或纸板,或单独或粘贴在组分、试剂盒或包装材料(例如,盒子)上,或附在含有试剂盒组分的安瓿、管或小瓶上。标签或插页还可以包括计算机可读介质、光盘如CD-或DVD-ROM/RAM、DVD、MP3、磁带,或电子存储介质如RAM和ROM,或其混合体如磁/光存储介质、FLASH介质或存储型卡。产品标签或插页可以包括其中一种或多种成分的识别信息、剂量、活性成分的临床药理学,包括作用机制、药代动力学(PK)和药效学(PD)。产品标签或插页可以包括标识制造商信息、批号、制造商位置、日期、关于可以使用试剂盒组分的指示病况、病症、疾病或症状的信息。产品标签或插页可以包括临床医师或受试者在方法、处理方案或治疗方案中使用一种或多种试剂盒组分的说明。说明可以包括剂量、频率或持续时间,以及实施本文所述的任何方法、处理方案或治疗方案的说明。试剂盒可以另外包括用于实施本文所述的任何方法的标签或说明。产品标签或插页可以包括潜在不良副作用和/或警告的信息。
实施例
实施例1-制造
Organicell Flow是衍生自人羊水(HAF)的脱细胞治疗性组合物。OrganicellFlow通过无菌收集来自经筛选和合格的供体的羊水制备。一旦获得,HAF在4℃下以500xg离心10分钟(min.)并以2000xg离心30分钟以去除大细胞碎片。离心后,将上清液转移到新的小瓶中并用.22μM过滤器过滤,同时保持无菌。
Organicell Flow XL也是衍生自人羊水(HAF)的脱细胞治疗性组合物。Organicell Flow XL通过无菌收集来自经筛选和合格的供体的羊水制备。一旦获得,将HAF在4℃以500xg离心10分钟。然后将样品上清液转移到无菌锥形管中。丢弃样品沉淀物。然后将流体在4℃以2000x g离心30分钟。收集样品上清液。留出处理过的HAF的一部分(约1/4)用于后期的外泌体重悬。处理过的HAF的另一部分(约3/4)用于外泌体分离。处理过的HAF的另一部分用于“对照”样品。过滤后的流体在100,000xg下经受超速离心至少3小时,以沉淀外泌体级分。用留出用于重悬的处理过的HAF将每个外泌体沉淀物重悬。将重悬的外泌体转移到留出用于重悬的HAF总体积中。重复这个过程,直到所有的外泌体沉淀物被重悬并转移到留出用于重悬的HAF中。重悬完成后,使用0.22μM过滤器对溶液进行过滤。然后等分过滤的产物。
Nanosight纳米颗粒分析(图1)和通过ELISA的外泌体标志物定量(图2)证实了Flow-XL的成功产生。使用Nanosight NS300,将Organicell Flow(图1A)的纳米颗粒分布与Organicell Flow-XL(图1B)进行了比较。分析表明,与Flow对照相比,Flow-XL产品中的纳米颗粒浓度显著增加(图1C)。通过ELISA还证明了Flow-XL产品中外泌体标志物CD63的浓度增加(图2)。Flow-XL制造过程能够将CD63浓度从不可检测的水平提高到超过400pg/mL。
Organicell Flow和Flow XL的可溶性蛋白质隔室由多种细胞因子、趋化因子、生长因子和透明质酸组成。使用Bradford蛋白质分析在每个Organicell Flow批次中进行总可溶性蛋白质浓度的常规测试,以确保可重现的蛋白质浓度超过约1mg/ml(图3)。还进行了若干细胞因子测定,以检测和半定量测量Flow和Flow XL产品中存在的细胞因子和生长因子的量(图4、5A-5C和6)。结果表明,Flow和Flow XL产品含有相似种类的促血管生成、免疫调节
透明质酸参与许多生物学过程,如组织愈合、炎症、水稳态和细胞间通讯。
使用Nanosight NS300(Malvern Panalytical)仪器对Flow和Flow XL产品进行纳米颗粒分析。结果表明,最终产品中的纳米颗粒浓度可重现,其中平均浓度为5.24x10
进行了MACsplex外泌体表面标志物阵列分析,以证明在Nanosight分析中观察到的纳米颗粒是外泌体。除了与外泌体群体的各种亚群相关联的表面标志物外,还检测到外泌体标志物CD63、CD81和CD9(图9、图10)。该分析的结果证实了CD63、CD81和CD9的表达。有趣的是,发现外泌体表达高水平的CD133和CD326(上皮细胞群和上皮祖细胞群的两个标志物)
外泌体的脂质双层性质允许外泌体货物到受体细胞中的高效摄取。作为外泌体再生的良好介质的外泌体货物的两个主要组分是蛋白质和微小RNA因子。为了确定外泌体的蛋白质货物,使用Easy nLC 1000和Q Exactive仪器进行了质谱分析。使用尺寸排阻过滤然后从3份独立产物(一式三份)中超速离心来从Organicell Flow中沉淀外泌体,并对其进行蛋白质裂解。Tune(版本2.9)和Xcalibur(版本4.1)用于收集数据,而Proteome Discoverer(版本2.2)用于分析数据。通过将3份样品重复合并在一起创建蛋白质表达列表,并使用Vinny 2.0vin图分析确定共同表达的蛋白质。使用WebGestalt工具包分类系统来鉴定最高蛋白质功能和途径命中。完成的分析揭示了3份产物中的1225个共同检测到的蛋白质(图11)。鉴定出的蛋白质的最高分子功能包括与酶、转录调节剂和代表最丰富蛋白质组的转运蛋白的蛋白质结合、离子结合和核酸结合(图12)。途径富集分析揭示了整合素、PDGF和P53途径的最高命中。对蛋白质货物的酶类别的更深入研究进一步证明了促进DNA修复的蛋白质(如DNA聚合酶(β和λ)、端粒酶逆转录酶和RAD50)的存在(图13)。
从3份独立产物(一式三份)中沉淀外泌体,并进行RNA分离以用于miRNA测序和鉴定(表1)。完成的测序揭示了102个共同表达的miRNA(其中最小表达为100拷贝)(图14)。使用Qiagen IPA软件完成生物信息学分析,将63个miRNA关联到1216个RNA靶标。这些mRNA靶标的最高典型途径分析揭示了各种途径的调节,如肝纤维化、衰老、白介素6信号传导、关节炎、IGF-1和NFκ-B信号传导的调节(图15)。尽管miRNA的功能各不相同,但miRNA是抑制不需要的基因表达的强大工具。
对参与COPD病理学的mRNA靶标的集中分析揭示了25个miRNA,它们通过实验观察到的关系直接靶向与COPD相关联的45个基因(图17)。在这45个基因中,若干促炎分子脱颖而出,成为Organicell Flow外泌体的潜在治疗靶标。因此,Hsa-mir-21被鉴定为靶向CXCL8(IL-8)和TNFα,而Hsa-mir-191与IL-6相关。促炎细胞因子如CXCL8、TNFα和IL-6的上调与COPD的进展增加相关联。类似地,Hsa-mir-146a与介导IL-1的炎症信号传导的促炎信号传导受体IL-1受体1的调节有关。除了鉴定炎症和组织损伤的共同介质外,完成的分析还揭示了靶向COPD的新介质的潜在机制。该分析将hsa-mir-30d表达(Flow纳米颗粒中第三高表达的miRNA)与WNT5a的调节相关联。增加的WNT5a表达介导COPD病理学中间充质-上皮串扰的损伤。在弹性蛋白酶诱导的肺气肿的鼠模型中,证明经由IgG中和抗体抑制WNT-5A诱导肺泡细胞功能。总之,Flow和Flow XL中靶向炎症和COPD相关基因的若干miRNA的鉴定允许制定针对这种病症的潜在治疗机制。基于此数据,假设hsa-mir-30d、hsa-mir-191、hsa-mir-21和mir-146a可以协同工作以抑制WNT5a、IL1-R1、IL-6、CXCL8和TNFα的表达以减弱COPD的发病机制。
表1来自Organicell外泌体的miRNA货物组成
安全性测试
在每个Organicell Flow批次上完成了以下组的测试,以确保产品安全性和再现性:
(1)无菌和内毒素测试
通过进行内毒素和14天无菌测试以检测细菌、真菌和酵母污染来完成安全性评估。内毒素测试根据USP<85>指南完成,并且无菌测试由VRL Eurofins(合格的CLIA认证的实验室)根据USP<71>指南进行。选择一个小瓶进行内毒素检测,并在处理规程完成时随机选择总批次体积的10%进行14天无菌检测。为14天测试选择的小瓶样品量由USP<71>指南基于总批次生产规模所需的最小体积和容器确定。此外,在羊水处理开始时(原产品样品)和过滤前(过滤前样品)收集过程中样品(总体积2mL)进行14天无菌分析。安全性评估放行标准规定,内毒素水平必须低于5EU/ml,并且所有样品必须对无菌呈阴性。
(2)Bradford分析
对每个产品完成产品组成测试,以确保批次间的再现性和稳定性。对每个产品完成Bradford分析,以证明总体蛋白质浓度的相似性(>1mg/ml)。
(3)Nanosight纳米追踪分析(NTA)
完成NTA分析以证明模式粒径和浓度落在预期范围内(<200nM模式大小和>1x10
所有产品都必须符合标准质量要求,才能被认为可接受用于临床用途。如果产品批次未能通过安全性和组成的最低放行标准,质量保证相关负责人和实验室负责人将进行生产调查以确定根本原因。如果报告无菌阳性,则寄送额外的备用样品进行立即测试。当备份结果待定时,必须记录偏差,并将审查批次记录文件。
实施例2-支气管肺发育不良(BPD)
已完成研究以测试Organicell Flow-XL在支气管肺发育不良(BPD)大鼠模型中的安全性和生物活性
肺组织的组织学分析显示,接受Flow-XL处理的高氧暴露(HYP)组肺泡结构得到改善。通过计算平均线性截距(MLI)确定肺泡化(alveolarization)。形态测定分析表明,与HYP-PL(101±6.1μm,p值<0.05)相比,接受Flow-XL处理的HYP组的MLI显著降低(87.4±2.5μm)(图24A-C、M)。与安慰剂(PL)处理的室内空气(RA)对照(RA-PL)相比(22.2±0.8条血管/HPF),PL处理的HYP(HYP-PL)组的血管密度也有所降低(7.33±0.6条血管/HPF,p值<0.0001)。HYP组的血管密度随着Flow-XL处理而增加(9.5±1.0条血管/HPF)(图24D-F、N)。
通过量化肌化血管的百分比来评估肺血管重塑。与RA-PL(31.33±7.1%肌化肺血管)相比,HYP-PL组的动物具有显著增加的肺血管重塑(92.0±3.3%肌化肺血管,p值<0.0001)。与HYP-PL相比,Flow-XL处理显著降低了肌化(65.7±6.6%肌化肺血管,p值<0.05)(图24G-I、O)。通过经由Mac-3免疫染色的巨噬细胞到肺组织中的浸润来测量对高氧损伤的免疫应答。与RA-PL(0±1.0Mac-3阳性细胞/HPF)相比,HYP-PL组(28.2±4.4Mac-3阳性细胞/HPF,p值<0.001)响应于高氧而增加巨噬细胞浸润。然而,与HYP-PL相比,接受Flow-XL的HYP动物的巨噬细胞具有显著减少的浸润(14.20±4.4Mac-3阳性细胞/HPF,p值<0.05)(图24J-L、P)。
实施例3-炎症
生物信息学分析将63个miRNA与1216个RNA靶标相关联。发现将由Flow和Flow XL产品中存在的miRNA靶向的参与促炎细胞因子和细胞因子介导的免疫应答级联的主要参与者包括TNF、IL-6和IL-8。此外,还由Flow和Flow XL产品中miRNA的收集靶向的更广泛的促炎细胞因子包括FGF2、IFNB1、IGF1、IL36a、IL37、TGF-B2、VEGFA、CCL8和CXCL12(图18)。抑制或压制这种促炎细胞因子级联可以降低与免疫应答升高相关的症状的严重性
实施例4-COVID-19和呼吸窘迫综合征
重度COVID-19感染的一个主要并发症是急性呼吸窘迫综合征(ARDS)的发展。在COVID-19感染中发生ARDS的风险与符合免疫激活和较弱免疫应答的因素有关
实施例5-所选参考文献
1.Hovius JW,Bijlsma MF,van der Windt GJ,Wiersinga WJ,Boukens BJ,Coumou J,Oei A,de Beer R,de Vos AF,van't Veer C,van Dam AP,Wang P,Fikrig E,Levi MM,Roelofs JJ and van der Poll T.The urokinase receptor(uPAR)facilitatesclearance of Borrelia burgdorferi.PLoS Pathog.2009;5:e1000447.
2.Arend WP.The balance between IL-1and IL-1Ra in disease.CytokineGrowth Factor Rev.2002;13:323-40.
3.Achari AE and Jain SK.Adiponectin,a Therapeutic Target for Obesity,Diabetes,and Endothelial Dysfunction.Int J Mol Sci.2017;18.
4.Johns DE and Athanasiou KA.Growth factor effects on costalchondrocytes for tissue engineering fibrocartilage.Cell Tissue Res.2008;333:439-47.
5.Koike C,Zhou K,Takeda Y,Fathy M,Okabe M,Yoshida T,Nakamura Y,Kato Yand Nikaido T.Characterization of amniotic stem cells.Cell Reprogram.2014;16:298-305.
6.Murphy SV,Kidyoor A,Reid T,Atala A,Wallace EM and Lim R.Isolation,cryopreservation and culture of human amnion epithelial cells for clinicalapplications.J Vis Exp.2014.
8.Reiter J,Drummond S,Sammour I,Huang J,Florea V,Dornas P,Hare JM,Rodrigues CO and Young KC.Stromal derived factor-1mediates the lungregenerative effects of mesenchymal stem cells in a rodent model ofbronchopulmonary dysplasia.Respir Res.2017;18:137.
9.Liu Q,Zhou YH and Yang ZQ.The cytokine storm of severe influenzaand development of immunomodulatory therapy.Cell Mol Immunol.2016;13:3-10.
10.Wu C,Chen X,Cai Y,Xia J,Zhou X,Xu S,Huang H,Zhang L,Zhou X,Du C,Zhang Y,Song J,Wang S,Chao Y,Yang Z,Xu J,Zhou X,Chen D,Xiong W,Xu L,Zhou F,Jiang J,Bai C,Zheng J and Song Y.Risk Factors Associated With AcuteRespiratory Distress Syndrome and Death in Patients With Coronavirus Disease2019Pneumonia in Wuhan,China.JAMA Intern Med.2020.
实施例6-骨关节炎
这项研究入组了五名受试者:年龄在21至80岁之间、患有症状性膝关节骨关节炎(symptomatic osteoarthritis of the knee)并且符合所有纳入/排除标准的成人。研究时间为一年。受试者在第0天经由IV输注接受1ml Organicell Flow,并在第0天、第1周和第1、3、6、9和12个月进行随访。IV输注3个月后未观察到不良事件。在前3个月,所有受试者都受到密切监测,以观察与产品相关的不良事件。受试者在第6、9和12个月继续接受监测。以下人口统计资料、膝关节OA的基线特征和结果评估显示在表2中(受试者;n=5)。
表2:参与者人口统计资料和基线特征。
Organicell Flow处理的安全性
在IV输注后直到4小时、在IV输注后24和48小时以及在IV输注后1个月均未报告不良事件。
功效
评估了Organicell Flow处理对WOMAC疼痛评分的影响(图21A、图22A、图23和表3A)。与第0天相比,一名患者的疼痛评分在第30天没有任何变化。对于其余四名患者,与第0天相比,第30天的疼痛评分降低范围为16.7%-70%。与第0天相比,所有五名患者在第90天的疼痛评分均有所降低,疼痛减轻范围为25%至80%。与第30天相比,五名患者中的四名在第90天的评分进一步降低,范围为10%-40%;然而,与第30天(评分=8)相比,一名患者在第90天的疼痛评分增加了50%(评分=12)。
评估了Organicell Flow处理对WOMAC僵硬评分的影响(图21B、图22B、图23和表3B)。第0天、第30天和第90天的平均僵硬评分分别为5.4±2.2、4.0±1.9和3.4±2.1。在第30天,与第0天相比,两名患者的僵硬评分没有变化,并且其他三名患者的评分降低范围为16.7%至60%。在第90天,与第0天相比,两名患者的评分没有变化,并且其他三名患者的评分降低范围为37.5%至80%。与第30天相比,两名患者的评分没有变化,一名患者增加了20%(从5分增加到6分),并且其他两名患者均减少了50%。
评估了Organicell Flow治疗对WOMAC身体机能评分的影响(图21C、图22C、图23和表3C)。身体机能评分是衡量个体表现受限的指标,如起床困难、从椅子站起困难、行走困难和爬楼梯困难。评分越高,表明身体机能的限制越大。因此,WOMAC身体机能评分的降低表明身体机能增加。与第0天的评分(45.4±16.9)相比,第30天(29.8±16.2)和第90天(24±15.5)的WOMAC身体机能评分(平均值±SD)显著降低(p<0.05),表明身体机能的改善。与第0天相比,第30天身体机能下降范围为3.6%至60.7%,第90天为20%至82.1%。与第30天相比,五名患者中的四名在第90天的评分进一步下降。下降范围为17%至54.5%。另一名患者在第30天和第90天没有变化。
评估了Organicell Flow治疗对WOMAC总评分的影响(图21D、图22D、图23和表3D)。与第0天相比,第30天和第90天的总WOMAC评分显著提高(p<0.05)。第0天的平均总评分为63±23.6,第30天和第90天的评分分别为41.2±21和34.4±21.3。与第0天相比,第30天和第90天的总WOMAC评分平均分别降低了35.2%(范围为10.4%-62.8%)和49%(范围为23.4%-81.4%)。与第30天相比,五名患者中有四名在第90天的总WOMAC评分进一步降低,范围为14.5%至50%。另一名患者在第90天的评分增加了9.3%(从43至47)。
总之,本文的数据表明Organicell Flow有效减轻疼痛和僵硬,并改善骨关节炎患者的身体机能。
表3A-疼痛
表3B-僵硬
表3C-身体机能
表3D-总WOMAC
实施例7–COVID-19、急性肺损伤、急性脑损伤、急性器官衰竭
本研究的主要目的是证明Organicell Flow用于治疗这些重症Covid-19患者的安全性、可行性和可及性,并观察可以表明潜在的治疗功效的临床状态改善和炎症生物标志物改善的治疗后变化。Organicell Flow如实施例1中所述制备。本研究中施用的Organicell Flow的具体参数是:无菌(14天培养物:需氧、厌氧和真菌污染无生长)、内毒素(<0.05EU/mL)、纳米颗粒组成(浓度=3.26x 10
向三名重症Covid-19患者施用Organicell Flow同时进行持续的医疗护理,对这些患者进行28天的治疗后监测。所有患者均诊断患有COVID-19,发生呼吸衰竭,并住院超过40天。所有三名患者都患有由COVID-19感染诱导的重度多器官并发症,除了当时可用的授权标准护理外,还使用Organicell Flow进行治疗。这些患者代表了受病毒影响最大的COVID-19患者亚组。在入院时,没有针对COVID-19感染的紧急授权护理标准。这些患者用补充氧、抗炎药、抗生素、抗病毒药物和控制他们的多器官衰竭症状所需的其他药物治疗。
第一名患者(去识别受试者CU#1)是74岁的白人女性,患有多种合并症,包括肥胖、高血压(HTN)、2型糖尿病、抑郁症、高脂血症(HLD)和维生素D缺乏症。该患者在研究地点治疗前44天首次入院。初步诊断为急性低氧性呼吸衰竭伴COVID-19感染阳性。患者在住院6天后经口插管,并治疗COVID-19伴肺炎。入院后20天内报告了COVID-19+测试。在转移到研究地点之前进行气管切开术置入。患者CU#1在治疗前持续需要机械通气,并发生急性代谢性脑病伴ICU谵妄(delirium)以及急性肾损伤和贫血。入院时的初始COVID-19治疗包括10天周期的羟氯喹、三剂利巴韦林和克力芝(Kaletra)。持续进行额外药物的纳入以管理由多种合并症诱导的并发症。转移到研究地点十天后,除了持续进行的药物治疗外,开始Organicell Flow输注。由于患者的高BMI,决定施用总共四剂Organicell Flow。
第二名患者(去识别受试者CU#2)是79岁的白人女性,患有多种慢性合并症,包括肥胖、HTN、HLD、霍奇金病、甲状腺功能减退(HYT)和左颈动脉内膜切除术后状态。该患者在研究地点治疗前47天入院。她的初步诊断包括败血症综合征和低氧性呼吸衰竭伴阳性COVID-19感染。初步治疗报告没有说明该患者是否接受过任何靶向COVID-19感染的抗病毒药物治疗;取而代之的是,治疗包括管理与合并症、抗生素(头孢吡肟和万古霉素)和血液透析相关联的重度症状的多种药物治疗。由于患者入院时病情严重,2天后立即需要机械通气。患者被拔管然后重新插管,随后进行气管切开术置入。入院后16天内报告了COVID-19+测试。住院期间并发急性肾损伤、需要输血的贫血、脑病和脓毒症休克。患者在转移到研究地点前几天接受了PEG置入。已完成患者到研究地点的转移以进行呼吸机的解除和其他合并症的管理。CU#2的高BMI使该患者有资格接受四剂Organicell Flow。
第三名患者(去识别受试者CU#3)是66岁的西班牙裔男性,患有包括2型糖尿病和HTN的合并症。该患者在研究地点治疗前42天入院。初步诊断为继发于COVID-19肺炎的低氧性呼吸衰竭。初始COVID-19治疗包括在门诊用羟氯喹,然后在入院时用托珠单抗。患者CU#3需要插管,然后进行拔管和再插管。住院期间并发低氧性心脏骤停、需要肾脏替代治疗的急性肾损伤、急性DVT和脑病。患者在转移到研究地点之前经历气管切开术。已完成到研究地点的转移以进行呼吸机的解除、血液透析的管理、营养支持的继续和其他合并症的管理。入院后8天内报告了COVID-19+测试。随着患者状况的进展,在整个治疗过程中掺入了额外的药物和抗生素。患者在转移到研究地点后第9天开始接受三剂Organicell Flow。
方法
进行了序贯器官衰竭评估(SOFA)评分评估、胸部X光检查和炎症生物标志物测试,以测试Organicell Flow对Covid 19患者的影响。ChartPad软件(Technomad)是基于云的电子数据采集平台,用于收集患者数据。依据文献中的报道计算SOFA评分(Lambden S.等人,“The SOFA score-development,utility and challenges of accurate assessment inclinical trials,”Crit Care.23:374(2019))并在Organicell Flow疗法开始后0、4、6、8、14、21和28天进行评估。SOFA评分衍生自呼吸(PaO2/FiO2,mmHg)、凝血(血小板,x 103/μL)、肝脏(胆红素,mg/dL)、心血管(平均动脉压)、神经系统(格拉斯哥昏迷评分)和肾脏(肌酐,mg/dL)的临床和实验室结果。
使用便携式胸部X光(CXR)以在基线和整个治疗过程中采集成像,以评估、鉴定和监测肺部异常。采集图像后,由Landmark医院的放射科医师进行分析,并生成CXR报告以概述临床发现。
在Organicell Flow疗法开始后第0、4、6、8、14、21和28天收集生物标志物,以评估D-二聚体、CRP、IL2、IL6和TNFa的浓度。D-二聚体和CRP测量在Athens Regional Labs进行,而IL2、IL6和TNFa由Quest Diagnostics测量。
收集所有患者在Organicell Flow治疗前后的格拉斯哥昏迷量表(GCS)评分。GCS是15分的神经量表,用于评估患者的意识水平和神经功能水平。其是广泛使用的评分系统,用于量化创伤性脑损伤后的意识水平。总评分是三个类别评分的总和,对以下每个类别评分:最佳运动反应、最佳言语反应和睁眼。
结果
在Organicell Flow疗法开始后监测患者的临床状态28天。经治疗后,患者呼吸状态改善并稳定。CU#1的呼吸状态在28天内改善,从21%的氧T型领变为不需要氧气治疗的室内空气,CU#2的呼吸状态在28天内改善,从机械通气过渡到非机械通气,CU#3的呼吸状态在治疗后4天改善,拔管并随后在第14天停止氧治疗。此外,所有患者都在28天内从ICU状态转移到二级病房(step-down unit)(表4)。患者CU#1在治疗开始后29天出院,并且患者CU#3在治疗开始后26天出院。患者CU#2由于误吸而经历挫折留在医院,但通过通气和血液透析在二级病房中得到控制和稳定。
表4-同情用药患者的临床状态
HTN,高血压;T2DM,2型糖尿病;HLD,高血脂;HYT,甲状腺功能减退
对SOFA评分的影响
在所有患者中均发现SOFA评分改善。SOFA评分计算在CU#1中在28天内从3下降到0,在CU#2中在28天内从7下降到4,在CU#3中在21天内从4下降到0(表5)。用于计算SOFA评分的个体参数的评估显示了CU#1的PaO2/FiO2和格拉斯哥评分的改善,CU#2的格拉斯哥评分和肌酐水平的改善,CU#3的PaO2/FiO2和肌酐水平的改善(表5)。血小板计数、胆红素和MAP测量值在整个治疗过程中保持稳定。
表5-SOFA评分参数
对肺成像的影响
在整个治疗过程中收集CXR图像,并观察和报告从基线到第21天和第28天的变化(图25)。在基线展示的患者CU#1的CXR分析显示左下叶存在浸润,无确定的胸腔积液。28天后,CXR显示肺底双侧存在基底、肺门下气腔阴影。患者CU#2的CXR分析展示在基线时的双侧肺部疾病。在第28天,CXR分析显示少量胸腔积液。患者CU#3的CXR分析在基线时展示双侧上叶浸润。在第21天,CXR分析显示在左肺门周围区域存在残留实变。右上叶肺实变部分间期消退。
炎症生物标志物评估
在每个测试时间点完成炎症生物标志物的量化(表6)。在28天内,CU#1的TNFa略微增加。CU#1的CRP和IL-6升高归因于第4、6和8天受感染静脉端口的菌血症。然而,从第14天到第28天,CRP和IL-6的水平开始低于基线。此外,该患者的D-二聚体浓度在第28天下降。从第14天到第28天,CU#2也显示CRP和IL-6水平下降,然而TNFa和D-二聚体仍然升高。直到第8天,CU#3显示出高水平的炎症标志物TNFa、IL-6和D-二聚体,然而到第21天时,所有标志物均报告下降。
表6-炎症生物标志物
收集所有患者治疗前后的格拉斯哥评分(表6)。
表6-格拉斯哥评分
对所有患者的集体数据分析显示SOFA评分降低、ICU临床状态改善、格拉斯哥评分改善和呼吸改善。此外,患者的实验室结果显示了炎症生物标志物减少的改善。
患者CU#1的临床特征显著改善,CXR上的肺部改善,并且精神状态和肾功能恢复正常。该患者的呼吸功能在治疗后21天改善,从21%T型领过渡到室内空气PMV,并在第26天拔管,这代表了该患者人口统计数据的相当大的成就。该患者的炎症标志物状态IL6和CRP在14天的时间点后改善。患者在治疗开始后29天后进一步改善至出院。CU#1的格拉斯哥评分在治疗后提高到15。
患者CU#2的临床特征包括呼吸功能在治疗时间过程中系统性改善。到第28天,患者从CPAP 5PS 10 30%通气过渡到30%T型领通气,并且急性谵妄改善。该患者患有急性肾损伤,并且在研究期间需要定期进行血液透析。CU#2的格拉斯哥评分在治疗后提高到15。
在接受Organicell Flow后,患者CU#3显示呼吸功能迅速改善,在第4天从氧治疗中完全拔管。患者肾功能完全恢复,肌酐浓度水平降低,并在第17天停止血液透析。CU#3在治疗开始后26天出院。
这些已完成的病例研究表明,人羊水衍生的纳米颗粒是恢复COVID-19感染诱导的并发症的安全且有效的治疗方法。Organicell Flow的多剂量施用作为用于COVID-19重症患者的治疗方法是安全且耐受良好的,没有任何严重不良事件的报告。Organicell Flow的分子组成,特别是包括围产期分泌的细胞外囊泡和外泌体在内的纳米颗粒群,作为COVID-19患者的治疗剂。这项研究展示了羊水衍生产品作为治疗剂在人中的首次使用,以帮助从COVID-19感染诱导的严重器官损伤中恢复。
***
本文引用的每项专利、专利申请、出版物或任何其他参考文献或文件的全部内容在此通过引用并入。在冲突的情况下,以本说明书包括定义为准。
任何专利、专利申请、出版物或任何其他文件的引用并不是对前述任何一项是相关的现有技术的承认,也不构成对这些出版物或文件的内容或日期的任何承认。
除非另有定义,否则本文使用的所有技术和科学术语与本发明所属领域的普通技术人员通常理解的含义相同。尽管与本文所述那些相似或等同的方法和材料可用于本发明的实践或测试,但本文描述了合适的方法和材料。
本文公开的所有特征可以以任何组合方式组合。说明书中公开的每个特征可以由用于相同、等同或相似目的的替代特征代替。因此,除非另有明确说明,否则所公开的特征(例如,抗体)是等同或相似特征的一类实例。
如本文所用,所有数值或数值范围包括此范围内的整数和此范围内的整数或数值的分数,除非上下文另有明确说明。此外,当本文描述数值列表时(例如,约50%、60%、70%、80%、85%或86%),该列表包括其所有中间值和分数值(例如,54%、85.4%)。因此,为了说明,提及80%或更高的同一性,包括81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%等,以及81.1%、81.2%、81.3%、81.4%、81.5%等,82.1%、82.2%、82.3%、82.4%、82.5%等,等等。
提及具有更多(更大)或更小的整数分别包括大于或小于参考数的任何数。因此,例如,提及小于100时,包括99、98、97等一直向下到数字一(1);并且小于10,包括9、8、7等一直向下到数字一(1)。
如本文所用,所有数值或范围包括在此范围内的值和整数的分数以及在此范围内的整数的分数,除非上下文另有明确说明。因此,为了说明,提及数值范围,如1-10包括1、2、3、4、5、6、7、8、9、10,以及1.1、1.2、1.3、1.4、1.5等,等等。因此,提及1-50的范围包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20等,最多并包括50,以及1.1、1.2、1.3、1.4、1.5等,2.1、2.2、2.3、2.4、2.5等,等等。
对一系列范围的引用包括组合该系列内不同范围的边界值的范围。因此,为了说明,提及一系列范围,例如1-10、10-20、20-30、30-40、40-50、50-60、60-75、75-100、100-150、150-200、200-250、250-300、300-400、400-500、500-750、750-1,000、1,000-1,500、1,500-2,000、2,000-2,500、2,500-3,000、3,000-3,500、3,500-4,000、4,000-4,500、4,500-5,000、5,500-6,000、6,000-7,000、7,000-8,000或8,000-9,000,包括范围10-50、50-100、100-1,000、1,000-3,000、2,000-4,000等。
在不脱离本技术的基本方面的情况下,可以对前述内容进行修改。尽管参考一个或多个具体实施方案对本技术进行了相当详细的描述,但是本领域的普通技术人员应当认识到,可以对本申请具体公开的实施方案进行更改,但是这些修改和改进都在本技术的范围和精神内。
本发明在本文中使用肯定的语言来描述众多实施方案和方面而大体公开。本发明还具体包括其中特定主题,如物质或材料、方法步骤和条件、方案、或程序全部或部分排除的实施方案。例如,在本发明的某些实施方案或方面中,材料和/或方法步骤排除在外。因此,即使本发明通常未在本文中表述,但不是本发明明确排除的方面的本发明不包括的方面仍然在本发明中公开。
本文描述的技术的一些实施方案可以在没有本文未具体公开的元素的情况下适当地实施。因此,在一些实施方案中,术语“包含”或“包括”可以替换为“基本上由...组成”或“由...组成”或其语法变体。术语“一个”或“一种”可以指其修饰的一个或多个元素(例如,“一种试剂”可以表示一种或多种试剂),除非在上下文中明确描述元素中的一个或多于元素中的一个。如本文所用,术语“约”是指基础参数的10%以内的值(即,正负10%),并且在一串值的开头使用术语“约”修饰每个值(即,“约1、2和3”是指约1、约2和约3)。例如,“约100克”的重量可以包括90克至110克之间的重量。如本文所用,术语“基本上”是指意思是“至少95%”、“至少96%”、“至少97%”、“至少98%”或“至少99%”并且可以包括100%的值修饰语。例如,基本上无X的组合物可以包括少于5%、少于4%、少于3%、少于2%或少于1%的X,和/或X可以在组合物中不存在或不可检测。
- 甘草水提取物、包含其的组合物及其制备方法和用途
- 小茴香水提取物、包含其的组合物及其制备方法和用途
- 包含具有可交换交联点的交联有机硅的聚合物组合物、制备方法和用途
- 一种包含左卡尼汀的药用组合物及其制备方法和用途
- 美白组合物、包含美白组合物的美白亮肤霜及其制备方法
- 多孔中空二氧化硅纳米颗粒、所述二氧化硅纳米颗粒的制备方法以及包含所述二氧化硅纳米颗粒的药物载体和药物组合物
- 多孔中空二氧化硅纳米颗粒、所述二氧化硅纳米颗粒的制备方法以及包含所述二氧化硅纳米颗粒的药物载体和药物组合物
