一株具有抗炎、抗氧化功能的罗伊氏乳杆菌菌株A21041及其应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明属于功能微生物技术领域,具体涉及一株具有抗炎、抗氧化功能的罗伊氏乳杆菌(Limosilactobacillus reuteri)菌株A21041及其应用。
背景技术
益生菌是一类对人体有益的微生物,可作为调控肠道微生态平衡的靶点,通过调节肠道菌群丰度及其代谢产物以缓解肠道应激,抑制炎症反应,进而改善肠道综合征。近年来,氧化应激性结肠炎在我国发病率明显升高,具有复发特性,也存在癌变的风险。临床上常用非甾体类抗炎药、糖皮质激素和免疫抑制剂等西药缓解症状,然而长期使用会导致疗效降低、不良反应增多等问题。
目前,越来越多的研究通过抑制炎症反应、缓解氧化应激、调节肠道菌群失衡等作用机制治疗应激性结肠炎。许多研究表明,益生菌可致力于缓解氧化应激性结肠炎,公开号CN115011518A的专利公开一种乳酸菌混合物,包括两歧双歧杆菌H3-R2和乳酸乳球菌KLDS4.0325,能改善CAC小鼠结肠组织氧化损伤,并降低炎症因子IL-6、TNF-α水平,同时上调了结肠和血清中抗炎细胞因子IL-10的水平,具有缓解结肠炎相关结直肠癌作用。公开号CN112625964B的专利公开一株鼠李糖乳杆菌,具有良好的生物学特性,缓解溃疡性结肠炎小鼠体重减轻,改善粪便性状和便血情况,改善结肠粘膜氧化损伤,减少结肠中促炎因子TNF-α、IL-1β、IL-6、IFN-γ含量,提高肠道菌群丰富度和多样性,共同发挥抗炎、抗氧化作用而治疗氧化应激性结肠炎。因此,益生菌防治应激性结肠炎的研究和开发是具有临床应用价值的,益生菌能够辅助增强西药治疗肠道综合症药效作用,减少西药用药剂量,避免因西药积累而出现严重不良反应。
然而,目前还未有关于罗伊氏乳杆菌具有抑制炎症反应,缓解氧化应激方面作用的报道。
发明内容
有鉴于此,本发明的目的在于提供一株罗伊氏乳杆菌(Limosilactobacillusreuteri)菌株A21041,具有抗炎、抗氧化功能,为氧化应激性结肠炎的防治提供了新手段。
本发明提供了一株具有抗炎、抗氧化功能的罗伊氏乳杆菌(Limosilactobacillusreuteri)菌株A21041,所述菌株A21041的保藏编号为GDMCC No:62832。
本发明提供了一种益生菌剂,包括所述具有抗炎、抗氧化功能的罗伊氏乳杆菌菌株A21041和辅料。
优选的,所述罗伊氏乳杆菌菌株A21041的活菌浓度为10
所述益生菌剂的剂型为口服剂。
本发明提供了所述罗伊氏乳杆菌菌株A21041或所述益生菌剂在制备抗菌产品中的应用。
优选的,所述抗菌中菌的种类包括致病性细菌;
优选的,所述致病性细菌包括金黄色葡萄球菌和/或大肠杆菌。
本发明提供了所述罗伊氏乳杆菌菌株A21041或所述益生菌剂在制备预防和/或治疗结肠炎的药物中的应用。
优选的,所述罗伊氏乳杆菌菌株A21041通过抑制COX-2iNOS表达,而抑制下游促炎因子IL-6、TNF-α表达,增加抗炎因子IL-10的表达,减少NO的释放,进而达到防治结肠炎的作用。
本发明提供了所述罗伊氏乳杆菌菌株A21041或所述益生菌剂在制备抗炎和抗氧化的产品中的应用。
优选的,所述罗伊氏乳杆菌菌株A21041有超氧化物歧化酶和谷胱甘肽过氧化酶酶活力,具有清除超氧阴离子和DPPH自由基能力。
优选的,所述产品包括以下至少一种:药品、保健品和化妆品。
本发明提供的具有抗炎、抗氧化功能的罗伊氏乳杆菌(Limosilactobacillusreuteri)菌株A21041,保藏编号为GDMCC No:62832。所述菌株A21041具有良好的耐受人工胃肠液、肠道胆盐的刺激及抑制大肠杆菌和金黄色葡萄球菌致病菌生长的生物学特性。菌株A21041能显著降低由LPS诱导的RAW264.7细胞产生炎症因子COX-2、iNOS、IL-6、TNF-α的表达,上调抗炎因子IL-10的表达,且有效减少NO的释放;A21041也能显著地延长DSS诱导小鼠结肠炎后结肠的长度,抑制结肠组织IL-6的表达,增加IL-10的表达,有效缓解小鼠溃疡性结肠炎;A21041还能清除DPPH、O
附图说明
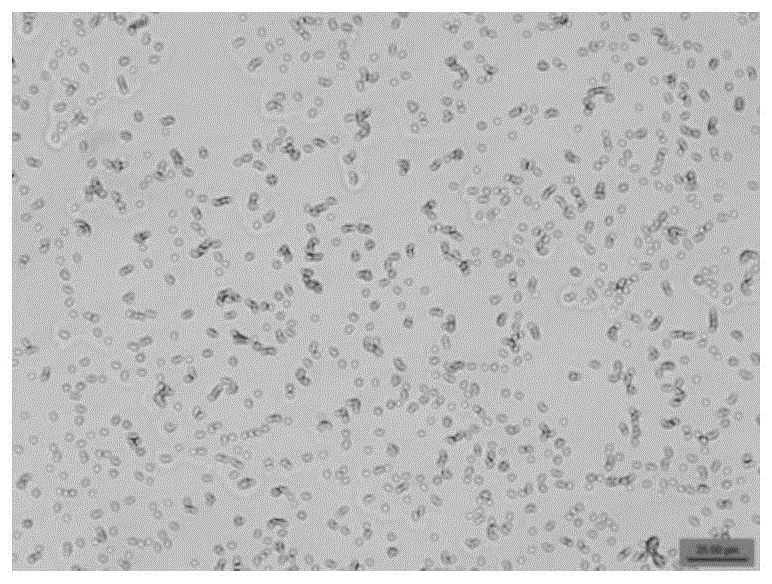
图1为A21041显微形态图;
图2为A21041生长曲线图;
图3为A21041对人工胃肠液的耐受性结果;
图4为A21041对牛胆盐的抵抗能力结果;
图5为A21041对大肠杆菌和金黄色葡萄球菌抑制作用结果;
图6为A21041对RAW264.7细胞炎症状态下COX-2iNOS基因的相对表达量结果;注:*表示LPS组与Control组对比,#表示LPS+A21041组与LPS组对比;
图7为A21041对RAW264.7细胞炎症状态下IL-6TNF-αIL-10iNOS蛋白表达影响结果;注:*表示LPS组与Control组对比,#表示LPS+A21041组与LPS组对比;
图8为A21041对RAW264.7细胞炎症状态下释放NO的含量结果;注:*表示LPS组与Control组对比,#表示A21041组与LPS组对比;
图9为A21041对结肠炎小鼠结肠长度的影响结果;*表示模型组与正常组对比,#表示美沙拉嗪组或A21041-H组与模型组对比
图10为A21041对结肠炎小鼠结肠组织IL-6IL-10蛋白表达影响结果,注:*表示模型组与正常组对比,#表示美沙拉嗪组或A21041-H组或A21041-D组与模型组对比。
生物材料保藏信息
罗伊氏乳杆菌(Limosilactobacillus reuteri)菌株A21041,已保藏于广东省微生物菌种保藏中心,单位简称GDMCC,地址为广州市先烈中路100号大院59号楼5楼,广东省微生物研究所,保藏编号为GDMCCNo:62832,保藏日期为2022年9月23日。
具体实施方式
本发明提供了一株具有抗炎、抗氧化功能的罗伊氏乳杆菌(Limosilactobacillusreuteri)菌株A21041,所述菌株A21041的保藏编号为GDMCC No:62832。
在本发明中,所述罗伊氏乳杆菌A21041是从百岁老人肠道微生物菌群样本中分离得到。现已保藏于广东省微生物菌种保藏中心,保藏编号为GDMCC No:62832,保藏日期为2022年9月23日。革兰氏染色观察菌株A21041的显微形态,紫外分光光度法检测A21041的生长状态,结果表明,菌株A21041为革兰氏阳性菌,细胞形态为短杆状,菌体大小(宽度×长度)为(0.5~1.0)μm×(1.0~2.0)μm。生长周期为前3h为静置适应期,3h-12h为对数生长期、OD
在本发明中,所述罗伊氏乳杆菌A21041具有耐受人工胃肠液、肠道胆盐及体外抑菌能力,较商品菌株17938抵抗pH 8的人工肠液和牛胆盐溶液能力强,8h处理A21041活菌数高达10
在本发明中,所述罗伊氏乳杆菌A21041的扩增方法,优选包括以下步骤:
挑取A21041单菌落接种于MRS液体培养基,置于37℃下培养12~14h,得到处于对生生长期的A21041菌悬液。
本发明提供了一种益生菌剂,包括所述具有抗炎、抗氧化功能的罗伊氏乳杆菌菌株A21041和辅料。
在本发明中,所述罗伊氏乳杆菌菌株A21041的活菌浓度优选为10
鉴于所述罗伊氏乳杆菌菌株A21041具有良好的耐受胃肠道液和牛胆盐溶液的特性,因此所述益生菌剂的剂型优选为口服剂,例如,粉剂、口服液、片剂等。
本发明提供了所述罗伊氏乳杆菌菌株A21041或所述益生菌剂在制备抗菌产品中的应用。
在本发明中,所述抗菌中菌的种类优选包括致病性细菌。所述致病性细菌优选包括金黄色葡萄球菌和/或大肠杆菌。体外抑菌实验结果表明,菌株A21041明显抑制大肠杆菌和金黄色葡萄球菌的生长,抑制作用显著优于菌株17938。
本发明提供了所述罗伊氏乳杆菌菌株A21041或所述益生菌剂在制备预防和/或治疗结肠炎的药物中的应用。
在本发明中,所述罗伊氏乳杆菌菌株A21041优选通过抑制COX-2iNOS表达,而抑制下游促炎因子IL-6、TNF-α表达,增加抗炎因子IL-10的表达,减少NO的释放,进而达到防治结肠炎的作用。在本发明实施例中,以DSS诱导小鼠结肠炎模型为实验对象,灌胃小鼠模型A21041菌液,结果表明,与正常组比较,模型组小鼠结肠极显著缩短;与模型组比较,A21041-H组(1×10
本发明提供了所述罗伊氏乳杆菌菌株A21041或所述益生菌剂在制备抗炎和抗氧化的产品中的应用。
在本发明中,所述罗伊氏乳杆菌菌株A21041优选有超氧化物歧化酶和谷胱甘肽过氧化酶酶活力,具有清除超氧阴离子和DPPH自由基能力。
在本发明中,所述产品优选包括以下至少一种:药品、保健品和化妆品。
下面结合实施例对本发明提供的一株具有抗炎、抗氧化功能的罗伊氏乳杆菌菌株A21041及其应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
一种罗伊氏乳杆菌菌株A21041的分离纯化及鉴定方法
将广西合浦县102岁老人肠道微生物菌群样本按倍比稀释,涂布在MRS平皿,在生化培养箱37℃培养48h左右,获得单菌落。挑取单菌落,接种于MRS液体培养基,放在37℃摇床培养24h。再挑取菌液,在MRS平皿上划线,继续培养出单菌落。再挑取单菌落重新划线,继续培养出单菌落,经过3次划线后,得到纯的乳杆菌。挑取纯分离的乳杆菌单菌落,进行革兰氏染色、16S rDNA(SEQ ID NO:1),鉴定为罗伊氏乳杆菌A21041。A21041单菌落培养于MRS液体培养基,酶标仪检测生长状态,Graphpadprism 5软件绘制生长曲线。
图1显示出了A21041的生长周期:前3h为静置适应期,3h-12h为对数生长期、OD600值变化很大、菌株迅速增长,12h-30h为平台期、菌株生长趋势趋于平缓,未出现衰亡期。图2显示出A21041的显微形态,该菌株为革兰氏阳性菌,细胞形态为短杆状,菌体大小(宽度×长度)为(0.5~1.0)μm×(1.0~2.0)μm。
实施例2
罗伊氏乳杆菌菌株A21041耐受人工胃液及肠液情况
挑取纯化后的罗伊氏乳杆菌菌株17938和罗伊氏乳杆菌菌株A21041单菌落,分别接种于MRS液体培养基,于37℃摇床培养过夜。按10%的接种量,将菌液接种于pH=2.5的人工胃液,设置3个时间点(0h、1h、3h),各取100μl涂布于MRS平皿,在生化培养箱37℃培养48h后,计数单菌落数量;将在人工胃液处理3h后的菌液,按10%的接种量,接种于pH=8的人工胃液,设置4个时间点(0h、2h、4h、8h),各取100μl涂布于MRS平皿,在生化培养箱37℃培养48h后,计数单菌落数量,按照公式I计算存活率。存活率(%)=(不同时间点的单菌落数量/0h时单菌落数量)×100%公式I
结果如图3显示,17938和A21041均能耐受pH=2.5人工胃液3h,且存活率均在90%左右;而A21041较17938抵抗pH=8的人工肠液能力强,8h后A21041活菌数高达10
实施例3
罗伊氏乳杆菌菌株A21041耐受牛胆盐溶液情况
挑取纯化后的罗伊氏乳杆菌菌株17938和罗伊氏乳杆菌菌株A21041单菌落,分别接种于MRS液体培养基,于37℃摇床培养过夜。按10%的接种量,将菌液接种于0.5g/L浓度牛胆盐溶液中,在生化培养箱37℃培养2h后,取100μl倍数稀释后涂布于MRS平皿;继续培养到24h,取100μl倍数稀释后涂布于MRS平皿;上述这些MRS平皿在生化培养箱37℃培养48h后,计数单菌落数量,并计算存活率。
结果如图4显示出,A21041能耐受0.5g/L牛胆盐溶液,且活菌数高达10
实施例4
A21041体外抑制大肠致病菌和金黄色葡萄球菌情况
培养具有致病性的O157:H7大肠杆菌(ATCC35150)和金黄色葡萄球菌(ATCC43300)为指示菌,12h后,分别取100ul指示菌液涂布于LB平皿,待平皿晾干后放置牛津杯,在各牛津杯中加入200μl 17938和A21041菌液,MRS培养液做对照。LB平皿先于4℃放置6h,后置于37℃培养箱放置12h。观察有无抑菌圈并测量抑菌圈直径。
结果见表1。
表1A21041与17938体外抑菌情况
结果如图5显示,A21041明显抑制大肠杆菌和金黄色葡萄球菌的生长,抑制作用显著优于17938。
实施例5
A21041对LPS诱导RAW264.7细胞炎症状态下炎症因子的表达及NO释放的影响
(1)由DMEM完全培养基(含10%Gibco胎牛血清)培养小鼠单核巨噬细胞系RAW264.7细胞。选择对数生长期的RAW264.7细胞,按照5×10
(2)收集细胞,使用
qPCR扩增体系(总体积20.0uL)如表2所示。
表2qPCR扩增体系
表3小鼠COX-2、iNOS基因引物
qPCR反应程序如下:
结果如图6所示,与Control组相比,LPS组极显著增加COX-2及iNOS基因的表达;而与LPS组比较,A21041显著降低COX-2及iNOS基因的表达,具有统计学意义(p<0.01或p<0.05)。
(3)收集细胞上清液,使用ELISA试剂盒(江莱生物提供)检测IL-6、IL-10、iNOS、TNF-α蛋白的表达情况。
结果如图7所示,与Control组相比,LPS组极显著增加IL-6、TNF-α、iNOS蛋白的表达,而对抗炎因子IL-10蛋白的表达没有影响;与LPS组比较,A21041显著降低IL-6、TNF-α、iNOS蛋白的表达,且极显著提高IL-10蛋白的表达,具有统计学意义(p<0.01或p<0.05)。
(4)收集细胞及细胞上清液,使用总NO检测试剂盒检测亚硝酸盐含量,间接推算出总NO释放量。
结果如图8所示,与Control组相比,LPS组极显著增加NO的释放;而与LPS组比较,A21041显著降低NO的释放量,具有统计学意义(p<0.01或p<0.05)。
实施例6
A21041对DSS诱导小鼠结肠炎状态下结肠长度的变化及炎症因子表达的影响
(1)24只、6周龄SPF级雌性C57BL/6小鼠,初始体重为15-17g,购于长沙市天勤生物技术有限公司,实验动物许可证号(Scxk(湘)2019-0013)。适应性喂养1周后,随机将小鼠分为正常组3只,模型组3只,美沙拉嗪组6只,A21041低浓度组(浓度为1×10
(2)观察小鼠活动情况、精神状态、皮毛光泽度和体重变化:模型组小鼠行动迟缓、精神萎糜、毛发粗糙脱毛、弓背及体重下降;美沙拉嗪组和A21041-H组小鼠反应敏捷、精神活跃、毛发光滑及体重有所增加。
(3)小鼠结肠长度测量:第22天处死小鼠并解剖后,取肛门至盲肠末端的整段结肠,清洗血迹并自然展开,测量长度,结果如图9所示:与正常组比较,模型组小鼠结肠极显著缩短(p<0.01);与模型组比较,A21041-H组小鼠结肠显著增长(p<0.05),且具有统计学意义。
(4)小鼠结肠炎症因子IL-6、IL-10的测定:取小鼠结肠组织1cm,置于1.5mL离心管,每个离心管放入3粒钢珠并加入9倍体积的预冷无菌PBS,置于高速组织研磨机研磨后,以1000×g,4℃离心15min,收集上清用于炎症因子的检测。根据酶联免疫试剂盒(江莱生物提供)检测小鼠结肠组织中炎症因子IL-6、IL-10的含量。
测定结果如图10所示,结果表明与正常组比较,模型组小鼠结肠组织中IL-6表达量极显著升高,IL-10极显著降低(p<0.01)。与模型组相比,高浓度A21041显著降低结肠炎小鼠结肠组织IL-6的表达(p<0.05),低浓度A21041对IL-6有抑制作用,但不显著(p>0.05)。A21041(浓度1×10
结论:A21041可能通过降低促炎因子IL-6的表达和增加抗炎因子IL-10的表达而缓解结肠炎症。
实施例7
A21041清除DPPH/O2-自由基能力及其所含SOD、GSH-Px活力
挑取纯化后的17938和A21041单菌落,分别接种于MRS液体培养基,于37℃摇床培养过夜。
(1)检测A21041清除1,1-二苯基-2-三硝基苯肼(DPPH)自由基能力菌液浓度调至10
DPPH清除率W1计算按照公式II完成。
W1(%)={1-(A
(2)检测A21041清除超氧阴离子(O
取0.05mol/L Tris-HCl缓冲液4.5mL,置于25℃水浴预热20min。分别加入2mL菌液和2.4mL无菌生理盐水以及0.1mL 25mmol/L的邻苯三酚溶液(由10mmol/L HCl配制),混匀后置于25℃水浴反应5min,加入1mL 8mol/L HCl终止反应,325nm下测定吸光度值A
W2(%)=(1-A
(3)检测A21041含超氧化物歧化酶(SOD)活力
菌液浓度调至5×10
(4)检测A21041含谷胱甘肽过氧化酶(GSH-Px)活力
菌液浓度调至5×10
(5)综上清除DPPH/O
表4A21041中DPPH/O
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一株罗伊氏乳杆菌及其在蜜蜂养殖过程中的应用
- 一株具有益生特征的罗伊氏乳杆菌菌株及其应用
- 一株具有益生特征的罗伊氏乳杆菌菌株及其应用
