一种3D打印仿生复合多孔支架的制备方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及骨缺损修复支架材料技术领域,更具体的是,本发明涉及一种3D打印仿生复合多孔支架的制备方法。
背景技术
人工骨支架材料因来源广泛、免疫排斥风险低和可个性化定制等优点,成为继自体骨、异体骨和异种骨之外的一种非常有前景的新型骨缺损修复材料。合格的人工骨支架材料需要具有良好的生物活性、一定的孔隙率,足够的机械强度、易于制造和可控降解等要求,而满足上述要求的两大核心要素便是支架的制备工艺和材料选择。在制备工艺方面,传统的骨支架制造方法复杂且难以控制支架的内部结构,比如冷冻干燥、气体发泡法与粒子沥滤法、熔融浇铸法等,这些方法虽然能够形成多孔的结构,但是难以控制孔的尺寸和形状,并且孔之间的连通性差,难以实现与骨缺损部位匹配,同时,由于制备过程中需要使用大量的有机溶剂,无法避免的有机溶剂残留会产生毒性作用。
3D打印技术的进步及其与骨组织工程的结合再次推动了骨支架材料领域的快速发展。因其在骨支架的几何形状和内部结构控制方面的独到优势,如今已成为骨组织工程的关键制造工艺。在当前种类众多的3D打印技术中,熔融沉积成型(FDM)技术因其原理简单、成本较低、产品精度良好而得到广泛应用。其基本原理是由送丝机构以丝状材料供料,将材料加热至熔融态后通过打印机的喷嘴挤出,喷头沿着程序预先设定的轨道在水平方向移动,同时配合平台在垂直方向的运动,新的一层粘合到先前形成的层上,层层堆叠从而在室温下固化形成一个3D立体模型,但是其制备的多孔支架仅有单一尺寸的孔洞,与具有层级孔洞结构的天然骨相比在结构上相差甚远,有研究表明,具有多层孔洞的结构更有利于成骨。
在材料选择方面,热塑性聚合物是FDM技术常用的材料,其中以人工合成聚合物为主,比如PCL,PLGA,PLA等,因为它们来源广泛、有着较天然聚合物更好的机械性能。同金属材料相比,聚合物材料有着更接近骨的弹性模量,可以减少支架材料植入后的应力屏蔽效应,更重要的一点是,聚合物材料可以伴随着缓慢的成骨过程逐渐降解。但其也有比较明显的缺点,比如聚合物材料往往因表面疏水导致生物相容性较差;聚合物材料不含钙磷元素,这与以钙磷为主要无机成分的天然骨在组成方面相差甚远;纯聚合物材料的机械性能较低。于是有人将生物陶瓷类材料,比如HA,TCP,BCP,BG等与聚合物材料相混合制备复合材料,结合了两种材料的优点,利用生物陶瓷类材料提高聚合物的机械性能和表面亲水性,进而提高生物相容性,有利于新骨的形成和沉积。
HA广泛存在于自然界,是动物和人的牙齿和骨骼中的主要无机成分,PCL生物相容性良好,是经FDA(美国食品和药品监督委员会)批准的可用于人体内使用的材料。当前研究表明,FDM制备的PCL基nHA复合材料支架具有良好的生物相容性,相对于纯PCL支架在亲水性和成骨性能方面有所提升,但受限于PCL自身高度疏水的性质和FDM制备支架表面过于光滑的技术通病,导致支架的亲水性较差,细胞不易迁移和黏附到支架上,使得HA对PCL支架的性能改进有限,并且,PCL/HA复合支架的降解速度仍然较慢,难以与新骨形成速度匹配,且仅具有单一尺寸的大孔。
发明内容
本发明的目的是设计开发了一种3D打印仿生复合多孔支架的制备方法,通过调整PEG的添加量,使得支架具有仿生多级孔道结构,提高了支架的亲水性、粗糙度和降解速度,并且能够促成骨。
本发明提供的技术方案为:
一种3D打印仿生复合多孔支架的制备方法,包括如下步骤:
步骤一、将聚己内酯和羟基磷灰石以质量比8:2混合均匀后形成一级混合物;
步骤二、按照一级混合物总质量的10%~30%比例向其中加入聚乙二醇后,熔融共混造粒,获得复合材料颗粒;
步骤三、将所述复合材料颗粒投入FDM打印机的料筒中,进行3D打印,获得仿生PCL/nHA/PEG复合多孔支架。
优选的是,所述熔融温度为140℃。
优选的是,所述步骤二中为手动造粒。
优选的是,所述FDM打印机的打印温度为100℃。
优选的是,所述FDM打印机在进行3D打印之前需预加热10分钟,预加热温度与打印温度相同。
优选的是,所述FDM打印机的参数包括:
喷嘴内径为400μm,线间距为0.8mm,层高0.30mm,挤出速度为0.20mm3/s,打印速度1.50mm/s。
优选的是,所述仿生PCL/nHA/PEG复合多孔支架的挤出丝直径为405.65±31.41μm,孔径为356.28±20.06μm,层高为157.43±10.79μm。
优选的是,所述聚己内酯、羟基磷灰石和聚乙二醇均为固体。
优选的是,所述羟基磷灰石的粒径为20nm。
本发明所述的有益效果:
(1)、本发明设计开发的一种3D打印仿生复合多孔支架的制备方法,利用其原理简单、操作简便、原材料成本低廉和能够快速、个性化定制支架外形与内部结构的优点,巧妙地将具有良好生物相容性、亲水性和快速水解性能的PEG以不同的比例添加到原PCL/nHA复合材料体系中进行改进,使制备出的PCL/nHA/PEG多孔复合支架材料的亲水性得到大幅度提升,并且在PEG水解后,在支架表面形成次级孔道,增大了支架的孔隙率和吸水率,提高了材料表面的粗糙度和比表面积,支架的降解速度也得到提升,便于细胞的迁移和成骨,利于与骨缺损部位的匹配。
(2)、本发明设计开发的一种3D打印仿生复合多孔支架的制备方法,利用PEG改良PCL基材料的原理简单,适用范围广,可以用于改良大多数FDM制备的热塑性高聚物及其复合材料支架的亲水性和粗糙度,即等同于对FDM支架表面过于光滑这一技术通病的改进。
附图说明
图1为本发明所述PHP0、PHP10、PHP20、PHP30和PHP40的结构示意图。
图2a~2d为本发明所述PHP0、PHP10、PHP20和PHP30的俯视SEM示意图。
图3a~3d为本发明所述PHP0、PHP10、PHP20和PHP30的剖面SEM示意图。
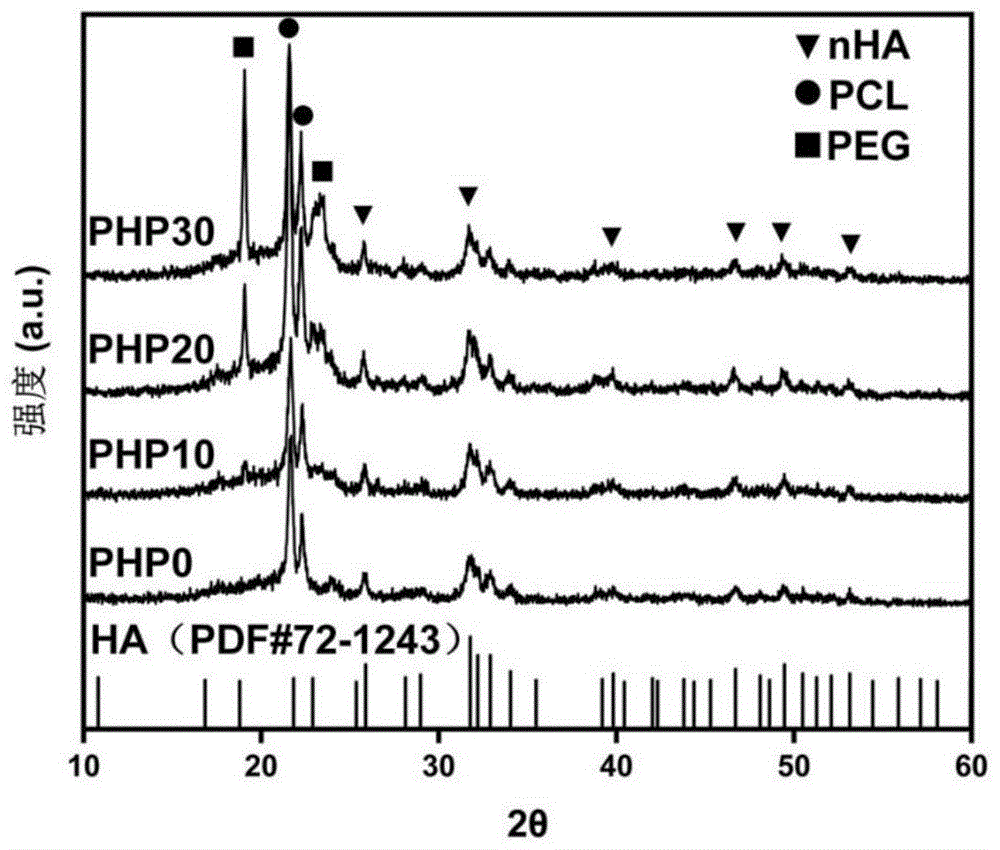
图4为本发明所述PHP0、PHP10、PHP20和PHP30的XRD衍射图。
图5a~5c为本发明所述PHP0、PHP10、PHP20和PHP30的应力-应变、弹性模量和压缩强度的机械性能测试结果示意图。
图6为本发明所述PHP0、PHP10、PHP20和PHP30的水接触角随PEG含量的变化示意图。
图7为本发明所述PHP0、PHP10、PHP20和PHP30的孔隙率随PEG含量的变化示意图。
图8为本发明所述PHP0、PHP10、PHP20和PHP30的吸水率随PEG含量的变化示意图。
图9为本发明所述PHP0、PHP10、PHP20和PHP30在PBS中随浸泡时间变化的降解失重曲线示意图。
图10a~10c为本发明所述PHP0在PBS中未浸泡、浸泡第一天和浸泡第七天的表面微观形貌示意图。
图11a~11c为本发明所述PHP10在PBS中未浸泡、浸泡第一天和浸泡第七天的表面微观形貌示意图。
图12a~12c为本发明所述PHP20在PBS中未浸泡、浸泡第一天和浸泡第七天的表面微观形貌示意图。
图13a~13c为本发明所述PHP30在PBS中未浸泡、浸泡第一天和浸泡第七天的表面微观形貌示意图。
图14为本发明所述PHP0、PHP10、PHP20和PHP30降解造孔前后的孔隙率变化示意图。
图15为本发明所述PHP0、PHP10、PHP20和PHP30降解造孔前后的吸水率变化示意图。
图16a~16d为本发明所述PHP0在SBF中浸泡第一天、浸泡第三天、浸泡第七天和浸泡第十四天的SEM示意图。
图17a~17d为本发明所述PHP10在SBF中浸泡第一天、浸泡第三天、浸泡第七天和浸泡第十四天的SEM示意图。
图18a~18d为本发明所述PHP20在SBF中浸泡第一天、浸泡第三天、浸泡第七天和浸泡第十四天的SEM示意图。
图19a~19d为本发明所述PHP20在SBF中浸泡第一天、浸泡第三天、浸泡第七天和浸泡第十四天的放大SEM示意图。
图20a~20d为本发明所述PHP30在SBF中浸泡第一天、浸泡第三天、浸泡第七天和浸泡第十四天的SEM示意图。
图21为本发明所述PHP0、PHP10、PHP20和PHP30浸提液与MC3T3-E1细胞共培养的细胞增殖结果示意图。
图22为本发明所述PHP0、PHP10、PHP20和PHP30浸提液与MC3T3-E1细胞共培养的活性检测结果示意图。
图23a~23c为本发明所述PHP0浸提液与MC3T3-E1细胞共培养的活死染色检测结果示意图。
图24a~24c为本发明所述PHP10浸提液与MC3T3-E1细胞共培养的活死染色检测结果示意图。
图25a~25c为本发明所述PHP20浸提液与MC3T3-E1细胞共培养的活死染色检测结果示意图。
图26a~26c为本发明所述PHP30浸提液与MC3T3-E1细胞共培养的活死染色检测结果示意图。
具体实施方式
下面结合对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
如图1、图2、图3所示,本发明提供的一种3D打印仿生复合多孔支架的制备方法,包括如下步骤:
步骤一、将固体聚己内酯(PCL,分子量=80,000)和纳米羟基磷灰石(nHA,粒径=20nm)以质量比8:2称量后置于烧杯内,在室温条件下搅拌均匀形成一级混合物;
步骤二、按照一级混合物总质量的10%~30%比例向其中加入聚乙二醇(PEG,分子量=20,000)后,将其转移到烘箱内,设置烘箱温度为140℃,熔融状态下手动搅拌均匀后将其取出并塑形成复合材料颗粒;
其中,所述复合材料颗粒均为手动造粒,因此,复合材料颗粒的粒径小于打印机的料筒直径即可,受不同品牌型号3D打印机之间的差异,颗粒的最大粒径可有不同。
步骤三、将所述复合材料颗粒干燥后投入FDM打印机的不锈钢料筒中,设置打印温度为100℃,并在打印之前预加热10分钟,且预加热温度与打印温度相同,通过3D打印机(BiomakerPro,中国)自带软件BiomakerV2构建三维虚拟模型支架,支架按Zig-Zag走线模式沿0°/90°交替构成,进行3D打印,获得仿生PCL/nHA/PEG复合多孔支架;
其中,打印机参数设置:喷嘴内径为400μm,线间距为0.8mm,层高0.30mm,挤出速度为0.20mm3/s,打印速度1.50mm/s。
实施例1
步骤一、将8g固体PCL和2g纳米nHA(粒径=20nm)称量后置于烧杯内,在室温条件下搅拌均匀形成一级混合物;
步骤二、向一级混合物中加入1g固体PEG后,将其转移到烘箱内,设置烘箱温度为140℃,熔融状态下手动搅拌均匀后将其取出并塑形成复合材料颗粒;
步骤三、将所述复合材料颗粒干燥后投入FDM打印机的不锈钢料筒中,设置打印温度为100℃,并在打印之前预加热10分钟,通过3D打印机(BiomakerPro,中国)自带软件BiomakerV2构建三维虚拟模型支架,支架按Zig-Zag走线模式沿0°/90°交替构成,进行3D打印,获得仿生PCL/nHA/PEG复合多孔支架PHP10;
其中,打印机参数设置:喷嘴内径为400μm,线间距为0.8mm,层高0.30mm,挤出速度为0.20mm3/s,打印速度1.50mm/s。
实施例2
步骤一、将8g固体PCL和2g纳米nHA(粒径=20nm)称量后置于烧杯内,在室温条件下搅拌均匀形成一级混合物;
步骤二、向一级混合物中加入2g固体PEG后,将其转移到烘箱内,设置烘箱温度为140℃,熔融状态下手动搅拌均匀后将其取出并塑形成复合材料颗粒;
步骤三、将所述复合材料颗粒干燥后投入FDM打印机的不锈钢料筒中,设置打印温度为100℃,并在打印之前预加热10分钟,通过3D打印机(BiomakerPro,中国)自带软件BiomakerV2构建三维虚拟模型支架,支架按Zig-Zag走线模式沿0°/90°交替构成,进行3D打印,获得仿生PCL/nHA/PEG复合多孔支架PHP20;
其中,打印机参数设置:喷嘴内径为400μm,线间距为0.8mm,层高0.30mm,挤出速度为0.20mm3/s,打印速度1.50mm/s。
实施例3
步骤一、将8g固体PCL和2g纳米nHA(粒径=20nm)称量后置于烧杯内,在室温条件下搅拌均匀形成一级混合物;
步骤二、向一级混合物中加入3g固体PEG后,将其转移到烘箱内,设置烘箱温度为140℃,熔融状态下手动搅拌均匀后将其取出并塑形成复合材料颗粒;
步骤三、将所述复合材料颗粒干燥后投入FDM打印机的不锈钢料筒中,设置打印温度为100℃,并在打印之前预加热10分钟,通过3D打印机(BiomakerPro,中国)自带软件BiomakerV2构建三维虚拟模型支架,支架按Zig-Zag走线模式沿0°/90°交替构成,进行3D打印,获得仿生PCL/nHA/PEG复合多孔支架PHP30;
其中,打印机参数设置:喷嘴内径为400μm,线间距为0.8mm,层高0.30mm,挤出速度为0.20mm3/s,打印速度1.50mm/s。
对比例1
步骤一、将8g固体PCL和2g纳米nHA(粒径=20nm)称量后置于烧杯内,在室温条件下搅拌均匀形成一级混合物;
步骤二、将一级混合物转移到烘箱内,设置烘箱温度为140℃,熔融状态下手动搅拌均匀后将其取出并塑形成复合材料颗粒;
步骤三、将所述复合材料颗粒干燥后投入FDM打印机的不锈钢料筒中,设置打印温度为100℃,并在打印之前预加热10分钟,通过3D打印机(BiomakerPro,中国)自带软件BiomakerV2构建三维虚拟模型支架,支架按Zig-Zag走线模式沿0°/90°交替构成,进行3D打印,获得仿生PCL/nHA/PEG复合多孔支架PHP0;
其中,打印机参数设置:喷嘴内径为400μm,线间距为0.8mm,层高0.30mm,挤出速度为0.20mm3/s,打印速度1.50mm/s。
对比例2
步骤一、将8g固体PCL和2g纳米nHA(粒径=20nm)称量后置于烧杯内,先在室温条件下搅拌均匀形成一级混合物;
步骤二、向一级混合物中加入4g固体PEG后,将其转移到烘箱内,设置烘箱温度为140℃,熔融状态下手动搅拌均匀后将其取出并塑形成复合材料颗粒;
步骤三、将所述复合材料颗粒干燥后投入FDM打印机的不锈钢料筒中,设置打印温度为100℃,并在打印之前预加热10分钟,通过3D打印机(BiomakerPro,中国)自带软件BiomakerV2构建三维虚拟模型支架,支架按Zig-Zag走线模式沿0°/90°交替构成,进行3D打印,获得仿生PCL/nHA/PEG复合多孔支架PHP40;
其中,打印机参数设置:喷嘴内径为400μm,线间距为0.8mm,层高0.30mm,挤出速度为0.20mm3/s,打印速度1.50mm/s。
如图1所示,对实施例1、2、3和对比例1、2中获得的PHP10、PHP20、PHP30、PHP0和PHP40进行外观检测,其中,a为PHP0的外观形貌图,b为PHP10的外观形貌图,c为PHP20的外观形貌图,d为PHP30的外观形貌图,e为PHP40的外观形貌图,可以看出,PHP0、PHP10、PHP20和PHP30的4各组支架外形规整,呈半透明的乳白色,支架的孔径大小均匀、相互连通,未出现塌陷和断裂现象,并且在添加PEG后,支架的侧面孔隙成型情况明显变好,但是,当PEG含量增加到一级混合物质量的40%时,在原有打印参数下,支架的层与层之间发生塌陷堆积,侧面无法形成孔隙,支架的整体收缩明显,无法制备出预期支架的形态,因此PHP40的无法到达使用要求,后续仅对PHP0~PHP30进行测试。
如图2a~2d和图3a~3d所示,在SEM示意图中,a
目前,骨支架的最佳孔径问题还没有明确的答案,根据现有研究,细胞存活所需的营养物质和氧气运输的最小有效孔径约为100μm,成骨和新生血管至少需要200-350μm的互连孔径,细胞迁移和构建新的骨组织层需要100~400μm的孔径,骨形成至少需要100-150μm孔径,而血管化需要的孔径在300μm以上,其中,小孔(<200μm)能促进高密度小血管的形成,但穿透深度较差;大孔(>200μm)有利于形成低密度、穿透深度较大的大血管,综合以上研究结论可以得出,本发明实施例所制备的骨支架在互联孔径方面满足骨组织工程支架的一般要求,为营养物质和代谢废物向支架中心的输送提供了一条途径。
表1PHP0支架参数
表2PHP10支架参数
表3PHP20支架参数
表4PHP30支架参数
表5 4组支架的处理结果
如图4所示,为了确定复合材料支架的物相,对不同PEG含量的4组支架材料进行了XRD检测,在25.8°、31.7°、39.8°、46.8°、49.4°和53.2°观察到nHA的特定衍射峰,在21.6°和22.3°观察到存在PCL的两个特征峰,以上特征峰在4组支架中均出现,说明nHA成功混入到PCL中,并且在高温打印过程中各物质没有发生相变;在PHP10~PHP30的3组支架的XRD图谱中观察到19.1°和23.5°两个PEG的特征峰,并且随着PEG含量的增加其峰逐渐尖锐,而在不含PEG的PHP0组支架中未出现该特征峰,说明PEG成功混合到PHP10~PHP30组中并且没有发生物相改变,这说明PCL/nHA/PEG复合材料是上述三种材料的物理混合,能够保持其各自的优良特性并汇集到一起,符合本发明的预期。
如图5a所示,为四组支架的应力-应变曲线图,曲线由线性弹性区域、相对恒定的应力平台区域和应力急剧上升的致密化区域构成;如图5b所示,通过对应力-应变曲线的分析和计算得出,支架的弹性模量随着PEG的增加先降低后升高再降低,由69.14MPa下降到43.02MPa;如图5c所示,支架的压缩强度由6.37MPa减小到3.69MPa,但是均满足人松质骨的相关力学要求(弹性模量:0.02-0.5GPa,压缩强度:2–12MPa),这说明制备的骨支架在机械性能方面符合要求。
水接触角指数反映支架的表面亲水性,这是影响细胞粘附和迁移的主要因素,但是PCL的疏水性会抑制细胞的迁移和粘附,聚乙二醇材料的分子链具有丰富的亲水性羟基。从图6中可以看出,当PEG含量从0增加到30%时,PEG与PCL/nHA的结合使水接触角从75.62°减小到44.05°,可见PCL/nHA/PEG支架具有良好的亲水性和润湿性,同时,在体外实验中发现,PEG的加入促进了PLGA/PEG支架表面的细胞增殖和形态适应。
如图7所示,支架的孔隙率随着PEG含量的增加发生了增加,由24.78%增加到39.28%,孔隙率的增加主要由支架挤出丝随PEG含量增加逐渐变细引起,这与前述SEM图像的测量结果相一致;如图8所示,吸水率随着PEG含量的增加也发生了增加,由23.58%增加到43.18%,支架吸水率的增加主要有2方面的原因:其一为支架的孔隙率增大,其二为PEG含有亲水性的羟基基团,当PEG含量增加时,支架表面暴露更多的PEG,从而吸附更多的水分;增大的孔隙率和吸水率更有利于营养物质和代谢废物的运输,从而为发生于支架内部的成骨过程提供足够的营养。
PCL/nHA多孔支架材料已经被证实具有良好的生物相容性和成骨能力,但是其降解速度较慢,与成骨速度相比匹配性较差。如图9所示,为PHP0、PHP10、PHP20和PHP30的4组支架在PBS中随浸泡时间延长的降解失重变化情况,由图可知大部分PEG的水解发生在浸泡的第一天,PHP0组支架不含PEG,因此该组支架的降解全程基本维持恒定的速度;PHP10组支架的PEG含量较少,在降解第一天后即达到稳定失重速度;PHP30组支架的PEG含量最高,在降解第7天时失重速度才基本达到稳定,失重曲线的斜率代表支架的降解速度,尽管PEG的快速水解主要发生在降解的初期,但在整个降解过程中,四组支架的降解速度为:PHP30>PHP20>PHP10>PHP0,这与PEG水解后在支架表面产生的次级微孔有关,次级微孔增大了支架的比表面积,能够在降解的过程中与更多的降解液接触,这种差异在不含PEG组中的表现更为明显,当降解时间到第70天时,PHP10-PHP30组的失重率分别为26.42%、34.07%、41.61%,而未加PEG的PHP0组仅为15.05%,由此可见,PEG的加入提高了PCL/nHA/PEG支架的降解速度,提升了支架降解与成骨速度的匹配性。
为了验证PEG的水解对支架表面微观结构产生的影响,结合图9反映出的PEG水解的规律,对降解过程中的支架进行了SEM观察,如图10a~10c、图11a~11c、图12a~12c和图13a~13c所示,分别为PHP0、PHP10、PHP20和PHP30组在PBS中浸泡不同时间的降解过程中表面微观形貌变化,其中,a3为PHP0在未浸泡的SEM示意图,a4为PHP0在浸泡第一天的SEM示意图,a5为PHP0在浸泡第七天的SEM示意图,b3~b5、c3~c5和d3~d5分别为PHP10、PHP20和PHP30在未浸泡、浸泡第一天和浸泡第七天的SEM示意图,与未浸泡PBS的支架相比,除PHP0组外,其他支架在降解第一天时即可发生明显的表面形貌变化,支架表面产生的微孔道随着PEG含量的增多而逐渐增多、加深;当支架降解到第7天时,此时PEG的水解已经大部分完成,PEG的造孔作用也同时完成,支架表面的次级微孔更多、更深。而不含PEG的PHP0组支架在此过程中并未发生明显的表面形貌变化,无次级微孔的产生。
图10a~10c、图11a~11c、图12a~12c和图13a~13c已经证实了PEG水解对支架表面微观结构产生的影响,为了量化这种影响,对降解第7天时的4组支架再次进行了孔隙率、吸水率和亲水性检测,如图14、图15所示,为PEG水解造孔后的支架孔隙率和吸水率结果及其与原始支架的对比结果,可知,降解7天后,支架的孔隙率和吸水率再次提升,由于PCL与nHA的降解过程较慢,因此,该时间段内支架的孔隙率和吸水率的变化主要由PEG的水解作用产生,由图14可知,支架降解7天后,除未添加PEG的PHP0组外,其他三组支架的孔隙率均有增加,并且孔隙率增加的幅度与PEG的添加量一致;图15显示除添加PEG的支架组降解7天后的吸水率发生增加外,未添加PEG的PHP0组也发生增加。
为了验证PCL/nHA/PEG支架的体外成骨效果,将4组支架分别浸泡于模拟体液(1xSBF)中,在第1,3,7,14天时取出支架,PBS轻轻冲洗后干燥,喷金后利用SEM观察支架表面矿化物的微观形貌,结果如图16a~16d、图17a~17d、图18a~18d、图20a~20d所示,a6为PHP0在SBF中浸泡第一天的SEM示意图,a7为PHP0在SBF中浸泡第三天的SEM示意图,a8为PHP0在SBF中浸泡第七天的SEM示意图,a9为PHP0在SBF中浸泡第十四天的SEM示意图,b6~b9、c6~c9和d6~d9分别为PHP10、PHP20和PHP30在SBF中浸泡第一天、浸泡第三天、浸泡第七天和浸泡第十四天的SEM示意图,如图19a~19d所示,为PHP20在SBF中浸泡第一天、浸泡第三天、浸泡第七天和浸泡第十四天的局部放大SEM示意图,第1天时,PHP0组支架表面即生成稀疏的条状矿化物,PHP10组支架表面的条状矿化物较PHP0组更为致密,并且可见明显的PEG水解后留下的裂痕和孔道,相比之下,PHP20和PHP30组支架表面仅有少量的矿化物沉积,而有更多的次级微孔道形成,推测可能是由于PEG的水解影响了SBF中钙磷离子在支架表面的沉积;SBF浸泡第3天时,PHP0组支架表面生成致密的条状矿化物,条带之间仅留有少量的缝隙;PHP10组支架表面生成一层较厚的矿化物,并几乎将次级微孔覆盖,PHP20和PHP30组支架表面的次级微孔较之前增大,放大图中明显可见相对于支架平整的表面,矿化物主要沉积在支架的次级微孔中;SBF浸泡第7天时,所有组支架的表面均与之前发生较大的变化,PHP0和PHP10组支架表面形貌类似,均生成了小颗粒状矿化物,但PHP10组支架表面的小颗粒更为致密,几乎覆盖支架的全部,PHP20组支架表面则生成了疏松的微米级矿化物小球,高倍镜下可见该小球是由大小、形貌均匀一致的矿化纤维或团聚或分散组成的,此时,PHP30组支架形成了与PHP20支架表面相似、但更厚的一层矿化物,低倍镜下可见支架表面出现裂痕和凹坑;SBF浸泡第14天的PHP0组支架表面与浸泡7天的PHP10组支架类似,表面生成了一层厚厚的颗粒状矿化物,而PHP10组支架表面的矿化物继续沉积,将之前的颗粒状表面覆盖,形成较为光滑、致密的表面结构,PHP20组支架表面的矿化物小球继续增大,并且较第7天时表面变的更为致密,相比之下,PHP30组支架可见比较明显的支架降解,这与前述PHP30组支架的降解速度最快的结论相一致,并且在降解过的支架表面仍可见大量的磷灰石沉淀,由图11a~11c、图12a~12c和图13a~13c可知,支架中所含的PEG水解时为支架产生了大量的次级微孔结构,推测模拟体液中的钙磷离子通过微孔到达支架的内部并同时发生磷灰石矿化物的沉积,表明由于PEG的加入,支架的降解速度和成骨速度均得到加快,有利于缩短骨缺损的修复时间。
PCL/nHA复合支架材料已被证实具有良好的生物相容性,为了验证加入PEG后的复合材料的生物安全性,制备了各组支架材料的浸提液并将其与MC3T3-E1细胞共培养进行CCK-8和活死染色检测,如图21、图22、图23a~23c、图24a~24c、图25a~25c和图26a~26c所示,各组支架浸提液培养的细胞随着时间的延长均发生增殖,根据吸光度值计算出细胞存活率均大于70%,根据ISO10993-5标准可认为所有组支架材料均无明显细胞毒性;细胞活死染色结果同样证明,各组支架浸提液培养的细胞随着时间的延长增殖明显,第5天时视野中几乎全部被细胞占据,并且以活细胞为主(白色光点)而仅有少量死亡细胞(标识部分),表明添加PEG后的复合材料支架没有明显的细胞毒性,具备体内应用的基本条件。
在实际应用中,还可以将PCL替换为PLGA,PLA,PLLA等具有良好生物相容性、热塑性、易降解的其他生物高分子材料;将nHA替换为TCP、BCP、BG等生物陶瓷类材料。
本发明设计开发的一种3D打印仿生复合多孔支架的制备方法,对现有FDM支架的结构进行改良,PEG作为亲水性改良成分和造孔剂几乎可以运用到任何FDM制备的支架中,制备具有仿生多级孔道结构的骨组织工程支架材料,通过调整材料组成间接解决FDM支架表面过于光滑的技术通病;并且PEG无毒无害,其良好的亲水性和水解能力可以用于改良热塑性聚合物表面疏水的问题,提高了支架的亲水性、粗糙度、比表面积和降解速度,使得支架的降解与成骨速度相匹配。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的实施例。
- 载药型仿生骨修复多孔支架的制备方法及其产品和应用
- 一种基于光固化3D打印技术成型的多孔骨羟基磷灰石陶瓷细胞支架的方法
- 一种3D打印多孔仿生膝关节软骨支架的制备方法
- 一种具有仿生三维微支架的3D打印多孔金属及其制备方法
