一种基于SERS技术的快速检测评估器官移植供肾质量的新方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及医工结合交叉学科领域,具体地说,是关于一种基于SERS技术的快速检测评估器官移植供肾质量的新方法。
背景技术
国内外移植领域迫切需要能准确、及时评估供肾的方法我国自2010年实施公民逝世后器官捐献以来,公民逝世后器官捐献(deceased donor,DD)已经成为我国器官移植中最重要的器官捐献来源。这类供者多半经历较长的热缺血时间,导致器官出现缺血再灌注损伤;供者年龄相对较大,易合并因高龄所致的器官退行性变化;供者住ICU时间长,易出现院内感染;供者血压不稳定,应用升压药物后易造成药物性肾损伤;上述因素均可能严重影响DD供肾质量,继而导致移植肾功能延迟恢复(delayed graft function,DGF)的发生率高、术后移植肾失功以及医疗成本大幅增加。因此,必须对供肾进行系统、准确、科学的评估,以减少术后DGF的发生率、降低术后医疗成本及提高移植肾存活率。因此我们迫切需要寻找一种更加快捷、精确、安全的评估供肾质量的方法。
而目前国内外移植领域的专家均在积极研究,是否可从供者体液中找到一些生物标志物,从而可以更准确、及时评估供肾质量以及预测移植肾的预期存活时间。通过筛选供者捐献前血清,与受者预后结果核对,目前发现了多个与供肾质量相关的生物标志物,并在英国国家生物样本库中,成立了一个供肾质量评估的生物学研究平台,KaisarM等人结合病理学穿刺结果、无标记定量质谱法(Label-Free Quantitation mass spectrometry,LFQ)分析蛋白丰度和患者预后结果,认为生物标志物可以作为供肾质量的预测指标。然而,这些蛋白的表达水平随着供者的病情进展极易发生变化。利用LFQ质谱法检测蛋白耗费时间约90分钟,比快速石蜡切片(2-3小时)快,但比冷冻切片(约40分钟)慢,因此临床上利用LFQ质谱法检测生物标志物,对移植中心提出了更高的辅助科室要求,而且会延长供肾的冷缺血时间。因此除了找到更准确的生物标志物,更需要有更好的检测手段,否则将严重限制其在临床中的实践。
近年来影像学技术取得了长足的进步,在临床实践中的应用前景广阔,尤其最近随着分子影像学的发展,也有了越来越多的选择。表面增强拉曼散射(surface enhancedRaman scattering,SERS)是指吸附在粗糙金属纳米结构表面的分子,在激光照射下其拉曼光谱信号显著增强的一种异常表面光学现象。利用金属纳米粒子的局域表面等离激元共振(LSPR)增强场,SERS可以将生化分子的拉曼散射信号增强到1014倍,从而大大增强其灵敏度,因而在核酸/蛋白检测生物成像等领域具有显著的优势。根据是否标记拉曼分子,SERS技术可分为标记和非标记两种:标记SERS技术由于拉曼分子的散射截面较大,检测信号强,灵敏度高,已被广泛用于生物体系,特别是活细胞体系的研究中;非标记SERS技术则直接获取待分析物的本征光谱信息,优势在于其丰富的SERS特征峰与待测物分子结构、取向等密切相关,能更全面可靠地反映待分析物的特性。
综上,我们可以发现,只有检测技术效果明确、快捷,才能应用于快速评估供肾质量,真正为临床服务。本发明拟先探究相关生物标志蛋白在血清或者尿液中的SERS光谱特性和成像效果;在器官获取之前,利用SERS光谱技术快速检测供者血清、尿液中的相关生物标志蛋白水平,探究其在标准供者和边缘供者中分布的差异及动态变化;结合移植肾的预后,研究生物标志物与预后的关系,建立利用SERS技术快速评估供肾质量的体系;结合供肾修复技术,在修复过程中检测保存液/灌洗液中生物标志蛋白,从而监测肾脏修复的效果。
而目前如本发明快速检测评估器官移植供肾质量的方法还未见报道。
发明内容
本发明的第一个目的是,针对现有技术中的不足,提供一种速检测评估器官移植供肾质量的方法。
本发明的第二个目的是,提供一种快速评估供肾质量的体系。
为实现上述第一个目的,本发明采取的技术方案是:
一种基于SERS技术的快速检测评估器官移植供肾质量的新方法,包括如下步骤:
a)相关生物标志物在供者体液中的SERS光谱特性和成像效果;
b)分别检测不同供肾质量组的供者体液的相关生物标志物水平;
c)分析检测结果和预后之间的关系;
d)动态监测供肾质量
更优选地,所述的相关标志物在供者体液中的SERS检测和成像方法包括以下步骤:
a1)明确与供肾质量评估相关的蛋白;
a2)体外分离/合成相关蛋白,探究激光波长、激发功率、积分时间下SERS检测结果的影响规律;
a3)优化检测各蛋白的检测方法,并且获得其SERS光谱特性,作为定标。
更优选地,所述步骤a)中的相关蛋白包括:SLPI、IL-18、CH3L1,L-FABP。
更优选地,相关生物标志物水平是分别使用SERS光谱技术和无标记定量质谱法检测三个组中血清、尿液中相关蛋白,比较两种检测方案的敏感性、特异性、检测时间、成本效益以及可行性。
更优选地,分析检测结果和预后之间的关系是通过观察这些生物标志物在标准供者和边缘供者中分布的差异,回归分析相关独立危险因素,从而明确各生物标志物在供肾质量评估时的预测价值。
更优选地,所述的步骤d)中动态监测供肾质量是在修复过程中利用SERS技术监测保存液/灌洗液中生物标志蛋白的动态变化,从而监测肾脏修复的效果。
为实现上述第二个目的,本发明采取的技术方案是:
如上任一所述的方法组成的快速评估供肾质量的体系,所述的评估供肾质量是通过SERS技术光谱技术分别监测活体供者以及DD供者(包括SCD和ECD)不同时间点血清中生物标志物的动态变化。
本发明优点在于:
1、以“缺乏有效可靠快速评估供肾质量的方法”这一临床需求作为切入点,以灵敏度高、特异性强、检测速度快的SERS光谱技术为工具,为快速评估供肾质量方案带来新的思路和手段,可行性强,具有深远的临床研究意义。
2、利用相关生物标志蛋、白的SERS特征峰信号,检测其在血清、尿液中的表达水平,从分子水平提示供肾质量;检测时间从传统的数小时缩短至数分钟内,利于迅速判断供肾质量以及其功能变化;SERS检测技术特异性更高,对蛋白等大分子物质的检测具有“指纹”图谱效应,排除其他大分子的干扰。通过该新方法的提出,可以精确、特异且迅速地检测评估供肾质量。
附图说明
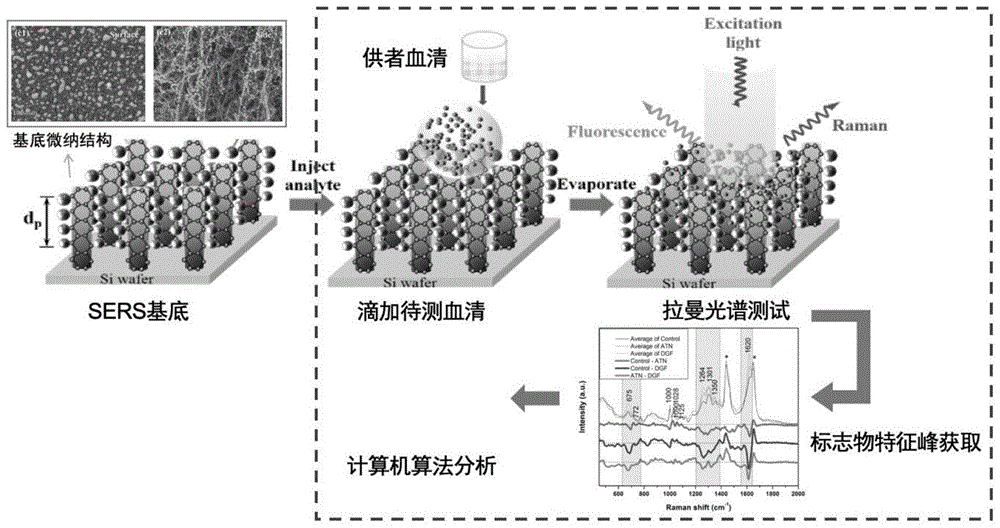
附图1为本发明方法的结构示意图。
附图2为本发明的技术流程图。
附图3为使用BP/Au纳米杂交种检测生物标志物SLPI和IL-18的SERS示意图((虚线表示在1000cm处的特征条带
附图4为:(a)为Au NPs、BP纳米片、BP/Au纳米杂化物的紫外-可见吸收光谱;AuNPs(左)和BP/Au纳米杂化体(右)的照片;(b)用DLS(0,24h)测定BP/Au纳米杂化体的流体动力尺寸分布;(c)AuNPs的TEM图像。(d)BP纳米片的TEM图像;(e-f)不同放大倍数下的BP/Au纳米杂化物的透射电镜图像。
附图5为:(a)浓度为10
附图6为利用有限时域差分法对(a)BP/Au纳米杂化体和(b)孤立材料的电磁场分布进行了数值模拟。(激发波长:638nm,网格设置:1nm,边界条件:PML,BP纳米片厚度:5nm,金纳米颗粒与BP纳米片的关系:切线)。
附图7为验证BP/Au纳米杂化体的均匀性和可重复性。(a)80R6G的SERS谱浓度为10
附图8为:(a)在缓冲液中进行SLPI检测(SERS光谱具有浓度依赖性,SLPI的浓度范围为2~2×10
附图9为:(a)在含10%胎牛血清的缓冲溶液中,检测不同浓度的SLPI的SERS光谱,具有浓度依赖性(SLPI的浓度范围为2~2×10
附图10为混合生物标志物样本A、B和C的平均SERS光谱。
附图11为AKI生物标志物的SERS检测示意图。
附图12为(a)UV–vis吸收光谱。(b)金胶体的粒径分布。(c,d)Au@AgNPs和GO/Au@AgNPs的TEM图像。
附图13为在GO/Au@AgNPs和Au@Ag NPs下的10
附图14为(a)测绘结果中所有像素的SERS光谱。(b)在1654cm
附图15为8个浓度的CH3L1(a)和L-FABP(b)标准溶液的SERS光谱。
附图16为CH3L1标准溶液的线性关系。在997cm
附图17为L-FABP标准溶液的线性关系。在1161cm
附图18为8个浓度的CH3L1(a)和L-FABP(b)血清样本中的SERS光谱。
附图19为CH3L1血清样本的线性关系。在997cm
附图20为L-FABP血清样本的线性关系。在1161cm
附图21为混合血清样本的平均SERS光谱(左一阴影:CH3L1在997cm
具体实施方式
本发明基于SERS光谱技术检测生物大分子的高敏感性和高特异性,探究相关生物标志物在体液中的SERS光谱特性和成像效果;在器官获取之前,利用SERS光谱技术快速检测供者体液的相关生物标志物水平,探究其在标准供者和边缘供者中分布的差异及动态变化;结合移植肾的预后,研究生物标志物与预后的关系,建立利用SERS技术快速评估供肾质量的体系;结合供肾修复技术,在修复过程中检测保存液/灌洗液中生物标志蛋白,从而监测肾脏修复的效果。本发明的实验内容和实验技术路线图参考附图1和附图2。
下面结合具体实施方式,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1基于BP/Au纳米杂化物的SERS方法检测SLPI和IL-18
1实验器材
1.1材料
SLPI和IL-18由长海医院提供,并由武汉塞维利亚生物技术有限公司进行纯度分析(>85%)。
1.2仪器
紫外-可见吸收光谱用Evolution 350UV-vis(Thermo Scientific,中国)记录。采用JEM-2100F(JEOL,日本)高分辨透射电子显微镜在200kV加速电压下对制备的BP/Au纳米杂化体的表面形貌和尺寸进行了表征。通过动态光散射实验(Zetasizer,Nano-ZS90,莫尔文,英国)测量了尺寸分布。SERS光谱由显微镜拉曼光谱仪(XploRAPLUS,HORIBA)记录,入射激光波长为638nm和10倍物镜。
2、实验步骤
2.1相关生物标志物在供者体液中的SERS光谱特性和成像效果
通过检索文献,明确与供肾质量评估相关的蛋白(CH3L1,SLPI、IL-18、CH3L1,L-FABP),体外分离/合成相关蛋白,探究不同检测条件(改变激光波长、激发功率、积分时间)下SERS检测结果的影响规律,优化检测各蛋白的检测方法,并且获得其SERS光谱特性,作为定标。
2.2分别检测不同供肾质量组的供者体液的相关生物标志物水平
2.2.1根据供肾质量分组回顾性分析我中心既往650例接受肾移植的受者数据
按照供肾质量和获取方式分为:活体供肾组(living donor,LD),标准供肾组(standard criteria donor,SCD)和边缘供肾组(expanded criteria donor,ECD)。入组要求:a样本库中标本未遗失;b主要以eGFR是否升高作为判断进入ECD组;c来自同一供者的两个肾脏,如果同时发生DGF才可纳入ECD组;d如果供肾eGFR良好,但均发生DGF,不能纳入ECD组;e如果明确因为受者因素导致发生DGF,但术后eGFR正常,可纳入SCD组。根据分组情况,联系样本库,得到相应的供者血清和尿液标本。
2.2.2检测不同组间生物标志物水平
分别使用SERS光谱技术和无标记定量质谱法检测三个组中血清、尿液中相关蛋白,比较两种检测方案的敏感性、特异性、检测时间、成本效益以及可行性。
2.3分析检测结果和预后之间的关系
通过检测,结合移植肾的预后,观察这些生物标志物在标准供者和边缘供者中分布的差异,回归分析相关独立危险因素,进一步明确在SERS光谱技术检测条件下,各生物标志物在供肾质量评估时的预测价值,建立利用SERS技术快速评估供肾质量的体系。
3、实验方法
3.1SERS底物的合成
3.1.1金纳米粒子(Au nanoparticles,Au NPs)的合成
将20mL去离子水加入锥形瓶中,连续搅拌加热沸腾。然后,600μL的1%HAuCl4依次加入1.2mL 1%柠檬酸三钠溶液,搅拌后保持煮沸18min。然后停止加热,不断搅拌混合物,直到冷却到室温。所获得的样品在冰箱中保存(4℃)。
3.1.2黑磷/金(BP/Au)纳米杂化物的合成
采用原位还原法合成BP/金纳米杂化体。600μL的HAuCl4(1wt%)加入到20mL的沸水,首先将80μL的4mg/mLBP纳米片溶液超声振荡5min,然后每3秒逐滴加入一次。然后加入1.2mL柠檬酸三钠溶液(1wt%),搅拌2h。最后,通过9000rpm离心20min得到产物。所得产物分散在去离子水中,在黑暗中保存在4℃。
3.2基于SERS的检测
将5μL不同浓度的SLPI和IL-18溶液加入到5μL的BP/Au纳米杂化物中。在638nm的激发下获得了SERS光谱。对于每个样本,测量来自10个随机位置的SERS光谱,以得到平均光谱。
4数据分析
SERS光谱是由显微拉曼光谱仪(LabRAM XploraPlus,HORIBA Scientific,法国)在638nm激发下收集的。用10倍物镜采集样品中的散射光。所有光谱均记录在400-1800cm
使用软件LabSpec6对获得的拉曼和SERS光谱进行了平滑、去噪和基线校正处理。对优化后的SERS光谱进行分析,分析其特征峰强度与分析物浓度之间的相关性。AKI生物标志物CH3L1和L-FABP的拉曼特征峰强度的对数与样品中CH3L1和L-FABP浓度的对数建立线性关系。当样品的浓度范围较大时,通常采用峰值强度对数(log I)与样品浓度对数(logC)之间的线性关系。平均强度是通过8次重复测量得到的均值。线性关系用R2进行评估,并对血清样本中CH3L1和L-FABP进行检测以验证所建立的线性校准模型的预测精度。检测极限(LOD)的计算定义为矩阵空白(S/N=3)产生的仪器背景信号值的3倍。
5实验结果
5.1Au NPs和BP/Au纳米杂化物的特征
Au NPs是根据上述方法制备的,然后进行吸收和透射电子显微镜(TEM)测量。如附图4所示。(a)中,在AuNPs的吸收光谱中有一个明显的吸收带在520nm处达到峰值,这来源于Au NPs的表面等离子体共振(surface plasmon resonance,SPR)。图4(c)中的透射电镜图像结果表明,AuNPs为球形单分散,平均尺寸为27nm。采用原位还原法合成BP/Au纳米杂化物,其中BP纳米片作为载体材料,而HAuCl4作为Au的前驱体和柠檬酸钠作为还原剂。图4(a)显示,纯BP纳米片没有明显的吸附带,而BP/Au纳米杂化物在545nm处有明显的SPR带,这与负载有关将AuNPs放在BP纳米片上。与AuNPs相比,纳米杂化体的SPR带表现出明显的红移和展宽。这说明BP纳米片上的AuNPs相互轻微堆积,有利于产生多个热点,从而提高了生物传感的SERS灵敏度。透射电镜图像进一步证实了BP/Au纳米杂化体的构建。BP纳米片具有典型的片状结构,横向尺寸为600nm
5.2BP/Au纳米杂化体的SERS性能
利用R6G做拉曼检测BP/Au纳米杂化体的SERS性能。首先,利用638nm和785nm的激光,得到R6G(10
如附图6所示,与Au NPs相比,BP/Au纳米杂化物通过粒子间等离子体耦合,在AuNPs之间的纳米尺度间隙提供了更强的电场。由于许多Au NPs被密集地沉积在BP纳米片上,因此产生了高密度的热点,并相应地提高了未来分析的灵敏度。
然后验证SERS信号的均匀性和可重复性。附图7(a)显示了从一个单一样本上随机选择的位置检测到的80个光谱,附图7(b)是从这80个光谱中收集到SERS码,可见SERS信号是相当一致的。附图7(c)绘制了特征SERS波段在1512cm
为了验证可重复性,在相同的实验条件下制备了5批底物,并在这些底物上收集了50个SERS光谱如图7(d)。在1512cm
5.3SLPI和IL-18的检测结果
用所制备的BP/Au纳米杂化物检测SLPI和IL-18。SLPI和IL-18溶液的浓度范围为2~2×10
表1.生物标志物溶液中的拉曼特征峰
为了定量分析SLPI,在1000cm
表2.生物标志物SLPI和IL-18的SERS检测的线性关系
5.4在真实样本中SLPI和IL-18的检测结果
将不同浓度的SLPI和IL-18混合在胎牛血清(10%FBS)中,然后分别暴露于BP/Au纳米杂化物。附图10(a)为SLPI检测的浓度依赖性校准曲线。可以看出,在1000cm
综上,利用BP/Au纳米杂化物可以同时定量检测SLPI和IL-18。
实施例2基于GO/Au@Ag NPs的SERS方法检测CH3L1和L-FABP
1实验器材
1.1材料
CH3L1(2mg/mL)和L-FABP(1.2mg/mL)由长海医院提供,并由武汉塞维利亚生物技术有限公司进行纯度分析(>85%)。
1.2仪器
同实施例1
2、实验步骤与方法
2.1氧化石墨烯/金和银核壳纳米颗粒(GO/Au@Ag NPs)的合成
Au-Ag核壳纳米结构(Au@Ag NPs)的制备可分为2个步骤。首先,用柠檬酸二水钠介导还原HAuCl4·3H2O制备AuNPs。将306μL HAuCl4·4H2O(10%w/w)溶解在99.694mL的去离子水中,加热至沸腾。然后,在沸腾的混合物中加入10ml二水柠檬酸钠(1%w/w)。继续加热15分钟直到变为酒红色,冷却至室温。然后通过D(+)-葡萄糖还原硝酸银,使Ag覆盖在AuNPs表面。将6mL金NPs以9500r/min的速度离心35min。去除上清液,沉淀物再稀释回6mL,加入54mL去离子水,搅拌加热至60℃。将500μL的0.08MD(+)葡萄糖溶液和140μL的0.1MAgNO3加入溶液,再加入200μL的1M氢氧化钠溶液。加热30分钟,直到溶液变成橙黄色,冷却到室温,在黑暗中保存一周,以供后用。
然后将10mL氧化石墨烯水溶液(0.01mg/mL)加入30mlAu@AgNPs胶体中,超声3分钟,连续搅拌2小时至完全混合。
2.2CH3L1和L-FABP标准溶液制备及SERS检测
制备CH3L1和L-FABP标准溶液用于SERS测定。根据以往的研究,在健康人群中,当尿液CH3L1值低于0.2ng/mL时,通常无法检测到,所以一般采用5ng/mL作为基线。L-FABP的基线一般为10.1ng/mL,急性肾损伤患者的生物标志物浓度通常高于基线水平。
CH3L1和L-FABP的初始浓度分别为2mg/mL和1.2mg/mL,然后用Tris-HCL稀释,得到浓度为2×10
2.3真实样品预处理及SERS检测
先用Tris-HCL(稀释度为1:9)稀释胎牛血清(FBS),然后分别加入不同浓度的CH3L1和L-FABP。CH3L1血清样品的浓度为2×10
血清样本的SERS检测方法参考前述(图11)。每个光谱同样是通过8个随机位置测量的光谱平均获得。
3数据采集和分析
SERS光谱是由显微拉曼光谱仪(LabRAM XploraPlus,HORIBA Scientific,法国)在638nm激发下收集的。用10倍物镜采集样品中的散射光。所有光谱均记录在400-1800cm
使用软件LabSpec6对获得的拉曼和SERS光谱进行了平滑、去噪和基线校正处理。对优化后的SERS光谱进行分析,分析其特征峰强度与分析物浓度之间的相关性。AKI生物标志物CH3L1和L-FABP的拉曼特征峰强度的对数与样品中CH3L1和L-FABP浓度的对数建立线性关系。当样品的浓度范围较大时,通常采用峰值强度对数(log I)与样品浓度对数(logC)之间的线性关系。平均强度是通过8次重复测量得到的均值。线性关系用R
为了验证SERS信号的可重复性,将10
4结果与讨论
4.1GO/Au@AgNPs的表征
GO/Au@Ag NPs制备完成后,用紫外-可见光(UV-Vis)光谱仪、透射电镜和动态光散射进行检测。GO/Au@Ag NPs采用Evolution 350UV-Vis检测(Thermo Scientific,中国)。如图12a所示,在411nm处有一个峰,在520nm处对应银壳和金核,与Ag和Au的UV-VIS吸收峰一致。通过动态光散射实验(Zetasizer,Nano-ZS90,Malvern,英国)得到其尺寸分布。图12b显示,GO/Au@Ag NPs的粒径比较均匀。采用JEM-2100F(JEOL,日本)高分辨率透射电子显微镜(TEM),在200kV的加速电压下,对GO/Au@Ag纳米颗粒的表面形貌和尺寸进行了观察。根据图12中的TEM图像,GO/Au@Ag NPs的平均粒径为24nm。核壳结构如图12c所示。如图12d所示,纳米颗粒均匀地分布在氧化石墨烯上。结果表明,GO/Au@AgNPs均匀一致。
比较GO/Au@Ag杂合体和Au@Ag复合纳米颗粒的SERS性能。根据金纳米粒子的吸光度,将2种杂合体的金含量调整为相同。然后分别用GO/Au@Ag纳米颗粒和Au@Ag纳米颗粒作为SERS底物,检测10
此外,为了验证GO/Au@Ag NPs在SERS中的稳定性,我们测绘了10
4.2CH3L1和L-FABP标准溶液的SERS测量和分析
如图15所示,SERS测量标准样品、CH3L1(2×10
在CH3L1和L-FABP标准样品中,可以清晰观察到CH3L1在997cm
表3.CH3L1和L-FABP的SERS谱峰的分布
有几个特征峰可能用于定量分析。对于CH3L1,强度在997cm
表4.在997、1161、1254和1321cm
为了量化CH3L1和L-FABP,分别提取νs(C─C)和苯丙氨酸在997cm
4.3血清样本中CH3L1、L-FABP的SERS测定及分析
为了确定SERS方法可用于真实复杂环境中CH3L1和L-FABP的测定,在胎牛血清(FBS)溶液中检测这2种生物标志物。血清样品的SERS光谱与CH3L1和L-FABP标准溶液有相似的变化趋势(图18)。与标准溶液中相似,分别在特征峰997和1161cm
在CH3L1的特征峰值997cm-1处,SERS光谱强度与浓度呈良好的线性关系,从2×10
表5.在997、1161、1254和1321cm
血清样品的结果与标准样品一致,血清样品中CH3L1和L-FABP的最低测定浓度分别为2×10
为了进一步评价该方案在真实样本中的应用,我们对一组新的CH3L1血清样本和L-FABP血清样本进行了验证实验。检测997和1161cm
表6血清中CH3L1、L-FABP的测定
4.4同时检测CH3L1和L-FABP
三种血清浓度的样品(混合样品浓度为10
综上,基于GO/Au@AgNPs的SERS方法是一种可靠的超灵敏的生物标志物检测方法,可用于检测极低浓度的CH3L1和L-FABP,在真实复杂的生物环境中具有可行性。整个检测流程方便、省时、经济,金基和银基底物也具有良好的生物相容性,因此该方法在各种医学和生物技术应用中有广阔的前景。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
- 一种基于SERS技术的微量乙酰胆碱酯酶快速检测方法
- 一种基于表面增强拉曼光谱SERS技术的柑橘中苯咪唑类农药残留快速检测方法及系统
