一种微流控芯片及其使用方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及细胞分选领域,特别是涉及一种微流控芯片及其使用方法。
背景技术
细胞分离领域中,基于不同细胞之间各种理化差异完成细胞分离的微流控芯片得到了广泛地应用。其中基于细胞尺寸和密度等物理特性的无标记分选技术,因为可以兼顾更多的下游应用而备受关注。在众多无标记微流控分选技术中,确定性侧向位移技术因具有类似滤网过滤的结构和性能,与惯性力、声场力等其他技术相比有着更高的分离回收率和分离纯度。同时可通过调节分离的压力或流量,控制细胞形变情况,尤其适合用在需要结合刚性和核质比差异的细胞分离场景。
当前的侧向位移微流控芯片技术中,通过将微流控芯片结构特征尺寸与细胞相匹配,具有高精度、高通量、低成本的优势,但是分选纯度依然有待提高,且在当前的侧向位移微流控芯片中,细胞分选所用的侧向位移微柱阵列均通过匹配固定的分选压力或分选流量,设置出固定但存在波动区间的临界分离尺寸(目标样本尺寸)。当样本差异较大或细胞分选需求出现变化时,会直接导致芯片的分选性能下降或丧失,大大限制了侧向位移技术在细胞分离领域的应用。
发明内容
基于此,提供一种微流控芯片及其使用方法,提高微流控芯片在细胞分选过程中的分选精度。
一种微流控芯片,包括:入口区,所述入口区形成有样本溶液通道与缓冲液通道;分选区,所述分选区与所述入口区连接,所述分选区形成分选通道,所述分选通道与所述样本溶液通道和所述缓冲液通道连通,所述分选通道上设有第一微柱阵列和第二微柱阵列,所述第一微柱阵列和所述第二微柱阵列分别由微柱阵列分布形成,所述第一微柱阵列朝向靠近所述分选通道的中心线方向倾斜,所述第二微柱阵列朝向远离所述分选通道的中心线方向倾斜,所述第一微柱阵列位于所述分选通道的溶液入口端与溶液出口端;出口区,所述出口区与所述分选区连接,所述出口区上形成第一出口通道和第二出口通道,所述第一出口通道位于所述第二出口通道的内侧,所述第一出口通道和所述第二出口通道与所述分选通道连通。
本申请公开一种微流控芯片,待测样本溶液与缓冲液通过入口区进入微流控芯片中,其形成的样本溶液通道与缓冲液通道分别将待测样本溶液与缓冲液共同流向分选区,分选区上设有分选通道,分选通道上包括倾斜设置微柱阵列,其中第一微柱阵列朝向分选通道的中心线方向倾斜,样本溶液进入分选通道后,小尺寸的细胞通过第一微柱阵列其流动方向不变,继续沿着液体流动的方向整体呈水平方向迁移,而大细胞则沿着第一微柱阵列的倾斜方向进行侧移,即大细胞向分选通道的中心方向汇集,而小细胞则沿着远离分选通道的中心方向继续流动;此时,通过第一微柱阵列进行富集后的样本溶液流入第二微柱阵列时,大细胞沿着第二微柱阵列的倾斜方向进行运动,即大细胞向远离分选通道的中心方向流动并大部分汇集至分选通道的侧壁上,随后再进入第一微柱阵列,经过上一级的第二微柱阵列从而富集在分选通道侧壁上的大细胞又沿着分选通道的中心方向汇集,第二微柱阵列位于分选区的末端,经过上述分选区富集后的大细胞经过循环分选富集后通过连接的第一出口通道流至大细胞收集端,而其余溶液则通过第二出口通道流出小细胞收集端,从而能获得更高纯度的目标细胞收集液,提高微流控芯片的分选精度,为工作人员节省更多的纯化工作流程和时间,进一步提高了使用微流控芯片对目标细胞的精确提纯。
在其中一个实施例中,所述第一微柱阵列和所述第二微柱阵列的数量有多个,所述第二微柱阵列位于两个所述第一微柱阵列之间。通过设有多个第一微柱阵列和第二微柱阵列,分选通道通过组合排列第一微柱阵列和第二微柱阵列,且至少包括一组第一微柱阵列与第二微柱阵列交错设置的结构,进一步地,该第一微柱阵列与第二微柱阵列的交错结构可以设置多组,以达到不断对上一级分选通道中的样本溶液进一步富集目标细胞,从而提高第一出口通道的目标细胞含量。
在其中一个实施例中,所述第一微柱阵列与所述分选通道的中心线方向形成第一偏移角度,所述第一偏移角度的范围为0.5~12.5°。
在其中一个实施例中,所述第二微柱阵列与所述分选通道的中心线方向形成第二偏移角度,所述第二偏移角度的范围为0.5~12.5°。
前述的偏移角度范围是指第一微柱阵列和第二微柱阵列分别与分选通道的中心线之间的偏移角度范围,通过设定优选的偏移角度范围,使得微流控芯片的分选通道长度以及第一微柱阵列和第二微柱阵列的循环结构更加合理,进一步提高分选效率和分选精度。
在其中一个实施例中,所述第一微柱阵列和/或第二微柱阵列沿流道方向相邻分布的所述微柱之间的距离范围为6~25微米。流道方向是指样本细胞进入分选通道后的液体流动方向,该流道方向沿上述的分选通道的中心线朝向液体出口端,在该方向上相邻设置的微柱之间的距离范围为6~25微米。
在其中一个实施例中,所述第一微柱阵列和/或第二微柱阵列垂直于流道方向相邻分布的所述微柱之间的距离范围为10~60微米。流道方向是指样本细胞进入分选通道后的液体流动方向,该流道方向沿上述的分选通道的中心线朝向液体出口端,垂直于流道方向相邻分布的微柱之间的距离范围为10~60微米。
在其中一个实施例中,所述第一微柱阵列和/或第二微柱阵列垂直于流道方向的高度范围为5~50微米。第一微柱阵列与第二微柱阵列在垂直于流道方向上的高度范围为5~50微米。上述尺寸的设计使得微流控芯片具有结构紧凑、分选精度高和重现性好的优点。
在其中一个实施例中,所述微柱的截面形状为圆形、椭圆形、三角形、矩形、梯形、菱形、L形、C形和T形中的其中一种。
在其中一个实施例中,所述分选通道垂直于流体方向的高度能够随不同的分选压力变化。入口区的待测样本溶液与缓冲液进入分选区后在其分选通道上进行流动,对于能产生形变的细胞而言,在液体加压进入分选通道的情况下,其细胞发生形变,从而使得分选通道的高度也即进入分选区上形成液体通道的高度会产生变化,所以针对能产生形变的细胞样本则可以通过改变分选压力进而调整分选区的实际临界分离尺寸,与现有的侧向位移技术中的微柱阵列均通过匹配固定的分选压力或分选流量来设置出固定的临界分离尺寸,从而导致当样本差异较大或细胞分选需求出现变化时,微流控芯片的分选性能下降或丧失,本微流控芯片通过改变调节分选压力改变临界分离尺寸并增加芯片复用,相比现有同类技术有着更高的分辨率和准确度,方便工作者在后期通过建立分选数据库和芯片复用。
在其中一个实施例中,所述分选通道垂直于流体方向的高度范围为15~60微米。分选通道也即分选区上形成液体通道,其垂直于流体方向的高度比第一微柱阵列和第二微柱阵列的垂直于流体方向的高度大,高度范围值为15~60微米。
在其中一个实施例中,所述分选区包括缓冲液流道区、循环分选区和小细胞流道区,所述缓冲液流道区上形成缓冲液补给通道,所述缓冲液补给通道与所述入口区的缓冲液通道连通,所述缓冲液流道区位于所述循环分选区的内侧,所述循环分选区与所述样本溶液通道和所述缓冲液通道连通,所述循环分选区形成所述分选通道,所述第一微柱阵列和第二微柱阵列位于所述循环分选区上,所述小细胞流道区形成小细胞通道,所述小细胞通道与所述分选通道连通。缓冲液流道区在分选通道的内部中心处,循环分选区上形成分选通道,小细胞流道区上形成的小细胞通道位于循环分选区的外侧,在流体流经循环分选区上的第一微柱阵列与第二微柱阵列进行细胞分选后,目标收集的细胞大部分沿分选通道继续向前流动,而小细胞则大部分沿外侧的小细胞流道区继续向前流动,从而实现细胞分选的工作。
在其中一个实施例中,所述循环分选区包括第一收敛区、发散区和第一分隔部,所述第一收敛区和发散区分别设有所述第一微柱阵列和所述第二微柱阵列,所述第一收敛区与所述入口区相邻,所述发散区位于所述第一收敛区的液体出口端,所述小细胞流道区位于所述发散区的外侧,所述第一分隔部设置在所述发散区和所述小细胞流道区之间,所述小细胞通道与所述第一收敛区连通。通过在循环分选区的溶液入口端上设有第一收敛区,第一收敛区上设有第一微柱阵列,使得样本溶液中的大细胞先沿朝向中心处的缓冲液流道区方向富集,经第一收敛区后的样本溶液流入发散区,此时细胞浓度高的样本溶液进入位于发散区外侧的小细胞流道区,而经过富集的含有较多大细胞的样本溶液进入发散区,使得样本溶液完成一次提纯。经过上述提纯的样本溶液流经发散区上设有的第二微柱阵列,并沿着远离流道方向进行运动至第一分隔部处,进一步地,大细胞与第一分隔部的侧壁之间发生弹性碰撞,不会对大细胞造成损伤,使得收集的目标细胞溶液中其细胞结构完整、活性高,便于进行下一步的使用和研究。上述过程中,将第一次提纯获得的样本溶液中的大细胞大部分又再集中在第一分隔部的侧壁上,然后在发散区的出口处沿着靠近流道方向进行运动至下一第一收敛区上,样本溶液中的细胞得到进一步提纯,从而减少小细胞通道中的目标分选大细胞含量。
在其中一个实施例中,所述循环分选区的数量为多个,多个沿着液体流动方向分布的所述循环分选区之间的临界分离尺寸递增,下一级所述循环分选区的临界分离尺寸为上一级循环分选区临界分离尺寸的105%~200%。进一步地,通过设置串联多个循环分选区逐级分离不同尺寸的细胞,使得样本溶液不断进行提纯以获取浓度更高的大细胞。相邻设置的循环分选区之间的尺寸不相同,具体地,下一级循环分选区指位于液体流出方向的循环分选区的尺寸为上一级循环分选区尺寸的105%~200%,沿着流道方向其临界分选尺寸增大,有利于进一步提高大细胞的分选精度和分选纯度,增加了细胞分离的分辨率并降低了流道堵塞风险。
在其中一个实施例中,所述第一收敛区、所述发散区与所述第一分隔部的数量为多个,所述第一收敛区与所述发散区交错设置。循环分选区内的第一收敛区和发散区的数量为多个,多个第一收敛区和发散区之间交错设置,有利于提高分选纯度,进一步提高分选通道中的大细胞含量。
在其中一个实施例中,所述缓冲液流道区与所述小细胞流道区上设有圆柱阵列,所述圆柱阵列的分布方向与液体流动方向相同。通过在第一收敛区和发散区上设有圆柱阵列,且圆柱阵列内的圆柱排布方向与液体流动方向一致,该圆柱阵列用于稳定流道的内的溶液流动。
在其中一个实施例中,还包括引流部,相邻的所述第一收敛区与所述发散区之间具有间隙,所述引流部设置在所述缓冲液流道区的外侧壁和/或所述第一分隔部的内侧壁上,所述引流部位于所述间隙处。优选地,引流部靠近第一收敛区的一侧沿液体流动方向朝远离分选通道的中心线方向倾斜,使得向分选通道的中心线方向汇集的溶液朝向发散区的方向流道,对大细胞起到引流的效果,引流部靠近发散区的一侧沿液体流动方向朝靠近分选通道的中心线方向倾斜。
在其中一个实施例中,还包括末级分选区,所述末级分选区位于所述循环分选区的液体出口端,所述末级分选区上设有所述第一微柱阵列,所述缓冲液流道区位于所述末级分选区的内侧,所述小细胞流道区位于所述末级分选区的外侧,所述分选通道延伸至所述末级分选区。通过设有末级分选区对循环分选区流出的靠近中心线一侧的溶液进行进一步提纯并完成最终的纯化工作。末级分选区的末端与出口区连接,末级分选区位于循环分选区的末端处,分选通道延伸至末级分选区上,而缓冲液流道区至少部分延伸至末级分选区的端部,使得缓冲液流道区上的缓冲液在末级分选区上与分选通道连通。
在其中一个实施例中,所述末级分选区包括第二收敛区和第二分隔部,所述第二收敛区上设有多个所述第一微柱阵列,所述第二分隔部位于所述第二收敛区外侧。末级分选区上设有第二收敛区,第二收敛区上通过循环设置第一微柱阵列,对已经经过循环分选区提纯的溶液进行再次提纯,第二分隔部设置在位于末级分选区上的小细胞流道区与第二收敛区之间,再次将经过循环分选区后的溶液中的小细胞分离出去,末级分选区与出口区的第一出口通道连通,通过第一出口通道获取目标细胞浓度高的溶液。
在其中一个实施例中,所述末级分选区的临界分离尺寸高于所述循环分选区,所述末级分选区的临界分离尺寸为首个循环分选区临界分离尺寸的120%~600%。末级分选区的临界分离尺寸比位于分选通道的首个循环分选区尺寸的要大,有利于进一步提高大细胞的分选精度和分选纯度,并降低了流道堵塞风险。
在其中一个实施例中,所述缓冲液流道区至少贯穿部分所述末级分选区,所述缓冲液流道区的末端位于所述末级分选区上。由于分选通道沿着流道方向不断进行分离提纯,导致末端的分选通道中大细胞含量高、缓冲液含量减少,缓冲液流道区至少部分延伸至末级分选区的端部并与分选通道连通,这样有利于保持末级分选区上的细胞活性。
在其中一个实施例中,所述第一分隔部包括第一分隔部本体和导流端,所述导流端设置在所述第一分隔部本体上,所述导流端位于所述第一收敛区的液体出口端,所述导流端用于引导液体流向小细胞流道区。通过在第一分隔部上设有导流端,其用于引导上一级分选通道外侧的溶液流进小细胞流道区上,而位于靠近分选通道内侧的溶液则继续进入下一级分选通道上,其溶液中的大细胞含量高,大细胞则沿下一级阵列方向进行偏移,按此不断进行循环提纯的过程。
在其中一个实施例中,所述导流端具有一导流弧面,所述导流弧面位于所述导流端的外侧,所述导流弧面朝向远离所述分选通道的中心线方向偏移。导流端的外侧形成向中心线偏移的导流弧面,有利于减少第一微柱阵列与第二微柱阵列连接处之间的流体阻力,达到引流和稳流的效果。进一步地,第二分隔部上具有与第一分隔部的相同结构。
在其中一个实施例中,所述导流端与所述第一分隔部本体的连接处形成弯角。
在其中一个实施例中,所述缓冲液通道包括第一缓冲液通道和第二缓冲液通道,所述入口区包括第一缓冲液入口区、第二缓冲液入口区和样本溶液入口区,所述第一缓冲液入口区形成所述第一缓冲液通道,所述第二缓冲液入口区形成所述第二缓冲液通道,所述第二缓冲液通道位于所述第一缓冲液通道的内侧。通过设有两个缓冲溶液通道,且样本溶液通道设置在第一缓冲液通道与第二缓冲液通道之间,第一缓冲液沿着第一缓冲液通道进入分选区时形成鞘流,有利于起始阶段部分的待分选样本细胞溶液更大程度地流向中间的分选区,从而降低目标样本细胞的损失率,通过在样本溶液通道的内侧设有第二缓冲液通道,第二缓冲液沿着二缓冲液通道进入分选区后,便于样本细胞溶液混合并形成中间的液流,从而保证样本细胞溶液从缓冲液补给通道外侧的具备分选功能的区域进行流动,进一步地,入口区的第一缓冲液通道、第二缓冲液通道以及样本溶液通道分别与分选通道内的液流方向相同,有利于避免样本细胞溶液随缓冲液进入分选区后影响液流方向。该缓冲液与样本溶液的流道设计使得避免待分选的样本细胞溶液在微流控芯片内形成湍流,有利于提高样本细胞溶液通过分选区后的分选效率和分选精度,提高出口区的样本细胞回收率。在其中一个实施例中,所述出口区包括第一出口部和第二出口部,所述第一出口部上形成所述第一出口通道,所述第一出口部与所述分选通道的出液端相邻,所述第二出口部上形成所述第二出口通道。出口区的第一出口部与分选区上的末级分选区连接,用于回收目标收集的大细胞溶液,而第二出口部与小细胞流道区连通,用于回收小细胞含量高的溶液。
在其中一个实施例中,所述样本溶液通道、所述缓冲液通道、所述第一出口通道和所述第二出口通道上分别设有圆柱阵列,所述圆柱阵列的分布方向与液体流动方向相同。通过在入口区和出口区的通道上设有圆柱阵列,且圆柱阵列内的圆柱排布方向与液体流动方向一致,该圆柱阵列用于稳定流道的内的溶液流动。
具体地,所述微流控芯片的微结构可使用热固性或热塑性聚合物、玻璃、硅等材料加工制备,并通过键合、压合、热封接/焊接等工艺形成封闭结构。
本申请的第二个方面公开一种微流控芯片的分离纯化方法,包括下列步骤:S1:使用上述一种微流控芯片,所述入口区与待处理样本溶液和缓冲液连接,待处理样本溶液流经所述样本溶液通道,缓冲液流经所述缓冲液通道,所述出口区与大细胞回收液管和小细胞回收液管连接,所述第一出口通道与所述大细胞回收液管连通,所述第二出口通道与所述小细胞回收液管连通;S2:向待处理样本溶液和缓冲液施加相同的分选压力,所述待处理样本溶液和缓冲液经过所述分选区,目标细胞溶液经过第一出口通道回收至大细胞回收液管,其余溶液经过第二出口通道回收至小细胞回收液管中;S3:待处理样本溶液排空或回收液装满后,中断所述入口区的进液以及出口区的出液,并接触施加待处理样本溶液和缓冲液施加的分选压力。
本申请的第二个方面公开一种通过上述微流控芯片的分离纯化方法,第一缓冲液入口区和第二缓冲液入口区与缓冲液连接,样本溶液入口区与待处理样本连接,第一出口部与大细胞回收液管连接,第二出口部与小细胞回收液管连接;向缓冲液和待处理样本溶液施加相等的分选压力,使缓冲液和样本分别从各自对应的入口流入微流控芯片并完成细胞分选;样本溶液排空或回收液装满后,中断微流控芯片的流入和流出,解除施加给缓冲液和待处理样本溶液的分选压力从而完成分选过程。
在其中一个实施例中,所述分选压力从分选数据库中确定,所述分选数据库的建库步骤包括:
S1:在0.5~2.5Bar区间的不同分选压力条件下,对2~25微米的聚合物颗粒样本进行分选测试,根据测试结果确认微流控芯片的临界分离尺寸;
S2:使用上述确认了临界分离尺寸的微流控芯片,测试不同分选压力下,不同种类细胞样本的分选回收率;
S3:根据上述测试结果,结合微流控芯片及临界分离尺寸、细胞种类和特征、分选压力及对应分选回收率,建立细胞分选数据库。
其中,上述的临界分离尺寸是由设定的分选回收率和测试数据统计而得,且临界分离尺寸包括正向临界分离尺寸和负向临界分离尺寸。进一步地,正向临界分离尺寸是由100%回收率流入第一出口部的样本的最小尺寸数据统计而得。负向临界分离尺寸是由100%回收率流入第二出口部的样本的最小尺寸数据统计而得。
在其中一个实施例中,所述临界分离尺寸范围为为5~9微米、8~13微米、12~18微米或16~24微米,其对应的分选压力为0.5~2.5Bar。
附图说明
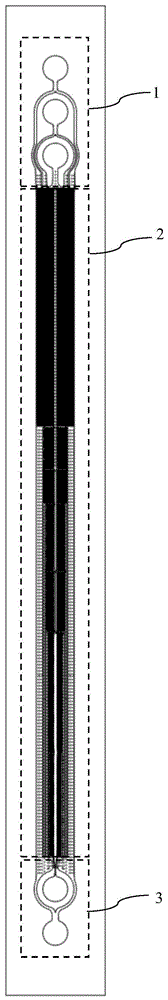
图1为微流控芯片整体结构示意图;
图2为微流控芯片的入口区结构示意图;
图3为微流控芯片的出口区结构示意图;
图4为循环分选区的结构示意图;
图5为第一收敛区和发散区的结构示意图;
图6为末级分选区的结构示意图;
图7为带缓冲液补给通道的末级分选区收敛区的结构示意图;
图8为无缓冲液补给通道的末级分选区收敛区的结构示意图;
图9为第一出口通道的结构示意图。
其中,附图标记与部件名称之间的对应关系为:
1入口区,101样本溶液通道,102第一缓冲液通道,103第二缓冲液通道,11第一缓冲液入口区,12第二缓冲液入口区,13样本溶液入口区;
2分选区,201间隙,21缓冲液流道区,22循环分选区,221第一收敛区,222发散区,223第一分隔部,2231第一分隔部本体,2232导流端,23小细胞流道区,24末级分选区,241第二收敛区,242第二分隔部;
3出口区,301第一出口通道,302第二出口通道,31第一出口部,32第二出口部;
4引流部;
A第一微柱阵列的局部结构,B第二微柱阵列的局部结构。
具体实施方式
为了能够更清楚地理解本发明的上述目的、特征和优点,下面结合附图和具体实施方式对本发明进行进一步的详细描述。需要说明的是,在不冲突的情况下,本申请的实施例及实施例中的特征可以相互组合。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是,本发明还可以采用其他不同于在此描述的其他方式来实施,因此,本发明的保护范围并不受下面公开的具体实施例的限制。
下面参照附图描述本发明一些实施例所述一种微流控芯片。
实施例1
如图1至图9所示,本实施例公开了一种微流控芯片,包括入口区1,入口区1形成有样本溶液通道101与缓冲液通道;分选区2,分选区2与入口区1连接,分选区2形成分选通道,分选通道与样本溶液通道101和缓冲液通道连通,分选通道上设有第一微柱阵列和第二微柱阵列,第一微柱阵列和第二微柱阵列分别由微柱阵列分布形成,第一微柱阵列朝向靠近分选通道的中心线方向倾斜,第二微柱阵列朝向远离分选通道的中心线方向倾斜,第一微柱阵列位于分选通道的溶液入口端与溶液出口端;出口区3,出口区3与分选区2连接,出口区3上形成第一出口通道301和第二出口通道302,第一出口通道301位于第二出口通道302的内侧,第一出口通道301和第二出口通道302与分选通道连通。
本申请公开一种微流控芯片,待测样本溶液与缓冲液通过入口区1进入微流控芯片中,其形成的样本溶液通道101与缓冲液通道分别将待测样本溶液与缓冲液共同流向分选区2,分选区2上设有分选通道,分选通道上包括倾斜设置的微柱阵列,其中第一微柱阵列朝向分选通道的中心线方向倾斜,样本溶液进入分选通道后,小尺寸的细胞通过第一微柱阵列其流动方向不变,继续沿着液体流动的方向液体流动的方向整体呈水平方向迁移,而大细胞则沿着第一微柱阵列的倾斜方向进行侧移,即大细胞向分选通道的中心方向汇集,而小细胞则沿着远离分选通道的中心方向继续流动;此时,通过第一微柱阵列进行富集后的样本溶液流入第二微柱阵列时,大细胞沿着第二微柱阵列的倾斜方向进行运动,即大细胞向远离分选通道的中心方向流动并大部分汇集至分选通道的侧壁上,随后再进入第一微柱阵列,经过上一级第二微柱阵列从而富集在分选通道侧壁上的大细胞又沿着分选通道的中心方向汇集,第一微柱阵列位于分选区2的末端,经过上述分选区2富集后的大细胞经过循环分选富集后通过连接的第一出口通道301流至大细胞收集端,而其余溶液则通过第二出口通道302流出小细胞收集端,从而能获得更高纯度的目标细胞收集液,提高微流控芯片的分选精度,为工作人员节省更多的纯化工作流程和时间,进一步提高了使用微流控芯片对目标细胞的精确提纯。
如图4至图7所示,除上述实施例的特征以外,本实施例进一步限定了:第一微柱阵列和第二微柱阵列的数量有多个,第二微柱阵列位于两个第一微柱阵列之间。通过设有多个第一微柱阵列和第二微柱阵列,分选通道通过组合排列第一微柱阵列和第二微柱阵列,且至少包括一组第一微柱阵列与第二微柱阵列交错设置的结构,进一步地,该第一微柱阵列与第二微柱阵列的交错结构可以设置多组,以达到不断对上一级分选通道中的样本溶液进一步富集目标细胞,从而提高第一出口通道301的目标细胞含量。
除上述实施例的特征以外,本实施例进一步限定了:第一微柱阵列与分选通道的中心线方向形成第一偏移角度,第一偏移角度的范围为0.5~12.5°。
除上述实施例的特征以外,本实施例进一步限定了:第二微柱阵列与分选通道的中心线方向形成第二偏移角度,第二偏移角度的范围为0.5~12.5°。
前述的偏移角度范围是指第一微柱阵列和第二微柱阵列分别与分选通道的中心线之间的偏移角度范围,通过设定优选的偏移角度范围,使得微流控芯片的分选通道长度以及第一微柱阵列和第二微柱阵列的循环结构更加合理,进一步提高分选效率和分选精度。
除上述实施例的特征以外,本实施例进一步限定了:第一微柱阵列和/或第二微柱阵列沿流道方向相邻分布的微柱之间的距离范围为6~25微米。流道方向是指样本细胞进入分选通道后的液体流动方向,该流道方向沿上述的分选通道的中心线朝向液体出口端,在该方向上相邻设置的微柱之间的距离范围为6~25微米。
除上述实施例的特征以外,本实施例进一步限定了:第一微柱阵列和/或第二微柱阵列垂直于流道方向相邻分布的微柱之间的距离范围为10~60微米流道方向是指样本细胞进入分选通道后的液体流动方向,该流道方向沿上述的分选通道的中心线朝向液体出口端,垂直于流道方向相邻分布的微柱之间的距离范围为10~60微米。
除上述实施例的特征以外,本实施例进一步限定了:第一微柱阵列和/或第二微柱阵列垂直于流道方向的高度范围为5~50微米。第一微柱阵列与第二微柱阵列在垂直于流道方向上的高度范围为5~50微米。上述尺寸的设计使得微流控芯片具有结构紧凑、分选精度高和重现性好的优点。
除上述实施例的特征以外,本实施例进一步限定了:微柱的截面形状为圆形、椭圆形、三角形、矩形、梯形、菱形、L形、C形和T形中的其中一种。
进一步地,除上述实施例的特征以外,本实施例进一步限定了:分选通道垂直于流体方向的高度能够随不同的分选压力变化。入口区1的待测样本溶液与缓冲液进入分选区2后在其分选通道上进行流动,对于能产生形变的细胞而言,在液体加压进入分选通道的情况下,其细胞发生形变,从而使得分选通道的高度也即进入分选区2上形成液体通道的高度会产生变化,所以针对能产生形变的细胞样本则可以通过改变分选压力进而调整分选区2的实际临界分离尺寸,与现有的侧向位移微柱阵列均通过匹配固定的分选压力或分选流量来设置出固定的临界分离尺寸,从而导致当样本差异较大或细胞分选需求出现变化时,微流控芯片的分选性能下降或丧失,本微流控芯片通过改变调节分选压力改变临界分离尺寸并增加芯片复用,相比现有同类技术有着更高的分辨率和准确度,方便工作者在后期通过建立分选数据库和芯片复用。
除上述实施例的特征以外,本实施例进一步限定了:分选通道垂直于流体方向的高度范围为15~60微米。分选通道也即分选区2上形成液体通道,其垂直于流体方向的高度比第一微柱阵列和第二微柱阵列的垂直于流体方向的高度大,高度范围值为15~60微米。
除上述实施例的特征以外,本实施例进一步限定了:分选区2包括缓冲液流道区21、循环分选区22和小细胞流道区23,缓冲液流道区21上形成缓冲液补给通道,缓冲液补给通道与入口区1的缓冲液通道连通,缓冲液流道区21位于循环分选区22的内侧,循环分选区22与样本溶液通道101和缓冲液通道连通,循环分选区22形成分选通道,第一微柱阵列和第二微柱阵列位于循环分选区22上,小细胞流道区23形成小细胞通道,小细胞通道与分选通道连通。缓冲液流道区21在分选通道的内部中心处,循环分选区22上形成分选通道,小细胞流道区23上形成的小细胞通道位于循环分选区22的外侧,在流体流经循环分选区22上的第一微柱阵列与第二微柱阵列进行细胞分选后,目标收集的细胞大部分沿分选通道继续向前流动,而小细胞则大部分沿外侧的小细胞流道区23继续向前流动,从而实现细胞分选的工作。
如图4和图5所示,除上述实施例的特征以外,本实施例进一步限定了:循环分选区22包括第一收敛区221、发散区222和第一分隔部223,第一收敛区221和发散区222分别设有第一微柱阵列和第二微柱阵列,第一收敛区221与入口区1相邻,发散区222位于第一收敛区221的液体出口端,小细胞流道区23位于发散区222的外侧,第一分隔部223设置在发散区222和小细胞流道区23之间,小细胞通道与第一收敛区221连通。通过在循环分选区22的溶液入口端上设有第一收敛区221,第一收敛区221上设有第一微柱阵列,使得样本溶液中的大细胞先沿朝向中心处的缓冲液流道区21方向富集,经第一收敛区221后的样本溶液流入发散区222,此时小细胞浓度高的样本溶液进入位于发散区222外侧的小细胞流道区23,而经过富集的含有较多大细胞的样本溶液进入发散区222,使得样本溶液完成一次提纯。经过上述提纯的样本溶液流经发散区222上设有的第二微柱阵列,并沿着远离流道方向进行运动至第一分隔部223处,进一步地,大细胞与第一分隔部223的侧壁之间发生弹性碰撞,不会对大细胞造成损伤,使得收集的目标细胞溶液中其细胞结构完整、活性高,便于进行下一步的使用和研究。上述过程中,将第一次提纯获得的样本溶液中的大细胞大部分又再集中在第一分隔部223的侧壁上,然后在发散区222的出口处沿着靠近流道方向进行运动至下一第一收敛区221上,样本溶液中的细胞得到进一步提纯,从而减少小细胞通道中的目标分选大细胞含量。
除上述实施例的特征以外,本实施例进一步限定了:循环分选区22的数量为多个,多个沿着液体流动方向分布的循环分选区22之间的临界分离尺寸递增,下一级循环分选区22的临界分离尺寸为上一级循环分选区22临界分离尺寸的105%~200%。进一步地,通过设置串联多个循环分选区22逐级分离不同尺寸的细胞,使得样本溶液不断进行提纯以获取浓度更高的大细胞。相邻设置的循环分选区22之间的尺寸不相同,具体地,下一级循环分选区22指位于液体流出方向的循环分选区22的尺寸为上一级循环分选区22尺寸的105~200%,沿着流道方向其临界分选尺寸增大,有利于进一步提高大细胞的分选精度和分选纯度,增加了细胞分离的分辨率并降低了流道堵塞风险。
除上述实施例的特征以外,本实施例进一步限定了:第一收敛区221、发散区222与第一分隔部223的数量为多个,第一收敛区221与发散区222交错设置。循环分选区22内的第一收敛区221和发散区222的数量为多个,多个第一收敛区221和发散区222之间交错设置,有利于提高分选纯度,进一步提高分选通道中的大细胞含量。
除上述实施例的特征以外,本实施例进一步限定了:缓冲液流道区21与小细胞流道区23上设有圆柱阵列,圆柱阵列的分布方向与液体流动方向相同。通过在第一收敛区221和发散区222上设有圆柱阵列,且圆柱阵列内的圆柱排布方向与液体流动方向一致,该圆柱阵列用于稳定流道的内的溶液流动。
除上述实施例的特征以外,本实施例进一步限定了:还包括引流部4,相邻的第一收敛区221与发散区222之间具有间隙201,引流部4设置在缓冲液流道区21的外侧壁和/或第一分隔部223的内侧壁上,引流部4位于间隙201处。具体地,引流部4靠近第一收敛区221的一侧沿液体流动方向朝远离分选通道的中心线方向倾斜,使得向分选通道的中心线方向汇集的溶液朝向发散区222的方向流道,对大细胞起到引流的效果,引流部4靠近发散区222的一侧沿液体流动方向朝靠近分选通道的中心线方向倾斜。
如图6至图9所示,除上述实施例的特征以外,本实施例进一步限定了:还包括末级分选区24,末级分选区24位于循环分选区22的液体出口端,末级分选区24上设有第一微柱阵列,缓冲液流道区21位于末级分选区24的内侧,小细胞流道区23位于末级分选区24的外侧,分选通道延伸至末级分选区24。通过设有末级分选区24对循环分选区22流出的靠近中心线一侧的溶液进行进一步提纯并完成最终的纯化工作。末级分选区24的末端与出口区3连接,末级分选区24位于循环分选区22的末端处,分选通道延伸至末级分选区24上,而缓冲液流道区21至少部分延伸至末级分选区24的端部,使得缓冲液流道区21上的缓冲液在末级分选区24上与分选通道连通。
除上述实施例的特征以外,本实施例进一步限定了:末级分选区24包括第二收敛区241和第二分隔部242,第二收敛区241上设有多个第一微柱阵列,第二分隔部242位于第二收敛区241外侧。末级分选区24上设有第二收敛区241,第二收敛区241上通过循环设置第一微柱阵列,对已经经过循环分选区22提纯的溶液进行再次提纯,第二分隔部242设置在位于末级分选区24上的小细胞流道区23与第二收敛区241之间,再次将经过循环分选区22后的溶液中的小细胞分离出去,末级分选区24与出口区3的第一出口通道301连通,通过第一出口通301道获取目标细胞浓度高的溶液。
除上述实施例的特征以外,本实施例进一步限定了:末级分选区24的临界分离尺寸高于循环分选区22,末级分选区24的临界分离尺寸为首个循环分选区22临界分离尺寸的120%~600%。末级分选区24的临界分离尺寸比位于分选通道的首个循环分选区22尺寸的要大,有利于进一步提高大细胞的分选精度和分选纯度,并降低了流道堵塞风险。
除上述实施例的特征以外,本实施例进一步限定了:缓冲液流道区21至少贯穿部分末级分选区24,缓冲液流道区21的末端位于末级分选区24上。由于分选通道沿着流道方向不断进行分离提纯,导致末端的分选通道中大细胞含量高、缓冲液含量减少,缓冲液流道区21至少部分延伸至末级分选区24的端部并与分选通道连通,这样有利于保持末级分选区24上的细胞活性。
如图4所示,除上述实施例的特征以外,本实施例进一步限定了:第一分隔部223包括第一分隔部本体2231和导流端2232,导流端2232设置在第一分隔部本体2231上,导流端2232位于第一收敛区221的液体出口端,导流端2232用于引导液体流向小细胞流道区23。通过在第一分隔部223上设有导流端2232,其用于引导上一级分选通道外侧的溶液流进小细胞流道区23上,而位于靠近分选通道内侧的溶液则继续进入下一级分选通道上,其溶液中的大细胞含量高,大细胞则沿下一级阵列方向进行偏移,按此不断进行循环提纯的过程。
除上述实施例的特征以外,本实施例进一步限定了:导流端2232具有一导流弧面,导流弧面位于导流端2232的外侧,导流弧面朝向远离分选通道的中心线方向偏移。导流端2232的外侧形成向中心线偏移的导流弧面,有利于减少第一微柱阵列与第二微柱阵列连接处之间的流体阻力,达到引流和稳流的效果。进一步地,第二分隔部242上具有与第一分隔部223的相同结构。
除上述实施例的特征以外,本实施例进一步限定了:导流端2232与第一分隔部本体2231的连接处形成弯角。
如图1和图2所示,除上述实施例的特征以外,本实施例进一步限定了:缓冲液通道包括第一缓冲液通道102和第二缓冲液通道103,入口区1包括第一缓冲液入口区11、第二缓冲液入口区12和样本溶液入口区13,第一缓冲液入口区11形成第一缓冲液通道102,第二缓冲液入口区12形成第二缓冲液通道103,第二缓冲液通道103位于第一缓冲液通道102的内侧。通过设有两个缓冲溶液通道,且样本溶液通道101设置在第一缓冲液通道102与第二缓冲液通道103之间,第一缓冲液沿着第一缓冲液通道102进入分选区2时形成鞘流,有利于起始阶段部分的待分选样本细胞溶液更大程度地流向中间的分选区2,从而降低目标样本细胞的损失率,通过在样本溶液通道101的内侧设有第二缓冲液通道103,第二缓冲液沿着第二缓冲液通道103进入分选区2后,便于样本细胞溶液混合并形成中间的液流,从而保证样本细胞溶液往缓冲液补给通道外侧的具备分选功能的区域进行流动,进一步地,入口区1的第一缓冲液通道102、第二缓冲液通道103以及样本溶液通道101分别与分选通道内的液流方向相同,有利于避免样本细胞溶液随缓冲液进入分选区2后影响液流方向。该缓冲液与样本溶液的流道设计使得避免待分选的样本细胞溶液在微流控芯片内形成湍流,有利于提高样本细胞溶液通过分选区2后的分选效率和分选精度,提高出口区3的样本细胞回收率。
如图1和图3所示,除上述实施例的特征以外,本实施例进一步限定了:出口区3包括第一出口部31和第二出口部32,第一出口部31上形成第一出口通道301,第一出口部31与分选通道的出液端相邻,第二出口部32上形成第二出口通道302。出口区3的第一出口部31与分选区2上的末级分选区24连接,用于回收目标收集的大细胞溶液,而第二出口部32与小细胞流道区23连通,用于回收小细胞含量高的溶液。
除上述实施例的特征以外,本实施例进一步限定了:样本溶液通道101、缓冲液通道、第一出口通道301和第二出口通道302上分别设有圆柱阵列,圆柱阵列的分布方向与液体流动方向相同。通过在入口区1和出口区3的通道上设有圆柱阵列,且圆柱阵列内的圆柱排布方向与液体流动方向一致,该圆柱阵列用于稳定流道的内的溶液流动。
具体地,微流控芯片的微结构可使用热固性或热塑性聚合物、玻璃、硅等材料加工制备,并通过键合、压合、热封接/焊接等工艺形成封闭结构。
实施例2
本申请第二个实施例公开一种微流控芯片的分离纯化方法。包括:
S1:使用上述一种微流控芯片,入口区1与待处理样本溶液和缓冲液连接,待处理样本溶液流经样本溶液通道101,缓冲液流经缓冲液通道,出口区3与大细胞回收液管和小细胞回收液管连接,第一出口通道301与大细胞回收液管连通,第二出口通道302与小细胞回收液管连通;
S2:向待处理样本溶液和缓冲液施加相同的分选压力,待处理样本溶液和缓冲液经过分选区2,目标细胞溶液经过第一出口通道301回收至大细胞回收液管,其余溶液经过第二出口通道302回收至小细胞回收液管中;
S3:待处理样本溶液排空或回收液装满后,中断入口区1的进液以及出口区3的出液,并接触施加待处理样本溶液和缓冲液施加的分选压力。
本申请的第二个方面公开一种通过上述微流控芯片的分离纯化方法,第一缓冲液入口区11和第二缓冲液入口区12与缓冲液连接,样本溶液入口区13与待处理样本连接,第一出口部31与大细胞回收液管连接,第二出口部32与小细胞回收液管连接;向缓冲液和待处理样本施加相等的分选压力,使缓冲液和样本分别从各自对应的入口流入微流控芯片并完成细胞分选;样本排空或回收液装满后,中断微流控芯片的流入和流出,解除施加给缓冲液和待处理样本的分选压力从而完成分选过程。
实施例3
除上述实施例的特征以外,本实施例进一步限定了,分选压力从分选数据库中确定,分选数据库的建库包括如下步骤,S1:在0.5~2.5Bar区间的不同分选压力条件下,对2~25微米的聚合物颗粒样本进行分选测试,根据测试结果确认微流控芯片的临界分离尺寸;S2:使用上述确认了临界分离尺寸的微流控芯片,测试不同分选压力下,不同种类细胞样本的分选回收率,确定最佳的分选压力;S3:根据上述测试结果,结合微流控芯片及临界分离尺寸、细胞种类和特征、分选压力及对应分选回收率,建立细胞分选数据库。
为了一进步更好地解释说明,本发明采用如下规格的微流控芯片进行分选数据库的建库:微流控芯片中的第一微柱阵列与第二微柱阵列均设有等腰三角形的微柱,其中三角形顶角角度为120度,第一收敛区221和第二收敛区241内的微柱阵列的分选通道的偏移角度为3.17度,发散区222内的微柱阵列的分选通道的偏移角度为5.22度,第一微柱阵列和第二微柱阵列垂直于流道方向相邻分布的微柱之间的距离范围为50微米,从前到后各级分选区的临界分离尺寸为4微米、5.6微米和7微米。0.5~2.5Bar分选压力下,芯片的整体临界分离尺寸范围为8~13微米。
其中:正向临界分离尺寸是由100%回收率流入第一出口部31的样本的最小尺寸数据统计而得。负向临界分离尺寸是由100%回收率流入第二出口部32的样本的最小尺寸数据统计而得。第一出口部31用于回收经分选后的大细胞溶液,第二出口部32用于回收小细胞溶液。
(1)颗粒测试:
针对临界分离尺寸设计值为2~16微米的5种不同规格微流控芯片,分别使用粒径为1微米、3微米、5微米、7微米、9微米、11微米、13微米、15微米、17微米和19微米的聚苯乙烯颗粒样本进行分选测试,并得到实际的正向临界分离尺寸和负向临界分离尺寸,如表1所示的正向临界分离尺寸测试数据,以及表2所示的负向临界分离尺寸测试数据。
表1
表2
(2)细胞测试:使用正向临界分离尺寸和负向临界分离尺寸分别为5微米和3微米的规格2芯片,测试最小尺寸为2微米、4微米、6微米、8微米和10微米的不同细胞,在分选压力分别为0.5Bar、0.75Bar、1Bar、1.25Bar、1.5Bar、1.75Bar、2Bar、2.25Bar和2.5Bar时的细胞回收率,并得到表3和表4所示的不同尺寸细胞的最佳分选压力数据。
表3
/>
表4
(3)根据测试结果建立数据库子库:
统计上述颗粒测试和细胞测试数据结果,得到表5所示的综合微流控芯片规格、分选压力和细胞尺寸特征的分选数据库子库;
表5
(4)重复上述操作,建立数据库:针对其他芯片规格、分选条件和细胞尺寸特征,重复上述操作,最后汇总所有数据,得到完成的分选数据库。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 一种微流控芯片、微流控检测装置及微流控检测方法
- 一种用于生物分子检测的微流控芯片及微流控装置
- 一种微流控组件、微流控芯片及其制备方法
- 微流控芯片系统及微流控芯片
- 一种微流控芯片和微流控芯片的使用方法
- 一种纸基微流控流体分配机构、微流控纸基芯片和全自动微流控纸基芯片检测分析平台
