一种快速检测对虾血细胞虹彩病毒的TaqMan荧光定量PCR方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于病毒PCR检测技术领域,尤其涉及一种快速检测对虾血细胞虹彩病毒的TaqMan荧光定量PCR方法。
背景技术
目前,中国对虾养殖产量居全球首位,但随着高密度集约化养殖的推广,对虾病毒性疾病频繁暴发,因缺乏全面有效的预防措施和靶向药物,已成为对虾养殖过程中威胁性最大的疾病,给对虾养殖户造成了巨大损失,严重阻碍了对虾养殖产业的发展。
对虾虹彩病毒病作为一种于近年发现的高致死性病毒病,其病原为对虾血细胞虹彩病毒(Shrimp hemocyte iridescent virus, SHIV),SHIV是一种以线性双链DNA为遗传物质的二十面体对称型病毒,可感染所有生长阶段的虾,SHIV感染会导致对虾行动缓慢且活力急剧下降,人工感染实验表明SHIV可致健康对虾在感染后15天内全部死亡。而SHIV感染引起的对虾空肠空胃及肝胰腺发白的症状也存在于其它病毒性疾病中,因此,亟需建立一种快速、准确、灵敏和特异的SHIV检测方法,以此实现养殖过程中的病毒现场检测和疫病监控,助力对虾健康养殖。
为满足对虾养殖产业中对SHIV的防控需求,目前已建立了多种关于SHIV的检测方法,主要包括组织病理学方法和分子生物学方法两大类。组织病理学方法中最常用的组织病理切片技术主要包括切片组织的固定、脱水、浸蜡、包埋、切片、染色及封片观察等步骤,制作完成的组织病理切片可在光学显微镜下进行观察,感染SHIV的病料样本切片中可观察到嗜碱性包含体的存在及核固缩现象,而健康对虾样本中没有。以环介导等温扩增(LAMP)技术、套式PCR(Nested PCR)技术、等温重组酶聚合酶(RPA)技术和实时荧光定量PCR(RT-PCR)技术为代表的分子诊断技术以特异性引物识别病原核酸,受样品种类限制少,具有快速、灵敏、损伤小、可定性、可量化、操作简便及试剂无毒性的特点,大幅提高了SHIV诊断的时效性和精准性,未来具有良好的发展潜力。
然而,上述方法在对虾产业应用过程中均存在一定局限性。组织病理观察所需操作步骤较为繁琐、耗时久(全过程约需2-3天)、损伤大、技术难度较高、不能一次性确诊且试剂对人体有一定毒性。与组织病理学方法相比,分子生物学技术具有操作便捷、可定性定量、毒性低的优势,但其敏感性仍存在一定的提升空间,其中定量实时环介导等温扩增(qLAMP)技术最低只能检测到1.9×10
发明内容
本发明的目的在于提供一种具有高灵敏度的快速检测对虾血细胞虹彩病毒的TaqMan荧光定量PCR方法。
为实现上述目的,本发明提供了如下技术方案:
本发明提供了一组用于快速检测对虾血细胞虹彩病毒的TaqMan荧光定量PCR的引物和探针,所述引物的序列和探针的序列如下所示:
SHIV-F:ACGGGAAAACGGTAACTCAAA;
SHIV-R:CTGCCCATCTAACACCATCTC;
SHIV-P:FAM-CGAATTGGCCAGGGCG-MGB。
其次,本发明提供了一种用于快速检测对虾血细胞虹彩病毒的TaqMan荧光定量PCR试剂盒,所述试剂盒含有检测SHIV病毒的引物和探针,所述引物和探针的序列如下:
SHIV-F:ACGGGAAAACGGTAACTCAAA;
SHIV-R:CTGCCCATCTAACACCATCTC;
SHIV-P:FAM-CGAATTGGCCAGGGCG-MGB。
优选地,所述试剂盒还含有2×qRT-PCR Mix,无DNA酶水。
优选地,所述试剂盒的反应体系为:
2 × qRT-PCR Mix 12.5 μL,SHIV-F 0.5 μL,SHIV-R 0.5 μL,SHIV-P 0.5 μL,无DNA酶水6 μL,待测样品DNA模板 5 μL。
优选地,所述试剂盒的反应条件为:95℃预变性30 s,95℃变性10 s,60℃退火延伸30 s,变性与退火延伸过程共40个循环。
其次,本发明提供了一种快速检测对虾血细胞虹彩病毒的TaqMan荧光定量PCR方法,所述方法包括如下步骤:
(1)获取待测样品DNA模板;
(2)配制TaqMan PCR反应体系进行PCR反应,所涉及引物和探针的序列如下:
SHIV-F:ACGGGAAAACGGTAACTCAAA;
SHIV-R:CTGCCCATCTAACACCATCTC;
SHIV-P:FAM-CGAATTGGCCAGGGCG-MGB;
(3)根据PCR反应检测结果进行判定。
优选地,所述TaqMan PCR反应体系为2 × qRT-PCR Mix 12.5 μL,SHIV-F 0.5 μL,SHIV-R 0.5 μL,SHIV-P 0.5 μL,无DNA酶水6 μL,待测样品DNA模板 5 μL。
优选地,所述PCR反应的条件为:95℃预变性30 s,95℃变性10 s,60℃退火延伸30s,变性与退火延伸过程共40个循环。
本发明的有益效果是:
1. 快速便捷:本发明所涉及检测方法反应体系中的2 × qRT-PCR Mix、SHIV-F、SHIV-R、SHIV-P及无DNA酶水五种组分可提前混合为预混液,如此在检测时仅需向反应管中添加预混液和样品DNA两种组分,操作简便;且检测迅速,反应时间仅需40 min。
2. 灵敏度高:本发明对SHIV ATPase基因的检测限可低至1 copy/μL,阳性样品检出率高。
3. 特异性强:本发明所涉及引物和探针根据SHIV ATPase保守区域三段不同序列设计,只有SHIV-F、SHIV-R和SHIV-P同时与样品DNA结合,体系内荧光强度才会增强,出现S型扩增曲线;同时,反应体系中的热启动Taq酶经过修饰,只有经过95℃的变性过程其活性中心才会暴露,从而发挥聚合作用,配合反应体系中的UNG酶系统,能够有效避免低温下的模板错配及非特异性扩增,具有更高的特异性。
4. 简单易判:检测结果以扩增曲线和Ct值两种形式同时呈现,客观、直接、明显。
附图说明
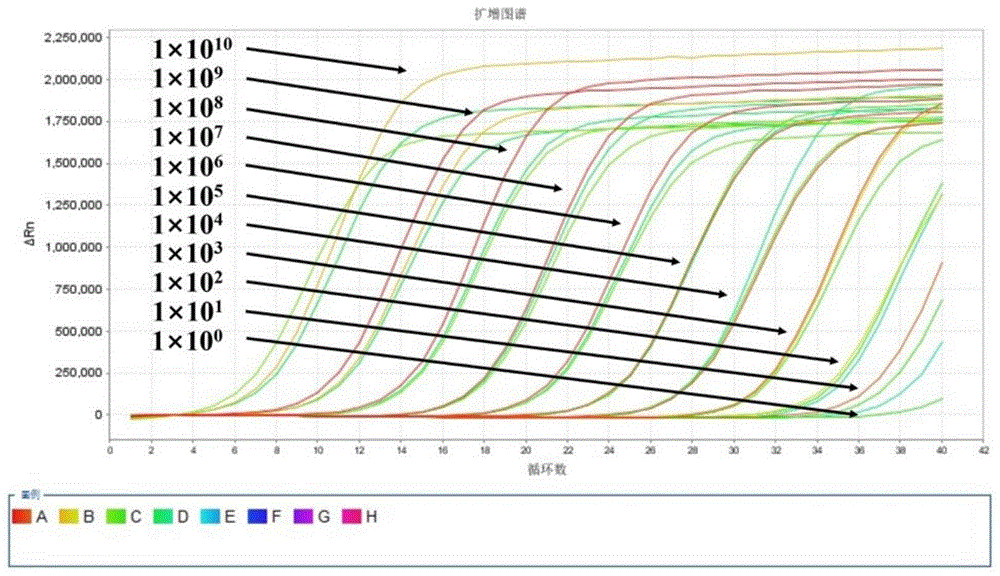
图1为实施例3提供的SHIV TaqMan荧光定量PCR的扩增曲线图;
图2为实施例3提供的SHIV TaqMan荧光定量PCR的标准曲线图;
图3为本发明实施例4提供的SHIV TaqMan荧光定量PCR的敏感性实验结果图;
图4为本发明实施例5提供的SHIV TaqMan荧光定量PCR的特异性实验结果图;
图5为本发明实施例6提供的SHIV TaqMan荧光定量PCR的批间重复性实验结果图;图A-E分别是五次重复性实验的结果图;
图6是本发明实施例6提供的SHIV TaqMan荧光定量PCR的批内重复性实验结果图。
具体实施方式
所举实施例是为了更好地对本发明进行说明,但并不是本发明的内容仅局限于所举实施例。所以熟悉本领域的技术人员根据上述发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。
实施例1
引物及探针设计
据对虾血细胞虹彩病毒(SHIV)ATPase基因DNA Star软件序列比对结果,利用引物探针设计程序Primer-BLAST(NCBI)设计出一对特异性引物和探针,均由上海生工生物有限公司合成,详见表1
实施例2
使用TaqMan荧光定量PCR方法实施SHIV的检测
(1)本发明采用博日科技(BIOER)MagaBio plus病毒DNA/RNA纯化试剂盒Ⅲ进行样品DNA的提取与纯化,制备TaqMan荧光定量PCR反应 DNA模板的详细操作步骤参见该试剂盒的使用说明书;
(2)TaqMan PCR反应体系:
为实现TaqMan荧光定量PCR的最佳扩增效率和检测特异性,经过优化,最终确定的反应体系为:2 × qRT-PCR Mix 12.5 μL,SHIV-F(10 μmol/L) 0.5 μL,SHIV-R(10 μmol/L) 0.5 μL,SHIV-P(10 μmol/L) 0.5 μL,无DNA酶水6 μL,共20 μL。本PCR体系中的2 ×qRT-PCR Mix由南京诺唯赞生物技术有限公司(Vazyme)提供。按照上述体系要求配制荧光定量反应液,混匀后分装到无菌无酶Eppendorf管(0.1mL)中,而后分别将5 μL待测样品DNA模板加入不同的Eppendorf管中,使得各Eppendorf管中反应体系的总体积达到25 μL。
(3)TaqMan PCR反应程序:
为发挥TaqMan PCR反应体系中的热启动Taq酶的最大效能,收获最佳反应效果,易于下一步的结果判定,本发明所涉及检测方法的PCR反应条件为:95℃预变性30 s,95℃变性10 s,60℃退火延伸30 s(此阶段收集荧光),变性与退火延伸过程共40个循环。总反应时间约为40 min。
(4)检测结果的判定:
PCR反应结束后,即可依据实时荧光定量PCR仪上的CT值和扩增曲线图谱进行检测结果的判定:
阳性:检测样品Ct值 ≤ 35,且扩增曲线有明显的指数增长期,呈S型;
可疑:检测样品Ct值 > 35,且出现典型的S型扩增曲线,进行重复实验;
阴性:检测不到样品Ct值,且无明显的扩增曲线。
实施例3:标准曲线的建立
(1)荧光定量标准品制备:
将SHIV ATPase基因中500 bp核苷酸片段(SEQ ID NO.4)连接到pUC57-T载体中即构建得到SHIV阳性质粒,并转化到DH5α感受态细胞中,而后通过蓝白斑筛选阳性单克隆并进行测序确认,遂得到阳性菌株,使用质粒提取试剂盒对阳性菌株进行质粒提取,提取产物即为标准品。
(2)标准曲线的建立:
1)标准品通过紫外分光光度计定量并计算拷贝数。
2)分子拷贝数(copies/μL)=DNA质量浓度/DNA分子量,其中DNA质量浓度=260 nm吸光度×稀释倍数×6.02×10
3)分别取不同稀释梯度的标准品1 μL,依次加入2 × qRT-PCR Mix 12.5 μL,SHIV-F(10 μmol/L) 0.5 μL,SHIV-R(10 μmol/L) 0.5 μL,SHIV-P(10 μmol/L) 0.5 μL,无DNA酶水10 μL,共25 μL。
4)将上述荧光定量反应液混匀后进行PCR扩增,反应程序为:95℃预变性30 s,95℃变性10 s,60℃退火延伸30 s(此阶段收集荧光),变性与退火延伸过程共40个循环。得到的SHIV扩增动力学曲线如图1所示,相应的标准曲线如图2所示。
结果显示标准曲线具有良好的线性关系,回归方程为Y=-3.2316X+39.241,相关系数R
实施例4
将SHIV标准品10倍梯度稀释(10
实施例5
特异性实验
(1)取感染对虾血细胞虹彩病毒(SHIV)、白斑综合症病毒(WSSV)、副溶血弧菌(
(2)分别取不同特异性模板5 μL,依次加入2 × qRT-PCR Mix 12.5 μL,SHIV-F(10 μmol/L) 0.5 μL,SHIV-R(10 μmol/L) 0.5 μL,SHIV-P(10 μmol/L) 0.5 μL,无DNA酶水6 μL,共25 μL。
(3)同时设置空白对照(NC)。将上述荧光定量反应液混匀后进行PCR扩增,反应程序为:95℃预变性30 s,95℃变性10 s,60℃退火延伸30 s(此阶段收集荧光),变性与退火延伸过程共40个循环。
结果如图4所示,可以看出只有SHIV出现了明显的S型扩增曲线,Ct值为15.35,其它虾源病原和空白对照均没有扩增曲线和Ct值。因此,本发明建立的TaqMan荧光定量RT-PCR检测方法具有良好的特异性。
实施例6
重复性实验
(1)批间重复性实验:取Ct值大小不同(均匀分布于12-30之间)的6个样品,在同一条件下进行5次重复实验;实验结果如表2所示:
表2 SHIV TaqMan荧光定量PCR批间重复
由表2可知,批间重复的变异系数均小于1%,表明本发明建立的TaqMan荧光定量PCR检测方法在批间具有良好的重复性。
(2)批内重复性实验:取Ct值大小不同(均匀分布于12-30之间)的6个样品,在一次实验中进行5次重复实验;实验结果如表3所示:
表3 SHIV TaqMan荧光定量PCR批内重复
由表3可知,批内重复的变异系数均小于0.5%,表明本发明建立的TaqMan荧光定量PCR检测方法在批内具有良好的重复性。
实施例7
一种快速检测对虾血细胞虹彩病毒的试剂盒
(1)该试剂盒包括如下组分:
2×qRT-PCR Mix,SHIV-F(10 μmol/L),SHIV-R(10 μmol/L),SHIV-P(10 μmol/L),无DNA酶水。
其中,SHIV-F:ACGGGAAAACGGTAACTCAAA;
SHIV-R:CTGCCCATCTAACACCATCTC;
SHIV-P:FAM-CGAATTGGCCAGGGCG-MGB;
(2)该试剂盒的反应体系为:
2 × qRT-PCR Mix 12.5 μL,SHIV-F(10 μmol/L) 0.5 μL,SHIV-R(10 μmol/L)0.5 μL,SHIV-P(10 μmol/L) 0.5 μL,无DNA酶水6 μL,待测样品DNA模板 5 μL。
(3)该试剂盒的反应条件为:
95℃预变性30 s,95℃变性10 s,60℃退火延伸30 s,变性与退火延伸过程共40个循环。
(4)该试剂盒的结果判定标准为:
阳性:检测样品Ct值 ≤ 35,且扩增曲线有明显的指数增长期,呈S型;
可疑:检测样品Ct值 > 35,且出现典型的S型扩增曲线,进行重复实验;
阴性:检测不到样品Ct值,且无明显的扩增曲线。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 一种大黄鱼虹彩病毒的双重TaqMan探针法荧光定量PCR检测试剂盒及制备方法
- 一种大黄鱼虹彩病毒的TaqMan探针法荧光定量PCR检测试剂盒及制备方法
