一种肿瘤细胞衍生的纳米疫苗及其制备方法和应用
文献发布时间:2023-06-29 06:30:04
技术领域
本发明属于生物医药技术领域,具体涉及一种肿瘤细胞衍生的纳米疫苗及其制备方法和应用。
背景技术
恶性肿瘤是严重威胁人类健康的疾病之一。2022年,中国有约482万新发病例以及321万死亡病例。恶性肿瘤的高异质性,免疫逃逸,持续增殖,侵袭转移等特性,使得传统治疗手段的疗效有限。2011年以来,肿瘤免疫治疗进入了一个快速发展的阶段,该疗法旨在调动机体免疫系统来治疗肿瘤,已经成为肿瘤治疗的重要手段之一。目前,肿瘤免疫疗法主要包括免疫检查点阻断疗法,细胞因子疗法,工程嵌合抗原受体T细胞或巨噬细胞疗法以及肿瘤疫苗。其中免疫检查点阻断疗法取得了令人瞩目的效果,但临床中的低响应率也限制了其进一步的应用。从相关研究可知,免疫细胞在肿瘤部位活化和浸润不充分是重要的影响因素。因此,仍然有必要发展其它肿瘤免疫治疗手段充分激活机体的免疫细胞,增强抗肿瘤免疫反应,同时弥补免疫阻断疗法的不足,以进一步改善肿瘤免疫疗法的临床收益。
肿瘤疫苗是根除肿瘤的最佳免疫治疗策略之一,其既可以触发抗肿瘤免疫反应来预防或治疗原发肿瘤,又可以建立长期免疫记忆来防止肿瘤转移和复发。肿瘤疫苗通常携带肿瘤抗原,通过刺激树突细胞加工呈递抗原,继而诱导T细胞介导的抗原特异性免疫反应杀伤肿瘤。肿瘤疫苗主要包括基于抗原肽,全肿瘤细胞或裂解物的肿瘤疫苗,以及通过高通量测序技术鉴定肿瘤特异性突变抗原表位发展而来的肿瘤疫苗平台,包括新抗原肽疫苗、全部或部分蛋白质编码的RNA或DNA疫苗,新抗原肽编码的重组病毒或细菌载体。尽管肿瘤疫苗在启动抗肿瘤免疫方面具有突出优势,但是肿瘤疫苗的临床转化仍然面临着诸多障碍,除了肿瘤免疫抑制因素外,最突出的问题就是由于树突细胞的无效激活导致免疫反应不佳。由肿瘤相关抗原和佐剂组成的亚单位疫苗未能产生令人满意的临床效果,正是由于疫苗输送到树突细胞的效率低下,导致树突细胞无法有效激活。虽然过继配备肿瘤抗原和免疫调节剂的患者来源的树突细胞可能克服这一挑战,但是树突细胞体外培养工作量大耗时长,且具有不同免疫衰竭水平的患者的疗效差异大,阻碍了其临床应用。2010年,首个树突细胞疫苗被FDA批准上市,用于治疗激素无效的转移性前列腺癌,但仅展现出较小的延长生存时间的优势。
为了提高肿瘤疫苗的递送效率,纳米技术被广泛应用于肿瘤疫苗的开发中。肿瘤纳米疫苗通常由肿瘤抗原,免疫佐剂和合适的纳米载体组成,旨在通过将肿瘤抗原和免疫佐剂同步递送入树突细胞,诱导全身性抗肿瘤免疫反应,从而预防或治疗治疗原发肿瘤,并建立长期免疫记忆以防止肿瘤转移和复发。随着生物仿生技术的兴起,肿瘤纳米疫苗的功效得到进一步提升。肿瘤细胞衍生的纳米疫苗作为仿生肿瘤纳米疫苗的一种类型,引入了肿瘤细胞衍生成分(如肿瘤细胞裂解物,细胞膜或细胞囊泡等),保留了肿瘤细胞大部分潜在的抗原,可诱导广泛的抗原特异性免疫反应,使得肿瘤细胞难以逃脱免疫监视。尽管肿瘤细胞衍生的纳米疫苗在展示肿瘤抗原表位方面具有独特优势,但是仍然存在一些问题严重阻碍了其临床应用。从生产制备角度来看:(1)肿瘤细胞衍生成分繁琐的提取和再组装过程(如反复冻融,共挤出等)可能会使肿瘤细胞衍生成分的功能降低甚至丧失;(2)外源性佐剂的装载方法(如电穿孔,超声等)通常具有破坏性,容易损伤肿瘤细胞衍生成分的结构。从有效性和安全性角度来看:(1)跨越生物屏障能力或自身效力不足致使树突细胞活化不充分;(2)外源性佐剂存在过度反应和毒性风险。
发明内容
本发明的目的在于提供一种肿瘤细胞衍生的纳米疫苗及其制备方法和应用,该肿瘤纳米疫苗可以在肿瘤细胞内自发高效组装,从而极大程度保留肿瘤外泌体上的肿瘤抗原信息;提升该肿瘤纳米疫苗的淋巴结靶向性和树突细胞的内化,使其可以同时将抗原和佐剂高效递送至树突细胞,从而激活强烈的抗肿瘤免疫反应来预防或治疗肿瘤。
具体的,本发明提供的肿瘤细胞衍生的纳米疫苗,由如下流程得到:将负载有触发内质网应激药物的纳米制剂与肿瘤细胞孵育,肿瘤细胞内吞纳米制剂后,纳米制剂释放触发内质网应激的药物,使肿瘤细胞发生内质网应激,上调热休克蛋白;随后纳米制剂经由外泌体生成途径被肿瘤细胞外排到细胞外得到纳米疫苗,并在该过程中内源性加载了热休克蛋白。该纳米疫苗的形态为外泌体包裹纳米制剂的壳-核形态。该纳米疫苗保留有肿瘤外泌体上肿瘤抗原信息,并内源性加载有热休克蛋白作为佐剂。
本发明中,所述纳米制剂的纳米材料包括聚乳酸(PLA)、聚乳酸-羟基乙酸共聚物(PLGA)、聚己内酯(PCL)中的一种。优选地,所述纳米制剂中的纳米材料选自PLGA。
本发明中,所述纳米制剂中负载的药物为可以触发细胞内质网应激的药物,包括α-倒捻子素(αM),衣霉素(Tun),毒胡萝卜素(Tha)。优选地,纳米制剂中负载的药物为αM。
本发明中,所述肿瘤细胞包括黑色素瘤、淋巴瘤、乳腺癌、前列腺癌、甲状腺癌、食道癌、骨癌、胃癌、肺癌、卵巢癌、子宫癌、肝癌、膀胱癌、皮肤癌、结肠癌或直肠癌,急性白血病细胞。优先地,所述肿瘤细胞选自黑色素瘤和乳腺癌细胞。
本发明中,所述作为佐剂的热休克蛋白为热休克蛋白70家族。
本发明中,所述的纳米制剂平均粒径小于100nm;所述的肿瘤细胞衍生的纳米疫苗平均粒径在100-200nm之间。
本发明中,所述肿瘤细胞衍生的纳米疫苗的制备方法,包括以下步骤:
S1:将负载有触发内质网应激药物的纳米制剂材料与肿瘤细胞孵育,共孵育的时间为1-24h;
S2:更换新鲜的不含载药纳米制剂的培养基,继续孵育,共孵育的时间为12-96h;
S3:梯度离心收集经培养基中肿瘤细胞衍生的纳米疫苗。
所述梯度离心的具体条件是,在0-10℃低温条件下,以2500g离心力出去完整细胞,以10000g离心力出去细胞碎片及微泡,以20000-30000g的离心力离心60-120min得到肿瘤细胞衍生的纳米疫苗。
本发明中,所述的肿瘤细胞衍生的纳米疫苗可在肿瘤细胞内高效自发组装,整合并简化了肿瘤细胞衍生的纳米疫苗的制备过程,并提升了疫苗的产量。
本发明中,所述的抗原和佐剂均来自肿瘤细胞内源成分,纳米材料为生物可降解材料,具有良好的生物安全性。佐剂的加载方式为内源性加载,避免了外源性加载方式对肿瘤细胞衍生成分的破坏。
本发明中,所述的肿瘤细胞衍生的纳米疫苗在皮下注射后,可借助热休克蛋白对淋巴结的靶向性和对树突细胞的亲和性,快速迁移至淋巴结并被树突细胞高效摄取;所述肿瘤细胞衍生的纳米疫苗同时装载了肿瘤抗原以及免疫佐剂热休克蛋白,可同步将抗原和佐剂递送入树突细胞,促进树突细胞的成熟和抗原呈递,继而激活抗强烈的肿瘤免疫反应来预防和治疗肿瘤。
本发明所述的肿瘤细胞衍生的纳米疫苗与免疫检查点疗法联合使用,可以发挥协同作用,增强肿瘤免疫治疗效果。
本发明描述了该肿瘤细胞衍生的纳米疫苗的具体制备方发,并提供了该纳米疫苗体内外免疫激活的试验结果,以及单独或联合其它药物的药效学评价结果。
本发明中所述的肿瘤细胞衍生的纳米疫苗制备简单,易于重现,无需提取新生抗原和装载外源性佐剂即可高效触发免疫应答,具有良好的临床转化和应用前景。
附图说明
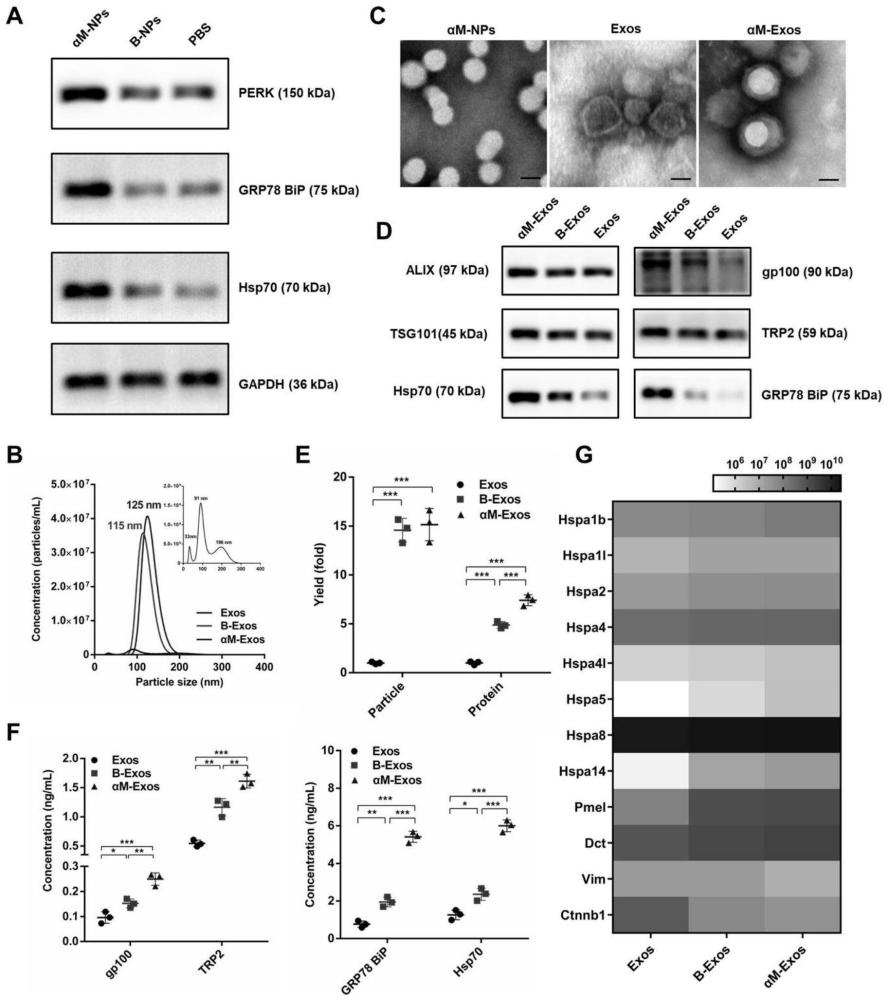
图1为αM-Exos的制备和表征。其中,A是B16F10-OVA细胞与PBS,B-NPs或αM-NPs孵育后细胞内质网应激标记物及热休克蛋白的western blot结果;B是Exos、B-Exos及αM-Exos的纳米粒子追踪分析结果;C是αM-NPs,Exos及αM-Exos的透射电镜拍摄结果;D是Exos、B-Exos及αM-Exos外泌体标志物、肿瘤抗原及热休克蛋白的western blot结果;E是Exos、B-Exos及αM-Exos的粒子数和蛋白量,数据以平均值±SD(n=3)表示,*p<0.05,**p<0.01,***p<0.001;F是Exos、B-Exos及αM-Exos肿瘤相关抗原及热休克蛋白的ELISA结果,数据以平均值±SD(n=3)表示,*p<0.05,**p<0.01,***p<0.001;G是Exos、B-Exos及αM-Exos热休克蛋白、肿瘤抗原及肿瘤转移相关蛋白的蛋白组学分析结果。
图2为BMDCs对αM-Exos的摄取。其中,A是BMDCs摄取Exos、B-Exos或αM-Exos的流式检测结果,数据以平均值±SD(n=3)表示,**p<0.01,***p<0.001;B是BMDCs对αM-Exos摄取机制的流式细胞检测结果,数据以平均值±SD(n=3)表示,***p<0.001;C是BMDCs摄取αM-Exos的共聚焦显微镜拍摄结果。
图3为αM-Exos促进BMDCs的成熟及抗原呈递。其中,A是PBS、Exos、B-Exos、αM-Exos、αM-NPs或Exos+αM-NPs诱导BMDCs成熟的流式细胞定量结果,数据以平均值±SD(n=3)表示,**p<0.001,***p<0.001;B是PBS、OVA、Exos、B-Exos、αM-Exos、或Exos+αM-NPs促进BMDCs抗原提呈的流式细胞定量结果,数据以平均值±SD(n=3)表示,**p<0.001,***p<0.001。
图4为αM-Exos可高效迁移至淋巴结,其中,A是DiR标记的B-Exos及αM-Exos在小鼠体内的活体成像及在腋窝淋巴结(ALNs)中的离体成像结果;B是DiR标记的B-Exos及αM-Exos在小鼠腋窝淋巴结中的荧光强度的定量结果数据以平均值±SD(n=3)表示,***p<0.001。
图5为αM-Exos诱导强烈的免疫反应。其中,A是给予PBS、B-Exos或αM-Exos的小鼠外周血CD3
图6为αM-Exos的抗肿瘤药效。其中,A为B16F10-OVA肿瘤模型小鼠的肿瘤生长曲线,数据以平均值±SD(n=6)表示,*p<0.05,***p<0.001;B为B16F10-OVA肿瘤模型小鼠肿瘤中T细胞的流式检测结果,数据以平均值±SD(n=4)表示,***p<0.001;C为B16F10-OVA肿瘤模型小鼠的生存曲线,*p<0.05,***p<0.001;D为4T1肿瘤模型小鼠的肿瘤生长曲线,数据以平均值±SD(n=5)表示,*p<0.05,***p<0.001;E为4T1肿瘤模型小鼠肿瘤中T细胞的流式检测结果;F为4T1肿瘤模型小鼠肿瘤中T细胞的流式定量结果,数据以平均值±SD(n=4)表示,*p<0.05,***p<0.001。
图7为αM-Exos的安全性评价。其中,A是给予PBS、B-Exos或αM-Exos的小鼠心,肝,脾,肺,肾的H&E染色结果;B是给予PBS、B-Exos或αM-Exos的小鼠外周血血液和血清生化分析结果,数据以平均值±SD(n=3)表示。
图8为给予PBS或Tun-Exos的小鼠外周血CD3
图9为给予PBS或Tha-Exos的小鼠外周血CD3
具体实施方式
下面通过具体实施例结合附图进一步介绍本发明。
实施例1:αM-Exos的制备和表征
通过乳化溶媒蒸发法制备载有αM的PLGA纳米制剂(αM-NPs)。精密称取20mg PLGA材料5mL EP管中,加入1mL浓度为2mg/mL的αM的二氯甲烷溶液,充分涡旋溶解,随后沿管壁缓缓加入2mL 1.0%的胆酸钠水溶液,冰浴超声(300W,工作1s,间歇2s,5min)乳化,然后立即倒入8mL 0.5%胆酸钠溶液中,磁力搅拌5min,旋转蒸发除去有机溶剂。过0.22μm微孔滤膜后,低温高速离心(14500rpm,4℃,60min),弃去上清,用PBS缓冲液重悬沉淀即得αM-NPs。将B16F10-OVA细胞与含αM-NPs(αM浓度为5μg/mL)的无血清RPMI 1640培养基共孵育4h后,换用无血清的RPMI 1640培养基继续培养36h,培养结束后收集细胞上清液,4℃,2500g离心30min除去完整细胞,4℃,10000g离心30min除去细胞碎片及微泡,过0.22μm微孔滤膜后,4℃,23000g离心1.5h,沉淀即为αM-Exos,用PBS重悬后对αM-Exos的理化性质和特征蛋白进行表征。用不含药物的PLGA纳米制剂(B-NPs)与B16F10-OVA细胞孵育后,收集到的产物为B-Exos。B16F10-OVA自然分泌的外泌体为Exos。
如图1A所示,western blot结果显示,与PBS,B-NPs相比,B16F10-OVA细胞与αM-NPs孵育后,内质网应激相关标志物PERK,GRP78 BiP及热休克蛋白GRP78 BiP,Hsp70均上调,表明αM-NPs可以诱导B16F10-OVA细胞内质网应激并上调细胞的热休克蛋白表达水平。
如图1B所示,纳米粒子追踪分析结果表明Exos粒径分布不均一,在33,91,196nm处均有分布,而B-Exos和αM-Exos的粒度分布较为均一,分别为115nm和125nm。
如图1C所示,透射电镜结果表明在αM-NPs表面,可清晰的观察到双层膜结构,表明外泌体成功覆盖在αM-NPs表面。
如图1D所示,western blot结果显示,外泌体标志物ALIX,TSG101在Exos,B-Exos和αM-Exos中均表达,而肿瘤相关抗原gp100,TRP2和热休克蛋白Hsp70,GRP78 BiP在αM-Exos中显著上调。
如图1E所示,BCA蛋白定量和纳米粒子追踪分析结果表明,αM-Exos的蛋白量和粒子数分别是Exos的15.1倍和7.4倍,表明αM-Exos具有更高的外泌体产量。
如图1F所示,ELISA结果表明,与Exos和B-Exos相比,αM-Exos的肿瘤抗原gp 100,TRP2和热休克蛋白Hsp70,GRP78 BiP含量更高。
如图1G所示,蛋白组学结果表明,与Exos和B-Exos相比,αM-Exos中肿瘤相关抗原(Pmel,Dct)和热休克蛋白(Hspa1b,Hspa1l,Hspa2,Hspa4,Hspa4l,Hspa5,Hspa14)均上调,而肿瘤转移相关蛋白(Vim,Ctnnb1)下调。
综上所述,αM-Exos具有均一的粒径分布,完整的核-壳结构,表明制剂构建成功。αM-Exos具有更高的外泌体的产量,其可以富集更多的肿瘤抗原以及热休克蛋白。
实施例2:BMDCs对αM-Exos的摄取
取小鼠未成熟的骨髓来源的树突细胞(BMDCs),分别加入含荧光染料DiI标记的Exos,B-Exos或αM-Exos(蛋白浓度均为5μg/mL)的无血清培养基,于37℃,5%CO
如图2A所示,流式细胞检测结果表明,当BMDCs与DiI标记的Exos、B-Exos或αM-Exos一起孵育时,BMDCs细胞内中DiI荧光强度随时间增加方式。而孵育4h后,DiI标记的αM-Exos在BMDCs内的积累更高,分别是DiI标记的Exos和B-Exos的2.2倍和1.6倍。
如图2B所示,流式细胞检测结果表明,BMDCs对DiI标记的αM-Exos的摄取显著被巨胞饮通路抑制剂乙基异丙基阿米洛利(EIPA),脱氧葡萄糖与叠氮化钠能量组合抑制剂(DOG+NaN3),网格蛋白内吞抑制剂氯丙嗪,小窝蛋白内吞抑制剂木黄酮抑制,抑制率分别为60.38%,42.82%,28.57%及24.32%,表明BMDCs对αM-Exos的摄取是多种途径协同的,包括巨胞饮,网格蛋白及小窝蛋白介导的内吞,且摄取过程呈能量依赖型。
如图2C所示,共聚焦显微镜拍摄结果表明,αM-Exos被BMDCs摄取后主要位于BMDCs的溶酶体中,后续进行抗原的加工呈递。
综上所述,αM-Exos可以高效被BMDCs摄取,摄取过程是多种途径协同的,包括巨胞饮,网格蛋白及小窝蛋白介导的内吞,且摄取过程呈能量依赖型。
实施例3:αM-Exos促进BMDCs的成熟及抗原呈递
对于BMDCs成熟的测定,BMDCs分别与PBS、Exos、B-Exos、αM-Exos、αM-NPs或Exos+αM-NPs(外泌体蛋白浓度为5μg/mL,αM浓度为60ng/mL)在37℃、5%CO
如图3A所示,流式细胞定量结果表明,与Exos和B-Exos相比,与αM-Exos孵育的BMDCs中的共刺激分子CD80和CD86显著上调,表明αM-Exos对刺激BMDCs的成熟具有更强的作用。
如图3B所示,流式细胞定量结果表明,与B-Exos和Exos相比,与αM-Exos孵育的BMDCs具有更高的荧光强度,表明αM-Exos可以改善BMDCs对抗原加工和呈递。
综上所述,αM-Exos可以促进BMDCs的成熟和抗原呈递。
实施例4:αM-Exos可高效迁移至淋巴结
荧光染料DiR标记的B-Exos或αM-Exos以每只小鼠50μg蛋白的剂量皮下注射到C57BL/6小鼠的足垫中。注射后2、4、8、12和24小时,在活体成像系统下对小鼠进行成像。腋窝淋巴结(ALNs)在注射后24小时后分离并离体成像。
如图4A所示,活体成像结果表明,DiR标记的αM-Exos注射后随时间在腋窝淋巴结中积累增多,注射后24小时仍保留强荧光信号,而B-Exos在不同时间点的荧光信号低于αM-Exos。在腋窝淋巴结的离体成像中,DiR标记的αM-Exos在腋窝淋巴结中的分布显著多于B-Exos。
如图4B所示,注射后24小时后分离的腋窝淋巴结中,DiR标记的αM-Exos的荧光强度是B-Exos的2.7倍。
综上所述,αM-Exos可以高效迁移并蓄积至淋巴结中。
实施例5:αM-Exos诱导强烈的免疫反应
C57BL/6小鼠分别皮下注射100μL PBS,B-Exos或αM-Exos共3次,剂量为50μg蛋白/只,注射间隔1周。最后一次注射结束后一周取外周血及脾脏分析其中免疫细胞比例及细胞因子含量。最后一次注射后40天取淋巴结分析记忆细胞比例。
如图5A,5B所示,流式细胞检测结果表明与PBS、B-Exos组相比,αM-Exos组小鼠外周血中CD3
如图5C所示,ELISA结果表明,αM-Exos组小鼠的血清中Th1型细胞因子IFN-γ、IL-2的水平显著升高,Th2型细胞因子IL-4、IL-10的显著降低。
如图5D-5F所示,流式细胞检测结果表明,αM-Exos组小鼠脾脏细胞中细胞比例升高,且脾脏细胞培养基上清中Th1型细胞因子IFN-γ水平显著升高,Th2型细胞因子IL-4、IL-10的无显著变化。
如图5G,5H所示,流式细胞检测结果表明,αM-Exos组小鼠淋巴结中效应记忆(CD3
如图5I所示,αM-Exos组小鼠外中血中活化的(NKG2D
综上所述,αM-Exos可以调节不同的T细胞亚群、细胞因子及NK细胞,诱导强烈且持久的免疫反应,以进一步应用于肿瘤免疫治疗。
实施例6:αM-Exos的抗肿瘤药效
在小鼠B16F10-OVA皮下瘤模型中,5×10
如图6A-6C所示,在B16F10-OVA肿瘤模型中,与PBS,B-Exos相比,αM-Exos可以显著抑制B16F10-OVA肿瘤的生长,且增加肿瘤中CD3
如图6D-6F所示在4T1原位肿瘤模型中,与PBS,B-Exos相比,αM-Exos可以显著抑制4T1肿瘤的生长,增加肿瘤中CD3
综上所述,αM-Exos可以治疗多种肿瘤,并且与aPD1联用后,治疗效果更加显著。
实施例7:αM-Exos的安全性评价
将C57BL/6小鼠随机分为3组。每只小鼠皮下注射100μL的B-Exos或αM-Exos,给药剂量为50μg/只,共给药三次,给药间隔为1周。以注射PBS溶液作为阴性对照。治疗结束后,收集小鼠的心,肝,脾,肺,肾,石蜡包埋后进行H&E染色,显微镜下观察脏器形态。同时,收集小鼠外周血进行血液和血清生化分析。
如图7A所示,H&E染色结果表明,与PBS组相比,B-Exos和αM-Exos组小鼠心脏、肝脏、脾脏、肺和肾没有任何明显的形态学变化。
如图7B所示,外周血血液和血清生化分析结果表明,与PBS组相比,B-Exos和αM-Exos组红细胞计数(RBC),天冬氨酸转氨酶(AST)或血尿素氮(Bun)没有显著差异。
综上所述,αM-Exos具有良好的生物安全性。
实施例8:Tun-Exos诱导强烈的免疫反应
用Tun和PCL制备装载有Tun的PCL纳米制剂(Tun-NPs),将B16F10-OVA细胞与含Tun-NPs的无血清RPMI 1640培养基共孵育4h后,换用无血清的RPMI 1640培养基继续培养36h,培养结束后收集细胞上清液,4℃,2500g离心30min除去完整细胞,4℃,10000g离心30min除去细胞碎片及微泡,过0.22μm微孔滤膜后,4℃,23000g离心1.5h,沉淀即为Tun-Exos。C57BL/6小鼠分别皮下注射100μL PBS,Tun-Exos共3次,剂量为50μg蛋白/只,注射间隔1周。最后一次注射结束后一周取外周血分析其中免疫细胞比例
如图8所示,与PBS组相比,Tun-Exos组小鼠外周血中CD3
实施例9:Tha-Exos诱导强烈的免疫反应
用Tha和PLA制备装载有Tha的PLA纳米制剂(Tha-NPs),将B16F10-OVA细胞与含Tha-NPs的无血清RPMI 1640培养基共孵育4h后,换用无血清的RPMI 1640培养基继续培养36h,培养结束后收集细胞上清液,4℃,2500g离心30min除去完整细胞,4℃,10000g离心30min除去细胞碎片及微泡,过0.22μm微孔滤膜后,4℃,23000g离心1.5h,沉淀即为Tha-Exos。C57BL/6小鼠分别皮下注射100μL PBS,Tha-Exos共3次,剂量为50μg蛋白/只,注射间隔1周。最后一次注射结束后一周取外周血分析其中免疫细胞比例
如图9所示,与PBS组相比,Tha-Exos组小鼠外周血中CD3
- 一种以四苯乙烯吲哚衍生物为光敏剂的纳米复合材料及制备方法和在肿瘤治疗方面的应用
- 一种具有pH响应性的两亲性白及多糖衍生物纳米颗粒及其制备方法和应用
- 一种氧化石墨烯上生长碳纳米片矩阵衍生碳纳米复合材料的制备方法
- 一种三氧化钨纳米空心球半导体材料及其制备方法、一种气敏传感器及其制备方法和应用
- 神经系统肿瘤细胞自噬体的制备方法及其在制备疫苗中的用途
- 一种靶向肿瘤细胞的壳聚糖衍生物纳米级超声造影剂及其制备方法与应用
- 一种靶向肿瘤细胞的壳聚糖衍生物纳米级超声造影剂及其制备方法与应用
