一种同轴集成的植入式光燃料传感器以及持久性有机污染物的检测方法
文献发布时间:2024-04-18 19:52:40
技术领域
本发明属于光电化学传感领域,尤其是涉及一种同轴集成的植入式光燃料传感器及其制备方法和在持久性有机污染物方面的检测应用。
背景技术
持久性有机污染物是指具有高毒性、持久性、生物蓄积性和长距离迁移性的人工合成化学品,其在环境中无处不在,已成为全球关注的主要环境污染问题。持久性有机污染物泄漏到环境中可通过食物链进行生物积累和生物放大,最终对人体健康造成严重的负面影响,如内分泌障碍、免疫和生殖系统功能障碍、发育性神经毒性以及某些癌症等。因此,迫切需要一种快速、灵敏、便携式和现场检测持久性有机污染物的分析方法,这是评估其环境风险的关键一步。鱼类作为人类膳食中的重要组成部分,能从饮食来源和鳃膜中积累持久性有机污染物,导致其组织中的污染物富集比周围水域高,是人类蓄积持久性有机污染物的主要来源。因此,鱼类中持久性有机污染物的原位定量检测对于全面评估持久性有机污染物对生态环境和人类健康的危害具有重要意义。
传统的动物样品中污染物的分析技术通常需要破坏或杀死生物体,不仅对动物不道德,对濒危物种不利,而且不能反映持久性有机污染物在活体内的真实积累和变化状态。固相微萃取技术虽然可以实现活体内原位取样,但是后续需要复杂的洗脱步骤并且要用大型仪器如高效液相色谱进行样品分析,难以实现目标污染物现场监测和及时反馈。在各种体内和原位分析技术中,电化学传感以其高时空分辨率、设备简单等优点得到了广泛应用。光电化学传感器作为电化学分析的进化产物,不仅继承了上述优点,而且由于光激发信号与电检测信号的分离而具有更高的灵敏度。此外,由只有阳极和阴极的光燃料电池构成的自供电光电化学传感器可以在没有外接电源的情况下工作,更容易实现设备便携和低成本检测。但是,目前的光电化学活体传感器基本上都需要植入一个分离的三电极系统,包括光阳极、参比电极和对电极,这容易导致以下三个问题:1)复杂的活体环境中的生物大分子对三个电极都造成生物污染,体内的电活性小分子容易干扰光阳极,同时光阳极上的光活性材料也可能对活体造成生物毒性;2)无法精确控制在自由活动的动物体内植入电极之间的距离,从而影响检测精度;3)多个电极附加光源植入活体需要多次插入操作,会对生物体造成较大的机械损伤。
发明内容
本发明所要解决的技术问题是针对上述现有技术存在的不足而提供一种同轴集成的植入式光燃料传感器及其制备方法和在持久性有机污染物方面的检测应用,解决了单独植入多个电极以及光源到复杂环境造成的灵敏度较低、选择性较差、易被污染、难以实现原位检测等问题。
本发明为解决上述提出的问题所采用的技术方案为:
一种同轴集成的植入式光燃料传感器,包括光阳极、生物阴极和燃料,所述的光阳极是以导光光纤为基底,在其一端依次修饰金层和碳纳米管以及Ag
按上述方案,所述燃料注入生物阴极内,光阳极插入生物阴极内与燃料相接触,光阳极和生物阴极处于同轴。
按上述方案,所述碳纳米管可以为多壁碳纳米管或者单壁碳纳米管等。
上述同轴集成的植入式光燃料传感器的制备方法,主要包括如下步骤:
S1.选取玻璃毛细管和导光光纤,玻璃毛细管的内径大于导光光纤的直径;
S21.在S1所述玻璃毛细管的一端采用种子介导生长法修饰金层,然后通过金硫键在金层表面修饰能特异性识别目标物的核酸适配体,并用6-巯基-1-己醇(MCH)溶液封闭活性位点,得到玻璃毛细管/金层/核酸适配体电极;
S22.将全氟化树脂溶液注入玻璃毛细管/金层/核酸适配体电极的修饰端,干燥后在该电极修饰端的端口处形成一层质子交换膜,得到生物阴极;
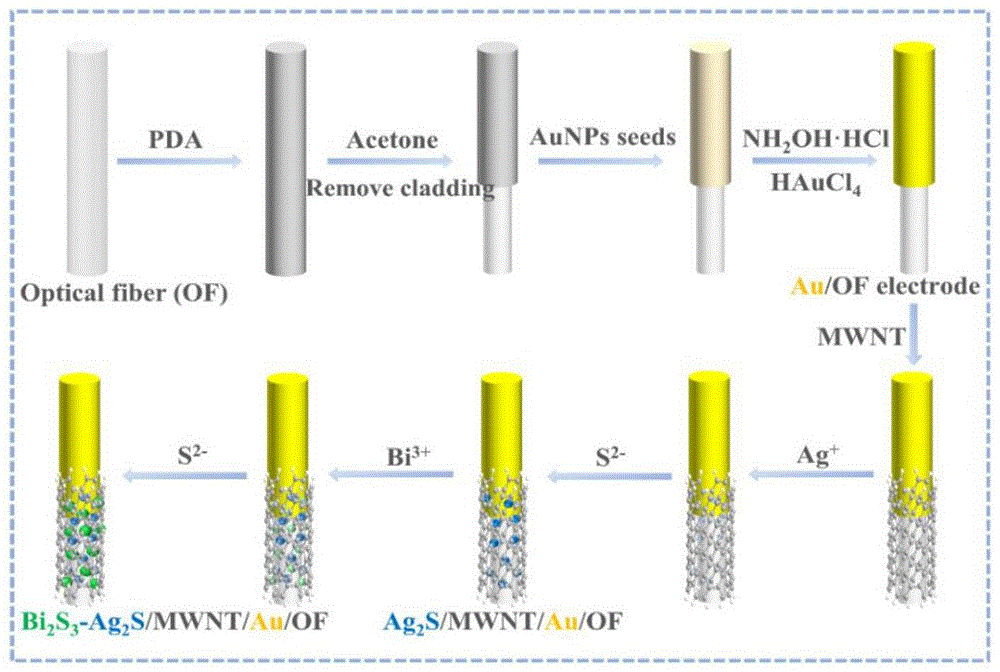
S31.在S1所述导光光纤的一端采用种子介导生长法修饰金层,然后在金层表面利用层层自组装法修饰多壁碳纳米管(MWNT),得到光纤/金层/MWNT电极;
S32.在光纤/金层/MWNT电极的修饰端利用连续离子层吸附修饰具有高光电转换效率的Ag
S4.将燃料抗坏血酸溶液灌入S22所得生物阴极内,并将S32所得光阳极的修饰端插入生物阴极内与燃料相接触,即得到同轴集成的植入式光燃料传感器。
按上述方案,透明导光光纤的直径优选在100~200μm,修饰端的长度优选在2~3cm;所述玻璃毛细管的内径和外径分别优选在250~350μm和350~450μm,修饰端的长度优选在1.5~2.5cm。进一步地,所述玻璃毛细管修饰端包括直管段以及位于直管段一端的缩口段(用拉制仪拉制而成),缩口段尖端直径优选在35~45μm。
按上述方案,S21中生长金层的方法为:将玻璃毛细管的一端在多巴胺溶液浸泡0.5~1.5h,水洗干燥后在金种中浸泡10~13h,最后在盐酸羟胺和氯金酸的混合溶液中静置生长金层,水洗干燥即可。其中,多巴胺溶液浓度在1~2mg/mL范围内,金种是指含金纳米粒子的水溶液,浓度优选在50~100μg/mL范围内;盐酸羟胺和氯金酸的混合溶液中,盐酸羟胺和氯金酸各自浓度优选在0.5~1.5mM和0.03~0.07wt%范围内,静置生长3~5min。
按上述方案,S21中通过金硫键修饰核酸适配体的方法为:首先,将巯基化核酸适配体溶于5~20mM PBS缓冲溶液(pH 7.0~7.5)中,浓度在6~10μM范围内,然后加入三(2-羧乙基)膦(TCEP)水溶液活化适配体1~3h(TCEP在适配体溶液中的浓度为0.2~1mM),得到适配体溶液;然后,将玻璃毛细管生长有金层的一端置于上述适配体溶液中在4℃下孵育12~20h,取出后用PBS缓冲溶液清洗;最后,再将其置于0.5~2mM 6-巯基-1-己醇(MCH)水溶液中封闭1~3h,再次取出用PBS缓冲溶液清洗,得到玻璃毛细管/金层/核酸适配体电极。
按上述方案,S22的具体操作方法为:将全氟磺酸树脂溶液(Nafion)注入到毛细玻璃管/金层/核酸适配体电极的修饰端端口,然后室温下固化在该端口形成质子交换膜。其中,Nafion溶液的浓度在0.4~0.6wt%范围,注入体积在0.04~0.06μL范围内,能实现在修饰端的端口固化形成质子交换膜即可。
按上述方案,S31中生长金层的方法为:将干净的导光光纤在1~2mg/mL多巴胺溶液中浸泡1.5~2.5h后水洗干燥,然后采用丙酮浸泡处理2~4s去掉光纤前端0.7~0.9cm的聚多巴胺层和光纤包层使其能在前端透光,水洗干燥后,将该端1.5~2.5cm在金种中浸泡3~5h,再在盐酸羟胺和氯金酸的混合溶液中静置生长3~5min,水洗干燥即可(注:该光纤前端0.7~0.9cm这一段未生长金层)。金种是指含金纳米粒子的水溶液,浓度优选在50~100μg/mL范围内;盐酸羟胺和氯金酸的混合溶液中,盐酸羟胺和氯金酸各自浓度优选在0.5~1.5mM和0.03~0.07wt%范围内。
进一步地,S31、S21中,导光光纤和玻璃毛细管生长金层后,电阻在10~20Ω。
按上述方案,S31和S32中,金层与碳纳米管未完全重叠,而是在该修饰端部分重叠,碳纳米管的修饰区域相对金层的修饰区域更靠近(或者说是延伸至)光纤修饰端的端口方向,且碳纳米管的修饰区域大于金层的修饰区域,即金层修饰区域未延伸至修饰端端口,距离修饰端端口存在一小段距离(比如0.7~0.9cm),而碳纳米管修饰区域延伸至修饰端端口,碳纳米管的修饰区域包括金层修饰区域以及光纤前端未修饰金层的区域;Ag
按上述方案,S31中层层自组装法修饰碳纳米管的方法为:将生长金层后的光纤置于聚二烯丙基二甲基氯化铵(PDDA)水溶液中进行吸附,用水浸洗后再置于羧基化碳纳米管水溶液中进行吸附,此为S31中的一个循环;一个循环后,进行水洗干燥,然后进行下一个循环,实现碳纳米管修饰。其中,循环次数的范围是3~5次;PDDA的浓度0.5~1.5wt%,吸附时间在4~6min;羧基化碳纳米管水溶液的浓度在0.4~0.6mg/mL范围内,吸附时间各自4~6min。
按上述方案,S32中在光纤/金层/MWNT电极上利用连续离子层吸附修饰Ag
按上述方案,S4中,燃料抗坏血酸溶液的浓度在20~100mM,在生物阴极内的灌注高度要高于光阳极修饰端。
按上述方案,所述目标物为持久性有机污染物,本发明以3,3’,4,4’-四氯联苯(PCB77)为例;能特异性识别3,3’,4,4’-四氯联苯(PCB77)的核酸适配体为SH-Aptamer,序列是5′-SH-(CH
上述同轴集成的植入式光燃料传感器在检测3,3’,4,4’-四氯联苯(PCB77)方面的应用,具体应用方法为:将所述同轴集成的植入式光燃料传感器插入PCB77溶液中,并用激光源照射光阳极的非修饰端,光随着光纤传输到光阳极的修饰端激发上面修饰的Ag
按上述方案,所述待测样本可以是鱼、老鼠、植物等活体,也可以是血液、尿液等溶液。
按上述方案,所述电位计可以是电化学工作站,也可以是便携式电位计。便携式电位计可以用能进行电位读数的便携式pH计代替。
本发明还提供一种同轴集成的植入式光燃料传感器系统,包括本发明上述同轴集成的植入式光燃料传感器和光源以及电位计;其中同轴集成的植入式光燃料传感器用于插入待测物中,光源与传感器的光阳极可以通过光阳极的基底光纤进行连接,传感器的生物阴极和光阳极的金层采用细铜丝分别与电位计的两端电连接。光源的波长为能够激发Ag
本发明的检测原理为:光纤表面修饰的光活性材料Ag
与现有技术相比,本发明的有益成果是:
1、本发明制备的同轴集成的植入式光燃料传感器,光阳极藏在生物阴极内,固定并缩短了光阳极与生物阴极之间的距离,减少光阳极的生物污染,提高了传感灵敏度和准确性;
2、本发明制备的同轴集成的植入式光燃料传感器可以消除复杂活体环境或溶液环境中电活性小分子对光阳极的干扰以及克服光活性材料可能存在的生物毒性;
3、本发明制备的同轴集成的植入式光燃料传感器减少了在活体中额外插入参比电极、对电极和光源所造成的损伤,极大程度上降低了对活体组织的机械损伤;
4、本发明制备的同轴集成的植入式光燃料传感器能应用于鱼脑等活体中PCB77的生物积累水平的原位监测,体内PCB77的波动可以通过现场手持电位计直接反映,为活体原位监测技术提供了重要的技术突破。
综上所述,本发明所述同轴集成的植入式光燃料传感器实现了在现场采用便携式电位计进行快速原位检测活体内持久性有机污染物,兼具灵敏度高、抗污染性良好、生物相容性优良、生物毒性低、植入损伤小等优势;并且,成本便宜,可以在没有外部电压的情况下工作,具有便携化和低成本的性能,适用于多种目标物的现场检测。
附图说明
图1为本发明光阳极的制备过程示意图;其中,Optical fiber(OF)表示光纤,PDA为聚多巴胺,Acetone为丙酮,Remove cladding表示去除包层,AuNPs seeds表示金种。
图2为本发明生物阴极的制备过程示意图;其中,Glass capillary表示玻璃毛细管,Au-decorated表示修饰金层,PCB77 aptamer表示PCB77适配体,MCH为巯基己醇。
图3为应用例1的线性关系图;
图4为应用例2同轴集成的植入式光燃料传感器活体检测示意图;
图5为应用例2的鱼在污染物溶液中暴露不同浓度PCB77不同时间的鱼脑富集污染物浓度的测试结果图。
图6为应用例2的用我们构建的传感器和气相色谱法测定不同浓度PCB77暴露6天后鱼脑中的PCB77浓度的测试结果对比图。
具体实施方式
为了更好地理解本发明,下面结合实施例进一步阐明本发明的内容,但本发明不仅仅局限于下面的实施例。
下述实施例中,导光光纤和玻璃毛细管生长金层后,电阻在10~20Ω。
实施例
一种同轴集成的植入式光燃料传感器的制备方法,具体步骤如下:
S11.用拉制仪将内径300μm、外径400μm的毛细管在拉制仪下进行拉制,得到尖端端口直径为40μm的锥形玻璃毛细管;将能特异性识别目标物PCB77的核酸适配体SH-Aptamer溶于10mM PBS(pH=7.4)溶液中,得到8μM的适配体溶液,并加入0.5mM TCEP活化适配体2h;
S12.将毛细玻璃管的尖端(约2cm长)在1.5mg/mL的多巴胺溶液浸泡1h,水洗干燥后在金种中浸泡12h,最后在1mM盐酸羟胺和0.05wt%的氯金酸的混合溶液中静置生长4min,水洗干燥;然后接着置于S11所得适配体溶液中在4℃下孵育16h,取出后,用10mM PBS(pH=7.4)缓冲溶液清洗后,再在1mM MCH溶液中封闭2h,取出后,再次用10mM PBS(pH=7.4)缓冲溶液清洗后得到毛细玻璃管/金层/核酸适配体电极;
S13.取0.05μL 0.5%Nafion 117全氟化树脂溶液注入到毛细玻璃管/金层/核酸适配体电极(即缩口段)的尖端,在室温下固化尖端端口形成Nafion 117膜,由此得到生物阴极;
S21.将干净的长度为7cm,直径为125μm的透明导光光纤的前端(前端约2cm长)在1.5mg/mL的多巴胺溶液浸泡2h,水洗干燥,采用丙酮处理3s去掉光纤前端(0.8cm)的聚多巴胺层和光纤包层使其能在前端透光,水洗干燥后在金种中浸泡4h,最后在1mM盐酸羟胺和0.05%的氯金酸的混合溶液中静置生长4min,水洗干燥,得到前端生长有金层的光纤,其中,光纤的金层修饰区域的纵向长度约1.7cm,该金层修饰区域距离该光纤修饰端的端口的距离约0.8cm;
S22.将S21所得光纤前端在含1wt%PDDA溶液中吸附5min,用水浸洗后在0.5mg/mL羧基化MWNT溶液中吸附5min,此为一个循环;共4个循环,水洗干燥,得到光纤/金层/MWNT电极;光纤修饰端最前端0.8cm部分没有修饰金层,但修饰了碳纳米管,碳纳米管修饰区域的纵向长度约2.5cm;
S23.将光纤/金层/MWNT电极的修饰端在黑暗环境下置于0.1M AgNO
S3.将S13所得生物阴极内灌注“燃料”抗坏血酸(50mM),将S23制备的光阳极修饰端插入生物阴极的修饰端,抗坏血酸溶液要高于光阳极修饰端的高度,即得到同轴集成的植入式光燃料传感器,可以用于活体内跟踪检测持久性有机污染物。
应用例1
采用实施例制备的同轴集成的植入式光燃料传感器对缓冲溶液中的PCB77进行检测。以650nm的激光笔作为光源,用便携式pH计测量开路电位,将同轴集成的植入式光燃料传感器插入含有不同浓度PCB77的缓冲溶液中,并用激光笔与光阳极的非修饰端连接,生物阴极和光阳极分别与pH计的两端通过铜丝连接,然后测定开路电压,得到该同轴集成的植入式光燃料传感器对系列浓度的PCB77的响应信号如表1所示。
表1PCB77测试结果
分析表1数据可知,该植入式光燃料传感器对PCB77系列浓度响应随着浓度的增加,产生的开路电位信号逐渐减小;线性拟合发现开路电位变化值ΔOCP(目标物的OCP与背景的OCP之差)与PCB77浓度的对数之间呈线性关系(附图3),所得回归方程为:ΔOCP=22.6+12.21lg C(R
应用例2
采用实施例制备的同轴集成的植入式光燃料传感器对鱼脑内富集的PCB77进行原位监测,具体过程如下:
在进行体内试验之前,将鱼放入含脱氯自来水的充气水族箱中两周,以适应饲料。将36尾草鱼分为4组(每50L水族箱(40L水)9尾鱼),分别在0(对照组)、0.1、1、10ng/mLPCB77水中饲养3、6、9天。为了保持水中PCB77浓度稳定,每12小时更换三分之二的污染水,每天监测水质(pH 6.8±0.2,溶解氧7.0±0.3mg/L,温度25±0.7℃)。在每个暴露间隔结束时,每个水族箱取出3条鱼进行体内PCB77的光电化学检测。
体内分析首先用0.03%丁香酚麻醉鱼,直到失去垂直平衡。然后用一根26号针灸针沿着鱼身轴线在两只眼睛的中点刺入鱼头,插入约7mm,以穿透头骨;之后,将针取出,将集成传感器插入约孔中1.7cm,以穿透整个大脑。同时,以650nm的激光笔作为激发源,激光笔与光阳极的非修饰端连接,生物阴极和光阳极分别通过其表面的金层与pH计的两端以铜丝连接。最后,将鱼放入淡水中恢复垂直平衡,同时通过pH计检测OCP响应。
对暴露于不同浓度的PCB77和不同时间的鱼的大脑中PCB77的浓度进行了监测(如图5),结果显示对照组鱼脑中(无PCB77暴露)的传感器的OCP信号在整个实验过程中基本保持不变,说明传感器背景稳定,PCB77在鱼脑中的积累与暴露剂量和暴露时间呈正相关,证实构建的光燃料微传感器可以直接跟踪持久性有机污染物在活体中的生物积累水平。最后,采用气相色谱法检测了鱼脑中的PCB77浓度,所得结果与所制备的微传感器检测结果非常接近(如图6),证明了本发明所述光燃料传感器具有较高的可靠性。
根据上述说明书的揭示和教导,本发明所属领域的技术人员还可以对上述实施方式进行变更和修改。因此,本发明并不局限于上面揭示和描述的具体实施方式,对发明的一些修改和变更也应当落入本发明的权利要求的保护范围内。此外,尽管本说明书中使用了一些特定的术语,但这些术语只是为了方便说明,并不对本发明构成任何限制范围。
- 一种基于相变结晶的光纤光镊分子俘获方法、持久性有机污染物的拉曼光谱检测方法
- 一种基于相变结晶的光纤光镊分子俘获方法、持久性有机污染物的拉曼光谱检测方法
