预防和/或治疗血栓栓塞性疾病的方法
文献发布时间:2024-04-18 19:52:40
技术领域
本申请涉及生物医药领域,具体的涉及一种预防和/或治疗血栓栓塞性疾病的方法。
背景技术
人体凝血途径分为内源性和外源性两种凝血途径。外源性凝血途径起始于组织损伤后TF的释放,TF与FVII形成复合物,进而激活FIX和FX。内源凝血途径主要由带负电荷分子结合的FXII因子活化启动,FXII被活化成FXIIa,活化的FXIIa激活FXI变成FXIa,FXIa然后激活下游FIX,在辅因子FVIII的作用下激活FX。外源和内源凝血途径活化的FXa和FVa共同构成凝血酶原复合物激活凝血酶原(FII),产生有活性凝血酶和纤维蛋白凝块,最终造成凝血。
FXI是内源凝血通路中的因子之一,以二聚体形式存在,其单体由4个Apple结构域和一个丝氨酸蛋白酶结构域组成,活化后的FXIa具有蛋白水解酶活性,活化其主要底物FIX,促使凝血酶产生。除了底物FIX,FXIa还可以活化FX、FV和FVIII。
FXI的缺乏可以对血栓性疾病起到保护作用。而靶向FXI的药物并无已上市产品,因此亟需开发针对FXI的抗血栓性疾病的药物。
发明内容
本申请提供了一种预防和/或治疗血栓栓塞性疾病的方法。利用本申请所述的凝血因子XI(FXI)结合蛋白,可以有效地治疗防和/或治疗血栓栓塞性疾病。例如,可以在体内预防血栓形成;可以有效地减少血栓重量;可以延长APTT;和/或可以降低血小板的聚集率。
一方面,本申请提供一种预防和/或治疗血栓栓塞性疾病的方法,其包括以下步骤:向有需要的受试者施用凝血因子XI(FXI)结合蛋白,其中可以包含至少一个能够特异性结合FXI的免疫球蛋白单一可变结构域,所述至少一个免疫球蛋白单一可变结构域可以包含SEQ IDNO:4、10和14中任一项所示的VHH中的CDR1、CDR2和CDR3。
在某些实施方式中,所述FXI结合蛋白包含第一免疫球蛋白单一可变结构域和第二免疫球蛋白单一可变结构域,其中,第一免疫球蛋白单一可变结构域包含SEQ ID NO:14所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域包含SEQ ID NO:17所示的VHH中的CDR1、CDR2和CDR3。
在某些实施方式中,所述血栓栓塞性疾病包括静脉血栓栓塞(VTE)。
在某些实施方式中,所述静脉血栓栓塞属于肿瘤的并发症,和/或关节置换术的并发症。
在某些实施方式中,所述静脉血栓栓塞与外周静脉植入中心静脉导管(PICC)相关。
在某些实施方式中,所述受试者患有静脉血栓栓塞(VTE),或具有患有VTE的风险。
在某些实施方式中,所述受试者为肿瘤患者。
在某些实施方式中,所述受试者的外周静脉植入了中心静脉导管(PICC)。
在某些实施方式中,所述静脉血栓栓塞与髋关节和/或膝关节的关节置换术相关。
在某些实施方式中,所述受试者为关节置换者。
在某些实施方式中,所述受试者的髋关节和/或膝关节被置换。
在某些实施方式中,所述血栓栓塞性疾病包括深静脉血栓形成(DVT)。
在某些实施方式中,所述深静脉血栓形成包括急性深静脉血栓形成和/或急性深静脉血栓形成发生后的深静脉血栓形成复发。
在某些实施方式中,所述静脉血栓栓塞包括肺血栓栓塞(PTE)。
在某些实施方式中,所述受试者患有深静脉血栓形成(DVT),或具有患有DVT的风险。
在某些实施方式中,所述受试者患有急性深静脉血栓形成和/或急性深静脉血栓形成发生后的深静脉血栓形成复发。
在某些实施方式中,所述受试者患有肺血栓栓塞(PTE)。
在某些实施方式中,所述血栓栓塞性疾病包括全身性血栓栓塞。
在某些实施方式中,所述全身性血栓栓塞属于肿瘤的并发症,房颤的并发症,和/或透析的并发症。
在某些实施方式中,所述房颤包括非瓣膜性房颤。
在某些实施方式中,所述受试者患有全身性血栓栓塞,或具有患有全身性血栓栓塞的风险。
在某些实施方式中,所述受试者患有非瓣膜性房颤。
在某些实施方式中,所述受试者为透析患者。
在某些实施方式中,所述受试者为成年人。
在某些实施方式中,所述受试者患有高血压、糖尿病、充血性心力衰竭、房颤和/或具有卒中史。
在某些实施方式中,所述受试者的年龄为至少75岁。
在某些实施方式中,所述受试者长期卧床。
在某些实施方式中,所述CDR可以是Kabat CDR、AbM CDR、Chothia CDR或IMGTCDR。
在某些实施方式中,SEQ ID NO:4所示的VHH中的CDR1、CDR2和CDR3选自以下的任一组:SEQ ID NO:60-62,SEQ ID NO:63-65,SEQ ID NO:66-68,SEQ ID NO:69-71。
在某些实施方式中,所述至少一个免疫球蛋白单一可变结构域可以包含SEQ IDNO:4、306-311之一所示氨基酸序列。
在某些实施方式中,SEQ ID NO:10所示的VHH中的CDR1、CDR2和CDR3选自以下的任一组:SEQ ID NO:132-134,SEQ ID NO:135-137,SEQ ID NO:138-140,SEQ ID NO:141-143。
在某些实施方式中,所述至少一个免疫球蛋白单一可变结构域可以包含SEQ IDNO:10、312-317之一所示氨基酸序列。
在某些实施方式中,SEQ ID NO:14所示的VHH中的CDR1、CDR2和CDR3选自以下的任一组:SEQ ID NO:180-182,SEQ ID NO:183-185,SEQ ID NO:186-188,SEQ ID NO:189-191。
在某些实施方式中,所述至少一个免疫球蛋白单一可变结构域可以包含SEQ IDNO:14、318-328之一所示氨基酸序列。
在某些实施方式中,所述的凝血因子XI(FXI)结合蛋白结合FXI的Apple2结构域。
在某些实施方式中,所述的凝血因子XI(FXI)结合蛋白还可以包含免疫球蛋白Fc区。
在某些实施方式中,所述免疫球蛋白Fc区的氨基酸序列如SEQ ID NO:336所示。
在某些实施方式中,所述凝血因子XI(FXI)结合蛋白的给药剂量为约0.5mg/Kg-约10mg/kg。
在某些实施方式中,所述方法还包括向所述受试者施用:编码本申请所述的凝血因子XI(FXI)结合蛋白的核酸分子、可以包含与表达调控元件可操作地连接的所述核酸分子的表达载体、可以包含所述核酸分子或以所述表达载体转化并能够表达所述凝血因子XI(FXI)结合蛋白的细胞,和/或可以包含所述凝血因子XI(FXI)结合蛋白以及药学上可接受的载体的药物组合物。
另一方面,本申请提供了一种凝血因子XI(FXI)结合蛋白在制备药物中的用途,所述药物用于预防和/或治疗血栓栓塞性疾病,其中所述凝血因子XI(FXI)结合蛋白可以包含至少一个能够特异性结合FXI的免疫球蛋白单一可变结构域,所述至少一个免疫球蛋白单一可变结构域可以包含SEQ ID NO:4、10和14中任一项所示的VHH中的CDR1、CDR2和CDR3。
另一方面,本申请提供了一种凝血因子XI(FXI)结合蛋白,其用于预防和/或治疗血栓栓塞性疾病,其中所述凝血因子XI(FXI)结合蛋白可以包含至少一个能够特异性结合FXI的免疫球蛋白单一可变结构域,所述至少一个免疫球蛋白单一可变结构域可以包含SEQIDNO:4、10和14中任一项所示的VHH中的CDR1、CDR2和CDR3。
本领域技术人员能够从下文的详细描述中容易地洞察到本申请的其它方面和优势。下文的详细描述中仅显示和描述了本申请的示例性实施方式。如本领域技术人员将认识到的,本申请的内容使得本领域技术人员能够对所公开的具体实施方式进行改动而不脱离本申请所涉及发明的精神和范围。相应地,本申请的附图和说明书中的描述仅仅是示例性的,而非为限制性的。
附图说明
本申请所涉及的发明的具体特征如所附权利要求书所显示。通过参考下文中详细描述的示例性实施方式和附图能够更好地理解本申请所涉及发明的特点和优势。对附图简要说明书如下:
图1显示的是本申请所述凝血因子XI(FXI)结合蛋白对人血浆APTT的延长作用结果。
图2显示的是本申请所述凝血因子XI(FXI)结合蛋白对食蟹猴血浆APTT的延长作用结果。
图3显示的是本申请所述凝血因子XI(FXI)结合蛋白对兔血浆APTT的延长作用结果。
图4显示的是本申请所述凝血因子XI(FXI)结合蛋白对鼠血浆APTT的延长作用结果。
图5显示的是本申请所述凝血因子XI(FXI)结合蛋白对血栓重量的抑制作用。
图6显示的是本申请所述凝血因子XI(FXI)结合蛋白对APTT的延长作用。
图7显示的是本申请所述凝血因子XI(FXI)结合蛋白对血小板聚集能力的影响。
图8显示的是本申请所述凝血因子XI(FXI)结合蛋白对PT的影响。
图9显示的是本申请所述凝血因子XI(FXI)结合蛋白对出血的影响。
具体实施方式
以下由特定的具体实施例说明本申请发明的实施方式,熟悉此技术的人士可由本说明书所公开的内容容易地了解本申请发明的其他优点及效果。
术语定义
在本申请中,术语“血栓栓塞性疾病”包括血栓形成和血栓栓塞两种病理过程所引起的疾病。血栓形成通常是指在一定条件下,血液有形成分在血管内(多数为小血管)形成栓子,造成血管部分或完全堵塞,相应部位血液供应障碍的病理过程。血栓栓塞通常是指血栓由形成部位脱落,在随血流移动的过程中部分或全部堵塞某些血管,引起相应组织和(或)器官缺血、缺氧、坏死(动脉血栓)及淤血、水肿(静脉血栓)的病理过程。所述血栓栓塞性疾病按发生血栓形成的血管类型可以包括(1)静脉血栓栓塞性疾病:即静脉血栓栓塞症,例如可以包括肺血栓栓塞、深静脉血栓形成;(2)动脉血栓栓塞性疾病:例如可以包括急性冠状动脉综合征、房颤、动脉缺血发作、脑卒中;(3)微血管血栓性疾病:例如可以包括弥散性血管内凝血(DIC)、血栓性血小板减少性紫癜等。
在本申请中,术语“静脉血栓栓塞(VTE)”通常是指静脉内血液斑块形成的情况:血液在静脉内不正常的凝结,使血管完全或不完全阻塞,属静脉回流障碍性疾病。所述静脉血栓栓塞可以常见于下肢的深静脉内。栓子可能从它生成的部位脱落,并进入血液循环,从而称为栓塞。所述静脉血栓栓塞可以由以下因素引起:血流的中断(例如,长期卧床石膏或支架制动,特别是合并有脱水和既往的静脉疾病(慢性静脉功能不全))、静脉壁受损(例如,手术、创伤或炎症)、或者血栓形成倾向(例如,促凝因子或特深药物导致的凝血和纤溶之间的不平衡)。
在本申请中,术语“并发症”通常是指一种疾病在发展过程中引起另一种疾病或症状的发生,后者即为前者的并发症。在某些情况下,所述并发症也可以包括在治疗过程中,由患一种疾病合并发生了与这种疾病有关的另一种或几种疾病。
在本申请中,术语“外周静脉植入中心静脉导管(PICC)”通常是指经外周静脉穿刺置入中心静脉的导管(即Peraipherally Inserted Central Catheter)。所述外周静脉植入中心静脉导管可以从肘部或上臂的静脉置入,然后沿着静脉的走向前行,导管最终被送到接近心脏的大血管处。所述PICC可以具有长期、安全、无痛的特点,可以应用于长期静脉治疗及输注高渗性、有刺激性药物的患者。所述PICC可能会引发感染、血栓、静脉炎等并发症。
在本申请中,术语“关节置换术”通常是指根据人体关节的形态、构造及功能制成人工关节假体,通过外科植入人体内的技术。例如,所述人工关节假体可以由人工材料制备,例如,金属、高分子聚乙烯和/或陶瓷。
在本申请中,术语“深静脉血栓形成(DVT)”通常是指血液在深静脉内不正常凝结,引起的病症。所述深静脉血栓形成可以发生于下肢,骨科大手术后常发生。所述深静脉血栓脱落可引起肺栓塞(pulmonary embolism,PE),合称为静脉血栓栓塞症。所述深静脉血栓形成可以由以下的因素引起:静脉血流滞缓、静脉壁损伤和血液高凝状态。
在本申请中,术语“肺血栓栓塞(PTE)”通常是指来自静脉系统或右心的血栓阻塞肺动脉或其分支所导致的以肺循环和呼吸功能障碍为主要临床和病理生理特征的疾病。引起PTE的血栓主要来源于深静脉血栓形成(DVT),PTE和DVT可以合称为静脉血栓栓塞症(VTE)。所述PTE的引起因素可以包括遗传性因素(例如,遗传变异)和获得性因素(例如,手术、创伤、急性内科疾病(如心力衰竭、呼吸衰竭、感染等)、某些慢性疾病(如抗磷脂综合征、肾病综合征等)和恶性肿瘤)。
在本申请中,术语“房颤”通常是指心房颤动,是一种常见的心律失常。是指规则有序的心房电活动丧失,代之以快速无序的颤动波,是严重的心房电活动紊乱。所述房颤可以与冠心病、高血压病和/或心力衰竭相关。所述房颤可以分为首诊房颤、阵发性房颤、持续性房颤、长程持续性房颤和永久性房颤。所述房颤可以导致心力衰竭、动脉栓塞等并发症,严重时甚至诱发猝死。
在本申请中,术语“非瓣膜性房颤”通常是指无风湿性二尖瓣狭窄、生物瓣或机械瓣置换、二尖瓣修复的情况下发生的心房颤动。所述非瓣膜性房颤可以使用非维生素K拮抗剂口服抗凝药(DOACs)预防卒中。
在本申请中,术语“透析”通常是指将小分子与生物大分子分开的一种分离纯化技术。是当肾脏无法正常工作时,代替肾脏从机体内清除代谢废物和过多水分的人工过程。所述透析(疗法)可以包括使体液内的成分(溶质或水分)通过半透膜排出体外的治疗方法,一般可包括血液透析、腹膜透析和/或结肠透析。
在本申请中,术语“充血性心力衰竭(CHF,congestive heart failure)”通常是指组织、器官血液灌注不足,同时出现肺循环和/或体循环淤血,是各种心脏病发展到严重阶段的临床综合症。所述充血性心力衰竭可以是由于心室泵血或充盈功能低下,心排血量不能满足机体代谢的需要所导致的。所述充血性心力衰竭可以具有左室肥厚或扩张的特征,可能导致神经内分泌失常、循环功能异常,例如可以出现典型临床症状:呼吸困难、体液潴留、乏力。
在本申请中,术语“高血压”通常是指以体循环动脉血压(收缩压和/或舒张压)增高为主要特征(在未使用降压药物的情况下,收缩压≥140毫米汞柱和/或舒张压≥90毫米汞柱),可伴有心、脑、肾等器官的功能或器质性损害的临床综合征。所述高血压可以是心脑血管病最主要的危险因素。
在本申请中,术语“糖尿病”通常是指是一组由多病因引起的胰岛素分泌和(或)利用障碍所导致的以慢性高血糖为特征的代谢性疾病。长期碳水化合物、脂肪、蛋白质代谢紊乱可引起多系统损耗,导致眼、肾、神经、心脏、血管等组织器官慢性进行性病变、功能减退及衰竭。所述糖尿病可以包含1型、2型、其他特殊类型、妊娠糖尿病。
在本申请中,术语“长期卧床”通常是指因长期患病或伤残而导致日常生活能力减退,部分或完全需人帮助的一种临床现象。
除非另有说明,否则可互换使用的术语“抗体”或“免疫球蛋白”在本申请中无论是指重链抗体还是指常规4链抗体,均用作一般术语以包括全长抗体、其单个的链以及其所有部分、结构域或片段(包括但不限于抗原结合结构域或片段,分别例如VHH结构域或VH/VL结构域)。此外,本申请所用的术语“序列”(例如在“免疫球蛋白序列”、“抗体序列”、“单一可变结构域序列”、“VHH序列”或“蛋白序列”等的术语中)一般应理解为既包括相关氨基酸序列,又包括编码所述序列的核酸序列或核苷酸序列,除非本申请需要更限定的解释。
如本申请所用,术语(多肽或蛋白的)“结构域”是指折叠蛋白结构,其能够独立于蛋白的其余部分维持其三级结构。一般而言,结构域负责蛋白的单个的功能性质,且在许多情况下可添加、移除或转移至其他蛋白而不损失蛋白的其余部分和/或结构域的功能。
如本申请所用的术语“免疫球蛋白结构域”是指抗体链(例如常规4链抗体的链或重链抗体的链)的球形区域,或是指基本上由这类球形区域组成的多肽。免疫球蛋白结构域的特征在于其维持抗体分子的免疫球蛋白折叠特征。
如本申请所用的术语“免疫球蛋白可变结构域”是指基本上由本领域及下文中分别称为“框架区1”或“FR1”、“框架区2”或“FR2”、“框架区3”或“FR3”、及“框架区4”或“FR4”的四个“框架区”组成的免疫球蛋白结构域,其中所述框架区由本领域及下文中分别称为“互补决定区1”或“CDR1”、“互补决定区2”或“CDR2”、及“互补决定区3”或“CDR3”的三个“互补决定区”或“CDR”间隔开。因此,免疫球蛋白可变结构域的一般结构或序列可如下表示为:FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4。免疫球蛋白可变结构域因具有抗原结合位点而赋予抗体对抗原的特异性。
如本申请所用的术语“免疫球蛋白单一可变结构域”是指能够在不与其他免疫球蛋白可变结构域配对的情况下特异性结合抗原表位的免疫球蛋白可变结构域。本申请含义中的免疫球蛋白单一可变结构域的一个实例为“结构域抗体”,例如免疫球蛋白单一可变结构域VH及VL(VH结构域及VL结构域)。免疫球蛋白单一可变结构域的另一实例为如下文定义的骆驼科的“VHH结构域”(或简称为“VHH”)。
“VHH结构域”,亦称为重链单域抗体、VHH、VHH结构域、VHH抗体片段和VHH抗体,是称为“重链抗体”(即“缺乏轻链的抗体”)的抗原结合免疫球蛋白的可变结构域(Hamers-Casterman C,Atarhouch T,Muyldermans S,Robinson G,Hamers C,Songa EB,BendahmanN,Hamers R.:“Naturally occurring antibodies devoid of light chains”;Nature363,446-448(1993))。使用术语“VHH结构域”以将所述可变结构域与存在于常规4链抗体中的重链可变结构域(其在本申请中称为“VH结构域”)以及存在于常规4链抗体中的轻链可变结构域(其在本申请中称为“VL结构域”)进行区分。VHH结构域特异性结合表位而无需其他抗原结合结构域(此与常规4链抗体中的VH或VL结构域相反,在该情况下表位由VL结构域与VH结构域一起识别)。VHH结构域为由单一免疫球蛋白结构域形成的小型稳定及高效的抗原识别单元。
在本申请的上下文中,术语“重链单域抗体”、“VHH结构域”、“VHH”、“VHH结构域”、“VHH抗体片段”、以及“VHH抗体”可互换使用。
例如Riechmann及Muyldermans,J.Immunol.Methods 231,25-38(1999)的图2中所示,对于骆驼科的VHH结构域所应用的氨基酸残基,可以根据Kabat等人给出的VH结构域的一般编号法来编号(Kabat et al.,Sequences of Proteins of ImmunologicalInterest,5th Ed.Public Health Service,National Institutes of Health,Bethesda,Md.(1991))。
本领域中已知对VH结构域的氨基酸残基进行编号的替代方法,所述替代方法还可以类似地应用于VHH结构域。例如,Chothia CDR指的是结构环的位置(Chothia and Lesk,J.Mol.Biol.196:901-917(1987))。AbM CDR代表的是Kabat超变区和Chothia结构环的折中,并且在Oxford Molecular's AbM抗体建模软件中使用。“接触(Contact)”CDR则基于对可获得的复合物晶体结构的分析。来自每种方法的CDR的残基描述如下:
然而应注意,如本领域中对于VH结构域及VHH结构域所公知的,各CDR中的氨基酸残基的总数可能不同,且可能不对应于由Kabat编号指示的氨基酸残基的总数(即根据Kabat编号的一个或多个位置可能在实际序列中未被占据,或实际序列可能含有多于Kabat编号所允许数目的氨基酸残基)。这意味着一般而言,根据Kabat的编号可能对应或可能不对应于实际序列中氨基酸残基的实际编号。
例如,CDR可以包括“扩展的(extended)CDR”,例如:在VL中的24-36或24-34(LCDR1),46-56或50-56(LCDR2)以及89-97或89-96(LCDR3);在VH中的26-35(HCDR1),50-65或49-65(HCDR2)以及93-102、94-102或95-102(HCDR3)。
VHH结构域中的氨基酸残基的总数将通常在110至120范围内,常常介于112与115之间。然而应注意较小及较长序列也可适于本申请所述的目的。
VHH结构域及含有其的多肽的其他结构特性及功能性质可总结如下:
VHH结构域(其已经天然“设计”以在不存在轻链可变结构域且不与轻链可变结构域相互作用的情况下与抗原功能性结合)可用作单一且相对较小的功能性抗原结合结构单元、结构域或多肽。此区分VHH结构域与常规4链抗体的VH及VL结构域,这些VH及VL结构域自身通常不适于作为单一抗原结合蛋白或免疫球蛋白单一可变结构域进行实际应用,但需要以某种形式或另一形式组合以提供功能性抗原结合单元(如以诸如Fab片段等常规抗体片段的形式;或以由与VL结构域共价连接的VH结构域组成的scFv的形式)。
由于这些独特性质,使用VHH结构域—单独或作为较大多肽的一部分—提供许多优于使用常规VH及VL结构域、scFv或常规抗体片段(例如Fab-或F(ab’)2-片段)的显著优势:仅需要单一结构域以高亲和力及高选择性结合抗原,从而使得既不需要存在两个单独结构域,也不需要确保该两个结构域以适当空间构象及构型存在(例如scFv一般需要使用经特别设计的接头);VHH结构域可自单一基因表达且不需要翻译后折叠或修饰;VHH结构域可容易地改造成多价及多特异性格式(格式化);VHH结构域高度可溶且无聚集趋势;VHH结构域对热、pH、蛋白酶及其他变性剂或条件高度稳定,且因此可在制备、储存或运输中不使用冷冻设备,从而达成节约成本、时间及环境;VHH结构域易于制备且相对廉价,甚至在生产所需的规模上亦如此;VHH结构域与常规4链抗体及其抗原结合片段相比相对较小(大约15kDa或大小为常规IgG的1/10),因此相比于常规4链抗体及其抗原结合片段,显示较高的组织渗透性且可以较高剂量给药;VHH结构域可显示所谓腔结合性质(尤其由于与常规VH结构域相比其延长的CDR3环),从而可到达常规4链抗体及其抗原结合片段不可到达的靶及表位。
获得结合特定抗原或表位的VHH的方法,先前已公开于以下文献中:R.van derLinden et al.,Journal of Immunological Methods,240(2000)185–195;Li et al.,JBiol Chem.,287(2012)13713–13721;Deffar et al.,African Journal ofBiotechnology Vol.8(12),pp.2645-2652,17June,2009和WO94/04678。
源自骆驼科的VHH结构域可通过以人常规4链抗体VH结构域中相应位置处存在的一个或多个氨基酸残基置换原始VHH序列的氨基酸序列中的一个或多个氨基酸残基而经“人源化”(本申请中亦称为“序列优化”,除人源化外,“序列优化”也可涵盖通过提供VHH改良性质的一个或多个突变对序列进行的其他修饰,例如移除潜在的翻译后修饰位点)。人源化VHH结构域可含有一个或多个完全人框架区序列。人源化可以使用蛋白表面氨基酸人源化(resurfacing)的方法和/或人源化通用框架CDR移植法(CDR grafting to a universalframework)完成,例如,如实施例中所示例。
如本申请所用,术语“表位”或可互换使用的术语“抗原决定簇”指抗体的互补位所结合的抗原上的任何抗原决定簇。抗原决定簇通常可以包含分子的化学活性表面基团,例如氨基酸或糖侧链,并且通常具有特定的三维结构特征以及特定的电荷特征。例如,表位通常以独特的空间构象包括至少3、4、5、6、7、8、9、10、11、12、13、14或15个连续或非连续的氨基酸,其可以是“线性”表位或“构象”表位。参见,例如,Epitope Mapping Protocols inMethods in Molecular Biology,第66卷,G.E.Morris,Ed.(1996)。在线性表位中,蛋白质与相互作用分子(例如抗体)之间的所有相互作用的点沿着蛋白质的一级氨基酸序列线性存在。在构象表位中,相互作用的点跨越彼此分开的蛋白质氨基酸残基而存在。
可使用本领域中熟知的许多表位定位技术鉴别给定抗原的表位。参见例如Epitope Mapping Protocols in Methods in Molecular Biology,第66卷,G.E.Morris,Ed.(1996)。举例而言,线性表位可通过例如以下方法来确定:在固体支持物上同时合成大量肽,其中这些肽对应于蛋白质分子的各部分,且使这些肽在仍然与支持物连接的情况下与抗体反应。这些技术在本领域中为已知的且描述于例如美国专利第4,708,871号;Geysen等人(1984)Proc.Natl.Acad.Sci.USA 81:3998-4002;Geysen等人(1986)Molec.Immunol.23:709-715中。类似地,构象表位可通过诸如通过例如x射线结晶学及2维核磁共振确定氨基酸的空间构形加以鉴别。参见例如Epitope Mapping Protocols(同上)。
可使用本领域技术人员已知的常规技术,就与相同表位的结合竞争性筛选抗体。例如,可进行竞争和交叉竞争研究,以获得彼此竞争或交叉竞争与抗原结合的抗体。基于它们的交叉竞争来获得结合相同表位的抗体的高通量方法描述于国际专利申请WO03/48731中。因此,可使用本领域技术人员已知的常规技术,获得与本申请的抗体分子竞争结合FXI上的相同表位的抗体及其抗原结合片段。
一般而言,术语“特异性”是指特定抗原结合分子或抗原结合蛋白(例如本申请的免疫球蛋白单一可变结构域)可结合的不同类型抗原或表位的数目。可基于抗原结合蛋白的亲和力和/或亲合力确定其特异性。由抗原与抗原结合蛋白的解离平衡常数(KD)所表示的亲和力,是表位与抗原结合蛋白上抗原结合位点之间结合强度的量度:KD值越小,表位与抗原结合蛋白之间的结合强度越强(或者,亲和力也可表示为缔合常数(KA),其为1/KD)。如本领域技术人员将了解,取决于具体感兴趣的抗原,可以以已知方式测定亲和力。亲合力为抗原结合蛋白(例如免疫球蛋白、抗体、免疫球蛋白单一可变结构域或含有其的多肽)与相关抗原之间结合强度的量度。亲合力与以下两者有关:与其抗原结合蛋白上的抗原结合位点之间的亲和力,以及存在于抗原结合蛋白上的相关结合位点的数目。
如本申请所用,术语“凝血因子XI(FXI)结合蛋白”意指任何能够特异性结合凝血因子XI(FXI)的蛋白。FXI结合蛋白可以包括针对FXI的如本申请定义的抗体。FXI结合蛋白还涵盖免疫球蛋白超家族抗体(IgSF)或CDR移植分子。
本申请的“FXI结合蛋白”可以包含至少一个结合FXI的免疫球蛋白单一可变结构域如VHH。在本申请中,本申请的“FXI结合分子”可以包含2、3、4或更多个结合FXI的免疫球蛋白单一可变结构域如VHH。本申请的FXI结合蛋白除结合FXI的免疫球蛋白单一可变结构域外也可可以包含接头和/或具有效应器功能的部分,例如半衰期延长部分(如结合血清白蛋白的免疫球蛋白单一可变结构域)、和/或融合配偶体(如血清白蛋白)和/或缀合的聚合物(如PEG)和/或Fc区。在本申请中,本申请的“FXI结合蛋白”还涵盖双特异性抗体,其含有结合不同抗原或相同抗原不同区域(如不同表位)的免疫球蛋白单一可变结构域。
通常,本申请的FXI结合蛋白将以如于Biacore或KinExA或Fortibio测定中测量的可以10
两个多肽序列之间的“序列相同性”指示序列之间相同氨基酸的百分比。“序列相似性”指示相同或代表保守氨基酸取代的氨基酸的百分比。用于评价氨基酸或核苷酸之间的序列相同性程度的方法是本领域技术人员已知的。例如,氨基酸序列相同性通常使用序列分析软件来测量。例如,可使用NCBI数据库的BLAST程序来确定相同性。对于序列相同性的确定,可以参见例如:Computational Molecular Biology,Lesk,A.M.,ed.,OxfordUniversity Press,New York,1988;Biocomputing:Informatics and Genome Projects,Smith,D.W.,ed.,Academic Press,New York,1993;Computer Analysis of SequenceData,Part I,Griffin,A.M.,and Griffin,H.G.,eds.,Humana Press,New Jersey,1994;Sequence Analysis in Molecular Biology,von Heinje,G.,Academic Press,1987和Sequence Analysis Primer,Gribskov,M.and Devereux,J.,eds.,M Stockton Press,NewYork,1991。
相比于其天然生物来源和/或获得该多肽或核酸分子的反应介质或培养基,当其已与至少一种在该来源或介质(培养基)中通常与之相关的其他组分(例如另一蛋白/多肽、另一核酸、另一生物组分或大分子或至少一种污染物、杂质或微量组分)分离时,多肽或核酸分子视为“分离的”。特别地,多肽或核酸分子在其已纯化至少2倍、特别是至少10倍、更特别是至少100倍且多达1000倍或1000倍以上时被视为“分离的”。经适合的技术(例如适合色谱技术,如聚丙烯酰胺凝胶电泳)确定,“分离的”多肽或核酸分子可以基本上为均质的。
“有效量”意指本申请的FXI结合蛋白或药物组合物的量能导致疾病症状的严重性降低,疾病无症状期的频率和持续时间增加,或者防止因疾病痛苦而引起的损伤或失能。
如本申请所用,“血栓形成”是指在血管内形成或存在凝块(也称为“血栓”),从而阻碍血液流经循环系统。血栓形成通常由血液组成、血管壁的质量和/或血流的性质的异常所引起。凝块的形成通常由血管壁损伤(诸如来自创伤或感染的血管壁损伤)和通过损伤点的血流的减缓或停滞所引起。在一些情况下,凝血异常引起血栓形成。
发明详述
一方面,本申请提供一种预防和/或治疗血栓栓塞性疾病的方法,其包括以下步骤:向有需要的受试者施用凝血因子XI(FXI)结合蛋白,其中可以包含至少一个能够特异性结合FXI的免疫球蛋白单一可变结构域,所述至少一个免疫球蛋白单一可变结构域可以包含SEQ IDNO:4、10和14中任一项所示的VHH中的CDR1、CDR2和CDR3。
另一方面,本申请提供了一种凝血因子XI(FXI)结合蛋白在制备药物中的用途,所述药物用于预防和/或治疗血栓栓塞性疾病,其中所述凝血因子XI(FXI)结合蛋白可以包含至少一个能够特异性结合FXI的免疫球蛋白单一可变结构域,所述至少一个免疫球蛋白单一可变结构域可以包含SEQ ID NO:4、10和14中任一项所示的VHH中的CDR1、CDR2和CDR3。
另一方面,本申请提供了一种凝血因子XI(FXI)结合蛋白,其用于预防和/或治疗血栓栓塞性疾病,其中所述凝血因子XI(FXI)结合蛋白可以包含至少一个能够特异性结合FXI的免疫球蛋白单一可变结构域,所述至少一个免疫球蛋白单一可变结构域可以包含SEQIDNO:4、10和14中任一项所示的VHH中的CDR1、CDR2和CDR3。
例如,所述FXI结合蛋白包含第一免疫球蛋白单一可变结构域和第二免疫球蛋白单一可变结构域,其中,第一免疫球蛋白单一可变结构域包含SEQ ID NO:14所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域包含SEQ ID NO:17所示的VHH中的CDR1、CDR2和CDR3。
在本申请中,所述方法还可以包括向所述受试者施用:编码本申请所述的凝血因子XI(FXI)结合蛋白的核酸分子、可以包含与表达调控元件可操作地连接的所述核酸分子的表达载体、可以包含所述核酸分子或以所述表达载体转化并能够表达所述凝血因子XI(FXI)结合蛋白的细胞,和/或可以包含所述凝血因子XI(FXI)结合蛋白以及药学上可接受的载体的药物组合物。
在本申请中,所述血栓栓塞性疾病可以包括静脉血栓栓塞(VTE)。
例如,所述静脉血栓栓塞可以属于肿瘤的并发症,和/或关节置换术的并发症。
例如,所述静脉血栓栓塞可以与外周静脉植入中心静脉导管(PICC)相关。
例如,所述静脉血栓栓塞可以与髋关节和/或膝关节的关节置换术相关。在关节置换术中,下肢肌肉收缩活动可能会减少,加上置换术的切口出血可能会使得血液变得更容易凝固,可能会导致下肢深静脉血栓形成。
例如,所述血栓栓塞性疾病可以包括深静脉血栓形成(DVT)。
例如,所述深静脉血栓形成可以包括急性深静脉血栓形成和/或急性深静脉血栓形成发生后的深静脉血栓形成复发。
例如,所述静脉血栓栓塞可以包括肺血栓栓塞(PTE)。例如,深静脉血栓可能随着血液回流到肺部,从而卡住非的主干血管。所述肺血栓栓塞可能会导致致死性肺栓塞。
例如,所述血栓栓塞性疾病可以包括全身性血栓栓塞。例如,所述全身性血栓栓塞可以属于肿瘤的并发症,房颤的并发症,和/或透析的并发症。在本申请中,所述房颤可以包括非瓣膜性房颤。
在本申请中,所述受试者可以患有静脉血栓栓塞(VTE),或具有患有VTE的风险。
在本申请中,所述受试者的外周静脉可以植入了中心静脉导管(PICC)。
在本申请中,所述受试者可以为关节置换者。例如,所述受试者的髋关节和/或膝关节可以被置换。
在本申请中,所述受试者可以患有深静脉血栓形成(DVT),或具有患有DVT的风险。
在本申请中,所述受试者可以患有急性深静脉血栓形成和/或急性深静脉血栓形成发生后的深静脉血栓形成复发。
在本申请中,所述受试者可以患有肺血栓栓塞(PTE)。
在本申请中,所述受试者可以患有全身性血栓栓塞,或具有患有全身性血栓栓塞的风险。
在本申请中,所述受试者可以患有非瓣膜性房颤。
在本申请中,所述受试者可以为透析患者。所述透析患者可能经历了和/或经历着血液透析。所述血液透析可以包括利用半透膜原理,通过扩散、将血液内各种有害以及多余的代谢废物和过多的电解质移出体外的步骤。所述血液透析可以达到净化血液,并纠正电解质及酸碱平衡紊乱的目的。所述透析患者可能经历了和/或经历着腹膜透析。所述腹膜透析可以包括利用腹膜作为半渗透膜,将配制好的透析液经导管利用重力定时灌入患者的腹膜腔,不断更换腹腔透析液的步骤。所述腹膜透析可以达到清除体内代谢产物、毒性物质及纠正水、电解质平衡紊乱的目的。在本申请中,所述透析患者可能会产生心脑并发症。例如,可能在透析过程中产生或已经存在高血压、脑出血和/或心衰的症状。
在本申请中,所述受试者可以为成年人。在本申请中,所述成年人的年龄可以为十八周岁以上。
在本申请中,所述受试者可以为肿瘤患者。在本申请中,所述肿瘤可以为恶性肿瘤。在本申请中,所述肿瘤可以包括实体瘤和/或非实体瘤。
在本申请中,所述受试者可以患有高血压、糖尿病、充血性心力衰竭、房颤和/或具有卒中史。在本申请中,所述卒中可以包括脑卒中。所述脑卒中可以由以下的原因导致:颈动脉狭窄、房颤、脑出血和/或缺血性脑卒中。所述脑卒中的治疗方法可以参考《中国脑卒中系列指导规范-2015年发布版》。
在本申请中,所述受试者的年龄可以为至少75岁(例如,可以年龄为至少75岁、至少80岁、至少85岁或更大)。
在本申请中,所述受试者可以长期卧床(例如,可以卧床至少3个月、至少6个月、至少1年、至少2年、至少5年或更久)。
在本申请中,所述凝血因子XI(FXI)结合蛋白的给药剂量可以为约0.5mg/Kg-约10mg/kg。例如,可以为约0.5mg/Kg-约8.0mg/kg、约0.5mg/Kg-约7.5mg/kg、约0.5mg/Kg-约7.0mg/kg、约0.5mg/Kg-约6.5mg/kg、约0.5mg/Kg-约6mg/kg、约0.5mg/Kg-约5.5mg/kg、约0.5mg/Kg-约5.0mg/kg、约0.5mg/Kg-约4.5mg/kg、约0.5mg/Kg-约4.0mg/kg、约0.5mg/Kg-约3.5mg/kg、约0.5mg/Kg-约3.0mg/kg、约0.5mg/Kg-约2.5mg/kg、约0.5mg/Kg-约2.0mg/kg、约0.5mg/Kg-约1.5mg/kg、约0.5mg/Kg-约1.0mg/kg、约1.0mg/Kg-约10mg/kg或约1.0mg/Kg-约8.0mg/kg。
FXI结合蛋白
在一方面,本申请提供了一种FXI结合蛋白,其可以包含至少一个能够特异性结合FXI的免疫球蛋白单一可变结构域。
在本申请中,所述至少一个免疫球蛋白单一可变结构域可以包含SEQ ID NO:1-23中任一所示的VHH中的CDR1、CDR2和CDR3。所述CDR可以是Kabat CDR、AbM CDR、Chothia CDR或IMGT CDR。
在本申请中,所述至少一个免疫球蛋白单一可变结构域可以包含选自以下的一组CDR1、CDR2和CDR3:
在本申请中,本申请的FXI结合蛋白中的至少一个免疫球蛋白单一可变结构域是VHH。在本申请中,所述VHH可以包含SEQ ID NO:1-23中任一氨基酸序列。
在本申请中,本申请的FXI结合蛋白中的至少一个免疫球蛋白单一可变结构域是人源化的VHH。
在本申请中,本申请的FXI结合蛋白中的至少一个免疫球蛋白单一可变结构域是人源化的VHH,所述人源化的VHH可以包含与SEQ ID NO:1-23中任一序列具有至少80%、可以地至少90%、可以地至少95%、甚至可以地至少99%序列相同性的氨基酸序列。在本申请中,所述人源化的VHH的氨基酸序列与SEQ ID NO:1-23中任一相比可以包含一或多个氨基酸取代,可以保守氨基酸取代。例如,可以包含1、2、3、4、5、6、7、8、9或10个保守氨基酸取代。
在本申请中,本申请的FXI结合蛋白中的至少一个免疫球蛋白单一可变结构域是人源化的VHH,其中所述人源化的VHH可以包含SEQ ID NO:300-335中任一氨基酸序列。
在本申请中,所述至少一个免疫球蛋白单一可变结构域结合FXI的Apple2结构域。例如,所述免疫球蛋白单一可变结构域可以包含SEQ ID NO:4、SEQ ID NO:10或SEQ ID NO:14中任一所示的VHH中的CDR1、CDR2和CDR3。在本申请中,所述免疫球蛋白单一可变结构域可以包含选自SEQ ID NO:60-62、SEQ ID NO:63-65、SEQ ID NO:66-68、SEQ ID NO:69-71、SEQ ID NO:132-134、SEQ ID NO:135-137、SEQ ID NO:138-140、SEQ ID NO:141-143、SEQID NO:180-182、SEQ ID NO:183-185、SEQ ID NO:186-188、SEQ ID NO:189-191的一组CDR1、CDR2和CDR3。在本申请中,所述免疫球蛋白单一可变结构域可以包含SEQ ID NO:4、SEQ ID NO:10或SEQ ID NO:14中任一所示的氨基酸序列。在本申请中,所述免疫球蛋白单一可变结构域可以包含SEQ ID NO:306-323中任一所示的氨基酸序列。
在本申请中,所述至少一个免疫球蛋白单一可变结构域结合FXI的Apple3结构域。例如,所述免疫球蛋白单一可变结构域可以包含SEQ ID NO:17所示的VHH中的CDR1、CDR2和CDR3。在本申请中,所述免疫球蛋白单一可变结构域可以包含选自SEQ ID NO:216-218、SEQID NO:219-221、SEQ ID NO:222-224、SEQ ID NO:225-227的一组CDR1、CDR2和CDR3。在本申请中,所述免疫球蛋白单一可变结构域可以包含SEQ ID NO:17所示的氨基酸序列。在本申请中,所述免疫球蛋白单一可变结构域可以包含SEQ ID NO:324-329中任一所示的氨基酸序列。
在本申请中,所述至少一个免疫球蛋白单一可变结构域结合FXI的Apple4结构域。例如,所述免疫球蛋白单一可变结构域可以包含SEQ ID NO:1所示的VHH中的CDR1、CDR2和CDR3。在本申请中,所述免疫球蛋白单一可变结构域可以包含选自SEQ ID NO:24-26、SEQID NO:27-29、SEQ ID NO:30-32、SEQ ID NO:33-35的一组CDR1、CDR2和CDR3。在本申请中,所述免疫球蛋白单一可变结构域可以包含SEQ ID NO:1所示的氨基酸序列。在本申请中,所述免疫球蛋白单一可变结构域可以包含SEQ ID NO:300-305中任一所示的氨基酸序列。
在本申请中,所述至少一个免疫球蛋白单一可变结构域结合FXI的Apple1-2区域(Apple1结构域和Apple2结构域之间的区域)。
在本申请中,所述至少一个免疫球蛋白单一可变结构域结合FXI的Apple2-3区域(Apple2结构域和Apple3结构域之间的区域)。例如,所述免疫球蛋白单一可变结构域可以包含SEQ ID NO:20所示的VHH中的CDR1、CDR2和CDR3。在本申请中,所述免疫球蛋白单一可变结构域可以包含选自SEQ ID NO:252-254、SEQ ID NO:255-257、SEQ ID NO:258-260、SEQIDNO:261-263的一组CDR1、CDR2和CDR3。在本申请中,所述免疫球蛋白单一可变结构域可以包含SEQ ID NO:20所示的氨基酸序列。在本申请中,所述免疫球蛋白单一可变结构域可以包含SEQ ID NO:330-335中任一所示的氨基酸序列。
在本申请中,所述至少一个免疫球蛋白单一可变结构域结合FXI的Apple3-4区域(Apple3结构域和Apple4结构域之间的区域)。
在本申请中,所述FXI结合蛋白可以包含一个特异性结合FXI的免疫球蛋白单一可变结构域。
在本申请中,所述FXI结合蛋白可以包含至少两个,例如2、3、4或更多个特异性结合FXI的免疫球蛋白单一可变结构域。
在本申请中,所述至少两个免疫球蛋白单一可变结构域结合FXI的相同区域或表位,或竞争结合或部分竞争结合FXI的相同区域或表位,例如,所述至少两个免疫球蛋白单一可变结构域是相同的。
在本申请中,所述至少两个免疫球蛋白单一可变结构域结合FXI的不同区域或表位,或不竞争结合FXI的相同区域或表位。
两个抗体或免疫球蛋白单一可变结构域是否结合或竞争结合相同区域或表位可以通过生物膜干涉技术BLI进行epitope binning来确定,如本申请实施例所示例。
在本申请中,所述至少两个特异性结合FXI的免疫球蛋白单一可变结构域直接相互连接。
在本申请中,所述至少两个特异性结合FXI的免疫球蛋白单一可变结构域通过接头相互连接。所述接头可以是长1-20或更多个氨基酸、无二级以上结构的非功能性氨基酸序列。例如,所述接头是柔性接头,例如GGGGS、GS、GAP、(GGGGS)
在本申请中,所述FXI结合蛋白可以包含第一免疫球蛋白单一可变结构域和第二免疫球蛋白单一可变结构域,其中,
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:1所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:4所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:1所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:9所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:1所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:10所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:1所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:14所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:1所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:17所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:1所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:20所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:4所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:9所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:4所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:10所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:4所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:14所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:4所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:17所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:4所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:20所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:9所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:10所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:9所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:14所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:9所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:17所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:9所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:20所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:10所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:14所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:10所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:17所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:10所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:20所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:14所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:17所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:14所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:20所示的VHH中的CDR1、CDR2和CDR3;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:17所示的VHH中的CDR1、CDR2和CDR3,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:20所示的VHH中的CDR1、CDR2和CDR3。
在本申请中,其中SEQ ID NO:1、4、9、10、14、17或20所示的VHH中的CDR1、CDR2和CDR3如下表所示:
在本申请中,所述FXI结合蛋白可以包含第一免疫球蛋白单一可变结构域和第二免疫球蛋白单一可变结构域,其中,
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:1、300-305之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:4、306-311之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:1、300-305之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:9所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:1、300-305之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:10、312-317之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:1、300-305之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:14、318-323之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:1、300-305之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:17、324-329之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:1、300-305之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:20、330-335之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:4、306-311之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:9所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:4、306-311之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:10、312-317之一所示的VHH中的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:4、306-311之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:14、318-323之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:4、306-311之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:17、324-329之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:4、306-311之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:20、330-335之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:9所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:10、312-317之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:9所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:14、318-323之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:9所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:17、324-329之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:9所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:20、330-335之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:10、312-317之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:14、318-323之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:10、312-317之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:17、324-329之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:10、312-317之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:20、330-335之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:14、318-323之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:17、324-329之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:14、318-323之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:20、330-335之一所示的氨基酸序列;或
第一免疫球蛋白单一可变结构域可以包含SEQ ID NO:17、324-329之一所示的氨基酸序列,且第二免疫球蛋白单一可变结构域可以包含SEQ ID NO:20、330-335之一所示的氨基酸序列。
在本申请中,所述FXI结合蛋白可以具有SEQ ID NO:14所示VHH中的CDR1-CDR3。例如,所述FXI结合蛋白可以具有SEQ ID NO:14所示VHH中的CDR1(SEQ ID NO:183)。例如,所述FXI结合蛋白可以具有SEQ ID NO:14所示VHH中的CDR2(SEQ ID NO:181)。例如,所述FXI结合蛋白可以具有SEQ ID NO:14所示VHH中的CDR3(SEQ ID NO:182)。
例如,所述FXI结合蛋白可以具有SEQ ID NO:183所示的CDR1、SEQ ID NO:181所示的CDR2和SEQ ID NO:182所示的CDR3。
例如,所述FXI结合蛋白可以具有SEQ ID NO:349所示的VHH。
在本申请中,所述FXI结合蛋白可以具有SEQ ID NO:17所示VHH中的CDR1-CDR3。例如,所述FXI结合蛋白可以具有SEQ ID NO:17所示VHH中的CDR1(SEQ ID NO:219)。例如,所述FXI结合蛋白可以具有SEQ ID NO:17所示VHH中的CDR2(SEQ ID NO:217)。例如,所述FXI结合蛋白可以具有SEQ ID NO:17所示VHH中的CDR3(SEQ ID NO:218)。
例如,所述FXI结合蛋白可以具有SEQ ID NO:219所示的CDR1、SEQ ID NO:217所示的CDR2和SEQ ID NO:218所示的CDR3。
例如,所述FXI结合蛋白可以具有SEQ ID NO:350所示的VHH。
例如,所述FXI结合蛋白可以具有SEQ ID NO:183所示的CDR1、SEQ ID NO:181所示的CDR2和SEQ ID NO:182所示的CDR3;以及,所述FXI结合蛋白可以具有SEQ ID NO:219所示的CDR1、SEQ ID NO:217所示的CDR2和SEQ ID NO:218所示的CDR3。
例如,所述FXI结合蛋白可以具有SEQ ID NO:349所示的VHH,以及,所述FXI结合蛋白可以具有SEQ ID NO:350所示的VHH。
例如,所述FXI结合蛋白可以具有SEQ ID NO:344所示的氨基酸序列。
在本申请中,其中所述第一免疫球蛋白单一可变结构域位于所述第二免疫球蛋白单一可变结构域的N端。在另一些实施方案中,其中所述第二免疫球蛋白单一可变结构域位于所述第一免疫球蛋白单一可变结构域的N端。
在本申请中,本申请的FXI结合蛋白,除了至少一个能够特异性结合FXI的免疫球蛋白单一可变结构域外,还可以包含免疫球蛋白Fc区。在本申请的FXI结合蛋白中可以包含免疫球蛋白Fc区可以使所述结合分子形成二聚体。可用于本申请的Fc区可以来自不同亚型的免疫球蛋白,例如,IgG(例如,IgG1、IgG2、IgG3或IgG4亚型)、IgA1、IgA2、IgD、IgE或IgM。
在本申请中,可以在野生型的Fc序列上引入突变用于改变Fc介导的相关活性。所述突变包括但不限于:a).改变Fc介导的CDC活性的突变;b).改变Fc介导的ADCC活性的突变;或c).改变FcRn介导的体内半衰期的突变。此类突变描述于下列文献中:Leonard GPresta,Current Opinion in Immunology 2008,20:460–470;Esohe E.Idusogie et al.,J Immunol2000,164:4178-4184;RAPHAEL A.CLYNES et al.,Nature Medicine,2000,Volume 6,Number4:443-446;Paul R.Hinton et al.,J Immunol,2006,176:346-356。例如,可以通过突变CH2区上的1、2、3、4、5、6、7、8、9或10个氨基酸用于增加或去除Fc介导的ADCC或CDC活性或是增强或减弱FcRn的亲和力。此外,可以通过突变铰链区的1、2、3、4、5、6、7、8、9或10个氨基酸增加蛋白的稳定性。
在本申请中,Fc序列上可以引入突变,从而使得突变的Fc更容易形成同二聚体或者异二聚体。如Ridgway,Presta et al.1996以及Carter 2001中提到的利用Fc接触界面氨基酸侧链基团空间作用的knob-hole模型,使得不同Fc突变之间更容易形成异二聚体;再比如CN102558355A或者CN 103388013A中,通过改变Fc接触界面氨基酸所带的电荷,进而改变Fc接触界面之间的离子相互作用力,使得不同的Fc突变对之间更容易形成异二聚体(CN102558355A),亦或是具有相同突变的Fc之间更容易形成同二聚体(CN 103388013A)。
所述免疫球蛋白Fc区可以是人免疫球蛋白Fc区,可以是人IgG1的Fc区。在本申请中,所述免疫球蛋白Fc区的氨基酸序列示于SEQ ID NO:336。
在本申请中,本申请的FXI结合蛋白中,所述免疫球蛋白Fc区(例如人IgG1的Fc区)直接或通过接头(如肽接头)间接连接至所述免疫球蛋白单一可变结构域(如VHH)的C端。
在本申请中,本申请的FXI结合蛋白可以包含一个特异性结合FXI的免疫球蛋白单一可变结构域,其直接或通过接头与免疫球蛋白Fc区连接,所述免疫球蛋白Fc区允许所述FXI结合蛋白形成可以包含两个FXI结合结构域的二聚体分子。这样的FXI结合蛋白也称为二价FXI结合蛋白。在本申请中,所述二聚体是同二聚体。
在本申请中,本申请的FXI结合蛋白可以包含直接或通过接头相互连接的两个特异性结合FXI的免疫球蛋白单一可变结构域和一个免疫球蛋白Fc区,所述免疫球蛋白Fc区允许所述FXI结合蛋白形成可以包含四个FXI结合结构域的二聚体分子。这样的FXI结合蛋白也称为四价FXI结合蛋白。在本申请中,所述二聚体是同二聚体。在本申请中,所述FXI结合蛋白中的两个特异性结合FXI的免疫球蛋白单一可变结构域分别结合FXI的不同区域或不同表位。
在本申请中,本申请的FXI结合蛋白能够抑制FXI的活性。在本申请中,本申请的FXI结合蛋白能够抑制FXI的凝血功能。
核酸、载体、宿主细胞
在另一方面中,本申请涉及编码本申请的FXI结合蛋白的核酸分子。本申请的核酸可为RNA、DNA或cDNA。根据本申请的一个实施方案,本申请的核酸是基本上分离的核酸。
本申请的核酸也可呈载体形式,可存在于载体中和/或可为载体的一部分,该载体例如质粒、粘端质粒或YAC。载体可尤其为表达载体,即可提供FXI结合蛋白体外和/或体内(即在适合宿主细胞、宿主有机体和/或表达系统中)表达的载体。该表达载体通常可以包含至少一种本申请的核酸,其可操作地连接至一个或多个适合的表达调控元件(例如启动子、增强子、终止子等)。针对在特定宿主中的表达对所述元件及其序列进行选择为本领域技术人员的常识。对本申请的FXI结合蛋白的表达有用或必需的调控元件及其他元件的具体实例,例如启动子、增强子、终止子、整合因子、选择标记物、前导序列、报告基因。
本申请的核酸可基于关于本申请给出的本申请的多肽的氨基酸序列的信息通过已知的方式(例如通过自动DNA合成和/或重组DNA技术)制备或获得,和/或可从适合的天然来源加以分离。
在另一方面中,本申请涉及表达或能够表达一种或多种本申请的FXI结合蛋白和/或含有本申请的核酸或载体的重组宿主细胞。本申请的可以宿主细胞为细菌细胞、真菌细胞或哺乳动物细胞。
适合的细菌细胞包括革兰氏阴性细菌菌株(例如大肠杆菌(Escherichia coli)菌株、变形杆菌属(Proteus)菌株及假单胞菌属(Pseudomonas)菌株及革兰氏阳性细菌菌株(例如芽孢杆菌属(Bacillus)菌株、链霉菌属(Streptomyces)菌株、葡萄球菌属(Staphylococcus)菌株及乳球菌属(Lactococcus)菌株)的细胞。
适合的真菌细胞包括木霉属(Trichoderma)、脉孢菌属(Neurospora)及曲菌属(Aspergillus)的物种的细胞;或者包括酵母属(Saccharomyces)(例如酿酒酵母(Saccharomyces cerevisiae))、裂殖酵母属(Schizosaccharomyces)(例如粟酒裂殖酵母(Schizosaccharomyces pombe))、毕赤酵母属(Pichia)(例如巴斯德毕赤酵母(Pichiapastoris)及嗜甲醇毕赤酵母(Pichia methanolica))及汉森酵母属(Hansenula)的物种的细胞。
适合的哺乳动物细胞包括例如HEK293细胞、CHO细胞、BHK细胞、HeLa细胞、COS细胞等。
然而,本申请也可使用两栖类细胞、昆虫细胞、植物细胞及本领域中用于表达异源蛋白的任何其他细胞。
本申请还提供产生本申请的FXI结合蛋白的方法,所述方法通常可以包含以下步骤:
-在允许表达本申请的FXI结合蛋白的条件下培养本申请的宿主细胞;及
-从培养物回收由所述宿主细胞表达的FXI结合蛋白;及
-任选进一步纯化和/或修饰本申请的FXI结合蛋白。
本申请的FXI结合蛋白可在如上所述细胞中以细胞内方式(例如在细胞质中、在周质中或在包涵体中)产生,接着从宿主细胞分离且任选进一步纯化;或其可以细胞外方式(例如在培养宿主细胞的培养基中)产生,接着自培养基分离且任选进一步纯化。
用于重组产生多肽的方法及试剂,例如特定适合表达载体、转化或转染方法、选择标记物、诱导蛋白表达的方法、培养条件等在本领域中是已知的。类似地,适用于制造本申请的FXI结合蛋白的方法中的蛋白分离及纯化技术为本领域技术人员所公知。
然而,本申请的FXI结合蛋白也可以通过本领域已知的其它产生蛋白质的方法获得,例如化学合成,包括固相或液相合成。
药物组合物
另一方面,本申请提供一种组合物,例如药物组合物,其含有与药学上可接受的载体配制在一起的一种或组合的本申请的FXI结合蛋白。这样的组合物可以包含一种或组合的(例如两种或多种不同的)本申请的FXI结合蛋白。例如,本申请的药物组合物可以含有结合靶抗原(FXI)上的不同表位的抗体分子组合。
本申请使用的“药学上可接受的载体”包括生理学相容的任何和所有的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。可以地,该载体适合于静脉内、肌内、皮下、肠胃外、脊柱或表皮施用(如通过注射或输注)。根据施用途径,可将活性化合物即抗体分子包裹于一种材料中,以保护该化合物免受可使该化合物失活的酸和其他天然条件的作用。
本申请的药物组合物也可含有药学上可接受的抗氧化剂。药学上可接受的抗氧化剂的例子包括:(1)水溶性抗氧化剂,如抗坏血酸、盐酸半胱氨酸、硫酸氢钠、焦亚硫酸钠,亚硫酸钠等;(2)油溶性抗氧化剂,如棕榈酸抗坏血酸酯、丁羟茴醚(BHA)、丁羟甲苯(BHT)、卵磷脂、没食子酸丙酯、α-生育酚等;和(3)金属螯合剂,如柠檬酸、乙二胺四乙酸(EDTA)、山梨糖醇、酒石酸、磷酸等。
这些组合物还可含有如防腐剂、润湿剂、乳化剂和分散剂。
可以通过灭菌程序或通过可以包含诸如对羟基苯甲酸酯、氯代丁醇、苯酚山梨酸等各种抗细菌剂和抗真菌剂确保防止存在微生物。在很多情况下,组合物中可以包含等渗剂,例如,糖、多元醇例如甘露糖醇、山梨糖醇或氧化钠。通过在组合物中加入延迟吸收剂,例如单硬脂酸盐和明胶,可实现注射型药物延长的吸收。
药学上可接受的载体包括无菌水溶液或分散液和用于临时制备无菌注射液或分散液的粉末剂。这些用于药学活性物质的介质和试剂的使用是本领域公知的。常规介质或试剂,除了任何与活性化合物不相容的范围外,都可能在本申请的药物组合物中。还可以向组合物中掺入补充的活性化合物。
治疗性组合物一般必须是无菌的并且在制备和贮存条件下稳定的。可以将组合物配制成溶液、微乳状液、脂质体或其他适合高药物浓度的有序结构。载体可以是含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液态聚乙二醇等)及其合适的混合物的溶剂或分散剂。例如,通过使用包衣,例如卵磷脂,在分散液的情况下通过保持所需的颗粒大小,以及通过使用表面活性剂,可以保持适当的流动性。
通过将活性化合物以需要的量混入合适的溶剂中,并且根据需要加入以上列举的成分中的一种或其组合,接着无菌微过滤,可制备无菌注射液。通常,通过将活性化合物掺入到含有基本分散介质和上面所列其他所需成分的无菌载体中制备分散剂。对于用于制备无菌注射液的无菌粉末剂,可以的制备方法是真空干燥和冷冻干燥(冻干),由其预先无菌过滤的溶液得到活性成分加任何额外所需成分的粉末。
可以与载体材料组合制备单一剂量形式的活性成分的量根据所治疗的对象和特定给药方式而不同。可以与载体材料组合制备单一剂量形式的活性成分的量一般是产生治疗效果的组合物的量。通常,以100%计,这个量的范围是大约0.01%至大约99%的活性成分,例如大约0.1%至大约70%,或大约1%至大约30%的活性成分,与药学上可接受的载体相组合。
可以调节剂量方案以提供最佳的期望的反应(例如,治疗反应)。例如,可以施用单一推注,可以随时间施用几次分开的剂量,或者根据治疗状况的紧急情况所需,可以按比例减小或增加剂量。特别有利的是将肠胃外组合物配制成容易给药并且剂量均匀的剂量单位形式。此处使用的剂量单位形式是指适合作为单位剂量用于所治疗的对象的物理不连续单位;每个单位含有预定量的活性化合物,经计算该预定量的活性化合物与需要的药物载体组合产生所需的治疗效果。对本申请剂量单位形式的具体说明限定于且直接依赖于(a)活性化合物的独特特性和要达到的特定治疗效果,和(b)本领域中固有的对于配制这种用于治疗个体敏感性的活性化合物的限制。
对于抗体分子的给药而言,剂量范围为约0.0001至100mg/kg,更通常为0.01至30mg/kg受者体重。例如,剂量可以是0.3mg/kg体重、1mg/kg体重、3mg/kg体重、5mg/kg体重、10mg/kg体重、20mg/kg体重或30mg/kg体重,或在1-30mg/kg范围内。示例性的治疗方案需要每周给药一次、每两周一次、每三周一次、每四周一次、每月一次、每3个月一次、每3-6个月一次、或起始给药间隔略短(如每周一次至每三周一次)后期给药间隔加长(如每月一次至每3-6个月一次)。
或者,抗体分子也可以作为持续释放制剂来给药,在此情况中需要频率较低的给药。剂量和频率根据抗体分子在患者中的半衰期而不同。通常,人抗体表现出最长的半衰期,之后是人源化抗体、嵌合抗体和非人类抗体。给药剂量和频率根据处理是预防性的还是治疗性的而不同。在预防性应用中,在长时间内以较不频繁的间隔给予相对较低的剂量。有些患者在余生中持续接受处理。在治疗性应用中,有时需要以较短的间隔给予较高的剂量,直到疾病的进展减轻或停止,可以直到患者表现为疾病症状部分或完全改善。之后,可以以预防性方案给患者给药。
本申请药物组合物中活性成分的实际剂量水平可能改变,以获得可有效实现对特定患者、组合物和给药方式的所需治疗反应,而对患者无毒性的活性成分的量。选择的剂量水平取决于多种药物代谢动力学因素,包括应用的本申请特定组合物或其酯、盐或酰胺的活性,给药途径,给药时间,应用的特定化合物的排泄速率,治疗的持续时间,与应用的特定组合物联合应用的其他药物、化合物和/或材料,接受治疗的患者的年龄、性别、体重、状况、总体健康情况和病史,以及医学领域中公知的类似因素
本申请的组合物可以利用本领域公知的一种或多种方法通过一种或多种给药途径给药。本领域技术人员应当理解,给药途径和/或方式根据期望的结果而不同。本申请FXI结合蛋白的可以给药途径包括静脉内、肌肉内、皮内、腹膜内、皮下、脊柱或其他肠胃外给药途径,例如注射或输注。本申请使用的短语“肠胃外给药”是指除肠和局部给药以外的给药模式,通常是注射,包括但不限于静脉内、肌内、动脉内、鞘内、囊内、眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注。
或者,本申请的FXI结合蛋白也可以通过非肠胃外途径给药,如局部、表皮或粘膜途径给药,例如,鼻内、经口、阴道、直肠、舌下或局部。
不欲被任何理论所限,下文中的实施例仅仅是为了阐释本申请的融合蛋白、制备方法和用途等,而不用于限制本申请发明的范围。
实施例
实施例1制备凝血因子XI(FXI)结合蛋白
KN060为骆驼免疫库中筛选得到的抗FXI双特异性单域抗体融合蛋白。其为2条完全相同的肽链形成的同二聚体,其中肽链的氨基酸序列如SEQ ID NO.344所示。
对照抗体14E11为Aronora公司开发的抗FXI抗体。其中14E11的轻链的氨基酸序列如SEQ ID NO.346所示;重链的氨基酸序列如SEQ ID NO.345所示。
对照抗体BAY1213790为Bayer公司开发的抗FXI抗体。其中BAY1213790的轻链的氨基酸序列如SEQ ID NO.348所示;重链的氨基酸序列如SEQ ID NO.347所示。
将可以包含编码融合蛋白的核酸序列的载体转入细胞,表达纯化得到相应融合蛋白。
实施例2检测凝血因子XI(FXI)结合蛋白与FXI的亲和力
2.1KN060与FXI的亲和力
(1)将KN060针对hFXI-CHis蛋白的结合动力学,通过生物膜干涉(Biolayerinterferometry,BLI)技术,使用分子相互作用仪测量。具体操作包括:将KN060稀释至10μg/ml固化到Protein A biosensor上,然后将hFXI-Chis蛋白稀释至50nM、25nM、12.5nM、6.25nM、3.125nM 5个浓度梯度与KN060结合。结果采用1:1模型拟合,计算得到KN060与hFXI-Chis蛋白结合的平衡解离常数(KD)值。4E11以及BAY1213790作为对照。测量KN060对hFXI-Chis蛋白的亲和力为6.74E-10KD(M)。对照14E11对hFXI-Chis蛋白的亲和力为3.02E-09(M)。对照BAY1213790的亲和力为4.12E-09(M)。可见KN060对hFXI-CHis的亲和力略高于2个对照样品。
表1KN060与人FXI亲和力结果
/>
(2)将KN060稀释至终浓度10μg/mL直接固化到AHC biosensor上,对动力学测量,将hApple-Chis(序列参考Uniprot数据库,登录号P03951,选取前387位Apple domain氨基酸序列)稀释5个浓度,基线60s,结合120s,解离900s。稀释液为Kinetic buffer,再生液为glycine-HCl(pH1.7),中和液为稀释液。biosensor为ProteinA。使用简单一对一Languir结合模型(Octet K2数据分析软件9.0版(Data analysis 9.0)),计算结合速率(kon)和解离速率(kdis)。平衡解离常数(kD)以比率kdis/kon计算。
测量的KN060对hApple-Chis蛋白的亲和力为<1.0E-12KD(M)。
上述结果表明,KN060表现出对于人FXI因子蛋白以及人Apple结构域很好的亲和力。
2.2KN060与FXIa的亲和力
为考察KN060是否可以和FXIa结合,本实验采用了生物膜干涉(Bio-LayerInterferometry,BLI)技术评价了KN060与人FXIa(hFXIa)的亲和力。将KN060稀释至10μg/ml固化到Protein A biosensor上。然后将hFXIa稀释至400nM、200nM、100nM、50nM、25nM,共5个浓度梯度与KN060结合。结果采用1:1模型拟合,计算得到KN060与人FXIa结合的平衡解离常数(KD)值。
结果显示,KN060与hFXIa结合的KD值为1.88E-09M。
表2KN060与hFXIa的亲和力结果
2.3KN060与食蟹猴和兔FXI的亲和力
利用生物膜干涉(Bio-Layer Interferometry,BLI)技术评价了KN060与食蟹猴、兔FXI的亲和力。将KN060原液201113DS稀释至10μg/ml固化到Protein A biosensor上。然后将食蟹猴和兔FXI-apple蛋白分别稀释至50nM、25nM、12.5nM、6.25nM、3.125nM,共5个浓度梯度与KN060结合。结果采用1:1模型拟合,计算得到样品的平衡解离常数(KD)值。
结果显示,KN060与食蟹猴和兔FXI均能结合,KD值分别为1.520E-13M和1.834E-10M,提示KN060与食蟹猴FXI的亲和力高于与兔FXI的亲和力。
表3KN060与食蟹猴和兔FXI亲和力结果
实施例3检测凝血因子XI(FXI)结合蛋白对FXI活性的抑制作用
3.1KN060在体外对FXI的活性抑制作用
应用全自动血凝分析仪测定KN060对标准人血浆APTT(活化部分凝血活酶时间,Activated partial thromboplastin time)的作用,来分析KN060在体外对FXI的抑制活性。KN060样品用凝血校准品稀释至9.766ng/ml-20000ng/ml,然后检测不同浓度KN060处理后的APTT,通过凝血校准品的定标曲线计算得到FXI活性值。使用SoftMax Pro软件对数据进行处理,以KN060浓度为横坐标,以测定的FXI活性均值为纵坐标绘制曲线,对曲线进行4参数拟合,根据检测数据和SoftMax Pro软件自带函数Relative Potency*100%计算并分析KN060对FXI活性的抑制作用。
结果显示,KN060在体外对FXI活性有明显的抑制作用,对FXI活性抑制的IC50值为650ng/ml。
表4不同浓度KN060对FXI的抑制活性结果
实施例4KN060对血浆APTT的延长作用或抑制作用
抗FXI抗体可以通过结合FXI,延长血浆APTT(活化部分凝血活酶时间,Activatedpartial thromboplastin time)。本实验应用全自动血凝分析仪检测了KN060对不同种属血浆APTT的延长作用(包括延长倍数和延长时间)。凝血仪检测APTT是常见的评价内源凝血途径的检测手段。操作方法是通过适量的磷脂、表面激活剂和孵育血浆激活内源性凝血因子,然后添加钙离子触发凝血过程。
4.1对人血浆APTT的延长作用
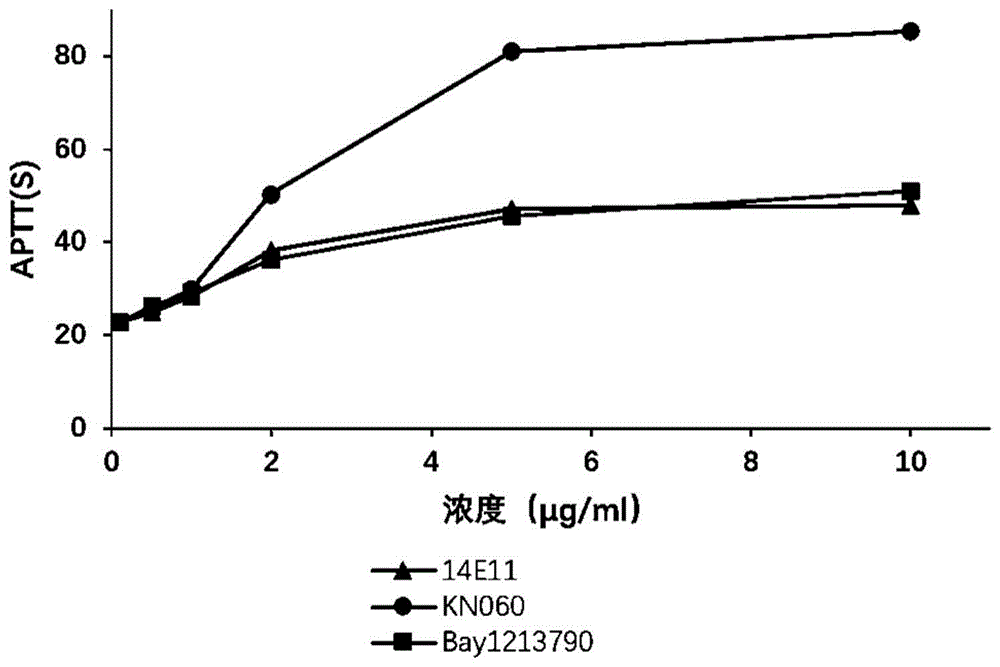
人血浆中,10μg/ml、5μg/ml、2μg/ml、1μg/ml和0.5μg/ml浓度的KN060、14E11和BAY1213790对标准人血浆APTT均有一定延长作用,且延长效果呈浓度依赖性。与空白人血浆相比,KN060、14E11和BAY1213790对APTT的最大延长倍数分别为3.71、2.09和2.22倍。KN060延长人血浆APTT效果明显强于14E11和BAY1213790。结果如图1和表5所示。
表5KN060、14E11和BAY1213790对标准人血浆APTT的延长倍数
4.2对食蟹猴血浆APTT的延长作用
食蟹猴血浆中,10μg/ml、5μg/ml、2μg/ml、1μg/ml和0.5μg/ml浓度的KN060和14E11对食蟹猴血浆APTT均有一定延长作用,且延长效果呈浓度依赖性。与空白血浆相比,KN060和14E11对APTT的最大延长倍数分别为3.38和2.53倍。KN060延长猴血浆APTT效果明显强于14E11。结果如图2和表6所示。
表6KN060和14E11对食蟹猴血浆APTT的延长倍数
4.3.对兔血浆APTT的延长作用
兔血浆中,10μg/ml、5μg/ml和2μg/ml浓度的KN060和14E11对兔血浆APTT均有一定延长作用,且延长效果呈浓度依赖性。与空白血浆相比,KN060和14E11对APTT的最大延长倍数分别为1.96和2.05倍。KN060在兔血浆中延长APTT的效果与14E11较为接近。结果如图3和表7所示。
表7KN060和14E11对兔血浆APTT的延长倍数
4.4.对大鼠血浆APTT的延长作用
大鼠血浆中,30μg/ml、10μg/ml和5μg/ml浓度的KN060和14E11对大鼠血浆APTT均有一定延长作用,且延长效果呈浓度依赖性。与空白血浆相比,KN060和14E11对APTT的最大延长倍数分别为1.76和1.37倍。KN060在大鼠血浆中延长APTT的效果与14E11类似。结果如图4和表8所示。
表8 KN060和14E11对大鼠血浆APTT的延长倍数
4.5对人全血浆的APTT的抑制活性
用标准人血浆(Sigma购买)稀释FXI抗体至不同浓度,37度孵育3min后检测全血APTT时间。14E11以及BAY1213790为阳性对照。
表9
表9显示了APTT时间随抗体浓度的变化。该结果展示KN060能有效延长全血APTT凝血时间;且表现出更优的抑制凝血的效果。
4.6对猴全血浆的APTT的抑制活性
用猴血浆(Sigma购买)稀释KN060至不同浓度,37度孵育3min后检测全血APTT时间。14E11以及BAY1213790为阳性对照。
结果见表10。
表10
4.7对兔全血浆的APTT的抑制活性
用兔血浆(Sigma购买)稀释施例KN060及标准品至不同浓度,检测全血APTT时间。14E11以及BAY1213790为阳性对照。
结果见表11。
表11
上述实验结果说明KN060能在人或猴的血浆中显示出较好的APTT抑制活性,并且都优于对照阳性抗体。
实施例5 KN060的体内药效检测
(1)在兔子AV-shunt血栓模型上通过单次预防性给予不同剂量的KN060,进行预防血栓形成的药效研究。
共24只雄性普通级新西兰兔,按照体重随机分为4组(G1-溶媒对照组;G2-KN0601mpk;G3-KN060 0.4mpk;G4-KN060 0.04mpk)。动物保持麻醉状态,用PE管连通左颈动脉与右颈静脉,连通管内含一长为10cm手术线并预填充生理盐水。在动静脉连通前15min对动物给药。连通后灌流30min使血栓形成。
模型结束后,取出管内手术线,在吸水滤纸上沾去血水,用天平称量血栓湿重。于给药前、模型结束时、模型结束后30min、60min和2h,采集血浆,测定APTT和PT(凝血酶原时间,Prothrombin time)。同时,模型结束时,采集全血,分离PRP(乏血小板血浆)和PPP(富血小板血浆),测定ADP(二磷酸腺苷)诱导的血小板聚集,评价血小板聚集能力。另外,于模型结束后5min,进行出血测试,测量出血量和出血时间,评价KN060对正常止血的影响。
结果显示,模型动物静脉注射给予0.04、0.4和1mg/kg的KN060,均表现出显著的抑制血栓重量(见图5和表12)和延长APTT的效果(见图6和表14)。低、中和高三个剂量治疗组的血栓湿重平均抑制率分别为20.57%、87.55%和95.87%(见图5和表13);模型结束后120min,低、中和高三个剂量治疗组APTT平均延长1.41、1.92和2.64倍(见图6和表15),药效呈明显的剂量依赖性。模型结束时,同时对ADP诱导的血小板聚集能力进行了测试,溶媒对照组和KN060低、中和高三个剂量治疗组的血小板平均聚集率分别为66.29%、60.59%、44.08%和33.62%,结果显示血小板聚集率与剂量呈负相关(见图7和表16)。KN060治疗对PT和出血无明显影响(见图8、图9和表17、表18、表19、表20)。
综上所述,不同剂量KN060在兔子AV-shunt血栓模型中,可剂量依赖性地减少血栓重量、延长APTT和降低血小板聚集率,表现出明显的预防血栓的药效,并且对PT和正常止血无明显影响。
表12不同剂量KN060对血栓重量的抑制作用
表13不同剂量KN060处理组的血栓重量抑制率
表14不同剂量KN060对APTT的延长作用
表15不同剂量KN060处理组的APTT延长倍数
表16不同剂量KN060处理后的血小板聚集率
表17不同剂量KN060对PT的影响
表18不同剂量KN060处理组的PT变化倍数
表19不同剂量KN060对出血时间的影响
表20不同剂量KN060对出血量的影响
(2)隔夜禁食兔子,通过耳缘静脉采集血液,耳缘静脉注射麻醉剂进行麻醉,在颈静脉远心端和近心端结扎,两根结扎线之间的间隔统一保持在3.0cm左右。造模前15min,耳缘静脉注射1mg/kg供试品或者PBS阴性对照品。动脉夹分别夹住颈静脉的近心端和远心端,用注射器从面静脉抽尽血管内的血液,再将0.3ml 5mg/ml的激动剂注射入封闭段血管中,激动剂孵育5分钟后将激动剂用注射器抽出,用生理盐水冲洗2次,松开动脉夹,使血液恢复流通,控制血管直径在0.8mm.诱导血栓形成。血液恢复流通25分钟后,用动脉夹夹紧封闭段的静脉远心端和近心段,并系紧之前结扎的静脉近心段和远心端手术线,剪开封闭静脉,取出血栓,立即称血栓湿重并记录。将血栓置于60度烘箱中烘干20h后,称取血栓干重并记录数据。
观察指标为血栓重量,实验数据用X±SD表示,应用GraphPad Prism 5 1wayANOVA进行显著性检验(见表21)。
表21
实施例6、KN060的特异性
选取上述实施例获得的KN060,通过生物膜干涉(Biolayerinterferometry,BLI)技术考察其对其他凝血相关蛋白的非特异性结合。将抗体蛋白固化到AHC芯片上,考察的蛋白为市售的FVII、FIX、FV、FXII、pro-thrombin、α-kallikrein、FVIIa、FIXa、FVa、FXIIa、Thrombin。实验结果表明所有的双特异性抗体与FVII、FIX、FV、FXII、pro-thrombin、α-kallikrein、FVIIa、FIXa、FVa、FXIIa、Thrombin均无结合。
实施例7、KN060的临床研究
1、评价在健康受试者中,KN060单次静脉滴注的安全性和耐受性。
试验方案:
试验设计:一项随机、双盲、安慰剂对照的I期临床研究,评估KN060注射液在中国健康受试者中的安全性、耐受性、药代动力学和药效学
受试者数:计划入组健康受试者38人。
具体分组及给药方式如下:
试验组:单次静脉滴注KN060注射液,共6个剂量组,各组给药剂量分别为0.1mg/kg、0.3mg/kg、1.0mg/kg、2.5mg/kg、5.0mg/kg、10.0mg/kg;
对照组:单次静脉滴注安慰剂。
入选受试者必须同时符合下列标准:1.健康男性或绝经后/无月经女性受试者;2.在签署知情同意时,年龄在18至55岁之间(包括界值);3.体重指数(BMI)在19.0和26.0kg/m2之间(不包括界值);男性体重≥50.0kg,女性体重≥45.0kg;4.活化部分凝血酶时间(APTT)、凝血酶原时间(PT)、国际标准化比值(INR)及血小板值正常;5.理解本研究方案的程序,愿意接受并遵守本方案的要求。
终点指标:
1)不良事件发生情况(D1-D56);
2)血药浓度及PK相关参数(D1-D56);
3)APTT、FXI活性、总FXI和Free FXI结果(D1-D56);
4)免疫原性(D1-D56)。
初步结果显示,KN060在人体中具有良好的安全性、药代动力学及药效动力学性质。
2、评价在择期全膝关节置换术患者中,单次静脉滴注KN060的有效性和安全性。
试验方案:
研究设计:在单侧膝关节择期置换术患者中,对比不同剂量KN060与依诺肝素预防静脉血栓栓塞的有效性及安全性的一项随机、开放、阳性对照的多中心研究
受试者数量及分组:预估纳入约400例受试者,随机分为KN060低、高两个剂量组以及LMWH组(低分子肝素)
给药方式:单次静脉滴注
给药时间:术后6~8h(不超过切口闭合后24h)
主要入排标准
1)入组标准:男性或女性(女性无生育潜力),年龄18~75岁之间(包括界值);
计划接受择期单侧TKA手术
2)排除标准:有出血性疾病或出血高风险;有VTE病史或正在进行无法中断的抗凝治疗;严重肝肾功能不全;血管造影禁忌;正在治疗的活动性恶性肿瘤;
需要进行区域麻醉,如脊髓或硬膜外麻醉;术前计划或术后需要进行硬膜外镇痛等。
主要终点指标
1)主要疗效终点:术后10~14天静脉血栓栓塞发生率(包括静脉造影检查证实DVT、症状性DVT和PE、致死性PE和PE不能排除的不明原因死亡);
2)主要安全性终点:签署知情同意书(ICF)到术后14天临床相关出血的发生率(定义为大出血或临床相关的非大出血);
3)PKPD终点(次要):部分受试者进行PKPD检测并与疗效及安全性终点进行相关性分析。
前述详细说明是以解释和举例的方式提供的,并非要限制所附权利要求的范围。目前本申请所列举的实施方式的多种变化对本领域普通技术人员来说是显而易见的,且保留在所附的权利要求和其等同方案的范围内。
- 用于治疗和/或预防血栓形成性或血栓栓塞性疾病和/或血栓形成性或血栓栓塞性并发症的取代的氧代吡啶衍生物
- 一种预防和治疗冠心病、血栓栓塞性疾病的药物制剂及其制备方法
