包括微针贴片的微创皮肤状态诊断试剂盒
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及包括微针贴片的微创皮肤状态诊断试剂盒。
背景技术
本发明要求以下7项韩国专利申请的优先权。以下7项韩国专利申请的说明书、权利要求书和附图中记载的全部技术内容均应视为包含在本发明的说明书中。
韩国专利申请第10-2020-0100151号(发明名称:包括微针贴片的微创皮肤皱纹或皮肤弹性诊断试剂盒)
韩国专利申请第10-2020-0100165号(发明名称:包括微针贴片的微创皮肤保湿程度评价试剂盒以及用于评价皮肤保湿程度的生物标志物)
韩国专利申请第10-2020-0100168号(发明名称:包括微针贴片的微创皮肤色素沉着程度评价试剂盒以及用于评价皮肤色素沉着程度的生物标志物)
韩国专利申请第10-2020-0100579号(发明名称:包括微针贴片的微创皮肤油分程度评价试剂盒以及用于评价皮肤油分程度的生物标志物)
韩国专利申请第10-2020-0101117号(发明名称:包括微针贴片的微创玫瑰痤疮型敏感皮肤评价试剂盒以及用于评价玫瑰痤疮型敏感皮肤的生物标志物)
韩国专利申请第10-2020-0101124号(发明名称:包括微针贴片的微创主观刺痛型敏感皮肤程度评价试剂盒以及用于评价主观刺痛型敏感皮肤程度的生物标志物)
韩国专利申请第10-2020-0100561号(发明名称:包括微针贴片的微创化妆品痤疮预测试剂盒以及用于预测化妆品痤疮的生物标志物)
本发明用于准确诊断、测定或评价各种皮肤状态。本发明所涵盖的皮肤状态为共7种。
-皮肤衰老(与皮肤皱纹或皮肤弹性相关)
-皮肤保湿
-皮肤色素沉着
-皮肤油分
-玫瑰痤疮型敏感皮肤
-刺痛型敏感皮肤
-化妆品痤疮
以下,将详细描述使用什么技术来诊断、测定或评价上述七种皮肤状态中的每一种,以及本发明人认识到了关于目前使用中的这些技术的哪些问题。
<皮肤衰老>
万物从出生就进入衰老的轨道,皮肤也会衰老。皮肤衰老的原因可以分为随衰老而进展的内源性因素和因长期暴露于阳光、寒冷、风和烟雾等环境因素而进展的外源性因素。
随着皮肤衰老,真皮层细胞外基质的主要成分胶原蛋白、弹性蛋白和透明质酸的含量以及成纤维细胞的数量减少,结果导致皱纹、弹性丧失而皮肤下垂。真皮层细胞外基质的减少是由基质金属蛋白酶(MMP:matrix metalloproteinase)引起的,例如胶原酶(collagenase)(MMP-1)和明胶酶(gelatinase)(MMP-2、MMP9)等,事实上在衰老的皮肤中这些酶的活性和表达显着增加。
皮肤屏障指的是角质层,其是比喻成“砖墙结构(Brick and Mortar)”的表皮层分化的最终形式。砖(Brick)由已死亡的无核角质细胞、各种细胞内蛋白质、包括天然保湿因子在内的分解产物,以及与其相连的角质化包膜(cornified envelope)组成。灰浆(Mortar)是指主要由神经酰胺、胆固醇和脂肪酸组成的角质细胞间脂质,具有多层板结构。随着衰老的进展,以约75%的比例观察到皮肤干燥,这是因为随着年龄的增长,对皮肤屏障的维持和基本功能的发挥很重要作用的因素(角质层脂质含量、表皮pH值)会被受损。在衰老的皮肤屏障中,板层体(Lamellar)数少,板层小体分泌减少,出现角质层中脂质减少等脂质代谢异常。并且,神经酰胺、胆固醇、脂肪酸等限速酶的功能降低,特别是胆固醇的合成大大减少,导致总脂质含量降低。并且,角质化包膜(cornified envelope)和天然保湿因子的表达减少。
需要进行适当的有效性评价,以测定皮肤衰老的状态,发现皮肤衰老的新机制,判断治疗效果,预测检查预后和开发新的治疗剂等。然而,由于经动物实验的化妆品、以经动物实验的原料生产的化妆品、经动物实验或以经动物实验的原料生产的进口化妆品均被全面禁止流通和销售,目前皮肤衰老机制的研究或化妆品的有效性评价依赖于使用人体应用设备的功效评价、胶带剥离、皮肤组织活检或使用3D皮肤模型(skin)进行离体(ex vivo)功效评价。
作为使用人体应用设备测定皮肤衰老的方法,以下描述的各种技术在本发明的申请日时被使用。
-使用皮肤快速三维成像系统(PRIMOS)设备用图像仅测定皮肤的形态部分的方法
-使用皮肤弹性测试仪(Cutometer)设备并利用负压测定皮肤反复收缩和松弛作用的平均值的方法
-使用经表皮失水率测定仪(Tewameter)设备测定与皮肤屏障功能异常相关的经表皮失水量(TEWL)变化的方法
-使用皮肤水份测试仪(Corneometer)设备并利用水的电导率等测定水分含量变化的方法
-使用皮肤酸度计(Skin-pHmeter)设备测定皮肤表面的酸度的方法
然而,上述方法难以用于研究皮肤衰老的具体机制,不能为科学解释具体因素的变化提供依据。特别是,无法提供有关细胞外基质变化的具体数据,包括作为皮肤衰老的最重要目标的真皮中的胶原蛋白。
最近,提出了一种使用胶带的无创剥离方法,通过在病变部位贴附和移除胶带来分析粘附于胶带上的皮肤标本。然而,皮肤衰老的主要原因在于真皮层的变化,如胶原蛋白或弹性纤维的退化等,而粘附于胶带上的物质仅限于角质层,不能反映真皮层的变化。
为了弥补这些缺点,采用了皮肤活检,但这一方法的缺点在于,需要外科医生熟练的技能,并且具有很强的侵入性,导致患者因疼痛而产生排斥感,并且在检查后会在活检部位留下疤痕。因此,在实际人体的有效性评价试验中,很难在试验药物使用前后一一进行皮肤活检,而且患者的依从性很差。
使用3D人造皮肤的离体(ex vivo)试验显示了模仿皮肤的最先进的结构,包括人体实际表皮层和真皮层的细胞,但价格昂贵,而且不包括实际皮肤中存在的血管、毛囊和皮下脂肪等结构,而不能认为反映实际皮肤的变化,因此不能完美替代皮肤活检。
因此,目前在研究皮肤衰老的机制或抗皮肤衰老的药物的有效性评价方面,没有替代动物实验或皮肤活检的方法,因此,迫切需要开发一种能够以无创方`式实际测定包括真皮层的胶原蛋白在内的细胞外基质的变化的方法。
<皮肤保湿>
皮肤负责对外部物理和化学刺激起到保护屏障作用和保持水分的作用。皮肤屏障存在于数层皮肤的表皮角质层中,负责对外部刺激的第一次物理防御作用。它具有由角质细胞与角质细胞之间的牢固的脂质结合构成的多层结构。皮肤屏障比喻成“砖墙结构(Brick and Mortar)”,角质细胞的主要砖(Brick)由已死亡的无核角质细胞、各种细胞内蛋白质、包括天然保湿因子在内的分解产物,以及与其相连的角质化包膜(cornifiedenvelope)组成。灰浆(Mortar)是指主要由神经酰胺、胆固醇和脂肪酸组成的角质细胞间脂质。因此,它负责防止水分流失和保持水分。角质层通过角质形成细胞增殖和分化形成,在各种蛋白水解酶的作用下周期性脱落,以维持稳态。
皮肤干燥是指伴有角质增加、皮肤表面粗糙、有拉扯感或瘙痒等症状的皮肤状态。由特应性皮炎或牛皮癣等皮肤病引起的内源性因素和干燥环境、风等气候条件、清洁剂和有机溶剂等化学物质、过度沐浴或洗脸、紫外线和物理刺激等外源性因素导致天然保湿因子、角质层中的脂质、皮脂等减少以及导致角质层异常脱落等,这些是因多种原因引起的,因此需要根据原因使用适当的保湿剂并管理生活方式。
因此,需要进行适当的有效性评价,以了解皮肤保湿状态并研究皮肤保湿障碍的机制,或开发能够纠正或治疗此类障碍的保湿剂或皮肤护理方法。由于经动物实验的化妆品、以经动物实验的原料生产的化妆品、经动物实验或以经动物实验的原料生产的进口化妆品均被全面禁止流通和销售,目前皮肤保湿机制的研究或化妆品的有效性评价使用诸如使用人体应用设备的功效评价、胶带剥离、皮肤组织活检或使用3D皮肤模型(skin)进行离体(ex vivo)功效评价等方法。
用于测定皮肤保持状态的人体应用设备包括皮肤水份测试仪(Corneometer)、经表皮失水率测定仪(Tewameter)以及皮肤酸度计(Skin-pHmeter)。皮肤水份测试仪(Corneometer)通过利用存储电荷的电量的电容(capacitance)与水分含量成正比的趋势来测定皮肤的保湿度,用于测定角质层下方30-40μm深度范围内的水分含量,水分越高,数值越高。经表皮失水率测定仪(Tewameter)与皮肤屏障的损坏密切相关,是一种测定经表皮失水量(TEWL;Transepidermal water loss)的设备。当皮肤屏障受损时,经表皮流失的水分蒸发增加,仪器检测经皮肤表皮蒸发的水分并提供一个数值,数值越高,表示失水量越大。皮肤酸度计(Skin-pHmeter)是一种测定皮肤酸度的仪器,通过测定皮肤表面的氢离子浓度来确认是否超出皮肤的正常酸度,即弱酸性(pH 4.5-5.5)。
由于这些人体应用设备非常敏感,因此受测定环境和操作人员的影响很大。因此,只有在暴露于恒温恒湿条件一定时间后,由熟练的操作人员用昂贵的仪器进行测定,才能得到可靠的结果。并且,由于这种方法只是简单地测定皮肤含水量、经表皮失水量和皮肤pH值,因此可以判断皮肤的干燥程度,但当由于各种原因导致皮肤保湿程度异常时,难以找出其原因机制、治疗方法或管理方法。
使用胶带的无创剥离方法通过在病变部位贴附和移除胶带来分析粘附于胶带上的皮肤标本,但该方法只是简单地测定皮肤表皮的最上层角质层,从而无法获取角质层下方的颗粒层到基底细胞层和真皮层中与保湿相关的变化的具体数据。
为了弥补这些缺点,采用了皮肤活检,但这一方法的缺点在于,需要外科医生熟练的技能,并且具有很强的侵入性,导致患者因疼痛而产生排斥感,并且在检查后会在活检部位留下疤痕。因此,在实际人体的有效性评价试验中,很难在试验药物使用前后一一进行皮肤活检,而且患者的依从性很差。
使用3D人造皮肤的离体(ex vivo)试验显示了模仿皮肤的最先进的结构,包括人体实际表皮层和真皮层的细胞,但价格昂贵,而且不包括实际皮肤中存在的血管、毛囊和皮下脂肪等结构或表皮层和真皮层中存在的各种免疫细胞,而可能跟实际皮肤变化不同,因此不能完美替代皮肤活检。
因此,目前在研究皮肤保湿的机制或保湿剂的有效性评价方面,没有替代动物实验或皮肤活检的方法,因此,迫切需要开发一种能够以无创方式测定整个表皮层和真皮层的变化的方法。
<皮肤色素沉着>
黑色素是一种分布于自然界的酚类高分子物质,是黑色的色素和蛋白质的复合物。黑色素具有阻挡一定量以上的紫外线的功能,因此维持皮肤的体温,保护皮肤免受紫外线的伤害。并且,黑色素是决定人体肤色的重要因素。皮肤中的黑色素是由黑素细胞产生的,黑色素的表达基因因人种不同而不同,黑素细胞的数量也随之调节,从而决定肤色。
当皮肤暴露于紫外线时,角质形成细胞会分泌促黑素细胞激素,促黑素细胞激素与黑素细胞的黑皮质素1受体(MC1R)结合,作用于黑素细胞的细胞核,使得酪氨酸酶、TYRP1和TYRP2等酶表达,黑色素开始产生。
黑色素的产生过程如下。首先,黑素细胞中的细胞器即黑素体生成,在黑素体中,以称为酪氨酸的氨基酸为起点,被氧化为DOPA,通过称为酪氨酸酶的氧化酶参与,被氧化为多巴醌(DOPA-quinone)。之后发生自氧化反应,生成5,6-二羟基吲哚(5,6-dihydroxyindol)、吲哚-5,6-醌(indol-5,6-quinone),最终产生深褐色黑色素。此后,大量的黑素体通过黑素细胞的树突向周围的角质形成细胞移动并被分解,黑素体在角质形成细胞中堆积,呈现出肤色。
根据肤色对皮肤分型进行分类始于1975年,当时美国的菲茨帕特里克(Fitzpatrick)首次将白种人皮肤分为四种类型,以确定牛皮癣的初始治疗量。后来又增加了两种类型,白种人定义为I、II、III、IV型,棕色皮肤的亚洲人定义为V型,黑色皮肤的人定义为VI型。然而,据多位研究人员提出,亚洲人也有多种皮肤分型并出现各种误差,因此目前根据皮肤对太阳紫外线的反应,分为从经常太阳灼伤的I型到只晒黑不灼伤的VI型。
需要进行适当的有效性评价,以评价或测定皮肤的色素沉着状态,发现皮肤色素性疾病中皮肤色素变化的新原因和机制,判断皮肤色素变化治疗的效果,预测检查预后和开发新的皮肤色素治疗剂等。然而,由于经动物实验的化妆品、以经动物实验的原料生产的化妆品、经动物实验或以经动物实验的原料生产的进口化妆品均被全面禁止流通和销售,目前皮肤色素沉着机制的研究或化妆品的有效性评价依赖于使用人体应用设备的功效评价、胶带剥离、皮肤组织活检或使用3D皮肤模型(skin)进行离体(ex vivo)功效评价。
作为使用应用于人体的装置测定皮肤色素的方法,一种使用皮肤黑色素和血红素测试仪(Mexameter)装置测定决定肤色的主要因素黑色素和血红蛋白量的皮肤吸收率的方法,或者使用分光光度计(Spectrophotometer)设备测定肤色的光谱反射率并通过三刺激值(tristimulus value)计算亮度和彩度的方法等。然而,这些方法只是简单地测定皮肤颜色或玫瑰痤疮的程度,难以用于研究皮肤色素沉着的具体机制。并且,无法科学解释特定因素的变化,特别是无法提供作为色素沉着的最重要目标的黑色素生成(melanogenesis)变化的具体数据。
提出了一种使用胶带的无创剥离方法,通过在病变部位贴附和移除胶带来分析粘附于胶带上的皮肤标本。然而,皮肤色素沉着的主要基质是黑色素生成(melanogenesis)等存在于基底层的黑素细胞的变化,而粘附于胶带上的物质仅限于角质层,因此存在难以反映其下表皮层(颗粒层、上皮细胞层、基底细胞层等)或真皮层内的变化的局限性。
为了弥补这些缺点,采用了皮肤活检,但这一方法的缺点在于,需要外科医生熟练的技能,并且具有很强的侵入性,导致患者因疼痛而产生排斥感,并且在检查后会在活检部位留下疤痕。因此,在实际人体的有效性评价试验中,很难在试验药物使用前后一一进行皮肤活检,而且患者的依从性很差。
使用3D人造皮肤的离体(ex vivo)试验显示了模仿皮肤的最先进的结构,包括人体实际表皮层和真皮层的细胞,但价格昂贵,而且不包括实际皮肤中存在的血管、毛囊和皮下脂肪等结构或表皮层和真皮层中存在的各种免疫细胞,而可能跟实际皮肤变化不同,因此不能完美替代皮肤活检。
因此,目前在研究皮肤色素沉着的机制或色素治疗剂的有效性评价方面,没有替代动物实验或皮肤活检的方法,因此,迫切需要开发一种能够以无创方式测定整个表皮层的变化的方法。
<皮肤油分>
与皮肤油分相关的皮脂是皮脂腺分泌的一种物质,其主要成分是甘油三酯、蜡酯和角鲨烯。皮脂腺是毛发的附属腺体,存在于真皮层,分泌的皮脂覆盖皮肤表面,防止水分向外释放。并且,还能中和碱,具有杀菌力,是防止皮肤干燥、延缓皮肤衰老的重要因素。
因此,当保持适当的皮脂分泌水平时才能说是健康的皮肤,当因雄性激素引起的皮脂分泌增加、毛囊壁角化、痤疮菌引起的炎症、压力等环境因素和遗传因素导致的皮脂分泌过度增加时,会阻塞毛孔而引起皮肤问题,与此相关的疾病包括痤疮和脂溢性皮炎等。
皮脂分泌因年龄和性别而异,婴儿时期分泌较少,青春期分泌增多,随后随年龄增长而减少。并且,男性的皮脂分泌量比女性多。一般来说,干性的反义词是皮脂分泌多的油性。皮脂腺主要分布的额头、眉间、鼻子周围部位称为T区。从脸颊到下巴的部位称为U区,一般来说,此部位的皮脂腺分布较少。U区偏干且T区偏油的皮肤属于混合性皮肤。对于油性皮肤,重要的是要相应地选择洗面奶和保湿剂。
需要进行适当的有效性评价,以了解皮肤油分状态并研究皮肤油脂的分泌障碍或分泌过多的机制。这对开发能够纠正或治疗皮肤油分障碍的清洁剂和治疗剂或皮肤护理方法也是必要的。
另一方面,由于经动物实验的化妆品、以经动物实验的原料生产的化妆品、经动物实验或以经动物实验的原料生产的进口化妆品均被全面禁止流通和销售,目前皮肤油分障碍或分泌过多的机制的研究或功能性化妆品的有效性评价依赖于使用人体应用设备的功效评价、胶带剥离、皮肤组织活检或使用3D皮肤模型(skin)进行离体(ex vivo)功效评价。
CK(Courage+Khazaka Electronic)公司的皮脂测定仪(Sebumeter)用作测定皮肤油分的人体应用设备。将厚度为0.1mm的皮脂收集胶带与皮肤接触后,测定吸收的皮脂,油分含量是根据胶带因皮脂而变得透明时透光率增加的原理来测定的。
由于这些人体应用设备非常敏感,因此受测定环境和操作人员的影响很大。因此,只有在暴露于恒温恒湿条件一定时间后,由熟练的操作人员进行测定才能得到可靠的结果。并且,由于这种方法只是简单地测定皮肤表面分泌的皮脂,不适合用于皮肤油脂的分泌的具体机制研究。并且,无法科学解释特定因素的变化,无法提供真皮层中存在的皮脂腺的变化的具体数据。
使用胶带的无创剥离方法通过在病变部位贴附和移除胶带来分析粘附于胶带上的皮肤标本,但该方法的标本采集区域仅限于角质层,因此无法反映与皮肤油分相关的真皮层的变化。
为了弥补这些缺点,采用了皮肤活检,但这一方法的缺点在于,需要外科医生熟练的技能,并且具有很强的侵入性,导致患者因疼痛而产生排斥感,并且在检查后会在活检部位留下疤痕。因此,在实际人体的有效性评价试验中,很难在试验药物使用前后一一进行皮肤活检,而且患者的依从性很差。
使用3D人造皮肤的离体(ex vivo)试验显示了模仿皮肤的最先进的结构,包括人体实际表皮层和真皮层的细胞,但价格昂贵,而且不包括实际皮肤中存在的血管、毛囊和皮下脂肪等结构或表皮层和真皮层中存在的各种免疫细胞,而可能跟实际皮肤变化不同,因此不能完美替代皮肤活检。
因此,目前在研究皮肤油脂的分泌状态以及油脂的分泌机制或皮肤油分的有效性评价方面,没有替代动物实验或皮肤活检的方法,因此,迫切需要开发一种能够以无创方式测定皮肤真皮层变化的方法。
<玫瑰痤疮型敏感皮肤>
敏感性,是鲍曼皮肤分型的四大类之一,又可进一步分为四种亚型:痤疮型敏感皮肤(acne type)、主观刺痛型敏感皮肤(stinging type)、过敏型敏感皮肤(allergic type)以及玫瑰痤疮(酒渣鼻)型敏感皮肤(rosacea type)。某些人可能只有这些敏感性中的一种,或者可能具有复合型敏感性。在对27485名美国人进行的鲍曼皮肤分型问卷调查研究中观察到,73%的受访者是敏感皮肤,49%的受访者是玫瑰痤疮型敏感皮肤分型(BaumannL.,Dermatol Clin.2008:26(3):359-373)。
玫瑰痤疮是主要发生在面部中央部位的肤色发红,是毛细血管扩张引起的症状,由更年期荷尔蒙失调、皮肤屏障减弱引起的敏感、类固醇的副作用等各种原因引起。它是由外部刺激暂时引起的,但是如果变成慢性,则可能会发生称为酒渣鼻(Rosacea)的慢性炎症性疾病。
玫瑰痤疮型敏感皮肤是指皮肤在使用含有特定成分的化妆品时,皮肤变得又红又热,有时还伴有炎症性丘疹和毛细血管扩张的皮肤。如果是玫瑰痤疮型敏感皮肤,建议尽量减少面部温度的快速变化,并建议使用含有抗炎成分的洗面奶、保湿剂或防晒霜,示例包括芦荟、摩洛哥坚果油(argan oil)、红没药醇(Bisabolol)、咖啡因、洋甘菊(chamomile)、黄瓜、绿茶、金缕梅(witch hazel)、烟酰胺(niacinamide)和水杨酸(Salicylic acid)等。
因此,需要进行适当的功效评价,以发现玫瑰痤疮型敏感皮肤的新机制,预测各种化妆品成分玫瑰痤疮型敏感皮肤的发生,并开发新的治疗剂等。然而,由于经动物实验的化妆品、以经动物实验的原料生产的化妆品、经动物实验或以经动物实验的原料生产的进口化妆品均被全面禁止流通和销售,目前玫瑰痤疮型敏感皮肤机制的研究或化妆品的有效性评价依赖于使用人体应用设备的功效评价、胶带剥离、皮肤组织活检或使用3D皮肤模型(skin)进行离体(ex vivo)功效评价。
皮肤黑色素和血红素测试仪(Mexameter)(Courage+Khazaka Electronic)和分光光度计(Spectrophotometer)可用作测定玫瑰痤疮型敏感皮肤的人体应用设备。皮肤黑色素和血红素测试仪(Mexameter)同时测定黑色素值和代表红斑的血红蛋白(hemoglobin)值,其是一种分光方式的设备,使用对应于黑色素和红斑的三个不同波段(568nm、660nm、880nm)测定从探针(probe)发出的光的反射率,以红斑指数(EI;Erythema index)提供红斑量。分光光度计(Spectrophotometer)是用于测定物体颜色的光谱反射率的设备,用CIE颜色系统L*、a*、b*计算颜色。L*表示明度,a*表示红色,b*表示黄色,越接近0表示越接近无色,反之表示色度越高。
由于这些人体应用设备非常敏感,因此受测定环境和操作人员的影响很大。因此,只有在恒温恒湿条件下由熟练的操作人员进行测定才能得到可靠的结果。并且,由于这种方法只是简单地测定皮肤表面颜色,不足以用于玫瑰痤疮型敏感皮肤具体机制研究,并且,没有提供有关对玫瑰痤疮很重要的真皮中存在的毛细血管的具体数据。
使用3D人造皮肤的离体(ex vivo)试验显示了模仿皮肤的最先进的结构,包括人体实际表皮层和真皮层的细胞,但价格昂贵,而且不包括实际皮肤中存在的血管、毛囊和皮下脂肪等结构,而不能认为反映实际皮肤的变化。
因此,需要一种可以预测玫瑰痤疮型敏感皮肤的新试验,以使用适合玫瑰痤疮型敏感皮肤的治疗剂或化妆品。
<刺痛型敏感皮肤>
敏感皮肤是指对刺激物质、压力、环境因素等反应敏感,产生刺痛感和刺痛反应的皮肤。敏感皮肤可以从主观和客观的角度来定义。在对主观刺痛敏感的皮肤中,在没有客观炎症症状的情况下,会出现烧灼感、瘙痒感等自己感到的主观症状。在客观反应的敏感皮肤中,出现由专家观察到的红斑、风团、水疱等伴随皮肤病变的客观症状。
虽然已知敏感皮肤的发展涉及多种机制,例如神经感觉信号传递增加、免疫反应增加和皮肤屏障减弱等,但它非常复杂。在导致皮肤敏感的因素中,内源性因素包括遗传、过度劳累、压力和睡眠不足等,外源性因素包括化妆品、清洁剂、紫外线、化学物质和环境等。在对27485名美国人进行的鲍曼皮肤分型问卷调查研究中观察到有73%的受访者是敏感皮肤,并观察到15%是主观刺痛型敏感皮肤。
需要进行适当的功效评价,以测定主观刺痛型敏感皮肤的敏感程度,发现主观刺痛型敏感皮肤的新机制,预测检查预后,开发可以预防主观刺痛型敏感皮肤的局部外用药物或化妆品等。然而,由于经动物实验的化妆品、以经动物实验的原料生产的化妆品、经动物实验或以经动物实验的原料生产的进口化妆品均被全面禁止流通和销售,目前作为主观刺痛型敏感皮肤机制的研究或个人的敏感度评价方法,可以使用根据受试者的意见确定皮肤刺痛程度的主观测定法和通过皮肤科医生视诊观察的客观测定法或者皮肤组织活检等来进行功效评价。
根据受试者的意见确定皮肤刺痛程度的主观测定法包括乳酸刺痛试验(lacticacid sting test)、使用氯仿和甲醇的混合溶液的烧灼感或疼痛诱发试验等,客观测定法包括将SLS、DMSO、氢氧化铵(ammonium hydroxide)、氢氧化钠(sodium hydroxide)等涂抹在皮肤上,观察皮肤的红斑、水疱等变化的方法。然而,对于主观刺痛型敏感皮肤的诊断尚无标准化的试验方法,而许多研究中引用的乳酸刺痛试验(lactic acid sting test)也依赖于受试者在涂抹乳酸(lactic acid)后的主观感受,因此存在其重现性和准确性无法定量化的局限性,很难将其视为完整的试验方法,因此需要一种排除主观评价的可重现的客观刺痛诊断方法。
为了弥补这些缺点可以采用皮肤活检,但这一方法的缺点在于,需要外科医生熟练的技能,并且具有很强的侵入性,导致患者因疼痛而产生排斥感,并且在检查后会在活检部位留下疤痕。因此,在实际人体的有效性评价试验中,很难在试验药物使用前后一一进行皮肤活检,而且患者的依从性很差。
因此,目前在研究主观刺痛型敏感皮肤的机制或开发用于预防主观刺痛型敏感皮肤的局部外用药物或化妆品方面,除了乳酸刺痛试验外,没有能够客观评价皮肤的敏感程度的方法。因此,需要开发一种发现特异性表达于主观刺痛型敏感皮肤的生物标志物并利用该生物标志物以无创方式评价主观刺痛型敏感皮肤的敏感程度的方法及实现该方法的试剂盒。
<化妆品痤疮>
敏感皮肤包括四种亚型:出现丘疹和脓疱等痤疮样病变的痤疮型、出现反复玫瑰痤疮和灼痛症状的酒渣鼻型、出现刺痛感的刺痛型以及与过敏原接触时出现红斑和瘙痒等症状的过敏型。
痤疮是一种发生在毛囊皮脂腺单位的炎症性皮肤病,它是一种频繁发生的疾病,在青少年和年轻人中显显示80%患病率。痤疮的原因包括毛囊过度角化、炎症反应、皮脂分泌增加和痤疮丙酸杆菌(Proprioni bacterium acnes)形成菌落等。除此之外,由于环境因素等复杂因素,会出现各种临床症状。痤疮以非炎症性病变和炎症性病变的形式出现,非炎症性病变表现为称为黑头的开放性粉刺和称为白头的闭合性粉刺,炎症性病变表现为丘疹、脓疱和结节等。轻度痤疮以粉刺为主要病变,中度痤疮以丘疹、脓疱为主要病变,重度痤疮以结节、假性囊肿为主要病变。
化妆品对青春期后发生的痤疮有重要影响。也就是说,部分患者在使用化妆品后,往往会出现痤疮样皮疹,这些病变就是所谓的化妆品痤疮。在对27485名美国人进行的鲍曼皮肤分型问卷调查研究中观察到有73%的受访者是敏感皮肤,并观察到58%是化妆品痤疮。使用化妆品后是否诱发痤疮,取决于毛囊角质栓的粉刺诱发能力和丘疹脓液的形成。
根据检查技术的不同,可能会出现不同的结果。如果肉豆蔻酸异丙酯的浓度或凡士林的浓度低于10%,则会在兔耳早期引起粉刺,而在人类中会引起丘疹脓液。乳化剂如十二烷基硫酸钠与剂量成正比地产生脓液。由于肉豆蔻酸异丙酯(Isopropyl myristate)、棕榈酸异丙酯(isopropyl palmitate)和椰子油(coconut oil)等形成粉刺的成分会引起化妆品痤疮,因此对出现化妆品痤疮的敏感皮肤应使用不含这些成分的产品。然而,这些化妆品痤疮发生的确切机制并不为人所知,也没有试验方法可以预测各种分型皮肤是否会因敏感性而发生化妆品痤疮。
因此,需要进行适当的新评价法,以发现化妆品痤疮的新机制,预测各种化妆品成分是否致化妆品痤疮发生,开发新的治疗剂等。然而,由于经动物实验的化妆品、以经动物实验的原料生产的化妆品、经动物实验或以经动物实验的原料生产的进口化妆品均被全面禁止流通和销售,目前痤疮发生机制的研究或个人化妆品痤疮的评价方法只有通过皮肤科医生视诊的观察方法和韩国食品医药品安全处(Ministry of Food and Drug Safety)指南中对痤疮的有效性评价变量的试验方法。最近,在化妆品停止动物实验后,通过使用检查或在背部涂抹化妆品4周后用强力粘合剂或阳离子聚合物表面活检的方法确认微粉刺的形成的方法,进行人体检查。
韩国食品医药品安全处(Ministry of Food and Drug Safety)指南中对痤疮的有效性评价变量的试验方法包括在测定受试物质作用前后受试者面部出现的病变的种类和数量并根据从1到5的等级中记录符合标准的等级的方法和测定病变的数量并计算麦克尔森氏痤疮严重程度指数(Michaelson's Acne Severity Index,ASI)的方法。然而,因为这些方法是根据受试者的主观标准来判断而存在无法客观定量的局限性,而且由于仅记录肉眼可见的痤疮现象,因此无法科学解释对痤疮发生的具体机制的研究和特定因素的变化,而无法将其视为完整的试验方法,使用3D人造皮肤的离体(ex vivo)试验显示了模仿皮肤的最先进的结构,包括人体实际表皮层和真皮层的细胞,但价格昂贵,而且不包括实际皮肤中存在的血管、毛囊和皮下脂肪等结构,而可能跟实际皮肤变化不同。因此,需要进行适当的化妆品痤疮发生预测检查,以针对青春期后因使用化妆品等而频繁出现痤疮样皮疹的皮肤选择合适的治疗剂或化妆品。
为了测定和评价以上七种皮肤状态,研究了截至申请日使用中的技术中存在问题。本发明人使用微针诊断、测定或评价本发明的皮肤状态。微针是一种长度为1mm以下的微细的针,是一种以微创的方式穿透角质层,在皮肤上形成微孔,有效输送药物的药物输送技术,最近它不仅用于药物和生物活性物质的输送,其使用范围扩展至用于获取体内标本并预测和诊断疾病。特别是,可以将通过微针形成的微孔采集体液或血液等人体标本用于生物标志物检测和疾病预测等。作为一例,空心(hollow)微针的针内有毛细管,贴在皮肤上后通过毛细管抽取血液。它的优点是使将患者的痛苦最小化的同时能够相对安全地抽取血液并检测血液中的葡萄糖和胆固醇或检测生物标志物,但是,如果针在皮肤中折段,则极有可能出现副作用,可能出现出血等副作用。
溶胀型(swellable)微针的原理是贴附于皮肤后吸收皮肤间质液而膨胀并封闭穿刺部位,无需粘合剂即可贴附于皮肤,将吸收的体液分离并用于生物标志物检测、监测和疾病预测。然而,由于贴片必须长时间贴附以吸收分析所需的体液,因此存在很难根据各种环境因素稳定贴附贴片的局限性。
本发明中使用的可溶性(dissolving)微针是通过将在体内溶解的高分子材料与活性成分混合,然后固化成微针而制成的。当这些可溶性微针贴附在皮肤上时,它们会被体液有效溶解,并且可以轻松地将药物输送到皮肤中。此外,可溶性微针不是由金属或塑料制成的,因为不会在皮肤上折断而安全。本申请人在本发明中将可溶性微针用于新目的,包括:首次使用可溶性微针采集皮肤标本(RNA、DNA、蛋白质);使用所述标本进行RNA微阵列(RNA microarray)分析;基于分析结果发现化妆品痤疮的生物标志物;使用所述生物标志物预测化妆品痤疮并评价治疗剂或化妆品的有效性等。
最近,随着直接面向消费者(DTC;Direct-To-Consumer)服务的提供,皮肤分型分析的研究正在积极进行,这是一项通过分析与皮肤相关的基因DNA中的单核苷酸多态性(SNP)来提供信息的服务。主要采集口腔上皮细胞来分析DNA碱基序列,通过比较特定基因的碱基序列是否与正常人不同来给出风险等级。皮肤基因可以通过无创方式进行检测,但也有局限性。由于DNA在所有细胞中都相同存在且不可改变,因此它不能反映因各种环境因素而发生变化的实际皮肤状态。即使一个人天生具有特定的SNP,如果通过后天管理或治疗恢复,则结果无法反映在SNP分析中。由于这些特点,SNP分析很难应用于新的有效物质的发现、机制研究或功效评价。不仅如此,目前使用口腔上皮的SNP分析不能反映实际皮肤状态,因为标本采集部位是口腔上皮,而不是皮肤。另一方面,由于RNA是一种可以翻译成在实际细胞中发挥作用的蛋白质的物质,并且每个细胞显示特异性表达水平,因此可以反映因各种因素而变化的实际皮肤特征。因此,可以说观察实际皮肤细胞中RNA和蛋白质水平的表达对于准确的皮肤状态分析是必不可少的。
与DNA基因组分析不同,RNA转录本分析可以检测仅在皮肤细胞中特异性表达或表达因药物暴露等环境条件而异的基因,并且可以确认试验组和对照组之间的基因表达量差异,因此可应用于需要进行试验前后对比的有效性评价、机制研究以及候选物质的发现。并且,通过微阵列(microarray)技术可以比较一个试样中40000个以上基因的表达,这对于预测疾病或发现治疗性生物标志物非常有用。然而,如上所述,以无创方式收集RNA和蛋白质的方法存在局限性。本发明人旨在提出一种能够克服上述局限的方法。
发明的内容
发明要解决的技术问题
本发明的一个目的在于解决如上所述的传统用于诊断、测定或评价皮肤状态的方法中存在的问题。在传统的方法中,例如组织活检的缺点在于需要外科医生的熟练技能,患者因疼痛而产生排斥感,并且在检查后会在活检部位留下疤痕。胶带剥离是另一种传统方法,其缺点在于粘附于胶带上的物质仅限于角质层,因此只能用作辅助试验方法,不能提供完整的结果。此外,传统的SNP阵列(SNP array)使用的是人体标本的DNA,而DNA是从出生就确定且不会改变的,其缺点是难以反映因各种环境因素而改变的实际皮肤状态。
本发明的再一目的在于,提供一种新型微创皮肤状态诊断试剂盒,与现有的组织活检相比几乎没有疼痛,不留疤痕,能够提高患者的使用便利性的同时,通过采集角质层内部的皮肤因子,与现有的胶带剥离相比,可以提高分析结果的可靠性,并反映实际皮肤因各种环境因素而改变的状态。
并且,本发明的另一目的在于,提供一种用于测定皮肤状态的生物标志物,其使用皮肤标本作为生物样品。
并且,本发明的又一目的在于,实现上述目的的同时提供以下内容。
-用于预测皮肤状态的组合物
-用于预测皮肤状态的试验方法以及皮肤分型分类方法
-用于筛选诱导或抑制皮肤状态的候选物质并评价治疗剂的有效性的方法
-用于评价改善皮肤状态的普通化妆品、功能性化妆品、医疗器械和药物等的人体应用功效的动物试验的替代方法。
用于解决问题的技术方案
本发明一实施例的微创皮肤状态诊断试剂盒包括:能够定量化从受试者的皮肤提取的标本中RNA基因的表达程度的设备;以及包括由生物可降解高分子透明质酸构成且具有实心结构的多个微针的微针贴片。所述微针贴片贴附于受试者的皮肤,并保持预定时间后分离的状态下,通过所述设备对吸附在所述微针贴片的微针表面的受试者的皮肤的标本或其提取物进行定量分析,所述设备定量化从吸附在所述微针贴片的微针表面的受试者的皮肤的标本或其提取物中要诊断的各种皮肤状态相关RNA生物标志物基因的表达程度,基于所述定量化的值做出各种皮肤状态的诊断。
在要诊断的皮肤状态为皮肤衰老的情况下,使用两种类型的生物标志物基因:胶原蛋白/弹性相关RNA生物标志物基因和皮肤屏障功能/水分合成相关RNA生物标志物基因。所述胶原蛋白/弹性相关生物标志物包含COL1A1、COL3A1、FN1、GSTA3、PON1、PINK1、COL4A4以及MMP8中的任意一种或两种以上,皮肤屏障功能/水分合成相关生物标志物包含IVL、HAS2、HAS3、AQP3、CERS6、CLDN1、SLC9A1、TGM1、SPINK5、KLF4、LCE1A、LCE1B、LCE1F、LCE2A、BGN以及AZGP1中的任意一种或两种以上。
在要诊断的皮肤状态为皮肤保湿的情况下,作为皮肤保湿相关生物标志物,可以使用CDSN、FLG、FLG2、LOR、KLF4、KRT10、LCE1A、LCE2A、LCE2B、LCE2C、SMPD3、CDH1、ITGB4、IVL、SPINK5、CLDN1、AQP3、BGN、HAS3、TGM1、CLDN7、CERS3、CLDN4以及KRT1中的任意一种或两种以上。
在要诊断的皮肤状态为皮肤色素沉着的情况下,作为皮肤色素沉着相关生物标志物,可以使用CAT、CLU、DSG1、GPNMB、GPX4、GSTM2、GSTP1、MLANA、PAX3、SOX10、TFAP2A、TYR、TYRP1、MC1R、F2RL1以及CLDN1中的任意一种或两种以上。
在要诊断的皮肤状态为皮肤油分的情况下,作为皮肤油分相关生物标志物,可以使用MFAP2、IGF1、HSD11B1、GPAM、CPT1C、AR、MPZL3、AQP3、SREBF2以及HSD17B2中的任意一种或两种以上。
在要诊断的皮肤状态为玫瑰痤疮型敏感皮肤的情况下,作为玫瑰痤疮型敏感皮肤相关生物标志物,可以使用COL3A1、TAC1、KLK5、CAMP、MMP9、TRPA1、IL13RA1、HSD3B1、CXCR4、ANGPT2、CXCL2、CXCR5以及PSMB9中的任意一种或两种以上。
在要诊断的皮肤状态为主观刺痛型敏感皮肤的情况下,作为主观刺痛型敏感皮肤相关生物标志物,可以使用IVL、LOR、FLG、FLG2、PGF、CYR61、HLA-B、IGHA1、MMP3、RBP4以及G0S2中的任意一种或两种以上。
在要诊断的皮肤状态为化妆品痤疮的情况下,作为化妆品痤疮相关生物标志物,可以使用MMP3、MMP12、CCR1、AKR1B10、THY1以及IL-6中的任意一种或两种以上。
并且,本发明一实施例的皮肤状态诊断试剂盒还可包括用于从受试者的皮肤的标本提取RNA的设备。通过所述RNA提取设备获取的RNA可以经过扩增过程并提供给所述定量化设备。
此外,本发明的微创皮肤状态诊断试剂盒还可以包括其他追加构成。
发明的效果
根据本发明独特的微创皮肤标本获取方法,揭示了生物标志物在诊断各种皮肤状态中的有用性。可用于诊断、评价或测定各种皮肤状态的生物标志物将在稍后描述的实施例中详细描述。
使用这些生物标志物,可以测定任何一个或多个基因的mRNA或其蛋白质水平。由于确认了所述基因或其蛋白质水平在各种皮肤状态测定对象中升高或降低,因此可以有效地用于通过测定其水平来测定和评价皮肤状态。
根据本发明,能够解决使用人体标本的DNA的传统的SNP阵列(SNP array)方式的皮肤分型诊断方法中存在的问题。传统的SNP阵列(SNP array)使用的是人体标本的DNA,而DNA是从出生就确定且不会改变的,其缺点是难以反映因各种环境因素而改变的实际皮肤状态。并且,根据本发明,能够解决传统的人体应用设备测定、胶带剥离、组织活检以及3D人造皮肤离体(ex vivo)试验方式的皮肤衰老诊断方法中存在的问题,本发明可以解决这种问题。
传统使用人体应用设备的测定是以单层方式测定皮肤表面的方法,缺点在于难以用于具体机制的研究和科学解释特定因素的变化。
传统的胶带剥离的缺点在于粘附于胶带上的物质仅限于角质层,因此只能用作辅助试验方法,不能提供完整的结果。
传统的组织活检的缺点在于需要外科医生的熟练技能,患者因疼痛而产生排斥感,并且在检查后会在活检部位留下疤痕。
传统的使用3D人造皮肤的离体(ex vivo)试验的价格昂贵,而且不包括实际皮肤中存在的血管、毛囊和皮下脂肪等结构,而不能认为反映实际皮肤的变化,因此不能完美替代皮肤活检。
根据本发明,可以提供一种新型微创皮肤状态诊断试剂盒以及用于测定皮肤状态的生物标志物,与现有的组织活检相比几乎没有疼痛,不留疤痕,能够提高患者的使用便利性的同时,通过采集角质层内部的皮肤因子,与现有的胶带剥离相比,可以提高分析结果的可靠性。
使用本发明提供的所述试剂盒或生物标志物,可以比现有技术更有效地开发和筛选诱导或抑制特定皮肤状态的物质以及治疗剂,并且可以针对每个人提供准确的皮肤分型信息,由此可以对个人的皮肤分型进行科学分类,以开发定制化化妆品。
并且,根据本发明,可以提供用于评价改善皮肤状态的普通化妆品、功能性化妆品、医疗器械和药物等的新型人体应用功效动物试验的替代方法。
附图说明
图1为显示现有技术的皮肤活检方法的图。
图2为概念性地显示本发明的皮肤活检方法的图。
图3为与眼部皱纹测定相关的高分辨率照片。
图4和图5为显示
图6为显示使用R 4.0.0程序进行基因比对的图。
图7为筛选并列出皮肤衰老原因中与胶原蛋白或弹性相关的基因的表。
图8为筛选并列出皮肤衰老原因中与屏障功能或水分合成相关的基因的表。
图9至图12显示为了直观比较分析通过RNA微阵列分析选择的皮肤衰老相关生物标志物候选物的表达程度而进行热图(heatmap)分析的结果。
图13至图20显示为了确认通过RNA微阵列分析选择的皮肤衰老相关生物标志物候选物与人体应用设备(皮肤快速三维成像系统(PRIMOS)、皮肤弹性测试仪(Cutometer)、皮肤水份测试仪(Corneometer)、经表皮失水率测定仪(Tewameter)以及皮肤酸度计(Skin-pHmeter))测定结果之间的相关关系而进行双变量相关分析的结果。
图21显示使用皮肤快速三维成像系统(PRIMOS)设备拍摄的高分辨率照片。
图22显示使用皮肤快速三维成像系统(PRIMOS)设备测定眼部皱纹的粗糙度的结果。
图23显示使用皮肤弹性测试仪(Cutometer)设备测定皮肤弹性的结果。
图24显示使用皮肤水份测试仪(Corneometer)设备测定含水量的结果。
图25为显示胶原蛋白/弹性相关皮肤衰老有效性评价生物标志物候选物的表。
图26为显示皮肤屏障功能/水分合成相关皮肤衰老有效性评价生物标志物候选物的表。
图27为使用进行了皮肤衰老有效性评价的受试者的RNA微阵列分析结果显示胶原蛋白/弹性相关皮肤衰老有效性评价生物标志物候选物的表达的热图(heatmap)。
图28为显示皮肤屏障功能/水分合成相关皮肤衰老有效性评价生物标志物候选物的表达的热图(heatmap)。
图29至图32为用于确认通过皮肤衰老有效性评价RNA微阵列分析筛选的皮肤衰老有效性评价生物标志物候选物与人体应用设备(皮肤快速三维成像系统(PRIMOS)、皮肤弹性测试仪(Cutometer)以及皮肤水份测试仪(Corneometer))测定结果之间的相关关系而进行双变量相关分析的结果。
图33为显示基因比对结果的图。
图34为整理出通过文献调查被确认为与皮肤保湿相关的基因的微阵列(microarray)试验结果的确认的基因表达相关数值的表。
图35至图38显示为了直观比较分析通过RNA微阵列分析选择的皮肤保湿相关生物标志物候选物的表达程度而进行热图(heatmap)分析的结果。
图39至图45显示为了确认通过RNA微阵列分析选择的皮肤保湿生物标志物候选物与人体应用设备(皮肤水份测试仪(Corneometer)、经表皮失水率测定仪(Tewameter)以及皮肤酸度计(Skin-pHmeter))测定结果之间的相关关系而进行双变量相关分析的结果。
图46显示进行了皮肤保湿有效性评价的结果。
图47为选择通过皮肤保湿有效性评价RNA微阵列分析被确认为与图35至图38的皮肤保湿(水分含量/水分流失/皮肤pH)生物标志物相同的趋势的基因并整理出基因表达相关数值的表。
图48为用于直观比较分析通过皮肤保湿有效性评价RNA微阵列分析筛选的皮肤保湿有效性评价生物标志物候选物的表达程度而进行图表化的图。
图49为显示基因比对结果的图。
图50为整理出被确认为与皮肤色素沉着相关的基因的微阵列试验结果的基因表达相关数值的表。
图51和图52显示为了直观比较分析通过RNA微阵列分析选择的皮肤色素沉着生物标志物候选物的表达程度而进行热图(heatmap)分析的结果。
图53至图58显示为了确认通过RNA微阵列分析选择的皮肤色素沉着相关生物标志物候选物CAT、CLU、DSG1、GPNMB、GPX4、GSTM2、GSTP1、MC2R、MLANA、PAX3、SOX10、TFAP2A、TYR以及TYRP1基因与人体应用设备(分光光度计(Spectrophotometer)以及皮肤黑色素和血红素测试仪(Mexameter))测定结果之间的相关关系而进行双变量相关分析的结果。
图59和图60显示为了评价皮肤美白有效性而分别使用分光光度计(Spectrophotometer)设备测定皮肤并使用皮肤黑色素和血红素测试仪(Mexameter)设备测定眼部黑色素的结果。
图61为列出皮肤美白有效性生物标志物候选物的表。
图62显示为了直观比较分析通过皮肤美白有效性评价RNA微阵列分析筛选的皮肤美白有效性评价生物标志物候选物的表达程度而进行热图(heatmap)分析的结果。
图63和图64显示进行了皮肤美白有效性评价的受试者的通过RNA微阵列分析选择的皮肤美白有效性生物标志物候选物与人体应用设备的测定结果之间的相关关系的分析结果。
图65为显示基因比对结果的图。
图66为整理出通过文献调查被确认为与皮肤油分相关的基因的微阵列试验结果的基因表达相关数值的表。
图67显示为了直观比较分析通过RNA微阵列分析选择的皮肤油分生物标志物候选物的表达程度而进行热图(heatmap)分析的结果。
图68和图69显示为了确认通过RNA微阵列分析选择的皮肤油分相关生物标志物候选物基因与人体应用设备(皮脂测定仪(Sebumeter))测定结果之间的相关关系而进行双变量相关分析的结果。
图70为显示基因比对结果的图。
图71为整理出通过文献调查被确认为与玫瑰痤疮型敏感皮肤相关的基因的微阵列试验结果的基因表达相关数值的表。
图72显示为了直观比较分析通过RNA微阵列分析选择的玫瑰痤疮型敏感皮肤生物标志物候选物的表达程度而进行热图(heatmap)分析的结果。
图73至图75显示为了确认通过RNA微阵列分析选择的玫瑰痤疮型敏感皮肤相关生物标志物候选物基因与人体应用设备(皮肤黑色素和血红素测试仪(Mexameter)、分光光度计(Spectrophotometer))测定结果之间的相关关系而进行双变量相关分析的结果。
图76为显示乳酸刺痛试验方法的图。
图77为显示基因比对结果的图。
图78为整理出通过文献调查被确认为与主观刺痛型敏感皮肤相关基因的微阵列试验结果的基因表达相关数值的表。
图79和图80显示为了直观比较分析通过RNA微阵列分析选择的主观刺痛型敏感皮肤的生物标志物候选物的表达程度而进行热图(heatmap)分析的结果。
图81至图84显示为了确认通过RNA微阵列分析选择的主观刺痛型敏感皮肤相关生物标志物候选物基因与乳酸刺痛试验分数之间的相关关系而进行双变量相关分析的结果。
图85为显示使用R 4.0.0程序进行基因比对的结果的图。
图86为整理出通过文献调查被确认为与痤疮相关的基因的微阵列试验结果的确认的基因表达相关数值的表。
图87为显示通过皮肤科医生的身体检查选择5名化妆品痤疮活性高的试验组和5名化妆品痤疮活性低且乳酸刺痛试验分数为0.5分以下的对照组,共10名受试者后,为了直观比较分析通过RNA微阵列分析结果选择的化妆品痤疮生物标志物候选物的表达程度而进行热图(heatmap)分析的结果的图。
图88至图94为显示不同基因的表达程度与身体检查之间的相关关系分析结果的图。
图95至图98为显示不同基因的表达程度与通过视觉上评价获得的油性分数之间的相关关系分析结果的图。
图99至图101为显示不同基因的表达程度与人体应用设备(皮脂测定仪(Sebumeter))测定结果之间的相关关系分析结果的图。
具体实施方式
对于下面本发明的具体说明,以本发明实施的特定实施例为例参照图示的附图。这些实施例被予以具体说明以使本领域的普通技术人员能够实施本发明。应当理解,本发明的各个实施例彼此不同但并不一定相互排斥。以下所说明的具体说明并非用于限定意义,并且本发明的范围应被视为包括权利要求所要求保护的范围和与其等同的所有范围。
以下,将参照附图具体说明本发明的各种优选实施例,以使本领域的普通技术人员能够容易地实施本发明。
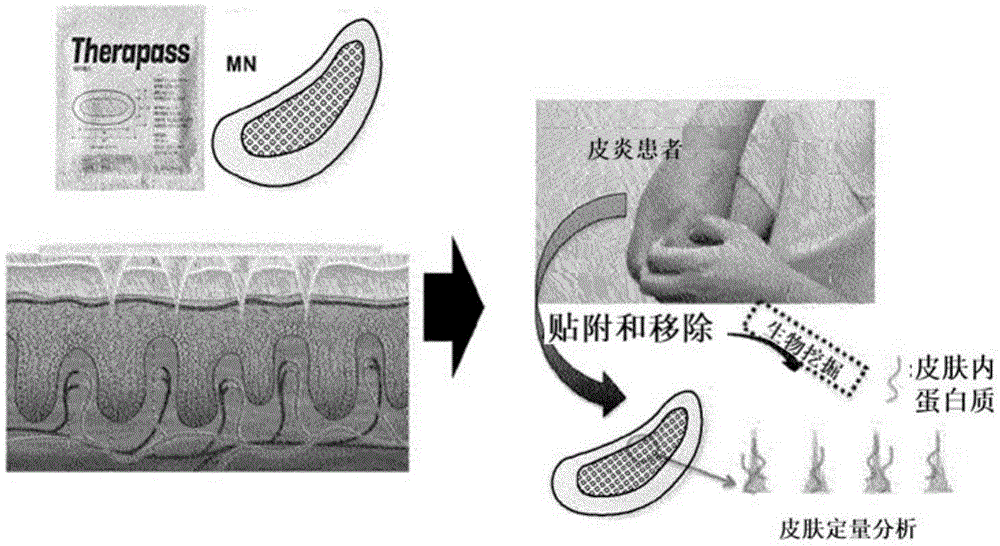
图1为显示现有技术的皮肤活检方法的图,图2为概念性地显示本发明的皮肤活检方法的图。
图2为概念性地显示本发明的皮肤活检方法的图。
在图2的左上端,显示了在提交本申请时本领域已知的微针贴片。在图2的左下端,显示了微针贴片贴附于皮肤的状态,更具体地,显示了贴片的微针刺入皮肤真皮层的状态。图2的右侧概念性地显示了本发明的代表性技术构思,其中在将微针贴片贴附于对象之后,使用粘附于贴片的微针上的皮肤中的蛋白质进行活检。本文使用的术语“生物挖掘(Bio-Mining)”用于表示在受试者皮肤中挖掘蛋白质以进行活检。
在本发明中用作采集皮肤标本的手段的生物可降解高分子透明质酸微针贴片具有实心(solid)结构,通过吹塑拉伸工艺(Droplet Extension,DEN)制成,但不应被解释为排除与本发明的范围不同的方法,例如模塑方法制成的微针贴片的使用。无论制造方式如何,相同材料和结构的微针贴片被评价为在皮肤标本采集性能上大同小异。
本发明人进行了临床试验以发现可用于测定和评价各种皮肤状态的生物标志物。临床试验对象的选择方式如下。
临床试验对象的选择
本发明人对33名20~70岁的健康受试者进行了实验,以发现与各种皮肤状态相关的生物标志物,并使用它们开发针对各种皮肤状态的诊断方法和诊断试剂盒。下表1总结了受试者的临床特征。
表1
其中,将以下对象排除在受试者之外:①IRB批准后未自愿同意本研究且未填写知情同意书者;②不同意提供人体衍生物者;③孕妇或哺乳期妇女及不同意方案规定的避孕方法的育龄期妇女;④为治疗皮肤病使用含有类固醇的皮肤外用剂1个月以上者;⑤最近一个月内服用过类固醇、口服抗生素或免疫抑制剂的人;⑥靶标病变部位发现感染(真菌、细菌或病毒)的患者;⑦接受紫外线治疗者;⑧有严重全身性疾病者;⑨无法阅读和理解知情同意书的受试者(文盲等);以及⑩其他经试验主任判断不适合试验的人。
以下,根据本发明诊断、评价或测定的各种皮肤病症,详细描述关于其后的临床试验进展的内容。
<皮肤衰老>
根据皮肤衰老程度的受试者分类、专家问诊、人体应用设备评价、乳酸
洗脸后,在恒温恒湿条件下等待30分钟,对受试者进行问卷评价和皮肤科医生问诊,并测定平时表情情况下的眼部皱纹、皮肤弹性、含水量、经表皮水分蒸发量以及皮肤酸度。具体地,对于眼部皱纹的测定使用PRIMOS
对受试者的眼部皱纹的身体检查是基于用于证实化妆品标签·广告的试验方法指南修订(案)由皮肤科医生作出视觉上判断的结果。
表2是从所有受试者中选择5名20多岁(对照组)和5名50岁以上(试验组),通过人体应用设备评价皮肤衰老的结果。
表2
并且,将微针贴贴在面部15分钟后,采集皮肤标本。
从皮肤标本采集RNA
将从受试者获取的皮肤标本提供至
RNA微阵列分析
对通过上述方法分离的RNA,使用
使用
图4和图5显示所述平台的手册中介绍的微阵列流程。下表3是整理了所述平台的RNA微阵列分析方案。
表3
之后,通过
通过生物信息学分析(Bioinformaticsanalysis)以及显著的相关关系分
进行RNA微阵列试验后,使用R 4.0.0程序进行基因比对,以确认试验组和对照组的4万多种基因表达差异。图6是显示基因比对结果的图。图6的基因比对也称为热图(heatmap)分析。热图(heatmap)分析是一个组合了热(heat)和地图(map)的术语,是一种可以将可以用颜色表示的各种信息以热分布的形式显示在图像上的分析方法。本说明书中记载的热图(heatmap)分析中,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。图6中,当对数百个基因进行分析时,确认到多个基因的表达值在试验组和对照组中存在特异性差异。
之后,本发明人通过文献调查筛选与皮肤衰老原因中胶原蛋白或弹性相关的基因(图7)并筛选皮肤衰老原因中屏障功能或水分合成相关的基因(图8)。本发明人将通过所述文献调查被确认为与皮肤衰老相关的基因的微阵列试验结果的确认的基因表达相关数值整理到以上图中的表。
只有在皮肤已衰老的试验组和没有衰老的对照组中进行微阵列获取的基因表达相关数值值存在差异的情况下,才可用作皮肤衰老相关生物标志物。为了判断这一点,本发明人使用了差异倍数(fold change)和p值(p-value)。差异倍数(fold change)是表示试验组中的测定数值与对照组中的测定数值相比增加或减少了多少倍的值,p值(p-value)是表示统计处理时试验组与对照组之间的值是否具有统计学上显著的差异的值。将通过RNA微阵列试验获取的各试样的标准化信号(normalized signal)值(表达值)示于图7和图8的表,差异倍数(fold change)是表示试验组与对照组之间的标准化信号(normalizedsignal)值来计算1:1表达差异的值。p值(p-value)表示数据与原假设的符合程度,以0到1之间的一个值表示,通常小于0.05时拒绝原假设。
结果确认到,在胶原蛋白/弹性相关皮肤衰老基因中差异倍数为1.2倍或-1.2倍以上或者p值(p-value)为0.05以下的基因是COL3A1、FN1、GSTA3以及PINK1,在皮肤屏障功能/水分合成相关皮肤衰老基因中差异倍数为1.2倍或-1.2倍以上或者p值(p-value)为0.05以下的基因是IVL、HAS3、AQP3、CERS6、CLDN1、SLC9A1、TGM1、SPINK5、KLF4、BGN、LCE1A、LCE1B、LCE1F以及LCE2A。
图9至图12为用于直观比较分析如上所述的通过RNA微阵列分析选择的皮肤衰老相关生物标志物候选物的表达程度而进行热图(heatmap)分析的图。图9为使用5名50岁以上试验组和5名20多岁对照组,图10为使用20多岁、30多岁、40多岁以及50岁以上的每个龄段分别5名,共20名受试者的RNA微阵列分析结果显示弹性/胶原蛋白相关皮肤衰老相关生物标志物候选物表达的热图(heatmap)。图11为使用5名50岁以上试验组和5名20多岁对照组,图12为使用20多岁、30多岁、40多岁以及50岁以上的每个龄段分别5名,共20名受试者的RNA微阵列分析结果显示皮肤屏障功能/水分合成相关皮肤衰老相关生物标志物候选物表达的热图(heatmap)。
与图6的情况相同,图9至图12的热图(heatmap)分析中也是如此,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。从图9至图12的试验结果可以直观确认到,试验组中通过文献调查筛选的特定基因的表达显示得更红而高于对照组。
为了确认上述的通过RNA微阵列分析选择的皮肤衰老相关生物标志物候选物与人体应用设备(皮肤快速三维成像系统(PRIMOS)、皮肤弹性测试仪(Cutometer)、皮肤水份测试仪(Corneometer)、经表皮失水率测定仪(Tewameter)以及皮肤酸度计(Skin-pHmeter))测定结果之间的相关关系,而进行双变量相关分析。结果如图13至图20所示。
图13和图14为5名50岁以上试验组和5名20多岁对照组,图15和图16为20多岁、30多岁、40多岁以及50岁以上的每个龄段分别5名,共20名受试者的通过RNA微阵列分析选择的胶原蛋白/弹性相关皮肤衰老相关生物标志物候选物与年龄以及人体应用设备的测定结果之间的相关关系的分析图。
结果确认到,5名50岁以上试验组和5名20多岁对照组,共10名受试者的RNA微阵列分析结果的FN1、GSTA3以及PINK1基因与受试者的年龄显显示统计学上显著的负相关关系,COL1A1、COL3A1、FN1、GSTA3、PON1以及PINK1基因与测定眼部皱纹的皮肤快速三维成像系统(PRIMOS)设备的测定结果显显示统计学上显著的负相关关系,PINK1基因与测定皮肤弹性的皮肤弹性测试仪(Cutometer)设备的测定结果显显示统计学上显著的正相关关系。虽然在图14中省略了标出每个基因,但是以上对图14的描述是从图14的左上端开始依次进行的。即,与受试者的年龄显显示统计学上显著的负相关关系的FN1、GSTA3以及PINK1基因的结果从图14的第一列依次显示,与测定眼部皱纹的皮肤快速三维成像系统(PRIMOS)设备的测定结果显显示统计学上显著的负相关关系的COL1A1、COL3A1、FN1、GSTA3、PON1以及PINK1基因的结果从图14的中间列依次显示,与测定皮肤弹性的皮肤弹性测试仪(Cutometer)设备的测定结果显显示统计学上显著的正相关关系的PINK1基因显示在图14的最后一列。以下,如图14所示,这一点在显示多个基因的相关关系的散点图中省略了基因标记的散点图中也同样适用。也就是说,将从散点图的左上段开始依次描述相关关系。
并且,确认到20多岁、30多岁、40多岁以及50岁以上的每个龄段分别5名,共20名受试者的RNA微阵列分析结果的COL1A1、FN1、GSTA3以及PINK1基因与受试者的年龄显显示统计学上显著的负相关关系,FN1、GSTA3以及PINK1基因与测定眼部皱纹的PRRMOS设备的测定结果显显示统计学上显著的负相关关系,GSTA3以及PINK1基因与测定皮肤弹性的皮肤弹性测试仪(Cutometer)设备的测定结果显显示统计学上显著的正相关关系。
因此,综合分析受试者的RNA微阵列分析结果和人体应用设备的测定结果,选择COL1A1、COL3A1、FN1、GSTA3、PON1以及PINK1共6种基因,作为胶原蛋白/弹性相关皮肤衰老生物标志物。
图17和图18为5名50岁以上试验组和5名20多岁对照组,图19和图20为20多岁、30多岁、40多岁以及50岁以上的每个龄段分别5名,共20名受试者的通过RNA微阵列分析选择的皮肤屏障功能/水分含量相关皮肤衰老相关生物标志物候选物与年龄以及人体应用设备的测定结果之间的相关关系的分析图。
结果确认到,5名50岁以上试验组和5名20多岁对照组,共10名受试者的RNA微阵列分析结果的IVL、CERS6、SPINK5以及KLF4基因与受试者的年龄显显示统计学上显著的负相关关系,确认到IVL、HAS2以及HAS3基因与测定眼部皱纹的皮肤快速三维成像系统(PRIMOS)设备的测定结果显显示统计学上显著的负相关关系,IVL、TGM1、SPINK5以及KLF4基因与测定皮肤弹性的皮肤弹性测试仪(Cutometer)设备的测定结果显显示统计学上显著的正相关关系。并且,确认到KLF4基因与测定含水量的皮肤水份测试仪(Corneometer)设备的显显示统计学上显著的正相关关系。
并且,确认到20多岁、30多岁、40多岁以及50岁以上的每个龄段分别5名,共20名受试者的RNA微阵列分析结果的IVL、CERS6以及TGM1基因与受试者的年龄显显示统计学上显著的负相关关系,确认到BGN基因与测定眼部皱纹的皮肤快速三维成像系统(PRIMOS)设备的测定结果显显示统计学上显著的负相关关系,IVL、TGM1、SPINK5以及KLF4基因与测定皮肤弹性的皮肤弹性测试仪(Cutometer)设备的测定结果显显示统计学上显著的正相关关系。并且,确认到CERS6以及KLF4基因与测定含水量的皮肤水份测试仪(Corneometer)设备的测定结果显显示统计学上显著的正相关关系,KLF4基因与测定经表皮失水量的经表皮失水率测定仪(Tewameter)设备的测定结果显显示统计学上显著的负相关关系。
因此,综合分析受试者的RNA微阵列分析结果和人体应用设备的测定结果,选择IVL、HAS2、HAS3、AQP3、CERS6、CLDN1、SLC9A1、TGM1、SPINK5、KLF4、LCE1A、LCE1B、LCE1F、LCE2A以及BGN共15种基因,作为皮肤屏障功能/水分合成相关皮肤衰老生物标志物。
通过皮肤衰老有效性评价选择胶原蛋白/弹性以及皮肤屏障功能/水分合成相关
进行皮肤衰老有效性评价,以检验通过上述方式选择的胶原蛋白/弹性以及皮肤屏障功能/水分合成相关皮肤衰老生物标志物是否可以用于测定和诊断皮肤衰老程度,筛选与实际皮肤衰老相关的活性成分或抗衰老的药物,或评价普通化妆品、功能性化妆品、医疗器械和药物的使用前后的皮肤衰老程度,进而替代动物实验。
具体地,对2名60岁以上受试者的眼部涂抹4周维甲酸乳膏(Stieva-
表4
表5
表6
进行RNA微阵列试验后,使用R 4.0.0程序进行基因比对,以确认根据皮肤衰老有效性评价的基因表达差异。之后,通过文献调查筛选的胶原蛋白/弹性相关基因和通过上述方式选择的胶原蛋白/弹性相关皮肤衰老生物标志物(COL1A1、COL3A1、FN1、GSTA3、PON1以及PINK1)中选择被确认为具有相同趋势的基因并分类在图25的表,通过文献调查筛选为皮肤屏障功能/水分合成相关基因和通过上述方式选择的皮肤屏障功能/水分合成相关皮肤衰老生物标志物(IVL、HAS2、HAS3、AQP3、CERS6、CLDN1、SLC9A1、TGM1、SPINK5、KLF4、LCE1A、LCE1B、LCE1F、LCE2A以及BGN)中选择显显示相同的模式的基因并分类在图26的表。
确认到,图25的表中显示的上述的胶原蛋白/弹性相关皮肤衰老基因中差异倍数(fold change)为1.2倍或-1.2倍以上或者p值(p-value)为0.05以下的基因是GSTA3,图26的表中显示的皮肤屏障功能/水分合成相关皮肤衰老基因中差异倍数为1.2倍或-1.2倍以上或者p值(p-value)为0.05以下的基因是LEC1A、LCE1F、LCE2A、LOR、AQP3、AQP10、BGN、HAS2以及HAS3。
图27和图28为显示为了直观比较分析所述的通过皮肤衰老有效性评价RNA微阵列分析筛选的皮肤衰老有效性评价生物标志物候选物的表达程度而进行热图(heatmap)分析的结果的图。图27是使用进行了皮肤衰老有效性评价的受试者的RNA微阵列分析结果显示胶原蛋白/弹性相关皮肤衰老有效性评价生物标志物候选物的表达热图(heatmap),图28是显示皮肤屏障功能/水分合成相关皮肤衰老有效性评价生物标志物候选物表达的热图(heatmap)。
本发明人为了确认所述的通过皮肤衰老有效性评价RNA微阵列分析筛选的皮肤衰老有效性评价生物标志物候选物与人体应用设备(皮肤快速三维成像系统(PRIMOS)、皮肤弹性测试仪(Cutometer)以及皮肤水份测试仪(Corneometer))测定结果之间的相关关系,而进行双变量相关分析。结果如图29至图32所示。图29和图30是进行了皮肤衰老有效性评价的受试者的通过RNA微阵列分析选择的胶原蛋白/弹性相关皮肤衰老有效性生物标志物候选物与人体应用设备的测定结果之间的相关关系的分析图。结果确认到,与第0周相比,涂抹维甲酸乳膏4周后,胶原蛋白/弹性相关皮肤衰老生物标志物COL4A4、FN1以及PINK1基因与测定眼部皱纹的皮肤快速三维成像系统(PRIMOS)测定结果显显示统计学上显著的负相关关系,确认到COL4A4以及MMP8基因与测定含水量的皮肤水份测试仪(Corneometer)测定结果显显示正相关或负相关关系。因此,综合分析所述的皮肤衰老以及皮肤衰老有效性评价,选择所述的皮肤衰老生物标志物(COL1A1、COL3A1、FN1、GSTA3、PON1以及PINK1)以及COL4A4和MMP8共8种基因作为胶原蛋白/弹性相关皮肤衰老有效性评价生物标志物。并且,在准确和有效诊断皮肤状态的观点来看,本发明人发现将这些基因中的COL1A1、COL3A1、FN1以及PINK1包含在生物标志物组中是有利的。
图31和图32为进行了皮肤衰老有效性评价的受试者的通过RNA微阵列分析选择的皮肤屏障功能/水分合成相关皮肤衰老有效性生物标志物候选物与人体应用设备的测定结果之间的相关关系的分析图。结果确认到,与第0周相比,涂抹维甲酸乳膏4周后,皮肤屏障功能/水分合成相关皮肤衰老生物标志物AQP3以及HAS3基因与测定眼部皱纹的皮肤快速三维成像系统(PRIMOS)测定结果显显示统计学上显著的负相关关系,LCE1A、AZGP1以及BGN基因与测定皮肤弹性的皮肤弹性测试仪(Cutometer)显显示统计学上显著的正相关关系,LCE1B、HAS2以及HAS3基因与测定含水量的皮肤水份测试仪(Corneometer)显显示统计学上显著的正相关关系。
因此,综合分析所述的皮肤衰老以及皮肤衰老有效性评价,选择所述的皮肤衰老生物标志物(IVL、HAS2、HAS3、AQP3、CERS6、CLDN1、SLC9A1、TGM1、SPINK5、KLF4、LCE1A、LCE1B、LCE1F、LCE2A以及BGN)和AZGP1共16种基因作为皮肤屏障功能/水分合成相关皮肤衰老有效性评价生物标志物。并且,在准确和有效诊断皮肤状态的观点来看,本发明人发现将这些基因中的IVL、HAS3、AQP3、BGN以及AZGP1包含在生物标志物组中是有利的。
综上,最终选择COL1A1、COL3A1、FN1、GSTA3、PON1、PINK1、COL4A4以及MMP8作为胶原蛋白/弹性相关皮肤衰老生物标志物,最终选择IVL、HAS2、HAS3、AQP3、CERS6、CLDN1、SLC9A1、TGM1、SPINK5、KLF4、LCE1A、LCE1B、LCE1F、LCE2A、BGN以及AZGP1作为皮肤屏障功能/水分合成相关皮肤衰老生物标志物。这些生物标志物可以用于皮肤衰老诊断方法或诊断试剂盒;皮肤衰老诱导或抑制物质以及抗衰老的药物的开发和筛选;对每个人提供皮肤分型信息;开发定制化化妆品;以及替代动物实验的皮肤衰老有效性评价。
<皮肤保湿>
根据皮肤保湿(水分含量/水分流失/皮肤pH)的受试者分类、专家问诊、
洗脸后,在恒温恒湿条件下等待30分钟,对受试者进行问卷评价和皮肤科医生问诊,并测定受试者的双颊部位测定含水量、经表皮失水量以及皮肤pH。具体地,对于含水量的测定使用
受试者的皮肤保湿的身体检查是基于相关文献(Int J Dermatol.2017Yoshida-Amano et al)由皮肤科医生作出视觉上判断的结果。
表7显示基于所有受试者中所述3种人体应用设备的测定结果分成5名对照组和5名干燥的试验组并评价皮肤保湿程度的结果。
表7
并且,将微针贴贴在面部15分钟后,采集皮肤标本。
从皮肤标本采集RNA
将从受试者获取的皮肤标本提供至
RNA微阵列分析
对通过上述方法分离的RNA,使用
之后,通过
通过生物信息学分析(Bioinformaticsanalysis)以及显著的相关关系分析筛选皮肤保湿(水分含量/水分流失/皮肤pH)生物标志物候选物
进行RNA微阵列试验后,使用R 4.0.0程序进行基因比对,以确认试验组和对照组的4万多种基因表达差异。图33为显示基因比对结果的图。图33的基因比对也称为热图(heatmap)分析。热图(heatmap)分析是一个组合了热(heat)和地图(map)的术语,是一种可以将可以用颜色表示的各种信息以热分布的形式显示在图像上的分析方法。本说明书中记载的热图(heatmap)分析中,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。图33中,当对数百个基因进行分析时,确认到多个基因的表达值在试验组和对照组中存在特异性差异。
之后,本发明人通过文献调查筛选与皮肤保湿(水分含量/水分流失/皮肤pH)相关的基因(图34)。本发明人将通过所述文献调查被确认为与皮肤保湿相关的基因的微阵列试验结果的确认的基因表达相关数值整理到以上图中的表。
只有在皮肤保湿程度优异的对照组和不优异而干燥的试验组中进行微阵列获取的基因表达相关数值值存在差异时,皮肤保湿程度相关生物标志物。为了判断这一点,本发明人使用了差异倍数(fold change)和p值(p-value)。差异倍数(fold change)是表示试验组中的测定数值与对照组中的测定数值相比增加或减少了多少倍的值,p值(p-value)是表示统计处理时试验组与对照组之间的值是否具有统计学上显著的差异的值。将通过RNA微阵列试验获取的各试样的标准化信号(normalized signal)值(表达值)示于图34的表,差异倍数(fold change)是表示试验组与对照组之间的标准化信号(normalized signal)值来计算1:1表达差异的值。p值(p-value)表示数据与原假设的符合程度,以0到1之间的一个值表示,通常小于0.05时拒绝原假设。
结果确认到,皮肤保湿(水分含量/水分流失/皮肤pH)相关基因中差异倍数为1.2倍或-1.2倍以上或者p值(p-value)为0.05以下的基因是CDSN、FLG、FLG2、LOR、KLF4、KRT10、LCE1A、LCE2A、LCE2B、LCE2C、SMPD3、CDH1、ITGB4、IVL、SPINK5、CLDN1、AQP3、BGN、HAS3、TGM1、CLDN7、CERS3、CLDN4以及KRT1。
图35至图38为用于直观比较分析如上所述的通过RNA微阵列分析选择的皮肤保湿相关生物标志物候选物的表达程度而进行热图(heatmap)分析的图。图35为显示5名所述干燥的对象的试验组和5名不干燥对照组,共10名的分析结果的皮肤保湿生物标志物候选物表达的热图(heatmap)。图36为显示皮肤保湿生物标志物候选物表达的热图(heatmap),是仅基于皮肤水份测试仪(Corneometer)测定结果将含水量结果值按分区划分来分析共15名的结果。图37为显示皮肤保湿生物标志物候选物表达的热图(heatmap),是仅基于经表皮失水率测定仪(Tewameter)测定结果将经表皮失水量结果值按分区划分来分析共15名的结果。图38为显示皮肤保湿生物标志物候选物表达的热图(heatmap),是仅基于皮肤酸度计(Skin-pHmeter)测定结果将皮肤pH结果值按分区划分来分析共13名的结果。
与图33的情况相同,图35至图38的热图(heatmap)分析中也是,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。从图35至图38的试验结果直观确认到,在干燥的试验组中通过文献调查筛选的特定基因的表达显示得更蓝而低于皮肤保湿优异的对照组。
为了确认上述的通过RNA微阵列分析选择的皮肤保湿生物标志物候选物与人体应用设备(皮肤水份测试仪(Corneometer)、经表皮失水率测定仪(Tewameter)以及皮肤酸度计(Skin-pHmeter))测定结果之间的相关关系,而进行双变量相关分析。结果如图39至图43所示。
图39为显示皮肤保湿生物标志物候选物基因与人体应用设备之间的相关关系分析数值的表。图40为汇总显示图39的分析数值的表。图41显示与皮肤水份测试仪(Corneometer)测定值显显示显著的相关关系的基因的散点图。由此确认到,FLG、FLG2、LOR、KLF4、CDH1、ITGB4、SPINK5、TGM1、CLDN7以及CLDN4基因与含水量(皮肤水份测试仪(Corneometer))显显示统计学上显著的正相关关系。图42显示与经表皮失水率测定仪(Tewameter)测定值显显示显著的相关关系的基因的散点图。由此确认到,FLG、FLG2、LOR、KLF4、KRT10、LCE1A、CDH1、ITGB4、SPINK5、CLDN1、BGN、TGM1以及CLDN7基因与经表皮失水量(经表皮失水率测定仪(Tewameter))显显示统计学上显著的负相关关系。图43显示与皮肤酸度计(Skin-pHmeter)测定值显显示显著的相关关系的基因的散点图。由此确认到,CDSN、KLF4、CDH1、CLDN1、AQP3以及CLDN7基因与皮肤pH(皮肤酸度计(Skin-pHmeter))显显示统计学上显著的负相关关系。图44和图45是基于图36、图37和图38中的结果分析皮肤保湿生物标志物候选物基因与各人体应用设备(皮肤水份测试仪(Corneometer)、经表皮失水率测定仪(Tewameter)、皮肤酸度计(Skin-pHmeter))之间的相关关系的图。结果,SMPD3、CDSN、KLF4、FLG、KRT10、CDH1、FLG2、ITGB4、IVL、SPINK5、CLDN1、AQP3、TGM1、CLDN7、CLDN4以及KRT1基因与含水量(皮肤水份测试仪(Corneometer))显显示统计学上显著的正相关关系,SMPD3、CDSN、KLF4、LOR、FLG、KRT10、LCE1A、CDH1、FLG2、ITGB4、IVL、SPINK5、CLDN1、AQP3、BGN、TGM1、CLDN7、CERS3以及CLDN4基因与经表皮失水量(经表皮失水率测定仪(Tewameter))显显示统计学上显著的负相关关系,SMPD3、CDSN、KLF4、LOR、FLG、KRT10、LCE2B、LCE1A、CDH1、FLG2、SPINK5、CLDN1、AQP3、TGM1以及KRT1基因与皮肤pH(皮肤酸度计(Skin-pHmeter))显显示统计学上显著的负相关关系。
皮肤保湿(水分含量/水分流失/皮肤pH)生物标志物的有效性检验以及生物标志
进行皮肤保湿有效性评价,以检验通过上述方式选择的皮肤保湿(水分含量/水分流失/皮肤pH)生物标志物是否可以用于评价皮肤保湿(水分含量/水分流失/皮肤pH)程度,筛选与实际皮肤保湿(水分含量/水分流失/皮肤pH)相关的活性成分或保湿剂,或评价普通化妆品、功能性化妆品、医疗器械和药物的使用前后的皮肤保湿(水分含量/水分流失/皮肤pH),进而替代动物实验。
具体地,对一名未使用皮肤保湿剂一个月以上而皮肤干燥的受试者(试验组)的面部涂抹2周姿露得倍润保湿霜(ZEROID INTENSIVE CREAM),并在第0周和第2周分别测定含水量、经表皮失水量、皮肤pH,将微针贴片贴在测定部位15分钟后,获取皮肤标本提取RNA来进行RNA微阵列。与第0周相比,涂抹2周姿露得倍润保湿霜后,受试者的皮肤干燥程度得到缓解了。即,含水量增加,经表皮失水量减少,皮肤pH值降低。详细的测定结果整理到下表8至表10和图46中。
表8
表9
表10
进行RNA微阵列试验后,使用R 4.0.0程序进行基因比对,以确认根据皮肤保湿有效性评价的基因表达差异。之后,通过上述方式选择的皮肤保湿(水分含量/水分流失/皮肤pH)生物标志物中选择被确认为具有相同趋势的基因并分类在图47的表。
确认到,图47的表中显示的皮肤保湿生物标志物基因中差异倍数为1.2倍或-1.2倍以上的基因是CDSN、FLG、FLG2、LOR、KRT10、LCE1A、LCE2A、LCE2B、LCE2C以及SMPD3共10种基因。
图48为用于直观比较分析通过所述的皮肤保湿有效性评价RNA微阵列分析筛选的皮肤保湿有效性评价生物标志物候选物的表达程度而进行图表化的图。
最终选择CDSN、FLG、FLG2、LOR、KLF4、KRT10、LCE1A、LCE2A、LCE2B、LCE2C、SMPD3、CDH1、ITGB4、IVL、SPINK5、CLDN1、AQP3、BGN、HAS3、TGM1、CLDN7、CERS3、CLDN4以及KRT1,作为皮肤保湿(水分含量/水分流失/皮肤pH)生物标志物。并且,在准确和有效诊断皮肤状态的观点来看,本发明人发现将这些基因中的FLG、AQP3以及LOR包含在生物标志物组中是有利的。
本发明人的上述研究结果可以在皮肤保湿程度评价方法或评价试剂盒的开发,皮肤保湿诱导或抑制物质的开发和筛选,对每个人提供皮肤分型信息,开发定制化化妆品以及替代动物实验的皮肤保湿有效性评价方面提供非常有用的工具。
<皮肤色素沉着>
根据皮肤色素沉着的受试者分类、专家问诊、人体应用设备评价以及皮肤标本采
洗脸后,在恒温恒湿条件下等待30分钟,对受试者进行问卷评价和皮肤科医生问诊,使用人体应用设备测定肤色和黑色素。具体地,对于肤色的测定使用分光光度计(Spectrophotometer)设备,对于黑色素的测定使用皮肤黑色素和血红素测试仪(Mexameter)设备,肤色通过ITA°值分析,黑色素通过黑素指数(melanin index)值分析。
受试者的肤色的身体检查是基于Fitzpatrick scale由皮肤科医生作出视觉上判断的结果。
[289]表11整理出将所有受试者分为试验组和对照组的标准。试验组由所有受试者中ITA°值为28以下的Fitzpatrick type V型深色肤色人组成。对照组由所有受试者中ITA°值为41以上的Fitzpatrick type II型浅色肤色人组成。选择试验组/对照组后通过人体应用设备评价皮肤色素沉着。
表11
并且,将微针贴贴在面部15分钟后,采集皮肤标本。
从皮肤标本采集RNA
将从受试者获取的皮肤标本提供至
RNA微阵列分析
对通过上述方法分离的RNA,使用
之后,通过
通过生物信息学分析(Bioinformaticsanalysis)以及显著的相关关系分
进行RNA微阵列试验后,使用R 4.0.0程序进行基因比对,以确认试验组和对照组的4万多种基因表达差异。图49显示基因比对结果的图。图49的基因比对也称为热图(heatmap)分析。热图(heatmap)分析是一个组合了热(heat)和地图(map)的术语,是一种可以将可以用颜色表示的各种信息以热分布的形式显示在图像上的分析方法。本说明书中记载的热图(heatmap)分析中,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。图49中,当对数百个基因进行分析时,确认到多个基因的表达值在试验组和对照组中存在特异性差异。
之后,本发明人通过文献调查筛选与皮肤色素沉着以及黑色素生成(melanogenesis)机制相关的基因(图50)。本发明人对通过所述文献调查被确认为与皮肤色素沉着相关的基因进行微阵列试验。将结果确认到的基因表达相关数值整理到图50的表。
只有在皮肤色素沉着程度严重的试验组和不严重的对照组中进行微阵列获取的基因表达相关数值值存在差异时,才可用作皮肤色素沉着程度相关生物标志物。为了判断这一点,本发明人使用了差异倍数(fold change)和p值(p-value)。差异倍数(foldchange)是表示试验组中的测定数值与对照组中的测定数值相比增加或减少了多少倍的值,p值(p-value)是表示统计处理时试验组与对照组之间的值是否具有统计学上显著的差异的值。将通过RNA微阵列试验获取的各试样的标准化信号(normalized signal)值(表达值)示于图50的表,差异倍数(fold change)是表示试验组与对照组之间的标准化信号(normalized signal)值来计算1:1表达差异的值。p值(p-value)表示数据与原假设的符合程度,以0到1之间的一个值表示,通常小于0.05时拒绝原假设。
结果确认到,皮肤色素沉着相关基因中差异倍数为1.2倍或-1.2倍以上或者p值(p-value)为0.05以下的基因是CAT、CLU、DSG1、GPNMB、GPX4、GSTM2、GSTP1、MC2R、MLANA、PAX3、SOX10、TFAP2A、TYR以及TYRP1。
图51和图52显示为了直观比较分析如上所述的通过RNA微阵列分析选择的皮肤色素沉着生物标志物候选物的表达程度而进行热图(heatmap)分析的结果。图51是5名ITA°值为28以下的试验组和5名ITA°值为41以上的对照组,共10名的热图(heatmap)分析结果图。图52是选择5名ITA°28以下的人、7名ITA°为29~40的人、7名ITA°为41以上的人,共19名受试者后使用RNA微阵列分析结果显示皮肤色素沉着生物标志物候选物
与图49的情况相同,图51和图52的热图(heatmap)分析中也是,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。图51和图52的试验结果可以直观确认到,试验组中通过文献调查筛选的特定基因的表达显示得更红而高于对照组。
为了确认上述的通过RNA微阵列分析选择的皮肤色素沉着相关生物标志物候选物CAT、CLU、DSG1、GPNMB、GPX4、GSTM2、GSTP1、MC2R、MLANA、PAX3、SOX10、TFAP2A、TYR以及TYRP1基因与人体应用设备(分光光度计(Spectrophotometer)以及皮肤黑色素和血红素测试仪(Mexameter))测定结果之间的相关关系而进行双变量相关分析。结果如图53至图58所示。
图53至图55为选择5名ITA°28以下的人和10名ITA°为41以上的人,共10名受试者后分析通过RNA微阵列分析选择的皮肤色素沉着生物标志物候选物与人体应用设备的测定结果之间的相关关系的结果。图56至图58为选择5名ITA°28以下的人、7名ITA°为29~40的人、7名ITA°为41以上的人,共19名受试者后分析通过RNA微阵列分析选择的皮肤色素沉着生物标志物候选物与人体应用设备的测定结果之间的相关关系的图。
结果确认到,5名ITA°值为28以下的试验组和5名ITA°值为41以上的对照组,共10名受试者的RNA微阵列分析结果的CAT、CLU、DSG1、GPNMB、GPX4、GSTM2、GSTP1、MLANA、SOX10、TFAP2A以及TYR基因与测定肤色的分光光度计(Spectrophotometer)设备的测定结果显显示统计学上显著的正相关或负相关关系,确认到CAT、CLU、DSG1、GPNMB、GPX4、GSTM2、GSTP1、MLANA、PAX3以及SOX10基因与测定眼部黑色素的皮肤黑色素和血红素测试仪(Mexameter)设备显显示统计学上显著的负相关或正相关关系。
并且,确认到5名ITA°28以下的人、7名ITA°为29~40的人、7名ITA°为41以上的人,共19名受试者的RNA微阵列分析结的CAT、CLU、DSG1、GPNMB、GPX4、GSTM2、GSTP1、MLANA、PAX3、SOX10以及TYR基因与测定肤色的分光光度计(Spectrophotometer)设备的测定结果显显示统计学上显著的正相关或负相关关系,CAT、CLU、DSG1、GPNMB、GPX4、GSTM2、GSTP1、MLANA、PAX3、SOX10以及TYRP1基因与测定眼部黑色素的皮肤黑色素和血红素测试仪(Mexameter)设备显显示统计学上显著的负相关或正相关关系。
因此,综合分析受试者的RNA微阵列分析结果和人体应用设备的测定结果,选择CAT、CLU、DSG1、GPNMB、GPX4、GSTM2、GSTP1、MLANA、PAX3、SOX10、TFAP2A、TYR以及TYRP1共13种基因作为皮肤色素沉着生物标志物。
通过皮肤美白有效性评价筛选皮肤色素沉着生物标志物
进行皮肤美白有效性评价,以检验通过上述方式选择的皮肤色素沉着生物标志物是否可以用于测定和诊断皮肤色素程度,筛选与实际皮肤色素沉着或美白相关的活性成分或美白剂,或评价普通化妆品、功能性化妆品、医疗器械和药物的使用前后的皮肤色素沉着或美白,进而替代动物实验。
具体地,对2名眼部有黄褐斑的受试者涂抹2周Trilustra Cream(韩国科玛),并在第0周和第2周使用分光光度计(Spectrophotometer)设备测定肤色(表12,图59),使用皮肤黑色素和血红素测试仪(Mexameter)设备测定眼部黑色素(表13,图60),将微针贴片贴在眼部15分钟后,获取皮肤标本提取RNA来进行RNA微阵列。
表12
表13
进行RNA微阵列试验后,使用R 4.0.0程序进行基因比对,以确认皮肤美白有效性评价。之后,通过文献调查筛选为皮肤色素沉着或黑色素生成(melanogenesis)相关基因和通过上述方式选择的皮肤色素沉着相关生物标志物(CAT、CLU、DSG1、GPNMB、GPX4、GSTM2、GSTP1、MLANA、PAX3、SOX10、TFAP2A、TYR以及TYRP1)中选择被确认为具有相同趋势的基因并分类。图61是显示分类结果的表,列出皮肤美白有效性生物标志物候选物。
确认到,通过文献调查筛选为皮肤色素沉着或黑色素生成(melanogenesis)相关基因和所述的皮肤色素沉着基因中差异倍数为1.2倍或-1.2倍以上或者p值(p-value)为0.05以下的基因是MC1R、F2RL1、CLDN1、DSG1以及GSTP1。
图62显示为了直观比较分析通过所述的皮肤美白有效性评价RNA微阵列分析筛选的皮肤美白有效性评价生物标志物候选物的表达程度而进行热图(heatmap)分析的结果。
本发明人为了确认通过如上所述的皮肤美白有效性评价RNA微阵列分析筛选的皮肤美白有效性评价生物标志物候选物与人体应用设备(分光光度计(Spectrophotometer)以及皮肤黑色素和血红素测试仪(Mexameter))测定结果之间的相关关系而进行双变量相关分析。图63和图64显示进行了皮肤美白有效性评价的受试者的通过RNA微阵列分析选择的皮肤美白有效性生物标志物候选物与人体应用设备的测定结果之间的相关关系的分析结果。参照图63和图64的试验结果确认到,与第0周相比,涂抹2周Trilustra Cream(维甲酸、对苯二酚、类固醇复合物)后,TFAP2A以及TYRP1基因与测定肤色的分光光度计(Spectrophotometer)测定结果显显示统计学上显著的负相关关系。并且,确认到TFAP2A基因与测定眼部黑色素的皮肤黑色素和血红素测试仪(Mexameter)测定结果显显示正相关关系。
综合分析如上所述的本发明人进行的皮肤色素沉着以及皮肤美白有效性评价试验结果,在将皮肤色素沉着生物标志物设定在最宽范围的情况下,可以选择CAT、CLU、DSG1、GPNMB、GPX4、GSTM2、GSTP1、MLANA、PAX3、SOX10、TFAP2A、TYR、TYRP1、MC1R、F2RL1以及CLDN1共16种基因。并且,在准确和有效诊断皮肤状态的观点来看,本发明人发现将这些基因中的MLANA、TYRP1以及GPNMB包含在生物标志物组中是有利的。
利用这些选择结果,可以将所述16种RNA基因中的任意一种或两种以上基因作为生物标志物,定量评价皮肤色素沉着或皮肤美白程度。进而,本发明人的上述研究结果可以在皮肤色素沉着程度评价方法或评价试剂盒的开发,皮肤色素沉着诱导或抑制物质的开发和筛选,对每个人提供皮肤分型信息,开发定制化化妆品以及替代动物实验的皮肤色素沉着有效性评价方面提供非常有用的工具。
<皮肤油分>
根据皮肤油分的受试者分类、专家问诊、人体应用设备评价以及皮肤标本采集
洗脸后,在恒温恒湿条件下等待30分钟,对受试者进行问卷评价和皮肤科医生问诊,并测定双鼻翼部位的皮肤油分。具体地,使用
受试者的皮肤油分的身体检查是基于相关文献(Reprod BiolEndocrinol.2017Homburg et al)由皮肤科医生作出视觉上判断的结果。
表14显示所有受试者分为5名皮肤油分少的对照组和5名皮肤油分多的试验组并评价皮肤油分的结果。
表14
并且,将微针贴贴在面部15分钟后,采集皮肤标本。
从皮肤标本采集RNA
将从受试者获取的皮肤标本提供至
RNA微阵列分析
对通过上述方法分离的RNA,使用
之后,通过
通过生物信息学分析(Bioinformaticsanalysis)以及显著的相关关系分
进行RNA微阵列试验后,使用R 4.0.0程序进行基因比对,以确认试验组和对照组的4万多种基因表达差异。图65显示基因比对结果的图。图65的基因比对也称为热图(heatmap)分析。热图(heatmap)分析是一个组合了热(heat)和地图(map)的术语,是一种可以将可以用颜色表示的各种信息以热分布的形式显示在图像上的分析方法。本说明书中记载的热图(heatmap)分析中,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。图65中,当对数百个基因进行分析时,确认到多个基因的表达值在试验组和对照组中存在特异性差异。
之后,本发明人通过文献调查筛选与皮肤油分相关的基因(图66)。本发明人对通过所述文献调查被确认为与皮肤油分相关的基因进行微阵列试验。将结果确认到的基因表达相关数值整理到图66的表。
只有在皮肤油分程度高的试验组和低的对照组中进行微阵列获取的基因表达相关数值值存在差异时,才可用作皮肤油分相关生物标志物。为了判断这一点,本发明人使用了差异倍数(fold change)和p值(p-value)。差异倍数(fold change)是表示试验组中的测定数值与对照组中的测定数值相比增加或减少了多少倍的值,p值(p-value)是表示统计处理时试验组与对照组之间的值是否具有统计学上显著的差异的值。将通过RNA微阵列试验获取的各试样的标准化信号(normalized signal)值(表达值)示于图66的表,差异倍数(fold change)是表示试验组与对照组之间的标准化信号(normalized signal)值来计算1:1表达差异的值。p值(p-value)表示数据与原假设的符合程度,以0到1之间的一个值表示,通常小于0.05时拒绝原假设。
结果确认到,皮肤油分相关基因中差异倍数为1.2倍或-1.2倍以上或者p值(p-value)为0.05以下的基因是MFAP2、IGF1、HSD11B1、GPAM、CPT1C、AR、MPZL3、AQP3、SREBF2以及HSD17B2。
图67显示为了直观比较分析如上所述的通过RNA微阵列分析选择的皮肤油分生物标志物候选物的表达程度而进行热图(heatmap)分析的结果。与图65的情况相同,图67的热图(heatmap)分析结果中也是,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。从图67的结果直观确认到,试验组中通过文献调查筛选的特定基因的表达显示得更红而高于对照组或者显示得更蓝而低于对照组。
为了确认上述的通过RNA微阵列分析选择的皮肤油分相关生物标志物候选物MFAP2、IGF1、HSD11B1、GPAM、CPT1C、AR、MPZL3、AQP3、SREBF2以及HSD17B2基因与人体应用设备(皮脂测定仪(Sebumeter))测定结果之间的相关关系而进行双变量相关分析。结果如图68和图69所示。
本发明人从图68和图69的双变量相关分析试验结果确认到,MFAP2、GPAM以及IGF1基因与皮肤油分含量(皮脂测定仪(Sebumeter)的测定值)显显示统计学上显著的正相关关系,MPZL3以及AQP3基因与皮肤油分含量(皮脂测定仪(Sebumeter)的测定值)显显示统计学上显著的负相关关系。
综合分析如上所述的本发明人进行的皮肤油分评价试验结果,在将皮肤油分生物标志物设定在最宽范围的情况下,可以选择MFAP2、AQP3、SREBF2、HSD17B2、GPAM、CPT1C、AR、IGF1、HSD11B1以及MPZL3共10种基因。并且,在准确和有效诊断皮肤状态的观点来看,本发明人发现将这些基因中的MPZL3、GPAM以及IGF1包含在生物标志物组中是有利的。
利用这些选择结果,可以将所述10种RNA基因中的任意一种或两种以上基因作为生物标志物,定量评价皮肤油分程度。进而,本发明人的上述研究结果可以在皮肤油分评价方法或评价试剂盒的开发,皮肤油分诱导或抑制物质的开发和筛选,对每个人提供皮肤分型信息,开发定制化化妆品以及替代动物实验的皮肤油分有效性评价方面提供非常有用的工具。
<玫瑰痤疮型敏感皮肤>
根据玫瑰痤疮型敏感皮肤的受试者分类、专家问诊、人体应用设备评价、乳酸刺痛
洗脸后,在恒温恒湿条件下等待30分钟,对受试者进行问卷评价和皮肤科医生问诊,使用人体应用设备测定双颊部位,通过乳酸刺痛试验评价主观刺痛敏感性。
具体地,使用
分数=(总乳酸值-总DW值)/12(4分区*3项)
表15整理出所有受试者中红斑量和红色值低且无主观刺痛敏感的对照组5名和具有高红斑量和红色值且无主观刺痛敏感性的试验组5名的分类结果。
表15
并且,将微结构贴片贴在面部15分钟后,采集皮肤标本。
从皮肤标本采集RNA
将从受试者获取的皮肤标本提供至
RNA微阵列分析
对通过上述方法分离的RNA,使用
之后,通过
通过生物信息学分析(Bioinformaticsanalysis)以及显著的相关关系分
进行RNA微阵列试验后,使用R 4.0.0程序进行基因比对,以确认试验组和对照组的4万多种基因表达差异。图70为显示基因比对结果的图。图70的基因比对也称为热图(heatmap)分析。热图(heatmap)分析是一个组合了热(heat)和地图(map)的术语,是一种可以将可以用颜色表示的各种信息以热分布的形式显示在图像上的分析方法。本说明书中记载的热图(heatmap)分析中,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。图70中,当对数百个基因进行分析时,确认到多个基因的表达值在试验组和对照组中存在特异性差异。
之后,本发明人通过文献调查筛选与玫瑰痤疮型敏感皮肤相关的基因(图71)。本发明人对通过所述文献调查被确认为与玫瑰痤疮型敏感皮肤相关的基因进行微阵列试验。将结果确认到的基因表达相关数值整理到图71的表。
只有在玫瑰痤疮型敏感度高的试验组和低的对照组中进行微阵列获取的基因表达相关数值值存在差异时,才可用作玫瑰痤疮型敏感皮肤相关生物标志物。为了判断这一点,本发明人使用了差异倍数(fold change)和p值(p-value)。差异倍数(fold change)是表示试验组中的测定数值与对照组中的测定数值相比增加或减少了多少倍的值,p值(p-value)是表示统计处理时试验组与对照组之间的值是否具有统计学上显著的差异的值。将通过RNA微阵列试验获取的各试样的标准化信号(normalized signal)值(表达值)示于图71的表,差异倍数(fold change)是表示试验组与对照组之间的标准化信号(normalizedsignal)值来计算1:1表达差异的值。p值(p-value)表示数据与原假设的符合程度,以0到1之间的一个值表示,通常小于0.05时拒绝原假设。
结果确认到,玫瑰痤疮型敏感皮肤相关基因中差异倍数为1.2倍或-1.2倍以上或者p值(p-value)为0.05以下的基因是COL3A1、TAC1、KLK5、CAMP、MMP9、TRPA1、IL13RA1、HSD3B1、CXCR4、ANGPT2、CXCL2、CXCR5以及PSMB9。
图72显示为了直观比较分析如上所述的通过RNA微阵列分析选择的玫瑰痤疮型敏感皮肤生物标志物候选物的表达程度而进行热图(heatmap)分析的结果。与图70的情况相同,图72的热图(heatmap)分析结果中也是,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。
为了确认上述的通过RNA微阵列分析选择的玫瑰痤疮型敏感皮肤相关生物标志物候选物COL3A1、TAC1、KLK5、CAMP、MMP9、TRPA1、IL13RA1、HSD3B1、CXCR4、ANGPT2、CXCL2、CXCR5以及PSMB9基因与人体应用设备(皮肤黑色素和血红素测试仪(Mexameter)、分光光度计(Spectrophotometer))测定结果之间的相关关系而进行双变量相关分析。结果如图73至图75所示。
图73为整理出玫瑰痤疮型敏感皮肤生物标志物候选物基因与人体应用设备之间的相关关系数值的表。
图74显示与皮肤黑色素血红素测试仪(Mexameter)测定值显显示显著的相关关系的基因的散点图。从图74的结果可知,TAC1、CAMP以及MMP9基因与皮肤红斑量(皮肤黑色素和血红素测试仪(Mexameter))显显示统计学上显著的正相关关系。
图75显示与分光光度计(Spectrophotometer)测定值显显示显著的相关关系的基因的散点图。从图75的结果可知,TAC1、MMP9以及ANGPT2基因与皮肤红色值(分光光度计(Spectrophotometer),a*值)显显示统计学上显著的正相关关系。
综合分析如上所述的本发明人进行的玫瑰痤疮型敏感皮肤评价试验结果,在将玫瑰痤疮型敏感皮肤生物标志物设定在最宽范围的情况下,可以选择COL3A1、TAC1、KLK5、CAMP、MMP9、TRPA1、IL13RA1、HSD3B1、CXCR4、ANGPT2、CXCL2、CXCR5以及PSMB9共13种基因。并且,在准确和有效诊断皮肤状态的观点来看,本发明人发现将这些基因中的MMP9、TAC1以及CAMP包含在生物标志物组中是有利的。
利用这些选择结果,可以将所述13种RNA基因中的任意一种或两种以上基因作为生物标志物,定量评价玫瑰痤疮型敏感皮肤。进而,本发明人的上述研究结果可以在玫瑰痤疮型敏感皮肤评价方法或评价试剂盒的开发,玫瑰痤疮型敏感皮肤诱导或抑制物质的开发和筛选,对每个人提供皮肤分型信息,开发定制化化妆品以及替代动物实验的玫瑰痤疮型敏感皮肤有效性评价方面提供非常有用的工具。
<刺痛型敏感皮肤>
根据主观刺痛型敏感皮肤的受试者分类、专家问诊,乳酸刺痛试验以及皮肤标本
洗脸后,在恒温恒湿条件下等待30分钟,对受试者进行问卷评价和皮肤科医生问诊,使用乳酸进行主观刺痛型敏感皮肤的敏感程度。
具体地,根据Frosch&Kligman method(1977),通过“5%乳酸刺痛试验”评价敏感性。图76为显示乳酸刺痛试验的图。将乳酸(5%)和DW分别取50μl并涂于两侧鼻唇沟部位(nasolabial fold),在第0、2.5、5和8分钟时,由受试者亲自评价刺痛、灼痛和瘙痒,根据强度打分,分为4种分数(0:无刺痛(no sting),1:轻微刺痛(slight sting),2:中度刺痛(moderate sting),3:严重刺痛(severe sting))。刺痛感的强度的数值越高表示越敏感,本试验分析了乳酸(5%)与DW的差异,计算式如下。
分数=(总乳酸值-总DW值)/12(4分区*3项)
表16整理出所有受试者中乳酸刺痛试验分数为0.5分以上的有主观刺痛型敏感皮肤的受试者(试验组)和分数为0分的无主观刺痛型敏感皮肤的受试者(对照组)的选择结果。
表16
并且,将微针贴贴在面部15分钟后,采集皮肤标本。
从皮肤标本采集RNA
将从受试者获取的皮肤标本提供至
RNA微阵列分析
对通过上述方法分离的RNA,使用
之后,通过
通过生物信息学分析(Bioinformatics analysis)以及显著的相关关系分析筛选
进行RNA微阵列试验后,使用R 4.0.0程序进行基因比对,以确认试验组和对照组的4万多种基因表达差异。图77是显示基因比对结果的图。图77的基因比对也称为热图(heatmap)分析。热图(heatmap)分析是一个组合了热(heat)和地图(map)的术语,是一种可以将可以用颜色表示的各种信息以热分布的形式显示在图像上的分析方法。本说明书中记载的热图(heatmap)分析中,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。图77中,当对数百个基因进行分析时,确认到多个基因的表达值在试验组和对照组中存在特异性差异。
之后,本发明人通过文献调查筛选与主观刺痛型敏感皮肤相关的基因(图78)。本发明人对通过所述文献调查被确认为与主观刺痛型敏感皮肤相关的基因进行微阵列试验。将结果确认到的基因表达相关数值整理到图78的表。
只有在主观刺痛型敏感皮肤的敏感程度高的试验组和低的对照组中进行微阵列获取的基因表达相关数值值存在差异时,才可用作主观刺痛型敏感皮肤相关生物标志物。为了判断这一点,本发明人使用了差异倍数(fold change)和p值(p-value)。差异倍数(fold change)是表示试验组中的测定数值与对照组中的测定数值相比增加或减少了多少倍的值,p值(p-value)是表示统计处理时试验组与对照组之间的值是否具有统计学上显著的差异的值。将通过RNA微阵列试验获取的各试样的标准化信号(normalized signal)值(表达值)示于图8的表,差异倍数(fold change)是表示试验组与对照组之间的标准化信号(normalized signal)值来计算1:1表达差异的值。p值(p-value)表示数据与原假设的符合程度,以0到1之间的一个值表示,通常小于0.05时拒绝原假设。
结果确认到,主观刺痛型敏感皮肤相关基因中差异倍数为1.2倍或-1.2倍以上或者p值(p-value)为0.05以下的基因是IVL、LOR、FLG、FLG2、PGF、CYR61、HLA-B、IGHA1、MMP3、RBP4以及G0S2。
图79和图80为用于直观比较分析如上所述的通过RNA微阵列分析选择的主观刺痛型敏感皮肤生物标志物候选物的表达程度而进行热图(heatmap)分析的图。图79为选择乳酸刺痛试验分数为0.5分以上的试验组5名和0分的对照组5名,共10名受试者后使用RNA微阵列分析结果显示主观刺痛型敏感皮肤生物标志物候选物表达的热图(heatmap)。图80为将所有受试者33名按乳酸刺痛试验分数分类后使用各分数的RNA微阵列平均值显示主观刺痛型敏感皮肤生物标志物候选物表达的热图(heatmap)。与图77的情况相同,图79和图80的热图(heatmap)分析结果中也是,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。
为了确认上述的通过RNA微阵列分析选择的主观刺痛型敏感皮肤相关生物标志物候选物IVL、LOR、FLG、FLG2、PGF、CYR61、HLA-B、IGHA1、MMP3、RBP4以及G0S2基因与各个乳酸刺痛试验分数之间的相关关系,而进行双变量相关分析。结果如图81至图84所示。
结果确认到,乳酸刺痛试验分数为0.5分以上的有主观刺痛的试验组5名和分数为0分的无主观刺痛的对照组5名,共10名受试者的RNA微阵列分析结果的CYR61、RBP4以及PGF基因与乳酸刺痛试验分数显显示统计学上显著的正相关或负相关关系,所有受试者33名的RNA微阵列分析结果的LOR、PTGS2、PGF以及HLA-B基因与乳酸刺痛试验分数显显示统计学上显著的负相关或正相关关系。因此,综合分析受试者的RNA微阵列分析结果和乳酸刺痛试验,本发明人选择IVL、LOR、FLG、FLG2、PGF、CYR61、HLA-B、IGHA1、MMP3、RBP4以及G0S2共11种基因,作为主观刺痛型敏感皮肤生物标志物。并且,在准确和有效诊断皮肤状态的观点来看,本发明人发现将这些基因中的PGF、RBP4以及CYR61包含在生物标志物组中是有利的。
利用这些选择结果,可以将所述11种RNA基因中的任意一种或两种以上基因作为生物标志物,定量评价主观刺痛型敏感皮肤的敏感程度。进而,本发明人的上述研究结果可以在主观刺痛型敏感皮肤评价方法或评价试剂盒的开发,主观刺痛型敏感皮肤诱导或抑制物质的开发和筛选,对每个人提供皮肤分型信息,开发定制化化妆品以及替代动物实验的主观刺痛型敏感皮肤有效性评价方面提供非常有用的工具。
<化妆品痤疮>
根据化妆品痤疮程度的受试者分类、专家问诊、人体应用设备评价、乳酸刺痛试验
洗脸后,在恒温恒湿条件下等待30分钟,对受试者进行问卷评价和皮肤科医生问诊,使用人体应用设备测定皮肤油分含量,通过乳酸刺痛试验评价皮肤刺痛敏感性。
具体地,使用
分数=(总乳酸值-总DW值)/12(4分区*3项)
受试者的化妆品痤疮的身体检查是基于相关文献(韩国痤疮严重程度系统,韩国皮肤病学杂志:第24卷,第10期,2004年),皮肤油分的身体检查是基于相关文献(ReprodBiol Endocrinol.2017Homburg et al),由皮肤科医生作出视觉上判断的结果。
所有受试者中,通过专家视觉上判断选择有化妆品痤疮的受试者(试验组)和无化妆品痤疮且乳酸刺痛试验分数为0.5分以下的受试者(对照组),这些试验组以及对照组的详细内容整理到下表17。
表17
并且,将微针贴贴在面部15分钟后,采集皮肤标本。
从皮肤标本采集RNA
将从受试者获取的皮肤标本提供至
RNA微阵列分析
对通过上述方法分离的RNA,使用
之后,通过
通过生物信息学分析(Bioinformaticsanalysis)以及显著的相关关系分
进行RNA微阵列试验后,使用R 4.0.0程序进行基因比对,以确认试验组和对照组的4万多种基因表达差异。图85显示基因比对结果的图。图85的基因比对也称为热图(heatmap)分析。热图(heatmap)分析是一个组合了热(heat)和地图(map)的术语,是一种可以将可以用颜色表示的各种信息以热分布的形式显示在图像上的分析方法。本说明书中记载的热图(heatmap)分析中,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。图85中,当对数百个基因进行分析时,确认到多个基因的表达值在试验组和对照组中存在特异性差异。
之后,本发明人通过文献调查筛选与化妆品痤疮相关的基因。本发明人将通过所述文献调查被确认为与化妆品痤疮相关的基因的微阵列试验结果的确认的基因表达相关数值整理到图86的表。
只有在化妆品痤疮活性高的试验组和化妆品痤疮活性低的对照组中进行微阵列获取的基因表达相关数值值存在差异时,才可用作化妆品痤疮
结果确认到,图86的表中显示的化妆品痤疮相关基因中差异倍数为1.2倍或-1.2倍以上或者p值(p-value)为0.05以下的基因是MMP3、MMP12、CCR1、AKR1B10、THY1以及IL-6。
图87为显示通过皮肤科医生的身体检查选择5名化妆品痤疮活性高的试验组和5名化妆品痤疮活性低且乳酸刺痛试验分数为0.5分以下的对照组,共10名受试者后,为了直观比较分析通过上述的RNA微阵列分析结果选择的化妆品痤疮生物标志物候选物的表达程度而进行热图(heatmap)分析的结果的图。与图84的情况相同,图87的热图(heatmap)分析中也是,颜色越红表示基因的表达值越大,颜色越蓝表示基因的表达值越低。图87的试验结果可以直观确认到,试验组中通过文献调查筛选的特定基因的表达显示得更红而高于对照组。
为了确认上述的通过RNA微阵列分析选择的化妆品痤疮生物标志物候选物MMP3、MMP12、CCR1、AKR1B10、THY1以及IL-6基因与通过皮肤科医生的身体检查的痤疮有/无以及油性视觉上评价以及人体应用设备(皮脂测定仪(Sebumeter))之间的相关关系,而进行双变量相关分析。结果如图88至图101所示。
本发明人分析了通过身体检查被确认为有化妆品痤疮的试验组5名和无化妆品痤疮且乳酸刺痛试验分数为0.5分以下的对照组5名,共10名受试者的通过RNA微阵列分析选择的化妆品痤疮生物标志物候选物与根据身体检查的痤疮有/无的分数(有:+1分,无:0分)、通过视觉上评价获得的油性分数(0~5分)以及人体应用设备(皮脂测定仪(Sebumeter))测定结果之间的相关关系。
结果确认到,MMP3、MMP12、CCR1、THY1以及IL6基因与根据身体检查的痤疮有/无的分数显显示统计学上显著的正相关关系(图88至图94)。图88和图89是显示身体检查之间的相关关系分析结果的表。图90至图94是显示所述显著的正相关关系的5个基因的散点图。
并且,确认到MMP12以及CCR1基因与视觉上评价的油性分数显显示统计学上显著的正相关关系(参照图95至图98)。图95和图96为显示通过视觉上评价获得的油性分数之间的相关关系分析结果。图97和图98是显示所述显著的正相关关系的2个基因的散点图。
并且,确认到CCR1基因与人体应用设备(皮脂测定仪(Sebumeter))测定结果显显示统计学上显著的正相关关系(参照图99至图101)。图99和图100为显示人体应用设备(皮脂测定仪(Sebumeter))测定结果之间的相关关系分析结果。图101是显示所述显著的正相关关系的一个基因的散点图。
综合分析如上所述的本发明人进行的化妆品痤疮评价试验结果,在将化妆品痤疮生物标志物设定在最宽范围的情况下,可以选择MMP3、MMP12、CCR1、AKR1B10、THY1以及IL-6共6种基因。并且,在准确和有效诊断皮肤状态的观点来看,本发明人发现将这些基因中的MMP3、MMP12以及CCR1包含在生物标志物组中是有利的。
利用这些选择结果,可以将所述6种RNA基因中的任意一种或两种以上基因作为生物标志物,定量预测化妆品痤疮。进而,本发明人的上述研究结果可以在化妆品痤疮预测方法或预测试剂盒的开发,化妆品痤疮诱导或抑制物质以及治疗剂的开发和筛选,对每个人提供皮肤分型信息,开发定制化化妆品以及替代动物实验的化妆品痤疮有效性评价方面提供非常有用的工具。
在以上所述中描述了使用微针从受试者的皮肤提取皮肤标本,并从中提取RNA,将其提供至RNA微阵列定量分析设备,以定量化RNA不同基因的表达程度的方法。然而,本发明不应被解释为限于这种特定的定量化方法。应当理解,任何能够使用受试者的皮肤标本定量RNA表达程度的方法都落在本发明的范围内。例如,可以应用ELISA法等蛋白质水平的测定方法。每个RNA基因的表达程度可以通过指定相应RNA生物标志物表达产生的蛋白质类型并对蛋白质进行定量化来定量化。也就是说,用于实施本发明的定量化设备或试剂盒可以是ELISA、RT-PCR试剂盒、RNA芯片、DNA芯片或蛋白质芯片试剂盒。可以通过选自ELISA、Western印迹、磁珠-抗体免疫沉淀、免疫化学组织染色和质谱中的至少一种方法来进行蛋白质水平的测定。并且,可以通过选自RT-PCR、竞争性RT-PCR(competitive RT-PCR)、实时RT-PCR(Real-time RT-PCR)、核糖核酸酶保护测定(RPA:RNase Protection Assay)、北方印迹法(Northern blotting)和DNA芯片中的至少一种方法进行所述mRNA水平的测定。
本发明的特种证在于,以无创方式使用微针测定和评价皮肤状态,使用特定RNA生物标志物,可以使用RNA水平的试验方法和蛋白质水平的试验方法均可用于检测特定RNA生物标志物,在使用RNA水平的试验方法的情况下,与蛋白质水平的试验方法相比具有如下优点。与蛋白质相比,应用检测量少的RNA试样扩增技术,即使从少量试样中也可以有效和准确地检测到更多的生物标志物,这就是RNA水平的试验方法的优势。
蛋白质水平的试验方法和RNA水平的试验方法在观察或定量化特定生物标志物表达方面的最大实际差异之一是,与蛋白质相比,可以用非常少的生物标志物观察或定量化非常大量的生物标志物。为了在蛋白质水平同时观察各种生物标志物的变化,需要进行蛋白质组(proteome)分析,但需要大量的试样,尤其,在从皮肤组织提取蛋白质的情况下,收率是10%以下,因此需要所需量10倍左右的试样。具体来说,蛋白质组(proteome)分析需要至少1-2mg的蛋白质样品,从3mm穿孔皮肤组织活检中提取约0.15mg的蛋白质。即,通过计算可知,只有在进行大约10次3mm穿孔皮肤组织活检时才可能进行蛋白质组(proteome)分析。
然而,鉴于组织活检的各种局限性,实际上很难执行10次3mm穿孔。用微针贴片提取蛋白质的方法也很难实际应用于皮肤,因为从一个微针贴片中提取的蛋白质约为0.06mg,因此只有贴20个以上的微针贴片才能进行蛋白质组(proteome)分析。此外,即使以这种方式从试样中提取蛋白质,通过蛋白质组(proteome)分析检测到的生物标志物数量约为650,效率降低到通过RNA微阵列分析检测到的生物标志物(4万个以上)的1-2%左右。
即使用其他分析方法进行,也有局限性。即使与蛋白质分析方法中最灵敏的检测方法ELISA法相比,用1个微针贴片提取的0.06mg蛋白质也只是3次分析时能够确认1个生物标志物的表达变化的量。此外,由于ELISA法的特点,每个试剂盒只能检测一种生物标志物,可能会根据溶剂发生干扰现象,并且操作人员需执行的步骤很多,因此存在每次测定时的变化(variation)较大的缺点。与RNA不同,蛋白质具有三维结构,无法扩增,因此无法克服标本采集限制,很难应用于同时分析多种生物标志物变化,用于皮肤分型或皮肤病的预后判断和诊断、新材料治疗有效性评价等。
为了解决这个问题,本发明将RNA应用于分析。为了合成特定的蛋白质需要经过如下过程:参与蛋白质合成的基因部位从存在于细胞核中的DNA以RNA的形式复制(转录),并将该RNA移至细胞质并用作模板连接与每个碱基序列对应的氨基酸,最后合成(翻译)蛋白质。RNA是蛋白质合成的前体,是反映因各种环境因素而改变的实际皮肤蛋白质表达量的遗传物质,可以用于分析以达到更高的效率。
然而,与蛋白质相比,RNA的收率较低且不稳定性较高,因此需要进行研究以设定用于分析的最佳条件。只有通过本发明,才证实可以从使用微针贴片获取的微量皮肤标本中可靠地鉴定RNA生物标志物。在本发明之前,如上所述,由于本领域认识到RNA比蛋白质具有更低的收率和更高的不稳定性,因此难以通过从使用微针贴片获取的微量RNA生物标志物中鉴定出特定的皮肤状态或疾病。
本发明人进行了扩增RNA的过程,以确保适合于分析的微量RNA,如在前面的实施例中详细描述的那样,首次证实了从使用微针贴片获取的微量标本可以高效准确地检测RNA生物标志物。
当转换成相同的单位时,每片微针贴片提取的蛋白质的量约为60ng/μL,而RNA约为10ng/μL,相当于1/6。它少于蛋白质的量,但为了克服这个问题,应用了RNA扩增技术,并且可以进行RNA微阵列分析。RNA扩增技术通过聚合酶反应原理,可将10ng的RNA扩增约550倍至5500ng。以此方式,可以从从每片微针贴片提取的皮肤标本中鉴定约4万多个生物标志物的表达变化,并且上述实施例中为了用于测定、评价或诊断各种皮肤状态而选择的多个RNA生物标志物可以非常容易和准确地检测到。
另一方面,通过用微针贴片获取皮肤标本的方法,不可能通过以从单个微针贴片获取的量获取具有微针贴片的皮肤标本来准确地检测多个例如九种蛋白质生物标志物的表达。需要使用多个微针贴片,并且需要多次执行从一个微针贴片获取用于检查的标本的过程。如上所述,如果使用ELISA法,由于每个试剂盒只能检测一种生物标志物的特点,将不得不调动多个试剂盒,甚至可能会根据溶剂发生干扰现象,操作人员需执行的步骤很多,因此不得不接受每次测定时的变化(variation)较大的缺点。
以上通过有限的实施例和附图对本发明的具体组成等特定细节进行了描述,但这仅是为了帮助更全面地理解本发明,本发明不限于以上实施例,本领域的技术人员可以根据这些描述作出各种修改和变化。
因此,本发明的精神不应限于所描述的上述实施例,并且从权利要求及其等同或等同修改的所有内容都在本发明的精神范围内。
- 利用微针贴片的微创特应性皮炎检查方法及包括微针贴片的微创特应性检查试剂盒
- 微针贴片、制造微针贴片的方法和使用微针贴片诊断过敏性疾病的方法
