一种Bst DNA聚合酶活性的检测方法及其试剂盒
文献发布时间:2024-04-18 19:53:33
技术领域
本发明属于生物检测技术领域,更具体地,涉及一种Bst DNA聚合酶活性的检测方法及其试剂盒。
背景技术
嗜热脂肪地芽孢杆菌(Bacillus stearothermophilus,Bst)DNA聚合酶是DNA聚合酶A家族的成员之一,Bst DNA聚合酶全长基因为2634bp,表达的蛋白为878个氨基酸,对应分子量为98k Da。而Bst DNA聚合酶的大片段像Klenow大片段DNA聚合酶一样具有5′→3′DNA聚合酶活性,但不具有5′→3′外切核酸酶活性,失去了N端292个氨基酸,基因长度为1758bp,编码蛋白长度为586个氨基酸,对应分子量为67k Da。由于其具有较强的热稳定性、链置换活性以及聚合酶活性,被广泛应用于环介导等温扩增(Loop-Mediated IsothermalAmplification,LAMP)。
在LAMP等温扩增方法中,Bst DNA聚合酶以双链环状质粒DNA为模板,在等温条件和扩增引物的作用下实现快速、高效的扩增,不需要进行模板的预变性,进而减少了PCR技术升降温带来的影响以及对昂贵、精密实验仪器的要求,具有操作简单、特异性强、产物易检测等优点。另外,Bst DNA聚合酶还可用于富含GC序列的DNA序列测定;亦可用于微量(纳克量)DNA模板的快速测序。在医学检测、病原微生物的检验检疫、食品检疫等各个领域有着重要的作用。因此准确标定Bst DNA聚合酶的活性,保证各个批次间酶活性的稳定,具有十分重要的意义。
现有的Bst DNA聚合酶活性测定通常采用同位素法,即在Bst DNA聚合酶的反应体系和条件下,依赖于被放射性元素
专利CN114561444A提供了Bst DNA聚合酶活性检测方法,其原理是Bst DNA聚合酶的活性在一定范围内与双链DNA产物的量呈正比,而双链DNA产物的量与反应体系中的焦磷酸呈正比,因此可以用焦磷酸试剂盒荧光强度来测定其活性。该方法虽然在一定程度上克服了同位素法的缺点,但是需要在等温扩增反应结束后加入焦磷酸检测试剂,利用酶标仪来测出相应的信号进行计算,过程相对繁琐,且成本较高。除此外,该方法绘制的标准曲线呈S曲线并非线性正相关,即随着酶活性增加焦磷酸含量呈现先增加后趋于平衡,可见,使用该检测方法检测的酶活适用范围有限,尤其是在检测酶活性较高的样品时,检测准确性较差。因此,研究一种使用性广且准确性高的Bst DNA聚合酶活性检测方法具有十分重要的意义。
发明内容
针对现有技术的以上缺陷或改进需求,本发明提供了一种Bst DNA聚合酶活性检测方法及其试剂盒,其目的在于发现双链DNA扩增产物在线性增长期内单位时间最大荧光增量与酶量呈线性正相关,通过绘制线性标准曲线快速测定Bst DNA聚合酶活性,由此解决现有Bst DNA聚合酶活性检测方法绘制标准曲线为S曲线,检测范围较小且高酶活样品检测准确性较差的技术问题。
为实现上述目的,按照本发明的一个方面,提供了一种Bst DNA聚合酶活性检测方法,其包括以下步骤:
利用Bst DNA聚合酶进行等温扩增,绘制Bst DNA聚合酶标准品与扩增产物双链DNA对应的扩增曲线线性增长期内单位时间最大荧光增量的标准曲线,通过检测Bst DNA聚合酶待测样品扩增产物在线性增长期内单位时间最大荧光增量,根据标准曲线计算待测样品的酶活。
优选地,所述Bst DNA聚合酶活性检测方法,其所述单位时间为等温扩增反应单次循环所需的时间。
优选地,所述Bst DNA聚合酶活性检测方法,其所述等温扩增,扩增引物为一组等温扩增引物。
优选地,所述Bst DNA聚合酶活性检测方法,其所述扩增引物,包括但不局限于如SEQ ID No.1-6所示序列在内的所有常规等温扩增引物组。
优选地,所述Bst DNA聚合酶活性检测方法,其所述扩增引物,序列如SEQ IDNo.1-6所示。
优选地,所述Bst DNA聚合酶活性检测方法,其所述等温扩增,其模板双链环状质粒DNA,包括但不局限于如SEQ ID No.7所示序列在内的所有对应如本发明中常规等温扩增引物组中任一组引物组的产物或模板序列。
优选地,所述Bst DNA聚合酶活性检测方法,其所述等温扩增,其模板双链环状质粒DNA如SEQ ID No.7所示序列。
优选地,所述Bst DNA聚合酶活性检测方法,其所述最大荧光增量采用荧光染料法实时荧光定量扩增获得。
优选地,所述Bst DNA聚合酶活性检测方法,其扩增反应条件为65℃,15~60秒,60个循环;85℃,5分钟。
按照本发明的另一方面,还提供了一种Bst DNA聚合酶活性检测试剂盒,其包括酶浓度在5~80U/μL的Bst DNA聚合酶标准品。
总体而言,通过本发明所构思的以上技术方案与现有技术相比,由于发现双链DNA扩增产物在线性增长期内单位时间最大荧光增量与酶量呈线性正相关,能够取得下列有益效果:
本发明提供的Bst DNA聚合酶活性检测方法,通过绘制Bst DNA聚合酶标准品与扩增产物双链DNA对应的扩增曲线线性增长期内单位时间最大荧光增量的标准曲线,能够快速测定待测样品的酶活性。由于绘制的标准曲线呈线性,使用范围更广,尤其是检测酶活性在10~80U的样品,准确性高。
附图说明
图1为本发明的酶活检测方法的原理示意图;
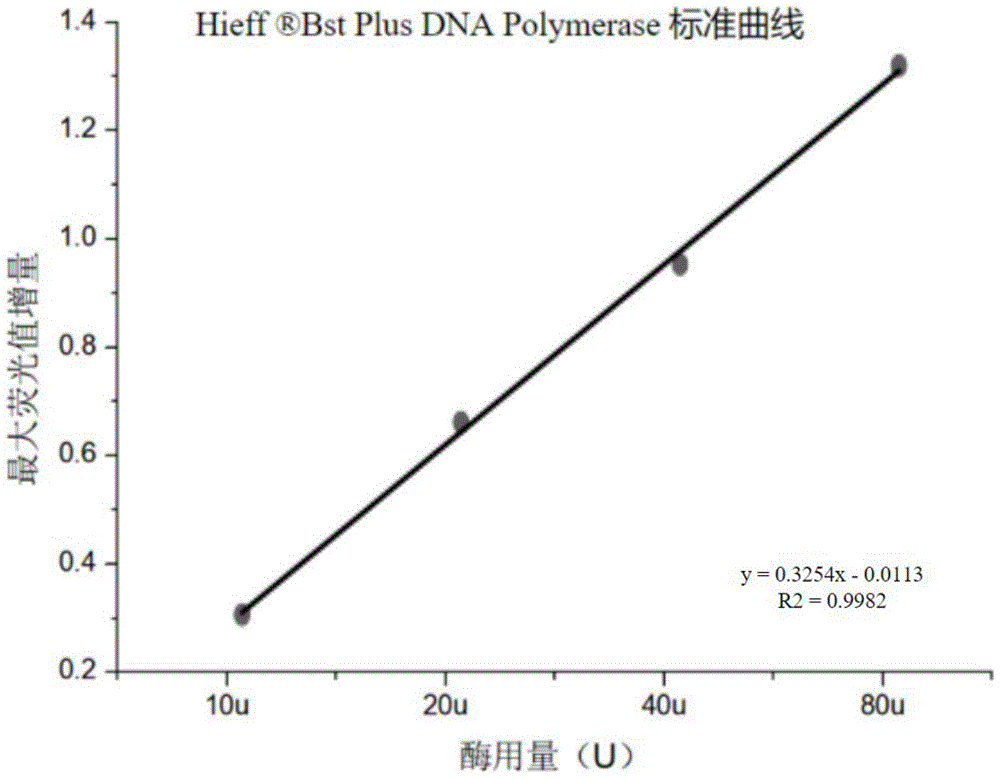
图2为本发明的检测方法获得的酶用量-最大荧光值增量标准曲线图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
现有研究表明,通过测定等温扩增产物双链DNA的副产物焦磷酸根含量,绘制标准曲线可以快速测定Bst DNA聚合酶活性,但是该检测方法获得的标准曲线为S曲线,随着酶活性增加焦磷酸含量呈现先增加后趋于平衡,尤其是当酶量达到16U时,焦磷酸含量趋于平衡,可见,该检测方法检测范围有限,尤其是在检测酶活在16U/μL以上样品时,其检测结果准确性较差。
本研究基于实时荧光定量PCR仪测定等温扩增产物双链DNA的荧光强度数据,通过分析荧光数据变化,意外发现扩增曲线的线性增长期内单位时间最大荧光增量与Bst DNA聚合酶活性正相关,进一步通过测定不同浓度的Bst DNA聚合酶标准品对应的线性增长期内单位时间最大荧光增量,绘制的标准曲线呈线性正相关,关系式为y=0.3254x-0.0113,式中,x为Bst DNA聚合酶活性,y为线性增长期内单位时间最大荧光增量,且R
本发明提供的一种Bst DNA聚合酶活性检测方法,其具体包括以下步骤:
(1)绘制最大荧光增量-酶活标准曲线:以双链环状质粒DNA为模板,在dNTP mix和一组等温扩增引物的存在下,利用Bst DNA聚合酶进行等温扩增,获取多个不同酶活浓度标准品对应的扩增曲线线性增长期内单位时间最大荧光增量,绘制最大荧光增量-酶活标准曲线;
所述标准曲线为线性正相关,如在一些实施例中绘制的标准曲线为y=0.3254x-0.0113,R
相比专利CN114561444A中的检测方法获得的标准曲线,该标准曲线随着酶活性增加焦磷酸含量呈现先增加后趋于平衡,而且在酶量为16U时达到平衡,可见,在检测酶活在16U/μL以上时,检测结果准确性较差。而本发明提供的标准曲线呈线性正相关,检测范围更为广泛,在检测酶活在16U/μL以上样品时准确度更高。
(2)测定Bst DNA聚合酶活性:等温扩增获取待测酶样扩增曲线线性增长期内单位时间最大荧光增量,代入步骤(1)获得的标准曲线,计算出待测酶样的活性,即为测定的BstDNA聚合酶活性。
进一步地,所述Bst DNA聚合酶活性的检测方法,其所述最大荧光增量,通过实时荧光定量PCR仪测定获得;所述单位时间为等温扩增反应(LAMP反应)单次循环所需的时间,在一些实施例中所述单位时间为30s。
在一些实施例中,扩增曲线的线性增长期内单位时间内的最大荧光增量采用荧光染料法实时荧光定量扩增获得。
所述等温扩增,以双链环状质粒DNA为模板,在dNTP mix和一组等温扩增引物的条件下进行等温扩增;所述等温扩增引物,包括但不局限于如SEQ ID No.1-6所示序列在内的所有常规LAMP引物组。
所述双链环状质粒DNA,包括但不局限于如SEQ ID No.7所示序列在内的所有对应本发明中常规LAMP引物组中任一一组的产物或模板序列。
所述扩增的反应程序,根据选择的双链环状质粒DNA模板及扩增引物进行设置,以能够实现有效扩增为准。
在一些实施例中所述扩增的反应程序,模板如SEQ ID No.7所示的双链环状质粒DNA,其扩增反应条件为:65℃,15~60秒,60个循环;85℃,5分钟;荧光通道:SYBR,在每个循环结束时自动收集荧光信号。采用实时荧光定量PCR仪测定,获取最大荧光增量,具体如下:
待实时等温扩增完成后,先终止Bst DNA聚合酶的扩增反应,导出获得的荧光值数据,并参考其扩增曲线在线性增长期时的荧光值范围和ct值范围如图1所示,然后在导出的数据中找到该范围中单位时间内的最大荧光值增量,即为扩增曲线的线性增长期中单位时间内的最大荧光增量。
另外,本发明还提供了一种Bst DNA聚合酶活性检测试剂盒,其包括酶浓度在5~80U/μL的Bst DNA聚合酶标准品,优选包括至少2个酶浓度在5~80U/μL的Bst DNA聚合酶标准品和至少一组LAMP引物。
以下为实施例:
实施例1Bst 2.0DNA Polymerase(NEB)活性的测定
(1)标准曲线的绘制
本实施例以双链环状质粒DNA为模板,在dNTP mix和一组等温扩增引物的存在下,利用Bst DNA聚合酶进行等温扩增,通过实时荧光定量PCR仪扩增获取扩增产物双链DNA的扩增曲线,根据Bst DNA聚合酶标准品与扩增曲线的线性增长期中单位时间内的最大荧光增量的绘制标准曲线,其中x坐标为Bst DNA聚合酶活性,y坐标为最大荧光增量,根据标准曲线来即可计算出待测Bst DNA聚合酶的活性。标准曲线的绘制,该标准曲线是在各个浓度的荧光增量减去x=0时的净荧光增量,具体操作如下:
①等温扩增反应所需要的试剂:如表1所示。
表1等温扩增反应所需试剂
②等温扩增反应的操作步骤
首先按照表2配制反应混合液,将
表2等温扩增反应混合液参考体系
标注:10×primers:(FIP:BIP:F3:B3:LF:LB)为
12μM:12μM:2μM:2μM:8μM:8μM。
③绘制标准曲线
反应结束后,导出各个酶用量浓度的荧光值数据,并参考其扩增曲线在线性增长期内的荧光值范围和ct值范围,如图1所示,然后在导出的数据中找到该范围中单位时间30s内的最大荧光值增量,以酶用量(U)为横轴,最大荧光值增量(RFL)为纵轴,用OriginPro8.6做非线性回归曲线绘制商品酶的标准曲线。发现这些数据点能够很好地拟合出一条标准曲线,如图2所示,并且其R
具体的不同酶活性对应的最大荧光值增量如下表3所示。
表3不同酶浓度梯度及对应的荧光值
(2)Bst 2.0DNA Polymerase(NEB)活性的测定
①等温扩增反应:等温扩增反应所需要的试剂如表4所示。
表4等温扩增反应试剂
标注:Bst 2.0DNA Polymerase(NEB),商品化酶活性为8U/μL,其酶活定义(30min,消耗25mmol的dNTP),Yeasen品牌的
②等温扩增反应操作步骤
本实验待测样品测定与标准曲线实验同时进行,反应体系和操作流程相同,待测样品Bst 2.0DNA Polymerase(NEB),商品化酶标记活性为20U/μL。进行等温扩增反应。等温扩增反应混合液的配制参考表2,待测样品酶用量为1μL,并进行三次平行试验。
反应条件:65℃30s,60个循环;85℃5min;荧光通道:SYBR,在每个循环结束时自动收集荧光信号。
③数据处理
导出各个酶用量浓度梯度的荧光值数据,并参考其扩增曲线在线性增长期时的荧光值范围和ct值范围,然后在导出的数据中找到该范围中单位时间内的最大荧光值增量,将其代入标准曲线进行计算,得到待测样本的相对酶活,具体结果如表5所示。
表5待测样品Bst 2.0DNA Polymerase(NEB)酶活检测结果
由表5可知,按照本发明提供的测定方法,计算得到的待测酶活20.816U/μL与Bst2.0DNA Polymerase(NEB)的实际酶活20U/μL(30min,消耗10mmol的dNTP)一致性较高,而且同一个样品重复测试3次,其CV%<5%,说明此方法的重复性比较好,可信度比较高。
实施例2Bst 2.0HS(BiORi)活性的测定
(1)绘制标准曲线:采用
(2)测定Bst 2.0HS(BiORi)活性
①等温扩增反应:等温扩增反应所需试剂,如表6所示。
表6等温扩增反应试剂
/>
②等温扩增反应操作步骤
本实验待测样品测定与标准曲线实验同时进行,反应体系和操作流程相同,待测样品Bst 2.0HS(BiORi),商品化酶标记活性为8U/μL。进行等温扩增反应。等温扩增反应混合液的配制参考表2,待测样品酶用量为1μL,并进行三次平行试验。
反应条件:65℃30s,60个循环;85℃5min;荧光通道:SYBR,在每个循环结束时自动收集荧光信号。
③数据处理
导出各个酶用量浓度梯度的荧光值数据,并参考其扩增曲线在线性增长期时的荧光值范围和ct值范围(图1),然后在导出的数据中找到该范围中单位时间内的最大荧光值增量,将其代入标准曲线进行计算,得到待测样本的相对酶活,测定结果如表7所示。
表7待测样品Bst 2.0HS(BiORi)酶活检测结果
由表7可知,按照本发明提供的测定方法,计算得到的待测酶活为8.3378U/μL与Bst 2.0HS(BiORi)的实际酶活8U/μL(30min,消耗10mmol的dNTP)一致性较高,而且检测酶活较低的样品时,同一个样品重复测试3次,其CV%<5%,说明此方法的重复性比较好,可信度比较高。
实施例3Bst DNA Polymerase(NanoMagBio)活性的测定
(1)绘制标准曲线:采用
(2)测定Bst DNA Polymerase(NanoMagBio)活性
①等温扩增反应操作步骤:等温扩增反应所需要的试剂如实施例1中的表1所示,本实验待测样品测定与标准曲线实验同时进行,反应体系和操作流程相同,待测样品为本公司自产的Bst DNA Polymerase,使用酶稀释缓存液将本公司自产的Bst DNA Polymerase进行两倍梯度稀释,得到2×、4×、8×、16×、32×、64×、128×的酶稀释浓度梯度,然后进行等温扩增反应。等温扩增反应混合液的配制参考实施例1中表2,待测样品酶用量为1μL,各浓度梯度的待测样品进行三次平行试验。
反应条件:65℃30s,60个循环;85℃5min;荧光通道:SYBR,在每个循环结束时自动收集荧光信号。
③数据处理
首先根据扩增结果,确定能够扩增的最大酶稀释浓度梯度,然后导出与能够扩增的最大酶稀释梯度相邻的两个酶用量梯度的荧光值数据,并参考其扩增曲线在线性增长期内的荧光值范围和ct值范围,然后在导出的数据中找到该范围中单位时间内的最大荧光值增量,将其代入标准曲线进行计算,得到待测样本的相对酶活。在本次实验中,能够成功扩增的最大酶稀释浓度梯度为64×,故导出相邻的16×、32×、64×的酶稀释浓度梯度的荧光值数据,并代入标准曲线进行计算,按照标准曲线核算的结果与实际酶活一致性均较高,其中以最大酶稀释浓度梯度64×为例,具体测定结果如表8所示。
表8待测样品Bst DNA Polymerase(NanoMagBio)酶活检测结果
由表8可知,按照本发明提供的测定方法,计算得到的待测酶活20.412U/μL与BstDNA Polymerase(NanoMagBio)的实际酶活20U/μL一致性高,而且同一个样品重复测试3次,其CV%<5%,说明此方法的重复性比较好,可信度比较高。
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 一种检测胎儿染色体非整数倍的试剂盒和检测胎儿甲基化DNA拷贝数的方法
- 一种鉴别美洲大蠊的DNA条形码标准检测片段COⅡ、试剂盒及其使用方法
- Bst DNA聚合酶活性的检测方法
- 一种检测DNA聚合酶I活性的试剂盒及检测方法
