一种靶向肝癌的纳米颗粒的制备方法和应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于生物医药技术领域,具体涉及一种靶向肝癌的纳米颗粒的制备方法和应用。
背景技术
肝脏是一个“沉默”的内脏,没有神经,不会疼痛,很多患者在确诊肝癌(HCC)时已是(中晚期)末期,5年生存期仅为10.1%。在我国,仅20%~30%的肝癌患者可以通过手术切除,但5年内复发率仍高达60%~70%。发病率和致死率高,仍然是肝癌治疗面临的现状。目前,由于传统的诊断方法和治疗方案在肿瘤应用中的局限性,肝癌早期诊断效率低,死亡率高,因此,迫切需要一种有效的、有针对性的HCC诊断和治疗方案。肿瘤诊疗一体化是一种不仅能提供肿瘤位置、类型和大小的精确信息,还能发挥有效的治疗的方法,在肿瘤治疗领域占主导地位。
基因治疗是一种新兴的抗癌治疗方法,可以通过多种机制靶向肿瘤,因此核酸疗法引起了研究人员的广泛兴趣。基因治疗的重点是将治疗性核酸药物输送到靶细胞中以治疗疾病。特别是在癌症治疗方面,治疗性核酸最近引起了极大的关注。在治疗性核酸中,DNAzyme通过调节特定基因的表达而成为一种有前景的治疗癌症的药物。DNAzyme由一个特定的单链DNA序列组成,它可以通过互补碱基配对与靶mRNA结合,在单个可编程位点上切割mRNA。此外,与siRNA和microRNA等其他核酸药物相比,DNAzyme具有更高的稳定性、更低的成本和更低的免疫原性,有利于临床应用。到目前为止,DNAzyme已经被很好地设计并整合到各种用于癌症诊断和治疗的纳米平台中。
据统计,80%以上的原发性肝癌发生在肝硬化的基础上,端粒酶再激活是恶性转化过程中的关键,因此90%的人类HCC具有端粒酶表达增加。在HCC中,端粒酶激活主要是由于体细胞TERT启动子突变激活,导致TERT基因表达升高。TERT作为端粒酶的催化亚单位和限速酶,其表达水平高低决定端粒酶活性。TERT的表达受多种转录因子调控。在这些转录因子中,Myc是TERT转录的重要调节因子。Myc诱导TERT表达独立于细胞增殖和从头蛋白合成,暗示其对TERT启动子的直接作用。Myc/Max二聚体与TERT启动子中存在的两个E-box结合均匀且特异性。据报道Myc和Mad在TERT基因的正调控和负调控中发挥重要作用。Myc和Mad都可以与Max蛋白相互作用。Myc/Max和Mad/Max二聚体在TERT启动子中竞争结合相同的靶DNA序列(E-box,位于转录起始位点上游+22至+27)。然而,在结合后,Myc/Max和Mad/Max二聚体对转录有相反的影响。因此,利用Mad和Myc对TERT启动子的拮抗作用来调节端粒酶的活性是一种可行的方案。为了将调节Myc和Mad表达的DNA电路装载并随后运输到活的癌细胞中,需要一种载体;这种载体应该具有理想的特性,包括生物稳定性、生物安全性、生物相容性、穿透生物屏障的能力和细胞摄取的高效率。(2,3-二烯丙基)-三甲基氯化铵(DOTAP)具有研究基础广泛、成本相对较低、易于合成的特点,更重要的是,研究显示DOTAP在I期临床试验中具有可接受的安全性,表明DOTAP具有良好的临床应用前景。
阳离子脂质通常具有一个带正电的头部基团,后面是不同组成的疏水尾部,它被广泛应用于传递基因药物,包括DNA、siRNA和质粒传递,扩大了核酸药物的灵活性和可用性。但DOTAP也具有阳离子脂质体普遍存在的缺点,研究表明,阳离子脂质体以正电荷依赖的方式引起急性细胞坏死,高正电荷的阳离子纳米颗粒可能破坏血细胞并导致溶血,阳离子纳米载体通过与Na
发明内容
本发明的目的在于提供一种靶向肝癌的纳米颗粒的制备方法和应用,其通过对DOTAP阳离子脂质体表面修饰生物素化海藻酸钠进行电荷翻转,实现对肝癌细胞的双重靶向性,同时结合治疗性核酸探针,在检测肝癌标志物的同时达到靶向杀伤肝癌细胞的目的。
本发明的目的是通过如下技术方案实现的:
本发明提供了一种靶向肝癌的纳米颗粒的制备方法,包括以下步骤:
(1)制备生物素化海藻酸钠;
(2)制备DNA探针;
(3)采用脂质挤出法制备包裹步骤(2)所制得的DNA探针的DOTAP脂质体;
(4)在步骤(3)所制备的DOTAP脂质体中加入步骤(1)所制备的生物素化海藻酸钠,经孵育后制得靶向肝癌的诊疗一体化纳米颗粒。
进一步的,在步骤(1)中,所述生物素化海藻酸钠的制备方法为:
(1)将海藻酸钠溶于去离子水中,得到1-3mg/mL海藻酸钠溶液;
(2)再将Bio和EDC·HCl溶解于5mLDMSO中,得到Bio浓度为1-3mg/mL、DMSO浓度为2-4mg/mL的溶液,20-30℃搅拌30-90min,加入DMAP,使DMAP的浓度为1-2mg/mL,再搅拌30-90min,得到混合物溶液;
(3)将混合物溶液滴入海藻酸钠溶液中,室温反应24-48h,即得生物素化海藻酸钠。
进一步的,在步骤(2)中,所述DNA探针的制备方法为:
(1)将序列分别为SEQ ID NO.1-5的H1,H2,H3,H4和mad干粉探针用DEPC水溶解为50-200μM浓度的液体,置于-20℃避光保存备用;
(2)将H1,H2,H3,H4探针进行梯度退火,以形成发夹结构的探针;
(3)将H1,H2,H3和H4四种形成发夹结构的探针与mad探针分别以1:1-1:3的浓度比例在30-40℃下孵育30-60min,即得。
进一步的,在步骤(3)中,所述包裹DNA探针的DOTAP脂质体的制备方法为:
(1)将DOTAP溶解在不含RNase的超纯水中,使DOTAP的浓度为5-15mg/mL,按DNA探针:DOTAP为1:3-1:4的体积比例配置成混合溶液;
(2)将混合溶液通过挤压法制备包裹DNA探针的DOTAP脂质体,其中在制备过程中所采用的是Avestin聚碳酸酯膜径迹蚀刻膜PC滤膜,挤压次数为3-5次。
进一步的,在步骤(4)中,所述加入的比例为在包裹DNA探针的DOTAP脂质体中按BSA:DOTAP-DNA:为1:3-1:5的体积比加入生物素化海藻酸钠;所述孵育为37℃孵育5-20min。
本发明还提供了一种所述的制备方法所制备得到的纳米颗粒。
本发明还提供了一种所述的纳米颗粒在制备抗癌症药物中的应用。
进一步的,所述癌症为肝癌,包括肝细胞癌、肝内胆管癌、混合型肝癌。
海藻酸钠(SA)是一种广泛使用且易于获得的药用赋形剂,其稳定性、高溶解度、高粘度、安全性和易于生产等优点使其成为一种优良的涂层材料。特别是,研究表明SA可能促进纳米颗粒从溶酶体中逃逸,降低溶酶体中大量的酶对DNA探针稳定性的影响。其次,海藻酸钠由两种异质重复单元组成,β-D-mannuronic acid(M)和α-L-guluronic acid(G)单元,是一种典型的分子链上带有羧基的阴离子聚合物。M单元通过受体-配体相互作用表现出与甘露糖受体的天然免疫和特异性结合能力,G单元的高反应活性,使其可作为生物素的高效键合位点。通过对SA进行生物素修饰后,可实现对肝细胞癌细胞的双重靶向特性,以增强肿瘤累积。
hTR:端粒酶RNA组分,端粒酶利用其自身hTR所携带的RNA为模板,在端粒酶逆转录酶(Telomerase reverse transcriptase,TERT)的逆转录催化下,将端粒重复序列合成到染色体末端,延长或稳定了随着细胞分裂而进行性缩短的端粒,在细胞永生化及恶性肿瘤的发生和发展中起到了重要的作用。hTR在多种肿瘤中均表现出高表达,提示其在致瘤性中的重要作用。因此,hTR的可靠、特异的检测对于癌症的早期诊断具有重要意义。
本发明有益效果在于:
本发明以生物素化的SA(BSA)为DOTAP脂质体涂层材料,实现电荷翻转,在降低纳米材料对细胞本身毒害作用的同时,可提高细胞对DNA探针体系的摄取效率。同时,结合SA与肝癌细胞膜表面高表达的甘露糖受体固有的受体-配体结合作用,和生物素化修饰后的BSA对癌细胞的双重靶向作用,可提高DNA体系的抗癌效果。BSA可促进纳米颗粒从溶酶体中逃逸,保护DNA探针体系的稳定性。结合SA与肝癌细胞膜表面高表达的甘露糖受体固有的受体-配体结合作用,和生物素化修饰后的BSA对癌细胞的双重靶向作用,可提高肝癌细胞对DNA探针体系的摄取效率。
附图说明
图1为BSA的制备示意图;
图2为DNA纳米体系的制备示意图;
图3为BSA@DOTAP-DNA的制备示意图;
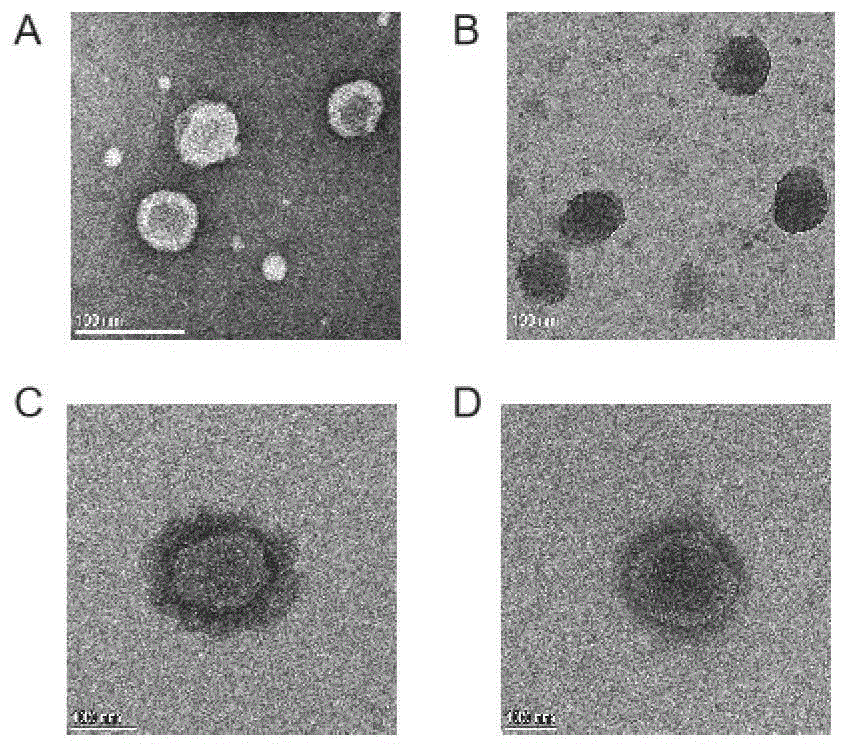
图4为透射电镜图,其中A.DOTAPliposome;B.DOTAP-DNA;C.SA@DOTAP-DNA;D.BSA@DOTAP-DNA;
图5为BSA@DOTAP-DNA用于肝癌细胞诊疗示意图;
图6为DOTAP,DOTAP-DNA,SA,BSA,SA@DOTAP-DNA和BSA@DOTAP-DNA的Zeta电位示意图;
图7为DNA探针体系用于检测hTR可行性验证图;
图8为DNA探针体系用于剪切Myc mRNA从而达到下调Myc的可行性验证图;
图9为BSA@DOTAP-DNA用于胞内检测hTR,时间依赖成像;其中,左图为HepG2细胞的Confocal成像,右图为FAM通道的MFI;
图10为DOTAP-DNA,SA@DOTAP-DNA,BSA@DOTAP-DNA三种纳米颗粒进入肿瘤细胞内进行细胞毒性实验结果图。
具体实施方式
下述实验例和实施例用于进一步说明本发明,但不限于本发明。
实施例1
1.BSA的制备
将80.00mg海藻酸钠(SA)溶于40mL去离子水中(海藻酸钠溶液浓度在1-3mg/mL均可),将9.70mgBio和15.00mg EDC·HCl溶解于5mLDMSO中(Bio浓度在1-3mg/mL、DMSO浓度在2-4mg/mL均可),25℃搅拌60min,加入5.00mg DMAP(DMAP的浓度在1-2mg/mL均可),再搅拌60min,将混合物滴入上述ALG溶液中,室温反应48h,形成生物素化海藻酸钠(BSA),BSA的制备示意图如图1所示。
2.DNAnanosystem的制备
将mad,H1,H2,H3,H4干粉探针用DEPC水溶解为100μM(50-200μM均可)浓度的液体,置于-20℃避光保存备用。将H1,H2,H3,H4探针通过退火buffer分别稀释为5μM的浓度进行梯度退火,以形成发夹探针;
退火buffer:10mM Tris-HCl,pH 7.4,50mMNaCl,100mMKCl,0.5mM MnCl
退火形成发夹结构的H1,H2,H3,H4探针与mad探针分别以1:1(1:1-1:3均可)的浓度比例在37℃(30-40℃均可)下孵育45min(30-60min均可),形成mad-DNA复合物,即完成DNAnanosystem的制备。DNA纳米体系的制备示意图如图2所示。
其中,mad,H1,H2,H3,H4探针的序列如下所示:
mad(SEQ ID NO.5):GGACGU GGACGUAGACGU GGACGUG
H1(SEQ ID NO.1):ACG TCCACG TCC CTT CTCAG/iBHQ1dT/TAGGG TTAGAC GTG GACGTAGAC GTC TAACCC TAAC/i6FAMdT/CGG TCGAAACCTTGG GGGCC
H2(SEQ ID NO.2):TTT GAGGATCATC CGAGC GTC TAACCC TAACT CGTAGACGTGGAAGTTAGGG TTAGAC GTCTACG TCCAC
H3(SEQ ID NO.3):TTT GAGGATCATC CGAGC TCCACGTCTACGAGTTAGGG TTA GACGACGTGGACGTG GTC TAACCC TAACT
H4(SEQ ID NO.4):GTC TAA CCC TAA CT GAG AAG GG AGTT AGGG TTA GACCACGTCCACGTC CGGTCGAAACCTTGG GGGCC
3.采用脂质挤出法制备空DOTAPliposome
首先,将50mg DOTAP溶解在不含RNase的5ml超纯水中。按DNA:DOTAP为1:3(1:3至1:4均可)的体积比例配置成混合溶液。将溶液通过挤压法制备包裹DNA探针的DOTAP脂质体(DOTAP-DNA),该处滤膜选择的是Avestin聚碳酸酯膜径迹蚀刻膜PC滤膜;挤压4次(3-5次均可),制成DOTAP脂质体。
4.SA@DOTAP-DNA和BSA@DOTAP-DNA的制备
SA@DOTAP-DNA:将80.00mg海藻酸钠(SA)溶于40mL去离子水中,制成2mg/mL的SA溶液。在DOTAP-DNA中按1:3(1:3至1:5均可)体积比加入SA溶液(SA:DOTAP-DNA),37℃孵育5min,制备SA@DOTAP-DNA。
BSA@DOTAP-DNA:将80.00mg海藻酸钠(SA)溶于40mL去离子水中。将9.70mg Bio和15.00mg EDC·HCl溶解于5mLDMSO中,25℃搅拌60min,加入5.00mg DMAP,再搅拌60min,将混合物滴入上述ALG溶液中,室温反应48h(24-48h均可),形成生物素化海藻酸钠(BSA)。在DOTAP-DNA中按1:3(1:3至1:5均可)体积比加入BSA溶液(BSA:DOTAP-DNA),37℃孵育5min(5-20min均可),制备BSA@DOTAP-DNA。BSA@DOTAP-DNA的制备示意图如图3所示。
最终所制备得到的DOTAP liposome;DOTAP-DNA;SA@DOTAP-DNA;BSA@DOTAP-DNA的透射电镜图如图4所示。
5.DNA纳米诊疗部分的构建
DNA纳米诊疗部分由mad和四个发夹探针(H1,H2,H3,H4)通过连续退火过程构建而成。当BSA@DOTAP-DNA纳米颗粒进入肝癌细胞,DNA探针被释放到胞质中。肝癌细胞高表达hTR,hTR通过碱基互补配对与H1探针中的teohold区域结合,从而启动由H1,H2,H3,H4组成的HCR。形成HCR产物的同时,MadmRNA脱落,恢复单链,实现MadmRNA的转染,上调Mad。HCR产物的形成使预先包载在四个发夹中的DNAzyme序列重构,形成完整结构。DNAzyme识别切割肝癌细胞中的Myc mRNA,下调Myc。总得来说,肝癌细胞中高表达的hTR作为启动开关,上调Mad的同时下调Myc,从而达到抗肿瘤的作用。BSA@DOTAP-DNA用于肝癌细胞诊疗示意图如图5所示。
DOTAP,DOTAP-DNA,SA,BSA,SA@DOTAP-DNA和BSA@DOTAP-DNA的Zeta电位图如图6所示,可知,DOTAP脂质体Zeta电位表现为正电,对DOTAP-DNA进行表层修饰SA或BSA后,Zeta电位呈负电,表明对DOTAP阳离子脂质体电荷改性成功。
DNA探针体系用于检测hTR可行性验证图如图7所示,可知修饰有FAM-BHQ1荧光基团-淬灭基团对的H1发夹探针,在无hTR靶标时无明显荧光信号产生,当引入hTR后,H1发夹探针的teohold区域通过碱基互补配对与hTR结合从而打开发夹探针,引发HCR,释放荧光信号。
DNA探针体系用于剪切Myc mRNA从而达到下调Myc的可行性验证图如图8所示,可知,在Myc探针序列(与Myc mRNA序列相同)两端修饰Cy3-BHQ2荧光基团-淬灭基团对,在加入hTR作为触发靶标时,产生的HCR产物剪切Myc探针,从而释放荧光信号,表明该DNA探针体系可用于剪切Myc mRNA。
将HepG2细胞传代培养后,取约2×10
取2mL含10%FBS的DMEM培养基加入上述待测细胞,加入100μLBSA@DOTAP-DNA,于37℃且CO
FAM荧光通道反映胞内hTR的表达情况,通过对FAM通道进行定量分析后,可实现对hTR的检测。
采用CCK-8检测纳米材料的细胞毒性。将HepG2细胞接种到96孔板上,24h后,在每个孔中加入不同量的纳米材料。孵育24h后,每孔中加入10μLCCK-8,37℃孵育4h,采用酶标法测定细胞活力,DOTAP-DNA,SA@DOTAP-DNA,BSA@DOTAP-DNA三种纳米颗粒进入肿瘤细胞内进行细胞毒性实验结果图如图10所示。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围。
- 一种用作光/声敏剂的靶向纳米颗粒及其制备方法和应用
- 靶向胎盘样硫酸软骨素A的多肽、靶向纳米颗粒及其制备方法和应用
- 一种肝癌靶向的纳米递药系统及其制备方法和用途
- 一种靶向线粒体的自组装蛋白质纳米颗粒的制备与应用
- 用于药物流产的胎盘靶向纳米颗粒及其制备方法和应用
- 一种具有肝癌靶向功能的低代数树状大分子包裹的金纳米颗粒作为CT纳米造影剂的制备方法
- 一种具有肝癌靶向功能的低代数树状大分子包裹的金纳米颗粒作为CT纳米造影剂的制备方法
