用于培养细胞聚集体的微流控悬滴培养装置
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及一种用于培养细胞聚集体的微流控悬滴培养装置。
背景技术
组织特异性类器官培养技术作为目前干细胞研究中最受关注的前沿领域,可以在诸如疑难杂症模型、患者定制药物筛选平台以及用于新药开发的体外模型等的再生医学和新药研究领域中无限扩展应用性。
与宏观培养不同,利用微流控装置培养细胞的技术是一种给细胞提供合适的微观环境并精确控制对周围环境敏感反应的细胞的培养条件的技术,近年来在细胞组织工程领域中分别得到了应用。
然而,与静态培养(static culture)不同,动态培养(dynamic culture)需要流体流动,因此需要注射泵或液压泵等复杂的设备,以及使用者的高熟练度。
在现有的类器官研究中,为了向培养液提供流动而使用的方法包括将培养皿(culture dish)安装在轨道振荡器(orbital shaker)上或使用旋转烧瓶(spinner flask)等生物反应器,但提供到各类器官的流体流动并不均匀,可能会导致被认为是在类器官研究中最大问题的极端的个体差异(batch-to-batch variation)。
现有的悬滴培养技术是将微升体积(20-50μl)的细胞培养液放置在玻璃或培养皿上进行。此后,倒置玻璃皿或培养皿。这些水滴因表面张力而无法掉落,悬挂在培养液中的细胞因重力而沉降,沉降在培养液内部的细胞与相邻细胞相互作用实现结合并形成三维球体或三维微组织。在这种技术中的最大难点是从液滴(Droplet)中交换培养液。
因此,本发明人开发了一种微流控悬滴培养装置,其使用实验室中常用的搅拌装置无需单独的设备即可产生流体流,并确认了其可以增强类器官的存活能力、分化能力以及功能性。
发明内容
发明所要解决的问题
本发明的目的在于提供一种细胞聚集体培养装置,包括:培养腔,其包含一个以上的孔;一个以上的储液器,其用于储存培养液;以及微通道,其用于连接培养腔和储液器。
本发明的目的在于提供一种细胞聚集体培养系统,包括:上述装置;搅拌器(摇杆(rocker));以及通过微通道共享的培养液。
本发明的目的在于提供一种使用上述培养系统培养细胞聚集体的方法。
用于解决问题的方案
本发明的一个方面提供一种细胞聚集体培养装置,包括:培养腔,其包含一个以上的孔;一个以上的储液器,其用于储存培养液;以及微通道,其用于连接培养腔和储液器。
作为本发明的一个具体例,上述培养腔还可以包括连接多个孔的微通道。
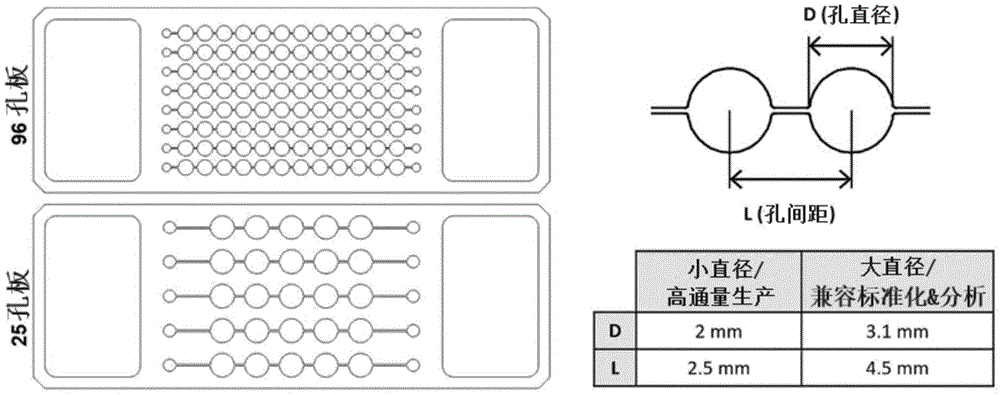
作为本发明的一个具体例,上述孔的直径可以为1.5mm至4mm,并且通过上述微通道连接的孔之间的间距可以为1.5mm至5mm。
作为本发明的一个具体例,上述储液器可以位于上述装置的两端。
作为本发明的一个具体例,上述细胞聚集体可以是衍生自间充质干细胞、神经干细胞、血管内皮细胞、诱导多能干细胞、胚胎干细胞、组织干细胞、胎儿干细胞、癌症干细胞以及心脏细胞中任意一种的球状体或类器官。
作为本发明的一个具体例,上述细胞聚集体可以是衍生自由脑、视杯(opticcup)、肾、肝、胰腺、神经管、胃、大肠、前列腺、乳房、心脏、唾液腺(salivary gland)、子宫内膜(endometrium)、乳腺(mammary gland)、甲状腺、舌、小肠、食道、脊髓、皮肤、胆管、肺、血管、肌肉、肾上腺皮质以及甲状腺类器官组成的组中的一个。
本发明的另一方面提供一种细胞聚集体培养系统,包括:上述装置;搅拌器(摇杆);以及通过微通道共享的培养液。
作为本发明的一个具体例,上述装置可以通过上述搅拌器进行摇摆运动(swingmotion)。
本发明的另一方面提供一种使用上述培养系统培养细胞聚集体的方法。
发明效果
与常规细胞聚集体培养技术相比,本发明的细胞聚集体培养装置、包括上述细胞聚集体培养装置的细胞聚集体培养系统以及使用上述细胞聚集体培养装置的培养细胞聚集体的方法具有进一步增强的干细胞活性以及高分化度的效果。
上述细胞聚集体培养装置能够反复重复使用,并且通过改变孔的尺寸和数量,能够用作多种用途的平台。
此外,上述细胞聚集体培养系统通过使用搅拌器,使位于储液器和培养腔内的孔中的培养液通过微通道不断流动,从而能够使整个孔的环境保持相同,并且能够均匀、高通量培养细胞聚集体。
此外,上述细胞聚集体培养系统可以通过大量生产保持疾病表型的细胞聚集体,应用为疾病研究和药物筛选的模型,还可以通过大量生产治疗用细胞聚集体,应用于移植治疗以治疗疾病。
附图说明
图1示出了本发明的悬滴培养芯片(hanging drop chip;HD chip)的结构。
图2以及图3是示出悬滴培养芯片(HD芯片)的结构和培养方式的图。
图4是使用悬滴培养芯片(HD芯片)的球状体形成以及培养的图。
图5是示出由PDMS制作的悬滴培养芯片(HD芯片)的可重复使用性(reusability)的图。
图6是示出使用悬滴培养芯片(HD芯片)的各种细胞聚集体形成方式的图。
图7是为了与现有培养皿悬滴培养方法进行比较,示出的脂肪干细胞球状体(hADSC spheroid)的培养结果的图。
图8是为了与现有的U形底(U-bottom)孔板培养方式进行比较,示出的脂肪干细胞球状体(hADSC spheroid)的培养结果的图。
图9是作为各种球状体/类器官培养应用的示例,示出的神经干细胞球状体(hNSCspheroid)的培养结果的图。
图10是作为各种球状体/类器官培养应用的示例,示出的心脏球状体(cardiacspheroid)的培养结果的图。
图11是作为各种球状体/类器官培养应用的示例,示出的脑类器官(human iPSC-derived brain organoid)的培养结果的图。
图12示出了根据在HD芯片中培养的肝脏类器官(Human iPSC-derived liverorganoid)的细胞成分的分化能力差异的分析结果的图。
图13示出了人类iPSC衍生肝脏类器官(Human iPSC-derived liver organoid,HEM)的脏器培养分化能力的比较结果。
图14以及15示出了人类iPSC衍生肝脏类器官(Human iPSC-derived liverorganoid,HEM)的标志物表达分析的结果。
图16示出了人类iPSC衍生肝脏类器官的标志物表达以及功能性分析结果。
图17示出了人类iPSC衍生肝脏类器官长期培养时标志物表达的比较结果。
图18至20示出了高通量(high-throughput)HD芯片的制作结果。
图21示出了在100孔HD芯片中生产的人类iPSC衍生肝脏类器官的均匀性分析结果。
图22示出了在高通量(high-throughput)HD芯片中培养的人类iPSC衍生肝脏类器官(Human iPSC-derived liver organoid)中基因表达均匀性的比较结果。
图23示出了人类iPSC衍生正常以及非酒精性脂肪性肝炎类器官的大量生产以及功能性分析的结果。
图24示出了人类iPSC衍生非酒精性脂肪性肝炎类器官的大量生产以及有效药物测试的结果。
图25示出了人类iPSC衍生非酒精性脂肪性肝炎类器官的大量生产以及ROS定量分析的结果。
图26示出了将人类iPSC衍生胰腺类器官(Human iPSC-derived pancreasorganoid)的大量培养结果与现有微孔(Microwell)以及U形底孔板方式进行比较的结果。
图27示出了人类iPSC衍生胰腺类器官(Human iPSC-derived pancreasorganoid)的标志物表达以及分化能力的比较结果。
图28示出了人类iPSC衍生胰腺类器官(Human iPSC-derived pancreasorganoid)的胰岛素产生的比较结果。
图29示出了通过芯片到芯片转移(Chip-to-chip transfer)的球状体(spheroid)(人脂肪干细胞(hADSC)球状体)融合(fusion)的结果。
图30示出了人类iPSC衍生肝脏类器官-胰腺类器官(Human iPSC-derived liver-pancreas fused organoid)的异种脏器之间融合方式的比较结果。
图31示出了制作高通量HD芯片并通过上述芯片的脂肪干细胞球状体(hADSCspheroid)之间的高通量融合结果。
图32示出了基于HD芯片的肝-胰腺类器官的高通量融合结果。
图33示出了将在HD芯片中培养的肝脏类器官(Human iPSC-derived liverorganoid)移植到小鼠脂肪性肝炎模型中的结果。
图34示出了将在HD芯片中培养的肝脏类器官(Human iPSC-derived liverorganoid)移植到小鼠脂肪性肝炎模型中的结果。
图35示出了使用芯片上(On-chip)药物筛选以及酶标仪的荧光定量分析(hADSC-人类脂肪干细胞球状体)的结果。
图36示出了使用3D打印进行HD芯片原型制作的结果。
图37示出了使用配件进行三维球状体/类器官培养的结果。
图38示出了使用配件培养具有多层结构的三维脂肪干细胞(ADSC)球状体的结果。
具体实施方式
本发明的一个方面提供一种细胞聚集体培养装置,包括:培养腔,其包含一个以上的孔;一个以上的储液器,其用于储存培养液;以及微通道,其用于连接培养腔和储液器。
上述培养腔包括一个以上的孔,并且上述孔中充满培养液,所以能够培养细胞聚集体。上述培养腔的孔可以单列培养,也可以考虑培养规模或用途而设置为多列。
上述储液器作为通过微通道向培养腔供应、共享培养液的装置,考虑实验目的可以制作成各种形状和数量。
上述微通道连接培养腔和储液器,只要能够使培养液流动,其形状、尺寸、长度等可以不受限制地改变。
作为本发明的一个具体例,上述培养腔还可以包括连接多个孔的微通道。上述培养腔包括一个以上的孔,因此除了培养腔和储液器之间的微通道,可以进一步包括孔之间的微通道,通过共享多个孔和储液器之间的培养液来保持恒定的环境。一方面,考虑到部分实验的目的,多个孔之间的微通道可以仅在部分孔之间形成。
作为本发明的一个具体例,上述孔的直径可以为1.5mm至4mm,具体可以为2mm至3.1mm,通过上述微通道连接的孔之间的间距可以为1.5mm至5mm,具体可以为2.5mm至4.5mm。更具体地,上述孔的直径为2.0mm或3.1mm,通过上述微通道连接的孔之间的间距可以为2.5mm或4.5mm,最具体地,当上述孔的直径为2.0mm时,孔之间的间距为2.5mm,并且当上述孔的直径为3.1mm时,孔之间的间距可以为4.5mm。
作为本发明的一个具体例,上述储液器可以位于上述装置的两端。上述储液器位于装置的两端,通过培养腔的一个以上的孔和微通道连接,并且每个孔也通过微通道连接,使储液器-一个以上的孔-储液器连接,使得培养液可以向整体供应、共享。
作为本发明的一个具体例,上述细胞聚集体可以是衍生自间充质干细胞、神经干细胞、血管内皮细胞、诱导多能干细胞、胚胎干细胞、组织干细胞、胎儿干细胞、癌症干细胞以及心脏细胞中任意一种的球状体或类器官。
上述“球状体(spheroid)”是指球状细胞的聚集体。实质上,称为球状形状不限于完全的球状,还可以包括稍微扁平的形状。
上述“类器官(organoid)”是指将组织或全能干细胞(totipotent stem cell)衍生的细胞以3D形态培养,制作成人工脏器形态的超小型活体器官。上述类器官作为包含由干细胞产生并以类似于活体内状态的方式进行自组织(或自我模式式)的脏器特异性细胞的三维组织类似物,可以通过对有限的要素(例如,生长因子)进行模式化而发育成特定组织。上述类器官具有细胞原有的生理学特性,并且可以具有模拟细胞混合物(不仅包括限定的细胞类型,还包括残留的干细胞、近端生理生态位(physiological niche))原始状态的解剖学结构。上述类器官通过三维培养方法使得细胞和细胞功能得到更好的排列,可以具有如具备功能性的器官的形态和组织特异性功能。
作为本发明的一个具体例,上述细胞聚集体可以是衍生自由脑、视杯(opticcup)、肾、肝、胰腺、神经管、胃、大肠、前列腺、乳房、心脏、唾液腺(salivary gland)、子宫内膜(endometrium)、乳腺(mammary gland)、甲状腺、舌、小肠、食道、脊髓、皮肤、胆管、肺、血管、肌肉、肾上腺皮质以及甲状腺类器官组成的组中的一个。
本发明的另一方面提供一种细胞聚集体培养系统,包括:上述装置;搅拌器(摇杆);以及通过微通道共享的培养液。
上述“搅拌器(摇杆)”通过使上述培养装置定期运动来向上述培养液赋予动态流动(flow)。上述搅拌器只要能够通过改变上述装置的位置向上述培养液提供动态流动即可,运动的范围或形式没有特别限制。
上述“培养液(culture medium)”是在作为细胞的培养介质的同时,还是营养物质或氧气等的传输介质。上述培养液可以为细胞供应必需的营养物质或氧气等,并去除废物。
作为本发明的一个具体例,上述装置可以通过上述搅拌器进行摇摆运动(swingmotion)。
上述“摇摆运动”是指机械装置的一种操作形式,是指驱动部分在一定区间内往复运动而不是绕轴旋转的运动。
上述装置以特定的周期摇摆运动,因此上述装置内的培养液可以在腔室内以特定周期往复运动,并且可以建立能够稳定培养细胞聚集体的环境。
本发明的另一方面提供一种使用上述培养系统培养细胞聚集体的方法。
上述培养是指在适合的条件下使细胞维持和生长的过程,适合的条件可以指例如,维持细胞的温度、营养素可溶性、大气CO
用于维持、增殖、扩增和分化不同类型细胞的适当培养条件在本领域中是已知的并记录在案。适合于上述细胞聚集体形成的条件可以是使细胞分化和多细胞结构形成变得容易或允许的条件。
本发明的最佳实施方式
以下通过实施例对一个以上的具体例进行更详细的描述。然而,这些实施例旨在示例性的说明一种以上的具体例,本发明的范围不限于这些实施例。
实施例1:类器官培养装置的制备
构建了由用于培养类器官的培养腔和用于容纳培养液的储液器组成的芯片,并且实现了使孔的直径和间距可以根据实验目的和类器官的特性进行选择。具体地,当目标为形成高通量类器官时,可以通过减小孔的尺寸和间距来提高培养效率,当目标为不仅是形成类器官还包括分析时,可以与现有的酶标板匹配标准使用市售的酶标仪。
一方面,可以利用培养液的表面张力来保持培养液流动以及用于捕获细胞的培养液液滴,并且HD芯片基本上使用PDMS聚合物,通过一般微流控芯片(microfluidic chip)制作方法制作。
制作HD芯片的具体方法是设计目标板的图案(图1)后,通过光刻工艺制作压纹图案化的硅片,并将其使用为模板,通过对聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)进行固化的软光刻工艺(soft lithography)制作装置图案PDMS。用叶片使其成型,并使用活组织检查穿刺器(biopsy punch)在孔室或培养液注入口上打孔。以这种方式制成的器件通过将氧等离子体以60W照射表面1分钟来激活后,再将其相互附着。为了完全结合,将其放入70℃以上的烘箱中过夜,然后通过高温高压灭菌以及UV照射进行灭菌。
其结果,制备了如图2上部所示的96孔装置以及25孔装置。
此外,当将人脂肪干细胞(hADSC)培养在制作的装置中时,确认了细胞可以在一天内聚集形成球状体(hADSC的情况下6小时内)。
具体地,将人脂肪干细胞(hADSC)放入到实施例1中制备的25孔装置中并进行培养。
当将细胞悬浊液注入到25孔装置时,细胞因重力下沉并聚集在培养液液滴的顶端,随着时间的推移细胞相互聚集,确认了6000个细胞/类器官水平的球状体/类器官形态(图2下部)。
一方面,本发明的装置可以通过使用搅拌器(摇杆)连续混合两侧存储有培养液的储液器中的培养液和各培养腔中的培养液来交换消耗的培养液和分泌的废物。
由此确认了即使在搅拌器上,HD芯片内的培养液液滴结构也保持稳定,并且可以通过两侧的储液器轻松更换培养液(图3)。
实验例1:使用悬滴培养芯片(HD芯片)的球状体形成以及培养结果的确认
通过增加培养腔的数量(96孔),确认了其可以用作高通量球状体/类器官形成平台(图4左侧)。通过这些结果可以一次性轻松注入细胞,从而大量形成球状体/类器官。
如图4右侧所示,确认了使用HD芯片可以形成尺寸均匀的球状体,并且可以根据注入的细胞数量调整球状体尺寸,在从球状体形成初期到长期培养(long-term culture)期间,可以进行稳定的球状体培养,而不会粘附在装置表面或变形。
实验例2:以PDMS制作的悬滴培养芯片(HD芯片)的可重复使用性的确认
确认了以PDMS制成的悬滴培养芯片(HD芯片)的可重复使用性(reusability)。
HD芯片装置能够用各种材料生产,但尤其是当用PDMS材质制成时,其可以通过灭菌再利用。
用PDMS制成悬滴培养芯片,实际上为了进行人脂肪源性干细胞(hADSC)球状体培养即使重复使用10次以上,hADSC球状体每次都形成良好,并且确认了没有细胞死亡的高细胞存活率(图5)。
实验例3:使用悬滴培养芯片的各种细胞聚集体形成方式的确认(通过各种方式的片上细胞/凝胶加载(On-chip cell/gel loading)的三维球状体以及类器官的形成可能)
现有的球状体/类器官培养系统大多是简单的三维培养,但使用本发明开发的HD芯片系统,可以实现以现有培养系统难以实现的各种方式的片上(on-chip)三维培养。
具体地,确认了能够进行(1)细胞球状体(cell spheroid)、(2)在水凝胶上的培养(凝胶床(gel bed))、(3)在水凝胶内的培养(凝胶封装(gel encapsulation))、(4)混合其的复合培养(组合(combination))、(5)异质水凝胶结合(凝胶+凝胶融合(gel+gelfusion))等各种形式的三维细胞聚集体培养(图6)。
此外,在培养过程中可以进行额外的细胞注入,有望制作出由各种种类的细胞组成的高度化的球状体以及类器官。
实验例4:与现有培养方式的比较
实验例4-1.与现有培养皿悬滴培养法的比较(脂肪干细胞球状体(hADSCspheroid)培养)
现有的通常使用的利用培养皿盖的悬滴培养法(hanging drop)需要熟练度以形成均匀的培养液液滴,并且更换培养液非常繁琐,培养液的总量较小,因此对于培养环境敏感的细胞以及形成球状体/类器官需要时间的细胞而言,存在生存能力大幅下降的问题。
如图7所示,与此不同,当使用通过微通道稳定供应培养液的HD芯片时,可以形成具有提高的细胞活力和活性的均匀球状体/类器官。
实验例4-2.与现有U形底(U-bottom)孔板培养方式的比较(脂肪干细胞球状体(hADSC spheroid)的培养)
目前广泛使用的U形底孔板,与之前比较的培养皿悬滴培养不同地,显示出较高的细胞活力,但培养6天后进行活/死检测(Live/dead assay)的结果,球状体的形状不规则且具有相对松散的结构,这被判断为是由于与底面接触所致。与此不同,确认了在细胞接触或可以粘附的底面不存在的HD芯片中培养的脂肪干细胞球状体,具有均匀的球形和以细胞密度高且细胞间融合优秀的形态形成(图8A)。
从U形底板各孔中培养的球状体和HD芯片内各孔中培养的球状体中提取mRNA对干细胞基因(Oct4,干性标记物(stemness marker))进行qPCR的结果,确认了与U形底板组相比,HD芯片组中不仅Oct4表达量大幅增加(图8B),而且表达的均匀性也大幅提高(图8C)。
因此,这些结果表明,使用HD芯片培养系统可以制作比现有方式品质更优异的干细胞球状体。
实验例5:各种球状体/类器官的培养
实验例5-1.神经干细胞球状体(hNSC spheroid)的培养
众所周知,人神经干细胞(hNSC)通常在培养皿中通过悬浮培养自然聚集在一起形成球状体,但在培养皿中球状体是随机形成的,因此使得其具有各种尺寸和形状,导致均匀性低并且组成各球状体的细胞的增殖和分化能力的批次间差异很大。
对同一培养皿中培养的神经干细胞球状体和同一HD芯片中培养的神经干细胞球体进行比较分析的结果,确认了HD芯片中培养的球状体的尺寸更加均匀地形成(图9A)。为了进行干细胞基因(Oct4,干性标记物)的表达分析在培养第6天进行qPCR分析时,确认了在HD芯片中形成的单个球状体中的Oct4基因表达比在培养皿中形成的球状体中的Oct4基因表达更均匀(图9B)。
实验例5-2.心脏球状体(cardiac spheroid)的培养
应用HD芯片培养系统以使用由小鼠成纤维细胞(fibroblast)通过直接重组方法(direct reprogramming)衍生的心肌细胞制作心脏球状体。其结果,如图10所示,确认了与现有的在培养皿中的悬滴培养方式或在U形底孔板中的培养相比,通过HD芯片培养形成的心脏球状体在结构上更加发达,并且心肌细胞标志物(α-辅肌动蛋白(α-actinin))的表达大幅提高,具有更加清晰的α-辅肌动蛋白图案。
此外,可以看出在HD芯片中培养的心脏球状体中,更加明显的形成了α-辅肌动蛋白结构,并且从与相邻细胞相比具有图案化排列来看,与现有方式相比,使用HD芯片可以制作出在心跳等电生理方面具有更高的成熟度和功能性的心脏球状体。
实验例5-3.脑类器官(人类iPSC-衍生大脑类器官)的培养
确认了在各条件下形成和培养人类诱导多能干细胞衍生脑类器官时观察到的形态(图11A、B)以及用于分析(图11C)神经分化标志物表达的qPCR结果(Pax6-培养25天以及MAP2-培养27天)。
能够确认与在作为对照组的U形底孔板中培养的脑类器官相比,在HD芯片中培养的脑类器官的尺寸更大(图11A、图11B),并且确认在HD芯片中与血管细胞(EC)共培养的脑类器官的基因表达的结果(图11C),能够确认神经祖细胞标志物(Pax6)和神经元标志物(MAP2)的表达显著增加。
实验例6:肝脏类器官(人类iPSC-衍生肝脏类器官)培养的确认
实验例6-1.在HD芯片中培养的肝脏类器官的根据细胞成分的分化能力差异分析
为了分析在HD芯片中培养的人类iPSC衍生的2种肝脏类器官(HM-iPSC衍生肝细胞(H):间充质干细胞(M)=10:2,HEM-iPSC衍生肝细胞(H):血管内皮细胞(E):间充质干细胞(M)=10:7:2)的分化能力的差异,在培养第5天和第7天,通过免疫染色和定量PCR(qPCR)方法比较并分析标志物表达。
其结果,如图11A所示,确认了在HD芯片中培养的HM和HEM肝脏类器官均良好表达肝脏特异性分化标志物HNF4A和ALB,并且HEM的血管标志物CD31也良好表达。
此外,如图11B所示,在培养第7天,当比较HM组和HEM组之间的基因表达时,观察到在含有血管内皮细胞的HEM组中肝分化标志物(AFP、FOXA2、HNF4A、ALB)表达增加的倾向,确认了含有血管内皮细胞的肝脏类器官发育为更成熟的肝脏类器官。
这些结果表明,使用HD芯片可以有效培养由各种细胞组成的肝脏类器官。实验例6-2.人类iPSC衍生肝脏类器官(HEM)的脏器培养分化能力的比较
将含有血管内皮细胞的人类iPSC衍生肝脏类器官(HEM)在各培养系统中培养20天后,比较了各标志物的基因表达。
其结果,如图13所示,确认了与作为对照组的U形底板和微孔(microwell)相比,在HD芯片中培养的肝脏类器官的分化标志物有显著增加的倾向。确认了肝脏分化相关标志物(AFP、ALB)和血管标志物(PECAM1、CD34、CDH5)均在HD芯片组中表达增加,而细胞凋亡标志物CASP3在HD芯片组中有略减少的倾向。
因此,确认了与作为现有的类器官培养系统的U形底孔板和微孔相比,使用HD芯片可以增强肝脏类器官(HEM)的肝细胞分化以及血管成熟,并减少细胞死亡,从而可以制作出品质更优异的肝脏类器官。
实验例6-3.人类iPSC衍生肝脏类器官(HEM)的标志物表达的分析
将含有血管内皮细胞的人类iPSC衍生肝脏类器官(HEM)在各培养系统中培养15天后,通过免疫染色比较了各组之间肝分化标志物和血管标志物的表达。
其结果,如图14所示,确认了与作为对照组的U形底板和微孔(microwell)相比,在HD芯片中培养的肝脏类器官中肝脏分化标志物HNF4A的表达量更高,血管标志物CD31的表达也增强。所形成的肝脏类器官的形状和形态也被确认为比对照组更加均匀地形成。
因此,确认了与作为现有的类器官培养系统的U形底孔板和微孔相比,使用HD芯片可以增强肝脏类器官(HEM)的肝细胞分化以及血管成熟,从而可以制作出品质更优异的肝脏类器官。
将含有血管内皮细胞的人类iPSC衍生肝脏类器官(HEM)在各培养系统中培养15天后,通过免疫染色比较了各组之间肝分化标志物和血管标志物的表达。
其结果,如图15所示,确认了与作为对照组的U形底板和微孔(microwell)相比,在HD芯片中培养的肝脏类器官中肝脏分化标志物ALB的表达量更高,血管标志物CD31的表达也增强。所形成的肝脏类器官的形状和形态也被确认为比对照组更加均匀地形成。
因此,确认了与作为现有的类器官培养系统的U形底孔板和微孔相比,使用HD芯片可以增强肝脏类器官(HEM)的肝细胞分化以及血管成熟,从而可以制作出品质更优异的肝脏类器官。
实验例6-4.人类iPSC衍生肝脏类器官的标志物表达以及功能性的分析
将人类iPSC衍生肝脏类器官在各培养系统中培养15天后,通过免疫染色比较了各组之间标志物的表达,并比较了肝功能重要指标之一的尿素合成能力。
其结果,如图16A所示,确认了与作为对照组的U形底板和微孔(microwell)相比,在HD芯片中培养的肝脏类器官中肝分化标志物AFP和HNF4A的表达更高,并且当通过F-肌动蛋白染色确认肌动蛋白纤维结构时,在HD芯片组中形成了形状均匀的类器官。
当比较作为肝脏功能指标的尿素合成能力时,如图16B所示,可以确认与对照组系统中培养的肝脏类器官相比,在HD芯片中培养的肝脏类器官的尿素合成能力显著增强。
因此,确认了与作为现有的类器官培养系统的U形底孔板和微孔相比,使用HD芯片可以制作出功能性提高的肝脏类器官。
实验例6-5.人类iPSC衍生肝脏类器官的长期培养时标志物表达的比较
将人类iPSC衍生肝脏类器官在各培养系统中培养10天、15天、30天后,通过免疫染色比较了标志物的表达。
其结果,如图17所示,确认了与作为对照组的U形底板和微孔(microwell)相比,在HD芯片中培养的肝脏类器官的形状长期保持均匀,并且成熟肝脏分化标志物(中期和晚期标志物)HNF4A和ALB也以较高水平表达。此外,确认了当长期培养30天以上时,U形底板和微孔中培养的肝脏类器官死亡,但在HD芯片中培养的肝脏类器官形成了肝脏组织特异性结构(HD芯片组高倍图像),并形成了更成熟的类器官。
实验例7:高通量(high-throughput)HD芯片的制作
实验例7-1.高通量HD芯片的制作
为了提高25孔HD芯片的培养效率,与现有的25孔HD芯片一样,制作了具有384孔板规格且增加培养腔数量的高通量HD芯片(图18)。
高通量HD芯片可以在100个孔中同时悬滴培养球状体/类器官,与现有的25孔HD芯片相同地,其制成能够在垂直方向上相互重叠的设计,并且被制成为可以装在托盘板(trayplate)中进行培养。
为了确认高通量HD芯片中的流体流动模式而进行了模拟,具体地,在10rpm条件下用时间依赖性研究(time-dependent study)进行模拟。
可以确认通道附近的流体的流动性相对较高,而类器官表面的剪切应力(shearstress)较低(图19)。
这表明,HD芯片利用连续的流动,可以通过平稳的培养液循环实现物质交换的同时,可以防止类器官移动到另一个腔室或受到因流动的直接性损伤,因此适用于细致的类器官培养。
为了比较从U形底板和HD芯片到类器官内部的氧转移速率,进行了模拟。作为通过平均流量的稳态(steady state)状态的模拟结果,对应于模拟了培养总体平均数值的值。
示出了将HD芯片中的氧浓度(图20A)和U形底板孔中的氧浓度(图20B)以三维(左)和横截面(右)表示的图像,并且导出了与各个横截面图像中的红色箭头相对应的氧浓度数值图表(图20C)。
模拟结果确认了在HD芯片中培养时,类器官中心部的氧浓度比在U形底板中培养时的氧浓度高。因此,对于向细胞高密度聚集的类器官中心部传输物质是非常重要的类器官培养来说,预测HD芯片培养系统将更加有效。
实验例7-2.在高通量芯片(100孔HD芯片)中生产的人类iPSC衍生肝脏类器官的均匀性分析
为了确认是否可以在高通量100孔HD芯片中均匀地大量生产人类iPSC衍生肝脏类器官,以iPSC肝细胞(H):血管内皮细胞(E):间充质干细胞(M)=10:7:2的比例,将细胞数量设置为每孔6000个,在每个芯片中共接种600000个细胞。为了确认进一步形成的肝脏类器官是否具有增殖能力,通过Ki67免疫染色进行了确认。
其结果,如图21A所示,能够确认当将600000个细胞接种在HD芯片中时,细胞在所有孔内部的培养液液滴中均匀凝聚并聚集在一起,并且100个类器官在24小时内均以均匀的尺寸形成。
对每孔形成1个的共100个类器官进行细胞增殖标志物Ki67染色时,可以确认在类器官内部以均匀的水平活跃地发生细胞增殖(图21B)。
因此,与作为现有的类器官培养系统的U形底孔板和微孔相比,可以预想HD芯片将更适合同时大量制作均匀的肝脏类器官。
实验例7-3.在高通量HD芯片中培养的人类iPSC衍生肝脏类器官基因表达的均匀性的比较
将在高通量100孔HD芯片中制备的100个人类iPSC衍生肝脏类器官(HEM)同时进行悬滴培养,并与在现有的U形底孔板中培养的肝脏类器官(HEM)比较了对肝组织标志物基因表达的均匀性。
其结果,如图22所示,确认了当对代表性肝分化标志物AFP、HNF4A以及ALB进行定量PCR分析时,与现有的U形底孔板中培养的肝脏类器官的基因表达分布相比,使用HD芯片制作的肝脏类器官的基因表达偏差较小,并且显著均匀。由此验证了通过使用HD芯片的高通量悬滴培养,可以生产主要分化标志物的表达均匀的肝脏类器官。
实验例7-4.人类iPSC衍生正常以及非酒精性脂肪性肝炎类器官的大量生产和功能性分析
在高通量100孔HD芯片中制作人类iPSC衍生肝脏类器官(HEMKS)后,正常(Normal)组在正常培养液中培养7天,非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)组在正常培养后5天后,将作为游离脂肪酸的油酸(Oleic acid)以500μM的浓度混合到培养液中,进一步培养2天以诱导脂肪性肝炎。像这样总共培养7天后,比较了正常组和脂肪性肝炎组之间的脂肪堆积程度,并比较了肝功能重要指标之一的细胞色素活性(CYP3A4活性)。为了更准确的脂肪性肝炎建模和药物筛选,制作了包括组成肝脏组织微环境的免疫细胞(库普弗细胞)和基质细胞(肝星状细胞)的肝脏类器官。为此,以iPSC衍生肝细胞(H):血管内皮细胞(E):间充质干细胞(M):iPSC衍生库普弗细胞(K):iPSC衍生肝星状细胞(S)=10:7:2:2:1的比例(HEMKS)制作人类iPSC衍生肝脏类器官。
其结果,如图23A所示,确认了对于大量生产的正常肝脏类器官的情况下,肌动蛋白丝(F-肌动蛋白)在类器官中分布良好,并且几乎观察不到标记脂质(lipid)的BODIPY荧光信号。相反,确认了在NASH类器官的情况下,观察到F-肌动蛋白结构异常,并且类器官内部发生了脂质堆积。
当比较作为肝功能指标的细胞色素活性时,如图23B所示,通过确认正常类器官组的活性显示出比诱导NASH的类器官组高出约2倍,从而确认成功制作了因脂肪性肝炎而引发的肝功能受损的NASH类器官。
因此,确认了使用高通量HD芯片不仅可以大量生产正常肝脏类器官,还可以大量生产显示疾病表型的非酒精性脂肪性肝炎类器官。
实验例7-5.人类iPSC衍生非酒精性脂肪性肝炎类器官的大量生产和有效药物测试
在高通量100孔HD芯片中制作人类iPSC衍生肝脏类器官(HEMKS)后,正常(Normal)组在正常培养液中培养7天,非酒精性脂肪性肝炎(NASH)组在正常培养后5天后,将作为游离脂肪酸的油酸(Oleic acid)以500μM的浓度混合到培养液中,进一步培养2天以诱导脂肪性肝炎。作为治疗脂肪肝的有效药物的依折麦布(Ezetimibe,Eze)是一种胆固醇吸收抑制剂,是以往用于治疗高血糖胆固醇和血脂异常的候选药物。正常培养5天后,将油酸(500μM)和依折麦布(50μM)混合到培养液中进一步培养2天,进行脂肪性肝炎药物测试。总共培养7天后,比较脂肪堆积程度,并通过免疫染色和定量PCR分析比较了组间主要标志物和基因表达。为了更准确的脂肪性肝炎建模和药物筛选,制作了包括构建肝脏组织微环境的免疫细胞(库普弗细胞)和基质细胞(肝星状细胞)的肝脏类器官。为此,以iPSC衍生肝细胞(H):血管内皮细胞(E):间充质干细胞(M):iPSC衍生库普弗细胞(K):iPSC衍生肝星状细胞(S)=10:7:2:2:1的比例(HEMKS)制作人类iPSC衍生肝脏类器官。
其结果,如图24A所示,当通过定量PCR分析对HD芯片中培养的正常、NASH以及NASH+Eze的各类器官组确认基因表达时,确认了脂肪酸堆积标志物PLIN2、炎症标志物TNF-α以及肝纤维化标志物SMA和VIM的表达量在NASH组中增加,而在处理Eze药物的组中减少。
此外,如图24B所示,确认了在正常类器官组的情况下,作为肌动蛋白丝标志物的F-肌动蛋白在类器官内分布良好,并且几乎观察不到标记脂质(lipid)的BODIPY荧光信号。在NASH类器官的情况下,观察到受损的F-肌动蛋白结构,并且类器官内部发生大量脂质堆积。在处理有效药物(Eze)的组中,确认了脂肪酸堆积减少而恢复了功能性。与正常组相比,NASH类器官中肝脏分化标志物ALB的表达量下降,但在处理Eze药物的组中观察到一定程度的恢复。对于肝纤维化标志物Vimentin而言,可以观察到在NASH类器官组中表达显著增加,尤其是,通过免疫染色可以确认,制作肝脏类器官时所包含的肝星状细胞被激活的同时,诱发纤维化的肌成纤维细胞(myofibroblast)分布在类器官内部。
因此,确认了使用基于高通量HD芯片制作的人类肝脏类器官,可以进行保持疾病表型的非酒精性脂肪性肝炎建模,并进一步验证了可以进行药物有效性筛选。
实验例7-6.人类iPSC衍生非酒精性脂肪性肝炎类器官的大量生产以及ROS定量分析
为了确认对使用与上述方式相同的培养方法在高通量100孔HD芯片中制作的人类iPSC衍生肝脏类器官(HEMKS)的正常组、NASH组、NASH+Eze组进行氧化应激(oxidativestress)引起的活性氧物种(Reactive oxygen species,ROS)堆积量,通过氧化应激检测分析方法CM-H
其结果,如图25A所示,确认了大量生产的正常类器官组的情况下,在100个类器官中几乎不显示由ROS引起的氧化应激,而在NASH类器官中与ROS相关的氧化应激显著增加。确认了在处理有效药物(Eze)的NASH类器官组中,这样的氧化应激也减少到一定水平以下,从而确认了用于评价脂肪性肝炎治疗药物有效性的基于HD芯片肝脏类器官的高通量筛选的可能性。
此外,如图25B所示,为了进行对每个类器官的ROS氧化应激定量评价,通过将培养肝脏类器官的HD芯片应用于市售的酶标仪(plate reader)设备来进行芯片上(on-chip)分析。对于高通量HD芯片而言,由于其以与市售的现有384孔板相同的标准设计和制作,因此可以与现有的分析设备互换使用,如酶标仪等。进行定量分析时确认到,在NASH类器官中荧光强度显著增加,而处理Eze药物的类器官组中荧光强度降低,从而确认了通过药物处理可以减少脂肪性肝炎类器官中的氧化应激。
因此,确认了使用以与现有384孔板相同规格制作的高通量HD芯片,可以进行基于大量生产的非酒精性脂肪性肝炎类器官的大规模药物筛选以及有效性定量评价。
实验例8:人类iPSC衍生胰腺类器官的胰腺类器官培养研究结果
实验例8-1.人类iPSC衍生胰腺类器官的大量培养(与现有的微孔和U形底孔板方式的比较)
使用制作的HD芯片实施人类iPSC衍生胰腺类器官培养。对照组使用了在3D类器官制作中使用最广泛的U形底孔板和微孔板。
对于胰腺类器官,以iPSC衍生胰腺祖细胞(P):血管内皮细胞(E):间充质干细胞(M)=10:7:2的比例混合,并以每孔6000个的细胞数进行接种(seeding)。类器官形成后,在β细胞分化培养液中诱导进一步分化为胰腺类器官。
其结果,如图26A所示,确认了与对照组相比,在HD芯片中培养的胰腺类器官以更均匀且一致的形态形成类器官。
此外,如图26B所示,当在类器官形成的第2天测量各培养环境中形成的类器官的尺寸时,确认了与对照组相比,在HD芯片中制成的胰腺类器官的个体间偏差最小。由此表明,通过HD芯片培养可以制作尺寸更加均匀的胰腺类器官。
实验例8-2.人类iPSC衍生胰腺类器官的标志物表达以及分化能力比较
将含有血管内皮细胞的人类iPSC衍生胰腺类器官(PEM)在各培养系统中培养5天后,通过免疫染色和qPCR进行基因表达分析,比较了组间胰腺分化标志物和血管标志物的表达。
其结果,如图27A所示,确认了与作为对照组的U形底板和微孔组相比,在HD芯片中培养的胰腺类器官中,内胚层分化标志物SOX17、胰腺祖细胞标志物PDX1和NKX6.1以及β细胞标志物CHGA和胰岛素(Insulin)的表达更高,血管标志物CD31的表达也进一步增强。
此外,如图27B所示,比较对照组和HD芯片中培养的胰腺类器官的基因表达量时,确认了胰腺分化标志物(PDX1、KRT19)、血管标志物(PECAM1)以及增殖能力相关标志物(KI67)均有在HD芯片中表达增加最多的趋势。
由此,确认了与现有的商业化平台相比,制作的HD芯片不仅可以提高胰腺类器官的均匀性,还可以是提高胰腺特异性分化标志物的表达量的装置。
实验例8-3.人类iPSC衍生胰腺类器官的胰岛素产生的比较
在高通量100孔HD芯片中制作人类iPSC衍生胰腺类器官(PEM),并用β细胞诱导培养液进一步培养5天后,通过免疫染色确认了类器官的均匀性和β细胞特异性胰岛素的产生。
其结果,如图28所示,确认了与肝脏类器官相同地,人类iPSC衍生胰腺类器官也可以在100孔HD芯中进行均匀的胰腺类器官的大量生产,并且在β细胞培养液中诱导分化的100个胰腺类器官能够均匀且高水平地产生胰岛素。
这表明,通过高通量HD芯片培养,可以大量生产糖尿病治疗中最重要的具有胰岛素产生/分泌能力的、均匀的人类胰腺类器官。
实验例9:通过HD芯片高通量融合的多种类器官的制作
实验例9-1.通过芯片到芯片转移(Chip-to-chip transfer)的球状体融合(spheroid fusion)
确认了向上开口的HD芯片(25孔版)被设计为可以在垂直方向上相互重叠,因此能够以彼此的垂直坐标结合。
在各HD芯片中培养彼此不同的球状体后,将2个芯片一次性以1:1结合,可以诱导从一个芯片到另一个芯片的直接的球状体移动(图29左侧)。
确认了由于是从HD芯片到HD芯片的移动,因此聚到同一个芯片中的两个球状体位于孔中聚集的培养液液滴的凹部的顶点,可以高效地使球状体之间进行融合(图29的右侧)。
最近,正在积极进行通过不同类器官的融合制作更先进的脏器类似物的研究,因此HD芯片能够以此用途,作为用于生产具有多种组织结构的类器官的培养系统而应用。
实验例9-2.与U形底孔板融合方式的比较
在各HD芯片中培养人类iPSC衍生肝脏类器官(HEMKS)和胰腺类器官(PEM)后,将2个芯片以垂直方向1:1融合使类器官从一个芯片移动到另一个芯片后,通过类器官之间的融合(fusion)制作肝脏-胰腺融合类器官。
使用作为对照组的U形底板进行类器官融合时,需要将分别培养的类器官以1:1逐个转移并融合(图30A左侧)。相反,使用HD芯片进行融合时,可以将所有孔中的类器官有效地一次性移动来融合(图30B右侧)。
确认了在HD芯片中培养的肝脏-胰腺类器官,在移动后24小时内形成融合类器官(图30B)。
确认作为对照组的U形底板和HD芯片中均形成肝脏-胰腺类器官(图30C)。
通过qPCR分析比较肝脏和胰腺相关分化标志物的基因表达量时,确认了与作为对照组的U形底板相比,肝分化标志物(ALB、HNF4A)、胰腺分化标志物(NKX6.1、PDX1)以及肝脏-胰胆管标志物(KRT19)的表达在HD芯片组中显著增加(图30D)。
实验例9-3.基于高通量HD芯片的球状体融合结果的确认
在高通量HD芯片中使用ADSC形成球状体的结果,确认了可以一次性形成100个具有均匀尺寸的球状体并培养(图31左侧)。
与现有的25孔HD芯片相同,将两个100孔HD芯片以垂直方向相互重叠使球状体向一侧移动,结果,能够以80%以上的成功率使球状体移动,并且预测如果后续改变制作芯片所用的材料,效率将进一步提高(图31右侧)。
实验例9-4.基于HD芯片的肝脏-胰腺类器官的高通量融合
在高通量100孔HD芯片中均匀大量生产人类iPSC衍生肝脏类器官(HEMKS),并在另一HD芯片中均匀地大量生产人类iPSC衍生胰腺类器官(PEM)后,通过将两个HD芯片以垂直方向相互重叠的芯片到芯片融合(Chip-to-chip fusion),诱导肝脏类器官和胰腺类器官以1:1融合。
其结果,如图32所示,将两个100孔HD芯片以垂直方向相互重叠,使肝脏类器官向胰腺类器官移动,结果,能够以95%以上的成功率使肝脏类器官移动,因此,确认了不仅可以大量生产单一脏器类器官,通过有效的类器官融合,还可以高通量大量生产肝脏-胰腺多种类器官。
当进行免疫染色来分析所形成的肝脏-胰腺融合多重类器官的各脏器特异性分化标志物时,确认了肝脏特异性分化标志物HNF4A仅在肝脏类器官部分中表达,而在胰腺部分中不表达。还确认了肝脏免疫细胞库普弗细胞标志物(CD68)也仅在肝脏类器官中表达,并且胰腺分化标志物NKX6.1仅在胰腺类器官部分中特异性表达。确认了在肝脏和胰腺中均表达的内胚层标志物SOX17和血管标志物CD31也在HD芯片中融合的多重类器官中良好表达。
实验例10:将HD芯片中培养的肝脏类器官移植至小鼠脂肪性肝炎模型中
为了确认HD芯片中大量生产的人类iPSC衍生肝脏类器官(HEM-肝细胞:血管内皮细胞:间充质干细胞=10:7:2)的体内可移植性和脂肪性肝炎治疗效果,在使用蛋氨酸胆碱缺乏(Methionine-choline-deficient,MCD)饲料诱发脂肪性肝炎的小鼠NASH模型中进行了肝脏类器官移植。缺乏蛋氨酸(Methionine)和胆碱(Choline)的MCD饮食作为诱发脂肪性肝炎、氧化应激、炎症以及纤维化,从而容易诱发非酒精性脂肪性肝炎(NASH)病变的饲料,广泛用于诱发小鼠脂肪性肝炎模型。
正常组(Normal)以正常饮食(Normal Chow)饲养4周,脂肪性肝炎诱发组(NASH)以MCD饲料饲养4周,但在前2周后,通过肝门静脉(Hepatic portal vein)仅注入肝脏类器官培养液(100μL)并在剩余2周继续饲喂MCD饲料来诱发NASH疾病。对诱发脂肪性肝炎的小鼠移植肝脏类器官的组(NASH+类器官)以MCD饲料饲喂4周,但在前2周后,通过肝门静脉注入由HD芯片生产的肝脏类器官(包含在100μL培养液中移植)后,在剩余2周饲喂MCD饲料来继续诱发NASH疾病。对每只小鼠,将由4个HD芯片产生的共400个肝脏类器官收集在胰岛素注射器中,并通过肝门静脉移植(图33A)。
其结果,如图33B所示,模型诱发后对各组进行血液分析时,在模型诱发第2周的类器官移植前一天(手术后(Post-operative day,POD)第1天),与正常组相比,MCD饮食方法诱发NASH疾病的小鼠组中测得的肝毒性指标ALT和LDH数值显著升高。通过肝门静脉注入培养液和类器官的第3天为止,即使是NASH组,由于其接受了类器官培养液的注入,因此培养液中包含的因子可以帮助恢复肝功能,从而与移植肝脏类器官的NASH+类器官组相同地,显示出在注入后ALT和LDH数值逐渐恢复的趋势。但,从注入7天后开始,培养液对肝功能的恢复效果不显著,在仅注入培养液的NASH组中,肝功能下降逐渐明显(ALT和LDH数值升高),但在移植肝脏类器官的NASH组中,ALT和LDH数值几乎降至正常水平,从而确认了肝功能的显著改善。确认了肝功能指标ALB的数值在NASH组中,也从注入培养液3天后开始逐渐下降,肝功能逐渐降低,而在移植肝脏类器官的NASH组中,ALB数值恢复到与正常水平相似的水平。
通过这些结果,确认了通过HD芯片大量生产的均匀的肝脏类器官应用于非酒精性脂肪性肝炎小鼠模型时,可以减少肝损伤,并可以帮助恢复肝功能。即,确认了高通量(high-throughput)HD芯片可以用作有效的培养系统,用于大量生产用于肝损伤治疗的基于类器官细胞的治疗剂。
为了确定通过小鼠脂肪性肝炎(NASH)模型的肝门静脉移植HD芯片中大量生产的人类iPSC衍生肝脏类器官(HEM)后,是否可以诱导脂肪性肝炎的治疗效果,在移植2周后进行了组织学分析和免疫染色。
其结果,如图34A所示,确认了与正常肝脏相比,使用MCD饲料诱发脂肪性肝炎(NASH)4周,并在第2周注入培养液的组中显示出严重的脂肪肝病变,相反,通过肉眼确认了在移植由HD芯片产生的肝脏类器官的组中部分病变得到了恢复。
此外,如图34B所示,当通过H&E染色进行组织学分析时,也确认了与正常肝脏相比,在NASH诱发模型中堆积了大量的脂肪。在注入肝脏类器官的组中,确认了移植的肝脏类器官植入脂肪堆积的区域,减少脂肪堆积并减少受损区域。当通过马松三色(Masson'sTrichrome,MT)染色对因纤维化而堆积的胶原蛋白进行染色时,同样确认了在仅注入培养液的NASH组中部分肝组织出现纤维化,但在移植肝脏类器官的组中,胶原蛋白堆积减少并纤维化进展受到抑制。
为了确认移植的肝脏类器官是否在脂肪肝组织中良好植入并发挥功能,当使用仅对人类蛋白质出现特异性反应的抗体,对肝脏分化标志物(ALB、SOX17)和紧密连接标志物(ZO1)进行免疫染色时,确认了人类蛋白分化标志物仅在移植有人类iPSC衍生类器官的小鼠肝脏组织中表达(图34C)。在本实验中,由于是通过肝门静脉注入肝类器官的,因此移植的类器官可以均匀分布在肝组织内,由此有望有效恢复因脂肪性肝炎而受损的肝功能。在仅注入培养液的NASH模型中,在肝组织内观察到发生SMA阳性纤维化的组织,但在接受肝脏类器官移植治疗的NASH模型中,表达SMA的纤维化区域大幅减少。
移植2周后测量各组小鼠体重时,如此前已知的那样,仅注入培养液的NASH小鼠组的体重大幅下降,但相比之下,在移植肝脏类器官的NASH小鼠组中体重恢复到了一定水平以上。此外,在仅注入培养液的NASH组中,测得的肝脏:体重的比例低于正常组,而在移植肝脏类器官的NASH组中,肝脏:体重的比例恢复到一定水平(图34D)。因此,确认了通过移植的肝脏类器官,使因NASH诱发而受阻的肝功能得到一定程度的恢复,并减少了肝损伤。
通过这些结果,确认了在HD芯片中大量生产的均匀的肝脏类器官被移植到非酒精性脂肪性肝炎(NASH)小鼠模型中时,显示出诱导肝功能恢复并抑制纤维化的效果。即,高通量(high-throughput)HD芯片可以用作有效的培养系统,用于大量生产用于肝损伤治疗的基于类器官细胞的治疗剂。
实验例11:HD芯片的进一步应用
实验例11-1.片上(On-chip)药物筛选以及使用酶标仪的荧光定量分析
通过对活细胞进行染色的钙黄绿素(calcein)染色10分钟来对hADSC球状体进行荧光标记。
对一个芯片内的每条线注入不同浓度的钙黄绿素进行标记,使得在一个HD芯片中培养的hADSC球状体具有不同的荧光强度(intensity),并立即在芯片上对荧光强度进行成像并分析。
由于在本发明中制作的HD芯片(25孔版本)被设计为适合384孔板的标准,因此可以使用市售的通用酶标仪设备直接对其进行分析。即,在芯片中培养球状体或类器官后,可以对其进行荧光染色并立即通过酶标仪测量荧光强度进行定量(图35)。
实际上,当对使用荧光图像的分析结果和使用酶标仪测量荧光强度的结果进行比较时,可以看出具有高度相关性。
实验例11-2.通过3D打印制作装置的可行性的确认
上述本发明的装置由PDMS聚合物材料制成,但在大规模量产方面存在限制。因此,确认了当为了克服这些问题而引入3D打印工艺时,是否可以通过3D打印来制作具有实际商业化设计的本发明装置。
结果,如图36所示,确认了通过3D打印可以轻松制作本发明的装置,还也可以看出由于使用了3D打印,因此设计变更容易,并且在材料选择上,还具有也可以使用易于标准化和大量生产的塑料类材料进行生产的优点。
此外,培养时,即使没有外部连接装置,也可以通过在搅拌器(rocker)上持续混合培养液,来减少悬滴培养装置内类器官个体之间的差异的同时进行培养,但根据实验目的或分析种类,在必要时,可以通过连接额外的管道来使用注射泵。
实验例11-3.能够适用于本发明的装置的配件的应用
制作了可以提高本发明的装置的可用性的配件,并确认了它们的应用性。
具体地,通过单纯地向培养液中添加凝胶溶液来诱导凝胶化的本发明的装置培养方式(图6)上,可以进一步通过使用环形配件,在凝胶溶液接触培养液之前,也可以利用凝胶溶液的粘性和表面张力来使其具有特定的形态,因此可以使用具有各种特性的水凝胶,从而可以使得应用各种种类的凝胶用于球状体/类器官培养(例如,低粘性凝胶、固化前不应与培养液接触的种类的凝胶等)。
配件被设计为适合芯片主体的形状,从而可以实现拆装,一段时间后,当球状体/类器官形成良好时,可以移除配件并继续培养(图37)
当使用现有的方式制作多层结构的3D球状体时,通常需要额外的微流控设备来分别形成中心部分和外层部分,并且大部分仅达到制作小尺寸的多层球状体的水平。
这样的现有方式损失率较高,难以应用于培养尺寸大的球状体,或尤其如类器官等水平的细胞聚集体。
在本发明开发的HD芯片中,确认了通过安装附加配件对中心部分和外层部分分开进行注入,可以非常容易且有效地形成具有多层结构的胶囊形态的球状体(图38)。
以上,对于本发明,重点观察了其优选实施例。本发明所属技术领域的技术人员可以理解,在不脱离本发明的本质特征的情况下,能够以修改的形式来实现本发明。因此,应当从说明性的角度而非限制性的角度来考虑所公开的实施例。本发明的范围在权利要求中而非在上述描述中表示,并且处于等同范围内的所有差异应当被解释为包括在本发明中。
- 一种微流控芯片细胞培养控制装置与方法
- 一种用于细胞共培养的微流控芯片装置及一种细胞共培养方法
- 一种制备均质胶滴用于3D细胞培养的微流控芯片
