用于阻抗监测的医疗装置和方法
文献发布时间:2024-04-18 19:58:21
技术领域
本公开整体涉及用于监测与组织或身体区域体液含量变化相关联的阻抗变化的医疗装置和方法。
天
背景技术
医疗装置可以感测多种用于监测患者情况的信号。此类装置可以是外部的(例如,床边或穿戴式监测器)或可植入监测器,其在一些情况下可包括治疗递送能力,诸如心脏起搏或药物递送。一些医疗装置已经用于或建议用于监测心力衰竭,以通过监测胸腔阻抗,检测心力衰竭状况的恶化。组织阻抗变化可提供良好的患者水肿程度的指示。虽然水肿是许多其他病症的体征,但它也是心力衰竭不断恶化的体征。
在心力衰竭的早期阶段,代偿机制响应于心脏不能泵送足够数量的血液而发生。一种代偿反应是心脏充盈压的增加。增加的充盈压增加了心脏中的血量,从而允许心脏在每次心跳时排出更大的血量。充盈压增加和其他代偿机制最初可能在心力衰竭症状不明显的情况下发生。然而,随着心脏继续变弱,心输出量不足的初始代偿机制会导致心力衰竭代偿失调。衰弱的心脏不再能够进行有效泵送,这使充盈压增加,从而导致胸闷(胸腔水肿)和心脏扩张,这进一步损害了心脏的泵送功能。患者开始了心力衰竭的“恶性循环”。
心室扩张、肺血容量增加和肺内体液潴留都造成了胸腔阻抗的降低。通常,直到水肿变成肿胀或呼吸困难的身体表现(这通常导致住院治疗),医生才将获得患者体内发生水肿的第一项指示。通常,针对急性代偿失调心力衰竭的住院患者的疗法包括早期引入静脉内输注利尿剂或血管扩张剂以清除患者潴留的过量体液。在出现严重症状之前,对水肿进行早期检测,这实现了例如通过药剂、心脏再同步化疗法(CRT)、或其他疗法进行早期处理与干预,这可以规避更严重的患者症状并减小因水肿而住院治疗的可能性。
发明内容
一般而言,本公开是针对一种用于基于多个阻抗测量结果来确定胸腔阻抗估计值的装置和方法。胸腔阻抗估计值可用于监测,该监测针对患者体液状态情况进行检测,例如,与心力衰竭不断恶化相关的水肿、或与利尿过多相关的脱水。在一些示例中,本文所公开的技术实现了使用心脏外电极来执行胸腔阻抗监测,作为示例,心脏外电极可皮下、肌肉下、胸骨下或经静脉但从心脏外部植入。根据公开技术而运行的医疗装置从多个阻抗测量电极向量中的每个向量获得阻抗测量结果。
使用阻抗测量结果,医疗装置可根据包括多个阻抗元件的胸腔阻抗电路模型来计算胸腔阻抗估计值,其中这些阻抗测量结果中的一个或多个测量结果表示了这些电路模型阻抗元件中的至少一个元件的串联或并联组合。以此方式,可计算出胸腔阻抗电路模型的阻抗并且将其用作与实际胸内阻抗测量结果紧密相关的胸腔阻抗测量结果。可以将胸腔阻抗估计值与体液状态情况标准进行比较,以检测某种病症,例如水肿或利尿过多,这可保证医疗装置作出治疗响应或其他医疗救治。
在一个示例中,本公开提供了一种医疗装置,包括:阻抗测量电路,该阻抗测量电路被配置为获得多个阻抗测量电极向量中的每个向量之间的阻抗测量结果;和控制电路,该控制电路被配置为通过使用阻抗测量结果计算胸腔阻抗电路模型的阻抗来确定胸腔阻抗估计值。胸腔阻抗电路模型包括在至少三个端子之间延伸的多个阻抗元件。控制电路可确定胸腔阻抗估计值满足体液状态情况标准;以及响应于胸腔阻抗估计值满足体液状态情况标准来检测体液状态情况。响应于检测到体液状态情况,控制电路可生成输出。医疗装置可包括存储器,该存储器被配置为响应于所生成的输出来存储与胸腔阻抗估计值相关的数据。
在另一示例中,本公开提供了一种方法,包括:获得多个阻抗测量电极向量中的每个向量之间的阻抗测量结果;以及通过使用阻抗测量结果计算胸腔阻抗电路模型的阻抗来确定胸腔阻抗估计值。胸腔阻抗电路模型包括在至少三个端子之间延伸的多个阻抗元件。该方法可包括:确定胸腔阻抗估计值满足体液状态情况标准;以及响应于胸腔阻抗估计值满足体液状态情况标准来检测体液状态情况。该方法还可包括:响应于检测到体液状态情况来生成输出;以及响应于所生成的输出,存储与胸腔阻抗估计值相关的数据。
在另一示例中,本公开提供了一种存储一组指令的非暂态计算机可读介质,当这些指令由医疗装置的控制电路执行时致使装置获得多个阻抗测量电极向量中的每个向量之间的阻抗测量结果,以及通过使用阻抗测量结果计算胸腔阻抗电路模型的阻抗来确定胸腔阻抗估计值。胸腔阻抗电路模型包括在至少三个端子之间延伸的多个阻抗元件。这些指令可以进一步使装置:确定胸腔阻抗估计值满足体液状态情况标准;以及响应于胸腔阻抗估计值满足体液状态情况标准来检测体液状态情况。这些指令可以使装置:响应于检测到体液状态情况来生成输出;以及响应于所生成的输出,存储与胸腔阻抗估计值相关的数据。
本文还公开了以下实施例的主题:
实施例1.一种医疗装置,包括:阻抗测量电路,该阻抗测量电路被配置为获得多个阻抗测量电极向量中的每个向量之间的阻抗测量结果;和控制电路,该控制电路被配置为通过使用阻抗测量结果计算胸腔阻抗电路模型的阻抗来确定胸腔阻抗估计值。胸腔阻抗电路模型可包括在至少三个端子之间延伸的多个阻抗元件。控制电路可被进一步配置为:确定胸腔阻抗估计值满足体液状态情况标准;响应于胸腔阻抗估计值满足体液状态情况标准来检测体液状态情况;以及响应于检测到体液状态情况来生成输出。医疗装置可包括存储器,该存储器被配置为响应于所生成的输出来存储与胸腔阻抗估计值相关的数据。
实施例2.根据实施例1所述的医疗装置,其中控制电路被进一步配置为通过计算电路模型的多个阻抗元件的等效阻抗来确定胸腔阻抗估计值。
实施例3.根据实施例1-2中任一项所述的医疗装置,其中阻抗测量电路被进一步配置为通过确定与电路模型的阻抗元件中的至少两个阻抗元件的组合相对应的阻抗测量结果来获得阻抗测量结果中的每个测量结果。
实施例4.根据实施例1-3中任一项所述的医疗装置,其中控制电路被进一步配置为通过计算包括三个阻抗元件的Y形电路模型的等效阻抗而由这些阻抗测量结果来计算该电路模型的等效阻抗,其中这些阻抗测量结果中的至少一个测量结果对应于Y形电路模型的三个阻抗元件中的至少两个元件的串联组合。
实施例5.根据实施例4所述的医疗装置,其中阻抗测量电路被进一步配置为获得这些阻抗测量结果中的至少一个测量结果,该至少一个阻抗测量结果对应于Y形电路模型的三个阻抗元件中的第一阻抗元件,第一阻抗元件与Y形电路模型的三个阻抗元件中的第二阻抗元件和第三阻抗元件的并联组合串联。
实施例6.根据实施例1-5中任一项所述的医疗装置,还包括封装阻抗测量电路和控制电路的外壳,并且其中阻抗测量电路被进一步配置为通过确定以下中的至少一项来获得阻抗测量结果:来自多个阻抗测量电极向量中的第一阻抗测量电极向量的第一阻抗测量结果,当第一电极和第二电极耦合到阻抗测量电路时,第一阻抗测量电极向量处于第一电极与第二电极之间;和来自多个阻抗测量电极向量中的第二阻抗测量电极向量的第二阻抗测量结果,第二阻抗测量电极向量处于第一电极与外壳之间。控制电路可被进一步配置为通过使用阻抗测量结果确定三端子电路模型的等效阻抗来确定胸腔阻抗估计值,其中第一阻抗测量结果对应于三端子电路模型的第一阻抗元件和第二阻抗元件的串联组合,并且第二阻抗测量结果对应于三端子电路模型的第一阻抗元件和第三阻抗元件的串联组合。
实施例7.根据实施例6所述的医疗装置,其中阻抗测量电路被进一步配置为通过从多个阻抗测量电极向量中的第三阻抗测量电极向量获得第三阻抗测量结果来获得阻抗测量结果。第三阻抗测量电极向量可处于第二电极和外壳的组合与第一电极之间。
实施例8.根据实施例1-5中任一项所述的医疗装置,其中控制电路被进一步配置为通过使用阻抗测量结果确定胸腔阻抗电路模型的单个阻抗元件的阻抗来确定胸腔阻抗估计值。
实施例9.根据实施例1-8中任一项所述的医疗装置,其中控制电路被进一步配置为通过确定胸腔阻抗估计值处于正常阻抗范围之外以及响应于胸腔阻抗估计值处于正常阻抗范围之外而检测到体液状态情况来确定胸腔阻抗估计值满足体液状态标准。
实施例10.根据实施例1-9中任一项所述的医疗装置,其中控制电路被进一步配置为通过以下方式来确定胸腔阻抗估计值满足体液状态标准:建立基线胸腔阻抗;通过确定多个连续确定的胸腔阻抗估计值与基线胸腔阻抗之差的累积和来确定体液状态指数;确定体液状态指数超出阈值;以及响应于体液状态指数超出阈值来确定满足体液状态标准。
实施例11.根据权利要求1-10中任一项所述的医疗装置,其中控制电路被进一步配置为通过计算多个阻抗元件的星形电路模型或多个阻抗元件的网状电路模型中的一者的阻抗来确定胸腔阻抗估计值。
实施例12.根据权利要求1-11中任一项所述的医疗装置,还包括遥测电路,该遥测电路被配置为响应于所生成的输出来传输体液状态通知信号。
实施例13.根据实施例1-12中任一项所述的医疗装置,其中阻抗测量电路被进一步配置为从多个阻抗测量电极向量获得阻抗测量结果,多个阻抗测量电极向量包括由心脏外、可植入引线所承载的至少两个电极。
实施例14.根据权利要求1-13中任一项所述的医疗装置,还包括遥测电路,并且控制电路被进一步配置为经由遥测电路来接收指示以下中的至少一项的用户选择信号:包含在多个阻抗测量电极向量中的可选择阻抗测量电极、胸腔阻抗电路模型、或电路模型的多个阻抗元件中的一个元件。控制电路可被配置为通过根据用户选择信号计算胸腔阻抗电路模型的阻抗来确定胸腔阻抗估计值。
实施例15.一种方法,包括:获得多个阻抗测量电极向量中的每个向量之间的阻抗测量结果;以及通过使用阻抗测量结果计算胸腔阻抗电路模型的阻抗来确定胸腔阻抗估计值。胸腔阻抗电路模型包括在至少三个端子之间延伸的多个阻抗元件。该方法还可包括:确定胸腔阻抗估计值满足体液状态情况标准;响应于胸腔阻抗估计值满足体液状态情况标准来检测体液状态情况;以及响应于检测到体液状态情况来生成输出。该方法还可包括:响应于所生成的输出,存储与胸腔阻抗估计值相关的数据。
实施例16.根据实施例15所述的方法,其中确定胸腔阻抗估计值还包括:计算电路模型的多个阻抗元件的等效阻抗。
实施例17.根据实施例15-16中任一项所述的方法,其中获得阻抗测量结果中的每个测量结果还包括:确定与电路模型的阻抗元件中的至少两个元件的组合相对应的阻抗测量结果。
实施例18.根据实施例15-17中任一项所述的方法,其中使用阻抗测量结果来计算电路模型的等效阻抗还包括:计算包括三个阻抗元件的Y形电路模型的等效阻抗,其中这些阻抗测量结果中的至少一个测量结果对应于Y形电路模型的三个阻抗元件中的至少两个元件的串联组合。
实施例19.根据实施例18所述的方法,其中获得阻抗测量结果还包括:获得与Y形电路模型的三个阻抗元件中的第一阻抗元件相对应的一个阻抗测量结果,第一阻抗元件与Y形电路模型的三个阻抗元件中的第二阻抗元件和第三阻抗元件的并联组合串联。
实施例20.根据实施例15-19中任一项所述的方法,还包括通过确定至少以下项来获得阻抗测量结果:来自多个阻抗测量电极向量中的第一阻抗测量电极向量的第一阻抗测量结果,第一阻抗测量电极向量处于第一电极与第二电极之间;和来自多个阻抗测量电极向量中的第二阻抗测量电极向量的第二阻抗测量结果,第二阻抗测量电极向量处于第一电极与医疗装置外壳之间。该方法还可包括:通过使用阻抗测量结果确定三端子电路模型的等效阻抗来确定胸腔阻抗估计值,其中第一阻抗测量结果对应于三端子电路模型的第一阻抗元件和第二阻抗元件的串联组合,并且第二阻抗测量结果对应于三端子电路模型的第一阻抗元件和第三阻抗元件的串联组合。
实施例21.根据实施例20所述的方法,其中获得阻抗测量结果还包括:从多个阻抗测量电极向量中的第三阻抗测量电极向量获得第三阻抗测量结果。第三阻抗测量电极向量可处于第二电极和外壳的组合与第一电极之间。
实施例22.根据实施例15-19中任一项所述的方法,还包括:通过使用阻抗测量结果确定胸腔阻抗电路模型的单个阻抗元件的阻抗来确定胸腔阻抗估计值。
实施例23.根据实施例15-22中任一项所述的方法,其中确定胸腔阻抗估计值满足体液状态标准还包括:确定胸腔阻抗估计值处于正常阻抗范围之外;以及响应于胸腔阻抗估计值处于正常阻抗范围之外来检测体液状态情况。
实施例24.根据实施例15-23中任一项所述的方法,其中确定胸腔阻抗估计值满足体液状态标准还包括:建立基线胸腔阻抗;通过确定多个连续确定的胸腔阻抗估计值与基线胸腔阻抗之差的累积和来确定体液状态指数;确定体液状态指数超出阈值;以及响应于体液状态指数超出阈值来确定满足体液状态标准。
实施例25.根据实施例15-24中任一项所述的方法,其中确定胸腔阻抗估计值还包括:计算多个阻抗元件的星形电路模型或多个阻抗元件的网状电路模型中的一者的阻抗。
实施例26.根据实施例15-25中任一项所述的方法,还包括:响应于所生成的输出,传输体液状态通知信号。
实施例27.根据实施例15-26中任一项所述的方法,还包括接收指示以下至少一项的用户选择信号:包含在多个阻抗测量电极向量中的可选择阻抗测量电极、胸腔阻抗电路模型、或电路模型的多个阻抗元件中的一个元件。该方法还可包括:通过根据用户选择信号计算胸腔阻抗电路模型的阻抗来确定胸腔阻抗估计值。
实施例28.一种存储一组指令的非暂态计算机可读介质,当这些指令由医疗装置的控制电路执行时致使装置获得多个阻抗测量电极向量中的每个向量之间的阻抗测量结果,以及通过使用阻抗测量结果计算胸腔阻抗电路模型的阻抗来确定胸腔阻抗估计值。胸腔阻抗电路模型可包括在至少三个端子之间延伸的多个阻抗元件。控制电路还可被配置为:确定胸腔阻抗估计值满足体液状态情况标准;响应于胸腔阻抗估计值满足体液状态情况标准来检测体液状态情况;响应于检测到体液状态情况来生成输出;以及响应于所生成的输出,存储与胸腔阻抗估计值相关的数据。
本发明内容旨在提供对本公开中所描述的主题的概述。其并不旨在提供对在以下附图和描述中详细描述的设备和方法的排他性或穷尽性解释。在以下附图和描述中阐述了一个或多个示例的进一步的细节。
附图说明
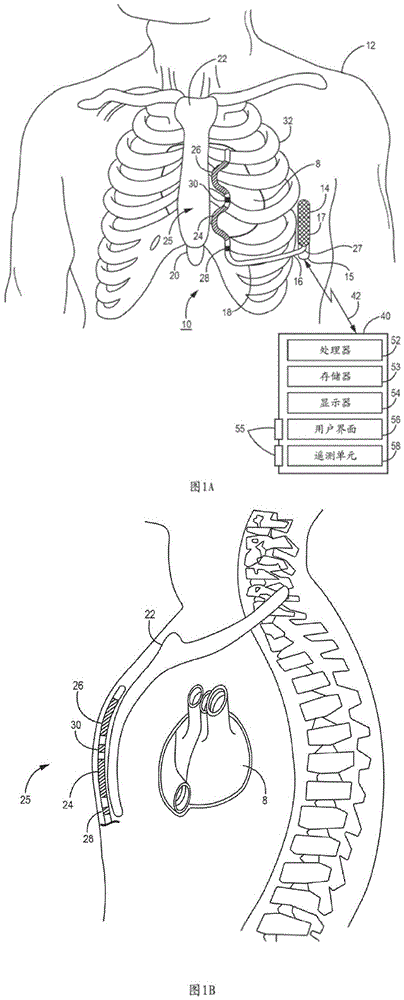
图1A和图1B是根据一个示例的被配置为监测胸腔阻抗的医疗装置系统的概念图。
图2A至图2C是植入了图1A的医疗装置系统的患者的概念图,该系统的植入构型不同于图1A至图1B所示的布置方式。
图3是根据一个示例的被配置为监测胸腔阻抗的医疗装置的概念图。
图4是根据另一示例的可由医疗装置执行以检测胸腔阻抗的方法的流程图。
图5A是阻抗测量电极向量和所需胸腔阻抗通路的概念图200。
图5B是根据一个示例的可用于基于图5A中表示的阻抗测量结果来计算胸腔阻抗估计值的胸腔阻抗电路模型的图示。
图6是根据一个示例的沿着所需胸腔阻抗通路所测的阻抗以及使用本文公开的技术所计算且与所需阻抗通路相对应的胸腔阻抗估计值的曲线图。
图7是使用经静脉引线所获得的胸腔阻抗测量结果的概念图(在图A中)以及可用于计算胸腔阻抗估计值的胸腔阻抗电路模型的概念图(在图B中)。
图8是根据一个示例的基于胸腔阻抗电路模型所确定的阻抗测量结果和胸腔阻抗估计值以及随时间所获取的阻抗测量结果的曲线图。
图9是根据另一示例的随时间所绘的阻抗测量结果以及由阻抗测量结果所确定的胸腔阻抗估计值的曲线图。
图10是根据一个示例的胸腔阻抗电路模型的计算阻抗元件以及被确定为阻抗元件的等效阻抗的胸腔阻抗估计值的曲线图。
图11是根据一个示例的用于监测胸腔阻抗的方法的流程图。
图12是根据另一示例的用于监测患者体液状态的方法的流程图。
图13是根据另一示例的一种可由医疗装置执行而用于监测胸腔阻抗以供体液状态情况检测的方法的流程图。
图14是一种用于选择阻抗电路模型以及选择电路模型的阻抗元件以供组织或身体区域阻抗计算的方法的图示。
图15是可以由外部装置的显示单元来显示的用户界面的另一示例的图示,该用户界面使用户能够选择以下一项或多项:由医疗装置用于计算组织阻抗的阻抗测量电极、阻抗电路模型和/或电路模型阻抗元件。
具体实施方式
一般而言,本公开描述了一种医疗装置和多项技术用于监测身体组织或身体区域的阻抗。身体组织或身体区域的电阻抗可随着体液含量的增加(例如,水肿)而降低,并且随着体液含量的降低(例如,当水肿消失或脱水出现时)而增加。在本文给出的示例中,描述了阻抗测量结果以及从阻抗测量结果来确定阻抗估计值以供胸腔阻抗监测。胸腔阻抗随着水肿的增加而降低(例如,由于充血性心力衰竭),并且随着水肿的降低而增加(例如,响应于利尿剂或心力衰竭治疗)。因此,胸腔阻抗变化可以提供患者心力衰竭状态的指示并且实现了早期医疗干预,早期医疗干预可以是解决利尿不足、利尿过多,或者优化心力衰竭治疗,诸如药物治疗或CRT。虽然本文呈现的说明性示例涉及胸腔阻抗监测,其可用于心力衰竭监测和治疗管理应用场景中,但所公开的技术可用于监测其他身体组织或身体区域的体液状态,以供检测与其他病症或疾病(诸如肾病、脱水等)相关的体液状态变化。对身体组织或身体区域的阻抗变化检测可以提供对与疾病状态或情况相关联的体液状态变化的早期警告,这可能触发医疗装置作出治疗调整或者向患者或临床医生或护理者传送通知或警报,从而实现及时且适当的响应。
在本文给出的示例中,多个阻抗测量结果被获得并用于基于所关注的身体组织或身体区域的阻抗的电路模型来计算所估计的阻抗。例如,三端子Y形(或“Y”)电路模型的等效阻抗可以表示胸腔阻抗。该电路模型的等效阻抗是由电路模型包括的各个阻抗元件的组合所给出的阻抗,该组合可包括各个阻抗元件的串联和/或并联组合。在一些临床应用场景中,身体组织或身体区域的阻抗的电路模型的等效阻抗和/或各个阻抗元件可能未必密切对应于可用的阻抗测量电极向量。例如,用于优化心脏电信号感测的电极放置方式、心脏电刺激疗法的递送、解剖限制因素、或其他考虑因素可能形成电极的植入位置,这些位置形成了对于胸腔阻抗测量与监测(例如,对于体液情况监测)而言并不理想的阻抗测量电极向量通路。
本文所公开的技术提供了使用多个阻抗测量结果且根据胸腔阻抗电路模型来确定胸腔阻抗估计值的方法,其中至少一个测量结果对应于电路模型的各个阻抗元件的串联和/或并联组合。每个阻抗测量结果不一定对应于电路模型的单个阻抗元件或电路模型的等效阻抗。然而,可用的阻抗测量结果可用于将胸腔阻抗估计值计算为等效阻抗以及/或者电路模型的一个或多个单个阻抗元件的阻抗,特别是当电极植入位置可能限制了获得可靠、精确或准确的胸腔阻抗测量结果的能力时。
图1A和图1B是根据一个示例的被配置为监测胸腔阻抗的医疗装置系统10的概念图。系统10包括可植入心律转复除颤器(ICD)14,其连接到心血管外电刺激与感测引线16。图1A是植入患者12内的ICD 14的前视图。图1B是植入患者12内的ICD 14的侧视图。在该示例中,ICD 14被配置为感测心脏电信号并递送心脏电刺激治疗,其可包括心脏起搏和/或心脏复律/除颤电击治疗(CV/DF)。
在该示例中,引线16是非经静脉、心血管外电刺激,并且感测引线16可用于感测阻抗信号,以使用多个阻抗测量电极向量来获得阻抗测量结果。阻抗测量结果可用于根据胸腔阻抗电路模型来确定胸腔阻抗估计值。在各种示例中,ICD 14可耦合到经静脉或非经静脉引线,该引线承载了用于获得阻抗测量结果、感测心脏电信号以及递送电刺激治疗的电极。比如,引线16可以是“心血管外”引线,其指的是定位在围绕患者心脏的血管、心脏和心包之外的引线。心血管外引线所承载的可植入电极可定位在胸腔外(在胸廓和胸骨外)或胸腔内(在胸廓或胸骨之下,有时称为胸骨下位置),但并不一定与心肌组织紧密接触,例如,在心包外。结合图1A至图2C来描述引线16的胸外和胸内位置的示例。心血管外引线也可称为“非经静脉”引线。在这些示例中,多个心脏外电极向量可用于获得阻抗测量结果,以供确定胸腔阻抗估计值。
在其他示例中,ICD 14可耦合到将电极定位在血管内的经静脉引线,但其可在“心外”位置中保持在心脏外部。比如,作为示例,耦合到ICD 14的经静脉医疗引线可沿着静脉通路推进,以将电极定位在胸内静脉(ITV)、肋间静脉、上腹部静脉或奇静脉、半奇静脉或副半奇静脉内的心脏外位置。在还有其他示例中,ICD 14可耦合到:经静脉引线,其被推进以将电极定位在心脏内,例如心房和/或心室心腔内;或引线,定位在心脏8的心外膜上或心包内。经静脉引线可以与第二非经静脉引线组合地耦合到ICD 14,使得多个阻抗测量电极向量可用于获得阻抗测量结果。
ICD 14包括外壳15,其形成了保护ICD 14的内部部件的气密式密封件。ICD 14的外壳15可由例如钛或钛合金的导电材料形成。外壳15可充当电极(有时称为“罐(can)”电极)。外壳15可以与引线16所承载的电极结合使用,用于从多个阻抗测量电极向量获得阻抗测量结果以供胸腔阻抗监测。在一些示例中,外壳15可用作有源罐电极,以用于递送CV/DF电击或其他使用高电压治疗电路递送的高电压脉冲。在其他示例中,外壳15可用于递送单极低压心脏起搏脉冲以及/或者用于结合引线16所承载的电极来感测心脏电信号。在其他情况下,ICD 14的外壳15可包含外壳的外部部分上的多个电极。外壳15的充当一个或多个电极的一个或多个外部部分可涂覆有诸如氮化钛等材料,例如用于减少刺激后极化伪影。
ICD 14包括连接器组件17(也称为连接器块或报头),该连接器组件包括穿过外壳15的电馈通件,以提供在引线16的引线主体18内延伸的导体与包括在ICD 14的外壳15内的电子部件之间的电连接。如本文还将详细所述,外壳15可容纳一个或多个处理器、存储器、收发器、心脏电信号感测电路、阻抗测量电路、治疗递送电路、电源、以及其他用于执行ICD14的各项功能的部件,这些功能包括了获得阻抗测量结果,确定胸腔阻抗估计值,感测心脏电信号、检测心律,以及控制并递送电刺激脉冲以治疗心律异常和/或心力衰竭。
在该示例中,引线16显示为植入胸腔和胸骨外部的心血管外引线。引线16包括细长引线主体18,该细长引线主体具有:近端27,其包括被配置为连接到ICD连接器组件17的引线连接器(未示出);和远侧部分25,其包括一个或多个电极。在图1A和图1B中所说明的示例中,引线主体18的远端部分25包括除颤电极24和26和起搏/感测电极28和30。在一些情况下,除颤电极24和26可一起形成除颤电极,这是因为其可配置为被同时激活。替代地,除颤电极24和26可形成单独除颤电极,在这种情况下,电极24和26中的每个电极均可被独立地激活。在本文呈现的说明性示例中,可单独地或组合地选择电极24和26,以从多个电极向量获得阻抗测量结果。比如,作为示例,可以在电极24与外壳15之间、电极26与外壳15之间、电极24与26之间、电极24与电极26和外壳15的组合之间、电极26与电极24和外壳15的组合之间、或者电极24和26的组合与外壳15之间获得阻抗测量结果。可根据胸腔阻抗电路模型,由至少三个阻抗测量结果来确定与胸液状态相关的胸腔阻抗估计值,如下文进一步所述。
电极24和26(并且在一些示例中,外壳15)在本文中称为除颤电极,因为它们被单独地或共同地用于递送高压刺激疗法(例如,心律转复或除颤电击)。电极24和26可为细长的线圈电极,并且相比起搏电极28和感测电极30,其通常具有相对较高的表面积以用于递送高电压电刺激脉冲。然而,除了或代替高电压刺激治疗,电极24和26和外壳15也可用于提供起搏功能性、感测功能性、和/或阻抗监测。在此意义上,术语“除颤电极”在本文中的使用不应视为是限制电极24和26仅用于高电压心律转复/除颤电击治疗应用场景。例如,除了获得阻抗测量结果之外,电极24和26中的任一电极可用作感测向量中的感测电极,用于感测心脏电信号并确定对电刺激治疗的需要。电极24和/或30可用于递送驱动信号以及/或者感测所得的阻抗信号。
电极28和30是可供感测电极向量用于感测心脏电信号且表面积相对较小的电极,并且在一些构型中可用于递送相对较低电压的起搏脉冲。本文将电极28和30称为起搏“电极/感测电极”,这是因为它们通常被配置用于低电压应用场景中,例如,与递送高电压CV/DF电击相反,用作阴极或阳极以供递送起搏脉冲以及/或者感测心脏电信号。在一些情况下,电极28和30可用于阻抗测量电极向量,其可包括递送驱动信号以及/或者记录所得的阻抗信号。电极28和30可以仅提供起搏功能性,仅提供感测功能性,仅提供阻抗测量功能性,或它们的任何组合。
可以从电极24、26、28和30以及外壳15中选择各种阻抗测量电极向量,以便获得多个阻抗测量结果,这些阻抗测量结果用于使用本文公开技术来确定胸腔阻抗估计值。除了上文给出的示例之外,作为示例,阻抗测量电极向量可包括以下项之间的向量:电极28与电极30、电极28与外壳15、电极30与外壳15、或电极28或30之一与除颤电极24和/或26之一或其组合。
除了获得阻抗测量结果之外,ICD 14可经由一个或多个感测向量来获得与心脏8的电活动相对应的心脏电信号,该感测向量包括电极24、26、28和/或30的组合。在一些示例中,ICD 14的外壳15与感测电极向量中的电极24、26、28和/或30中的一个或多个电极组合使用。在图1A和图1B中所说明的示例中,电极28位于除颤电极24的近侧,且电极30位于除颤电极24与26之间。一个、两个或更多个起搏/感测电极可由引线主体18承载。例如,在一些示例中,第三起搏/感测电极可位于除颤电极26的远侧。电极28和30示出为环状电极;然而,电极28和30可包括多种不同类型的电极中的任一种电极,包括环状电极、短线圈电极、半球形电极、定向电极、或分段电极等。电极28和30可沿着引线主体18定位在其他位置处并且不限于所示出的位置。在其他示例中,引线16可包括比此处所示出的示例更少或更多的起搏/感测电极和/或除颤电极。
在一些示例中,耦合到ICD 14的电极或耦合到另一被配置为获得阻抗测量结果以供确定身体组织或身体区域的阻抗估计值的医疗装置的电极包括至少三个以近似三角形构型所布置的电极(其中之一可以是医疗装置外壳)。如下所述,每个电极可对应于组织或身体区域阻抗的电路模型的一个端子。例如,三个电极可对应于胸腔阻抗的三端子电路模型,其在一些示例中可对应于Y形电路。以此方式,来自多个阻抗测量电极向量中的每个向量的阻抗测量结果可用于将电路模型的阻抗计算为对应身体组织或体腔的阻抗的估计值。在ICD 14耦合到引线16的情况下,引线16和外壳15所承载的两个电极可对应于胸腔阻抗电路模型的三个端子。使用三个阻抗测量结果(使用从引线16和外壳15上的两个电极选择的三个不同测量向量所获得),可将电路模型的各个阻抗元件的组合的等效阻抗计算为胸腔阻抗的估计值,如下文进一步所述。
引线16向内从ICD 14的连接器组件27且朝患者12的躯干中心(例如,朝患者12的剑突20)在皮下或肌肉下遍布于胸廓32。在剑突20附近的位置处,引线16可能弯折或转向,以在向上、皮下或肌肉下遍布于胸廓和/或胸骨,基本上平行于胸骨22。虽然在图1A中示出为与胸骨22横向偏移且基本上平行于该胸骨延伸,但引线16的远侧部分25可在其他位置植入,诸如胸骨22上方、向胸骨22的右侧或左侧偏移、或者从胸骨22朝左侧或右侧横向成角度等。替代地,引线16可沿着其他皮下或肌肉下路径放置。非经静脉的心血管外引线16的路径可取决于ICD 14的位置、引线主体18所承载的电极的布置方式和位置、和/或其他因素。本文公开的技术不限于引线16的特定路径或电极24、26、28和30的最终位置。用于由多个阻抗测量结果(例如,从三个相应阻抗测量电极向量中的每个向量所获得的至少三个阻抗测量结果)的组合来确定胸腔阻抗估计值的技术可针对电极的相对位置进行定制,使得其端子与包括在阻抗测量电极向量中的每个电极相对应的阻抗电路模型代表了贯穿至少一部分胸腔(或其他身体组织或关注区域)的所需阻抗通路。
电导体(未示出)从近侧引线端27处的引线连接器贯穿引线16的细长引线主体18的一个或多个内腔而到达沿引线主体18的远侧部分25定位的电极24、26、28和30。包含在引线主体18内的细长电导体(其可以是引线主体18内的单独的相应的绝缘导体)各自与相应的除颤电极24和26和起搏/感测电极28和30电耦合。经由连接器组件17中的连接件,包括相关联的穿过了外壳15的电馈通件,相应的导体将电极24、26、28和30电耦合至ICD 14的电路,诸如治疗递送电路和/或心脏电信号感测电路。电导体将治疗从ICD 14内的治疗递送电路传输至除颤电极24和26和/或起搏/感测电极28和30中的一个或多个电极,并且将来自患者心脏8的心脏电感测信号从除颤电极24和26和/或起搏/感测电极28和30中的一个或多个电极传输至ICD 14内的感测电路。
为了获得阻抗测量结果,治疗递送电路(或专用阻抗驱动信号电路)可耦合到所选电极向量以供递送驱动信号,该驱动信号可以是电压控制或电流控制的信号。在本文呈现的说明性示例中,驱动信号是电流控制信号,例如0.1ms电流脉冲,作为示例,其电流幅度范围为0.02毫安-0.1毫安。可将整个测量电极向量的所得电压确定为阻抗测量结果,或可基于注入电流和所得电压将其转换成实际阻抗。在其他示例中,驱动信号是电压控制信号,并且可将所得阻抗信号感测为用于生成驱动信号的保持电容器随着其对所选阻抗测量电极向量放电时的电压变化。由于在给定脉冲宽度上的电压变化取决于电流流动,电流流动取决于包括在阻抗测量电极向量中的电极之间的组织阻抗,因此可获得电压变化而作为阻抗测量结果。因此,可获得压控电脉冲结束时的电压(或从压控电脉冲开始到结束时的电压变化)而作为针对给定阻抗电极向量的阻抗测量结果。在其他示例中,可选择单独的驱动信号电极向量和记录电极向量来感测阻抗信号以供监测胸腔阻抗。
引线16的引线主体18可由非导电材料(包括硅树脂、聚氨酯、含氟聚合物、它们的混合物和/或其他适当的材料)形成,并且成形为形成一个或多个内腔,一个或多个导体在这些内腔内延伸。引线主体18可以是管状形状或圆柱形形状。在其他示例中,细长引线主体18的远端部分25(或所有)可具有扁平、带状或桨状形状。引线主体18可形成为具有预成形的远端部分25,该远端部分通常是直的、弯曲的、弯折的、蛇形的、波状的或锯齿形的。
在所示的示例中,引线主体18包括具有两个“C”形曲线的弯曲远侧部分25,这些曲线在一起可类似于希腊字母艾普西隆“ε”。除颤电极24和26各自由引线主体远侧部分25的两个相应C形部分中的一个部分承载。两个C形曲线在远离引线主体18的中心轴线的相同方向上延伸或弯曲,起搏/感测电极28和30沿着该中心轴线定位。在一些情况下,拉直时,起搏/感测电极28和30可以与引线主体18的直的近侧部分的中心轴线大致对齐,使得除颤电极24和26的中点与起搏/感测电极28和30横向偏移。
其他包括一个或多个除颤电极和一个或多个起搏和感测电极的心血管外引线的示例可包括引线主体18的弯曲的、蛇形的、波状的或之字形的远侧部分。然而,本文所公开的技术不限于任何特定的引线主体设计。在其他示例中,引线主体18是不具有任何预成形形状、弯折或弯曲的柔性细长引线主体。
ICD 14分析从一个或多个感测电极向量接收到的心脏电信号,以监测异常节律,诸如心动过缓、室性心动过速(VT)或室性纤维性颤动(VF)。ICD 14可分析所感测的心脏事件信号(例如,伴随心室去极化的R波)的速率和心脏电信号的形态,以根据多种快速性心律失常检测技术中的任一种,监测快速性心律失常。ICD 14响应于使用可选自可用电极24、26、28、30和/或外壳15中的任一者的治疗递送电极向量来检测快速性心律失常(例如,VT或VF)而生成并递送电刺激治疗。ICD 14可响应于VT检测而递送抗心动过速起搏(ATP),且在一些情况下可在CV/DF电击之前或在高电压电容器充电期间递送ATP,以试图避免递送CV/DF电击的需要。如果ATP未成功终止VT或当检测到VF时,ICD 14可经由除颤电极24和26以及/或者外壳15中的一者或两者来递送一个或多个CV/DF电击。ICD 14可单独地或一起使用电极24和26作为阴极(或阳极)且使用外壳15作为阳极(或阴极)来递送CV/DF电击。ICD 14可使用包括电极24、26、28和30中的一个或多个电极和ICD 14的外壳15的起搏电极向量来生成并递送其他类型的电刺激脉冲,诸如电击后起搏脉冲、心搏停止起搏脉冲、CRT或心动过缓起搏脉冲。
ICD 14被示出为沿着胸廓32皮下植入于患者12的左侧。在一些情况下,ICD 14可植入于患者12的左后腋窝线与左前腋窝线之间。然而,ICD 14可植入在患者12中的其他皮下或肌肉下位置处。例如,ICD 14可植入胸肌区域中的皮下袋中。在这种情况下,引线16可从ICD 14朝向胸骨22的柄皮下或肌肉下延伸,并且从柄向下弯折或转向且延伸至皮下或肌肉下的期望位置。在又一示例中,ICD 14可放置在腹部。引线16也可植入在其他心血管外位置中。举例来说,如关于图2A至图2C所描述,引线16的远端部分25可植入胸骨下空间中的胸骨/胸腔下面。
参见图1A,外部装置40被示出为通过通信链路42与ICD 14进行遥测通信。外部装置40可包括处理器52、存储器53、显示单元54、用户界面56和遥测单元58。处理器52控制了外部装置操作并处理从ICD 14接收的数据和信号。处理器52执行存储在存储器53中的指令。处理电路52可包括以下中的任何一个或多个:微处理器、控制器、数字信号处理器(DSP)、专用集成电路(ASIC)、现场可编程门阵列(FPGA)或等效的离散或模拟逻辑电路。在一些示例中,处理器52可包括多个部件(诸如一个或多个微处理器、一个或多个控制器、一个或多个DSP、一个或多个ASIC或一个或多个FPGA的任何组合)以及其他离散或集成逻辑电路。归属于本文的处理器52的功能可以体现为软件、固件、硬件或它们的任何组合。
存储器53可包括任何易失性介质、非易失性介质、磁介质、光学介质或电介质,诸如随机存取存储器(RAM)、只读存储器(ROM)、非易失性RAM(NVRAM)、电可擦除可编程ROM(EEPROM)、闪存或任何其他数字或模拟介质。存储器53可被配置为存储控制参数和相关联的可编程设置,其用于对ICD 14进行编程并且由ICD 14用于控制心脏信号感测、阻抗监测和治疗递送功能。存储器53可以存储由处理器52接收或确定的数据,以用于根据本文公开的技术生成表示胸腔阻抗变化的输出。
可包括图形用户界面的显示单元54向用户显示了数据和其他信息,以供查看ICD操作和编程参数、以及从ICD 14中检索到的心脏电信号和/或阻抗相关数据。如下所述,ICD14的处理器或外部装置处理器52可以由ICD 14所获得的阻抗测量结果来确定胸腔阻抗估计值。可以将胸腔阻抗估计值与用于检测体液状态情况(例如,水肿、脱水或利尿过多)的标准进行比较。外部装置处理器52可生成数据输出以供显示单元54显示,该数据输出可包括随时间推移以及/或者相对于与正常胸液状态相对应的预定阈值或范围的胸腔阻抗估计值或由此导出的体液状态指数的图形表示。以此方式,可以向用户呈现与胸腔阻抗随时间的变化相关的信息,这可包括体液状态情况诸如水肿或利尿过多的检测。外部装置处理器52可接收阻抗测量结果、胸腔阻抗估计值、体液状态情况检测警告或通知、或它们的任何组合,以用于生成输出,例如,用于在显示单元54上显示,呈现与患者体液状态有关的信息。
用户界面56可包括鼠标、触摸屏或小键盘等,以使用户能够与外部装置40交互,以启动与ICD 14的遥测会话,以从ICD 14中检索出数据以及/或者向其传输数据,包括用于控制心脏事件感测和治疗递送以及用于胸腔阻抗监测的可编程参数。临床医生可以使用用户界面56通过外部设备40向ICD 14发送和接收命令。通常,用户界面56包括一个或多个输入装置和一个或多个输出装置,包括显示单元54。用户界面56的输入设备可以包括通信设备,诸如网络接口、键盘、指向设备、语音响应系统、摄像机、生物特征检测/响应系统、按钮、传感器、移动设备、控制板、麦克风、存在敏感屏幕、触敏屏幕(其可以包括在显示单元54中)、网络或任何其他类型的用于检测来自人或机器的输入的设备。
用户界面56的一个或多个输出设备可以包括通信单元,诸如网络接口、显示器、声卡、视频图形适配器卡、扬声器、存在敏感屏幕、一个或多个USB接口、视频和/或音频输出接口或任何其他类型的能够产生触觉、音频、视频或其他输出的设备。显示单元54可以用作使用技术的输入和/或输出装置,包括液晶显示器(LCD)、量子点显示器、点阵显示器、发光二极管(LED)显示器、有机发光二极管(OLED)显示器、阴极射线管显示器、电子墨水,或单色、彩色或任何其他类型的能够生成触觉、音频和/或视觉输出的显示器。在其他示例中,用户界面56可以以另一种方式向用户产生输出,例如经由声卡、视频图形适配器卡、扬声器、存在敏感屏幕、触敏屏幕、一个或多个USB接口、视频和/或音频输出接口、或任何其他类型的能够生成触觉、音频、视频或其他输出的装置。在一些示例中,显示单元54是可用作用户界面设备的存在敏感显示器,该存在敏感显示器作为一个或多个输入设备和一个或多个输出设备运行。
遥测单元58包括收发器和天线,该收发器和天线被配置用于与包括在ICD 14中的遥测电路进行双向通信,并且被配置为结合处理器52来运行,以经由通信链路42来发送并接收与ICD功能相关的数据。可使用诸如
外部装置40可用于对ICD 14所用的心脏信号感测控制参数、阻抗监测控制参数、心律检测参数、和治疗递送控制参数进行编程。外部装置50可包括外部端口55以电连接至表面ECG引线和电极(图1A未示出),该表面ECG引线和电极可耦合至植入有ICD 14的患者。处理器52可接收ECG信号以供显示单元54显示以便用户看到。外部装置40可体现为在医院、诊所或医师办公室中使用的编程器,以从ICD 14中检索出数据并对ICD 14中的操作参数和算法进行编程以控制ICD功能。外部装置40可替代地体现为家庭监测器或手持式装置,其可为平板计算机、蜂窝式电话或其他个人装置。虽然外部装置40仅在图1A中示出为与ICD 14通信,但应当理解,本文公开技术的各部分可以由外部装置来执行,诸如装置40,其被配置为与另一被配置为感测心脏电信号并将其传输至外部装置40的可植入或外部医疗装置通信。外部装置40的各方面可总体上对应于美国专利第5,507,782号(Kieval等人)所公开的外部编程/监测单元。可以被配置为执行在本文公开的技术的示例编程器是可从美国明尼苏达州明尼阿波利斯的Medtronic,Inc.商购获得的
图2A至图2C是以与图1A至图1B所示布置方式不同的植入构型而植入有ICD系统10的患者12的概念图。图2A是植入有ICD系统10的患者12的前视图。图2B是植入有ICD系统10的患者12的侧视图。图2C是植入有ICD系统10的患者12的横向视图。在这一布置中,系统10的引线16在至少部分地植入在患者12的胸骨22下面。引线16从ICD 14朝向剑突20皮下或肌肉下延伸,且在剑突20附近的位置处在胸骨下位置中在前纵隔36内弯折或转向且向上延伸。
前纵隔36可视为由胸膜39横向地界定,由心包38向后界定,并由胸骨22向前界定(参见图2C)。引线16的远端部分25可基本上在前纵隔36的松散结缔组织和/或胸骨下肌肉组织内沿着胸骨22的后侧延伸。植入使得远侧部分25基本上在前纵隔36内或在胸膜腔内或更一般地在胸腔内的引线可称为“胸骨下引线”。
在图2A至图2C所示的示例中,引线16被定位成基本上置中于胸骨22下面。然而,在其他情况下,引线16被植入使得其与胸骨22的中心横向偏移。在一些情况下,引线16可横向延伸,使得除胸骨22之外或代替该胸骨,引线16的远侧部分25在胸腔32下方/下面。在其他示例中,引线16的远端部分25可植入在其他心血管外的胸内位置中,包括胸膜腔或围绕心脏8的心包38的周边且与心脏8的心包38相邻或在心脏8的心包38内。在下文结合图1A至图2C所述的示例中,用于感测心脏电信号且获得阻抗测量结果的电极由引线来承载,该引线可推进到膈上位置,在各种示例中,该膈上位置可处于胸腔内或胸膛外。
图3是根据一个示例的被配置为监测胸腔阻抗的医疗装置的概念图。结合图1A至图2C的ICD 14(包括治疗递送能力)来描述图3。然而,应当理解,在一些示例中,归于结合图3所述的电路的电路和功能性可全部或部分包括在不具有治疗递送能力的心脏监测装置中。图3将ICD外壳15示意性地示出为电极,因为医疗装置的外壳可用作电极,例如,在用于监测胸腔阻抗、感测心脏电信号和/或用于治疗递送的电极向量中。封装在外壳15内的电子电路包括软件、固件和硬件,该软件、固件和硬件协作监测心脏电信号,确定何时需要电刺激治疗,并且根据所编程的治疗递送算法和控制参数,按需递送治疗。根据本文公开的技术,该软件、固件和/或硬件被配置为感测多个阻抗信号并且确定胸腔阻抗估计值,例如以提供心力衰竭监测。
如图3所示,ICD 14包括控制电路80、存储器82、治疗递送电路84、阻抗测量电路85、心脏电信号感测电路86和遥测电路88。电源98按需向ICD 14的电路(包括部件80、82、84、85、86和88中的每个部件)提供电力。电源98可包括一个或多个储能装置,诸如一个或多个可再充电或不可再充电电池。电源98与其他部件80、82、84、85、86和88中的每个部件之间的连接将由图3的总框图中进行理解,但为了清楚起见并未示出。例如,电源98可耦合到在治疗递送电路84中包括的一个或多个充电电路,用于对包括于治疗递送电路84中的保持电容器或其他充电存储设备充电,所述保持电容器或其他充电存储设备在控制电路80的控制下在适当的时间放电,以根据治疗协议产生电脉冲。在其他示例中,电源98可用作通往治疗递送电路84和/或阻抗测量电路85的电压或电流源,而不需要充电存储装置。电源98也按需耦合至心脏电信号感测电路86的部件,诸如感测放大器、模数转换器、开关电路等。电源98提供电力,以将驱动信号递送至所选的阻抗测量电极向量,从而获得阻抗测量结果。
图3所示的电路表示包括在ICD 14和根据本文公开技术而运行的其他医疗装置中的功能性,并且可包括任何离散的和/或集成的电子电路部件,这些部件实现了能够产生归于本文中的ICD 14的功能的模拟和/或数字电路。与一个或多个电路相关联的功能性可通过单独的硬件部件、固件部件或软件部件来执行,或集成在共同的硬件部件、固件部件或软件部件内。
例如,阻抗测量结果可以由专用阻抗测量电路85来执行,该专用阻抗测量电路可包括用于生成由电源98供电的驱动信号并记录来自阻抗测量电极向量的所得阻抗信号的电路。在其他示例中,阻抗测量结果可以由治疗递送电路84和控制电路80来执行,而不需要专用阻抗测量电路85,或者在各种装置配置中,由治疗递送电路84和阻抗测量电路85来协作执行。例如,阻抗测量电路85可生成电流驱动信号并且测量整个阻抗测量电极向量的所得电压。在另一示例中,治疗递送电路84可生成对所选阻抗测量电极向量所递送的电压脉冲,并且阻抗测量电路85(或控制电路80)可以从治疗递送电路84接收与电压脉冲结束时保持电容器上剩余的电压相对应的电压信号。因此,胸腔阻抗估计值的确定可以由治疗递送电路84、阻抗测量电路84和/或控制电路80来协作执行,并且可包括在处理器或其他信号处理电路(包括在控制电路80中)中实现的且执行了存储在存储器82中的指令的操作。
ICD 14的各种电路可包括专用集成电路(ASIC)、电子电路、执行一个或多个软件或固件程序的(共享、专用或组)处理器和存储器、组合逻辑电路、状态机、或提供所述功能性的其他合适部件或部件组合。将主要由医疗装置中采用的特定系统架构以及由医疗装置采用的特定感测和治疗递送方法来确定用于实现本文所公开的功能性的软件、硬件和/或固件的特定形式。鉴于本文的公开内容,提供软件、硬件和/或固件以在任何现代医疗装置的背景下完成所述的功能性在本领域技术人员的能力范围内。
存储器82可包括任何易失性、非易失性、磁性或电非暂态计算机可读存储介质,诸如随机存取存储器(RAM)、只读存储器(ROM)、非易失性RAM(NVRAM)、电可擦除可编程ROM(EEPROM)、闪存存储器或任何其他存储器装置。此外,存储器82可包括存储指令的非暂态计算机可读介质,这些指令在由一个或多个处理电路执行时致使控制电路80和/或其他ICD部件执行属于ICD 14或那些ICD部件的各种功能。存储指令的非暂态计算机可读介质可包括上文所列举的介质中的任一种介质。
控制电路80例如经由数据总线与治疗递送电路84、阻抗测量电路85和感测电路86通信,用于监测胸腔阻抗、感测心脏信号、检测心脏节律以及控制心脏电刺激治疗的递送。治疗递送电路84、阻抗测量电路85和感测电路86电耦合到电极24、26、28、30和外壳15,其可充当公共或接地电极或充当有源罐电极以递送CV/DF电击脉冲或心脏起搏脉冲。如上所述,图3所示的电极24、26、28和30可以由经推进以将电极定位在心脏外位置中的非经静脉引线(如图1A至图2C所示)来承载,或者由用于将电极定位在血管内的经静脉引线来承载。此外,在一些示例中,耦合到ICD 14的电极可包括不由引线来承载的多个基于外壳的电极。
阻抗测量电路85可以从选自可用电极24、26、28、30和外壳15的多个阻抗测量电极向量获得阻抗测量结果。在一个示例中,阻抗测量电路85可包括驱动信号电路和阻抗测量电路,以递送电压或电流控制的驱动信号并且记录来自所选阻抗测量电极向量的所得阻抗信号(例如,所得电流或电压信号)。可以对该阻抗测量电极向量或一个不同的驱动信号电极向量递送驱动信号。在其他示例中,阻抗测量电路85可通过控制治疗递送电路84以递送阻抗测量驱动信号(例如,电压或电流脉冲)来获得阻抗测量结果,并且阻抗测量电路85可同时接收从一个阻抗测量电极向量或多个阻抗测量电极向量所感测的所得阻抗信号。
用于执行阻抗测量并递送治疗性电刺激脉冲的电路可以在阻抗测量电路85与治疗递送电路84之间共享,或者治疗递送电路84可执行阻抗测量电路85所表示的功能性,而不需要单独的专用阻抗测量电路。治疗递送电路84可包括充电电路72、开关74、输出电路76和电极选择切换电路78。充电电路72可包括一个或多个保持电容器,保持电容器由电源98根据编程脉冲幅度充电到一定电压幅度,该编程脉冲幅度可以是治疗性刺激脉冲幅度或者电压控制或电流控制的阻抗驱动信号脉冲幅度。阻抗驱动信号的脉冲幅度可设置为“阈下幅度”,其小于去极化或“捕获”心脏组织所需的捕获阈值,例如,从而引起心肌去极化。以此方式,可以在不引起心脏捕获的情况下获得阻抗测量结果。经由开关74,充电到预定电压的保持电容器可耦合到输出电路76以实现编程脉冲宽度用于递送治疗性刺激脉冲或用于递送阈下阻抗测量驱动信号。
治疗递送电路84的输出电路76可包括电容器,根据从控制电路80所接收的控制信号,经由电极选择切换电路78,该电容器选择性地耦合到电极24、26、28、30和/或外壳15。充电电路72的保持电容器通过输出电路76且通过经由电极选择切换电路78而耦合到输出电路76的电极向量进行放电。电极选择切换电路78可包括开关阵列、开关矩阵、多路复用器、或任何其他类型的适于将所选电极选择性地耦合到输出电路76的切换装置。以此方式,当驱动信号脉冲正被递送以获得阻抗测量结果时,电极选择切换电路78可选择一个阻抗测量电极向量用于耦合到输出电路76。例如在不同的阻抗测量结果时隙期间,可将至少两个测量电极向量或者在一些示例中至少三个阻抗测量电极向量耦合到输出电路76,以获得多个阻抗测量结果用于计算胸腔阻抗估计值。在治疗递送期间,电极选择切换电路78可选择性地耦合从电极24、26、28、30和外壳15中选择的治疗递送电极向量,用于递送心脏起搏脉冲、CV/DF电击脉冲或其他治疗性起搏脉冲。在一些情况下,可以由治疗递送电路84来生成并递送其他电刺激脉冲,例如用于在ICD 14的CV/DF测试期间诱发快速性心律失常。
在一些示例中,当对所选阻抗测量结果向量递送阈下电压或电流脉冲时,在驱动信号脉冲宽度内,对充电至阈下电压的保持电容器进行放电。阻抗测量电路85(或控制电路80)可以在驱动信号脉冲宽度末端处的电压控制线上接收电压信号。保持电容器在驱动信号脉冲递送期间的电压变化对应于所选阻抗测量电极向量的阻抗。电压或终止电压的变化可以由阻抗测量电路85作为阻抗测量结果而获得,或者可以由阻抗测量电路85转换成以欧姆为单位的绝对阻抗测量结果。
在其他示例中,可提供专用阻抗测量电路85,其与用于治疗递送的治疗递送电路84分离或共享一些部件。阻抗测量电路85可传递对所选阻抗测量电极向量所施加的已知驱动信号(电流或电压),并且所得的电压或电流信号可以由阻抗测量电路进行感测并传递到控制电路80。例如,电压信号可被感测为“阻抗”信号或者由控制电路80使用已知驱动电流和所得电压信号转换成阻抗值或信号。在一些示例中,可以对阻抗测量电极向量施加驱动信号,该阻抗测量电极向量也用作记录电极向量以测量阻抗。在其他示例中,可以对驱动电极对施加驱动信号,并且可以由一个记录电极对或者多个记录电极对来同时感测所得的阻抗信号。阻抗测量电路85可以将驱动信号作为一串脉冲来递送,使得可将该阻抗确定为针对每个脉冲所测的平均阻抗值。在该串脉冲期间,阻抗测量电路85可以对来自多个阻抗测量电极向量的阻抗测量结果进行排序,以在该串脉冲结束时,为多个阻抗测量电极向量中的每个向量提供平均阻抗测量结果。任何用于确定所选电极向量之间的电阻抗的技术可以与本文公开的技术结合使用,以从多个阻抗测量电极向量获得阻抗测量结果而用于确定胸腔阻抗估计值以监测患者的体液状态。
控制电路80接收阻抗测量结果,以及通过使用多个阻抗测量结果确定胸腔阻抗电路模型的阻抗来确定胸腔阻抗估计值。如下文各种示例所述,控制电路80的处理器81可以确定表示胸腔阻抗的三端子阻抗电路模型的等效阻抗。例如,通过使用从阻抗测量电路85所接收的三个阻抗测量结果来求解电路模型的三个未知阻抗元件,处理器81可以计算电路模型的阻抗,其中三个阻抗测量结果中的每个测量结果对应于电路模型的未知阻抗元件的串联和/或并联组合。三个阻抗测量电极向量所包括的三个电极均可对应于三端子电路模型的端子,使得这些阻抗测量结果中的每个测量结果对应于电路模型的各个阻抗元件的某一组合。在一些示例中,由阻抗测量电路85来获得至少三个阻抗测量结果,并且使用三个阻抗测量结果,根据胸腔阻抗的三端子Y形电路模型来确定等效阻抗,如下所述。
心脏电信号感测电路86(在本文中也称为“感测电路”86)可选择性地耦合至电极28、30和/或外壳15,以便感测患者心脏的电活动。感测电路86可另外选择性地耦合至除颤电极24和/或26,用于与电极28、30和/或外壳15中的一者或多者一起或组合地在感测电极向量中使用。在一些示例中,经由预滤器/放大器92,感测电路86可启用以选择性地从选自可用电极24、26、28、30和外壳15的一个或多个感测电极向量接收心脏电信号。感测电路86可监测一个或多个心脏电信号,用于感测心脏事件以及/或者产生数字化心脏电信号而传递到控制电路80用于处理与分析以及/或者用于经由遥测电路88进一步传输到外部装置40。举例来说,感测电路86可包括开关电路,该开关电路用于选择电极24、26、28、30和外壳15中的哪一个耦合到感测电路86的一个或多个感测通道。
感测电路86可包括模数转换器94、整流器/放大器95和心脏事件检测器96,其被配置为将从预滤器/放大器92接收的心脏电信号进行放大、过滤、整流与数字化、或以其他方式进行处理,以提高用于感测心脏电事件的信号质量,诸如伴随心室肌去极化的R波或伴随心房心肌去极化的P波。心脏事件检测器96可包括一个或多个感测放大器、阈值检测器、比较器、峰值检测器、计时器、或其他被配置为感测心脏事件(例如,伴随心室去极化的R波或伴随心房去极化的P波)的模拟或数字部件。所感测的心脏事件可对应于固有的去极化心脏组织(没有递送电起搏脉冲)。
感测电路86可以在每个心动周期内控制自动调整心脏事件感测阈值的幅度。响应于心脏电信号超出感测阈值,心脏事件检测器96可感测到心脏事件。感测电路86可产生心脏感测事件信号,例如,响应于P波感测阈值超出的心房感测事件信号或响应于R波感测阈值超出的心室感测事件信号。心脏感测事件信号被传递到控制电路80。感测电路86可使用各种感测阈值控制参数来设置并调整每个心动周期期间的心脏事件感测阈值。这些感测阈值控制参数可存储在存储器82中并且从控制电路80传递到感测电路86,以供控制电路80和/或感测电路86的硬件、固件和/或软件用于控制心脏事件感测阈值的幅度。
控制电路80从感测电路86接收心脏感测事件信号,以通过计时电路90来确定感测事件间隔,例如,RR间隔(RRI)和/或PP间隔(PPI)。RRI是连续感测的R波之间的时间间隔,且可在由控制电路80从感测电路86接收到的连续R波感测事件信号之间确定。PPI是连续感测的P波之间的时间间隔,且可由控制电路80在从感测电路86接收到的连续R波感测事件信号之间确定。取决于所编程的治疗,计时电路90可触发治疗递送电路84,以:响应于所感测的事件信号,生成并递送电刺激脉冲;以及/或者响应于所感测的事件信号,启动起搏逸搏间隔计时器,以及响应于所感测的下一事件信号,重启逸搏间隔计时器。下一个感测事件信号时的逃逸间隔计时器的值可以缓存在存储器82中,作为相关联感测事件信号的感测事件间隔。以此方式,存储器82可以存储一系列心脏感测事件间隔,用于确定感测心脏事件发生率。
例如,计时电路90可包括由控制电路80的微处理器设置的可编程数字计数器,用于控制与ICD 14所递送的各种起搏模式或ATP序列相关联的基本起搏时间间隔。控制电路80的微处理器还可设置可基于存储在存储器82中的所编程值的心脏起搏脉冲的振幅、脉冲宽度、极性或其他特性。
计时电路90可包括各种计时器和/或计数器,该各种计时器和/或计数器用于通过治疗递送电路84控制治疗递送的计时。响应于逃逸间隔计时器的期满而未接收到心脏感测事件信号,控制电路80可以控制治疗递送电路84,以生成并递送起搏脉冲。计时电路90可另外设计时间窗口诸如形态模板窗口、形态分析窗口,或进行ICD 14的其他计时相关功能,包括使治疗递送电路84所递送的CV/DF电击或其他治疗与所感测的心脏事件同步。
控制电路80可被配置为分析从感测电路86所接收的信号,以检测快速性心律失常。控制电路80可基于感测电路86所感测的心脏事件满足快速性心律失常检测标准来检测快速性心律失常,诸如发生了落在快速性心律失常间隔范围内的感测事件间隔的感测心脏事件的阈值数量。控制电路80可在控制电路80中实现为硬件、软件和/或固件,该硬件、软件和/或固件处理并分析从感测电路86所接收的信号,以检测快速性心律失常,例如室上性心动过速(SVT)、VT和/或VF。控制电路80可包括比较器和计数器,该比较器和计数器用于对计时电路90所确定的心脏事件间隔(例如,PPI或RRI)进行计数,该心脏事件间隔落入各种发生率检测区中,用于确定心房率和/或心室率或者执行心脏感测事件信号的其他基于发生率或间隔的评估,从而检测并区分出快速性心律失常。
例如,控制电路80可将计时电路90所确定的RRI与一个或多个快速性心律失常检测间隔区(诸如,心动过速检测间隔区和纤维性颤动检测间隔区)进行比较。落入检测间隔区中的RRI由相应的VT间隔计数器或VF间隔计数器来计数,并且在一些情况下,处于所组合的VT/VF间隔计数器中。为了检测VT或VF,需要相应的VT或VF间隔计数器达到阈限“检测间隔数”或“NID”。检测VT或VF所需的NID可被编程为Y个连续RRI中的X个VT/VF间隔的阈值数。当VT或VF间隔计数器达到NID时,控制电路80可检测到心室快速性心律失常。VT或VF间隔可连续或非连续地从指定数量的最近RRI中检测到。在一些情况下,组合VT/VF间隔计数器可对VT间隔和VF间隔两者进行计数,并且基于达到指定NID时检测到的最快间隔来检测快速性心律失常发作。
控制电路80可被配置为执行其他信号分析,以确定在检测VT或VF之前是否满足其他检测标准,诸如R波形态标准和起始标准。为了支持另外的心脏信号分析,感测电路86可将数字化心脏电信号例如心电图(ECG)信号传递到控制电路80,以供处理器81执行形态分析,从而检测并区分出心脏节律。来自所选感测电极向量的心脏电信号可穿过滤波器和放大器,提供给多路复用器,并其后由感测电路86的ADC 94转换成多位数字信号。控制电路80可以是基于微处理器的控制器,该控制器采用数字信号分析技术来表征从感测电路86所接收的且存储在存储器82中的数字化信号,以采用用于分析心脏电信号和心脏事件波形(例如,R波)的多种信号处理方法中的任一方法来识别患者心律并将其分类。
响应于检测VT或VF,控制电路80可安排治疗并控制治疗递送电路84,以生成和递送治疗,诸如ATP和/或CV/DF治疗。治疗递送电路84由控制电路80控制以生成并递送治疗性电刺激脉冲,例如心脏起搏脉冲和/或CV/DF脉冲。治疗可通过发起对充电电路72中包括的高压电容器进行充电来生成。在一些示例中,被配置为递送CV/DF电击脉冲的高压治疗电路可由控制电路80来控制,以递送起搏脉冲,例如,用于递送ATP、电击后起搏脉冲或心室起搏脉冲。在其他示例中,治疗递送电路84可包括低电压治疗电路,该低电压治疗电路包括低电压保持电容器并且用于生成并递送针对多种起搏需要的起搏脉冲。低电压保持电容器可用于生成电压幅度小于心脏组织捕获阈值的低电压脉冲,以用于获得阻抗阈值测量结果。
应当认识到,本文所公开的用于获得阻抗测量结果并确定胸腔阻抗估计值的方法可实现于以下项中:医疗装置,用于监测心脏情况而不一定具有治疗递送能力;或起搏器,其监测心脏电信号并且通过治疗递送电路84例如CRT来递送心脏起搏治疗而不具有高电压治疗能力,诸如CV/DF电击能力。
由控制电路80用于感测心脏事件并控制治疗递送的控制参数可经由遥测电路88编程至存储器82中。遥测电路88包括收发器和天线,该收发器和天线用于使用如上所述的RF通信或其他通信协议与外部设备40(在图1A中示出)通信。在控制电路80的控制下,遥测电路88可从外部设备40接收下行链路遥测并且向该外部设备发送上行链路遥测。遥测电路88可将阻抗测量结果传输到另一医疗装置(例如,外部装置40),以根据本文所公开的技术进行处理与分析。在其他示例中,控制电路80可被配置为执行如本文所公开的一些或全部阻抗测量结果和胸腔阻抗估计值分析,并且可以将分析所得数据传输到外部装置40。在一些示例中,遥测电路88被配置为传输所检测到的体液状态情况(例如,检测到水肿或检测到利尿过多或脱水)的警报或通知。警报或通知可显示给患者或临床医生。在一些示例中,另一医疗装置可接收所传输的警报或通知,并且例如通过调整心脏起搏治疗诸如CRT、迷走神经刺激、药物诸如利尿剂或另一治疗的递送,调整由接收该传输的医疗装置所递送的治疗,以减轻所检测的体液状态情况。
图4是根据一个示例的可以由ICD 14执行以监测胸腔阻抗的方法的流程图100。为了方便起见,流程图100和本文呈现的其他流程图被描述为由控制电路80与阻抗测量电路85和/或治疗递送电路84来协作执行。然而,应当理解,阻抗测量电路85和/或治疗递送电路84所获得的阻抗测量结果的处理和分析可以由外部处理器或计算机(例如,外部装置处理器52或者控制电路80和外部装置处理器52的组合)来执行。
在框102处,阻抗测量电路85由多个阻抗测量电极向量中的每个向量来执行一次阻抗测量。阻抗测量结果被传递到控制电路80。在框102处,可获得至少两个不同的阻抗测量结果。在本文呈现的说明性示例中,控制电路80从阻抗测量电路85接收至少三个阻抗测量结果,以计算胸腔阻抗估计值。在一些情况下,各个阻抗测量结果可包括遍及整个胸腔或仅涉及一部分胸腔的阻抗测量结果。然而,在框104处,将阻抗测量结果的组合用于确定胸腔阻抗电路模型的阻抗,该阻抗表示通过或穿过胸腔的阻抗通路,并且因此与肺部、心脏和其他组织中的体液负相关。
如下所述,至少一个阻抗测量结果以及在一些示例中每个阻抗测量结果对应于胸腔阻抗电路模型的两个或多个单独阻抗元件的串联和/或并联组合。阻抗测量结果的数量可对应于电路模型的各个阻抗元件的数量,使得使用已知的阻抗测量结果,可求解出电路模型的相等数量的未知各个阻抗元件。在一些示例中,在框104处,可将电路模型的单独元件的阻抗计算为胸腔阻抗估计值。在其他示例中,由控制电路80将电路模型的等效阻抗(例如,表示虚拟阻抗元件的网络)计算为胸腔阻抗估计值。
在框106处,控制电路80确定胸腔阻抗估计值是否满足体液情况检测标准。如下文进一步所述,可以将胸腔阻抗估计值与阻抗阈值或范围进行比较。当胸腔阻抗估计值超出阻抗阈值或落在正常范围之外时,可检测到体液状态情况。例如,当胸腔阻抗估计值小于上限阻抗阈值时,可检测到水肿。当胸腔阻抗估计值大于上限阻抗阈值时,可检测到利尿过多或脱水病症。在其他示例中,可结合先前的胸腔阻抗估计值来分析胸腔阻抗估计值,以检测胸腔阻抗估计值满足体液情况检测标准的趋势或趋势变化。例如,胸腔阻抗估计值可用于基于多个连续的胸腔阻抗估计值来确定体液状态指数。可以由控制电路80将体液状态指数与体液情况检测标准进行比较,以检测体液情况,如下文结合图12和图13所述。
当在框106处,满足对胸腔阻抗估计值适用的体液情况检测标准时,在框108处,控制电路80检测到病症例如胸腔水肿或利尿过多或脱水。响应于检测到体液情况,在框110处,控制电路80可生成输出,该输出可包括存储在存储器82中的输出,该输出随后用于由遥测电路88来传输体液情况检测通知以及/或者调整由治疗递送电路84所递送的治疗。
图5A是根据一个示例的阻抗测量电极向量通路206、208和210以及整个胸部组织202所需的胸部阻抗通路204的概念图200。电极224和226可由引线承载,诸如图1所示的非经静脉引线16,其可定位在皮下、肌肉下或胸骨下。然而,电极224和226不需要由相同的引线主体来承载,并且可以由两个不同的引线来承载,这两个引线耦合到根据本文公开的技术来执行胸腔阻抗监测的医疗装置。电极224和226可对应于如图1A所示的除颤线圈电极24和26,但不一定是线圈电极。电极224和226可以是线圈电极、环形电极、尖端电极、或其他类型的电极、或它们的任何组合。
阻抗测量电路85可被配置为从选自电极224和226以及医疗装置外壳(有时称为“罐”电极)215的三个不同阻抗测量电极向量获得至少三个阻抗测量结果,该医疗装置外壳可对应于图1A的ICD外壳15。在其他示例中,代替或除了外壳(“罐”)215,另一电极可被包括在三个阻抗测量电极向量中,以提供除了或替代图5A所示的通路206、208和210中的任一通路,至少三个不同的阻抗测量向量通路。
阻抗测量电路85可获得如通路206所表示的电极224与电极226之间的阻抗测量结果。如上所述,在一些示例中,阻抗测量结果可涉及:治疗递送电路84,在一些示例中,用于对所选阻抗测量电极向量生成电压或电流脉冲:和阻抗测量电路85,用于接收与电极224与电极226之间的组织阻抗相关的电压(或电流)信号。阻抗测量电路85可获得如阻抗测量向量通路208所表示的电极224与外壳215之间的第二阻抗测量结果。第三阻抗测量结果可以由电极224与电极226和外壳215的组合之间的阻抗测量电路85获得,如阻抗测量向量通路210的两个分支所表示。在其他示例中,第三阻抗测量结果可处于电极226与外壳215之间或电极224、226和外壳215的任何其他组合之间。
胸腔阻抗通路204可表示所需的胸腔阻抗通路,其可建模为如图5B所示的三端子阻抗电路模型230。如下所述,由于电极226和224的组织封装或其他因素,胸腔阻抗通路204可能无法用作可选择阻抗测量电极向量,或者可能在阈下电流或电压驱动信号期间,形成不可靠的阻抗测量结果。这样,可以将可用的阻抗测量电极向量通路206、208和210用于获得阻抗测量结果,这些阻抗测量结果可用于根据表示了阻抗通路204的电路模型来计算胸腔阻抗通路204的估计阻抗。
图5B是表示所需胸腔阻抗通路204的三端子阻抗电路模型230的图示201。电极226、224和外壳215均可对应于阻抗电路模型230的三个相应端子。该示例中的阻抗电路模型230包括三个单独的阻抗元件R
继续参考图5A和图5B,沿通路206的第一阻抗测量结果(Z
方程1:Z
沿通路208的第二阻抗测量结果(Z
方程2:Z
沿阻抗测量向量通路210的第三阻抗测量结果(Z
方程3:Z
通过测量三个阻抗,例如Z
如三端子电路模型230所表示的所需经胸腔阻抗通路210对应于单独阻抗元件R
方程4:Z
通过重新整理上述方程1-3以求解R
方程5:Z
图5B的图示201是阻抗电路模型的一个示例,该阻抗电路模型可被建立为在限定数量的端子之间延伸的多个单独阻抗的网络,其中每个端子对应于可用于阻抗测量电极向量中的电极(或医疗装置外壳)。阻抗测量电极向量中的至少一个向量对应于电路模型的未知单独阻抗元件的串联和/或并联组合,使得所测的阻抗可用于将胸腔阻抗估计值计算为电路模型的阻抗,其可以是电路模型的单独阻抗元件或者单独阻抗元件的全部或子集的等效阻抗或者单独和/或等效阻抗两者的组合。在其他示例中,可使用与如图5A所示的上述示例不同的阻抗测量结果的组合来获得指定数量的已知阻抗测量结果,该指定数量的已知阻抗测量结果可用于求解胸腔阻抗的阻抗电路模型中的沿所需阻抗通路的相同数量的未知阻抗元件。可由阻抗测量电路85获得两个、三个、四个或多个阻抗测量结果(每个阻抗测量结果对应于电路模型的阻抗元件的不同组合)并将其传递到控制模块80以基于电路模型来计算胸腔阻抗估计值。电路模型230所表示的胸腔阻抗通路204是可以估计的所需胸腔阻抗的一个示例。
图5A和图5B所示的示例在确定与通路204相对应的等效胸腔阻抗方面是有用的,该等效胸腔阻抗被选择为近似于由定位在病人体内的经静脉引线所承载的电极与皮下植入的ICD外壳之间的胸腔阻抗测量结果。然而,应当理解,可将不同的阻抗通路定义为与阻抗电路模型端子相对应的电极之间的所需胸腔阻抗通路,并且可将其他不同于图5B所示的电路模型230的电路模型定义为用于基于电路模型和所测阻抗来求解胸腔阻抗估计值。例如,可将胸腔或另一身体组织或体腔中的阻抗电路模型定义为具有从中心节点开始延伸的多个阻抗元件的星形电路,诸如本文所述的“Y”电路、“X”电路、或具有中心节点和多个末端的其他多分支星形电路,其中阻抗元件处于每个末端与中心节点之间。在其他示例中,电路模型可为回路或网状电路,其在连续回路中的末端处具有多个端对端接合的电路元件,诸如三角形、正方形或六边形电路模型等。在一些示例中,电路模型可包括星形电路和网状电路的组合。可将基于所选电路模型的组织阻抗通路定义为电路模型的多个阻抗元件的任何串联和/或并联组合。在一些示例中,组织阻抗可以由电路模型的单个阻抗元件来限定,该单个阻抗元件不能从可用电极直接进行测量,但是可基于所测阻抗和电路模型来计算。电路模型阻抗元件的阻抗可基于类似数量的所测阻抗来求解,每个所测阻抗表示一种阻抗元件组合,使得可计算出电路模型的所选通路的阻抗。所关注的阻抗通路可贯穿任何所关注的组织平面或体积。
图6是根据一个示例的沿着所需胸腔阻抗通路所测的阻抗以及使用本文公开的技术所计算且与所需阻抗通路相对应的胸腔阻抗估计值的曲线图250。图5A所示的胸腔阻抗通路204可对应于从除颤电极24和26到ICD外壳15(如图1A所示)的高电压CV/DF电击治疗通路。ICD 14可将电连接在一起的除颤线圈电极24和26用为与外壳15配对的单个电极来递送CV/DF电击。当ICD 14被植入患者体内时,可诱发VT或VF用于递送测试CV/DF电击,以验证除颤阈值在可接受的限值之内并实现CV/DF电击递送参数的编程,该编程将促进:在检测到之后,成功终止自发的VT/VF发作。在除颤阈值测试期间,可获得高电压阻抗测量结果。因此,图5A所示的胸腔阻抗通路204可对应于HV电击通路。在高电压CV/DF电击的递送期间,可测量HV电击通路204的阻抗。
图6包括在植入后0天(HV阻抗260)和植入后120天(HV阻抗262)的20焦耳电击(大于除颤阈值能量)期间沿着与图5A的胸腔阻抗通路204相对应的HV电击阻抗通路所测的该高电压(HV)阻抗254的曲线图。在第0天,HV阻抗260被测量为56欧姆,并且在第120天,HV阻抗262被测量为67欧姆。
图6也包括在电压或电流脉冲驱动信号递送期间沿着与胸腔阻抗通路204(从作为单个电极电连接在一起的线圈电极24和26到外壳15)相对应的HV电击与阻抗通路所测的阈下阻抗252的曲线图,该电压或电流脉冲驱动信号的脉冲能量小于除颤阈值能量并且小于起搏捕获阈值。比如,可注入持续时间大约为0.1毫秒且幅度为0.02毫安至0.1毫安的驱动信号脉冲,以获得阈下阻抗测量结果。该阈下阻抗252在第0天被测量为64欧姆(阻抗264)并且在第120天被测量为94欧姆(阻抗266)。
注意,在HV电击递送期间沿阻抗通路204所测的第120天HV阻抗262比在低电压(阈下)驱动信号递送期间沿相同阻抗通路204所测的第120天阈下阻抗266低得多。非经静脉电极24和26的组织封装可能导致在低电压驱动信号期间比在高电压电击递送期间相对更高的阻抗测量结果。结果,由于非经静脉电极24和26的组织封装,响应于相对低的电压驱动信号而沿着图5A所示的阻抗通路204所测的阻抗可能偏高。这种由于组织封装引起的阻抗增加可能是一个使用非经静脉电极来监测胸腔阻抗以检测体液状态情况(例如,水肿或脱水)的混杂因素。由于患者的疼痛或不适以及对电源98的高电流需求,沿通路204递送高压驱动信号用于测量阻抗并不切实际。然而,当施加了阈下驱动信号后,与放置在血流中的引线封装相比,非经静脉引线的更大组织封装可能导致沿所需胸腔阻抗通路所测的阻抗的更高的测量结果。本文所公开的技术提供了一种方法,用于由低电压(阈下)阻抗测量结果的组合并根据表示所需胸腔阻抗通路的阻抗电路模型,沿所需阻抗通路,确定可靠且更准确的胸腔阻抗估计值。胸腔阻抗估计值可提供更具临床意义的胸腔阻抗估计值,以用于监测胸腔水肿和胸燥的变化。
图6所图示的胸腔阻抗估计值Z
图7是根据一个示例的使用经静脉引线所获得的胸腔阻抗测量结果的概念图300(在图A中)和使用由非经静脉引线16所获得的阻抗测量结果来确定胸腔阻抗估计值的阻抗电路模型230的概念图350(在图B中)。在图示300中,经静脉引线316被示出为从ICD外壳315开始延伸,以将引线316所承载的除颤线圈电极320定位在患者心脏的右室(RV)内。心内除颤线圈电极320与ICD外壳315之间的阻抗测量结果通过阻抗测量向量通路322来表示,该通路可遍布胸腔的心脏和肺部。从线圈电极320到外壳315的阻抗测量结果可用于确定跟踪了胸腔阻抗随时间变化的体液状态指数。使用来自经静脉引线的阻抗测量结果所确定的体液状态指数的一个示例可在以下项中获得:OptiVol
在图示350中,在一些示例中,三端子阻抗电路模型230可被应用于使用三个阻抗测量结果来确定胸腔阻抗估计值,该三个阻抗测量结果使用电极24和26以及ICD外壳15来获得。胸腔阻抗估计值Z
虽然定位在RV中的线圈电极320的某种封装可能发生于植入了引线316之后的急性阶段,但是植入在心脏和血管外的电极24、26、28和30的封装可以在更大程度上以及/或者在更长植入后阶段中发生。结果,与使用经静脉或心内电极所测的阻抗相比,在经静脉外ICD系统中,使用非经静脉引线(诸如引线16)所承载的电极而测量的阻抗可增加到更大的程度以及/或者在相对更长的植入后阶段内增加,从而在如上文结合图6所述的阈下驱动信号的注入期间,潜在地使阻抗测量结果更加偏高。本文所公开的用于根据胸腔阻抗的多端子电路模型来确定胸腔阻抗估计值的技术可至少部分地代偿心血管外电极随时间而变化的更大封装的影响,并且当经静脉的心内电极可用时,提供与可用胸腔阻抗测量通路322更密切相关的胸腔阻抗估计值。如图示300所示,使用电路模型230所估计的胸腔阻抗可能更接近地表示使用心内电极或经静脉电极(诸如心内电极322到外壳315)所获得的胸腔阻抗测量结果。图A所表示且使用心内电极的这类胸腔阻抗测量结果对于临床医生来说可能更公知或更熟悉。因此,根据本文公开的技术,使用电路模型和来自非经静脉电极的阻抗测量结果所确定的胸腔阻抗估计值随着时间的推移而在幅度上可能更类似于可使用心内电极所获得的阻抗测量结果,并且可能更准确地表示患者正常的水肿状态或脱水状态。
图8是根据一个示例的使用胸腔阻抗电路模型随时间的推移而确定的所测阻抗402、404和406以及所计算的阻抗估计值408和410的曲线图400。沿y轴并且在沿曲线图400的x轴所绘的时间(自植入了引线起,以天为单位,该引线携带了用于测量阻抗的电极)内,绘制了绝对阻抗值(以欧姆为单位)。在该示例中,Z
控制电路80可被配置为控制阻抗测量电路85,以按一天中的一个或多个预计时间和/或预计时间间隔来执行阻抗测量。在一个示例中,可将阻抗测量时间安排成每晚发生,例如,在午夜与上午6:00之间。在其他示例中,阻抗测量电路85可在一天中的一个或多个可编程时间(例如,早上3:00、早上9:00、下午3:00和/或下午9:00(作为说明性非限制性示例))获得阻抗测量结果,其中每个阻抗测量结果存储于存储器82中。可对一天中的多个预计时间所获取的阻抗测量结果进行平均,以获得每日平均值,或者在不进行平均的情况下,用于在一天中的多个预计时间获得胸腔阻抗估计值。
在其他示例中,阻抗测量结果可以在按所需采样间隔(例如,每20分钟、每30分钟、每小时、每天、或其他采样间隔)获得时进行存储并且存储在存储器82中而不进行平均。在还有其他示例中,可使用与一天间隔不同的平均间隔。例如,可对每X分钟由控制电路80接收的阻抗测量结果进行平均,以获得每小时阻抗测量结果平均值、每四小时平均值、每八小时平均值、每十二小时平均值,或者在更长间隔内进行平均,诸如作为示例,每48小时平均值、每72小时平均值或每周平均值。针对各个患者,例如基于患者心力衰竭病症(或心力衰竭类)的严重性或当处方药物剂量发生改变时,可定制由给定阻抗测量电极向量来确定一系列阻抗测量结果的平均值的频率。
所绘的胸腔阻抗估计值Z
所计算的阻抗估计值R
方程6:R
所测阻抗402、404和406往往具有绝对阻抗值,该绝对阻抗值相对很高,并且随着非经静脉引线16所承载的电极由于身体正常的异物反应而被纤维组织所封装,在大约前30天内急剧增加。包括了三端子电路模型230中的R
被确定为电路模型230的等效阻抗的胸腔阻抗估计值Z
治疗心力衰竭患者的临床医生可能习惯于观察所测的胸腔阻抗(例如,使用经静脉心内电极)和/或基于所测胸腔阻抗的相关体液状态指数,所测胸腔阻抗对应于Z
图9是根据另一示例的随时间推移所绘的所测阻抗422、424和426以及所确定的胸腔阻抗估计值428和430的曲线图420。沿y轴并且在沿曲线图420的x轴所绘的时间(自植入起,以天为单位)内,绘制了绝对阻抗值(以欧姆为单位)。如上所述,在该示例中,Z
所绘的Z
所绘的胸腔阻抗估计值R
所测阻抗422、424和426往往具有绝对阻抗值,该绝对阻抗值相对很高,并且随着非经静脉引线16所承载的电极被纤维组织所封装,在大约前30天内急剧增加。如上所述,包括了三端子电路模型230中的R
图10是根据一个示例的图5B所示的电路模型230的所计算的各个阻抗R
例如,上文给出的方程组1-3可使用三个所测阻抗Z
图11是根据一个示例的用于监测胸腔阻抗的方法的流程图600。为了方便起见,将结合图11以及本文给出的其他图示和流程图所述的阻抗测量结果进行的处理与分析描述为由ICD控制电路80来执行。然而,应当理解,由可植入医疗装置(例如,ICD 14)所获得的阻抗测量结果可存储在存储器82中并传输到另一装置以进行处理与分析,例如传输到图1A的外部装置40以供处理器52进行处理与分析。
在框601处,控制电路80可建立基线胸腔阻抗。基线胸腔阻抗可存储在存储器82中。基线胸腔阻抗可以是例如基于临床数据的预定参考值或正常胸腔阻抗范围。在其他示例中,可例如通过确定胸腔阻抗估计值的长期平均值来确定针对给定患者的基线胸腔阻抗,其中根据如上所述的阻抗电路模型,由所测的阻抗来计算每个胸腔阻抗估计值。比如,可将长期平均值确定为在固定的或移动的长期平均窗口内(例如,在一周、两周、一个月或其他所选时段内)确定的每日计算的胸腔阻抗估计值的平均值。
在其他示例中,可将基线胸腔阻抗最初设置为等于:在ICD植入或其他患者随访时,于测试CV/DF电击递送期间所测的HV阻抗,例如,如上文结合图6所述。当胸腔阻抗估计值被计算为三端子电路模型230的等效阻抗Z
由于所测阻抗可能由于电极的组织封装而在初始愈合阶段增加,因此在一些示例中,可在始于ICD(和电极)植入后的延时之后的时段内,建立基线胸腔阻抗。替代地,在植入后延时之后,可使用至少一个移动平均窗口来建立基线胸腔阻抗。例如,用于建立基线胸腔阻抗的阻抗测量结果可以在植入后几天之时或之内开始,并且持续至少14天、至少28天、至少35天或其他所选的植入后愈合期。
在框602处,控制电路80控制了阻抗测量电路85(和/或治疗递送电路86),以根据阻抗监测协议,获得多个阻抗测量结果。在框602处,可以从最少两个阻抗测量电极向量中的每个向量获得阻抗测量结果,但在其他示例中,从至少三个不同的阻抗测量电极向量获得阻抗测量结果。在一些示例中,可获得多于三个阻抗测量结果,例如多达六个-八个阻抗测量结果。阻抗测量电极向量的数量(以及在预计时间点获得的阻抗测量结果的对应数量)可对应于所需胸腔阻抗通路的阻抗电路模型的端子或各个阻抗元件的数量。
阻抗测量结果由控制电路80接收并且可存储在存储器82中。在一些示例中,从给定阻抗测量电极向量获得的多个连续阻抗测量结果可存储在存储器82中并且进行平均,以获得针对指定时段的每个阻抗测量电极向量的平均时间阻抗测量结果,例如每日平均值。阻抗测量结果可以在一天中的预计时间内按预计时间间隔进行,例如,在四小时-八小时的时间段内或在五小时的时段内每20分钟进行一次,并且进行平均,以获得针对每个阻抗测量电极向量的每日平均阻抗测量结果。
在框604处,控制电路80可使用阻抗测量结果来计算胸腔阻抗估计值。确定胸腔阻抗估计值可包括:首先从存储在存储器82中的各个阻抗测量结果来确定平均时间阻抗测量结果,例如平均每日阻抗测量结果。然后,可以由平均每日阻抗测量结果来计算每日胸腔阻抗估计值。替代地,每当获得阻抗测量结果时,可根据存储在存储器82中的各个阻抗测量结果来确定胸腔阻抗估计值。然后,可通过对所存储的胸腔阻抗估计值进行平均,来确定平均时间胸腔阻抗估计值,例如每日估计值。控制电路80可以将胸腔阻抗估计值计算为如上所述的胸腔阻抗电路模型的等效阻抗。在其他示例中,可使用方程组来求解电路模型的一个或多个单独阻抗元件以确定胸腔阻抗估计值。在上文给出的说明性示例中,例如,如图5A和图5B所示,在框604处,可将胸腔阻抗估计值计算为R
在框608处,控制电路80可以确定胸腔阻抗估计值是否在预定基线阻抗范围内。在一些示例中,可将低阻抗阈值定义为用于检测胸腔水肿。另外或替代地,可将高阻抗阈值定义为用于检测利尿过多或脱水。因此,阈值范围可以由控制电路80基于在框601处建立的基线胸腔阻抗来确定。阈值范围定义了针对患者的“正常”胸腔阻抗范围。阈值范围可以以基线阻抗为中心。然而,在一些示例中,与低阻抗阈值相比,可将高阻抗阈值设置为相对于基线胸腔阻抗更大的绝对差,或者反之亦然。
当控制电路80确定胸腔阻抗估计值在基线胸腔阻抗的预定范围内时,控制电路80可返回到框602以继续获得阻抗测量结果并确定下一个胸腔阻抗估计值。控制电路80可以确定患者体液状态无关紧要或处于患者的正常范围内。在一些情况下,例如当基线胸腔阻抗被确定为胸腔阻抗估计值的长期有效平均值时,在框614处,控制电路80可使用当前胸腔阻抗估计值来更新基线胸腔阻抗。
当胸腔阻抗估计值满足体液情况检测标准时,例如,通过在框608处,处于基线胸腔阻抗的正常范围之外,在框610处,控制电路80可检测体液情况,例如,水肿或脱水。响应于检测到体液状态情况,在框612处,控制电路80可生成输出。例如,当胸腔阻抗估计值高于高阻抗阈值时,在框612处,控制电路80可生成输出,该输出包括将存储器82中的胸腔阻抗估计值标记为脱水或利尿过多。当胸腔阻抗估计值低于低阻抗阈值时,在框612处,控制电路80可生成输出,该输出包括将存储器82中的胸腔阻抗估计值标记为水肿。在一些示例中,在框612处,控制电路80可控制遥测电路88,以传输如存储器82中所标记的可保证得到医疗救治的体液状态情况通知。在一些示例中,在阈值数量的连续或非连续(例如,Y中的X个)胸腔阻抗估计值始终大于高阻抗阈值或始终小于低阻抗阈值之后,在框612处,可生成输出或可传输通知,从而满足体液情况检测标准,指示有关的体液状态情况。
框612处生成的输出可包括传输存储在存储器82中的阻抗测量结果和/或胸腔阻抗估计值,以使外部装置40能够接收阻抗数据并生成阻抗测量结果、胸腔阻抗估计值和/或由此导出的数据的显示。例如,可由外部装置处理器52来生成随时间推移而图示的且相对于阈值或阈值范围所示的每日胸腔阻抗估计值的显示,以供在显示单元54上显示,该显示单元可为图形用户界面的一部分。
在框610处检测到体液状态并在框612处生成输出之后,控制电路80可返回到框602以继续获得阻抗测量结果。在框614处,控制电路80可使用最近的胸腔阻抗估计值来更新基线胸腔阻抗,例如,通过更新长期有效的平均胸腔阻抗估计值。虽然图11未明确示出,但应当理解,在框610处检测到体液状态情况之后,控制电路80可确定何时不再满足体液情况标准,例如,何时至少一个或一定阈值数量的连续胸腔阻抗估计值落入基线胸腔阻抗的正常范围内。当体液情况标准不再满足或者所检测的体液状态情况被确定为得到解决或改善时,控制电路80可生成输出。比如,可由遥测电路88传输指示正常体液状态的通知。可以在存储器82中标记返回无关紧要的体液状态,使得可由控制电路88确定水肿状态或脱水状态或利尿过多状态的持续时间并上报给例如外部装置40。
图12是根据另一示例的用于监测患者体液状态的方法的流程图700。如上文结合图11所述,在框702处,控制电路80可(例如)使用上文所述技术中的任一技术来建立基线阻抗。在框704处,胸腔阻抗监测可始于:根据预定时间表或监测协议,阻抗测量电路85从多个阻抗测量电极向量中的每个向量获得阻抗测量结果。在框706处,使用上述示例性技术中的任一技术,根据所需胸腔阻抗通路的阻抗电路模型,控制电路80由阻抗测量结果来确定胸腔阻抗估计值。
代替将胸腔阻抗估计值与阻抗阈值或范围进行比较,例如,如结合图11所述,在框708处,控制电路80可以由胸腔阻抗估计值来确定体液状态指数。在框710处,可以将体液状态指数与用于检测体液情况(例如,用于检测水肿或利尿过多或脱水)的标准进行比较。在框708处,基于胸腔阻抗估计值以及在框702处建立的基线胸腔阻抗(其可以随时间推移而更新),控制电路80可确定体液状态指数。由于胸腔阻抗与胸液含量负相关,因此可以确定与胸液含量直接相关的体液指数,使得体液状态指数分别随着胸液含量的增减而增减。以此方式,患者、临床医生或护理者可以更直观地解释基于体液指数的观察来识别体液情况。
在一些示例中,体液状态指数可以由控制电路80确定为当前胸腔阻抗估计值(或相对短期平均胸腔阻抗估计值)与基线胸腔阻抗(其可以是长期平均胸腔阻抗估计值)之差的累积和。随着水肿发展,发生胸腔阻抗的降低,从而导致基线胸腔阻抗与当前胸腔阻抗估计值之差增加。控制电路80可以从基线胸腔阻抗中减去当前胸腔阻抗估计值。随着水肿恶化,差是越来越大的正差。在一些示例中,可将单个差确定为体液状态指数。在其他示例中,可对连续确定的差求和。当连续差的总和达到大于水肿阈值的正值时,在框710处,可满足用于检测水肿的体液情况标准。在框712处,响应于体液状态指数超出正常体液状态指数范围的上限阈值,可检测到水肿。在一些示例中,当每日胸腔阻抗估计值等于或大于基线阻抗(或处于正常范围之内)时,控制电路80可以将体液状态指数重置为零并且重新开始对当前胸腔阻抗估计值与基线胸腔阻抗之间所连续确定的差进行求和。
随着水肿的改善,胸腔阻抗朝基线胸腔阻抗增加,从而导致基线胸腔阻抗与当前胸腔阻抗估计值之差降低。当连续差的总和随着水肿消退而降低时,在框710处,控制电路80可以确定不再满足体液情况标准。例如,当一个差或者连续差的总和小于用于检测水肿的阈值时,控制电路80可以确定:患者的体液状态已经改善,或者不再检测到水肿。在框714处,可以检测到正常的体液状态。应用于体液状态指数以初始检测水肿的阈值可不同于在框710处应用的阈值,以确定不再检测到水肿,从而避免控制电路80频繁地重新检测到单次水肿发作。在一些示例中,当控制电路80确定每日胸腔阻抗估计值等于或大于基线阻抗(或处于正常范围之内)时,控制电路80可以将体液状态指数重置为零。在框714处,可以检测到正常的体液状态。控制电路80可重新开始对当前胸腔阻抗估计值与基线胸腔阻抗之间所连续确定的差求和。
在一些情况下,可指导患者增加利尿剂剂量或采取其他行动以改善水肿病症。在其他情况下,患者可能因其他原因而过度用药或脱水。在脱水或利尿过多的患者中,当从基线胸腔阻抗减去当前胸腔阻抗估计值时,胸腔阻抗增加,从而导致负差。当连续负差被控制电路80求和时,在框708处确定的体液状态指数可能变得小于负阈值。在此情况下,基于体液状态负指数,可满足用于检测到脱水或利尿过多的体液状态情况标准。当体液状态指数超出限定体液状态指数的正常范围的阈值时,在框712处,检测到体液状态情况。在检测到脱水或利尿过多病症之后,当被确定为体液状态指数的负差再次增加到正常体液状态阈值下限值时,在框714处,控制电路80可检测到正常体液状态。在其他示例中,当单个胸腔阻抗估计值处于正常基线范围之内时,可将体液状态指数重置为零,并且正常体液状态可由控制电路80在框714处检测到。
在其他示例中,在框708处确定的体液状态指数可以是基线胸腔阻抗与当前所确定的胸腔阻抗估计值之差,并且该差可存储在存储器82中,例如作为每日体液状态指数。每日体液状态指数可存储在缓存中,例如,按先进先出的基础。当所存储的差的阈值数量具有相同的符号(正或负)并且每个都大于所存储的体液情况阈值差时,在框712处,可以由控制电路80检测到体液情况。
在框716处,响应于所检测的体液状态情况,控制电路80可生成输出。输出可包括存储在存储器82中的状态标记和/或与所检测的情况相关的数据,包括最近的阻抗测量结果、胸腔阻抗估计值和/或体液状态指数。响应于所生成的输出,遥测电路88可传输所检测的体液状态情况的通知。所传输的通知可以由外部装置40接收以用于生成体液状态数据的显示。所传输的通知可另外或替代地由另一能够响应于该通知来调整治疗的医疗装置所接收。当ICD 14被配置为递送CRT或用于治疗心力衰竭的其他治疗时,治疗递送电路84可通过调整治疗来响应在框716处生成的体液情况检测输出。
在一些示例中,响应于在框714处检测到正常体液状态,控制电路80可前进到框716,特别是当在检测到体液情况之后首次检测到正常体液状态时。例如通过生成存储在存储器中的标记和/或随后由遥测电路88传输的通知,控制电路80可生成指示正常体液状态的输出。在一些示例中,通过调整所递送的治疗,例如通过调整CRT,治疗递送电路84可以响应所生成的输出。在生成与所检测的体液状态相对应的输出之后,控制电路80可返回框718以更新基线胸腔阻抗并且继续监测胸腔阻抗。
图13是根据另一示例的一种可由ICD 14执行而用于监测胸腔阻抗以供体液状态情况检测的方法的流程图800。在框802处,阻抗测量电路85例如从如上所述的至少三个阻抗测量电极获得多个阻抗测量结果。在框804处,控制电路80通过如下方式来确定胸腔阻抗估计值:使用根据上述任何技术的多个阻抗测量结果,确定所需胸腔阻抗通路的阻抗电路模型的等效阻抗或单独阻抗元件。
在框806处,控制电路80确定自植入了用于获得阻抗测量结果的电极起的天数(例如,自植入了ICD引线16起的天数)是否已经达到或超过阈值天数。阈值天数可设置在21天与60天之间、或在一些示例中约30天-35天,并且表示外科植入之后的急性愈合阶段,在此期间,引线16所承载的电极由于异物反应而被组织封装。例如将引线16连接到ICD 14之后,控制电路80可启动日计数器以跟踪自植入起的天数。
在框806处,当自植入起的天数小于阈值时,在框810处,控制电路80可确定体液状态指数以用于检测体液状态情况。可将体液状态指数确定为当前胸腔阻抗估计值与基线胸腔阻抗之差的移动、累积和,如上文结合图12所述。在框812处,控制电路80可以将体液状态指数与正常体液状态指数范围进行比较。当体液状态指数是大于正常范围上限值的正值时,在框814处,可检测到水肿,并且在框816处,可生成对应的输出。当体液状态指数是小于正常范围下限值的负值时,在框814处,可检测到脱水或利尿过多,并且在框816处,生成对应的输出,例如随着经由遥测电路88传输了患者或临床医生警报或通知。如上所述,处于正常基线胸腔阻抗范围内的单个胸腔阻抗估计值可以使控制电路80将体液状态指数重置为零。
在框812处,当体液状态指数处于正常范围之内时,控制电路80可返回框802以根据在存储器82中编程的胸腔阻抗监测协议,继续获取阻抗测量结果。当体液状态指数处于正常范围之内时,体液状态指数和/或对应的胸腔阻抗估计值和/或阻抗测量结果可存储在存储器82中。在一些示例中,当体液状态指数处于正常范围之内时,可以不生成通知或警报。然而,应当理解,在其他示例中,当已经检测到体液状态情况并且已经响应于所检测的体液状态情况而传输了通知或警报或者生成了其他输出时,控制电路80可响应于随后的体液状态指数落入框812处的正常范围之内而传输不再检测到体液状态情况的通知。
在框806处,当控制电路80确定自引线16植入起的天数已经达到或超过阈值天数时,在框808处,控制电路80可以将胸腔阻抗估计值直接与用于检测体液情况的标准进行比较。例如,在框808处,可以将胸腔阻抗估计值直接与正常阻抗范围进行比较。在初始愈合阶段之后,当阻抗随着电极被封装而上升时,基于当前阻抗估计值与基线胸腔阻抗之差的体液状态指数的确定过程可以是任选的。通过分析胸腔阻抗估计值的短期和长期趋势,体液状态指数可以说明阻抗在愈合阶段的升高。然而,在初始愈合阶段之后,胸腔阻抗估计值可能相对稳定,除非体液状态情况实际上存在或正在发展,诸如水肿或利尿过多。此时,控制电路80可以将胸腔阻抗估计值直接与框808处的体液情况检测标准进行比较,而无需由胸腔阻抗估计值来确定体液状态指数。
例如,在框808处,当胸腔阻抗估计值处于正常范围之内时,这可基于所建立的基线胸腔阻抗估计值),控制电路80可返回到框802以继续获取阻抗测量结果并且更新胸腔阻抗估计值而无需检测体液状态。然而,在框808处,当胸腔阻抗估计值处于正常阻抗范围之外时,在框814处,控制电路80可检测体液状态情况,并且在框816处,生成对应的输出。在一些示例中,为了在框808处满足体液情况检测标准,可要求阈值数量的最近胸腔阻抗估计值处于正常阻抗范围之外。根据如本文所公开的阻抗电路模型且由多个阻抗测量结果所确定的胸腔阻抗估计值的值预期提供了与胸液含量负相关的度量,并且在一些示例中,可用于直接与正常阻抗范围进行比较以检测体液状态情况。
在框816处,响应于检测到体液状态情况,控制电路80可生成输出,该输出可对应于对检测到上述体液状态情况的响应中的任一响应。此外,如上所述,处于正常范围之外后,当胸腔阻抗估计值返回正常范围时,或者更一般地,当在检测到体液情况之后如框808处所确定的不再满足体液情况检测标准时,控制电路80可响应于体液状态返回到正常状态而生成输出。
图14是一种用于选择阻抗电路模型和/或电路模型的阻抗元件以使用阻抗测量结果来计算所关注的整个组织或身体区域的阻抗的方法的图示900。在上文呈现的说明性示例中,可将电路模型预定义为例如图7所示的三端子Y形电路模型,并且可将由电路模型所确定的阻抗预定义为该模型的阻抗元件之一或者该模型的阻抗元件中的两个或多个元件的组合的等效阻抗。然而,在其他示例中,用于估计整个身体组织或身体区域的阻抗的电路模型和/或电路模型的阻抗元件可以由用户来选择。
根据一个示例,图9的图示900可表示外部装置显示单元54(图1A所示)所显示的图形用户界面。窗口902可显示所植入的引线/电极系统的近似电极位置的图像。电极E1、E2、E3和E4可对应于引线16(图1A所示)所承载的电极24、26、28和30的近似位置,并且外壳15的近似位置由窗口902中的CAN电极示出。在一些示例中,临床医生可以选择将窗口902中显示的电极中的哪些电极用作电路模型中的端子。临床医生可能能够添加、移除或调整在窗口902中显示的电极的位置,以指示可用作阻抗电路模型中的端子的电极以及它们在患者解剖结构内相对于彼此的相应位置。在其他示例中,可用于进行阻抗测量并定义显示在窗口902中的电路模型端子的电极和近似位置可根据正在植入的医疗装置和引线来预定义,例如根据医疗装置型号等来限定。
在相同(例如,叠加的)窗口或不同窗口中,显示单元54可基于窗口902所示或所选的可用电极来生成可用电路模型的显示。例如,除颤电极24和26(在窗口902中标记为E1和E2)连同外壳15(标记为CAN)可以是默认的阻抗测量电极。在所示的说明性示例中,这些阻抗测量电极被示为电路模型选择窗口910中的Y形电路模型914、三角形电路模型916和所组合的Y形电路模型与三角形电路模型912的三个端子。基于电极和外壳的解剖位置,临床医生可以选择哪个电路模型、Y形和三角形电路模型912的组合、Y形电路模型914或三角形电路模型916,以及/或者临床医生可选择将所选电路模型的哪些阻抗元件(任何子集或所有阻抗元件)组合用于确定组织阻抗,在该示例中为胸腔阻抗,如窗口920所示。
在图14的说明性示例中,临床医生可选择Y形和三角形电路模型912的组合并选择与阻抗元件R
在所示的说明性示例中,如果临床医生选择窗口920中所示的阻抗通路,则控制电路80可使用Y形电路模型(914)来求解阻抗元件R
临床医生可使用外部装置40来编程所选电极和/或位置、所选电路模型、以及/或者与所选电路模型相对应的所选阻抗元件(或阻抗通路),以例如通过与显示单元54所生成的窗口902、910和920交互,来表示整个组织或身体区域的阻抗而用于体液状态监测。控制电路80可被配置为经由遥测电路88来接收例如作为以下项而传输的用户编程信息:与电极选择、电路模型选择和/或阻抗元件选择相关或指示电极选择、电路模型选择和/或阻抗元件选择的用户选择信号。例如以可执行指令的形式,存储器82可存储必要的方程而用于计算不同电路模型阻抗元件的阻抗以及/或者每个可用电路模型选择的可用阻抗元件组合。
响应于用户编程选择,控制电路80可选择求解所选电路模型(或电路模型组合)的阻抗元件所需的适当阻抗测量结果,并且控制阻抗测量电路85根据监测协议按需获取阻抗测量结果。控制电路80可选择存储在存储器82中的适当方程和算法,用于由对应阻抗测量结果,计算由所选电路模型的阻抗元件而表示的所选阻抗通路的阻抗。在图14所示的示例中,窗口920所示的所选胸腔阻抗可由控制电路80使用所测阻抗、电路模型912的所选组合、以及可存储在存储器82中用于根据本文所公开的技术来监测患者体液状态的对应方程来计算。
图15是可以由外部装置的显示单元来显示的用户界面的另一示例的图示950,该用户界面用于使用户能够选择由医疗装置用于计算组织阻抗的阻抗测量电极、阻抗电路模型和/或电路模型阻抗元件中的一项或多项。在该示例中,电极E1、E2、E3和E4以及CAN被示出在窗口952中的不同解剖位置处。如上所述,基于正在植入的医疗装置和相关联的引线/电极,根据默认数量和默认位置,可以显示电极的数量和位置。在其他示例中,临床医生可以选择每个可用阻抗测量电极的近似位置。在该示例中,将三个电极E2、E3和E4以及CAN选为该电路模型的阻抗测量电极和端子,这可以是一个默认项或用户选择。
在该示例中,将具有四个端子的可用电路模型在窗口960中示为星形电路模型964、网状电路模型966、以及星形电路模型加网状电路模型962的组合。给定电路模型(或电路模型的组合)的阻抗元件可以是一次可选择的一个、两个、三个或四个元件,或者根据预定义的可选择阻抗元件组合能够选为胸腔阻抗选择。在所示的示例中,电路模型的用户选择对应于星形电路模型964,并且胸腔阻抗由与R
在各种示例中,电路模型可以是基于用户在窗口952中所做的阻抗测量电极选择的默认模型,电路模型可能是能够由用户在窗口960中基于窗口952中的阻抗测量电极的默认数量和位置而选择的,或者电路模型(或模型的组合)和阻抗测量电极数量和/或位置都可能是能够通过用户与用户界面交互而选择的,用户界面例如包括窗口952和960,其可以例如以叠加方式分开或一起显示。
窗口970中的胸腔阻抗选择(或取决于电极位置和临床应用场景的其他组织阻抗选择)可以是基于用户对电极和/或电路模型的选择的默认选择。在其他示例中,用户可选择定义了表示所需阻抗通路的胸腔阻抗选择的电路模型阻抗元件,这可基于用户所选的或默认的电极数量和/或电极位置和/或用户所选的或默认的电路模型。如上所述,存储器82可被配置为存储计算每个可选胸腔阻抗(被选为一个或多个电路模型阻抗元件的组合)所需的方程和算法。控制电路80和阻抗测量电路85可被配置为选择性地获得对应的用于计算以下项所需的阻抗测量结果:电路模型阻抗元件以及由电路模型阻抗元件中的一个元件或一个组合所表示的胸腔阻抗通路。
控制电路80可被配置为从外部装置40接收用户选择,并且结合存储器82和阻抗测量电路85运行以获得适当的阻抗测量结果并根据用于监测体液情况的电路模型来计算所需的胸腔阻抗。应认识到,由于存储器存储容量、处理要求、阻抗测量电路85所执行的可用阻抗测量或其他因素,并非所有可能的电路模型和/或所有可能的阻抗元件或它们组合都可能能够由用户从给定数量的阻抗测量电极和对应位置中进行选择。然而,至少在一些示例中,用户可具有选择阻抗测量电极、电路模型和/或电路模型的阻抗元件中的一项或多项的灵活性,该一项或多项表示了正被监测的整个组织或身体区域的所需阻抗通路,同时理解这些选择可处于以下约束条件内:医疗装置能够执行的阻抗测量;以及/或者可存储在存储器82中且与不同电路模型相关联的方程和算法的数量。
应当理解,取决于示例,本文所述的方法中的任一方法的某些动作或事件可按不同顺序来执行,可进行添加、合并或完全省略(例如,并非所有所述动作或事件对于实践该方法来说都是必须的)。此外,在某些示例中,动作或事件可以同时执行,例如,通过多线处理、中断处理或多个处理器,而不是顺序地执行。另外,出于清楚的目的,虽然本公开的某些方面被描述为由单个电路或单元来执行,但是应当理解,本公开的技术可由与例如医疗设备相关联的单元或电路的组合来执行。
在一个或多个示例中,所描述的功能可在硬件、软件、固件或它们的任何组合中实施。如果在软件中实施,则功能可作为一个或多个指令或代码存储在计算机可读介质上并且由基于硬件的处理单元执行。计算机可读介质可包括计算机可读存储介质,其对应于有形介质,诸如数据存储介质(例如,RAM、ROM、EEPROM、闪存存储器或可用于存储指令或数据结构形式的期望程序代码并且可由计算机访问的任何其他介质)。
指令可由一个或多个处理器执行,诸如一个或多个数字信号处理器(DSP)、通用微处理器、专用集成电路(ASIC)、现场可编程逻辑阵列(FPLA)或其他等效的集成或离散逻辑电路。因此,如本文所用的术语“处理器”可指代任何前述结构或适于实施本文所描述的技术的任何其他结构。另外,本技术可在一个或多个电路或逻辑元件中完全实施。
因此,已经参考具体示例,在前述描述中呈现了医疗装置系统。应当理解,本文公开的各个方面可以与附图中呈现的具体组合不同的组合进行组合。应当理解,在不脱离本公开和以下权利要求书的范围的情况下,可以对参考示例进行各种修改。
- 动力电池绝缘阻抗在线监测装置及方法
- 基于压电阻抗原理的覆冰监测装置及方法
- 用于识别自然语言的医疗文本中的医疗实体的方法和装置
- 用于将医疗装置附接到对象的装置和方法
- 用于影音作品的广告监测方法及监测装置
- 用于电阻抗监测的微流控装置及检测细胞电阻抗的方法
- 用于监测医疗过程的系统和方法与用于监测医疗设备的系统
