细胞药用冻存管及其制造方法和细胞药用注射针
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及细胞药物生产及应用技术领域,涉及细胞药用冻存管及其制造方法和细胞药用注射针。
背景技术
细胞药不同于传统化学药及大分子药物,细胞药物被称为“活的药物”,是以活的细胞发挥药物治疗作用,因此细胞要在生产工艺上及临床应用上更加复杂,要求更高。因此,尽管细胞药发展快速,但在细胞药品化开发及生产应用过程中同样面临巨大的挑战,细胞治疗产品药品化生产标志着细胞产品生产方式的巨大转变,细胞产品的生产与质量控制体系需要根据GMP药品法规进行改革,针对生产过程中的关键因素,人、机、物、法、料、环的管控以及各个制备生产阶段,都需要按照药品化需求进行适应性转化。物料是细胞药生产的关键要素之一,与研发、生产技术工艺及细胞药应用的安全性、有效性及简便性密切相关,同时也是细胞药上市申报的重点审查内容之一。
细胞药用冻存管是细胞药关键物料耗材之一,其使用贯穿整个生物药生产及应用过程,包含种子细胞冻存、解冻复苏及最终产品复苏应用,是细胞药研发及生产企业常用耗材。细胞是活的药物,在冻存必须添加冷冻保护剂,而冻存保护剂又是高渗溶液,带有毒性,在复苏解冻后需要立即稀释或者去除,否则将导致细胞失活死亡,影响继续培养及临床应用效果。目前细胞药领域所使用的冻存管沿用科研所使用的冻存管,在结构设计及材质上均无法有效满足细胞药生产及应用要求。现有技术中,冻存管存在封闭性差,无法预置复苏稀释液,在细胞解冻后无法对细胞进行快捷、无菌稀释的问题;而且,必须转移至洁净环境中进行细胞处理操作(尤其是对于药品化生产,为了保证无菌操作,所有物料均需灭菌后再转移至洁净条件下进行处理,采用最快速的过氧化氢灭菌方式,单灭菌步骤需10分钟以上),不但操作复杂,耗时长,而且处理过程中冻存液的毒性会严重影响细胞活性及功能。
发明内容
本发明的目的在于,提供一种细胞药用冻存管及其制造方法和细胞药用注射针,既满足药品化包装需求又满足细胞药工艺及应用特性,能够简化细胞药生产及应用工艺的操作步骤,提高生产效率以及细胞药应用的安全性及有效性。
为解决上述技术问题,第一方面,本发明提供一种细胞药用冻存管,所述细胞药用冻存管包括:封堵器、冻存管、底盖、第一弹性塞体第二弹性塞体和活塞杆;
所述冻存管为两端开口内部中空的管状结构,所述封堵器设置于所述冻存管的上端并与所述冻存管密封连接,所述底盖设置于所述冻存管的下端进行密封;
所述第一弹性塞体和所述第二弹性塞体均设置于所述冻存管内并与所述冻存管的管壁紧密贴合,能够沿着所述冻存管的管壁滑动,所述第一弹性塞体与所述封堵器以及所述冻存管的管壁共同形成一密闭的悬液腔,所述悬液腔用于存放细胞悬液,所述第一弹性塞体与所述第二弹性塞体之间形成密闭的稀释液腔,所述稀释液腔用于存放稀释液;
所述活塞杆的其中一端穿过所述底盖进入于所述冻存管中并推动所述第二弹性塞体移动,对所述活塞杆施加轴向力时,所述稀释液腔在压力作用下向所述悬液腔方向移动,并推动所述第一弹性塞体沿着所述冻存管的轴向移动;
所述冻存管的管壁上开设有用于连通所述悬液腔和所述稀释液腔的第一流体通道,当所述第一弹性塞体移动到所述第一流体通道所在位置时,所述稀释液腔通过所述第一流体通道与所述悬液腔相互连通;或者
所述冻存管的管壁上开设有用于容纳所述第一弹性塞体进行弹性恢复的环形凹槽,所述第一弹性塞体具有上下贯通的第二流体通道,所述第二流体通道在所述第一弹性塞体弹性恢复时打开,所述稀释液腔通过所述第二流体通道与所述悬液腔相互连通。
优选地,在所述细胞药用冻存管的中,所述第一流体通道中起点与终点的连线长度略大于所述第一弹性塞体的厚度。
优选地,在所述细胞药用冻存管的中,所述第一流体通道包括若干个开设于所述冻存管上的条形凹槽,所述条形凹槽的开槽宽度上大下小。
优选地,在所述细胞药用冻存管的中,所述环形凹槽的开槽宽度与所述第一弹性塞体的厚度相适配,所述环形凹槽的深度范围根据所述第一弹性塞体的线性膨胀系数设置。
优选地,在所述细胞药用冻存管的中,所述第一弹性塞体的侧壁为粗糙表面,所述第一弹性塞体沿着所述冻存管的轴向移动时,所述粗糙表面与所述冻存管的管壁内侧进行滑动摩擦;
优选地,在所述细胞药用冻存管的中,所述冻存管的管壁内侧设置有微粒结构,所述微粒结构与所述第一弹性塞体的粗糙表面配合,以限定所述第一弹性塞体的位置。
优选地,在所述细胞药用冻存管的中,还包括:识别编码,所述识别编码设置于所述封堵器、所述冻存管、所述底盖中的任意位置,所述识别编码为RFID芯片、条码、二维码、数字码中的任意一种或其任意组合。
优选地,在所述细胞药用冻存管的中,所述封堵器包括转接头,所述转接头的下端与所述冻存管固定连接,所述转接头的上端设置有针头连接结构。
第二方面,本发明还提供一种细胞药用注射针,所述细胞药用注射针包括:
如上所述的细胞药用冻存管;
针头,通过所述转接头上的针头连接结构与所述细胞药用冻存管固定连接。
第三方面,本发明还提供一种细胞药用冻存管的制造方法,所述细胞药用冻存管的制造方法包括:
通过两次熔融工艺制备冻存管的管体,以在所述冻存管的管壁上形成至少一个条形凹槽;
将第一弹性塞体插入于所述冻存管的管体内,使其与所述冻存管的管壁紧密贴合;
从所述冻存管的其中一端注入细胞悬液,并将封堵器安装于所述冻存管上,所述封堵器与第一弹性塞体以及所述冻存管的管壁共同形成一密闭的悬液腔;
从所述冻存管的另一端注入稀释液,并将第二弹性塞体插入于所述冻存管的管体内,使其与所述冻存管的管壁紧密贴合,所述第一弹性塞体与所述第二弹性塞体之间形成一密闭的稀释液腔;以及
依次安装底盖和活塞杆。
第四方面,本发明还提供一种细胞药用冻存管的制造方法,所述细胞药用冻存管的制造方法包括:
通过熔融工艺制备冻存管的管体,以在所述冻存管的管壁上形成用于容纳所述第一弹性塞体进行弹性恢复的环形凹槽;
将第一弹性塞体插入于所述冻存管的管体内,使其与冻存管的管壁紧密贴合,所述第一弹性塞体具有上下贯通的第二流体通道,所述第二流体通道仅在所述第一弹性塞体弹性恢复时打开;
从所述冻存管的其中一端注入细胞悬液,并将封堵器安装于所述冻存管上,所述封堵器与第一弹性塞体以及所述冻存管的管壁共同形成一密闭的悬液腔;
从所述冻存管的另一端注入稀释液,并将第二弹性塞体插入于所述冻存管的管体内,使其与冻存管的管壁紧密贴合,所述第一弹性塞体与所述第二弹性塞体之间形成一密闭的稀释液腔;以及
依次安装底盖和活塞杆。
相比于现有技术,本发明至少具有以下有益效果:
通过第一弹性塞体、第二弹性塞体将冻存管本身分成稀释液腔和悬液腔,完美地隔离出细胞悬液和稀释液的封闭腔体,并在冻存管的管壁或者第一弹性塞体上设计流体通道,让稀释液腔与悬液腔在特定条件下相互连通,由此细胞悬液和稀释液可直接在冻存管内部进行无菌混合。
附图说明
图1为本发明实施例一的细胞药用冻存管的结构示意图;
图2为本发明实施例一的冻存管的部分结构示意图;
图3为图2的半剖结构示意图;
图4为本发明实施例一的冻存管与活塞杆配合的结构示意图;
图5为图4的半剖结构示意图;
图6为本发明实施例一的底盖的结构示意图;
图7为本发明实施例一的细胞药用冻存管的局部半剖结构示意图;
图8为本发明实施例二的环形凹槽的结构示意图。
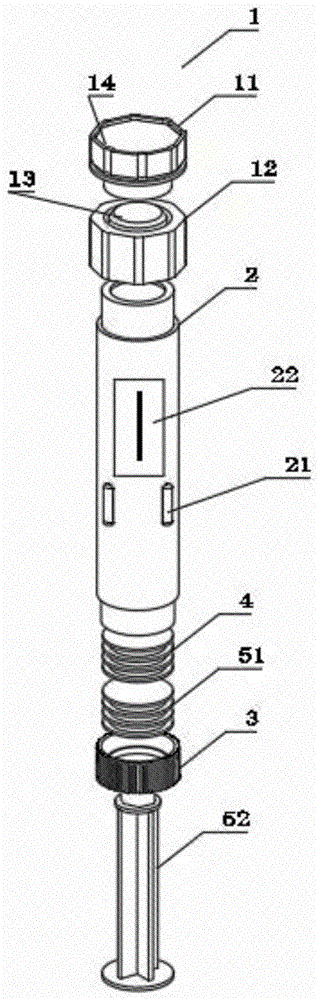
注:1封堵器;11封堵头;12转接头;13针头连接结构;14第三弹性塞体;2冻存管;21条形凹槽;22识别编码;23悬液腔;24稀释液腔;25环形凹槽;3底盖;31主体;32密封件;33活塞杆口;4第一弹性塞体;51第二弹性塞体;52活塞杆。
具体实施方式
下面将结合示意图对本发明进行更详细的描述,其中表示了本发明的优选实施例,应该理解本领域技术人员可以修改在此描述的本发明,而仍然实现本发明的有利效果。因此,下列描述应当被理解为对于本领域技术人员的广泛知道,而并不作为对本发明的限制。
在下列段落中参照附图以举例方式更具体地描述本发明。根据下面说明和权利要求书,本发明的优点和特征将更清楚。需说明的是,附图均采用非常简化的形式且均使用非精准的比例,仅用以方便、明晰地辅助说明本发明实施例的目的。
【实施例一】
请参考图1,其为本发明实施例一的细胞药用冻存管的结构示意图。如图1所示,一种细胞药用冻存管,包括:封堵器1、冻存管2、底盖3第一弹性塞体4、第二弹性塞体51和活塞杆52;冻存管2为两端开口内部中空的管状结构,封堵器1设置于冻存管的上端并与冻存管2密封连接,底盖3设置在冻存管2的下端进行密封;第一弹性塞体4和第二弹性塞体51均设置于冻存管2内并与冻存管2的管壁紧密贴合,能够沿着冻存管2的管壁滑动,第一弹性塞体4与封堵器1以及冻存管2的管壁共同形成一密闭的悬液腔23,悬液腔23用于存放细胞悬液第一弹性塞体4与第二弹性塞体51之间形成密闭的稀释液腔24,稀释液腔24用于存放稀释液;活塞杆52穿过底盖3进入于冻存管2中并推动第二弹性塞体51移动,对活塞杆52施加轴向力时,稀释液腔24在压力作用下向悬液腔23方向移动,并推动第一弹性塞体4沿着冻存管2的轴向移动;冻存管2的管壁上开设有用于连通稀释液腔和悬液腔的第一流体通道,当稀释液腔24移动到第一流体通道所在位置时,稀释液腔通过第一流体通道与悬液腔相互连通。
具体的,所述稀释液腔24的内部可预置复苏稀释液,所述悬液腔23的内部可预置细胞悬液。复苏稀释液由平衡盐溶液临床用乳酸钠或复方氯化钠溶液、碳酸氢钠或等渗盐水溶液、研究生产用DPBS杜氏磷酸缓冲液、HBSS汉克斯平衡盐溶液、人血白蛋白、氨基酸、糖类等一种或多种试剂配制而成。
具体的,所述冻存管2可根据用药群体的需求进行不同规格的设计,根据实际的细胞药存储量需要,可设置不同规格装量,如1mL、2mL、5mL、10mL、25mL、50mL、100mL等,以覆盖各种规格的细胞药冻存需要。
具体的,第一弹性塞体4和第二弹性塞体51保持一定间距并均以压缩(即发生弹性形变)的状态与冻存管2的内壁紧密贴合,由此在所述冻存管2内分别形成稀释液腔24和悬液腔23。推动所述第二弹性塞体51时,稀释液腔24在压力作用下向悬液腔23方向移动,同时推动所述第一弹性塞体4同向移动,即所述悬液腔23和所述稀释液腔24均可沿着冻存管2的轴向移动。
本实施例中,所述冻存管2的管壁上设置有第一流体通道,所述第一流体通道的长度根据所述第一弹性塞体4的厚度设置。通常的,所述第一流体通道中起点与终点的连线长度略大于所述第一弹性塞体4的厚度。如此,当所述第一弹性塞体4移动到所述第一流体通道所在位置时,所述稀释液腔24通过所述第一流体通道与所述悬液腔23相互连通,流体能够从所述第一流体通道的起点顺利流向终点,所述第一弹性塞体4不会阻塞流体流动。
在一些实施例中,第一流体通道包括若干个开设于所述冻存管2上的条形凹槽21。
本实施例中,所述条形凹槽21为直条行结构,所述条形凹槽21的长度方向与冻存管2轴向平行,所述条形凹槽21的长度(即第一流体通道中起点和终点的连线距离)略大于所述第一弹性塞体4的厚度,所述条形凹槽21的宽度和深度根据实际需要进行设置,能够让稀释液和细胞悬液顺利通过即可。
如图3所示,当所述第一弹性塞体4移动到所述第一流体通道(即条形凹槽21)所在位置时,稀释液腔24内的稀释液在第一弹性塞体4的阻挡下,只能通过冻存管2管壁内侧开设的条形凹槽21进入悬液腔23。相应的,悬液腔23内的细胞悬液在第一弹性塞体4的阻挡下,只能通过条形凹槽21进入稀释液腔24。
优选的,若干个所述条形凹槽21均匀排布于所述冻存管2的管壁内侧,且若干个所述条形凹槽21的开口方向均朝向所述冻存管2的中心轴线。
优选的,所述条形凹槽21的开口尺寸(即开槽宽度)上大下小。如此,可确保开始阶段的药液混合相对比较缓慢,以满足稀释工艺的要求。如图1和图3所示,所述条形凹槽21的上端靠近所述冻存管2的上端(即相对远离底盖3的一端),所述条形凹槽21的下端靠近所述冻存管2的下端(即相对靠近底盖3的一端),所述条形凹槽21的开口尺寸(即开槽宽度)上大下小。所述条形凹槽21采用上大下小的开槽设计,能够控制稀释液流入条形凹槽21的初始速度,使得稀释液与细胞悬液的初期混合速率不会过快,以满足稀释工艺要求。
在其他实施例中,所述条形凹槽21可以是螺旋状、波浪状或其他条形结构也可以是若干条不同延伸方向的直条形结构组成的Z形、X形、网状或其他结构,还可以是直条形、螺纹状、波浪状、Z形、X形、网状以及其他结构的任意组合。
本实施例中,冻存管的管壁在条形凹槽21位置凸出于其他部分,冻存管在条形凹槽21位置的管壁厚度与其他部分一致。在其他实施例中,所述冻存管2的管壁在条形凹槽21位置也可以不凸出于其他部分,即冻存管的外径保持一致,所述冻存管2在条形凹槽21的管壁厚度较其他部分要薄。
在一些实施例中,根据医药包装材料要求进行严格筛选,统筹考虑耐低温、稳定性、安全性及生物相容性,可选择已通过验证的医药包装材料,例如EVA乙烯-醋酸乙烯酯共聚物、COP、COC环烯烃聚合物等材料制作冻存管2或者选择玻璃材质,这些材料可使冻存管在低温以及室温下正常使用。
本实施例中,所述冻存管2由透明玻璃制成。为确保所述冻存管2结构完好,不易破损,所述条形凹槽21的深度要求不超过所述冻存管2的管壁厚度的2/3。进一步的,所述条形凹槽21的深度不超过所述冻存管2的管壁厚度的1/2。
其他实施例中,所述冻存管2可由透明塑料或其他材料制成。相对于透明玻璃制成的冻存管2,透明塑料制成的冻存管2中条形凹槽21的深度可适当加深。
在一些实施例中,第一弹性塞体4的侧壁为粗糙表面,第一弹性塞体4在沿着冻存管2进行移动的过程中,其粗糙表面会摩擦冻存管2的管壁内侧,由此避免第一弹性塞体4在运输过程中出现移位的现象,进而保证了一些有特殊要求的细胞药剂在使用前不能让稀释液与细胞悬液接触的情况。
如图7所示,在一些实施例中,冻存管2上在第一弹性塞体4的移动路径上均设有微粒结构,半圆形的微粒结构与冻存管2一体设计,避免在使用过程中出现微粒掉落的情况,影响实用性和安全性;微粒结构的出现大大增大了冻存管2与第一弹性塞体4之间的摩擦力。
具体的,微粒结构与粗糙表面配合设计,增大摩擦力,使得第一弹性塞体4在冻存管2的内部位置更加稳定,不会因为外部因素造成移位,同时也避免了稀释液会泄露的发生,粗糙表面和微粒结构配合使用作用效果更好。
具体的,微粒结构位于冻存管2的管壁内侧除条形凹槽21的区域,这样在保证密封性的前提下,在液体通过第一流体通道时,不会有残留物的体现。
如图1所示,在一些实施例中,活塞杆52穿过底盖3后与第二弹性塞体51抵接,为了方便运输,第二弹性塞体51与活塞杆52可以进行简单的拆卸与组装,在运输过程中,可在冻存管2的下端安装底盖3进行封堵;当需要使用冻存管2内部的药剂时,冻存管2不用拆卸掉底盖3,底盖3上面设置有活塞杆口33,直接通过活塞杆52将密封件32破坏露出活塞杆口33,活塞杆52进入冻存管2内后,与第二弹性塞体51抵接,通过推动活塞杆52推动第二弹性塞体51进而推动整个稀释液腔24,通过稀释液腔24推动第一弹性塞体4,到达第一流体通道21继续推动第二弹性塞体51稀释液通过第一流体通道21进入悬液腔23与细胞悬液进行混合,当稀释液与细胞悬液全部融合并充分混匀形成细胞药后,即达到注射人体的要求。
本实施例中,冻存管2外部设有外螺纹,底盖3内设有内螺纹,外螺纹与内螺纹配套设置,通过底盖3可以很容易地旋紧冻存管2,实现冻存管2在稀释液腔24方向通道的密封;同时封堵器1实现悬液腔23方向通道的密封,进而完成整个冻存管的密封。
在另一实施例中,冻存管2与底盖3为卡接方式,便于底盖3与冻存管2的拆装。如图6所示,底盖3包括主体31、密封件32和活塞杆口33,主体31与冻存管2阴阳卡槽连接,实现冻存管2在稀释液腔24的密封,密封件32与主体31一体设计,主体31上开设有活塞杆通孔43,密封件32封堵活塞杆口33,实现活塞杆口33的预密封;当需要预稀释时,活塞杆52穿过压迫密封件32,使得部分密封件32与主体31分离,露出活塞杆口33活塞杆52穿过活塞杆口33与第二弹性塞体51抵接,密封件32固定在主体31上,密封件32沿预设方向弯折或破开,使得密封件32不会掉落进冻存管2内部,造成使用不便等问题。
具体的,密封件32为密封薄膜或密封薄片,可以是PE膜、铝箔、硅胶、橡胶、塑胶及树脂中的一种或多种组合。
如图1所示,在一些实施例中,还包括有识别编码22,识别编码22设置在封堵器1、冻存管2、底盖3中的任意位置,识别编码22可以为RFID芯片、条码、二维码、数字码中的任意一种或其任意组合,识别编码22可以高效的每一个细胞药用注射针的信息,方便医护工作人员的使用。
如图3所示,在一些实施例中,封堵器1包括转接头12,转接头12的下端与冻存管2固定连接,冻存管2上面设置有倒环(图中标号未示出),转接头12内部有与之相适配的沟槽结构(图中标号未示出),转接头12与冻存管2通过卡接方式固定连接;转接头12的上端设有针头连接结构13,针头连接结构13的尺寸与冻存管2上端的内径尺寸相同,冻存管2的内径尺寸与针头连接结构13的尺寸统一规格设置,可以有效地保证融合后的细胞药没有死角的全部注射,减少了药业残留量,可以有效的保证细胞悬液注射时的便捷性,封堵器1需要密封时,封堵器1上还包括有封堵头11与针头连接结构13连接,封堵头11上安装第三弹性塞体14,实现封堵器1这边的密封。
具体的,封堵器1包括转接头12、封堵头11、第三弹性塞体14,转接头12与冻存管2进行连接,实现更多转换的可能,通过转接头12连接注射器、注射针等,具有更多的使用方式,使得注射方式不为一种。
具体的,封堵头11的其中一端与针头连接结构13紧密连通,封堵头11的另一端设有安装槽,第三弹性塞体14安装于所述安装槽内,并与所述安装槽的槽壁紧密贴合,第三弹性塞体14与封堵头11形成一密封盖结构,对转接头12进行密封。以及,用针头刺穿第三弹性塞体14可以直接将悬液腔23中的细胞悬液抽取出来。
其中,转接头12与封堵头11之间可采用卡扣连接、螺纹连接、阴阳卡槽配合连接或者其他可拆卸连接方式,通过封堵器1可以更加便捷地实现不同规格注射的要求。
具体的,第一弹性塞体4、第二弹性塞体51、第三弹性塞体14均可以使用丁基胶塞或TPE弹性体胶塞,丁基胶塞的耐低温为零下80°左右,TPE弹性体胶塞的耐低温为零下190°左右,无论是使用丁基胶塞或者是TPE弹性体胶塞均可以满足现在所需要的冻存温度,当需要冻存的温度在零下80°以上时,可以选用丁基胶塞;当需要冻存的温度在零下190°以上时,当选用TPE弹性体胶塞。
在一些实施例中,结合以上的任意一种实施方式,可以将封堵头11换成针头,直接混合完毕后进行人体注射。
具体的,所述细胞药用冻存管的使用方法如下:首先,使用封堵器1将冻存管2细胞悬液方向进行密封,这种情况下,使用活塞杆52将底盖3的密封件32进行破坏,使得活塞杆52穿过活塞杆口33与第二弹性塞体51抵接,继续推动活塞杆52,带动稀释液腔24向悬液腔23方向进行移动,直至第一弹性塞体4移动至环形凹槽25,使得稀释液进入到悬液腔23与细胞悬液进行混合形成细胞药,之后,将转接头12上的封堵头11更换为针头,继续推动柱塞推杆5,此时细胞悬液在稀释液腔24的压力下推送至针头,进行人体注射。
有益之处在于,冻存管的结构按细胞冻存后应用的安全性及方便性进行全新设计,能够同时实现低温冻存、快捷复苏、预稀释,在冻存细胞复苏及下一步处理时,操作简便,省时省力。
现有的冻存管通常采用单腔体设计,由于无法预置稀释液,在细胞解冻后无法进行快捷无菌稀释,必须转移至洁净条件下进行处理操作(尤其是对于药品化生产,为了保证无菌操作,所有物料均需灭菌后再转移至洁净条件下进行处理,即使采用最快速的过氧化氢灭菌方式,单灭菌步骤也需10分钟以上,灭菌时间长,操作复杂,导致冻存液对细胞毒性难以受控,严重影响细胞活性及功能。而且,在操作过程中药液不可避免地暴露于环境中与空气接触,存在被污染的风险。
本实施例采用单管双腔设计,两种物质((即稀释液和细胞悬液)可分别存放在一根冻存管2的两个密闭腔室内,仅需在装填稀释液和细胞悬液时转移至洁净环境中。稀释液和细胞悬液装填完成后,由于冻存管中预置有稀释液,因此后续需要时可直接进行稀释操作,操作过程中稀释液和细胞悬液一直处于密封环境中,不会与外部空气接触,没有被污染的风险,无需转移至洁净室,也无需进行灭菌处理。采用本实施例提供的细胞药用冻存管,能够有效提高细胞活性的同时提高生产效率,进一步的,稀释过程中药液不会暴露在外部环境中,保证了细胞药应用的安全性及有效性。
【实施例二】
请结合参考图1和图8,其为本发明实施例二的细胞药用冻存管的结构示意图。如图1和图8所示,所述细胞药用冻存管,包括:封堵器1、冻存管2、底盖3第一弹性塞体4、第二弹性塞体51和活塞杆52;冻存管2为两端开口内部中空的管状结构,封堵器1设置于冻存管的上端并与冻存管2密封连接,底盖3设置在冻存管2的下端进行密封;第一弹性塞体4和第二弹性塞体51均设置于冻存管2内并与冻存管2的管壁紧密贴合,能够沿着冻存管2的管壁滑动,第一弹性塞体4与封堵器1以及冻存管2的管壁共同形成一密闭的悬液腔23,悬液腔23用于存放细胞悬液第一弹性塞体4与第二弹性塞体51之间形成密闭的稀释液腔24,稀释液腔24用于存放稀释液;活塞杆52穿过底盖3进入于冻存管2中并推动所述第二弹性塞体51移动,对活塞杆52施加轴向力时,稀释液腔24在压力作用下向悬液腔23方向移动,并推动第一弹性塞体4沿着冻存管2的轴向移动;冻存管2的管壁上开设有用于容纳第一弹性塞体4进行弹性恢复的环形凹槽25,第一弹性塞体4具有上下贯通的第二流体通道,第二流体通道在第一弹性塞体4弹性恢复时打开,稀释液腔通过所述第二流体通道与悬液腔相互连通。
具体的,如图8所示,本实施例的冻存管2包括一环形凹槽25,所述环形凹槽25设置在冻存管2的长度方向的中段区域,具体位置可根据细胞悬液与稀释液的配置比例(即细胞悬液腔23和稀释液腔24的大小比例)进行设置,环形凹槽25的开槽宽度与所述第一弹性塞体4的厚度相适配,环形凹槽25的深度根据第一弹性塞体4的线性膨胀系数进行设置,第一弹性塞体4压缩进入冻存管2内部,其侧壁与冻存管2的管壁内侧接触并受到挤压,活塞杆52推动稀释液腔24并带动第一弹性塞体4向环形凹槽25方向进行移动,当第一弹性塞体4到达环形凹槽25时,能够嵌入于环形凹槽25中并实现弹性恢复,所述第一弹性塞体4弹性恢复后其侧壁仍与冻存管2的管壁内侧接触。
本实施例中,所述环形凹槽25的深度计算公式为:
h=(D×K×∣T1-T2∣)÷2
其中,h为所述环形凹槽25的深度,K为所述第一弹性塞体4的线性膨胀系数,D为所述第一弹性塞体4在自由状态时的外径(此时,环境温度为所述第一弹性塞体4在进行预稀释操作时的温度),T1为所述第一弹性塞体4在冻存时的温度,T2为所述第一弹性塞体4在进行预稀释操作时的温度。
在其他实施例中,所述环形凹槽25的深度还可根据所述细胞药用冻存容器的实际使用情况进行微调。
本实施例中,第一弹性塞体4中开设有至少一条第二流体通道。第一弹性塞体4在初始预制进冻存管2内部时,第一弹性塞体4一直处于极度压缩状态,这种情况下,第二流体通道由于受到挤压而封闭;当第一弹性塞体4嵌入于环形凹槽25内时,第一弹性塞体4根据自身的回弹性能,进行形变恢复,第二流体通道恢复原有通孔形状可供稀释液通过,稀释液腔24的稀释液可通过第二流体通进入到悬液腔23与细胞悬液进行混合。
优选的,所述第二流体通道的个数为多个,且多个所述第二流体通道呈阵列排布。
本实施例中,所述第二流体通道在第一弹性塞体4处于压缩状态时闭合,在第一弹性塞体4弹性恢复后打开。具体的,所述第一弹性塞体4在移动到环形凹槽25之前一直处于压缩状态,因此所述第二流体通道也一直处于闭合状态,所述悬液腔23与所述稀释液腔24不连通。所述第一弹性塞体4移动到环形凹槽25时进行弹性恢复,因此所述第二流体通道处于打开状态,所述悬液腔23与所述稀释液腔24仅通过第二流体通道相互连通,稀释液腔24内的稀释液只能通过第二流体通道与悬液腔23内的细胞悬液进行混合。
本实施例中与实施例一的不同之处在于:流体通道设置于所述第一弹性塞体4中,而不是所述冻存管2的管壁上,所述冻存管2的管壁上设置有容纳所述第一弹性塞体4进行弹性恢复的环形凹槽25,所述第一弹性塞体4移动到环形凹槽25时弹性恢复,稀释液腔24与悬液腔23才能互相连通。
【实施例三】
请继续参考图1至图5,本实施例还提供一种细胞药用冻存管的制造方法,所述细胞药用冻存管的制造方法包括:
通过两次熔融工艺制备冻存管2的管体,以在冻存管2的管壁上形成至少一个条形凹槽21;
将第一弹性塞体4插入于所述冻存管2的管体内,使其与所述冻存管2的管壁紧密贴合;
从所述冻存管2的其中一端注入细胞悬液,并将封堵器1安装于所述冻存管2上,封堵器1与第一弹性塞体4以及所述冻存管2的管壁共同形成一密闭的悬液腔23;
从冻存管2的另一端注入稀释液,并将第二弹性塞体51插入于所述冻存管2的管体内,使其与所述冻存管2的管壁紧密贴合,第二弹性塞体51之间形成一密闭的稀释液腔24;以及
依次安装底盖3和活塞杆52。
具体的,由于冻存管结构复杂,特别是条形凹槽21的结构尺寸较小,制作精度较高,直接开模制作冻存管不易脱模和落模,因此本实施例采用两次熔融工艺,即将冻存管分成两个组成部分分别进行制作,然后将两个组成部分熔融在一起,形成完整的冻存管,由此大大降低了冻存管的制作难度。
在注入细胞悬液和稀释液之前,冻存管2通常与其他部件组装并放置于真空无菌袋中。本实施例中,按照药用辅料需要对单支冻存管2采用双层密闭无菌包装,安全可靠,以保证运送及使用中无菌性。
其中,第一弹性塞体4设置于冻存管2中实现稀释液腔24和悬液腔23的隔断,封堵器1和底盖3分别安装于冻存管2的两端。由于所述第二弹性塞体51与所述活塞杆52为可拆卸连接,所述第二弹性塞体51也可预置于冻存管2中,进行稀释液的注入前通过所述活塞杆52拉出所述第二弹性塞体51即可。
需要说明的是,细胞悬液和稀释液的注入顺序在此不做限制,细胞悬液的注入与密封可以在稀释液的注入与密封之前,也可以在稀释液的注入与密封之后。
【实施例四】
请继续参考图1和图8,本实施例还提供一种细胞药用冻存管的制造方法,所述细胞药用冻存管的制造方法包括:
通过熔融工艺制备冻存管2的管体,以在所述冻存管2的管壁上形成用于容纳所述第一弹性塞体4进行弹性恢复的环形凹槽25;
将第一弹性塞体4插入于所述冻存管2的管体内,使其与冻存管2的管壁紧密贴合,所述第一弹性塞体4具有上下贯通的第二流体通道,所述第二流体通道仅在所述第一弹性塞体4弹性恢复时打开;
从所述冻存管2的其中一端注入细胞悬液,并将封堵器1安装于所述冻存管2上,所述封堵器1与第一弹性塞体4以及所述冻存管2的管壁共同形成一密闭的悬液腔23;
从所述冻存管2的另一端注入稀释液,并将第二弹性塞体51插入于所述冻存管2的管体内,使其与冻存管2的管壁紧密贴合,所述第一弹性塞体4与所述第二弹性塞体51之间形成一密闭的稀释液腔24;以及
依次安装底盖3和活塞杆52。
本实施例中与实施例三的不同之处在于:制备冻存管2的管体时,需在所述冻存管2的管壁上形成环形凹槽25。环形凹槽25的制作精度相对较低,没有条形凹槽21的制作精度高,采用两次熔融工艺即可完成冻存管的制备。
综上,在本发明实施例提供的细胞药用冻存管及其制造方法和细胞药用注射针中,冻存管采用单管双腔设计,可直接在冻存管内制作细胞药,无需使用移液器,也无特定的无菌环境要求,操作简便、耗时短、有效避免渗漏及污染风险。进一步的,制作完成后可将封堵头更换为针头即可进行注射,无需将细胞药转移至注射用具内再使用,操作简单、而且耗时短无安全风险。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 间充质干细胞冻存液、制备方法及其冻存方法
- 一种牙周膜干细胞冻存液及其冻存方法
- 一种小肠黏膜干细胞冻存液及冻存方法
- 细胞冻存液、细胞冻存液制备方法和细胞冻存方法
- 一种干细胞药用冻存袋
