一种以降金刚烷为疏水基团的蛋白降解剂及其制备方法、药物组合物和应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明属于化药领域,具体涉及一种以降金刚烷为疏水基团的蛋白降解剂及其制备方法、药物组合物和应用。
背景技术
疏水标签(Hydrophobic Tag,Hyt)双功能分子由靶蛋白配体、连接子、疏水基团三部分构成。通过在可与靶标结合的小分子上连接一个大而疏水基团,这样的双头分子结合到靶标后,会被细胞内蛋白修复机制错误的认为是目标蛋白中错误折叠的部分,随后可通过伴侣蛋白对其进行折叠,进而被蛋白酶体降解。Hyt分子中的疏水基团往往分子量较小,因而可能具有更高的溶解性和成药性。目前基于疏水标签的降解剂的研发仍处于探索阶段,一方面是报道的疏水标签片段较少,在降解活性,理化性质上依然存在较大的优化空间。另一方面是确切降解机制尚未明确。因此探索更多的具有高活性、优良理化性质的疏水片段以及明确其对应的降解机制,对于基于疏水标签片段向临床应用发展是十分关键的。
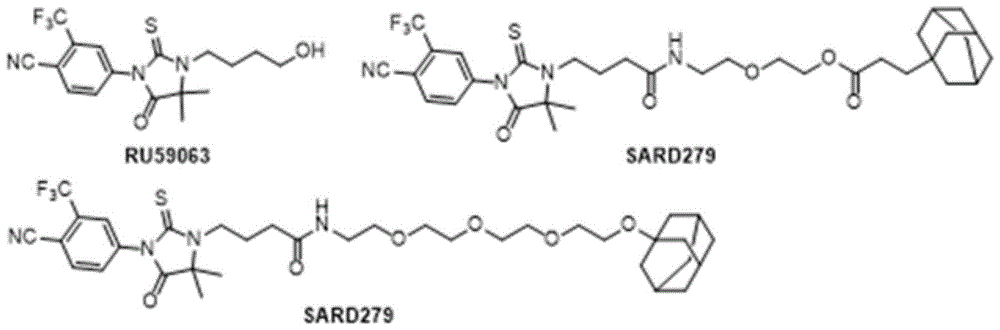
雄激素受体(AR)是经过临床验证的治疗人类前列腺癌的靶点。雄激素受体拮抗剂对转移性去势抵抗性前列腺癌(mCRPC)的治疗有效,可以显著提高前列腺癌患者的生存期,且耐受性良好。但当前临床雄激素受体拮抗剂(恩杂鲁胺等)通常在病人用药18个月内容易产生耐药性。在大多数对恩杂鲁胺产生耐药性的患者中,雄激素受体的信号通路仍在发挥作用,因此,靶向雄激素受体蛋白降解或许是一种非常有潜力的治疗策略,可能比雄激素受体拮抗剂更有效果。现有技术中,某研究团队基于疏水标签技术开发得到了可降解AR的蛋白降解剂SARD279和SARD033,如图1所示,这两种降解剂是以金刚烷为疏水标签,通过不同长度的聚乙二醇连接AR配体RU59063得到的,其中SARD279能够在LNCaP细胞中以1μM浓度降解50%的AR蛋白(DC50),然而无论是常规的PROTAC降解剂还是此类疏水标签降解剂,都对AR-V7蛋白水平无明显影响。并且,常规AR降解剂的降解效果相对较低、肝微粒体及血浆代谢稳定性较差、溶解度差难以口服,难以用于临床上进一步的治疗和开发,需要代谢稳定性更好的新型AR蛋白降解剂的开发以满足临床需求。
发明内容
本发明的目的是解决现有技术的不足,提供一种肝微粒体代谢稳定性高的以降金刚烷为疏水基团的蛋白降解剂及其制备方法、药物组合物和应用,具体采用以下的技术方案:
根据本发明的第一方面,提供了一种以降金刚烷为疏水基团的蛋白降解剂,其结构式如式(I)所示:
其中,Linker为任一化学上可行的连接结构。
本发明提供一种以降金刚烷为疏水基团的蛋白降解剂,在双功能分子中,以降金刚烷为疏水基团,恩杂鲁胺母核为靶蛋白配体,本发明通过替换不同的Linker,筛选能够有效降解AR的蛋白降解剂。
本发明制得的AR的蛋白降解剂可以以剂量依赖性的方式有效诱导人前列腺癌细胞系(22Rv1细胞系)中AR和AR-V7的降解,具有可观的肝微粒体代谢稳定性,并且表现出优异的体内抗前列腺癌效果。
优选地,Linker为饱和脂肪链或不饱和脂肪链。通过选择不同类型、不同长度的理想的连接子,从而达到在空间上既不影响两个蛋白结合又能维持它们的结合的目的。
优选地,蛋白降解剂的分子结构为式(II)、式(III)、式(IV)中的任意一种:
其中,式(II)中,n为1-9中的任一正整数;式(III)中,m为2-10中的任一整数;式(IV)中,o为1-9中的任一正整数。
更为优选地,以降金刚烷为疏水基团的蛋白降解剂的分子结构为式(V)所示:
如式(V)所示的化合物可以以剂量依赖性的方式有效诱导人前列腺癌细胞系22Rv1中AR和AR-V7的降解,具有可观的肝微粒体代谢稳定性,并且表现出最为优异的体内抗前列腺癌效果,肿瘤抑制率为76.3%。
根据本发明的第二方面,还提供了一种上述以降金刚烷为疏水基团的蛋白降解剂的制备方法,路线简便,所用原料廉价易得,反应总体收率较高,其制备路线为路线一、路线二或路线三:
路线一:使用降金刚烷甲酸(A)与不同长度的炔胺(B1-B6)在HATU作用下酰胺缩合获得中间体C1-C6,恩杂鲁胺母核D与2-叠氮乙基-4-甲基苯磺酸酯(化合物D1)在K
路线二:使用降金刚烷甲酸(A)与不同长度的氨烷基溴(G1-G3)在HATU作用下酰胺缩合获得中间体H1-H3,随后与恩杂鲁胺母核D在K
;
路线三:使用不同长度的羧基烷基溴(J1-J3)与N-Boc哌嗪(K)在HATU作用下酰胺缩合获得中间体L1-L3,随后与恩杂鲁胺母核D在K
根据本发明的第三方面,还提供了上述以降金刚烷为疏水基团的蛋白降解剂或其药学上可接受的盐在制备AR降解剂中的应用。
优选地,AR降解剂可用于制备治疗具有AR异常的相关癌症的药物。相关癌症包括:前列腺癌、乳腺癌、卵巢癌、子宫内膜癌。更为优选地,相关癌症为前列腺癌。
根据本发明的第四方面,还提供了一种药物组合物,以上述的以降金刚烷为疏水基团的AR蛋白降解剂或其药学上可接受的盐为主要活性成分。
优选地,药物组合物包含赋形剂、溶剂、药用载体。赋形剂包括阿拉伯胶、糖浆、羊毛脂、淀粉中的至少一种。该赋形剂性质稳定,与主药无配伍禁忌,不产生副作用,不影响疗效,在常温下不易变形、干裂、霉变、虫蛀、对人体无害、无生理作用,不与主药产生化学或物理作用,不影响主药的含量测定。溶剂包括水、甘油或乙醇。
本发明的有益效果为:本发明获得了一种以降金刚烷为疏水基团的蛋白降解剂,制备过程简单易行,通过不同路径得到多种蛋白降解剂,可应用于制备AR降解剂中,所得蛋白降解剂相较于阳性对照SARD279具有更高的肝微粒体代谢稳定性,在体内实验中可降低给药频次,有效提高药物效力。还可组成药物组合物,对多种肿瘤细胞增殖均有一定抑制作用,适合用于治疗前列腺癌等癌症药物的开发。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实施例了解到。
附图说明
图1为基于疏水标签技术开发得到了可降解AR的蛋白降解剂SARD279和SARD033的结构图;
图2所示为高浓度化合物F1-F5在22Rv1细胞系中浓度依赖性的降解AR和AR-V7蛋白作用的筛选图;
图3所示为低浓度化合物F1、F4、F5在22Rv1细胞系中浓度依赖性的降解AR和AR-V7蛋白作用的筛选图。
如下具体实施方式将结合上述附图进一步说明本发明。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的若干实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
实施例1
一种以降金刚烷为疏水基团的蛋白降解剂(记为化合物F1)、化合物A、化合物B1、化合物C1、化合物D、化合物D1、化合物E,其结构如下所示:
具体制备方法为:
1)化合物C1的制备:在冰浴下,将化合物A(332mg,2.00mmol)溶解在N,N-二甲基甲酰胺(6mL)中,分别加入N,N,N′,N′-四甲基-O-(7-氮杂苯并三唑-1-基)六氟磷酸脲(912mg,2.40mmol)、二异丙基乙胺(388mg,3.00mmol)和化合物B1(炔丙胺,110mg,2.00mmol),5分钟后撤去冰浴,室温搅拌过夜后,将瓶内的液体用乙酸乙酯稀释(20mL),随后分别用1N HCl溶液(20mL)、饱和碳酸氢钠溶液(20mL)和饱和食盐水(20mL)洗,合并有机相使用无水硫酸钠进行干燥,浓缩后通过硅胶快速柱色谱(石油醚∶乙酸乙酯=2∶1)得到化合物C1。
对化合物C1进行检测,其检测结果如下:HRMS(ESI)calculated for C
2)化合物E的制备:将化合物D(811mg,2.00mmol)和化合物D1(483mg,2.00mmol)溶于N,N-二甲基甲酰胺(6mL)中,加入碳酸钾(553mg,4.00mmol),室温反应过夜,反应完成后用水(30mL)稀释,并用乙酸乙酯(3×20mL)萃取,随后合并有机相并用饱和NaCl溶液(30mL)洗反应液,有机相使用无水硫酸钠进行干燥,浓缩,将得到的粗品用硅胶柱层析进行纯化(二氯甲烷:甲醇=25:1)得化合物E。
对化合物E进行检测,其检测结果如下:HRMS(ESI)calculated for C
3)化合物F1的制备:将E(237mg,0.500mmol)和化合物C1(102mg,0.500mmol)溶于t-BuOH/H
对化合物F1进行检测,其检测结果如下:
实施例2
一种以降金刚烷为疏水基团的蛋白降解剂(记为化合物F2),其结构如下所示:
化合物F2的结构如下:
具体制备方法为:本实施例基本按照实施例1所述化合物F1的合成步骤获得化合物F2,与实施例1不同的是:仅将炔丙胺改为了丁-3-炔-1-胺。
对化合物F2进行检测,其检测结果如下:
实施例3
一种以降金刚烷为疏水基团的蛋白降解剂(记为化合物F3),其结构如下所示:
化合物F3的结构如下:
具体制备方法为:本实施例基本按照实施例1所述化合物F1的合成步骤获得化合物F3,与实施例1不同的是:仅将炔丙胺改为了4-戊炔-1-胺。
对化合物F3进行检测,其检测结果如下:
实施例4
一种以降金刚烷为疏水基团的蛋白降解剂(记为化合物F4),其结构如下所示:
化合物F4的结构如下:
具体制备方法为:本实施例基本按照实施例1所述化合物F1的合成步骤获得化合物F4,与实施例1不同的是:仅将炔丙胺改为了5-己炔-1-胺。
对化合物F4进行检测,其检测结果如下:
实施例5
一种以降金刚烷为疏水基团的蛋白降解剂(记为化合物F5),其结构如下所示:
化合物F5的结构如下:
具体制备方法为:本实施例基本按照实施例1所述化合物F1的合成步骤获得化合物F5,与实施例1不同的是,仅将炔丙胺改为了6-庚炔-1-胺。
对化合物F5进行检测,其检测结果如下:
实施例6
一种以降金刚烷为疏水基团的蛋白降解剂(记为化合物F6),其结构如下所示:
化合物F6的结构如下:
具体制备方法为:本实施例基本按照实施例1所述化合物F1的合成步骤获得化合物F6,与实施例1不同的是:仅将炔丙胺改为了7-辛炔-1-胺。
对化合物F6进行检测,其检测结果如下:
1
实施例7
一种以降金刚烷为疏水基团的蛋白降解剂(记为化合物I1)、化合物A、化合物G1、化合物H1、化合物D,其结构如下所示:
具体制备方法为:
1)化合物H1的制备:在冰浴下,将化合物A(332mg,2.00mmol)溶解在N,N-二甲基甲酰胺(3mL)中,分别加入N,N,N`,N`-四甲基-O-(7-氮杂苯并三唑-1-基)六氟磷酸脲(912mg,2.40mmol)、二异丙基乙胺(388mg,3.00mmol)和化合物G1(2-溴乙胺,248mg,2.00mmol),5分钟后撤去冰浴,室温搅拌过夜后,将瓶内的液体用乙酸乙酯稀释(20mL),随后分别用1N HCl溶液(20mL)、饱和碳酸氢钠溶液(20mL)和饱和食盐水(20mL)洗,合并有机相使用无水硫酸钠进行干燥,浓缩后通过硅胶快速柱色谱(石油醚∶乙酸乙酯=2∶1)得到化合物H1。
对化合物H1进行检测,其检测结果如下:HRMS(ESI)calculated for C
2)化合物I1的制备:将化合物D(405mg,1.00mmol)和化合物H1(272mg,1.00mmol)溶于N,N-二甲基甲酰胺(3mL)中,加入碳酸钾(277mg,2.00mmol),室温反应过夜,反应完成后用水(15mL)稀释,并用乙酸乙酯(3×10mL)萃取,随后合并有机相并用饱和NaCl溶液(15mL)洗反应液,有机相使用无水硫酸钠进行干燥,浓缩,将得到的粗品用硅胶柱层析进行纯化(二氯甲烷:甲醇=20:1)得化合物I1。
对化合物I1进行检测,其检测结果如下:
1
实施例8
一种以降金刚烷为疏水基团的蛋白降解剂(记为化合物I2),其结构如下所示:
化合物I2的结构如下:
具体制备方法为:本实施例基本按照实施例7所述化合物I1的合成步骤获得化合物I2,与实施例7不同的是:仅将2-溴乙胺改为了3-溴丙胺。
对化合物I2进行检测,其检测结果如下:
1
实施例9
一种以降金刚烷为疏水基团的蛋白降解剂(记为化合物I3),其结构如下所示:
化合物I3的结构如下:
/>
具体制备方法为:本实施例基本按照实施例7所述化合物I1的合成步骤获得化合物I3,与实施例7不同的是:仅将2-溴乙胺改为了4-溴丁胺。
对化合物I3进行检测,其检测结果如下:
1
实施例10
一种以降金刚烷为疏水基团的蛋白降解剂(记为化合物N1)、化合物J1、化合物K、化合物L1、化合物D、化合物M1、化合物A,其结构如下所示:
具体制备方法为:
1)化合物L1的制备:在冰浴下,将化合物J1(2-溴乙酸,278mg,2.00mmol)溶解在N,N-二甲基甲酰胺(6mL)中,分别加入N,N,N`,N`-四甲基-O-(7-氮杂苯并三唑-1-基)六氟磷酸脲(912mg,2.40mmol)、二异丙基乙胺(388mg,3.00mmol)和化合物K(N-Boc哌嗪,371mg,2.00mmol),5分钟后撤去冰浴,室温搅拌过夜后,将瓶内的液体用乙酸乙酯稀释(20mL),随后分别用1N HCl溶液(20mL)、饱和碳酸氢钠溶液(20mL)和饱和食盐水(20mL)洗,合并有机相使用无水硫酸钠进行干燥,浓缩后通过硅胶快速柱色谱(石油醚∶乙酸乙酯=3∶2)得到化合物L1。
对化合物L1进行检测,其检测结果如下:HRMS(ESI)calculated for C
2)化合物M1的制备:将化合物D(405mg,1.00mmol)和化合物L1(307mg,1.00mmol)溶于N,N-二甲基甲酰胺(3mL)中,加入碳酸钾(277mg,2.00mmol),室温反应过夜,反应完成后用水(15mL)稀释,并用乙酸乙酯(3×10mL)萃取,随后合并有机相并用饱和NaCl溶液(15mL)洗反应液,有机相使用无水硫酸钠进行干燥,浓缩,将得到的粗品用硅胶柱层析进行纯化(二氯甲烷:甲醇=20:1)得中间体后溶于二氯甲烷(5mL),随后加入三氟乙酸(3mL),室温搅拌0.5小时,随后旋干溶剂得到化合物M1粗品。
对化合物M1进行检测,其检测结果如下:HRMS(ESI)calculated for C
3)化合物N1的制备:在冰浴下,将化合物M1(266mg,0.500mmol)溶解在N,N-二甲基甲酰胺(2mL)中,分别加入N,N,N`,N`-四甲基-O-(7-氮杂苯并三唑-1-基)六氟磷酸脲(228mg,0.600mmol)、二异丙基乙胺(97.2mg,0.750mmol)和化合物A(83.0mg,0.500mmol),5分钟后撤去冰浴,室温搅拌过夜后,将瓶内的液体用乙酸乙酯稀释(10mL),随后分别用1NHCl溶液(10mL)、饱和碳酸氢钠溶液(10mL)和饱和食盐水(10mL)洗,合并有机相使用无水硫酸钠进行干燥,浓缩后通过硅胶快速柱色谱(石油醚∶乙酸乙酯=3∶1)得到化合物N1。
对化合物N1进行检测,其检测结果如下:
实施例11
一种以降金刚烷为疏水基团的蛋白降解剂(记为化合物N2),其结构如下所示:
化合物N2的结构如下:
具体制备方法为:本实施例基本按照实施例10所述化合物N1的合成步骤获得化合物N2,与实施例10不同的是:仅将2-溴乙酸改为了3-溴丙酸。
对化合物N2进行检测,其检测结果如下:
1
实施例12
一种以降金刚烷为疏水基团的蛋白降解剂(记为化合物N3),其结构如下所示:
化合物N3的结构如下:
具体制备方法为:本实施例基本按照实施例10所述化合物N1的合成步骤获得化合物N3,与实施例10不同的是:仅将2-溴乙酸改为了4-溴丁酸。
对化合物N3进行检测,其检测结果如下:
1
实施例13
本实施例对上述以降金刚烷为疏水基团的蛋白降解剂(实施例1-12制得的蛋白降解剂,F1-F6,I1-I3,N1-N3)应用蛋白质免疫印迹法在人前列腺癌细胞系22Rv1中进行降解AR和AR-V7能力的评估,以文献报道AR蛋白降解剂SARD 279为阳性药,所用化合物浓度均为10μM。降解效率结果如表1所示。
表1人前列腺癌细胞系22Rv1中化合物对AR和AR-V7降解效率
由表中可以看出各个化合物都有一定降解AR和AR-V7的能力,其中化合物F1-F5表现出与阳性药SARD279相当或相对更高的降解AR和AR-V7的效率。选取F1-F5进行进一步的降解效果评价,分别设置0、1、10μM三个浓度梯度,以判断这些优选化合物是否能够浓度依赖性的降解AR和AR-V7。结果见图2。结果表明,化合物F1-F5均能够浓度依赖性的降解AR和AR-V7,其中降解效率最高的是化合物F1、F4、F5。因此选取化合物F1、F4、F5作为后续评价的优选化合物。
在更低的浓度中(分别选取0、100、300nM)进行上述化合物降解效率的评价,结果见图3,结果表明,其中降解效率最高的是化合物F4。因此选取化合物F4作为后续评价的优选化合物。
实施例14
本实施例对上述以降金刚烷为疏水基团的蛋白降解剂(实施例1-12中合成得到的化合物)进行抗肿瘤细胞增殖实验的评价,在人前列腺癌细胞22Rv1细胞系中进行实验,以文献报道AR蛋白降解剂SARD279为阳性药,分别加药1μM孵育6天后计数,结果见表2,发现细胞数量都有不同程度的减少,且其中化合物F4细胞数量降低最为明显,与实施例13中降解效率结果相符。
为了较为直观比较化合物活性差异,将细胞数量剩余比例分为四类:80%<比例<100%(*),50%<比例<80%(**),50%>比例(***)。具体测试结果如下表2所示:
表2
实施例15
本实施例对化合物F4肝微粒体代谢稳定性进行评价实验。前人报道的疏水标签蛋白降解剂的肝微粒体代谢不稳定性通常限制着其体内药效的发挥,本发明在疏水标签类型和连接子类型等方面做出了优化,选用的化合物F4有望发挥出更高的代谢稳定性和体内生物利用度。以SARD279为阳性对照进行肝微粒体代谢稳定性的评估。
肝微粒体代谢稳定性评价具体方法为:从-80℃冰箱中取出肝微粒体,置于37℃水浴恒温振荡器上预温孵3min,融化待用。随后称取一定量的NADPH,加入适量氯化镁溶液溶解成2mM的溶液待用。按照实验温孵体系的构成比例(3Mm MgCl
表3肝微粒体代谢稳定性
实施例16
本实施例对化合物F4体内药效评价,选用22Rv1细胞进行异种移植模型的建立,并以文献报道的SARD279为阳性对照。
具体方法为:将22Rv1注射到nu/nu免疫缺陷小鼠体内。当肿瘤平均直径达到3毫米时,将其随机分为对照组(5只)、化合物F4静脉给药1组(10mpk,5只,每天给药)、化合物F4静脉给药2组(10mpk,5只,每两天给药)、化合物F4静脉给药3组(10mpk,5只,每三天给药)、SARD279静脉给药1组(10mpk,5只,每天给药)、SARD279静脉给药2组(10mpk,5只,每两天给药)和SARD279静脉给药3组(10mpk,5只,每三天给药),18天后,给药组小鼠体重和对照组小鼠体重均无明显波动且小鼠状态无明显异常,表明化合物F4安全性良好,给药组小鼠肿瘤重量和肿瘤体积均明显低于对照组,肿瘤抑制率((1-给药组肿瘤重量/对照组肿瘤重量)*100%)见表4。结果表明,相较于SARD279,化合物F4具有较强的体内代谢稳定性,体内保留时间长,可降低给药频次,在更低的给药频次组中具有与阳性药每日给药组相当的效果。
表4 22Rv1细胞异种移植模型TGI
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 一种光热增强降解化学战剂模拟物的纳米核壳复合物及其复合纤维膜的制备方法与应用
- 一种组合物、制备方法及其在可降解材料领域的应用
- 一种胶原蛋白肽和弹性蛋白肽的组合物及其制备方法和应用
- 一种健肝消脂的药物组合物及其制备方法、制剂与应用
- 一种防治酒精性肝损伤的药物组合物及其制备方法与应用
- 一种双功能MDM2蛋白降解剂,及其制备方法、药物组合物和应用
- 基于CRBN配体诱导Tau蛋白降解的化合物及其制备方法、药物组合物和应用
