乳酸脱氢酶及其编码基因、重组载体、重组菌体和发酵剂以及它们的应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及基因工程,具体涉及一种乳酸脱氢酶及其编码基因,一种重组载体,一种重组菌株,一种发酵剂,一种制备D-苯基乳酸的方法,以及它们在制备D-苯基乳酸中的应用。
背景技术
苯基乳酸存在于蜂蜜、酸面团和乳酸菌发酵食品中,是一种天然有机酸,它具有广谱抗菌活性,能抑制多种革兰氏阳性菌、革兰氏阴性菌、酵母、霉菌等微生物的生长,其水溶性好,耐高温,作用pH较宽,安全无毒,可在防止食品腐败、保留营养品质的同时,维持食品的风味,因此可作为抗菌剂和防腐剂应用于食品工业。此外,苯基乳酸也可作为饲料添加剂,增加家禽产蛋率和禽蛋品质;或者作为抗皱剂和抑菌剂添加到化妆品中。苯基乳酸分子中含有一个手性碳原子,因而存在一对对映异构体,其中D-苯基乳酸的抗菌活性较强,并且还可作为前体,合成降血糖药恩格列酮和冠心病治疗药物丹参素,因此,D-苯基乳酸获得了较多关注。D-苯基乳酸在食品、饲料、制药、化妆品等行业的广阔应用前景激发了学术界和产业界对其合成方法的研究热情。
多种乳酸菌可通过细胞内代谢途径合成苯基乳酸,但其发酵周期长,产率低,产物光学纯度较差,制约了D-苯基乳酸的大规模发酵生产。在乳酸菌代谢途径中,苯丙酮酸钠是苯基乳酸的直接前体,通过乳酸脱氢酶的不对称还原获得D-苯基乳酸。酶是具有生物催化功能的生物大分子,酶分子介导的生物催化反应具有催化活性高,立体选择性好,反应条件温和,副产物少,环境友好等特点,符合绿色化学合成的发展方向,正日益成为传统化学合成法的重要补充,广泛地应用于医药、农药、食品、化妆品和其他精细化工品的生产。以苯丙酮酸钠为底物,在乳酸脱氢酶催化作用下一步还原,是制备D-苯基乳酸最普遍采用的方法。
通过基因挖掘已获得多种乳酸脱氢酶及其编码基因,能够催化苯丙酮酸钠不对称还原合成D-苯基乳酸,产物对映体过量值(e.e.)大于99%,但现有的乳酸脱氢酶的催化活性和热稳定性较低,从而限制了其工业化应用。
发明内容
本发明的目的是为了克服现有技术存在的乳酸脱氢酶对苯丙酮酸钠不对称还原活性较低的问题,提供一种乳酸脱氢酶及其编码基因,一种重组载体,一种重组菌株,一种发酵剂,一种制备D-苯基乳酸的方法,以及它们在制备D-苯基乳酸中的应用,该乳酸脱氢酶具有更高的催化活性和更出色的热稳定性。
为了实现上述目的,本发明第一方面提供一种乳酸脱氢酶,所述乳酸脱氢酶为(a)-(d)中任意一项所述的酶:
(a)具有SEQ ID NO.1所示氨基酸序列的酶;
(b)SEQ ID NO.1所示的氨基酸的第247位经过取代、缺失或添加一个或几个氨基酸残基且仍具有乳酸脱氢酶活性的氨基酸序列所示的酶;
(c)在(a)或(b)所述氨基酸序列的氨基末端和/或羧基末端连接有标签的氨基酸序列所示的酶;
(d)在(a)或(b)所述氨基酸序列的氨基末端连接有信号序列的氨基酸序列所示的酶。
优选地,所述乳酸脱氢酶为SEQ ID NO.1所示氨基酸序列的第247位苏氨酸取代为异亮氨酸的氨基酸序列所示的酶。
本发明第二方面提供一种编码乳酸脱氢酶的基因,该基因具有编码上述的乳酸脱氢酶的核苷酸序列。
优选地,所述基因具有编码具有SEQ ID NO.1所示氨基酸序列的酶的核苷酸序列。
更优选地,所述基因具有SEQ ID NO.2所示的核苷酸序列。
本发明第三方面提供一种重组载体,所述重组载体含有上述的基因。
优选地,所述重组载体的表达载体为pET28a质粒。
本发明第四方面提供一种重组菌株,所述重组菌株含有上述的基因或者上述的重组载体。
优选地,所述重组菌株为大肠杆菌和/或枯草芽孢杆菌。
更优选地,所述重组菌株为大肠杆菌。
本发明第五方面提供一种发酵剂的制备方法,该制备方法包括:将上述的重组菌株接种至发酵培养基中进行发酵得到发酵液,对所述发酵液进行固液分离,得到湿菌体。
本发明第六方面提供上述的乳酸脱氢酶、上述的基因、上述的重组载体、上述的重组菌株和上述的制备方法制得的发酵剂中的至少一种在制备D-苯基乳酸中的应用。
本发明第七方面提供一种制备D-苯基乳酸的方法,该方法包括以下步骤:将上述的乳酸脱氢酶、上述的基因、上述的重组载体、上述的重组菌株和上述的制备方法制得的发酵剂中的至少一种与苯丙酮酸钠接触。
优选地,所述接触的过程包括:在辅助底物和反应介质存在的条件下,将所述发酵剂与苯丙酮酸钠混合后在温度为25-45℃,转速为150-250rpm的条件下反应至所述苯丙酮酸钠反应完全。
优选地,所述辅助底物选自葡萄糖、6-磷酸葡萄糖和异丙醇中的至少一种,更优选为葡萄糖;所述反应介质采用pH为6.0-8.0的磷酸钾缓冲液。
优选地,相对于1L所述反应介质,所述苯丙酮酸钠的用量为1-100g,所述辅助底物的用量为5-300g,所述发酵剂的用量为10-250g。
通过上述技术方案,本发明的有益效果为:
本发明提供的乳酸脱氢酶在不对称还原苯丙酮酸钠过程中的催化活力和热稳定性明显提高,与野生型乳酸脱氢酶相比,催化效率(k
附图说明
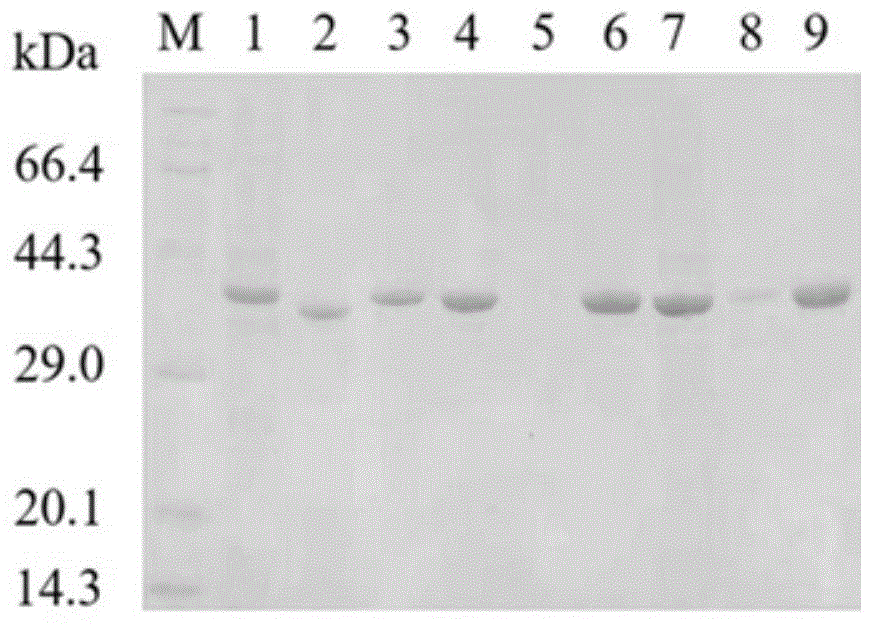
图1是实施例3中SDS-PAGE电泳图,其中,M为蛋白Marker;1、4、7为E.coli/pET28a-lrldh、E.coli/pET28a-lrldh-D249A和E.coli/pET28a-lrldh-D249A/T247I经诱导表达后的可溶部分;2、5、8为E.coli/pET28a-lrldh、E.coli/pET28a-lrldh-D249A和E.coli/pET28a-lrldh-D249A/T247I经诱导表达后的不可溶部分;3、6、9为野生型LrLDH,突变体D249A和D249A/T247I纯化酶;
图2是实施例5中野生型乳酸脱氢酶LrLDH(WT)、突变体D249A以及突变体D249A/T247I在50℃孵育时残余酶活随时间的变化曲线图;
图3是实施例5中野生型乳酸脱氢酶LrLDH(WT)、突变体D249A以及突变体D249A/T247I残余酶活随孵育温度的变化曲线图;
图4是实施例7中野生型乳酸脱氢酶LrLDH(WT)、突变体D249A以及突变体D249A/T247I相对酶活随温度的变化曲线图;
图5是实施例8中重组菌株E.coli BL21(DE3)/pET28a-lrldh和E.coli/pET28a-lrldh-D249A/T247I催化苯丙酮酸钠不对称还原合成D-苯基乳酸时,D-苯基乳酸的含量随反应时间的变化曲线图。
具体实施方式
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
在本发明中,在未作相反说明的情况下,乳酸脱氢酶的酶活通过在30℃下监测NADH的消耗量来测定,标准反应液由含0.5mM NADH和1mM苯丙酮酸钠的磷酸缓冲液(100mM,pH 7.0)及100μL适当稀释的纯化蛋白构成,总体积为200μL,每分钟消耗1μmol NADH所需的酶量定义为1个酶活力单位,即1U。“比酶活”代表每单位质量蛋白质的催化能力,比活力的计算公式为:比酶活(U/mg)=总酶活力单位数/mg总蛋白;单位M表示mol/L。
本发明第一方面提供一种乳酸脱氢酶,所述乳酸脱氢酶为(a)-(d)中任意一项所述的酶:
(a)具有SEQ ID NO.1所示氨基酸序列的酶;
(b)SEQ ID NO.1所示的氨基酸的第247位经过取代、缺失或添加一个或几个氨基酸残基且仍具有乳酸脱氢酶活性的氨基酸序列所示的酶;
(c)在(a)或(b)所述氨基酸序列的氨基末端和/或羧基末端连接有标签的氨基酸序列所示的酶;
(d)在(a)或(b)所述氨基酸序列的氨基末端连接有信号序列的氨基酸序列所示的酶。
本发明中,乳酸脱氢酶的氨基酸序列中,第247位苏氨酸可以发生氨基酸残基取代、缺失或添加,所述残基在蛋白质结构域中所起的作用(比如提供正电荷或形成疏水囊袋结构的作用)没有改变,对蛋白质的立体结构并不会产生影响,因此仍然可以实现蛋白的功能。优选地,本发明中SEQ ID NO.1所示的乳酸脱氢酶氨基酸序列的第247位苏氨酸取代为异亮氨酸,得到氨基酸序列如SEQ ID NO.3所示的酶。
为了方便纯化,还可以采用本领域常见的标签对(a)或(b)进行添加修饰,举例来说,可以通过在(a)的氨基末端和/或羧基末端连接有标签的氨基酸序列而获得。所述标签不会影响本发明的乳酸脱氢酶的活性,在实际应用过程中,可以根据需求选择是否添加标签。
在本发明中,所述乳酸脱氢酶的氨基末端还可以连接信号序列。所述信号序列可以来自大肠杆菌和枯草芽孢杆菌,但不限于此。
上述乳酸脱氢酶可以通过人工合成得到,也可以先合成其编码基因,再通过生物表达获得。示例性地,本发明中提供的乳酸脱氢酶通过使用定点饱和突变技术对野生型乳酸脱氢酶LrLDH编码基因进行突变,连接表达载体后转化宿主大肠杆菌,诱导表达后再通过高效液相检测方法将活性提高的正突变检出,获得乳酸脱氢酶突变体(即为本发明中所述的乳酸脱氢酶),在不对称还原苯丙酮酸钠过程中的催化活力和热稳定性明显提高,与野生型乳酸脱氢酶LrLDH相比,催化效率提高的同时,热稳定性能显著提升。具体方法如下:克隆得到的野生型乳酸脱氢酶LrLDH已成功构建表达载体pET28a-lrldh,功能正常的酶蛋白在大肠杆菌BL21(DE3)中实现过量表达;然后经过同源建模和分子对接,并结合在线软件HotSpot Wizard 3.0进行计算机辅助设计,选取潜在的可能影响酶活性和热稳定性的位点;设定定点饱和突变位点,再设计并合成适当的引物,以所述的含亲本乳酸脱氢酶基因的重组表达质粒为模板,PCR扩增全长突变基因的质粒,通过将含有全长突变的质粒转化到适当的宿主细胞,经培养、诱导表达、筛选出具有高活性和热稳定性的阳性突变子;最后从阳性突变子中抽提出质粒DNA,进行DNA测序分析,以确定引物的突变。在本发明乳酸脱氢酶的制备中,可以采用任何合适的载体。
本发明第二方面提供一种编码乳酸脱氢酶的基因,该基因具有编码上述的乳酸脱氢酶的核苷酸序列。
根据本发明,优选地,所述基因具有编码具有SEQ ID NO.1所示氨基酸序列的酶的核苷酸序列,或者具有编码具有SEQ ID NO.3所示氨基酸序列的酶的核苷酸序列。
如上所述,相应地,核苷酸序列的5'端和/或3'端还可以连接有修饰的标签的编码序列。
本领域公知,组成蛋白质的20种不同的氨基酸中,除Met(ATG)或Trp(TGG)分别为单一密码子编码外,其他18种氨基酸分别由2-6个密码子编码(Sambrook等,分子克隆,冷泉港实验室出版社,纽约,美国,第二版,1989,见950页附录D)。即由于遗传密码子的简并性,决定一个氨基酸的密码子大多不止一个,三联体密码子中第三个核苷酸的置换,往往不会改变氨基酸的组成,因此编码相同蛋白的基因的核苷酸序列可以不同。
更优选地,所述编码具有SEQ ID NO.1所示氨基酸序列的酶的基因具有SEQ IDNO.2所示的核苷酸序列,所述编码具有SEQ ID NO.3所示氨基酸序列的酶的基因具有SEQID NO.4所示的核苷酸序列。
本发明提供的核苷酸序列通常可以用聚合酶链式反应(PCR)扩增法、重组法、或人工合成的方法获得。一旦获得了有关核苷酸序列,就可以用重组法大批量的获得有关氨基酸序列。通常将所得核苷酸序列克隆入载体,再转入基因工程菌中,然后通过常规的方法从增殖后的宿主细胞分离得到有关核苷酸序列。
此外,还可用公知的人工化学合成的方法来合成有关核苷酸序列。
本发明第三方面提供一种重组载体,所述重组载体含有上述的基因。
重组载体中使用的“载体”可选用本领域已知的各种载体,如市售的各种质粒、粘粒、噬菌体及反转录病毒等,本发明优选的表达载体为pET28a质粒。重组载体构建可采用能够在载体多克隆位点具有切割位点的各种核酸内切酶(如对于pET28a,可用Nco I和Xho I等)进行酶切获得线性质粒,与采用相同核酸内切酶切割的基因片段连接,获得重组质粒。本发明优选采用Nco I和Xho I双酶切pET28a及与其连接的基因片段,经连接酶连接,构建得到重组载体pET28a-D249A。
本发明第四方面提供一种重组菌株,所述重组菌株含有上述的基因或者上述的重组载体。
本发明中,可以通过本领域常规的方法将所述重组载体转化、转导或者转染到宿主细胞(菌株)中,如氯化钙法化学转化、高压电击转化。所述宿主细胞可以为原核细胞或真核细胞,优选为大肠杆菌和/或枯草芽孢杆菌,更优选地,所述宿主细胞为大肠杆菌,比如可以为大肠杆菌BL21(DE3)。
本发明中,乳酸脱氢酶可以采用重组菌株全细胞的形式使用,也可以是从重组菌株细胞中分离出、未经纯化的粗酶或者纯化的酶的形式使用。如果需要,还可以使用本领域已知的固定化技术将本发明的乳酸脱氢酶制成固定化酶或者固定化细胞。
本发明中,所述乳酸脱氢酶可以制成相应的酶制剂,具体地,酶制剂可以以固体、半固体或液体形式存在,所述酶制剂可以含有制备酶制剂的辅料或添加剂等,本领域技术人员可以根据需要进行选择,在此不再赘述。
本发明第五方面提供一种发酵剂的制备方法,该制备方法包括:将上述的重组菌株接种至发酵培养基中进行发酵得到发酵液,对所述发酵液进行固液分离,得到湿菌体。所述湿菌体可以作为含有乳酸脱氢酶的酶制剂进行使用。
本发明中,所述发酵剂中可以含有本领域常规制备菌剂时添加的辅料,本领域技术人员可以根据需要选择。
本发明中,所述固液分离可以采用本领域内常规的分离方式,例如离心、过滤等。具体地,采用离心的方式,所述离心的条件包括:温度为0-10℃、转速为6000-10000rpm、时间为8-12min。
本发明中,所述重组菌株发酵的条件没有特别的限制,只要通过发酵的过程可以使所述重组菌株大量增殖即可。优选地,所述发酵的过程包括:先将所述重组菌株制备成种子液,然后将所述种子液接种至含有卡那霉素的发酵培养基中培养至菌体浓度OD
根据本发明,优选情况下,发酵培养基中卡那霉素的含量为40-60mg/L。
进一步优选地,所述种子液的制备方法包括:挑取所述重组菌株的单菌落接种于含有卡那霉素的种子培养基中进行种子培养,得到所述种子液。本发明中,所述重组菌株的单菌落可以选自新鲜制备的所述重组菌株或低温冻存的所述重组菌株(例如在甘油冻存管中冻存于-80℃冰箱中的合成脂质的重组菌株)。
本发明对种子培养的方法没有特别的限制,只要通过该方法可以使所述重组菌株进行活化增殖即可,优选情况下,种子培养基中卡那霉素的含量为40-60mg/L;种子培养所采用的温度、pH、转速、时间等参数,可以是本领域内的常规设置。优选地,所述种子培养的条件包括:温度为30-45℃,时间为8-12h。
本发明中,对所述种子培养基和发酵培养基没有特别的限制,可以为本领域常规使用的培养基。优选地,所述种子培养基和发酵培养基采用LB液体培养基(胰蛋白胨8-12g/L,酵母提取物4-6g/L,NaCl 8-12g/L)。
本发明第六方面提供上述的乳酸脱氢酶、上述的基因、上述的重组载体、上述的重组菌株和上述的制备方法制得的发酵剂中的至少一种在制备D-苯基乳酸中的应用。
本发明第七方面提供一种制备D-苯基乳酸的方法,该方法包括以下步骤:将上述的乳酸脱氢酶、上述的基因、上述的重组载体、上述的重组菌株和上述的制备方法制得的发酵剂中的至少一种与苯丙酮酸钠接触。
根据本发明,优选地,所述接触的过程包括:在辅助底物和反应介质存在的条件下,将所述发酵剂(即发酵液分离得到的湿菌体)与苯丙酮酸钠混合后在温度为25-35℃,转速为150-250rpm的条件下反应至所述苯丙酮酸钠反应完全。
根据本发明,优选地,所述辅助底物为葡萄糖、6-磷酸葡萄糖和异丙醇中的至少一种,更优选为葡萄糖。所述反应介质采用pH为6.0-8.0的磷酸钾缓冲液,磷酸钾缓冲液由磷酸二氢钾和磷酸氢二钾按照不同比例混合溶解而得,其磷酸根浓度为0.1mol/L。
根据本发明,优选地,相对于1L所述反应介质,所述苯丙酮酸钠的用量为1-100g,所述辅助底物的用量为5-300g,所述发酵剂的用量为10-250g。
以下将通过实施例对本发明进行详细描述。
以下实施例中,大肠杆菌E.coli BL21(DE3)购自宝生物工程(大连)有限公司,编号为9126;pET28a购自生工生物工程(上海)股份有限公司,编号为B540183;苯丙酮酸钠购自生工生物工程(上海)股份有限公司,编号为A600877;其余试剂和原料均为常规的市售品。
LB液体培养基:胰蛋白胨10g/L,酵母提取物5g/L,NaCl 10g/L,pH调节至7.0,在高压下蒸汽灭菌21min,备用;
LB琼脂平板培养基:胰蛋白胨10g/L,酵母提取物5g/L,NaCl 10g/L,琼脂12g/L,pH调节至7.0,在高压下蒸汽灭菌21min,备用。
实施例1乳酸脱氢酶突变体的制备
通过克隆得到野生型乳酸脱氢酶LrLDH基因(GenBank ID:AZFF01000004.1),成功构建表达载体pET28a-lrldh,功能正常的酶蛋白在大肠杆菌BL21(DE3)中实现过量表达,然后经过同源建模和分子对接,并结合在线软件HotSpot Wizard 3.0进行计算机辅助设计,选取潜在的可能影响酶活性和热稳定性的位点;设定定点饱和突变位点,再设计并合成适当的引物,以所述的含亲本乳酸脱氢酶基因的重组表达质粒为模板,PCR扩增全长突变基因的质粒;通过将含有全长突变的质粒转化到适当的宿主细胞,经培养、诱导表达、筛选出具有高活性和热稳定性的阳性突变子,最后从阳性突变子中抽提出质粒DNA,进行DNA测序分析,以确定引物的突变,得到突变体D249A、D249K、D249A/T247I、D249A/T247W和D249A/T247C;
其中,所述D249A为具有SEQ ID NO.1所示氨基酸序列的突变酶,D249K为SEQ IDNO.1所示氨基酸序列的第249位丙氨酸取代为赖氨酸的突变酶,D249A/T247I为SEQ IDNO.1所示氨基酸序列的第247位苏氨酸取代为异亮氨酸的突变酶,D249A/T247W为SEQ IDNO.1所示氨基酸序列的第247位苏氨酸取代为色氨酸的突变酶,D249A/T247C为SEQ IDNO.1所示氨基酸序列的第247位苏氨酸取代为半胱氨酸的突变酶。
以重组质粒pET28b-lrldh为模板进行突变体D249A的全质粒扩增,引物对设计分别为D249-F和D249-R(见表1,核苷酸序列分别如SEQ ID NO.5和SEQ ID NO.6所示所示),得到氨基酸序列如SEQ ID NO.1所示的乳酸脱氢酶突变体D249A(核苷酸序列如SEQ ID NO.2所示);然后以乳酸脱氢酶突变体D249A的基因(即核苷酸序列如SEQ ID NO.2所示)重组质粒为模板进行全质粒扩增,引物对设计为T247/D249A-F和T247/D249A-R(见表1,核苷酸序列分别如SEQ ID NO.7和SEQ ID NO.8所示所示),得到将SEQ ID NO.1所示的氨基酸序列的第247位苏氨酸突变为异亮氨酸的乳酸脱氢酶突变体D249A/T247I(氨基酸序列如SEQ IDNO.3所示,核苷酸序列如SEQ ID NO.4所示)。
实施例1中,PCR体系为:5×Prime STAR Buffer(Mg
PCR反应产物经0.9%琼脂糖凝胶电泳分析PCR为阳性后,取PCR溶液20μL,加入1μLDpn I,37℃酶切3h去除模板质粒,65℃灭活10min,转化大肠杆菌E.coli BL21(DE3)感受态细胞,涂布含有卡那霉素(终浓度为50μg/mL)的LB琼脂平板,37℃培养过夜;经生工生物工程(上海)股份有限公司测序确认,获得了乳酸脱氢酶重组菌株E.coli BL21(DE3)/pET28a-lrldh-D249A(D249A)以及E.coli BL21(DE3)/pET28a-lrldh-D249A/T247I(D249A/T247I)。
表1乳酸脱氢酶突变引物
表1中划线部分表示突变的核苷酸。
实施例2野生型乳酸脱氢酶和突变体的诱导表达
将含野生型乳酸脱氢酶基因的野生菌株E.coli BL21(DE3)/pET28a-lrldh和实施例1得到的乳酸脱氢酶重组菌株E.coli BL21(DE3)/pET28a-lrldh-D249A和E.coli BL21(DE3)/pET28a-lrldh-D249A/T247I,分别接种到含有卡那霉素(终浓度为50mg/L)的LB液体培养基中,在温度为37℃条件下培养10h,再以体积浓度4%接种到新鲜的含有卡那霉素(终浓度为50mg/L)的LB液体培养基中,在温度为37℃条件下培养至菌体浓度OD
实施例3野生型乳酸脱氢酶和突变体的纯化
将实施例2得到的E.coli BL21(DE3)/pET28a-lrldh湿菌体和E.coli BL21(DE3)/pET28a-lrldh-D249A湿菌体以及E.coli BL21(DE3)/pET28a-lrldh-D249A/T247I湿菌体分别用buffer A(20mM,pH8.0的磷酸缓冲液含500mM NaCl和20mM咪唑)悬浮,使湿菌体细胞浓度为50g/L,细胞悬浮液置于冰浴中,以功率为300W超声破碎10min,然后离心(10000×g,4℃,20min)除去细胞碎片,收集上清液,载入经buffer A平衡的Ni-NTA亲和层析预装重力柱(5mL),用25mL buffer A洗柱,除去未结合的蛋白,然后用buffer B(20mM,pH 8.0的磷酸缓冲液含500mM NaCl和500mM咪唑)洗脱乳酸脱氢酶蛋白并在磷酸缓冲液(20mM,pH8.0)中透析过夜,以上所有纯化步骤均在0-4℃条件下进行,得到野生型乳酸脱氢酶蛋白、突变体D249A蛋白以及突变体D249A/T247I蛋白;将得到的蛋白采用12%分离胶浓度的SDS-PAGE在变性条件下进行检查,结果如图1所示。
实施例4乳酸脱氢酶及其突变体比酶活和热处理残余测定
测定实施例3中获得的野生型乳酸脱氢酶、突变体D249A、突变体D249A/T247I以及实施例1中得到的突变体D249K、D249A/T247W和D249A/T247C的酶活:通过在30℃下监测NADH的消耗量来测定,标准反应液由含0.5mM NADH和1mM苯丙酮酸钠的磷酸缓冲液(100mM,pH 7.0)及100μL适当稀释的纯化蛋白构成,总体积为200μL;每分钟消耗1μmol NADH所需的酶量定义为1个酶活力单位,即1U。“比酶活”代表每单位质量蛋白质的催化能力,比活力的计算公式为:比酶活(U/mg)=总酶活力单位数/mg总蛋白;单位M表示mol/L。
蛋白纯度以标准牛血清白蛋白为对照,采用Bradford法测定。
残余酶活的测定:将实施例3中获得的野生型乳酸脱氢酶、突变体D249A、突变体D249A/T247I以及实施例1中得到的突变体D249K、D249A/T247W和D249A/T247C对应的纯化酶溶液分别置于50℃下孵育30min,取样,迅速冷却至室温并按比酶活的测定方法分别测定比酶活,并以各自未处理的纯化酶溶液的酶活为100%,计算残余酶活。
野生型乳酸脱氢酶、突变体D249A、D249A/T247I、D249K、D249A/T247W和D249A/T247C的酶活和残余酶活如表2所示。与野生型乳酸脱氢酶相比,突变体D249A的比酶活显著增加,达到3.10U/mg,约为野生型乳酸脱氢酶LrLDH比酶活的6倍。在50℃下孵育30min后,突变体D249A的残余酶活为70.03%,明显高于野生型乳酸脱氢酶LrLDH(相同条件下孵育后残余酶活为37.70%),可见,通过突变使得乳酸脱氢酶的比酶活和热稳定性同时提高。
在突变体D249A的基础上,进一步将突变体D249A第247位苏氨酸突变为异亮氨酸,获得突变体D249A/T247I,其比酶活为1.61U/mg,经热处理后残余酶活为89.07%,与野生型乳酸脱氢酶相比,其催化活性约为野生型的2倍,经热处理后的残余活性约为野生型的1.4倍(结果见表2)。与单突变D249A相比,虽然突变体D249A/T247I牺牲了部分催化活性,但酶热稳定性却得到了显著提升。突变体D249A/T247I使酶达到了较好的平衡,同时提升了催化活性和热稳定性。此外,SDS-PAGE结果表明,突变体D249A和突变体D249A/T247I均提高了乳酸脱氢酶在大肠杆菌中的可溶性表达,结果见图1。
表2乳酸脱氢酶及其突变体的比酶活和热处理后相对残余酶活
实施例5乳酸脱氢酶及其突变体热稳定性的测定
半衰期(t
半衰期(t
半失活温度
从图2和图3可以看出,野生型乳酸脱氢酶LrLDH、突变体D249A以及突变体D249A/T247I的t
实施例6乳酸脱氢酶及其突变体动力学参数的测定
固定NADH的浓度为1mM,分别测定野生型乳酸脱氢酶,突变体D249A和突变体D249A/T247I在不同底物浓度(苯丙酮酸钠的浓度为1-5mM)下的比酶活,经米氏方程非线性拟合,获得了动力学参数,结果见表3。野生型乳酸脱氢酶,突变体D249A和突变体D249A/T247I的V
通过以下公式计算k
k
突变体D249A与野生型乳酸脱氢酶相比,催化效率(k
表3野生型乳酸脱氢酶、突变体D249A以及突变体D249A/T247I的动力学参数以及t
实施例7乳酸脱氢酶及其突变体的最适温度测定
在不同温度下(30℃、35℃、40℃、42℃、44℃、46℃、50℃、52℃、54℃、56℃、60℃),分别测定实施例3中得到的野生型乳酸脱氢酶、突变体D249A以及突变体D249A/T247I对苯丙酮酸钠的催化活性,结果如图4所示。与野生型乳酸脱氢酶相比,突变体D249A的最适催化活性小幅提升(从40℃提升至44℃);突变体D249A/T247I使最适催化温度进一步提升至52℃。这表明,突变体D249A以及突变体D249A/T247I酶的热稳定性明显提高,酶分子在较高温度下的热变性变慢,因此,乳酸脱氢酶的最适催化温度得以提升。
实施例8乳酸脱氢酶突变体D249A/T247I在不对称还原苯丙酮酸钠合成D-苯基乳酸中的应用
苯丙酮酸钠和苯基乳酸的浓度通过装配有ODS HYPERSIL液相色谱柱(4.6×250mm,5μm,Thermo,USA)和紫外检测器(SPD-10A VP Plus,Shimadzu,日本)的液相色谱仪(LC-20A,Shimadzu,日本)测定;检测器波长设置为210nm,柱温控制为40℃,流动相由乙腈和0.1%的甲酸水溶液按1:4的比例混合而成,流速设定为1.0mL/min。
D-苯基乳酸光学纯度由装配有CHIRALCEL OJ-RH柱(4.6×150mm,5μm,Daicel,Japan)的液相色谱仪测定,紫外检测器波长设置为210nm,柱温控制为40℃,流动相由乙腈、甲醇、三氟乙酸和水按50:50:1.5:898.5的比例混合而成,流速设定为0.6mL/min。
催化反应在100mL圆底烧瓶中进行,分别取10g实施例2中得到的E.coli BL21(DE3)/pET28a-lrldh和E.coli BL21(DE3)/pET28a-lrldh-D249A/T247I湿菌体,加入溶解有3g苯丙酮酸钠和3g葡萄糖的50mL磷酸钾缓冲液(100mM,pH7.0)中,充分悬浮,在温度为45℃、转速为200rpm的磁力搅拌反应器中反应,自动补加1.0M Na
从图5可以看出,经过5.5h反应,E.coli BL21(DE3)/pET28a-lrldh-D249A/T247I(乳酸脱氢酶为LrLDH-D249A/T247I)催化的反应基本完成,D-苯基乳酸的累积浓度为29.2g/L,时空产率为127.4g/(L/h),而E.coli BL21(DE3)/pET28a-lrldh(乳酸脱氢酶为LrLDH-WT),在相同条件下经过7h反应,D-苯基乳酸的累积浓度仅为12.9g/L,时空产率为44.2g/(L/h)。经手性色谱检测发现,LrLDH-D249A/T247I未对乳酸脱氢酶的立体选择性造成影响,在LrLDH-D249A/T247I和LrLDH-WT的作用下,苯基乳酸产物均为D型,对映体过量值e.e大于99%。与野生型乳酸脱氢酶相比,突变酶LrLDH-D249A/T247I的催化活性和稳定性菌显著提升,更适用于工业生产合成D-苯基乳酸。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
- 一种台湾金线莲的苯丙氨酸解氨酶及其编码基因、重组载体、重组工程菌及应用
- 一种福建金线莲的苯丙氨酸解氨酶及其编码基因、重组载体、重组工程菌及应用
- 一种Nucyep酶的编码基因、重组表达载体、重组工程菌及其制备方法和应用
- 一种7β-羟基类固醇脱氢酶突变体、编码序列、重组表达载体、基因工程菌及应用
- 水稻产量相关的SAP30C功能蛋白、编码基因、重组载体及应用
- 几丁质脱乙酰酶及其编码基因、重组载体、重组菌株、发酵剂和酶制剂以及它们的应用
- 几丁质脱乙酰酶及其编码基因、重组载体、重组菌株、发酵剂和酶制剂以及它们的应用
